A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصنيع وتشغيل التدفق المستمر ، نظام التثقيب الكهربائي الدقيق مع كشف النفاذية
In This Article
Summary
يصف هذا البروتوكول تقنيات التصنيع الدقيق المطلوبة لبناء جهاز التثقيب الكهربائي للميكروفلويديك على رقاقة. يقوم الإعداد التجريبي بإجراء عمليات نقل على مستوى خلية واحدة خاضعة للرقابة في تدفق مستمر ويمكن تمديدها إلى إنتاجية أعلى مع التحكم القائم على السكان. يتم توفير تحليل يوضح القدرة على مراقبة درجة نفاذية غشاء الخلية كهربائيا في الوقت الفعلي.
Abstract
تعتمد الابتكارات العلاجية الحالية، مثل العلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية، بشكل كبير على توصيل الجينات بوساطة فيروسية. على الرغم من كفاءة هذه التقنية ، إلا أنها مصحوبة بتكاليف تصنيع عالية ، مما أدى إلى الاهتمام باستخدام طرق بديلة لتوصيل الجينات. التثقيب الكهربائي هو نهج كهروفيزيائي وغير فيروسي لتوصيل الجينات والمواد الخارجية الأخرى داخل الخلايا. عند تطبيق مجال كهربائي ، يسمح غشاء الخلية مؤقتا بالتوصيل الجزيئي إلى الخلية. عادة ، يتم إجراء التثقيب الكهربائي على المقياس الكلي لمعالجة أعداد كبيرة من الخلايا. ومع ذلك ، يتطلب هذا النهج تطويرا مكثفا للبروتوكول التجريبي ، وهو أمر مكلف عند العمل مع أنواع الخلايا الأولية والتي يصعب نقلها. أدى تطوير البروتوكول المطول ، إلى جانب متطلبات الفولتية الكبيرة لتحقيق شدة المجال الكهربائي الكافية لاختراق الخلايا ، إلى تطوير أجهزة التثقيب الكهربائي على نطاق صغير. يتم تصنيع أجهزة التثقيب الكهربائي الدقيقة هذه باستخدام تقنيات التصنيع الدقيق الشائعة وتسمح بتحكم تجريبي أكبر مع إمكانية الحفاظ على قدرات إنتاجية عالية. يعتمد هذا العمل على تقنية التثقيب الكهربائي للموائع الدقيقة القادرة على اكتشاف مستوى نفاذية غشاء الخلية على مستوى خلية واحدة تحت التدفق المستمر. ومع ذلك ، اقتصرت هذه التقنية على 4 خلايا تمت معالجتها في الثانية ، وبالتالي تم اقتراح نهج جديد لزيادة إنتاجية النظام وتقديمه هنا. هذه التقنية الجديدة ، التي يشار إليها باسم التحكم في التغذية المرتدة القائمة على سكان الخلية ، تأخذ في الاعتبار استجابة نفاذية الخلية لمجموعة متنوعة من ظروف نبض التثقيب الكهربائي وتحدد أفضل ظروف نبض التثقيب الكهربائي لنوع الخلية قيد الاختبار. ثم يتم استخدام وضع الإنتاجية الأعلى ، حيث يتم تطبيق هذه النبضة "المثلى" على تعليق الخلية أثناء النقل. يتم عرض خطوات تصنيع الجهاز وإعداد وتشغيل تجارب الموائع الدقيقة وتحليل النتائج بالتفصيل. أخيرا ، يتم عرض تقنية التثقيب الكهربائي الدقيق هذه من خلال تقديم ترميز بلازميد الحمض النووي لبروتين الفلورسنت الأخضر (GFP) في خلايا HEK293.
Introduction
تعتمد الابتكارات العلاجية الحالية في البحوث الطبية الحيوية ، مثل العلاج الخلوي CAR-T (الخلايا التائية المهندسة لمستقبلات المستضد الخيمري) والتحرير الجيني باستخدام CRISPR (تسلسلات الحمض النووي المتكررة القصيرة المتباعدة بانتظام / Cas9 ، بشكل كبير على القدرة على توصيل المواد الخارجية بنجاح وكفاءة إلى الفضاء داخل الخلايا1. في علاج CAR-T ، يستخدم المعيار الذهبي لأداء خطوة توصيل الجينات في تصنيع العلاج بالخلايا النواقل الفيروسية2. على الرغم من أن توصيل الجينات بوساطة فيروسية هو طريقة توصيل فعالة ، إلا أن له أيضا العديد من العيوب. وتشمل هذه تكاليف التصنيع ، والسمية الخلوية ، والمناعة ، والطفرات / إمكانية تكوين الورم ، وقيود الحجم على الجين (الجينات) التي سيتم تسليمها3. وقد أدت هذه القيود إلى البحث والتطوير لتقنيات توصيل بديلة غير فيروسية.
يعتمد التثقيب الكهربائي ، وهو بديل لتوصيل الجينات بوساطة فيروسية ، على تطبيق شكل موجة نبضة كهربائية مثالية لأداء عمليات نقل الحمض النووي والحمض النووي الريبي والبروتين للخلايا. بعد تطبيق مجال كهربائي خارجي ، يتم اختراق غشاء الخلية لفترة وجيزة ، مما يجعل الخلية عرضة للتوصيل داخل الخلايا للمواد الخارجية غير المنفذةبطريقة أخرى 4. بالمقارنة مع التسليم بوساطة فيروسية ، فإن التثقيب الكهربائي مفيد لأنه آمن بشكل عام وسهل التشغيل وله تكاليف تشغيل منخفضة. يمكن أن يوفر التثقيب الكهربائي شحنات جزيئية صغيرة وكبيرة ويمكن أن يكون فعالا في نقل الخلايا بغض النظر عن النسب5. لتحقيق النتائج المرجوة بعد التثقيب الكهربائي ، أي الجدوى الجيدة وكفاءة النقل الكهربائي الجيدة ، يجب تحسين مجموعة متنوعة من المعلمات التجريبية. وتشمل هذه نوع الخلية6 ، وكثافة الخلية ، وتركيز الجزيء7 ، وخصائص المخزن المؤقت للتثقيب الكهربائي (على سبيل المثال ، التركيب الجزيئي ، والتوصيل ، والأسمولية) 8 ، وحجم / هندسة القطب9 ، وشكل موجة النبض الكهربائي (الشكل ، القطبية ، عدد النبضات)10 (راجع الشكل 1 للحصول على توضيح). على الرغم من أن كل من هذه المعلمات يمكن أن يكون لها تأثير كبير على نتائج تجارب التثقيب الكهربائي ، فقد تمت دراسة شكل موجة النبض بشكل خاص بتفصيل كبير ، حيث أن الطاقة الكهربائية للنبضة (النبضات) المطبقة هي جذر المفاضلة الجوهرية بين قابلية بقاء الخلية الناتجة وكفاءة النقل الكهربائي8.
عادة ، يتم إجراء تجارب التثقيب الكهربائي على المقياس الكلي ، حيث يتم تعليق الخلايا في 100s من ميكرولتر من المخزن المؤقت بين مجموعة من الأقطاب الكهربائية الكبيرة المتوازية داخل كوفيت التثقيب الكهربائي. عادة ما يتم تصنيع الأقطاب الكهربائية من الألومنيوم بمسافة قطب كهربائي من 1-4 مم. بمجرد تحميل الخلايا يدويا عبر ماصة ، يتم توصيل الكوفيت كهربائيا بمولد نبض كهربائي ضخم حيث يمكن للمستخدم ضبط وتطبيق معلمات شكل موجة النبض لكهرباء تعليق الخلية. على الرغم من أن التثقيب الكهربائي على نطاق كبير أو السائبة يمكنه معالجة كثافات الخلايا >106 خلايا / مل ، إلا أن هذه الميزة يمكن أن تكون مهدرة عند تحسين إعدادات شكل موجة النبض الكهربائي. هذا مثير للقلق بشكل خاص عند استخدام أنواع الخلايا الأولية بالكهرباء حيث يمكن أن تكون أعداد الخلايا محدودة. بالإضافة إلى ذلك ، نظرا للمسافة الكبيرة بين الأقطاب الكهربائية ، يجب أن يكون مولد النبض قادرا على توفير جهد كبير لتحقيق شدة المجال الكهربائي >1kV / cm11. تتسبب هذه الفولتية العالية في تبديد الطاقة المقاومة من خلال المخزن المؤقت للكهارل مما يؤدي إلى تسخين جول ، مما قد يضر بصلاحية الخلية الناتجة12. أخيرا ، فإن إجراء التثقيب الكهربائي على تعليق كثيف للخلايا سيكون مثقلا باستمرار بتنوع فطري في كفاءة النقل الكهربائي الناتجة وصلاحية الخلية. يمكن أن تتعرض كل خلية معلقة لشدة مجال كهربي مختلفة بسبب الخلايا المحيطة. اعتمادا على ما إذا كانت شدة المجال الكهربائي ذات الخبرة إما زيادة أو نقصان ، قد تتأثر كل من صلاحية الخلية الناتجة أو كفاءة النقل الكهربائي سلبا11. أدت هذه الجوانب السلبية للتثقيب الكهربائي على نطاق واسع إلى متابعة وتطوير تقنيات بديلة تعمل على النطاق الصغير وتسمح بتحكم أفضل على مستوى الخلية الواحدة.
ينبع مجال BioMEMS ، أو الأنظمة الكهروميكانيكية الدقيقة الطبية الحيوية ، من التطورات التكنولوجية التي تحققت في صناعة الإلكترونيات الدقيقة. على وجه التحديد ، استخدام عمليات التصنيع الدقيق لتطوير الأجهزة الدقيقة للنهوض بالبحوث الطبية الحيوية. تشمل هذه التطورات تطوير صفائف الأقطاب الكهربائية الدقيقة للمراقبة الكهربائية في الجسم الحي 13 ، والأقطاب الكهربائية الدقيقة السعوية للتثقيب الكهربائي في الموقع 14 ، وأجهزة الأعضاء المصغرة على الرقاقة 15 ، وتشخيصات نقطة الرعاية للموائع الدقيقة 16 ، وأجهزة الاستشعار الحيوية 17 ، وأنظمة توصيل الأدوية18 ، بما في ذلك أجهزة التثقيب الكهربائي النانوي والدقيق 19،20،21 . نظرا للقدرة على تصميم وتصنيع الأجهزة بنفس حجم الخلايا البيولوجية ، فإن تقنيات التثقيب الكهربائي النانوي والدقيق مفيدة عند مقارنتها بنظيرتها على نطاق كلي22,23. تلغي أجهزة التثقيب الكهربائي هذه متطلبات تطبيقات نبض الجهد العالي ، حيث يتم عادة دمج مجموعات الأقطاب الكهربائية ذات المسافات من 10 إلى 100 ثانية من الميكرومتر. تقلل هذه الميزة بشكل كبير من التيار عبر المنحل بالكهرباء ، مما يقلل بدوره من تراكم منتجات التحليل الكهربائي السامة وتأثيرات تسخين جول في هذه الأنظمة. تضمن القنوات الصغيرة أيضا تطبيق مجال كهربائي أكثر اتساقا بشكل موثوق على الخلايا أثناء تطبيق النبض ، مما يؤدي إلى نتائج أكثر اتساقا24. بالإضافة إلى ذلك ، من الشائع أيضا دمج أجهزة التثقيب الكهربائي الدقيقة في منصة الموائع الدقيقة التي تفسح المجال للاندماج المستقبلي في تقنية مؤتمتة بالكامل ، وهي قدرة مرغوبة للغاية في تصنيع العلاج بالخلايا25. أخيرا ، يسمح التثقيب الكهربائي على نطاق صغير بالاستجواب الكهربائي لأحداث التثقيب الكهربائي. على سبيل المثال ، يمكن مراقبة درجة نفاذية غشاء الخلية في الوقت الفعلي على مستوى خلية واحدة26,27. الغرض من هذه الطريقة هو وصف التصنيع الدقيق وتشغيل النظام وتحليل جهاز التثقيب الكهربائي الدقيق أحادي الخلية أحادي الخلية القادر على قياس درجة نفاذية غشاء الخلية لتحسين بروتوكولات التثقيب الكهربائي ، مع زيادة الإنتاجية على الحالة السابقة من بين الفن.
لم يعد إجراء التثقيب الكهربائي على مستوى الخلية الواحدة تقنية جديدة ، كما تم توضيحها لأول مرة من قبل Rubinsky et al. في عام 2001 مع تطوير تقنية التثقيب الكهربائي للخلايا الثابتة28. كان جهازهم الصغير مبتكرا لأنهم كانوا أول من أظهر القدرة على مراقبة حدث التثقيب الكهربائي كهربائيا. وقد أدى ذلك أيضا إلى تطوير تقنيات التثقيب الكهربائي الثابت أحادي الخلية القادرة على الكشف كهربائيا عن درجة نفاذية غشاء الخلية بطريقة متوازية لزيادة إنتاجية الأجهزة. ومع ذلك ، حتى مع التوازي ومعالجة الدفعات ، تفتقر هذه الأجهزة بشدة إلى العدد الإجمالي للخلايا التي يمكنها معالجتها لكل وحدة زمنية29,30. وقد أدى هذا القيد إلى تطوير أجهزة التدفق القادرة على إجراء التثقيب الكهربائي الدقيق على مستوى الخلية الواحدة عند إنتاجية أكبر بكثير31. يحد انتقال الجهاز هذا ، من البيئة الثابتة إلى بيئة التدفق ، من القدرة على المراقبة الكهربائية لدرجة نفاذية غشاء الخلية بعد تطبيق نبضة التثقيب الكهربائي. تعمل الطريقة الموصوفة في هذا العمل على سد الفجوة بين هاتين التقنيتين ، وهي تقنية تثقيب كهربائي دقيق قادرة على الكشف الكهربائي والنبض ومراقبة درجة نفاذية غشاء الخلية للخلايا الفردية ، بطريقة تسلسلية مستمرة التدفق.
تم وصف هذه التكنولوجيا مؤخرا في Zheng et al. في هذا العمل ، تم إدخال قدرات هذه التكنولوجيا مع الانتهاء من دراسة بارامترية ، حيث تم تغيير كل من سعة ومدة نبضة التثقيب الكهربائي ، وتم استكشاف الإشارة الكهربائية اللاحقة ، التي تدل على نفاذية غشاء الخلية ،32. أظهرت النتائج أن زيادة شدة نبضة التثقيب الكهربائي (أي زيادة في المجال الكهربائي المطبق أو زيادة في مدة النبضة) تسببت في زيادة نفاذية غشاء الخلية المقاسة. لمزيد من التحقق من صحة النظام ، تمت إضافة مؤشر فلوري شائع للتثقيب الكهربائي الناجح ، وهو بروبيديوم يوديد33 ، إلى تعليق الخلية ، وتم التقاط صورة مضان فور تطبيق النبضة الكهربائية. كانت الإشارة الضوئية ، أي شدة مضان يوديد البروبيديوم داخل الخلية ، مرتبطة ارتباطا وثيقا بالقياس الكهربائي لدرجة نفاذية غشاء الخلية ، مما تحقق من موثوقية هذا القياس الكهربائي. ومع ذلك ، فإن هذا العمل نظر فقط في توصيل جزيء يوديد البروبيديوم الصغير ، والذي ليس له أهمية تذكر أو معدومة.
في هذا العمل ، يتم تقديم تطبيق جديد لهذه التكنولوجيا لتحسين إنتاجية النظام مع تقديم ناقل الحمض النووي البلازميد النشط بيولوجيا (pDNA) وتقييم كفاءة النقل الكهربائي للخلايا المعاد طلاؤها وزراعتها بعد التثقيب الكهربائي. على الرغم من أن العمل السابق يتفوق على تقنيات التثقيب الكهربائي الدقيقة الحالية القادرة على قياس حدث التثقيب الكهربائي كهربائيا ، إلا أن الحالة الحالية للجهاز لا تزال تتطلب أوقات عبور طويلة للخلايا بين مجموعة القطب (~ 250 مللي ثانية) لإجراء الكشف عن الخلية وتطبيق النبض وقياس نفاذية غشاء الخلية. مع قناة واحدة ، يحد هذا من الإنتاجية إلى 4 خلايا / ثانية. لمكافحة هذا القيد ، تم تقديم مفهوم جديد للتثقيب الكهربائي الذي يتم التحكم فيه بواسطة التغذية المرتدة القائمة على الخلايا لأداء النقل الكهربائي pDNA. باستخدام المخزن المؤقت للتوصيل الكهربائي hypo-الفسيولوجية ، يسمح هذا النظام بالاستجواب الكهربائي للخلايا المفردة عبر العديد من تطبيقات نبض التثقيب الكهربائي. بناء على الاستجابة الكهربائية ، يتم بعد ذلك تحديد نبضة التثقيب الكهربائي "الأمثل". ثم يتم تنفيذ وضع "الإنتاجية العالية" حيث يتم إبطال تحديد نفاذية غشاء الخلية ، وزيادة معدل التدفق ، ومطابقة دورة عمل نبضة التثقيب الكهربائي مع وقت عبور الخلية لضمان نبضة واحدة لكل خلية أثناء النقل بين الأقطاب الكهربائية. سيوفر هذا العمل تفاصيل شاملة حول خطوات التصنيع الدقيق لتصنيع الجهاز الصغير ، والمواد / المعدات وإعدادها المطلوب لإجراء التجارب ، وتشغيل / تحليل الجهاز وكفاءة النقل الكهربائي (eTE).
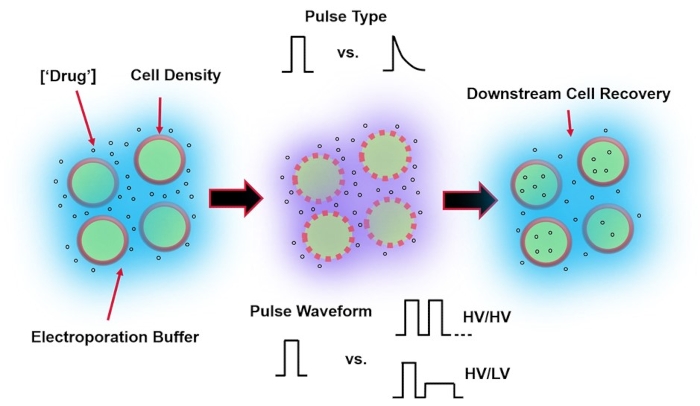
الشكل 1: العوامل التجريبية التي تؤثر على نتائج التثقيب الكهربائي. (يسار) تعليق الخلية - تشمل العوامل المهمة التي يجب مراعاتها قبل بدء التثقيب الكهربائي ما يلي: الحمولة الصافية (في هذه الحالة ، pDNA) ، والتركيز ، وكثافة الخلية ، وخصائص المخزن المؤقت للتثقيب الكهربائي. خصائص المخزن المؤقت للتثقيب الكهربائي التي يجب مراعاتها هي الموصلية ، الأسمولية ، والتركيب الجزيئي الدقيق الذي يساهم في هذه القيم. (وسط) تطبيق النبض - يجب تحسين نوع النبضة الدقيق (الموجة المربعة مقابل الاضمحلال الأسي) وشكل موجة النبض (النبضة المفردة مقابل قطار النبض) لزيادة كل من صلاحية الخلية الناتجة وكفاءة النقل الكهربائي. تتكون قطارات النبض الشائعة المطبقة في عمليات التثقيب الكهربائي عادة من سلسلة من نبضات الجهد العالي (HV) أو سلسلة من النبضات التي تدور بين مقادير نبضات الجهد العالي والجهد المنخفض (LV). (يمين) يجب تحسين خطوات معالجة استرداد الخلايا ، على وجه الخصوص ، وسائط ثقافة خلية الاسترداد التي يتم نقل الخلايا إليها. غير مميز (أقصى اليسار) ، يمكن تنفيذ خطوات معالجة خلايا إضافية في المنبع لتحسين عملية التثقيب الكهربائي بشكل عام. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
ملاحظة: يجب على المستخدمين مراجعة كافة MSDS للمواد والمستلزمات المستخدمة في هذا البروتوكول. يجب ارتداء معدات الوقاية الشخصية المناسبة في كل خطوة واستخدام تقنية معقمة أثناء التجربة. تناقش الأقسام 1-7 تصنيع الجهاز.
1. تصنيع الجهاز - تصميم القناع
ملاحظة: راجع الشكل 2 للحصول على توضيح لعملية التصنيع الدقيق. يجب تنفيذ خطوات التصنيع الدقيق في بيئة غرف الأبحاث. معدات الوقاية الشخصية الإضافية ضرورية (شبكة الشعر ، شبكة شعر الوجه ، القناع ، بدلة غرف الأبحاث ، أغطية الأحذية).
- قم بتثبيت برنامج CAD من اختيارك ، وصمم "قناعا" 2 الأبعاد لكل من قناة الموائع الدقيقة والأقطاب الكهربائية واحفظ التصميم بتنسيق الملف المطلوب (أي .dxf ، .dwg).
ملاحظة: راجع الشكل التكميلي 1 للحصول على مثال لمخطط قناع ثنائي الأبعاد. - أرسل إلى المورد الذي تختاره لتتم طباعته. تأكد من أن أبعاد التصاميم ضمن قدرات الدقة للمورد.
2. تصنيع الأجهزة - الطباعة الحجرية الضوئية
ملاحظة: يتم اعتماد وصفات التصنيع الدقيق المقدمة من توصيات الشركة المصنعة للمقاومة الضوئية ويجب استخدامها فقط كنقطة انطلاق34. يجب تحسين القيم الدقيقة لأوقات الخبز وأوقات التعرض وما إلى ذلك لكل بروتوكول تصنيع. يوصى باستخدام ملاقط الويفر للتعامل مع كل من رقائق السيليكون والشرائح الزجاجية.
- تصنيع قناة الموائع الدقيقة
- تنظيف شرائح رقاقة السيليكون وزجاج الصودا والجير: اتبع الخطوات 2.1.2-2.1.3 لإجراء تنظيف رقاقة السيليكون وتنظيف شرائح زجاج الصودا والجير 1 "× 3" (يشار إلى كلاهما باسم "الركيزة").
- اغمر الركائز في حمام الأسيتون وحمام الأيزوبروبانول (IPA) وحمام مائي منزوع الأيونات لمدة 10 دقائق لكل منهما. قم بإجراء هذا الغسيل المكون من 3 خطوات بشكل متسلسل في درجة حرارة الغرفة.
- قم بإزالة وتجفيف السطح باستخدام النيتروجين المضغوط أو مصدر غاز الهواء المصفى. ضع الركائز في فرن 150 درجة مئوية لمدة لا تقل عن 30 دقيقة للسماح بتبخر الرطوبة المتبقية.
- الطباعة الحجرية الضوئية SU-8 على رقاقة السيليكون: قم بإجراء الطباعة الحجرية الضوئية على رقاقة السيليكون باتباع الخطوات 2.1.5-2.1.14.
ملاحظة: لتحقيق ارتفاع قناة الموائع الدقيقة من 20 ميكرومتر ، تم استخدام المقاومة الضوئية السلبية من سلسلة SU-8 2000. ستختلف معدلات الدوران الدقيقة اعتمادا على تركيبة SU-8 (أي 2010 ، 2015 ، إلخ) ؛ ومع ذلك ، فإن الشروط التالية هي لصياغة SU-8 201035. - أخرجي رقاقة السيليكون من الفرن الذي تبلغ درجة حرارته 150 درجة مئوية واتركيه يبرد إلى درجة حرارة الغرفة (RT).
- قم بتثبيت الرقاقة في ظرف طلاء دوران الرقاقة باستخدام نظام تفريغ مغلف الدوران. برمجة الدوار. الخطوة 1 - 500 دورة في الدقيقة لمدة 10 ثوان بتسارع 100 دورة في الدقيقة / ثانية ، الخطوة 2 - 1000 دورة في الدقيقة لمدة 30 ثانية بتسارع 300 دورة في الدقيقة / ثانية.
- الاستغناء عن 4 مل من SU-8 2010 photoresistant على مركز رقاقة السيليكون. قم بتشغيل البرنامج. بمجرد توقف النظام ، قم بإيقاف تشغيل الفراغ.
- باستخدام الملقط ، انقل رقاقة السيليكون المطلية ب SU-8 على طبق ساخن عند 95 درجة مئوية لمدة 4-5 دقائق للخبز الناعم. ثم أخرج الرقاقة من اللوح الساخن واتركها تبرد إلى RT.
ملاحظة: اتبع إجراء بدء التشغيل المناسب لمحاذاة القناع الحجري الضوئي الخاصة بالمختبر. - قم بتأمين القناع الضوئي باستخدام تصميمات قناة الموائع الدقيقة 2D على حامل القناع. أدخل رقاقة السيليكون ، مع توجيه طلاء SU-8 لأعلى ، على ظرف الرقاقة.
- اضبط إعدادات التعريض الضوئي على 150 مللي جول/سم2 وقم بتشغيل الجهاز.
تنبيه: لا تنظر مباشرة إلى مصدر ضوء الأشعة فوق البنفسجية لتجنب تلف العين المحتمل. - ضع رقاقة السيليكون المطلية ب SU-8 على طبق ساخن عند 95 درجة مئوية لمدة 4-5 دقائق للخبز بعد التعرض.
- اغمر رقاقة السيليكون في حل مطور SU-8 (انظر جدول المواد) لمدة 3-4 دقائق. تطبيق التحريض لطيف. قم بإزالة الرقاقة من المحلول وشطف السطح باستخدام IPA.
- جفف السطح باستخدام نيتروجين مضغوط أو مصدر غاز هواء مصفى. افحص الميزات تحت المجهر باستخدام مرشح للأشعة فوق البنفسجية وتأكد من عدم وجود عيوب واضحة في قنوات الموائع الدقيقة.
- ضع رقاقة السيليكون في فرن على حرارة 150 درجة مئوية لمدة لا تقل عن 30 دقيقة للخبز الصلب.
- السماح لتبرد إلى RT واستخدام profilometry القلم لقياس الارتفاع الدقيق والمنحدر من الجدران الجانبية للقناة.
- الطباعة الحجرية الضوئية على الشرائح الزجاجية
ملاحظة: يستخدم Hexamethyldisilazane (HMDS) كمروج للالتصاق لمقاومة الضوء الإيجابية S181836.- أخرج الشريحة الزجاجية من الفرن الذي تبلغ درجة حرارته 150 درجة مئوية واتركه يبرد إلى RT.
- قم بتأمين الشريحة الزجاجية على ظرف الدوار باستخدام الفراغ وبرمجة الدوار. الخطوة 1 - 500 دورة في الدقيقة لمدة 10 ثوان بتسارع 100 دورة في الدقيقة / ثانية. الخطوة 2 - 3000 دورة في الدقيقة لمدة 30 جلس بتسارع 300 دورة في الدقيقة / ثانية.
- قم بتوزيع 3-4 قطرات من HMDS عبر سطح الشريحة الزجاجية. قم بتشغيل البرنامج.
ملاحظة: لتحقيق طلاء سطحي ~ 3 ميكرومتر ، يجب استخدام سلسلة مقاومة الضوء الإيجابية S1800. تختلف معدلات الدوران الدقيقة اعتمادا على التركيبة ؛ التوصيات الواردة أدناه هي لصياغة S181834. - قم بتوزيع 1 مل من المقاومة الضوئية على سطح الشريحة الزجاجية. تأكد من وجود ما يكفي لتغطية مساحة السطح.
- قم بتشغيل البرنامج. بمجرد توقف النظام ، قم بإيقاف تشغيل المكنسة الكهربائية وإزالة الشريحة الزجاجية.
- ضع الشريحة الزجاجية المطلية ب S1818 على طبق ساخن على حرارة 120 درجة مئوية لمدة 4 دقائق للحصول على خبز ناعم. إزالة والسماح للمجيء إلى RT.
- قم بتأمين القناع الضوئي باستخدام تصميمات القطب الكهربائي 2D على حامل القناع.
- أدخل الشريحة الزجاجية وقم بمحاذاتها ، بحيث يكون طلاء S1818 متجها لأعلى ، على ظرف الرقاقة. اضبط إعدادات التعريض الضوئي على 250 مللي جول/سم2 وقم بتشغيل الجهاز.
ملاحظة: قد تكون نماذج محاذاة التلامس المختلفة أكثر أو أقل ملاءمة للركائز غير الدائرية ذات السماكة المتفاوتة. - اغمر الشريحة الزجاجية في حل المطور MF-319 لمدة 2 دقيقة. تطبيق التحريض لطيف. شطف سطح الشريحة الزجاجية بالماء منزوع الأيونات.
- جفف السطح باستخدام النيتروجين المضغوط أو مصدر غاز الهواء المصفى ولاحظ الميزات تحت المجهر باستخدام مرشح الأشعة فوق البنفسجية. تأكد من عدم وجود عيوب واضحة في أنماط الطباعة الحجرية.
- ضع الشريحة الزجاجية في الفرن الذي تبلغ درجة حرارته 150 درجة مئوية ، مع التأكد من أن سطح الركيزة محل الاهتمام متجها لأعلى ، لمدة لا تقل عن 30 دقيقة للخبز الصلب. أخرجيها من الفرن واحفظيها بعيدا عن الضوء.
3. تصنيع الجهاز: حمض الهيدروفلوريك (HF) حفر
تنبيه: تتضمن هذه الخطوة التعامل مع حمض الهيدروفلوريك (HF) والتخلص منه ، والذي يمكن أن يسبب حروقا كيميائية عميقة ومؤلمة. يجب استخدام معدات الوقاية الشخصية الإضافية لحماية المعالج (درع الوجه ، قفازات مقاومة كيميائيا بطول الكوع ، ساحة مقاومة كيميائيا مع أكمام). يجب أن يبقى محايد حمض غلوكونات الكالسيوم وجل الجلد بالقرب من مقعد المختبر. لا ينبغي تنفيذ هذه الخطوة وحدها. لا ينبغي أبدا تخزين HF أو الاستغناء عنه في عبوات زجاجية حيث سيتم حفر الحاوية بواسطة الحمض.
ملاحظة: يقوم HF بشكل موحد بحفر الزجاج المكشوف (أي تصميم القطب) لتشكيل تجويف في الزجاج ، مما يسمح بتحسين دقة حافة نمط القطب بعد ترسيب المعدن (القسم 4).
- اغمر الشريحة الزجاجية في محلول HF مخزن بنسبة 10: 1 لمدة دقيقة واحدة في حاوية بولي تترافلورو إيثيلين. نقل وغسل الشرائح الزجاجية في الماء منزوع الأيونات. كرر خطوة الغسيل 3 مرات.
- جفف السطح باستخدام نيتروجين مضغوط أو مصدر غاز هواء مصفى. ضع ركائز زجاجية في فرن 65 درجة مئوية طوال الليل لإزالة أي رطوبة متبقية. تغطية ركائز من الضوء.
4. تصنيع الجهاز: ترسيب البخار المادي
ملاحظة: تتضمن هذه الخطوة ترسيب المعدن على ركائز الشريحة الزجاجية لتحديد أنماط القطب. الأقطاب الكهربائية المعدنية شائعة الاستخدام هي الكروم / الذهب والتيتانيوم / البلاتين. لا يلتصق الذهب والبلاتين بالركيزة الزجاجية ، لذلك يلزم وجود طبقة التصاق البذور من الكروم أو التيتانيوم ، على التوالي ، لتعزيز الالتصاق37.
- اتبع البروتوكول الخاص بغرف الأبحاث لتشغيل نظام PVD الداخلي. يستخدم هذا العمل نظام الاخرق DC والرش مع 100 SCCM غاز الأرجون عند ضغط ~ 8 mTorr و 200 واط الطاقة.
- رش التيتانيوم لمدة 8 دقائق بمعدل ~ 100 Å / دقيقة. رش البلاتين لمدة 10 دقائق بمعدل ~ 200 Å / دقيقة. إزالة ركائز من غرفة PVD.
5. تصنيع الجهاز: رفع مقاوم للضوء
ملاحظة: تتضمن هذه الخطوة إذابة الطبقة المقاومة للضوء في حمام الأسيتون ، تاركة أقطاب البلاتين الملتصقة منقوشة على الشرائح الزجاجية.
- اغمر الشرائح الزجاجية المطلية بالمعدن في حمام الأسيتون لمدة ~ 10 دقائق.
- قم بتقطيع الحمام لإدخال التحريض لتفريق الفيلم المعدني غير الملتصق. استخدم منديلا منقوعا بالأسيتون لإزالة أي بقايا إذا لزم الأمر.
- بمجرد إزالة كل المعدن المقاوم للضوء ، اغسل أنماط القطب بالماء منزوع الأيونات ، وضعها في فرن 65 درجة مئوية طوال الليل لإزالة أي رطوبة سطحية متبقية.
- استخدم قياس ملامح القلم لقياس ملف تعريف الأقطاب الكهربائية المنقوشة.
6. تصنيع الجهاز: الطباعة الحجرية الناعمة
ملاحظة: تتضمن هذه الخطوة قولبة طبق الأصل لقناة الموائع الدقيقة على هيكل الإغاثة الرئيسي SU-8 باستخدام المطاط الصناعي ، بوليديميثيل سيلوكسان (PDMS).
- سيلاني رقاقة السيليكون
ملاحظة: هذه خطوة اختيارية; ومع ذلك ، فإنه سيزيد من عمر هيكل الإغاثة SU-8 الذي تم تصنيعه في القسم الفرعي 2.1. يجب تنفيذ هذه الخطوة في غطاء دخان كيميائي.- ثبت الرقاقة في قاع طبق بتري وضع طبق بتري في مجفف.
- أحيط محيط رقاقة السيليكون بحوالي 50 ميكرولتر من ثلاثي كلورو (1H ، 1H ، 2H ، 2H-perfluorooctyl) سيلان. قم بتوصيل الفراغ (مضخة التفريغ أو خط تفريغ المنزل) وقم بتشغيله لمدة 20 دقيقة.
- PDMS نسخة طبق الأصل صب
- في حاوية يمكن التخلص منها (على سبيل المثال ، قارب وزن ، كوب بلاستيكي) ، امزج قاعدة المطاط الصناعي PDMS مع المقسى بنسبة وزن 10: 1 أعلى الميزان الإلكتروني. صب محلول PDMS فوق رقاقة السيليكون وضع الخليط تحت فراغ لإزالة جميع فقاعات الهواء.
- علاج عند 65 درجة مئوية لمدة لا تقل عن 4 ساعات مما يسمح PDMS بالتصلب. باستخدام طرف شفرة الحلاقة ، قم بقطع PDMS المصبوب وقشره من رقاقة السيليكون.
- باستخدام لكمة خزعة حادة ، قم بإزالة PDMS من مدخل / منافذ الجهاز. بالنسبة لهذا الجهاز ، تم استخدام لكمات خزعة 0.75 مم و 3 مم للمداخل والمنافذ ، على التوالي.
ملاحظة: يجب أن يكون قطر ثقب الخزعة المستخدم أصغر قليلا من القطر الخارجي للأنبوب المتصل لضمان إحكام إغلاق الأنابيب في الخزانات.
- تنظيف صوتي من PDMS
- اغمر أجهزة PDMS في IPA وضعها في جهاز صوتي لمدة 30-45 دقيقة لإزالة أي حطام PDMS من المدخل / المنافذ. قد تنتفخ PDMS في حل IPA.
- يشطف بالماء منزوع الأيونات ويوضع في فرن على حرارة 65 درجة مئوية طوال الليل للسماح لنظام PDMS بإزالة الانتفاخ مرة أخرى إلى الحجم الطبيعي.
ملاحظة: أي بقايا متبقية يمكن أن تسد الجهاز أثناء التجربة. يمكن إزالة قطع كبيرة من الحطام من سطح PDMS باستخدام قطعة من شريط سكوتش قبل الصوتنة.
7. تصنيع الجهاز: PDMS الترابط / مرفق الأسلاك
ملاحظة: تتضمن هذه الخطوة معالجة سطح PDMS والركيزة الزجاجية ببلازما الأكسجين لتشكيل رابطة لا رجعة فيها بين PDMS والزجاج38. قد تحتاج الوصفة المقدمة إلى تكييفها مع النظام الدقيق المستخدم في المختبر.
- قم بقص الأجهزة حسب الحجم وتأكد من نظافة سطح جهاز PDMS. إذا لم تتم إعادة التنظيف ، فاتبع الخطوات الواردة في القسم الفرعي 6.3.
- برمجة مولد البلازما. اضبط الطاقة على 70 واط ، والوقت على 35 ثانية ، والضغط على 325 mTorr ، ومعدل تدفق غاز الأكسجين على 60 SCCM. ضع PDMS وشريحة زجاج القطب الكهربائي في النظام مع توجيه الميزات لأعلى وتشغيل البرنامج.
- قم بإزالة الأجهزة ومحاذاة ميزات القناة بسرعة مع الأقطاب الكهربائية باستخدام مجسم. قم بالضغط بقوة من مركز PDMS باتجاه الجانبين لإزالة أي فقاعات هواء غير مرغوب فيها في واجهة الترابط.
- ضعه في مكان ساخن عند 95 درجة مئوية لمدة 2 دقيقة على الأقل لإنهاء إجراء الترابط واترك الجهاز يبرد عند RT.
- قطع 2 قطعة من الأسلاك الصلبة 22-G بأطوال ~ 6 "وتجريد العازل من كلا الطرفين.
- اربط الأسلاك بوسادات القطب باستخدام الإيبوكسي الموصل للفضة. ضع الأجهزة المكتملة في فرن 65 درجة مئوية طوال الليل.
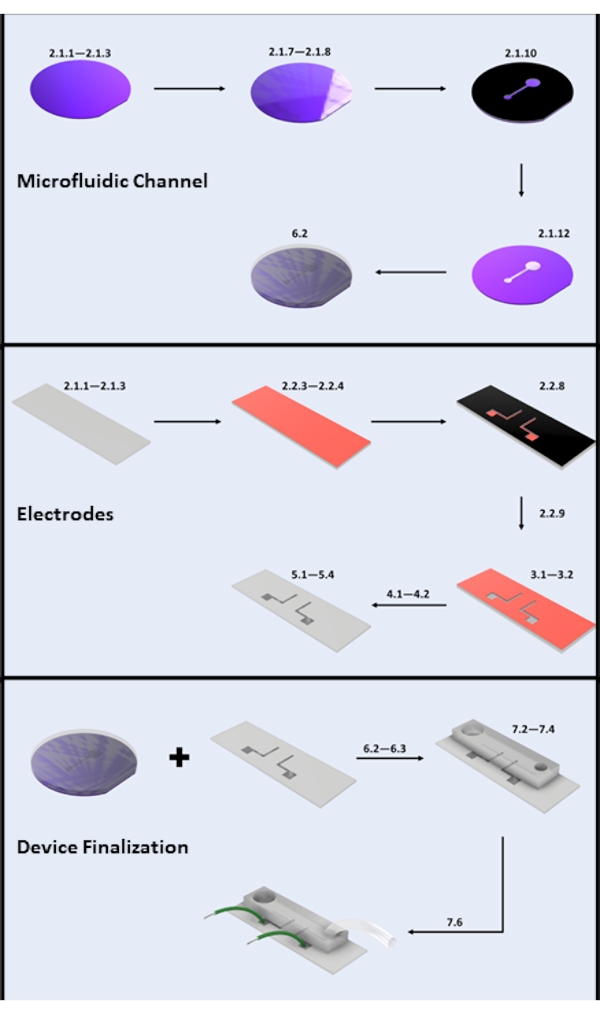
الشكل 2: تصنيع الأجهزة الدقيقة. (أ) تصنيع قناة الموائع الدقيقة - الخطوات الرئيسية: تنظيف رقاقة السيليكون (الخطوات 2.1.1-2.1.3) ، الطلاء المقاوم للضوء والخبز الناعم (الخطوات 2.1.7-2.1.8) ، التعرض للأشعة فوق البنفسجية (الخطوة 2.1.10) ، التطوير (الخطوة 2.1.12) ، وصب PDMS (القسم الفرعي 6.2). (ب) الخطوات الرئيسية لتصنيع الأقطاب الكهربائية: تنظيف الشرائح الزجاجية (الخطوات 2.1.1-2.1.3) ، طلاء HMDS والطلاء المقاوم للضوء (الخطوات 2.2.3-2.2.4) ، التعرض للأشعة فوق البنفسجية (الخطوة 2.2.8) ، التطوير (الخطوة 2.2.9) ، حفر HF (القسم 3) ، ترسيب البخار المادي (القسم 4) ، والرفع المقاوم للضوء (القسم 5). (ج) خطوات إنهاء الجهاز الرئيسية: الوصول إلى المدخل / المخرج والصوتنة (الخطوة 6.2.3 والقسم 6.3) ، وربط PDMS ، ومرفق الأسلاك (القسم 7). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
8. زراعة الخلايا والحصاد
ملاحظة: يجب استخدام زراعة الخلايا القياسية وإجراءات المناولة المعقمة. اتبع البروتوكول الخاص بنوع الخلية لزراعة الخلايا.
- زراعة الخلايا
- مرور الخلية: زراعة الخلايا ومرورها باتباع الخطوات 8.1.2-8.1.5.
- خلايا HEK293 في محلول DMEM كامل (88٪ DMEM ، 10٪ مصل بقري جنيني معطل بالحرارة ، 1٪ L- جلوتامين ، 1٪ بنسلين ستربتومايسين) في دورق T25 في حاضنة عند 37 درجة مئوية ، 95٪ O2 ، 5٪ CO2. خلايا المرور في الموعد المحدد عند الوصول إلى ~ 80٪ التقاء.
- قم بشفط الوسائط باستخدام ماصة أو نظام تفريغ واحتضان الخلايا في 0.25٪ تربسين-EDTA (دورق 2 مل-T25) لمدة دقيقتين عند 37 درجة مئوية. تحييد التربسين مع ضعف حجم وسائط الثقافة.
- انقل معلق الخلية إلى أنبوب مخروطي سعة 15 مل وخلايا طرد مركزي HEK293 بسرعة 770 × جم لمدة 2 دقيقة. نضح الطافية باستخدام إما ماصة أو نظام فراغ
- أعد تعليق خلايا HEK293 في 1 مل من DMEM الذي تم تسخينه مسبقا.
- طلاء الخلية: قم بطلاء الخلايا باتباع الخطوات 8.1.7-8.1.8
- قم بطلاء الخلايا بتخفيف 10: 1 إلى 20: 1 في دورق T25 (5 مل من DMEM) لمواصلة الثقافة.
- قم بتصفية الخلايا بتخفيف 5: 1 إلى 20: 1 في لوحة من 6 آبار (2 مل من DMEM لكل بئر) ليتم حصادها لتجارب التثقيب الكهربائي.
ملاحظة: خلايا HEK293 مطلية 24 ساعة قبل تجارب التثقيب الكهربائي لتحقيق التقاء ~ 70٪ عند حصاد الخلايا (القسم الفرعي 8.3). يمكن أن يؤدي جدول الحصاد غير المتسق إلى تباين في نتائج التثقيب الكهربائي.
- العازلة الكهربائية
- تحضير المخزن المؤقت للتثقيب الكهربائي
ملاحظة: راجع Sherba et al. للحصول على تفاصيل حول إعداد المخزن المؤقت للتثقيب الكهربائي8. كان تكوين المخزن المؤقت 285 mM Sucrose ، 0.7 mM MgCl2 ، 1 mM KCl ، 10 mM HEPES ، 3 mM NaOH (الرقم الهيدروجيني: 7.4 ؛ الأسمولية: 310 mOsm ، الموصلية: 500 μS / cm). يجب صياغة المخزن المؤقت للتثقيب الكهربائي بطريقة معقمة وتخزينه في 4 °C لمدة صلاحية ~ 1 شهر. يجب تحسين تركيبة عازلة التثقيب الكهربائي على أساس نوع كل خلية.
- تحضير المخزن المؤقت للتثقيب الكهربائي
- حصاد الخلايا وإضافة pDNA
- اتبع نفس خطوات مرور الخلية (8.1.2-8.1.4).
- اغسل الخلايا في 1x PBS معقم ، وتعليق خلية النقل إلى أنبوب مخروطي سعة 15 مل ، وخلايا طرد مركزي عند 770 × جم لمدة دقيقتين.
- اغسل حبيبات خلية HEK293 في المخزن المؤقت للتثقيب الكهربائي وأجهزة الطرد المركزي عند 770 × جم لمدة 2 دقيقة. أعد تعليق الخلايا في المخزن المؤقت للتثقيب الكهربائي عند ~ 5 مليون خلية / مل.
ملاحظة: يجب تحسين كثافة الخلية لكل نوع خلية. - أضف ترميز pDNA للبروتين الفلوري الأخضر (GFP) إلى تركيز نهائي قدره 20 ميكروغرام / مل. امزج تعليق pDNA / الخلية برفق وانقل المعلق إلى حقنة 1 سم مكعب للتجريب.
9. الأجهزة / الإعداد التجريبي
ملاحظة: قبل حصاد الخلايا للتجريب ، تأكد من اكتمال الإعداد التجريبي لتقليل مقدار الوقت الذي يتم فيه تعليق الخلايا في المخزن المؤقت للتثقيب الكهربائي. قم بتشغيل الإلكترونيات قبل 20-30 دقيقة من التجارب للإحماء. ارجع إلى الشكل 3 للحصول على رسم تخطيطي للإعداد التجريبي لتشغيل وحدة الكشف أحادية الخلية.
ملاحظة: تم تطوير دائرة PA90 Op-Amp المصممة خصيصا لاستيعاب كل من الحساسية المطلوبة للكشف عن مستوى الخلية الواحدة باستخدام مضخم القفل والفولتية العالية المطلوبة لتطبيق نبضات تثقيب كهربائي قوية بما فيه الكفاية. راجع ورقة بيانات PA90 للحصول على مواصفات الدوائرالموصى بها 39.
- قم بتهيئة مضخم الصوت المقفل بإعدادات مكبر الصوت المسبق الحالية وقم بتعيينه عبر الخوارزمية. ارجع إلى Zheng et al. للحصول على تفاصيل حول إعدادات القفل32.
- مزودات الطاقة ومولد الوظائف ومضخم الصوت
- مزود الطاقة 1: اضبط على -15 فولت لتشغيل الطرف السلبي للدائرة.
- مزود الطاقة 2 (مولد الوظائف): اضبط على إخراج إشارة التيار المستمر واضبط السعة على 2 فولت. قم بتوصيله بإدخال مكبر للصوت 50x.
- برنامج مولد نبض التثقيب الكهربائي للموجة المربعة: اضبط عرض النبضة المطلوب (دورة العمل) وسعة النبضة المطلوبة (فولت).
- اضبط الإخراج على وضع التشغيل (1 نبضة). قم بتوصيل الإخراج بإدخال مكبر الصوت 50x.
ملاحظة: تذكر كسب 50x عند برمجة سعة النبض. أي لتحقيق شدة مجال كهربائي تبلغ 1 كيلو فولت / سم ، يلزم إجمالي 30 فولت ، 30 فولت / 300 ميكرومتر (المسافة بين الأقطاب الكهربائية) ، لذلك يجب ضبط خرج مولد الوظيفة على 30/50 ، أو 600 مللي فولت. - تحقق من مخرجات مكبر الصوت 50x باستخدام راسم الذبذبات. خرج 1-100 فولت من مصدر الطاقة 2 (9.2.2). الناتج 2-سعة متغيرة لنبضة التثقيب الكهربائي (9.2.4).
- قم بتوصيل مسبار 10x بقناة راسم الذبذبات وبالجهاز الصغير المكتمل (الجهاز قيد الاختبار ، DUT) في الخطوة 7.6 حيث سيتم تطبيق نبضة التثقيب الكهربائي. راقب النظام أثناء التجريب للتأكد من تطبيق النبضات.
- تأكد من توصيل USB المقفل وتسجيله. تحقق جيدا من جميع إعدادات القفل في رمز الخوارزمية (والأهم من ذلك ، تردد إخراج القفل).
- المجهر / كاميرا اتفاقية مكافحة التصحر
- ضع الجهاز الصغير على مرحلة المجهر عبر حامل منزلق. قم بتشغيل كاميرا CCD وركز على قناة الموائع الدقيقة. استخدم هدفا 4x أو 10x.
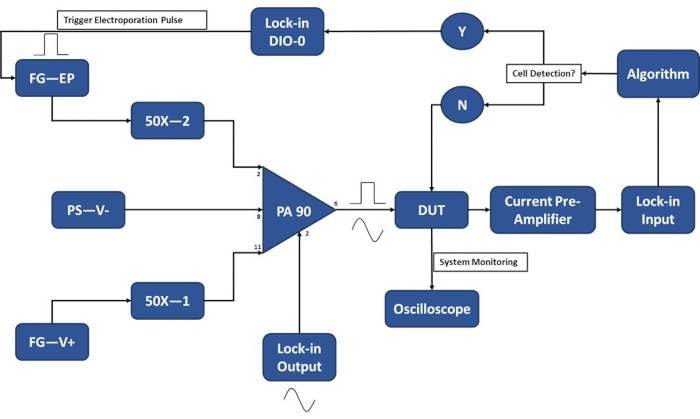
الشكل 3: الإعداد التجريبي للكشف عن خلية واحدة تخطيطية. يسمح مضخم التشغيل عالي الطاقة (PA-90) بتراكب نبضة التثقيب الكهربائي عالي الجهد على إشارة التيار المتردد الناتجة المغلقة المطلوبة للكشف عن الخلية الواحدة. تمر إشارة الإثارة هذه عبر جهاز التثقيب الكهربائي الدقيق (الجهاز قيد الاختبار ، DUT) حيث يتم بعد ذلك تضخيم التيار بواسطة مكبر الصوت المسبق الحالي وإدخاله في الخوارزمية. يراقب النظام باستمرار حدث اكتشاف الخلية. عند دخول الخلية ، يتم إنشاء إشارة رقمية بواسطة مكبر الصوت المقفل لتشغيل تطبيق نبضة التثقيب الكهربائي على الخلية (الخلايا) أثناء النقل. مفتاح الرموز: PA-90 (مضخم تشغيل عالي الطاقة) ، DUT (جهاز قيد الاختبار) ، DIO (إدخال / إخراج رقمي) ، FG-EP (مولد وظيفة / نبض كهربي) ، 50X (مضخم صوت 50X) ، PS-V- (مصدر طاقة / جهد سلبي ل PA 90) ، FG-V + (مولد وظيفة ، جهد إيجابي ل PA 90). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
10. العملية التجريبية
- فتيلة قناة الموائع الدقيقة
- قم بإزالة جميع فقاعات الهواء من المحقنة المحملة بالخلايا. قم بتوصيل إبرة 30 G بالمحقنة المحملة بالخلايا.
- باستخدام ملاقط ، حرك أنبوب tygon على طول الإبرة. املأ خزان المخرج مسبقا بوسائط الاسترداد (مثل الخطوة 8.1.2 بدون المضادات الحيوية) ، ~ 40-50 ميكرولتر.
- باستخدام الإبهام ، اضغط برفق على المكبس بحيث يصل السائل ببطء إلى نهاية خط الأنابيب.
- تأمين حقنة لمضخة حقنة. قم بتشغيل مضخة المحقنة وتأكد من ضبطها على التروية الأمامية.
- قم ببرمجة المضخة للقطر المناسب للمحقنة لضمان دقة معدلات التدفق. راجع دليل المضخة للحصول على تفاصيل حول أقطار الحقن.
ملاحظة: لمنع الخلايا من الاستقرار في المحقنة ، قم بتثبيت مضخة المحقنة على حامل مشبك بحيث يمكن أن تعمل في وضع رأسي مع توجيه طرف المحقنة لأسفل. - اضبط معدل تدفق مضخة المحقنة ، ~ 10-20 ميكرولتر / دقيقة ، واترك المضخة تعمل حتى يصل السائل إلى نهاية خط الأنابيب. تأمين الأنابيب إلى جهاز الموائع الدقيقة.
- قم بخفض معدل تدفق مضخة الحقنة ، ~ 5-10 ميكرولتر / دقيقة ، واترك المضخة تعمل حتى يتم طرد كل الهواء من جهاز الموائع الدقيقة وتعبر الخلايا إلى مخرج الجهاز.
- قم بإزالة الخلايا من المخرج عن طريق شفط الماصة. أعد ملء خزان المخرج بوسائط الاسترداد (مثل الخطوة 8.1.2 بدون المضادات الحيوية) ، ~ 40-50 ميكرولتر.
- رسم خرائط نفاذية غشاء خلية التثقيب الكهربائي أحادي الخلية
ملاحظة: راجع الشكل 4 والشكل 5 للحصول على فهم أفضل للبيانات الكهربائية التي تشير إلى نفاذية غشاء الخلية ورسم خرائط نفاذية غشاء الخلية ، على التوالي.- اضبط معدل تدفق مضخة الحقنة على ~ 0.1-0.3 ميكرولتر / دقيقة لضمان تدفق الخلايا المفردة عبر مجموعة القطب. يجب أن يكون وقت عبور الخلية بين الأقطاب الكهربائية ~ 250 مللي ثانية.
- ابدأ تشغيل برنامج الكمبيوتر بالنقر فوق تشغيل. تأكد من أن النظام يقوم بحفظ البيانات الكهربائية.
- تأكد من أن النظام يكتشف الخلايا بشكل موثوق لتشغيل تطبيقات النبض التي يتحكم فيها الكمبيوتر. اضبط عتبة الكشف وفقا لذلك.
- اضبط معلمات النبض للنبضة الأولية الأقل للطاقة الكهربائية. راجع الجدول 1 لمعرفة معلمات نبض التثقيب الكهربائي في هذه الدراسة.
- قم بتشغيل قناة الإخراج لمولد نبض التثقيب الكهربائي (الخطوة 9.2.3.).
- اتبع عددا محددا مسبقا من تطبيقات الكشف عن الخلايا / النبض (ن = 100). في نهاية كل حالة تم اختبارها ، قم بشفط الخلايا من منفذ الجهاز الصغير وقم بتجديد المخرج بوسائط الاسترداد.
- كرر إلى حالة نبض التثقيب الكهربائي التالية. كرر حتى يتم اختبار جميع حالات نبض التثقيب الكهربائي.
- تحديد درجة نفاذية غشاء الخلية لكل تطبيق نبض تم اختباره. (يرد وصف للتحقق بعد العملية في القسم الفرعي 11.1). قم بإنشاء خريطة نفاذية غشاء الخلية (الشكل 5).
- تحديد معلمات نبض التثقيب الكهربائي للحصول على ردود فعل عالية الإنتاجية وقائمة على السكان.
- قم بإيقاف تشغيل مضخة المحقنة ، وإزالة الخلايا من خزان المخرج ، وتجديد المخرج بوسائط الاسترداد.
- التثقيب الكهربائي الذي يتم التحكم فيه استنادا إلى التغذية المرتدة - الإنتاجية العالية
ملاحظة: ارجع إلى الشكل 6 للحصول على رسم تخطيطي يوضح عملية التغذية الراجعة المستندة إلى السكان.- اضبط معدل تدفق مضخة المحقنة على ~ 1-3 ميكرولتر / دقيقة لضمان تدفق الخلايا المفردة عبر مجموعة القطب. يجب أن يكون وقت عبور الخلية بين الأقطاب الكهربائية ~ 25 مللي ثانية.
- اضبط سعة النبضة على الحالة "المحسنة" (10.2.9) ، وقم بإيقاف تشغيل وضع التشغيل ، واضبط عرض النبضة لتتناسب مع وقت عبور الخلية.
- اضبط دورة العمل بحيث يتطابق وقت تشغيل النبض مع الحالة "المحسنة". راجع الجدول 1.
- اضبط مولد وظيفة قناة الإخراج على ON ، وقم بتشغيل مضخة المحقنة ، واترك النظام يعمل حتى يتم شحن العدد المطلوب من الخلايا بالكهرباء.
- عند الانتهاء ، قم بإيقاف تشغيل كل من مضخة المحقنة ومولد الوظائف.
- انقل الخلايا من خزان المخرج إلى دورق / صفيحة زراعة الخلايا ذات الحجم المناسب المملوءة بوسائط الاسترداد الدافئة مسبقا ونقل دورق / صفيحة الثقافة إلى الحاضنة.
11. التحليل
- كشف نفاذية الغشاء على مستوى الخلية الواحدة
ملاحظة: لضمان استخدام النبضة "المثلى" أثناء وحدة الإنتاجية العالية ، يجب إجراء تحليل ما بعد التجربة للتحقق من البيانات الكهربائية المصدرة من القسم الفرعي 10.2. يرجى الرجوع إلى الشكل 4 للحصول على تمثيل رسومي لممثل الإشارة الكهربائية لنفاذية الغشاء بسبب التثقيب الكهربائي.- قم بتحميل البيانات في برنامج تحليل (MATLAB ، Python ، إلخ). قم بإنشاء مخطط للتيار مقابل الوقت لكل حالة نابضة.
- حدد يدويا درجة نفاذية غشاء الخلية (Δ IP / ΔIC). ارجع إلى الشكل 4. قم بإنشاء خريطة نفاذية غشاء الخلية (Δ IP / ΔIC مقابل الطاقة الكهربائية ، الشكل 5) على جميع ظروف النبض المختبرة. تحقق من حالة النبض "المثلى".
- كفاءة النقل الكهربائي (eTE)
- بعد فترة الحضانة 24 ساعة ، قم بإزالة الخلايا الكهربائية من الحاضنة.
- أداء وصمة عار الخلية الحية. تمييع DRAQ5 1: 1000 إلى تركيز نهائي قدره 5 ميكرومتر في وعاء زراعة الخلية. اخلطي الخلايا / محلول التلوين برفق واحتضنيها عند 37 درجة مئوية لمدة 5-30 دقيقة.
ملاحظة: يمكن تنفيذ بقعة مختلفة في هذه الخطوة. تأكد من أن خصائص الفلورسنت لا تتداخل مع علامة الفلورسنت التي تشير إلى نجاح النقل الكهربائي (على سبيل المثال ، GFP في الطول الموجي الأخضر و DRAQ5 هو الأحمر البعيد). - قم بتشغيل مجهر فوق فلوري ومصباح وكاميرات (انظر جدول المواد).
- قم بإزالة الخلايا من الحاضنة وجعلها تركز على المجهر.
- التقط صورة تباين الطور (حقل ساطع) للحقل المحدد.
- التقط صورا فوق فلورية لنفس المجال باستخدام مرشحات FITC (GFP) و Far-Red (DRAQ5). تحليل مجموعات الصور يدويا أو عبر خوارزمية.
ملاحظة: راجع الشكل 7 للحصول على صور تمثيلية. - احسب العدد الإجمالي للخلايا الموجبة ل GFP في جميع الصور. احسب العدد الإجمالي للخلايا الملطخة DRAQ5 في جميع الصور. احسب eTE (نسبة الخلايا الموجبة GFP إلى الخلايا الملطخة DRAQ5).
النتائج
يسلط الشكل 4 الضوء على مبادئ التشغيل وراء اكتشاف نفاذية الغشاء على مستوى الخلية الواحدة لسعة نبضة واحدة. بعد بدء تجربة التثقيب الكهربائي ، تحدد خوارزمية الكشف عن الخلايا عتبة مثالية للكشف عن الخلايا عبر طريقة الكشف القائمة على المنحدر نقطة تلو الأخرى. ثم يراقب النظام باست?...
Discussion
تركز المنهجية المقدمة في هذا البروتوكول بشكل أساسي على التصنيع الدقيق لجهاز الموائع الدقيقة الذي يتم دمجه بعد ذلك في إعداد تجريبي متخصص للتثقيب الكهربائي. يشير مصطلح "الوصفة" ، الذي يستخدم غالبا عند وصف تفاصيل عملية التصنيع الدقيق ، إلى أهمية اتباع / تحسين كل خطوة لتصنيع جهاز فعال بنجاح. و?...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يود المؤلفون الاعتراف بالدعم المالي المقدم من المؤسسة الوطنية للعلوم (NSF CBET 0967598 ، DBI IDBR 1353918) وتدريب الخريجين التابع لوزارة التعليم الأمريكية في المجالات الناشئة للطب الدقيق والشخصي (P200A150131) لتمويل طالب الدراسات العليا JJS على الزمالة.
Materials
| Name | Company | Catalog Number | Comments |
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O'Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications - An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods - An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 - Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive - alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved