É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A Fabricação e Operação de um Sistema de Micro-Eletroporação de Fluxo Contínuo com Detecção de Permeabilização
Neste Artigo
Resumo
Este protocolo descreve as técnicas de microfabricação necessárias para construir um dispositivo de eletroporação microfluídica de laboratório em um chip. A configuração experimental realiza transfecções controladas em nível de célula única em um fluxo contínuo e pode ser estendida a rendimentos mais altos com controle de base populacional. Uma análise é fornecida mostrando a capacidade de monitorar eletricamente o grau de permeabilização da membrana celular em tempo real.
Resumo
As inovações terapêuticas atuais, como a terapia com células CAR-T, são fortemente dependentes da entrega de genes mediados por vírus. Embora eficiente, essa técnica é acompanhada por altos custos de fabricação, o que trouxe um interesse em usar métodos alternativos para a entrega de genes. A eletroporação é uma abordagem eletrofísica e não viral para a entrega intracelular de genes e outros materiais exógenos. Após a aplicação de um campo elétrico, a membrana celular permite temporariamente a entrega molecular na célula. Normalmente, a eletroporação é realizada em macroescala para processar um grande número de células. No entanto, essa abordagem requer um extenso desenvolvimento de protocolo empírico, o que é caro quando se trabalha com tipos de células primárias e difíceis de transfectar. O longo desenvolvimento de protocolos, juntamente com a exigência de grandes tensões para alcançar forças de campo elétrico suficientes para permeabilizar as células, levou ao desenvolvimento de dispositivos de eletroporação em microescala. Esses dispositivos de microeletroporação são fabricados usando técnicas comuns de microfabricação e permitem um maior controle experimental com o potencial de manter altas capacidades de rendimento. Este trabalho baseia-se em uma tecnologia de microfluídico-eletroporação capaz de detectar o nível de permeabilização da membrana celular em um nível de célula única sob fluxo contínuo. No entanto, essa tecnologia foi limitada a 4 células processadas por segundo e, portanto, uma nova abordagem para aumentar a taxa de transferência do sistema é proposta e apresentada aqui. Esta nova técnica, denotada como controle de feedback baseado na população celular, considera a resposta de permeabilização celular a uma variedade de condições de pulsação de eletroporação e determina as condições de pulso de eletroporação mais adequadas para o tipo de célula em teste. Um modo de maior rendimento é então usado, onde esse pulso "ideal" é aplicado à suspensão celular em trânsito. As etapas para fabricar o dispositivo, configurar e executar os experimentos microfluídicos e analisar os resultados são apresentadas em detalhes. Finalmente, esta tecnologia de micro-eletroporação é demonstrada através da entrega de um plasmídeo de DNA codificando para proteína fluorescente verde (GFP) em células HEK293.
Introdução
As inovações terapêuticas atuais na pesquisa biomédica, como a terapia celular CAR-T (Chimeric Antigen Receptor Engineered T cell) e a edição genética usando CRISPR (sequências de DNA palindrômicas curtas agrupadas regularmente interespaçadas)/Cas9, dependem fortemente da capacidade de fornecer material exógeno com sucesso e eficiência no espaço intracelular1. Na terapia CAR-T, o padrão-ouro para realizar a etapa de entrega gênica na fabricação da terapia celular é o uso de vetores virais2. Embora a entrega de genes mediada por vírus seja uma modalidade de entrega eficiente, ela também tem várias desvantagens. Estes incluem custos de fabricação, citotoxicidade, imunogenicidade, potencial de mutagênese/tumorigênese e limitações de tamanho no(s) gene(s) a ser entregue(s)3. Essas limitações levaram à pesquisa e desenvolvimento de tecnologias alternativas de entrega não viral.
A eletroporação, uma alternativa à entrega de genes mediados por vírus, depende da aplicação de uma forma de onda de pulso elétrico ideal para realizar transfecções de DNA, RNA e proteínas das células. Após a aplicação de um campo elétrico externo, a membrana celular é brevemente comprometida, tornando a célula suscetível à entrega intracelular de materiais exógenos de outra forma impermeáveis4. Em comparação com a entrega mediada por vírus, a eletroporação é vantajosa, pois geralmente é segura, fácil de operar e tem baixos custos operacionais. A eletroporação pode fornecer carga molecular pequena e grande e pode ser eficiente na transfecção de células, independentemente da linhagem5. Para alcançar resultados desejáveis após a eletroporação, ou seja, boa viabilidade e boa eficiência de eletrotransfecção, uma variedade de parâmetros experimentais precisa ser co-otimizada. Estes incluem o tipo de célula6, densidade celular, concentração de molécula7, propriedades tampão de eletroporação (por exemplo, composição molecular, condutividade e osmolaridade)8, tamanho/geometria do eletrodo9 e forma de onda de pulso elétrico (forma, polaridade, número de pulsos)10 (consulte a Figura 1 para ilustração). Embora cada um desses parâmetros possa ter um efeito significativo nos resultados de experimentos de eletroporação, a forma de onda de pulso tem sido especialmente estudada em grande detalhe, pois a energia elétrica do(s) pulso(s) aplicado(s) é a raiz do trade-off intrínseco entre a viabilidade celular resultante e a eficiência de eletrotransfecção8.
Normalmente, os experimentos de eletroporação são realizados em macroescala, onde as células são suspensas em 100s de microlitros de tampão entre um conjunto de eletrodos grandes de placa paralela dentro de uma cubeta de eletroporação. Os eletrodos são comumente fabricados em alumínio com uma distância de eletrodo de 1-4 mm. Uma vez que as células são carregadas manualmente via pipeta, a cubeta é eletricamente conectada a um gerador de pulso elétrico volumoso, onde o usuário pode definir e aplicar os parâmetros de forma de onda de pulso para eletroporar a suspensão celular. Embora a macroescala ou a eletroporação a granel possam processar densidades celulares >106 células/mL, esse recurso pode ser um desperdício ao otimizar as configurações de forma de onda de pulso elétrico. Isso é particularmente preocupante ao eletroporar tipos de células primárias, onde o número de populações celulares pode ser limitado. Além disso, devido à grande distância entre os eletrodos, o gerador de pulso deve ser capaz de fornecer grandes tensões para alcançar intensidades de campo elétrico >1kV/cm11. Essas altas tensões causam dissipação de energia resistiva através do tampão eletrolítico, resultando em aquecimento de Joule, o que pode ser prejudicial à viabilidade celular resultante12. Por fim, a realização de eletroporação em uma densa suspensão de células será consistentemente sobrecarregada com uma variabilidade inata na eficiência de eletrotransfecção resultante e na viabilidade celular. Cada célula em suspensão poderia experimentar uma força de campo elétrico diferente devido às células circundantes. Dependendo se a intensidade do campo elétrico experimentado é aumentada ou diminuída, a viabilidade celular resultante ou a eficiência de eletrotransfecção podem ser impactadas negativamente11. Essas desvantagens da eletroporação em macroescala levaram à busca e ao desenvolvimento de tecnologias alternativas que operam em microescala e permitem um melhor controle no nível de célula única.
O campo do BioMEMS, ou sistemas micro-eletromecânicos biomédicos, decorre dos avanços tecnológicos feitos na indústria de microeletrônica. Especificamente, utilizando processos de microfabricação para desenvolver micro-dispositivos para o avanço da pesquisa biomédica. Esses avanços incluem o desenvolvimento de matrizes de microeletrodos para monitoramento elétrico in vivo13, microeletrodos capacitivos para eletroporação in situ 14, dispositivos miniaturizados de órgão em um chip 15, diagnósticos microfluídicos no ponto de atendimento 16, biossensores 17 e sistemas de liberação de medicamentos 18, incluindo dispositivos de nano e microeletroporação 19,20,21 . Devido à capacidade de projetar e fabricar dispositivos na mesma escala de tamanho que as células biológicas, as tecnologias de nano e microeletroporação são vantajosas quando comparadas à sua contraparte em macroescala22,23. Esses dispositivos de eletroporação eliminam a necessidade de aplicações de pulso de alta tensão, pois os conjuntos de eletrodos com espaçamentos de 10s a 100s de micrômetros são tipicamente integrados. Esta característica reduz drasticamente a corrente através do eletrólito, o que, por sua vez, reduz o acúmulo de produtos de eletrólise tóxicos e os efeitos do aquecimento Joule nesses sistemas. Os canais de microescala também garantem que um campo elétrico muito mais uniforme seja aplicado de forma confiável às células durante a aplicação do pulso, resultando em resultados mais consistentes24. Além disso, também é comum que os dispositivos de microeletroporação sejam integrados em uma plataforma microfluídica que se presta para integração futura em uma tecnologia totalmente automatizada, uma capacidade altamente desejável na fabricação de terapia celular25. Por fim, a eletroporação em microescala permite a interrogação elétrica de eventos de eletroporação. Por exemplo, o grau de permeabilização da membrana celular pode ser monitorado em tempo real em um único nível celular26,27. O objetivo deste método é descrever a microfabricação, a operação do sistema e a análise de um dispositivo microfluídico de microeletroporação de célula única, capaz de medir o grau de permeabilização da membrana celular para otimizar os protocolos de eletroporação, mas aumentando a produtividade em relação ao estado da arte anterior.
A realização de eletroporação em nível de célula única não é mais uma técnica nova, como foi demonstrado pela primeira vez por Rubinsky et al. em 2001 com o desenvolvimento de uma tecnologia de eletroporação de células estáticas28. Seu micro-dispositivo foi inovador, pois eles foram os primeiros a demonstrar a capacidade de monitorar eletricamente o evento de eletroporação. Isso levou ainda ao desenvolvimento de tecnologias estáticas de eletroporação de célula única, capazes de detectar eletricamente o grau de permeabilização da membrana celular de maneira paralelizada para aumentar os rendimentos dos dispositivos. No entanto, mesmo com paralelização e processamento em lote, esses dispositivos carecem severamente do número total de células que podem processar por unidade de tempo29,30. Essa limitação levou ao desenvolvimento de dispositivos de fluxo capazes de realizar microeletroporação em nível de célula única com rendimentos muito maiores31. Essa transição do dispositivo, do ambiente estático para o ambiente de fluxo, limita a capacidade de monitorar eletricamente o grau de permeabilização da membrana celular após a aplicação do pulso de eletroporação. O método descrito neste trabalho preenche a lacuna entre essas duas tecnologias, uma tecnologia de microeletroporação capaz de detectar eletricamente, pulsar e monitorar o grau de permeabilização da membrana celular de células individuais, de fluxo contínuo e seriado.
Esta tecnologia foi recentemente descrita em Zheng et al. Nesse trabalho, as capacidades dessa tecnologia foram introduzidas com a conclusão de um estudo paramétrico, onde tanto a amplitude quanto a duração do pulso de eletroporação foram variadas, e o sinal elétrico subsequente, indicativo de permeabilização da membrana celular, foi explorado32. Os resultados mostraram que um aumento na intensidade do pulso de eletroporação (ou seja, aumento no campo elétrico aplicado ou aumento na duração do pulso) causou um aumento na permeabilização da membrana celular medida. Para validar ainda mais o sistema, um indicador fluorescente comum de eletroporação bem-sucedida, iodeto de propídio33, foi adicionado à suspensão celular, e uma imagem de fluorescência foi capturada imediatamente após a aplicação do pulso elétrico. O sinal óptico, ou seja, a intensidade de fluorescência do iodeto de propídio no interior da célula, correlacionou-se fortemente com a medida elétrica do grau de permeabilização da membrana celular, verificando-se a confiabilidade dessa medida elétrica. No entanto, este trabalho considerou apenas a entrega da pequena molécula de iodeto de propídio, que tem pouco ou nenhum significado traduzível.
Neste trabalho, uma nova aplicação desta tecnologia é introduzida para melhorar o rendimento do sistema, ao mesmo tempo em que fornece um vetor de DNA plasmidial biologicamente ativo (pDNA) e avalia a eficiência de eletrotransfecção de células rechapeadas e cultivadas após a eletroporação. Embora o trabalho anterior supere as tecnologias de micro-eletroporação existentes que são capazes de medir eletricamente o evento de eletroporação, o estado atual do dispositivo ainda requer longos tempos de trânsito celular entre o conjunto de eletrodos (~ 250 ms) para realizar a detecção de células, a aplicação de pulso e a medição de permeabilização da membrana celular. Com um único canal, isso limita a taxa de transferência a 4 células/s. Para combater essa limitação, um novo conceito de eletroporação controlada por feedback baseado na população celular é introduzido para realizar a eletrotransfecção de pDNA. Usando um tampão de eletroporação de condutividade hipofisiológica, este sistema permite a interrogação elétrica de células individuais através de uma infinidade de aplicações de pulso de eletroporação. Com base na resposta elétrica, um pulso de eletroporação "ideal" é então determinado. Um modo de "alto rendimento" é então implementado onde a determinação da permeabilização da membrana celular é anulada, a taxa de fluxo é aumentada e o ciclo de trabalho do pulso de eletroporação é combinado com o tempo de trânsito da célula para garantir um pulso por célula em trânsito entre os eletrodos. Este trabalho fornecerá detalhes extensivos sobre as etapas de microfabricação para a fabricação do microdispositivo, o material / equipamento e sua configuração necessária para realizar a experimentação e a operação / análise do dispositivo e sua eficiência de eletrotransfecção (eTE).
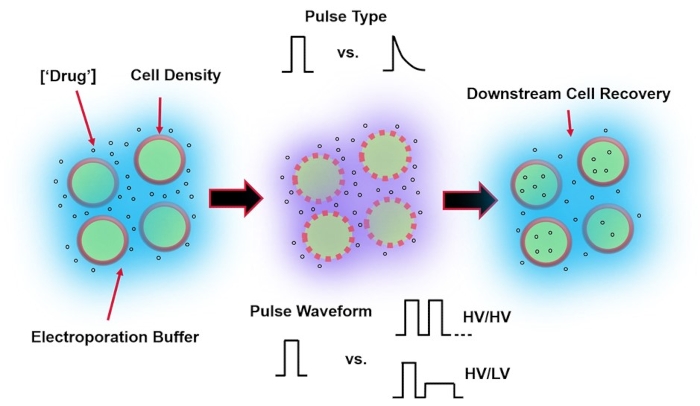
Figura 1: Fatores experimentais que afetam os resultados da eletroporação. (Esquerda) Suspensão Celular - Fatores importantes a serem considerados antes do início da eletroporação incluem: Carga útil (neste caso, pDNA), concentração, densidade celular e propriedades do tampão de eletroporação. As propriedades do tampão de eletroporação a serem consideradas são a condutividade, a osmolaridade e a composição molecular exata que contribui para esses valores. (Meio) Aplicação de pulso – O tipo exato de pulso (onda quadrada vs. decaimento exponencial) e a forma de onda de pulso (pulso único vs. trem de pulso) devem ser otimizados para maximizar a viabilidade celular resultante e a eficiência de eletrotransfecção. Trens de pulso comuns implementados em processos de eletroporação são tipicamente compostos de uma série de pulsos de Alta Tensão (HV) ou séries de pulsos que giram entre as magnitudes de pulso HV e Baixa Tensão (LV). (Direita) Recuperação de células - As etapas de processamento a jusante, em particular, o meio de cultura de células de recuperação para o qual as células são transferidas, devem ser otimizadas. Não apresentado (Extrema Esquerda), etapas adicionais de processamento de células upstream podem ser implementadas para otimização geral do processo de eletroporação. Por favor, clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
NOTA: Os usuários devem revisar todas as MSDS para os materiais e suprimentos usados neste protocolo. Devem ser utilizados EPI adequados em cada etapa e técnica estéril utilizada durante a experimentação. As seções 1-7 discutem a fabricação do dispositivo.
1. Fabricação do dispositivo - Design da máscara
NOTA: Consulte a Figura 2 para obter uma ilustração do processo de microfabricação. As etapas de microfabricação devem ser realizadas em um ambiente de sala limpa. São necessários EPI adicionais (rede de cabelo, rede de pelos faciais, máscara, roupa limpa, capas de sapatos).
- Instale um software CAD de sua escolha, projete uma "máscara" 2-Dimensional do canal microfluídico e dos eletrodos e salve o projeto no formato de arquivo desejado (ou seja, .dxf, .dwg).
NOTA: Consulte a Figura 1 Suplementar para obter um exemplo de um esquema de máscara de 2 dimensões. - Envie para um fornecedor de escolha para ser impresso. Certifique-se de que as dimensões dos projetos estejam dentro dos recursos de resolução do fornecedor.
2. Fabricação de dispositivos - Fotolitografia
NOTA: As receitas de microfabricação fornecidas são adotadas a partir das recomendações do fabricante dos fotorresistentes e devem ser usadas apenas como ponto de partida34. Os valores exatos para tempos de cozimento, tempos de exposição, etc., precisam ser otimizados para cada protocolo de fabricação. Recomenda-se o uso de pinças de wafer para manusear bolachas de silício e lâminas de vidro.
- Fabricação de canais microfluídicos
- Limpeza de lâminas de vidro de bolacha de silício e soda-cal: Siga as etapas 2.1.2-2.1.3 para realizar a limpeza de lâminas de vidro de soda-cal de 1" e × de 3" (ambas referidas como "substrato").
- Submergir os substratos em um banho de acetona, um banho de isopropanol (IPA) e um banho de água deionizado por 10 min cada. Realize esta lavagem em série de 3 etapas à temperatura ambiente.
- Remova e seque a superfície usando um nitrogênio pressurizado ou uma fonte de gás de ar filtrado. Colocar os substratos num forno a 150 °C durante um período mínimo de 30 minutos para permitir a evaporação da humidade restante.
- Fotolitografia SU-8 em wafer de silício: Realizar fotolitografia na bolacha de silício seguindo as etapas 2.1.5-2.1.14.
NOTA: Para atingir uma altura de canal microfluídico de 20 μm, foi utilizado fotorresistente negativo da série SU-8 2000. As taxas exatas de rotação variam dependendo da formulação do SU-8 (ou seja, 2010, 2015, etc.); no entanto, as seguintes condições são para a formulação SU-8 201035. - Retire a bolacha de silício do forno a 150 °C e deixe-a arrefecer até à temperatura ambiente (RT).
- Prenda a bolacha ao mandril do revestidor de fiação de wafer usando o sistema de vácuo do revestidor de fiação. Programe o spinner. Passo 1 - 500 rpm por 10 s a uma aceleração de 100 rpm/s, Passo 2 - 1000 rpm por 30 s a uma aceleração de 300 rpm/s.
- Dispense 4 mL de fotorresistência SU-8 2010 no centro da bolacha de silício. Execute o programa. Quando o sistema parar, desligue o vácuo.
- Usando uma pinça, transfira a bolacha de silício revestida SU-8 em uma placa quente a 95 °C por 4-5 min para assar macio. Em seguida, retire a bolacha da placa quente e deixe-a esfriar para RT.
NOTA: Siga o procedimento de arranque adequado para o alinhador de máscara fotolitográfica específico do laboratório. - Prenda a fotomáscara com os desenhos de canais microfluídicos 2D no suporte da máscara. Insira a bolacha de silício, com o revestimento SU-8 voltado para cima, no mandril da bolacha.
- Defina as configurações de exposição para 150 mJ/cm2 e execute a máquina.
CUIDADO: Não olhe diretamente para a fonte de luz UV para evitar possíveis danos oculares. - Coloque a bolacha de silício revestida com SU-8 em uma placa quente a 95 °C por 4-5 min para assar após a exposição.
- Submerja a bolacha de silício na solução de desenvolvedor SU-8 (consulte Tabela de materiais) por 3-4 min. Aplique agitação suave. Retire a bolacha da solução e lave a superfície com IPA.
- Seque a superfície usando um nitrogênio pressurizado ou uma fonte de gás de ar filtrado. Inspecione as características sob um microscópio usando um filtro UV e certifique-se de que não haja defeitos óbvios nos canais microfluídicos.
- Coloque a bolacha de silício num forno a 150 °C durante um período mínimo de 30 minutos para um cozimento duro.
- Deixe esfriar até RT e use a perfilometria da caneta para medir a altura e a inclinação exatas das paredes laterais do canal.
- Fotolitografia em Lâminas de Vidro
NOTA: O hexametildisilazano (HMDS) é utilizado como promotor de adesão para o fotorresistente positivo S181836.- Retire a lâmina de vidro do forno a 150 °C e deixe-a arrefecer até RT.
- Prenda a lâmina de vidro ao mandril do spinner usando vácuo e programe o spinner. Passo 1 - 500 rpm por 10 s a uma aceleração de 100 rpm/s. Passo 2 - 3000 rpm para 30 sentou-se uma aceleração de 300 rpm/s.
- Dispense 3-4 gotículas de HMDS em toda a superfície da lâmina de vidro. Execute o programa.
NOTA: Para obter um revestimento de superfície de ~ 3 μm, a série de fotorresistentes positivos S1800 deve ser usada. As taxas exatas de rotação variam dependendo da formulação; as recomendações abaixo são para a formulação S181834. - Dispense 1 mL de fotorresistência na superfície da lâmina de vidro. Certifique-se o suficiente para cobrir a área de superfície.
- Execute o programa. Quando o sistema parar, desligue o vácuo e remova a lâmina de vidro.
- Coloque a lâmina de vidro revestida S1818 sobre uma placa quente a 120 °C durante 4 minutos para um cozimento macio. Remova e permita que venha para RT.
- Prenda a fotomáscara com os desenhos de eletrodo 2D no suporte da máscara.
- Insira e alinhe a lâmina de vidro, com o revestimento S1818 voltado para cima, no mandril da bolacha. Defina as configurações de exposição para 250 mJ/cm2 e execute a máquina.
NOTA: Diferentes modelos de alinhadores de contato podem ser mais ou menos adequados a substratos não circulares e de espessura variável. - Submerja a lâmina de vidro na solução de desenvolvedor MF-319 por 2 min. Aplique agitação suave. Lave a superfície da lâmina de vidro com água desionizada.
- Seque a superfície usando um nitrogênio pressurizado ou uma fonte de gás de ar filtrado e observe as características sob um microscópio usando um filtro UV. Certifique-se de que não há defeitos óbvios nos padrões litográficos.
- Coloque o vidro deslize para o forno a 150 °C, garantindo que a superfície do substrato de interesse esteja voltada para cima, por um período mínimo de 30 minutos para um cozimento duro. Retire do forno e mantenha protegido da luz.
3. Fabricação do dispositivo: Ácido fluorídrico (HF) etch
CUIDADO: Esta etapa envolve o manuseio e descarte de ácido fluorídrico (HF), que pode causar queimaduras químicas profundas e dolorosas. EPIs adicionais devem ser usados para proteger o manipulador (protetor facial, luvas quimicamente resistentes na altura do cotovelo, avental quimicamente resistente com mangas). O neutralizador de ácido gluconato de cálcio e o gel de pele devem ser mantidos nas proximidades da bancada de laboratório. Esta etapa não deve ser executada sozinha. HF nunca deve ser armazenado ou dispensado em recipientes de vidro, pois o recipiente será gravado pelo ácido.
NOTA: O HF ajusta uniformemente o vidro exposto (ou seja, o design do eletrodo) para formar um recesso no vidro, permitindo uma melhor resolução da borda do padrão do eletrodo após a deposição do metal (seção 4).
- Submerja a lâmina de vidro em solução de HF tamponada 10:1 por 1 min em um recipiente de politetrafluoroetileno. Transfira e lave as lâminas de vidro em água deionizada. Repita a etapa de lavagem 3 vezes.
- Seque a superfície usando um nitrogênio pressurizado ou uma fonte de gás de ar filtrado. Coloque os substratos de vidro em um forno de 65 °C durante a noite para remover qualquer umidade restante. Cubra os substratos da luz.
4. Fabricação do dispositivo: Deposição física de vapor
NOTA: Esta etapa envolve a deposição de metal nos substratos de lâmina de vidro para definir os padrões do eletrodo. Os eletrodos de metal comumente usados são cromo / ouro e titânio / platina. O ouro e a platina não aderem ao substrato de vidro, de modo que uma camada de adesão de sementes de cromo ou titânio, respectivamente, é necessária para promover a adesão37.
- Siga o protocolo específico da sala limpa para operar o sistema PVD interno. Este trabalho utiliza um sistema de pulverização CC e um sputter com gás argônio de 100 SCCM a uma pressão de ~8 mTorr e 200 W de potência.
- Sputter titânio por 8 min a uma taxa de ~ 100 Å / min. Sputter platina por 10 min a uma taxa de ~200 Å/min. Remova os substratos da câmara PVD.
5. Fabricação do dispositivo: Photoresist lift-off
NOTA: Esta etapa envolve a dissolução da camada fotorresistente em um banho de acetona, deixando os eletrodos de platina aderidos padronizados nas lâminas de vidro.
- Submerja as lâminas de vidro revestidas de metal em um banho de acetona por ~ 10 min.
- Sonicate o banho para introduzir agitação para quebrar o filme de metal não aderido. Use um lenço embebido em acetona para remover quaisquer resíduos, se necessário.
- Uma vez que todos os fotorresistentes/metais sejam removidos, lave os padrões dos eletrodos com água deionizada e coloque-os em um forno de 65 °C durante a noite para remover qualquer umidade superficial restante.
- Use a perfilometria da caneta para medir o perfil dos eletrodos padronizados.
6. Fabricação do dispositivo: Litografia macia
NOTA: Esta etapa envolve a moldagem da réplica do canal microfluídico na estrutura de relevo mestre SU-8 usando um elastômero, polidimetilsiloxano (PDMS).
- Silanização de bolachas de silício
NOTA: Esta é uma etapa opcional; no entanto, aumentará a vida útil da estrutura de relevo SU-8 que foi fabricada na subseção 2.1. Esta etapa deve ser realizada em um exaustor químico.- Prenda a bolacha no fundo de uma placa de Petri e coloque a placa de Petri em um dessecador.
- Circundar o perímetro da bolacha de silício com aproximadamente 50 μL de tricloro (1H,1H,2H,2H-perfluorooctil) de silano. Conecte o vácuo (bomba de vácuo ou linha de vácuo da casa) e funcione por 20 minutos.
- Moldagem de réplicas PDMS
- Em um recipiente descartável (por exemplo, barco de pesagem, copo de plástico), misture a base do elastômero PDMS ao endurecedor em uma proporção de peso de 10:1 em cima de uma balança eletrônica. Despeje a solução PDMS sobre a bolacha de silício e coloque a mistura sob vácuo para remover todas as bolhas de ar.
- Cura a 65 °C durante um período mínimo de 4 h permitindo que o PDMS se solidifique. Usando a ponta de uma lâmina de barbear, corte o PDMS moldado e descasque da bolacha de silício.
- Usando um soco de biópsia afiado, remova o PDMS da entrada / saídas do dispositivo. Para este dispositivo, foram utilizados perfuradores de biópsia de 0,75 mm e 3 mm para as entradas e saídas, respectivamente.
NOTA: O punção de biópsia usado deve ter um diâmetro ligeiramente menor do que o diâmetro externo da tubulação de interconexão para garantir uma vedação apertada da tubulação nos reservatórios.
- Limpeza de sonicação de PDMS
- Submerja os dispositivos PDMS no IPA e coloque-os em um sonicator por 30-45 min para remover quaisquer detritos PDMS da entrada / saídas. O PDMS pode inchar na solução IPA.
- Enxaguar com água desionizada e colocar num forno a 65 °C durante a noite para permitir que o PDMS volte a inchar para o tamanho normal.
NOTA: Qualquer sobra de detritos pode entupir o dispositivo durante a experimentação. Grandes pedaços de detritos podem ser removidos da superfície do PDMS usando um pedaço de fita adesiva antes da sonicação.
7. Fabricação do dispositivo: Colagem do PDMS/acessório do fio
NOTA: Esta etapa envolve o tratamento da superfície do PDMS e do substrato de vidro com um plasma de oxigênio para formar uma ligação irreversível entre o PDMS e o vidro38. A receita fornecida pode precisar ser adaptada ao sistema exato usado no laboratório.
- Corte os dispositivos para dimensionar e certifique-se de que a superfície do dispositivo PDMS esteja limpa. Se não for limpo novamente, siga as etapas na subseção 6.3.
- Programe o gerador de plasma. Ajuste a potência para 70 W, o tempo para 35 s, a pressão para 325 mTorr, a taxa de fluxo de gás oxigênio para 60 SCCM. Coloque o PDMS e o deslizamento de vidro do eletrodo no sistema com os recursos voltados para cima e execute o programa.
- Remova os dispositivos e alinhe rapidamente os recursos do canal aos eletrodos usando um estereoscópio. Aplique firmemente pressão do centro do PDMS em direção aos lados para remover quaisquer bolhas de ar indesejadas na interface de ligação.
- Colocar num local quente a 95 °C durante, pelo menos, 2 minutos para finalizar o procedimento de colagem e deixar arrefecer o dispositivo a RT.
- Corte 2 pedaços de fio sólido 22-G em comprimentos de ~6" e retire o isolante de ambas as extremidades.
- Cole os fios às almofadas do eletrodo usando epóxi condutor de prata. Coloque os dispositivos acabados num forno a 65 °C durante a noite.
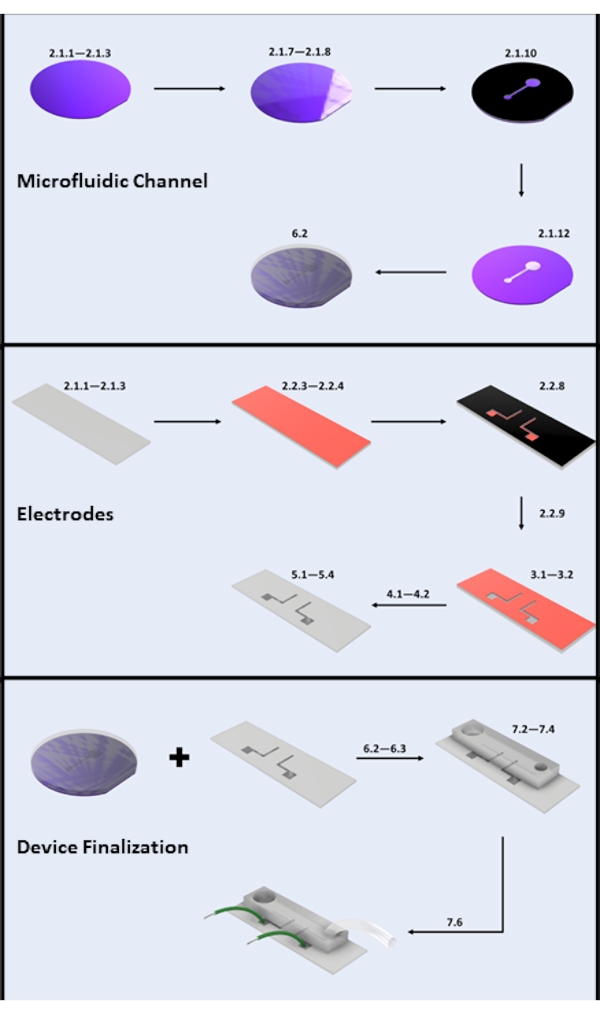
Figura 2: Fabricação de microdispositivos. (A) Etapas chave de fabricação de canais microfluídicos: limpeza de bolachas de silício (etapas 2.1.1-2.1.3), revestimento fotorresistente e cozimento macio (etapas 2.1.7-2.1.8), exposição UV (etapa 2.1.10), desenvolvimento (etapa 2.1.12) e derramamento PDMS (subseção 6.2). (B) Etapas chave de fabricação de eletrodos: limpeza de lâminas de vidro (etapas 2.1.1-2.1.3), revestimento HMDS e revestimento fotorresistente (etapas 2.2.3-2.2.4), exposição UV (etapa 2.2.8), desenvolvimento (etapa 2.2.9), HF etch (seção 3), deposição física de vapor (seção 4) e decolagem fotorresistente (seção 5). (C) Etapas chave de finalização do dispositivo: Acesso de entrada/saída e sonicação (etapa 6.2.3 e seção 6.3), colagem PDMS e fixação de fio (seção 7). Por favor, clique aqui para ver uma versão maior desta figura.
8. Cultura e colheita de células
NOTA: A cultura celular padrão e os procedimentos de manuseio estéril devem ser utilizados. Siga o protocolo específico do tipo de célula para cultura de células.
- Cultura celular
- Passagem celular: Cultura e passagem das células seguindo os passos 8.1.2-8.1.5.
- Cultivar células HEK293 em solução DMEM completa (88% DMEM, 10% de soro fetal bovino inativado pelo calor, 1% de L-glutamina, 1% de penicilina-estreptomicina) em um frasco de T25 em uma incubadora a 37 °C, 95% de O2, 5% de CO2. Células de passagem dentro do cronograma quando atingir ~80% de confluência.
- Aspirar o meio utilizando uma pipeta ou um sistema de vácuo e incubar as células em EDTA de tripsina a 0,25% (balão de 2 mL-T25) por 2 min a 37 °C. Neutralizar a tripsina com o dobro do volume de meios de cultura.
- Transfira a suspensão celular para um tubo cônico de 15 mL e centrífuga de células HEK293 a 770 x g por 2 min. Aspirar o sobrenadante usando uma pipeta ou um sistema de vácuo
- Ressussuscite as células HEK293 em 1 mL de DMEM pré-aquecido.
- Revestimento celular: Chapear as células seguindo as etapas 8.1.7-8.1.8
- Colocar as células em chapa numa diluição de 10:1 a 20:1 num balão de T25 (5 ml de DMEM) para continuar a cultura.
- Chapear as células em uma diluição de 5:1 a 20:1 em uma placa de 6 poços (2 mL de DMEM por poço) para ser colhida para experimentos de eletroporação.
NOTA: Células HEK293 chapeadas 24 h antes das experiências de electroporação para atingir uma confluência de ~70% na colheita celular (subsecção 8.3). Um cronograma de colheita inconsistente pode levar à variabilidade nos resultados da eletroporação.
- Tampão de eletroporação
- Preparar tampão de eletroporação
NOTA: Consulte Sherba et al. para obter detalhes sobre a preparação do tampão de eletroporação8. A composição do tampão foi de 285 mM de sacarose, 0,7 mM de MgCl2, 1 mM de KCl, 10 mM de HEPES, 3 mM de NaOH (pH: 7,4; osmolalidade: 310 mOsm, condutividade: 500 μS/cm). O tampão de eletroporação deve ser formulado de forma estéril e armazenado a 4 °C durante um prazo de validade de ~1 mês. A formulação do tampão de eletroporação deve ser otimizada por tipo de célula.
- Preparar tampão de eletroporação
- Colheita celular e adição de pDNA
- Siga os mesmos passos que a passagem celular (8.1.2-8.1.4).
- Lave as células em PBS estéril 1x, suspensão de células de transferência em um tubo cônico de 15 mL e células centrífugas a 770 x g por 2 min.
- Lave o pellet de célula HEK293 no tampão de eletroporação e centrífuga a 770 x g por 2 min. Ressuspenda as células no tampão de eletroporação em ~5 milhões de células/mL.
NOTA: A densidade da célula deve ser otimizada por tipo de célula. - Adicione a codificação de pDNA para proteína fluorescente verde (GFP) a uma concentração final de 20 μg/mL. Misture suavemente o pDNA/suspensão celular e transfira a suspensão para uma seringa de 1 cc para experimentação.
9. Configuração de hardware/experimental
NOTA: Antes de colher as células para experimentação, certifique-se de que a configuração experimental esteja concluída para minimizar a quantidade de tempo que as células estão suspensas no tampão de eletroporação. Ligue a eletrônica 20-30 min antes dos experimentos para aquecer. Consulte a Figura 3 para obter um esquema da configuração experimental para a operação do módulo de detecção de célula única.
NOTA: Um circuito Op-Amp PA90 personalizado foi desenvolvido para acomodar tanto a sensibilidade necessária para a detecção de nível de célula única usando o amplificador de bloqueio quanto as altas tensões necessárias para aplicar pulsos de eletroporação suficientemente fortes. Consulte a ficha técnica do PA90 para obter especificações sobre os circuitos recomendados39.
- Inicialize o amplificador de bloqueio com as configurações atuais do pré-amplificador e defina através do algoritmo. Consulte Zheng et al. para obter detalhes sobre as configurações de bloqueio32.
- Fontes de alimentação, gerador de funções e amplificador
- Fonte de alimentação 1: Ajuste para -15 V para alimentar a extremidade negativa do circuito.
- Fonte de alimentação 2 (gerador de função): Ajuste para saída de sinal DC e defina a amplitude para 2 V. Conecte-se à entrada do amplificador 50x.
- Programa Gerador de Pulso de Eletroporação para a onda quadrada: Defina a largura de pulso desejada (ciclo de trabalho) e a amplitude de pulso desejada (Volts).
- Defina a saída para o modo de disparo (1 pulso). Conecte a saída à entrada do amplificador de 50x.
NOTA: Lembre-se do ganho de 50x ao programar a amplitude de pulso. Ou seja, para alcançar uma intensidade de campo elétrico de 1 kV/cm, é necessário um total de 30 V, 30 V/300 μm (distância entre eletrodos), portanto, a saída do gerador de função deve ser ajustada para 30/50, ou 600 mV. - Verifique as saídas do amplificador 50x usando um osciloscópio. Saída 1-100 V da fonte de alimentação 2 (9.2.2). Potência de saída 2 variável para o pulso de electração (9.2.4).
- Conecte uma sonda 10x a um canal de osciloscópio e ao microdispositivo completo (dispositivo em teste, DUT) na etapa 7.6, onde o pulso de eletroporação será aplicado. Monitore o sistema durante a experimentação para garantir que os pulsos estejam sendo aplicados.
- Verifique se o USB de bloqueio está conectado e registrado. Verifique novamente todas as configurações de bloqueio no código do algoritmo (o mais importante, a frequência de saída de bloqueio).
- Microscópio/câmera CCD
- Coloque o microdispositivo no palco do microscópio através de um suporte de lâmina. Ligue a câmera CCD e coloque o canal microfluídico em foco. Use um objetivo de 4x ou 10x.
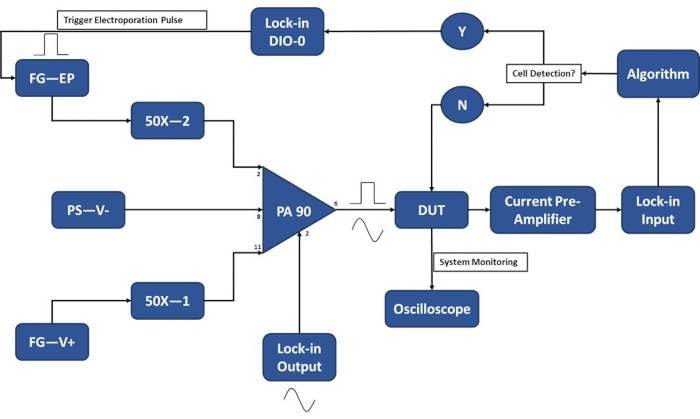
Figura 3: Configuração experimental esquemática - Detecção de célula única. O op-amp de alta potência (PA-90) permite a superposição do pulso de eletroporação de alta tensão no sinal de entrada CA de saída de bloqueio que é necessário para a detecção de célula única. Este sinal de excitação passa através do dispositivo de micro-eletroporação (Device Under Test, DUT), onde a corrente é então amplificada pelo pré-amplificador de corrente e alimentada no algoritmo. O sistema monitora continuamente o evento de detecção de células. Após a entrada da célula, um sinal digital é gerado pelo amplificador de bloqueio para acionar a aplicação do pulso de eletroporação na(s) célula(s) em trânsito. Legenda: PA-90 (amplificador op de alta potência), DUT (dispositivo em teste), DIO (entrada / saída digital), FG-EP (gerador de função / pulso de eletroporação), 50X (amplificador 50X), PS-V- (fonte de alimentação / tensão negativa para PA 90), FG-V + (gerador de função, tensão positiva para PA 90). Por favor, clique aqui para ver uma versão maior desta figura.
10. Operação experimental
- Escorva de canais microfluídicos
- Remova todas as bolhas de ar da seringa carregada com células. Ligue uma agulha de 30 G à seringa carregada com células.
- Usando pinças, deslize a tubulação do dígono pelo comprimento da agulha. Pré-encha o reservatório de saída com meios de recuperação (o mesmo que a etapa 8.1.2 sem os antibióticos), ~ 40-50 μL.
- Usando o polegar, aplique suavemente pressão no êmbolo de tal forma que o fluido atinja lentamente o final da linha de tubulação.
- Prenda a seringa à bomba da seringa. Ligue a bomba da seringa e certifique-se de que está ajustada para a perfusão para a frente.
- Programe a bomba para o diâmetro adequado da seringa para garantir que as taxas de fluxo sejam precisas. Consulte o manual da bomba para obter informações específicas sobre os diâmetros das seringas.
NOTA: Para evitar que as células se instalem na seringa, prenda a bomba da seringa num suporte de braçadeira de modo a que possa funcionar numa posição vertical com a extremidade da seringa virada para baixo. - Defina a taxa de fluxo da bomba da seringa, ~10-20 μL/min, e deixe a bomba funcionar até que o fluido atinja o final da linha de tubulação. Tubo seguro para o dispositivo microfluídico.
- Abaixe a taxa de fluxo da bomba da seringa, ~5-10 μL/min, e permita que a bomba funcione até que todo o ar seja expelido do dispositivo microfluídico e as células estejam atravessando para a saída do dispositivo.
- Remova as células da saída através da aspiração da pipeta. Reabastecer o reservatório de saída com meios de recuperação (o mesmo que a etapa 8.1.2 sem os antibióticos), ~ 40-50 μL.
- Mapeamento da permeabilização da membrana celular de eletroporação de célula única
NOTA: Consulte a Figura 4 e a Figura 5 para uma melhor compreensão dos dados elétricos indicativos de permeabilização da membrana celular e do mapeamento da permeabilização da membrana celular, respectivamente.- Ajuste a taxa de fluxo da bomba da seringa para ~0,1-0,3 μL/min para garantir um fluxo de células únicas através do conjunto de eletrodos. O tempo de trânsito celular entre os eletrodos deve ser de ~250 ms.
- Inicie o programa de computador clicando em Executar. Verifique se o sistema está salvando os dados elétricos.
- Certifique-se de que o sistema está detectando células de forma confiável para acionar os aplicativos de pulso controlados por computador. Ajuste o Limite de Detecção de acordo.
- Defina os parâmetros de pulso para o pulso inicial de eletroporação de menor energia elétrica. Consulte a Tabela 1 para os parâmetros de pulsação de eletroporação neste estudo.
- Ligue o canal de saída para o gerador de pulso de eletroporação (etapa 9.2.3.).
- Siga um número predeterminado de aplicações de detecção de células/pulso (n = 100). No final de cada condição testada, aspirar as células da saída do microdispositivo e reabastecer a saída com meios de recuperação.
- Itere para a próxima condição de pulso de eletroporação. Repita até que todas as condições de pulso de eletroporação sejam testadas.
- Determinar o grau de permeabilização da membrana celular para cada aplicação de pulso testada. (A validação pós-processo é descrita na subsecção 11.1). Gerar o mapa de permeabilização da membrana celular (Figura 5).
- Determine os parâmetros de pulso de eletroporação para feedback de alto rendimento e baseado na população.
- Desligue a bomba da seringa, remova as células do reservatório de saída e reabasteça a tomada com meios de recuperação.
- Eletroporação controlada por feedback de base populacional - alto rendimento
NOTA: Consulte a Figura 6 para obter um esquema que ilustre o processo de feedback baseado na população.- Ajuste a taxa de fluxo da bomba da seringa para ~1-3 μL/min para garantir um fluxo de células únicas através do conjunto de eletrodos. O tempo de trânsito celular entre os eletrodos deve ser de ~25 ms.
- Defina a amplitude de pulso para a condição "otimizada" (10.2.9), desative o modo de gatilho e defina a largura de pulso para corresponder ao tempo de trânsito celular.
- Defina o ciclo de trabalho de tal forma que o pulso ON time corresponda à condição "otimizada". Consulte a Tabela 1.
- Defina o gerador de função do canal de saída como ON, ligue a bomba da seringa e permita que o sistema funcione até que o número desejado de células tenha sido eletroporado.
- Quando terminar, desligue a bomba da seringa e o gerador de funções.
- Transferir as células do reservatório de saída para o balão/placa de cultura celular de dimensões adequadas, preenchido com meios de recuperação pré-aquecidos e transferir o balão/placa de cultura para a incubadora.
11. Análise
- Detecção de permeabilização por membrana de nível unicelular
NOTA: Para garantir que o pulso "ideal" foi usado durante o módulo de alto rendimento, uma análise pós-experimento deve ser realizada para verificar os dados elétricos exportados da subseção 10.2. Consulte a Figura 4 para obter uma representação gráfica do sinal elétrico representativo da permeabilização da membrana devido à eletroporação.- Carregue dados em um software de análise (MATLAB, Python, etc.). Gere um gráfico de Corrente versus Tempo para cada condição pulsante.
- Determinar manualmente o grau de permeabilização da membrana celular (Δ IP/ΔIC). Consulte a Figura 4. Gerar o Mapa de Permeabilização da Membrana Celular (Δ IP / ΔIC versus Energia Elétrica, Figura 5) sobre todas as condições de pulso testadas. Verifique a condição de pulsação "ideal".
- Eficiência de eletro-transfecção (eTE)
- Após o período de incubação de 24 horas, remova as células eletroporadas da incubadora.
- Realize uma coloração de célula viva. Diluir DRAQ5 1:1000 até uma concentração final de 5 μM no recipiente de cultura celular. Misturar suavemente as células/solução de coloração e incubar a 37 °C durante 5-30 min.
Observação : uma mancha diferente pode ser implementada nesta etapa. Certifique-se de que as propriedades fluorescentes não se sobreponham ao marcador fluorescente que indica eletrotransfecção bem-sucedida (ou seja, a GFP está no comprimento de onda verde e o DRAQ5 no vermelho distante). - Ligue um microscópio epifluorescente, uma lâmpada e uma câmera (consulte Tabela de materiais).
- Remova as células da incubadora e coloque-as em foco no microscópio.
- Capture uma imagem de contraste de fase (campo brilhante) do campo selecionado.
- Capture imagens epifluorescentes do mesmo campo usando filtros FITC (GFP) e Far-Red (DRAQ5). Analise os conjuntos de imagens manualmente ou através de um algoritmo.
NOTA: Consulte a Figura 7 para obter imagens representativas. - Conte o número total de células GFP-positivas em todas as imagens. Conte o número total de células coradas com DRAQ5 em todas as imagens. Calcular eTE (proporção de células GFP positivas para células coradas com DRAQ5).
Access restricted. Please log in or start a trial to view this content.
Resultados
A Figura 4 destaca os princípios operacionais por trás da detecção de permeabilização de membrana de nível de célula única para uma única amplitude de pulso. Após o início do experimento de eletroporação, o algoritmo de detecção de células determina um limiar ideal para a detecção de células por meio de um método de detecção ponto a ponto, baseado em inclinação. O sistema então monitora continuamente (1) uma mudança negativa significativa na corrente elétrica medi...
Access restricted. Please log in or start a trial to view this content.
Discussão
A metodologia apresentada dentro deste protocolo se concentra principalmente na microfabricação de um dispositivo microfluídico que é então integrado em uma configuração experimental especializada em eletroporação. O termo "receita", que é frequentemente usado ao descrever as especificidades do processo de microfabricação, sugere a importância de seguir / otimizar cada etapa para fabricar com sucesso um dispositivo funcional. No entanto, certas etapas críticas dentro do processo, quando não otimizadas, com...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer o apoio financeiro da National Science Foundation (NSF CBET 0967598, DBI IDBR 1353918) e do Treinamento de Pós-Graduação em Áreas Emergentes de Precisão e Medicina Personalizada do Departamento de Educação dos EUA (P200A150131) para financiar o estudante de pós-graduação J.J.S. em bolsa.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
Referências
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O'Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053(2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications - An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods - An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021).
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001).
- Substrate Preparation. MicroChemicals. , Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021).
- Lisinenkova, M., Hahn, L., Schulz, J. 4M 2006 - Second International Conference on Multi-Material Micro Manufacture. , Elsevier. 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive - alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX. , Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021).
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045(2020).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados