A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצור והפעלה של זרימה רציפה, מערכת מיקרו-אלקטרופורציה עם זיהוי חלחול
In This Article
Summary
פרוטוקול זה מתאר את טכניקות המיקרו-פבריקציה הנדרשות לבניית התקן אלקטרופורציה מיקרופלואידי במעבדה על שבב. מערך הניסוי מבצע טרנספקציות מבוקרות ברמת תא בודד בזרימה רציפה וניתן להרחיב אותן לתפוקות גבוהות יותר עם בקרה מבוססת אוכלוסייה. ניתן ניתוח המציג את היכולת לעקוב באופן חשמלי אחר מידת החדירה של קרום התא בזמן אמת.
Abstract
החידושים הטיפוליים הנוכחיים, כגון טיפול בתאי CAR-T, מסתמכים במידה רבה על העברת גנים בתיווך ויראלי. למרות יעילותה, טכניקה זו מלווה בעלויות ייצור גבוהות, מה שהביא להתעניינות בשימוש בשיטות חלופיות להעברת גנים. אלקטרופורציה היא גישה אלקטרו-פיזיקלית, לא ויראלית, להעברה תוך-תאית של גנים וחומרים אקסוגניים אחרים. עם יישום שדה חשמלי, קרום התא מאפשר באופן זמני העברה מולקולרית לתוך התא. בדרך כלל, אלקטרופורציה מבוצעת בקנה מידה מאקרו כדי לעבד מספר גדול של תאים. עם זאת, גישה זו דורשת פיתוח פרוטוקול אמפירי נרחב, שהוא יקר כאשר עובדים עם סוגי תאים ראשוניים וקשים להעברה. פיתוח פרוטוקולים ממושך, יחד עם הדרישה למתחים גדולים כדי להשיג עוצמות שדה חשמלי מספיקות כדי לחדור לתאים, הובילו לפיתוח התקני אלקטרופורציה בקנה מידה זעיר. התקני מיקרו-אלקטרופורציה אלה מיוצרים בטכניקות מיקרו-פבריקציה נפוצות ומאפשרים בקרה ניסיונית רבה יותר עם פוטנציאל לשמירה על יכולות תפוקה גבוהות. עבודה זו מתבססת על טכנולוגיה מיקרופלואידית-אלקטרופורציה המסוגלת לזהות את רמת החדירה של קרום התא ברמת תא בודד תחת זרימה רציפה. עם זאת, טכנולוגיה זו הוגבלה ל -4 תאים מעובדים בשנייה, ולכן גישה חדשה להגדלת תפוקת המערכת מוצעת ומוצגת כאן. טכניקה חדשה זו, המסומנת כבקרת משוב מבוססת אוכלוסיית תאים, בוחנת את תגובת חלחול התא למגוון תנאי פעימת אלקטרופורציה וקובעת את תנאי פולס האלקטרופורציה המתאימים ביותר לסוג התא הנבדק. לאחר מכן נעשה שימוש במצב תפוקה גבוהה יותר, שבו הדופק 'האופטימלי' הזה מוחל על השעיית התא במעבר. השלבים לייצור המכשיר, להגדרה ולהפעלה של הניסויים המיקרופלואידיים ולניתוח התוצאות מוצגים בפירוט. לבסוף, טכנולוגיית מיקרו-אלקטרופורציה זו מודגמת על ידי העברת קידוד פלסמיד DNA עבור חלבון פלואורסצנטי ירוק (GFP) לתאי HEK293.
Introduction
חידושים טיפוליים עכשוויים במחקר ביו-רפואי, כגון טיפול בתאי CAR-T (קולטן אנטיגן כימרי מהונדס) ועריכה גנטית באמצעות קריספר (רצפי דנ"א חוזרים פלינדרומיים קצרים בין-מרחביים באופן קבוע)/Cas9, מסתמכים במידה רבה על היכולת להעביר חומר אקסוגני הן בהצלחה והן ביעילות לחלל התוך-תאי1. בטיפול CAR-T, תקן הזהב לביצוע שלב העברת הגנים בייצור טיפול תאי הוא שימוש בווקטורים נגיפיים2. למרות שהעברת גנים בתיווך ויראלי היא שיטת העברה יעילה, יש לה גם כמה חסרונות. אלה כוללים עלויות ייצור, ציטוטוקסיות, אימונוגניות, פוטנציאל מוטגנזה/גידול ומגבלות גודל על הגנים שיסופקו3. מגבלות אלה הובילו למחקר ופיתוח של טכנולוגיות אספקה חלופיות, שאינן ויראליות.
אלקטרופורציה, חלופה להעברת גנים בתיווך ויראלי, מסתמכת על יישום של צורת גל אופטימלית של פולס חשמלי לביצוע טרנספקציות של דנ"א, רנ"א וחלבונים של תאים. בעקבות יישום של שדה חשמלי חיצוני, קרום התא נפגע לזמן קצר, מה שהופך את התא רגיש להעברה תוך תאית של חומרים אקסוגניים אטומים אחרת4. בהשוואה לאספקה בתיווך ויראלי, אלקטרופורציה היא יתרון מכיוון שהיא בדרך כלל בטוחה, קלה לתפעול ובעלת עלויות תפעול נמוכות. אלקטרופורציה יכולה לספק מטענים מולקולריים קטנים וגדולים כאחד ויכולה להיות יעילה בהעברת תאים ללא קשר לשושלת5. כדי להשיג תוצאות רצויות לאחר אלקטרופורציה, כלומר כדאיות טובה ויעילות אלקטרו-טרנספקציה טובה, יש לבצע אופטימיזציה משותפת של מגוון פרמטרים ניסיוניים. אלה כוללים את סוג התא6, צפיפות התא, ריכוז מולקולות7, תכונות חיץ אלקטרופורציה (למשל, הרכב מולקולרי, מוליכות ואוסמולריות)8, גודל/גיאומטריה של אלקטרודה9, וצורת גל של פולס חשמלי (צורה, קוטביות, מספר פולסים)10 (עיין באיור 1 להמחשה). למרות שלכל אחד מהפרמטרים הללו יכולה להיות השפעה משמעותית על התוצאות של ניסויי אלקטרופורציה, צורת הגל של הפולס נחקרה במיוחד בפירוט רב, שכן האנרגיה החשמלית של הפולסים המיושמים היא שורש הפשרה הפנימית בין כדאיות התא המתקבלת לבין יעילות האלקטרו-טרנספקציה8.
בדרך כלל, ניסויי אלקטרופורציה מבוצעים בקנה מידה מאקרו, שבו התאים תלויים ב-100 שניות של מיקרוליטרים של חיץ בין קבוצה של אלקטרודות גדולות בעלות לוח מקבילי בתוך קובט אלקטרופורציה. האלקטרודות מיוצרות בדרך כלל מאלומיניום עם מרחק אלקטרודה של 1-4 מ"מ. לאחר שהתאים נטענים ידנית באמצעות פיפטה, הקובט מחובר חשמלית למחולל פולסים חשמלי מגושם שבו המשתמש יכול להגדיר וליישם את הפרמטרים של צורת הגל של הפולס כדי לחשמל את מתלה התא. למרות שאלקטרופורציה בקנה מידה מאקרו או בתפזורת יכולה לעבד את צפיפות התאים >106 תאים למ"ל, תכונה זו יכולה להיות בזבזנית בעת מיטוב הגדרות צורת הגל של הפולס החשמלי. זה מדאיג במיוחד בעת אלקטרופורציה של סוגי תאים ראשוניים שבהם ניתן להגביל את מספר אוכלוסיית התאים. בנוסף, בשל המרחק הגדול בין האלקטרודות, מחולל הפולסים חייב להיות מסוגל לספק מתחים גדולים כדי להשיג עוצמות שדה חשמלי >1kV/cm11. מתחים גבוהים אלה גורמים לפיזור כוח התנגדותי דרך מאגר האלקטרוליטים וכתוצאה מכך לחימום ג'ול, מה שעלול להזיק לכדאיות התא המתקבל12. לבסוף, ביצוע אלקטרופורציה על תרחיף צפוף של תאים יהיה נטל באופן עקבי עם שונות מולדת ביעילות ההעברה החשמלית המתקבלת ובכדאיות התא. כל תא בהשעיה יכול לחוות חוזק שדה חשמלי שונה עקב התאים הסובבים אותו. תלוי אם חוזק השדה החשמלי המנוסה גדל או יורד, כדאיות התא המתקבלת או יעילות ההעברה החשמלית עשויות להיות מושפעות כל אחת לרעה11. חסרונות אלה של אלקטרופורציה בקנה מידה מאקרו הובילו למרדף ופיתוח של טכנולוגיות חלופיות הפועלות בקנה מידה זעיר ומאפשרות שליטה טובה יותר ברמת התא הבודד.
תחום הביו-MEMS, או מערכות מיקרו-אלקטרו-מכניות ביו-רפואיות, נובע מההתקדמות הטכנולוגית בתעשיית המיקרו-אלקטרוניקה. באופן ספציפי, שימוש בתהליכי מיקרו-פבריקציה לפיתוח מיקרו-התקנים לקידום המחקר הביו-רפואי. פיתוחים אלה כוללים פיתוח מערכי מיקרו-אלקטרודות לניטור חשמלי in vivo 13, מיקרו-אלקטרודות קיבוליות עבור אלקטרופורציה in situ14, התקני איבר-על-שבב ממוזערים 15, אבחון נקודת טיפול מיקרופלואידית 16, ביוסנסורים 17, ומערכות אספקת תרופות 18, כולל התקני ננו-אלקטרופורציה ומיקרו-אלקטרופורציה 19,20,21 . בשל היכולת לתכנן ולייצר התקנים באותו קנה מידה של תאים ביולוגיים, טכנולוגיות ננו-ומיקרו-אלקטרופורציה הן יתרון בהשוואה למקבילותיהן בקנה מידה מאקרו22,23. התקני אלקטרופורציה אלה מבטלים את הדרישה של יישומי פולסים במתח גבוה, מכיוון שמערכות אלקטרודות עם מרווחים של 10 עד 100 שניות של מיקרומטרים משולבות בדרך כלל. תכונה זו מפחיתה באופן דרסטי את הזרם דרך האלקטרוליט, אשר בתורו מפחית את הצטברות של מוצרי אלקטרוליזה רעילים ואת ההשפעות של חימום ג'ול במערכות אלה. התעלות בקנה מידה זעיר גם מבטיחות כי שדה חשמלי אחיד הרבה יותר מוחל באופן אמין על התאים במהלך יישום הדופק, וכתוצאה מכך תוצאות עקביות יותר24. בנוסף, מקובל גם שמכשירי מיקרו-אלקטרופורציה ישולבו בפלטפורמה מיקרופלואידית המאפשרת שילוב עתידי בטכנולוגיה אוטומטית לחלוטין, יכולת רצויה ביותר בייצור תרפיה תאית25. לבסוף, אלקטרופורציה בקנה מידה זעיר מאפשרת חקירה חשמלית של אירועי אלקטרופורציה. לדוגמה, ניתן לנטר את מידת החדירה של קרום התא בזמן אמת ברמת תא בודד26,27. מטרת שיטה זו היא לתאר את המיקרו-פברינציה, פעולת המערכת והניתוח של מכשיר מיקרו-אלקטרופורציה חד-תאי, המסוגל למדוד את מידת החדירות של קרום התא לצורך אופטימיזציה של פרוטוקולי אלקטרופורציה, ועם זאת להגדיל את התפוקה בהשוואה לקודמתה.
ביצוע אלקטרופורציה ברמת התא הבודד כבר אינה טכניקה חדשנית, כפי שהודגם לראשונה על ידי Rubinsky et al. בשנת 2001 עם פיתוח טכנולוגיית אלקטרופורציה של תאים סטטיים28. המיקרו-מכשיר שלהם היה חדשני מכיוון שהם היו הראשונים להדגים את היכולת לנטר חשמלית את אירוע האלקטרופורציה. זה הוביל עוד יותר לפיתוח של טכנולוגיות אלקטרופורציה סטטיות, חד-תאיות המסוגלות לזהות חשמלית את מידת החדירה של קרום התא באופן מקביל כדי להגדיל את התפוקה של המכשירים. עם זאת, אפילו עם מקביליות ועיבוד אצווה, התקנים אלה חסרים מאוד את המספר הכולל של תאים שהם יכולים לעבד ליחידת זמן29,30. מגבלה זו הובילה לפיתוח התקנים זורמים המסוגלים לבצע מיקרו-אלקטרופורציה ברמת תא יחיד בתפוקות גדולות בהרבה31. מעבר מכשיר זה, מסביבה סטטית לסביבה זרימה, מגביל את היכולת לנטר חשמלית את מידת החדירה של קרום התא בעקבות יישום פולס האלקטרופורציה. השיטה המתוארת בעבודה זו מגשרת על הפער בין שתי הטכנולוגיות הללו, טכנולוגיית מיקרו-אלקטרופורציה המסוגלת לזהות, לפעום ולנטר באופן חשמלי את מידת החדירה של קרום התא של תאים בודדים, באופן סדרתי בעל זרימה רציפה.
טכנולוגיה זו תוארה לאחרונה ב- Zheng et al. בעבודה זו הוצגו היכולות של טכנולוגיה זו עם השלמת מחקר פרמטרי, שבו הן המשרעת והן משך הזמן של פולס האלקטרופורציה היו מגוונים, והאות החשמלי שבא בעקבותיו, המעיד על חדירת קרום התא, נחקר32. התוצאות הראו כי עלייה בעוצמת פולס האלקטרופורציה (כלומר, עלייה בשדה החשמלי המופעל או עלייה במשך הפולס) גרמה לעלייה בחדירת קרום התא הנמדדת. כדי לאמת עוד יותר את המערכת, נוסף למתלה התא אינדיקטור פלואורסצנטי נפוץ לאלקטרופורציה מוצלחת, פרופידיום יודיד33, ותמונת פלואורסצנציה נלכדה מיד לאחר יישום הפולס החשמלי. האות האופטי, כלומר עוצמת הפלואורסצנטיות של פרופידיום יודיד בתוך התא, היה בקורלציה חזקה עם המדידה החשמלית של מידת החדירה של קרום התא, מה שמאמת את האמינות של מדידה חשמלית זו. עם זאת, עבודה זו שקלה רק את המסירה של המולקולה הקטנה פרופידיום יודיד, אשר יש משמעות מועטה עד אפסית לתרגום.
בעבודה זו, יישום חדש של טכנולוגיה זו מוצג כדי לשפר את התפוקה של המערכת תוך אספקת וקטור DNA פלסמיד פעיל ביולוגית (pDNA) והערכת יעילות ההעברה החשמלית של תאים מצופים מחדש ותרבית לאחר אלקטרופורציה. למרות שהעבודה הקודמת עולה בביצועיה על טכנולוגיות מיקרו-אלקטרופורציה קיימות המסוגלות למדוד חשמלית את אירוע האלקטרופורציה, המצב הנוכחי של המכשיר עדיין דורש זמני מעבר ארוכים של התא בין מערך האלקטרודות (~250 אלפיות השנייה) כדי לבצע את זיהוי התא, יישום הפולסים ומדידת החדירה של קרום התא. בערוץ יחיד, פעולה זו מגבילה את התפוקה ל- 4 תאים לשנייה. כדי להילחם במגבלה זו, מוצג רעיון חדש של אלקטרופורציה מבוקרת משוב מבוססת אוכלוסיית תאים לביצוע טרנספיקציה של pDNA. על ידי שימוש במאגר אלקטרופורציה היפו-פיזיולוגי של מוליכות, מערכת זו מאפשרת חקירה חשמלית של תאים בודדים על פני מספר רב של יישומי פולסים אלקטרופורציה. בהתבסס על התגובה החשמלית, נקבע פולס אלקטרופורציה 'אופטימלי'. לאחר מכן מיושם מצב 'תפוקה גבוהה' שבו קביעת החדירה של קרום התא מתבטלת, קצב הזרימה מוגבר, ומחזור העבודה של פולס האלקטרופורציה מותאם לזמן המעבר של התא כדי להבטיח פעימה אחת לכל תא במעבר בין האלקטרודות. עבודה זו תספק פרטים נרחבים על שלבי המיקרו-פבריקציה לייצור המיקרו-מכשיר, החומר/הציוד והגדרתם הנדרשים לביצוע הניסוי, והפעלה/ניתוח של המכשיר ויעילות ההעברה החשמלית שלו (eTE).
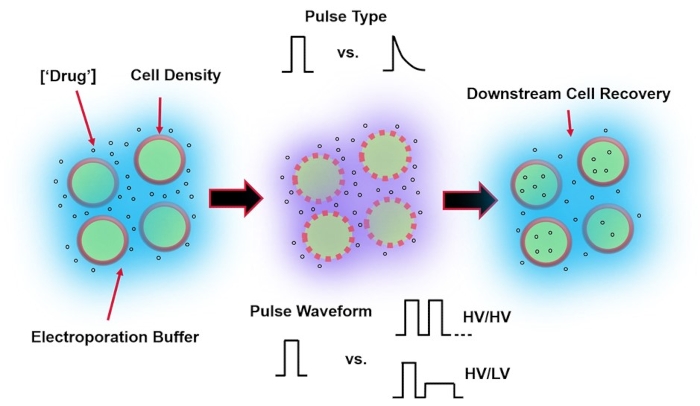
איור 1: גורמים ניסיוניים המשפיעים על תוצאות האלקטרופורציה. (משמאל) תרחיף תאים - גורמים חשובים שיש לקחת בחשבון לפני תחילת האלקטרופורציה כוללים: מטען (במקרה זה, pDNA), ריכוז, צפיפות תאים ותכונות חיץ אלקטרופורציה. תכונות חיץ אלקטרופורציה שיש לקחת בחשבון הן מוליכות, אוסמולריות וההרכב המולקולרי המדויק התורם לערכים אלה. (באמצע) יישום פולס - סוג הפולס המדויק (גל מרובע לעומת דעיכה מעריכית) וצורת הגל של הפולס (פולס יחיד לעומת רכבת דופק) חייבים להיות ממוטבים כדי למקסם הן את כדאיות התא המתקבלת והן את יעילות ההעברה החשמלית. רכבות פולסים נפוצות המיושמות בתהליכי אלקטרופורציה מורכבות בדרך כלל מסדרה של פולסים במתח גבוה (HV) או סדרה של פולסים המסתובבים בין סדרי גודל של פולסים של HV ומתח נמוך (LV). (זכות) יש למטב את שלבי העיבוד של Cell Recovery-Down-stream, בפרט, את מדיית תרבית תאי ההתאוששות שאליה מועברים התאים. לא מוצג (השמאל הקיצוני), ניתן ליישם שלבי עיבוד תאים נוספים במעלה הזרם לאופטימיזציה כוללת של תהליך האלקטרופורציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: על המשתמשים לסקור את כל MSDS עבור החומרים והחומרים המתכלים המשמשים בפרוטוקול זה. יש ללבוש PPE מתאים בכל שלב וטכניקה סטרילית המשמשת במהלך הניסוי. סעיפים 1-7 דנים בייצור המכשיר.
1. ייצור מכשירים - עיצוב מסכה
הערה: עיין באיור 2 להמחשה של תהליך המיקרו-פברייקציה. שלבי המיקרו-פבריקציה יבוצעו בסביבת חדר נקי. יש צורך ב- PPE נוסף (רשת שיער, רשת שיער פנים, מסכה, חליפת חדר נקי, כיסויי נעליים).
- התקן תוכנת CAD לפי בחירה, תכנן 'מסכה' דו-ממדית של התעלה המיקרופלואידית והאלקטרודות ושמור את העיצוב בפורמט הקובץ הרצוי (כלומר, .dxf, .dwg).
הערה: עיין באיור משלים 1 לקבלת דוגמה לסכמת מסכה דו-ממדית. - שלח לספק לבחירתך להדפסה. ודא שמידות העיצובים נמצאות בתוך יכולות הרזולוציה של הספק.
2. ייצור מכשירים - פוטוליתוגרפיה
הערה: מתכוני המיקרו-פבריקציה שסופקו מאומצים מהמלצות היצרן של הפוטורסיסטים ויש להשתמש בהם רק כנקודת מוצא34. ערכים מדויקים עבור זמני אפייה, זמני חשיפה וכו ', צריכים להיות מותאמים לכל פרוטוקול ייצור. מומלץ להשתמש בפינצטה של פרוסות לטיפול הן בוופלים מסיליקון והן במגלשות זכוכית.
- ייצור תעלות מיקרופלואידיות
- ניקוי שקופיות של פרוסות סיליקון וזכוכית סודה-ליים: בצע את השלבים 2.1.2-2.1.3 כדי לבצע ניקוי שקופיות סיליקון ו-1" × 3" ניקוי שקופיות זכוכית סודה-ליים (שניהם מכונים "מצע").
- טבלו את המצעים באמבט אצטון, אמבט איזופרופנול (IPA) ואמבט מים שעבר דה-יוניזציה למשך 10 דקות כל אחד. יש לבצע את השטיפה בת 3 השלבים באופן סדרתי בטמפרטורת החדר.
- הסר וייבש את פני השטח באמצעות חנקן בלחץ או מקור גז אוויר מסונן. מכניסים את המצעים לתנור של 150 מעלות צלזיוס למשך 30 דקות לפחות כדי לאפשר אידוי של הלחות שנותרה.
- פוטוליתוגרפיה SU-8 על פרוסת סיליקון: בצע פוטוליתוגרפיה על פרוסת הסיליקון בשלבים 2.1.5-2.1.14.
הערה: כדי להשיג גובה תעלה מיקרופלואידית של 20 מיקרומטר, נעשה שימוש בפוטורססיסט שלילי מסדרת SU-8 2000. קצבי הספין המדויקים ישתנו בהתאם לניסוח של SU-8 (כלומר, 2010, 2015 וכו '); עם זאת, התנאים הבאים הם עבור נוסחת SU-8 201035. - מוציאים את פרוסת הסיליקון מהתנור של 150 מעלות ומניחים לה להתקרר לטמפרטורת החדר (RT).
- הצמידו את הוופל לצ'אק של מעיל הספין של הוופל באמצעות מערכת הוואקום של מעיל הספין. לתכנת את הספינר. שלב 1 - 500 סל"ד במשך 10 שניות בתאוצה של 100 סל"ד לשנייה, שלב 2 - 1000 סל"ד במשך 30 שניות בתאוצה של 300 סל"ד לשנייה.
- יש לטפטף 4 מ"ל של פוטורסיסט SU-8 2010 על מרכז פרוסת הסיליקון. הפעל את התוכנית. ברגע שהמערכת נעצרת, כבו את הוואקום.
- בעזרת פינצטה, מעבירים את פרוסת הסיליקון המצופה SU-8 על פלטה חמה בטמפרטורה של 95 מעלות צלזיוס למשך 4-5 דקות לאפייה רכה. לאחר מכן הסר את הוופל מהצלחת החמה ותן לו להתקרר ל- RT.
הערה: בצע את הליך ההפעלה הנכון עבור יישור המסכה הפוטוליטוגרפית הספציפית למעבדה. - אבטחו את מסכת הצילום בעזרת עיצובי התעלה המיקרופלואידית הדו-ממדית על מחזיק המסכה. הכנס את פרוסת הסיליקון, כאשר ציפוי SU-8 פונה כלפי מעלה, על צ'אק הוופל.
- הגדר את הגדרות החשיפה עבור 150 mJ/cm2 והפעל את המכשיר.
התראה: אין להסתכל ישירות על מקור האור UV כדי למנוע נזק אפשרי לעיניים. - מניחים את פרוסת הסיליקון המצופה SU-8 על פלטה חמה בטמפרטורה של 95 מעלות צלזיוס למשך 4-5 דקות לאפייה לאחר החשיפה.
- השקע את פרוסת הסיליקון בפתרון המפתחים SU-8 (ראה טבלת חומרים) למשך 3-4 דקות. יש למרוח תסיסה עדינה. הסר את הוופל מהתמיסה ושטוף את המשטח עם IPA.
- יבש את פני השטח באמצעות חנקן בלחץ או מקור גז אוויר מסונן. בדוק את התכונות תחת מיקרוסקופ באמצעות מסנן UV וודא שאין פגמים ברורים בתעלות המיקרופלואידיות.
- מכניסים את פרוסת הסיליקון לתנור של 150 מעלות צלזיוס למשך 30 דקות לפחות לאפייה קשה.
- אפשר להתקרר ל-RT ולהשתמש בפרופילומטריה של עט אלקטרוני כדי למדוד את הגובה והשיפוע המדויקים של דפנות הערוץ.
- פוטוליתוגרפיה על שקופיות זכוכית
הערה: הקסמתיל-דיסילאזאן (HMDS) משמש כמקדם הידבקות עבור הפוטורסיסט החיובי S181836.- מוציאים את שקופית הזכוכית מהתנור של 150 מעלות צלזיוס ומניחים לה להתקרר ל-RT.
- הצמידו את מגלשת הזכוכית לצ'אק של הספינר באמצעות ואקום ותכנתו את הספינר. שלב 1 - 500 סל"ד במשך 10 שניות בתאוצה של 100 סל"ד לשנייה. שלב 2 - 3000 סל"ד עבור 30 ישב תאוצה של 300 סל"ד / שנייה.
- יש לפזר 3-4 טיפות של HMDS על פני השטח של מגלשת הזכוכית. הפעל את התוכנית.
הערה: כדי להשיג ציפוי פני שטח של ~ 3 מיקרומטר, יש להשתמש בסדרת פוטורסיסטים חיוביים S1800. קצבי הספין המדויקים ישתנו בהתאם לניסוח; ההמלצות שלהלן הן עבור נוסחת S181834. - יש לטפטף 1 מ"ל של פוטורסיסט על פני השטח של שקופית הזכוכית. ודא מספיק כדי לכסות את שטח הפנים.
- הפעל את התוכנית. ברגע שהמערכת נעצרת, כבו את הוואקום והסירו את מגלשת הזכוכית.
- הניחו את מגלשת הזכוכית המצופה S1818 על צלחת חמה בטמפרטורה של 120 מעלות צלזיוס למשך 4 דקות לאפייה רכה. הסר ואפשר להגיע ל- RT.
- אבטחו את מסיכת הצילום בעזרת עיצובי האלקטרודות הדו-ממדיות על מחזיק המסכה.
- הכנס ויישר את מגלשת הזכוכית, כאשר ציפוי S1818 פונה כלפי מעלה, על צ'אק הוופל. הגדר את הגדרות החשיפה ל- 250 mJ/cm2 והפעל את המכשיר.
הערה: דגמים שונים של מיישרי מגע עשויים להתאים פחות או יותר למצעים בעובי משתנה שאינם עגולים. - הטבל את שקופית הזכוכית בפתרון המפתחים MF-319 למשך 2 דקות. יש למרוח תסיסה עדינה. שטפו את פני השטח של מגלשת הזכוכית במים שעברו דה-יוניזציה.
- יבש את פני השטח באמצעות חנקן בלחץ או מקור גז אוויר מסונן וצפה בתכונות תחת מיקרוסקופ באמצעות מסנן UV. ודא שאין פגמים ברורים בתבניות הליתוגרפיות.
- הכניסו את מחליק הזכוכית לתנור של 150 מעלות צלזיוס, כדי לוודא שמשטח המצע המעניין פונה כלפי מעלה, למשך מינימום של 30 דקות לאפייה קשה. מוציאים מהתנור ושומרים מפני אור.
3. ייצור מכשיר: חריטת חומצה הידרופלואורית (HF)
אזהרה: שלב זה כולל טיפול וסילוק של חומצה הידרופלואורית (HF), שעלולה לגרום לכוויות כימיות עמוקות וכואבות. יש להשתמש ב- PPE נוסף כדי להגן על המטפל (מגן פנים, כפפות עמידות כימית באורך המרפק, סינר עמיד כימית עם שרוולים). מנטרל חומצה גלוקונאט סידן וג'ל לעור צריך להישמר בקרבת ספסל המעבדה. צעד זה לא צריך להתבצע לבד. לעולם אין לאחסן או לחלק HF למיכלי זכוכית מכיוון שהמכל ייחרט על ידי החומצה.
הערה: ה-HF מחריט באופן אחיד את הזכוכית החשופה (כלומר, עיצוב האלקטרודה) כדי ליצור שקע בזכוכית, מה שמאפשר רזולוציית קצה טובה יותר של תבנית האלקטרודה לאחר תצהיר המתכת (סעיף 4).
- טבלו את שקופית הזכוכית בתמיסת HF אטומה ביחס של 10:1 למשך דקה אחת במיכל פוליטטרפלואורואתילן. מעבירים ושוטפים את מגלשות הזכוכית במים שעברו דה-יוניזציה. חזור על שלב הכביסה 3 פעמים.
- יבש את פני השטח באמצעות חנקן בלחץ או מקור גז אוויר מסונן. מניחים מצעי זכוכית בתנור של 65 מעלות למשך הלילה כדי להסיר את הלחות שנותרה. מכסים את המצעים מאור.
4. ייצור מכשיר: תצהיר אדים פיזי
הערה: שלב זה כולל את תצהיר המתכת על מצעי שקופיות הזכוכית כדי להגדיר את תבניות האלקטרודות. אלקטרודות מתכת נפוצות הן כרום/זהב וטיטניום/פלטינה. זהב ופלטינה אינם נדבקים למצע הזכוכית, ולכן נדרשת שכבת הידבקות זרעים של כרום או טיטניום, בהתאמה, כדי לקדם הידבקות37.
- עקוב אחר הפרוטוקול הספציפי לחדר נקי כדי להפעיל את מערכת ה-PVD הפנימית. עבודה זו משתמשת במערכת sputtering DC sputter עם גז ארגון 100 SCCM בלחץ של ~ 8 mTorr ו 200 W כוח.
- מפזרים טיטניום במשך 8 דקות בקצב של ~ 100 Å / min. מפזרים פלטינה במשך 10 דקות בקצב של ~ 200 Å / min. הסירו את המצעים מתא ה-PVD.
5. ייצור מכשיר: הרמת פוטורסיסטים
הערה: שלב זה כולל המסת שכבת הפוטורסיסט באמבט אצטון, והשארת אלקטרודות הפלטינה המודבקות בדוגמת שקופיות הזכוכית.
- טבלו את הזכוכית המצופה מתכת באמבט אצטון למשך ~ 10 דקות.
- סוניקו את האמבטיה כדי להציג תסיסה כדי לשבור את סרט המתכת הלא מעובד. השתמשו במגבון ספוג אצטון כדי להסיר שאריות במידת הצורך.
- לאחר הסרת כל הפוטורסיסטים/מתכת, שטפו את תבניות האלקטרודות במים שעברו דה-יוניזציה, והכניסו אותן לתנור של 65 מעלות למשך הלילה כדי להסיר את הלחות שנותרה על פני השטח.
- השתמש בפרופילומטריה של חרט כדי למדוד את הפרופיל של האלקטרודות המעוצבות.
6. ייצור מכשיר: ליתוגרפיה רכה
הערה: שלב זה כולל עיצוב משוכפל של התעלה המיקרופלואידית על מבנה התבליט הראשי של SU-8 באמצעות אלסטומר, פולידימתילסילוקסן (PDMS).
- סיליזציה של פרוסות סיליקון
הערה: זהו שלב אופציונלי; עם זאת, הוא יאריך את אורך החיים של מבנה התבליט SU-8 שיוצר בסעיף קטן 2.1. שלב זה צריך להתבצע במכסה אדים כימי.- הצמידו את הוופל לתחתית צלחת פטרי והכניסו את צלחת הפטרי לייבוש.
- הקף את היקף פרוסת הסיליקון בכ-50 μL של טריכלורו (1H,1H,2H,2H-perfluorooctyl) סילן. חבר ואקום (משאבת ואקום או קו ואקום ביתי) והפעל במשך 20 דקות.
- יציקת העתק PDMS
- במיכל חד פעמי (למשל, סירת שקילה, פלסטיק), יש לערבב את בסיס האלסטומר PDMS כדי להתקשות ביחס משקל של 10:1 על גבי איזון אלקטרוני. יוצקים את תמיסת ה-PDMS על פרוסת הסיליקון ומניחים את התערובת מתחת לוואקום כדי להסיר את כל בועות האוויר.
- ריפוי בטמפרטורה של 65°C למשך 4 שעות לפחות, המאפשר ל-PDMS להתמצק. בעזרת קצה סכין גילוח, חותכים את ה-PDMS המעוצב ומקלפים את פרוסת הסיליקון.
- באמצעות ניקוב ביופסיה מחודד, הסר PDMS מהכניסה/שקעים של המכשיר. עבור מכשיר זה, 0.75 מ"מ ו 3 מ"מ אגרופים ביופסיה שימשו עבור הכניסות ואת שקעים, בהתאמה.
הערה: ניקוב הביופסיה שבו נעשה שימוש צריך להיות בקוטר מעט קטן יותר מהקוטר החיצוני של הצינורות המחוברים כדי להבטיח אטימה הדוקה של צינורות במאגרים.
- ניקוי סוניקציה של PDMS
- הטבל את התקני PDMS ב- IPA והנח אותם ב- sonicator למשך 30-45 דקות כדי להסיר כל פסולת PDMS מהכניסה / שקעים. PDMS עלול להתנפח בפתרון IPA.
- שוטפים במים שעברו דה-יוניזציה ומכניסים לתנור של 65 מעלות למשך הלילה כדי לאפשר ל-PDMS להתנפח בחזרה לגודל הרגיל.
הערה: כל שאריות פסולת עלולות לסתום את המכשיר במהלך הניסוי. ניתן להסיר חתיכות גדולות של פסולת משטח PDMS באמצעות חתיכת סרט סקוטש לפני סוניקציה.
7. ייצור מכשיר: חיבור PDMS להדבקה/חוט
הערה: שלב זה כולל טיפול בפני השטח של PDMS ומצע זכוכית עם פלזמה חמצן כדי ליצור קשר בלתי הפיך בין PDMS וזכוכית38. ייתכן שיהיה צורך להתאים את המתכון שסופק למערכת המדויקת המשמשת במעבדה.
- חתוך את המכשירים לגודל וודא שפני השטח של התקן PDMS נקיים. אם לא תנקה מחדש, בצע את השלבים בסעיף משנה 6.3.
- לתכנת את מחולל הפלזמה. הגדר הספק ל- 70 W, זמן ל- 35 שניות, לחץ ל- 325 mTorr, קצב זרימה של גז חמצן ל- 60 SCCM. מקם PDMS וזכוכית אלקטרודה להחליק לתוך המערכת כאשר התכונות פונות למעלה ולהפעיל את התוכנית.
- הסר את ההתקנים ויישר במהירות את תכונות הערוץ לאלקטרודות באמצעות סטריאוסקופ. הפעל בחוזקה לחץ ממרכז ה- PDMS לכיוון הצדדים כדי להסיר בועות אוויר לא רצויות בממשק המליטה.
- הניחו על מקום חם בטמפרטורה של 95 מעלות צלזיוס למשך 2 דקות לפחות כדי לסיים את הליך ההדבקה והניחו למכשיר להתקרר ב-RT.
- חותכים 2 חתיכות של חוט מוצק 22-G באורך ~ 6 אינץ 'ומפשיטים את המבודד משני הקצוות.
- קשרו את החוטים לרפידות אלקטרודה באמצעות אפוקסי מוליך כסף. הכניסו את המכשירים שהושלמו לתנור של 65 מעלות למשך הלילה.
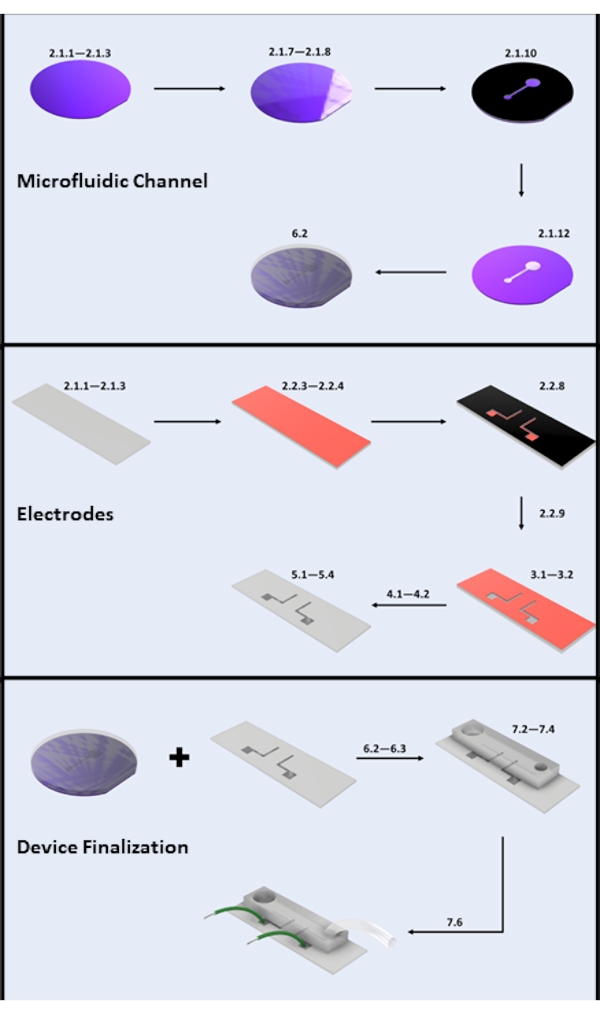
איור 2: ייצור מיקרו-מכשירים. (A) ייצור תעלות מיקרופלואידיות - שלבי מפתח: ניקוי פרוסות סיליקון (שלבים 2.1.1-2.1.3), ציפוי פוטורסיסטי ואפייה רכה (שלבים 2.1.7-2.1.8), חשיפה לקרינת UV (שלב 2.1.10), פיתוח (שלב 2.1.12) ומזיגת PDMS (תת-סעיף 6.2). (B) שלבי מפתח לייצור אלקטרודות: ניקוי שקופיות זכוכית (שלבים 2.1.1-2.1.3), ציפוי HMDS וציפוי פוטורסיסט (שלבים 2.2.3-2.2.4), חשיפה לקרינת UV (שלב 2.2.8), פיתוח (שלב 2.2.9), HF Etch (סעיף 3), תצהיר אדים פיזי (סעיף 4) והרמת פוטורסיסטים (סעיף 5). (C) שלבי מפתח לסיום המכשיר: גישה לכניסה/יציאה וסוניקציה (שלב 6.2.3 וסעיף 6.3), חיבור PDMS וחיבור חוט (סעיף 7). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
8. תרבית תאים וקציר
הערה: יש להשתמש בתרבית תאים סטנדרטית ובהליכי טיפול סטריליים. עקוב אחר פרוטוקול ספציפי לסוג תא עבור תרבית תאים.
- תרבית תאים
- מעבר תאים: תרבית ומעבר התאים בעקבות שלבים 8.1.2-8.1.5.
- תרבית תאי HEK293 בתמיסת DMEM מלאה (88% DMEM, 10% סרום בקר עוברי מומת בחום, 1% L-גלוטמין, 1% פניצילין-סטרפטומיצין) בבקבוק T25 באינקובטור בטמפרטורה של 37 מעלות צלזיוס, 95% O2, 5% CO2. מעבר תאים על לוח הזמנים כאשר מגיעים ~ 80% מפגש.
- שאפו את המדיה באמצעות מערכת פיפטה או ואקום ודגרו על התאים ב-0.25% טריפסין-EDTA (בקבוק 2 מ"ל-T25) למשך 2 דקות ב-37 מעלות צלזיוס. נטרול טריפסין עם נפח כפול של מדיה תרבותית.
- העבר את מתלה התא לצינור חרוטי של 15 מ"ל ולצנטריפוגה HEK293 תאים בגודל 770 x g למשך 2 דקות. שאפו את הסופרנטנט באמצעות מערכת פיפטה או ואקום
- יש להשעות את תאי HEK293 ב-1 מ"ל של DMEM שחומם מראש.
- ציפוי תאים: צלחת את התאים בשלבים הבאים 8.1.7-8.1.8
- צלחת את התאים בדילול 10:1 עד 20:1 בבקבוק T25 (5 מ"ל של DMEM) כדי להמשיך את התרבית.
- צלחת את התאים בדילול של 5:1 עד 20:1 בצלחת של 6 בארות (2 מ"ל של DMEM לכל באר) כדי להיקצר לניסויים באלקטרופורציה.
הערה: תאי HEK293 מצופים 24 שעות לפני ניסויי אלקטרופורציה כדי להשיג מפגש של ~70% בקציר התאים (תת-סעיף 8.3). לוח זמנים לא עקבי לקציר יכול להוביל לשונות בתוצאות האלקטרופורציה.
- חיץ אלקטרופורציה
- הכנת חיץ אלקטרופורציה
הערה: עיין ב- Sherba et al. לקבלת פרטים על הכנת חיץ האלקטרופורציה8. הרכב החיץ היה 285 mM סוכרוז, 0.7 mM MgCl2, 1 mM KCl, 10 mM HEPES, 3 mM NaOH (pH: 7.4; osmolality: 310 mOsm, מוליכות: 500 μS / cm). חיץ אלקטרופורציה צריך להיות מנוסח בצורה סטרילית ומאוחסן ב 4 °C למשך חיי מדף של ~ 1 חודש. יש למטב את ניסוח מאגר האלקטרופורציה על בסיס סוג תא.
- הכנת חיץ אלקטרופורציה
- קציר תאים ותוספת pDNA
- בצע את אותם השלבים כמו מעבר תא (8.1.2-8.1.4).
- שטפו את התאים ב-PBS סטרילי 1x, תרחיף תאי העברה לתוך צינור חרוטי של 15 מ"ל, ותאי צנטריפוגה ב-770 x g למשך 2 דקות.
- יש לשטוף את גלולת התא HEK293 בחיץ האלקטרופורציה ובצנטריפוגה בעוצמה של 770 x גרם למשך 2 דקות. יש להשעות את התאים במאגר האלקטרופורציה ב-~5 מיליון תאים/מ"ל.
הערה: יש למטב את צפיפות התאים לכל סוג תא. - הוסף קידוד pDNA עבור חלבון פלואורסצנטי ירוק (GFP) לריכוז סופי של 20 מיקרוגרם למ"ל. מערבבים בעדינות את ה-pDNA/תרחיף התא ומעבירים את המתלים למזרק בנפח 1 סמ"ק לצורך ניסויים.
9. הגדרת חומרה/ניסוי
הערה: לפני קצירת תאים לצורך ניסוי, ודא שמערך הניסוי הושלם כדי למזער את משך הזמן שבו התאים תלויים במאגר האלקטרופורציה. הפעל אלקטרוניקה 20-30 דקות לפני ניסויים כדי להתחמם. עיין באיור 3 עבור סכמטיקה של מערך הניסוי להפעלת מודול הגילוי החד-תאי.
הערה: מעגל PA90 Op-Amp שנבנה בהתאמה אישית פותח כדי להתאים הן לרגישות הנדרשת לזיהוי ברמת התא הבודד באמצעות מגבר הנעילה והן למתחים הגבוהים הנדרשים להפעלת פולסים חשמליים חזקים מספיק. עיין בגליון הנתונים PA90 לקבלת מפרטים על מעגלים מומלצים39.
- אתחל את מגבר הנעילה עם הגדרות קדם-מגבר נוכחיות והגדר באמצעות האלגוריתם. עיין ב- Zheng et al. לקבלת פרטים על הגדרות הנעילה32.
- ספקי כוח, מחולל פונקציות ומגבר
- ספק כוח 1: הגדר ל- -15 V כדי להפעיל את הקצה השלילי של המעגל.
- ספק כוח 2 (מחולל פונקציות): הגדר לפלט אות DC והגדר את המשרעת ל-2 V. התחבר לכניסת מגבר 50x.
- תוכנית מחולל פולסים אלקטרופורציה עבור הגל המרובע: הגדר את רוחב הפולס הרצוי (מחזור עבודה) ואת משרעת הדופק הרצויה (וולט).
- הגדר את הפלט למצב הפעלה (פעימה אחת). חבר את הפלט לקלט של מגבר 50x.
הערה: זכור את הרווח של פי 50 בעת תכנות משרעת הדופק. כלומר, כדי להשיג חוזק שדה חשמלי של 1 kV/cm, נדרש סך של 30 V, 30 V/300 μm (מרחק בין אלקטרודות), ולכן יש להגדיר את תפוקת מחולל הפונקציות ל-30/50, או 600 mV. - בדוק את הפלטים של מגבר 50x באמצעות אוסצילוסקופ. פלט 1-100 V מספק כוח 2 (9.2.2). פלט משרעת 2-משתנה עבור פולס האלקטרופורציה (9.2.4).
- חבר בדיקה 10x לתעלת אוסצילוסקופ ולמכשיר המיקרו שהושלם (מכשיר בבדיקה, DUT) בשלב 7.6 שבו פולס האלקטרופורציה הולך להיות מיושם. נטר את המערכת במהלך הניסוי כדי לוודא שפולסים מופעלים.
- ודא שה-USB הנעול מחובר ורשום. בדוק שוב את כל הגדרות הנעילה בקוד האלגוריתם (והכי חשוב, תדירות פלט נעילה).
- מיקרוסקופ/מצלמת CCD
- הניחו את המיקרו-מכשיר על במת המיקרוסקופ באמצעות מחזיק שקופיות. הפעל את מצלמת ה- CCD והבא את הערוץ המיקרופלואידי למיקוד. השתמש במטרה של 4x או 10x.
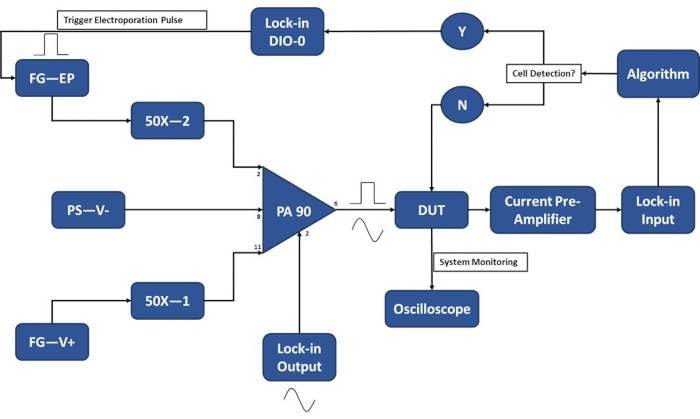
איור 3: מערך ניסויי של זיהוי תאים בודדים. מגבר ה-op-amp בהספק גבוה (PA-90) מאפשר סופרפוזיציה של פולס האלקטרופורציה במתח גבוה על אות AC של יציאה נעולה הנדרש לזיהוי תא יחיד. אות עירור זה עובר דרך התקן המיקרו-אלקטרופורציה (התקן תחת בדיקה, DUT) שבו הזרם מוגבר לאחר מכן על ידי קדם-מגבר הזרם ומוזן לאלגוריתם. המערכת מנטרת באופן רציף את אירוע זיהוי התא. עם כניסת התא, אות דיגיטלי נוצר על ידי מגבר הנעילה כדי להפעיל את היישום של פולס האלקטרופורציה על התאים במעבר. מקרא: PA-90 (מגבר op בהספק גבוה), DUT (התקן בבדיקה), DIO (כניסה/יציאה דיגיטלית), FG-EP (מחולל פונקציות / פולס אלקטרופורציה), 50X (מגבר 50X), PS-V- (ספק כוח / מתח שלילי עבור PA 90), FG-V+ (מחולל פונקציות, מתח חיובי עבור PA 90). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
10. פעולה ניסיונית
- תעלות מיקרופלואידיות
- הסר את כל בועות האוויר מהמזרק הטעון בתא. חברו מחט של 30 גרם למזרק הטעון בתאים.
- באמצעות פינצטה, החליקו טייגון לאורך המחט. מלאו מראש את מאגר היציאה במדיית התאוששות (זהה לשלב 8.1.2 ללא האנטיביוטיקה), ~ 40-50 μL.
- באמצעות האגודל, מפעילים בעדינות לחץ על הבוכנה כך שהנוזל מגיע באיטיות לקצה קו הצינורות.
- הצמידו את המזרק למשאבת המזרק. הפעל את משאבת המזרק וודא שהיא מוגדרת לזילוח קדימה.
- תכנתו את המשאבה לקוטר הנכון של המזרק כדי להבטיח שקצבי הזרימה יהיו מדויקים. עיין במדריך המשאבה לקבלת פרטים על קוטרי מזרק.
הערה: כדי למנוע מהתאים להתיישב במזרק, אבטחו את משאבת המזרק על מעמד מהדק כך שהיא תוכל לפעול במצב אנכי כאשר קצה המזרק פונה כלפי מטה. - הגדר את קצב זרימת משאבת המזרק, ~ 10-20 μL / min, ואפשר למשאבה לפעול עד שהנוזל מגיע לסוף קו הצינורות. צינורות מאובטחים למכשיר המיקרופלואידי.
- הנמיכו את קצב זרימת משאבת המזרק, ~5-10 μL לדקה, ואפשרו למשאבה לפעול עד שכל האוויר יוצא מהמכשיר המיקרופלואידי והתאים חוצים לשקע המכשיר.
- הסר את התאים מהשקע באמצעות שאיפת פיפטה. מלא מחדש את מאגר היציאה עם מדיה התאוששות (זהה לשלב 8.1.2 ללא אנטיביוטיקה), ~ 40-50 μL.
- מיפוי חלחול של קרום תא אלקטרופורציה חד-תאית
הערה: עיין באיור 4 ובאיור 5 כדי להבין טוב יותר את הנתונים החשמליים המעידים על חדירת קרום התא ומיפוי חלחול קרום התא, בהתאמה.- הגדר את קצב זרימת משאבת המזרק ל~0.1-0.3 μL לדקה כדי להבטיח זרימה של תאים בודדים דרך ערכת האלקטרודות. זמן המעבר של התא בין האלקטרודות צריך להיות ~ 250 אלפיות השנייה.
- הפעל את תוכנית המחשב על ידי לחיצה על הפעלה. ודא שהמערכת שומרת את הנתונים החשמליים.
- ודא שהמערכת מזהה באופן אמין תאים כדי להפעיל את יישומי הדופק הנשלטים על-ידי המחשב. התאם את סף הזיהוי בהתאם.
- הגדר את פרמטרי הפולס עבור פולס האלקטרופורציה הראשוני, בעל האנרגיה החשמלית הנמוכה ביותר. עיין בטבלה 1 לפרמטרים של פעימת אלקטרופורציה במחקר זה.
- הפעל את ערוץ הפלט עבור מחולל פולס האלקטרופורציה (שלב 9.2.3.).
- עקוב אחר מספר מוגדר מראש של יישומי זיהוי תאים/פולסים (n =100). בסוף כל מצב שנבדק, שאפו תאים משקע המיקרו-מכשיר ומלאו את השקע במדיית התאוששות.
- חזרו למצב הבא של פולס אלקטרופורציה. חזור על הפעולה עד לבדיקת כל תנאי פולס האלקטרופורציה.
- קבע את מידת החדירה של קרום התא עבור כל יישום דופק שנבדק. (אימות לאחר התהליך מתואר בסעיף קטן 11.1). צרו את מפת החדירה של קרום התא (איור 5).
- קבע את פרמטרי פולס האלקטרופורציה עבור משוב מבוסס אוכלוסייה בעל תפוקה גבוהה.
- כבה את משאבת המזרק, הסר תאים ממאגר היציאה וחדש את השקע עם מדיה התאוששות.
- אלקטרופורציה מבוססת משוב מבוסס אוכלוסייה - תפוקה גבוהה
הערה: עיין באיור 6 עבור סכמטית הממחישה את תהליך המשוב מבוסס האוכלוסייה.- הגדר את קצב זרימת משאבת המזרק ל~1-3 μL/min כדי להבטיח זרימה של תאים בודדים דרך מערך האלקטרודות. זמן המעבר של התא בין האלקטרודות צריך להיות ~ 25 אלפיות השנייה.
- הגדר את משרעת הדופק למצב 'אופטימלי' (10.2.9), כבה את מצב ההדק והגדר את רוחב הדופק כך שיתאים לזמן המעבר של התא.
- הגדר את מחזור העבודה כך שזמן הדופק ON יתאים למצב 'אופטימלי'. עיין בטבלה 1.
- הגדר את מחולל פונקציית ערוץ הפלט למצב ON, הפעל את משאבת המזרק ואפשר למערכת לפעול עד לאלקטרופורציה של מספר התאים הרצוי.
- בסיום, כבה הן את משאבת המזרק והן את מחולל הפונקציות.
- העבירו את התאים ממאגר היציאה לתוך בקבוק/צלחת תרבית תאים בגודל מתאים, המלאה במדיית התאוששות שחוממה מראש והעבירו בקבוק/צלחת תרבית לתוך האינקובטור.
11. ניתוח
- זיהוי חלחול ממברנה ברמת התא הבודד
הערה: כדי להבטיח שנעשה שימוש בפולס 'האופטימלי' במהלך מודול התפוקה הגבוהה, יש לבצע ניתוח לאחר הניסוי כדי לאמת את הנתונים החשמליים המיוצאים מתת-סעיף 10.2. אנא עיין באיור 4 לייצוג גרפי של האות החשמלי המייצג את חלחול הממברנה עקב אלקטרופורציה.- טען נתונים לתוכנת ניתוח (MATLAB, Python וכו '). צור עלילה של זרם לעומת זמן עבור כל תנאי פועם.
- לקבוע באופן ידני את מידת החדירה של קרום התא (ΔIP/ΔI C). עיין באיור 4. צור את מפת החדירות של קרום התא (Δ IP / ΔIC לעומת אנרגיה חשמלית, איור 5) בכל תנאי הדופק שנבדקו. ודא מצב פעימה 'אופטימלי'.
- יעילות אלקטרו-טרנספקציה (eTE)
- לאחר תקופת הדגירה של 24 שעות, הסר את התאים האלקטרופואטים מהאינקובטור.
- ביצוע כתם תא חי. לדלל DRAQ5 1:1000 לריכוז סופי של 5 μM בכלי תרבית התאים. מערבבים בעדינות את התאים/תמיסת הכתמים ומדגרים בטמפרטורה של 37°C למשך 5-30 דקות.
הערה: ניתן ליישם כתם אחר בשלב זה. ודא שתכונות הפלואורסצנט אינן חופפות לסמן הפלואורסצנטי המציין העברה חשמלית מוצלחת (כלומר, GFP נמצא באורך הגל הירוק ו- DRAQ5 הוא האדום הרחוק). - הפעל מיקרוסקופ אפיפלואורסצנטי, מנורה ומצלמות (ראו טבלת חומרים).
- הוציאו את התאים מהאינקובטור והכניסו אותם למיקוד במיקרוסקופ.
- צלם תמונה עם ניגודיות פאזה (שדה בהיר) של השדה שנבחר.
- צלם תמונות אפיפלואורסצנטיות מאותו שדה באמצעות מסנני FITC (GFP) ו-Far-Red (DRAQ5). נתח את ערכות התמונות באופן ידני או באמצעות אלגוריתם.
הערה: עיין באיור 7 לקבלת תמונות מייצגות. - ספרו את המספר הכולל של תאים חיוביים ל-GFP בכל התמונות. ספרו את המספר הכולל של תאים מוכתמים ב-DRAQ5 בכל התמונות. חישוב eTE (היחס בין תאים חיוביים GFP לתאים מוכתמים ב-DRAQ5).
Access restricted. Please log in or start a trial to view this content.
תוצאות
איור 4 מדגיש את עקרונות הפעולה מאחורי זיהוי חלחול הממברנה ברמת התא הבודד עבור משרעת פעימה אחת. לאחר תחילת ניסוי האלקטרופורציה, אלגוריתם זיהוי התאים קובע סף אופטימלי לזיהוי תאים באמצעות שיטת זיהוי מבוססת שיפוע נקודה אחר נקודה. לאחר מכן המערכת מנטרת באופן רציף (1) אחר שינוי ש?...
Access restricted. Please log in or start a trial to view this content.
Discussion
המתודולוגיה המוצגת בפרוטוקול זה מתמקדת בעיקר במיקרו-פבריקציה של התקן מיקרופלואידי המשולב לאחר מכן במערך ניסויי מיוחד של אלקטרופורציה. המונח 'מתכון', המשמש לעתים קרובות כאשר מתארים את הפרטים של תהליך המיקרו-פברייקציה, רומז על החשיבות של מעקב/אופטימיזציה של כל שלב כדי לייצר בהצלחה מכשיר מת...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים רוצים להודות על תמיכה כספית של הקרן הלאומית למדע (NSF CBET 0967598, DBI IDBR 1353918) והכשרת הבוגרים של משרד החינוך האמריקאי בתחומים מתפתחים של דיוק ורפואה מותאמת אישית (P200A150131) למימון הסטודנט לתואר שני J.J.S. על המלגה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O'Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053(2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications - An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods - An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021).
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU. , Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001).
- Substrate Preparation. MicroChemicals. , Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021).
- Lisinenkova, M., Hahn, L., Schulz, J. 4M 2006 - Second International Conference on Multi-Material Micro Manufacture. , Elsevier. 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive - alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX. , Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021).
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045(2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved