A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام محلل التدفق الأيضي للخلايا في الوقت الفعلي لمراقبة الطاقة الحيوية لمنطقة العظام
In This Article
Summary
يقيس فحص التدفق الأيضي للخلايا في الوقت الفعلي معدل استهلاك الأكسجين ومعدل التحمض خارج الخلية ، والذي يتوافق مع إنتاج الميتوكوندريا والأدينوسين ثلاثي الفوسفات المحلل للسكر ، باستخدام أجهزة استشعار الأس الهيدروجيني والأكسجين. تشرح المخطوطة طريقة لفهم حالة الطاقة للخلايا العظمية وتوصيف وتفسير حالة الطاقة الحيوية الخلوية.
Abstract
يعد تكوين العظام بواسطة الأرومات العظمية عملية أساسية لاكتساب العظام بشكل صحيح ودوران العظام للحفاظ على توازن الهيكل العظمي ، وفي النهاية ، منع الكسر. من أجل تحسين ذروة كتلة العظام ومكافحة الأمراض العضلية الهيكلية المختلفة (أي هشاشة العظام بعد انقطاع الطمث ، وفقدان الشهية العصبي ، وداء السكري من النوع 1 و 2) ، بذلت جهود لا تصدق في مجال بيولوجيا العظام لتوصيف الخلايا العظمية بشكل كامل طوال عملية التمايز الخاصة بها. بالنظر إلى الدور الأساسي للخلايا العظمية الناضجة في إفراز بروتينات المصفوفة وحويصلات التمعدن ، فقد لوحظ أن هذه العمليات تأخذ كمية لا تصدق من الطاقة الخلوية ، أو الأدينوسين ثلاثي الفوسفات (ATP). غالبا ما يشار إلى الحالة العامة للطاقة الخلوية باسم الطاقة الحيوية الخلوية ، وتتضمن سلسلة من التفاعلات الأيضية التي تستشعر توافر الركيزة لاشتقاق ATP لتلبية الاحتياجات الخلوية. لذلك ، فإن الطريقة الحالية تفصل عملية عزل الخلايا اللحمية الأولية لنخاع العظم الفئراني (BMSCs) ومراقبة حالتها الحيوية باستخدام محلل التدفق الأيضي للخلايا في الوقت الفعلي في مراحل مختلفة من تمايز الخلايا العظمية. الأهم من ذلك ، أظهرت هذه البيانات أن ملف التعريف الأيضي يتغير بشكل كبير خلال تمايز الخلايا العظمية. وبالتالي ، فإن استخدام هذا النوع من الخلايا ذات الصلة من الناحية الفسيولوجية مطلوب لتقدير كامل لكيفية تنظيم حالة الطاقة الحيوية للخلية للوظيفة العامة.
Introduction
ويرافق تكوين العظام بواسطة الأرومة العظمية تدمير منسق أو ارتشاف العظام بواسطة الخلايا الآكلة للعظام. التوازن بين تكوين العظام العظمية الأرومية وارتشاف الخلايا العظمية هو عملية مقترنة تصف دوران العظام أو إعادة تشكيلها ، وهو أمر ضروري لتوازن الهيكل العظمي. يؤدي خلل العظام إلى ضعف تكوين العظام ويؤدي إلى أمراض مختلفة ، بما في ذلك هشاشة العظام1،2،3. يؤدي التمايز خارج الجسم الحي / في المختبر للخلايا الجذعية اللحمية لنخاع العظم (BMSCs) إلى سلائف الخلايا العظمية العظمية والأرومات العظمية الناضجة إلى تكوين وترسب مصفوفة العظام المعدنية في وعاء الاستزراع بمرور الوقت4،5،6. يتطلب تكوين العظام هذا بواسطة الأرومة العظمية كمية كبيرة من الطاقة الخلوية. على وجه التحديد ، ثبت أن تخليق الكولاجين وإفرازه يعتمدان بشكل كبير على ATP الخلوي: نسب ADP ، ومن المفترض أن يتطلب الاتجار بالحويصلات المعدنية وإفرازهاATP إضافيا 7,8,9,10,11. وقد أثبت العديد من الباحثين أن عملية تكوين الخلايا الأرومية العظمية ووظيفة الأرومة العظمية تتطلب إمدادات كافية من الطاقة لتلبية الطلب الأيضي لتشكيل العظام12،13،14،15،16. لذلك ، فإن الهدف من هذه الطريقة هو توصيف حالة الطاقة الحيوية للخلايا اللحمية الأولية الفئرانية طوال تمايز الخلايا العظمية باستخدام محلل التدفق الأيضي للخلية في الوقت الفعلي. تساعد هذه التقنيات في تطوير فهم أفضل لتوازن الهيكل العظمي ، مما قد يؤدي في النهاية إلى تطوير خيارات علاجية جديدة قادرة على تحسين اضطرابات الهيكل العظمي.
يمكن استخدام محلل التدفق الأيضي للخلايا في الوقت الفعلي لقياس معدل استهلاك الأكسجين (OCR) ومعدل التحمض خارج الخلية (ECAR) للخلايا العظمية الحية ، والتي تتوافق مع إنتاج الميتوكوندريا و ATP المحللة للسكر ، على التوالي. من الأمور الأساسية لهذه المنهجية حقيقة أن أيون H+ واحد لكل لاكتات يتم إطلاقه أثناء تحلل السكر في تحويل الجلوكوز إلى لاكتات ، مما يغير درجة الحموضة في الوسائط المنعكسة في قيم ECAR. على العكس من ذلك ، خلال دورة TCA (حمض ثلاثي الكربوكسيليك) ، تنتج الفسفرة التأكسدية عبر الميتوكوندريا ثاني أكسيد الكربون2 عن طريق استخدام أو استهلاك الأكسجين ، وبالتالي فإن مراقبة OCR تعكس عملية التمثيل الغذائي هذه. يقيس المحلل كلا من OCR و ECAR في البيئة الدقيقة خارج الخلية في وقت واحد وفي الوقت الفعلي ، مما يسمح بإمكانات هائلة عند دراسة الطاقة الحيوية الخلوية 6,17. بالإضافة إلى ذلك ، فإن إجراء هذه الفحوصات بسيط نسبيا ويمكن تخصيصه بسهولة اعتمادا على الهدف التجريبي. تم استخدام تقنيات مماثلة لزيادة فهم التنظيم الأيضي للخلايا التائية للجهاز المناعي18,19 ، وبدء السرطان ، والتقدم 20 ، إلى جانب أنواع متعددة من الخلايا الأخرى التي تساهم في متلازمات التمثيل الغذائي21,22.
تشمل مزايا محلل التدفق الأيضي في الوقت الفعلي على التقنيات البديلة (1) القدرة على قياس الطاقة الحيوية الخلوية للخلايا الحية في الوقت الفعلي ، (2) القدرة على إجراء الفحص مع عدد صغير نسبيا من الخلايا (يتطلب ما يصل إلى 5000 خلية) ، (3) منافذ الحقن لمعالجة العلاجات المتعددة بالتوازي في نظام 96 بئرا عالي الإنتاجية ، (4) استخدام جهاز تصوير الخلايا الآلي الخالي من الملصقات المشعة للتطبيع18 ، 23,24. تهدف الطرق التالية إلى توفير وصف معمم ولكن مفصل لمراقبة الطاقة الحيوية الخلوية في BMSCs الفئران طوال تمايز الخلايا العظمية باستخدام المحلل. وسوف تشمل الفحوص التي تجرى بشكل روتيني. ومع ذلك ، كما هو الحال مع العديد من التقنيات والأساليب ، من المشجع للغاية أن تحدد المختبرات الفردية تفاصيل محددة لتجاربها.
اختيار المقايسة وأنواع مختلفة من المقايسات المتاحة: تتوفر مجموعة واسعة من مجموعات المقايسة والكواشف لدراسة الطاقة الحيوية للخلايا مع ضمان موثوقية واتساق النتائج التجريبية. بالإضافة إلى ذلك ، يوفر برنامج سطح المكتب أيضا قوالب فحص يمكن تخصيصها بسهولة. يمكن تعريف الفحص بناء على احتياجات المستخدم لقياس معلمات التمثيل الغذائي المختلفة. يمكن تعديل هذه الفحوصات بطرق مختلفة بناء على الهدف التجريبي و / أو السؤال العلمي. على سبيل المثال ، مع أربعة منافذ حقن ، يمكن حقن مركبات متعددة في وسائط الفحص لتحليل الاستجابة الخلوية الخاصة بكل مسار استقلابي.
اختبار النمط الظاهري لطاقة الخلية: يقيس هذا الفحص النمط الظاهري الأيضي للخلايا الحية وإمكانات التمثيل الغذائي. يوصى أيضا بإجراء هذا الفحص كخطوة أولى للحصول على فكرة عامة عن التمثيل الغذائي الخاص بالمسار. يتم حقن خليط من أوليغوميسين A-مثبط من سينثاز ATP وسيانيد الكربونيل 4-(ثلاثي فلوروميثوكسي) فينيل هيدرازون (FCCP) - وهو عامل فك ارتباط الميتوكوندريا لفهم إمكانات طاقة الخلية. حقن oligomycin A يمنع تخليق ATP ، مما يؤدي إلى زيادة في معدل تحلل السكر (ECAR) لتمكين الخلايا من تلبية احتياجاتها من الطاقة ؛ من ناحية أخرى ، يؤدي حقن FCCP إلى ارتفاع OCR بسبب إزالة استقطاب غشاء الميتوكوندريا. في الأساس ، يصور هذا الفحص التنفس الأيضي الأساسي ، وبعد الحقن المزدوج أو الدفع أو الإجهاد ، الاستجابة الأيضية. بناء على هذه المعلمات ، يقوم البرنامج بعد ذلك برسم OCR و ECAR للخلايا عن طريق تصنيف الخلايا على أنها حالة هوائية أو هادئة أو تحلل السكر أو نشطة بمرور الوقت25,26.
ATP في الوقت الحقيقي معدل الإنتاج: هذا يقيس إنتاج ATP الخلوي في وقت واحد من تحلل السكر والتنفس الميتوكوندريا. يقيس هذا الفحص كميا التحولات الأيضية من مساري الطاقة ويوفر بيانات عن معدلات إنتاج ATP للميتوكوندريا وتحلل السكر بمرور الوقت. يحصل الفحص على بيانات OCR و ECAR القاعدية متبوعة بحساب معدل إنتاج ATP الميتوكوندريا من خلال حقن oligomycin A ومعدل إنتاج ATP المحلل للسكر من خلال حقن خليط rotenone + antimycin A (التثبيط الكلي لوظيفة الميتوكوندريا) ، مما يؤدي إلى تحمض الميتوكوندريا17,27.
اختبار إجهاد الميتوكوندريا الخلوية (أو اختبار إجهاد ميتو الخلوي): هذا يقيس وظيفة الميتوكوندريا من خلال التنفس المرتبط ب ATP ، ويحدد كمية الطاقة الحيوية الخلوية ، ويحدد خلل الميتوكوندريا ، ويقيس استجابة الخلايا للإجهاد. يمكن الحصول على معلمات مختلفة ، بما في ذلك القدرة التنفسية القاعدية والاحتياطية ، والتنفس المرتبط ب ATP ، والتنفس الأقصى ، واستهلاك الأكسجين غير الميتوكوندريا ، في فحص واحد. يتضمن هذا الفحص حقن متسلسلة من oligomycin A ، FCCP (عامل فك ارتباط الميتوكوندريا) ، وهو مزيج من مثبطات الروتينون / antimycin A لتحليل تأثير هذه بكفاءة على وظيفة الميتوكوندريا28.
اختبار مرونة ميتو للوقود المرن: هذا يقيس معدل التنفس الميتوكوندريا عن طريق أكسدة وقود الميتوكوندريا الرئيسي الثلاثة من خلال وجود وغياب مثبطاتها. يساعد التثبيط المتسلسل للجلوكوز والجلوتامين والأحماض الدهنية في قياس اعتماد الخلايا وقدرتها ومرونتها واعتماد الخلايا في مسارات خلوية مختلفة لتلبية الطلب على الطاقة. عندما لا تستطيع الميتوكوندريا تلبية متطلبات المسار المسدود للاهتمام عن طريق أكسدة أنواع الوقود الأخرى ، تدخل الخلايا في حالة تبعية. يتم حساب قدرة الخلايا عن طريق تثبيط المسارين البديلين الآخرين متبوعا بتثبيط مسار الاهتمام. تساعد مرونة الخلايا في فهم قدرة الميتوكوندريا على تعويض وتلبية احتياجات الوقود للمسار المثبط. يتم حسابه عن طريق طرح تبعية الخلايا من قدرة الخلايا. يتم استخدام ثلاثة مثبطات مختلفة بشكل مستقل أو كمزيج من اثنين لحساب معلمات الفحص بشكل فعال. 2-سيانو-3-(1-فينيل-1H-إندول-3-يل)-2-حمض البروبينويك (UK5099) يمنع أكسدة الجلوكوز عن طريق منع الناقل البيروفات في تحلل السكر. Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl) (BPTES) يمنع كبريتيد الإيثيل مسار أكسدة الجلوتامين ، ويمنع etomoxir أكسدة الأحماض الدهنية طويلة السلسلة29.
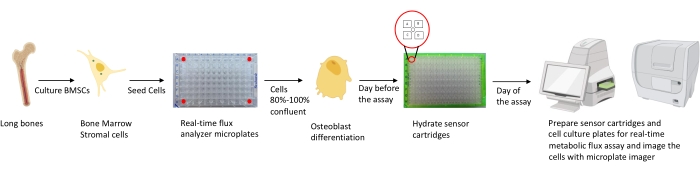
الشكل 1: التمثيل التخطيطي لمنهجية زراعة وإعداد الخلايا العظمية للتحليل. يتم عزل المورين BMSCs من العظام الطويلة ، وزرعها ، وزرعها في صفائح 96 بئرا بكثافة 25000 خلية / بئر. يبدأ زراعة هذه الخلايا في وسائط Osteoblast المحددة عندما تصل إلى 80٪ -100٪ من الالتقاء لبدء تمايزها. يتم إجراء الفحوصات في مراحل مختلفة من التمايز. يتم ترطيب ألواح الخرطوشة قبل يوم واحد من الفحص. في يوم الفحص ، يتم حقن مثبطات مختلفة في منافذ خراطيش المستشعر بناء على متطلبات الفحص ، ويضاف مخزن مؤقت للمعايرة إلى لوحة المعايرة المكونة من 96 بئرا. بعد المعايرة ، يتم إجراء اختبار التدفق الأيضي للخلية في الوقت الفعلي ، يليه تصوير الصفيحة الدقيقة لزراعة الخلايا باستخدام جهاز تصوير الصفائح الدقيقة لتطبيع بيانات محلل التدفق الأيضي للخلية في الوقت الفعلي مع عدد الخلايا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
استندت جميع الإجراءات إلى المبادئ التوجيهية وموافقة لجنة رعاية واستخدام الحيوانات المؤسسية في المركز الطبي بجامعة فاندربيلت.
1. إعداد الكواشف وإعداد المقايسة
- عزل وزراعة الخلايا اللحمية نخاع العظم (انظر أيضا المادة30 السابقة).
- قم بإعداد وسائط كاملة لزراعة الخلايا الأساسية الدنيا من ألفا (αMEM) عن طريق استكمال الحد الأدنى من الوسائط الأساسية بتعديل ألفا مع 10٪ FBS (مصل البقر الجنيني) ، و 100 U / مل من البنسلين ، و 100 ميكروغرام / مل من الستربتومايسين.
- قم بإعداد أنبوب جمع نخاع العظم عن طريق تقليم نهاية أنبوب الطرد المركزي الدقيق 0.6 مل بحيث يمكن للخلايا المرور عبره وإدخاله في أنبوب طرد مركزي دقيق 1.5 مل يحتوي على 100 ميكرولتر من αMEM الكامل.
- القتل الرحيم للفئران باستخدام علاج CO2 على النحو التالي. ضع الحيوان في غرفة CO 2 لمدة2-3 دقائق أو حتى يتوقف التنفس. انتظر لمدة 1 دقيقة على الأقل بعد أن يصبح الحيوان فاقدا للوعي لإزالة الفئران من الغرفة وخلع عنق الرحم.
- باستخدام ملقط معقم وزوج من المقصات ، قم بقطع أسفل البطن للفئران التي تم قتلها الرحيم لإجراء شق صغير. عزل العظام الطويلة (عظم الفخذ والساق والقمة الحرقفية) للفئران.
- تقليم العظام الطويلة لإزالة جميع الأنسجة الرخوة. بمجرد تنظيف العظم ، اقطع ~ 1-2 مم من الأطراف البعيدة والقريبة لإنشاء فتحة للنخاع للتدفق.
ملاحظة: يجب أن تكون هذه الفتحة متحفظة لتجنب فقدان النخاع مع السماح له بالخروج. - ضع العظام في أنبوب تجميع يحتوي على 100 ميكرولتر من 1x PBS معقم (محلول ملحي مخزن بالفوسفات) لعزل نخاع العظم الكلي.
- اغسل النخاع عن طريق الطرد المركزي عند 10000 × g لمدة 15-20 ثانية في درجة حرارة الغرفة. خلايا النخاع بيليه في الجزء السفلي من الأنبوب.
- كرر الطرد المركزي حتى يظهر تجويف العظام أبيض وخالي من معظم عناصر النخاع. أعد تعليق المجموعة المختلطة من نخاع العظم عن طريق السحب بلطف لأعلى ولأسفل.
- استزرع الخلايا من واحد (عظم الفخذ والساق) في قارورة زراعة خلية 75 سم 2 في 10 مل من وسائط زراعة الخلايا واحتضنها عند 37 درجة مئوية في حاضنة زراعة الخلايا مع 5٪ CO2. إذا تم تجميع الخلايا من 2-3 ، فاستخدم قارورة زراعة خلايا 150 سم2 (مستحسن).
- بعد 24-48 ساعة من حضانة السكان المختلطين ، قم بشفط مجموعة الخلايا المكونة للدم غير الملتصقة الموجودة داخل وسائط الثقافة واغسل الخلايا الملتصقة ب 1x PBS.
- بذر الخلايا من BMSCs وتمايز الخلايا العظمية
- قم بالتريبسين على الخلايا الملتصقة بإضافة ما يكفي من 0.25٪ من التربسين - EDTA (حوالي 3-4 مل) لتغطية سطح القارورة قليلا ، تليها حضانة لمدة 3 دقائق عند 37 درجة مئوية.
- أضف 6-7 مل من αMEM الكامل إلى القارورة / التربسين لإعادة تعليق BMSCs الملتصقة عن طريق السحب بعناية لأعلى ولأسفل. نقل تعليق BMSC إلى أنبوب طرد مركزي مخروطي.
- قم بإزالة أليكوت 50 ميكرولتر من تعليق BMSC وأضف 50 ميكرولتر من التربان الأزرق (تخفيف 1: 1) إليه. احسب العدد الإجمالي للخلايا القابلة للحياة التي تستبعد الصبغة عن طريق سحب 10 ميكرولتر من هذا الخليط على مقياس دمية الدم ومراقبته تحت المجهر. لا تحسب أي خلايا ميتة أو غير صحية تظهر زرقاء اللون (<10٪ خلايا).
- استنادا إلى عدد الخلايا ، احسب حجم تعليق الخلية في αMEM الكامل اللازم لتركيز نهائي قدره 2.4 × 106 خلايا / مل لحجم إجمالي لا يقل عن 10 مل لكل لوحة.

الشكل 2: الصفائح الدقيقة لزراعة الخلايا ، المصممة خصيصا للمحلل . (أ) يتم تمييز آبار تصحيح الخلفية الأربعة ، A1 ، A12 ، H1 ، H12. تحتوي هذه الآبار فقط على وسائط الفحص دون أي خلايا. (ب) الباركود الموجود على جانب اللوحة لمسح اللوحة ضوئيا باستخدام قارئ التصوير والمحلل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- الطرد المركزي للخلايا في الأنبوب المخروطي عند 1000 × g لمدة 5 دقائق وإعادة تعليق الخلايا إلى التركيز النهائي المطلوب من 2.4 × 106 خلايا / مل.
- انقل تعليق الخلية إلى خزان ، وباستخدام ماصة متعددة القنوات ، أعد تعليق الخلايا بعناية لضمان خليط متجانس من الخلايا.
- البذور 2.5 × 104 خلايا لكل بئر في الصفائح الدقيقة لزراعة الخلايا المكونة من 96 بئرا مع 80 ميكرولتر من αMEM الكامل. لا تزرع الخلايا في آبار تصحيح الخلفية (A1 ، A12 ، H1 ، H12) ؛ بدلا من ذلك ، ما عليك سوى إضافة الوسط في هذه الآبار الأربعة.
ملاحظة: يتم طلاء BMSCs للمقايسات في لوحة صغيرة لزراعة الخلايا من 96 بئرا مصممة للمحلل بالاقتران مع خراطيش المستشعر. تختلف مساحة سطح هذه الألواح عن لوحة 96 بئرا عادية. تبلغ مساحة سطح كل بئر في اللوحة 0.106 سم2 ، أي ما يقرب من 40٪ من مساحة اللوحة النموذجية المكونة من 96 بئرا. يتم اختيار كثافة بذر الخلايا المثلى بناء على نوع الخلية. عادة ، يمكن للمحلل اكتشاف ما بين 0.5-4 × 104 خلايا لكل بئر. يجب أن تكون الخلايا العظمية على اتصال للتمييز بشكل فعال. لهذا الغرض ، تم اختيار الطلاء بين 2.0 × 10 4-3.0 × 104 BMSCs / بئر في 80 ميكرولتر من αMEM الكامل. - حرك اللوحة بلطف لضمان التوزيع المتساوي للخلايا في الآبار واحتضنها عند 37 درجة مئوية ، 5٪ CO2. تحقق من نمو الخلايا وتلاقي الخلايا تحت المجهر بعد 48 ساعة. قم بتغيير وسائط زراعة الخلايا إذا لزم الأمر.
- اعتمادا على الهدف من الفحص ، عندما تكون BMSCs ملتقية بنسبة 60٪ -80٪ (عادة 48-72 ساعة) ، ابدأ في تمايز الخلايا العظمية عن طريق تغيير وسائط تمايز الخلايا إلى وسائط تمايز الأرومة العظمية (αMEM كاملة تستكمل ب 5 mM β-glycerol phosphate و 50 ميكروغرام / مل من حمض الأسكوربيك L).
- إذا كان من المقرر تحليل الخلايا اللحمية غير المتمايزة (اليوم 0) ، فحافظ على الخلايا تحت αMEM كاملة.
- قم بتغيير وسائط تمايز الخلايا العظمية كل يومين وتصور الخلايا تحت المجهر للتأكد من أنها صحية حتى يوم الفحص. يفضل ، قبل 24 ساعة من الفحص المقرر ، تغيير الوسائط والحفاظ على جدول زمني ثابت للتغيير المتوسط (مستحسن).
ملاحظة: قم بتغيير الوسائط بعناية عن طريق إمالة الألواح قليلا بزاوية. هذا يتجنب الاتصال العرضي لنصائح الماصة بألواح زراعة الخلايا وتعطيل الطبقة الأحادية من الخلايا.
2. إعداد خرطوشة الاستشعار لمعايرة التدفق خارج الخلية
- قم بترطيب خراطيش المستشعر من مجموعة الفحص خارج الخلية قبل يوم الفحص. قم بإزالة خراطيش المستشعر (اللوحة الخضراء) ووضع المستشعرات رأسا على عقب.
- باستخدام ماصة متعددة القنوات ، أضف 200 ميكرولتر من H2O إلى كل بئر من لوحة المرافق. ضع خراطيش المستشعر بعناية مرة أخرى على لوحة المرافق واحتضن اللوحة طوال الليل في درجة حرارة الغرفة.
ملاحظة: توصي الشركة المصنعة باحتضان خراطيش المستشعر في حاضنة غير CO2 37 °C بين عشية وضحاها. ومع ذلك ، يمكن أن يحدث تبخر كبير لخراطيش المستشعر. إذا حدث هذا ، يمكن تحضين خراطيش المستشعر في درجة حرارة الغرفة. يجب احتضان هذه الألواح لمدة لا تقل عن 4 ساعات وبحد أقصى 72 ساعة. - في يوم الفحص ، تخلص من H2O من لوحة الأداة المساعدة وأضف 200 ميكرولتر من المعايرة. احتضان لوحة المرافق لمدة 1 ساعة على الأقل قبل الفحص.
3. في الوقت الحقيقي خلية الأيض تدفق محلل إعداد الوسائط
- استخدم وسائط DMEM الخالية من الفينول الأحمر مع درجة حموضة معدلة مسبقا تبلغ 7.4 (مستحسن) لتشغيل الفحص باستخدام BMSCs.
- قم بإعداد 80 مل من وسائط الفحص عن طريق استكمال وسائط DMEM ببيروفات الصوديوم 1 mM ، والجلوتامين 2 mM ، والجلوكوز 10 mM ، والأنسولين 200 nM ، وحمض الأوليك BSA 50-200 ميكرومتر.
- احتضان وسائط الفحص الكاملة عند 37 درجة مئوية في حمام مائي.
4. إعداد المركبات لخراطيش الاستشعار
- إذابة الأوليغوميسين A والروتينون ومضاد المايسين A على الجليد. ماصة لأعلى ولأسفل لإذابة المركبات قبل الاستخدام.
- أضف 3 مل من وسط الفحص المحضر إلى كل أنبوب ، متبوعا بإضافة الأنبوب المركب المعني A: 26.4 ميكرولتر من 2.5 mM oligomycin A ؛ أنبوب B: 3.1 ميكرولتر من 12.67 mM rotenone + 4.1 ميكرولتر من 9.4 mM antimycin A + 30 μL Hoechst stain.
- قم بتحميل تركيز 10x لهذه المثبطات في المنفذ المقابل. التركيز النهائي لمحاليل الحقن اللازمة هو 2 ميكرومتر من oligomycin A ، و 1 ميكرومتر من الروتينون ، و 4.1 ميكرومتر من antimycin A.
ملاحظة: يضاف Hoechst إلى منفذ الحقن النهائي لتلطيخ النوى بالفلورسنت لأغراض التصوير والتطبيع. يمكن تحسين هذه التركيزات بناء على نوع الخلية. - تحميل 20 ميكرولتر من هذه المركبات في الخلايا في 180 ميكرولتر من وسائط المقايسة.
5. إعداد microplate زراعة الخلايا للفحص
- قم بإزالة الصفيحة الدقيقة لزراعة الخلايا من الحاضنة التي تبلغ درجة حرارتها 37 درجة مئوية وراقب الخلايا تحت المجهر.
- قم بإزالة وسيط الفحص من الحمام المائي.
- اغسل الخلايا بلطف مع 200 ميكرولتر من المقايسة المتوسطة مرتين وأضف 200 ميكرولتر من وسائط الفحص لكل بئر.
ملاحظة: بمجرد إضافة وسائط الفحص النهائية إلى الخلايا ، يكون الوقت حتى تدخل الألواح إلى المحلل أمرا بالغ الأهمية. لذلك، لا تبدأ في استبدال الوسائط حتى يتم تنفيذ الخطوات التالية في غضون 1 ساعة. - تحقق من الخلايا تحت المجهر للتأكد من أن الخلايا تظل ملتصقة بالآبار.
- تأكد من أن الخلايا في D5 و E8 ملتصقة بطبقة أحادية متسقة ولم يتم غسلها أثناء خطوة الغسيل. يستخدم برنامج التصوير الخلوي هذين البئرين لضبط التركيز البؤري التلقائي والتعرض التلقائي.
ملاحظة: توصي الشركة المصنعة باحتضان اللوحة في حاضنة غير CO2 37 °C لمدة 1 ساعة ؛ يمكن تخطي هذه الخطوة إذا كان التصوير الآلي مفضلا. على سبيل المثال، يحافظ جهاز تصوير الصفائح الدقيقة على نفس الظروف في غرفة مغلقة، ويمكن تصوير الخلايا تحت حقل ساطع.
6. إعداد الفحص والتصوير
الشكل 3: برنامج وحدة التحكم. يتحقق البرنامج من توصيل الجهاز ويتم ضبطه على 37 درجة مئوية. يمكن تحديد ملفات القالب للمقايسات المختلفة التي يمكن إجراؤها باستخدام محلل التدفق خارج الخلية لتخصيص الفحص بشكل أكبر بناء على الأهداف التجريبية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- افتح برنامج سطح المكتب في الكمبيوتر بجوار الجهاز.
- تحقق من حالة الاتصال في الزاوية السفلية اليمنى من برنامج وحدة التحكم.
- انتقل إلى القوالب وحدد ملف قالب مقايسة معدل XF ATP أو قالب الفحص المناسب.
- حدد تعريفات المجموعة في أعلى الشاشة وحدد المجموعات.
- حدد تخطيط خريطة اللوحة وقم بتعيين الآبار اعتمادا على المجموعات المحددة.
- تحقق من بروتوكول الصك ، وتأكد من أن المركبات المضافة مدرجة بشكل صحيح ، وتضمين معلومات المشروع للمراجع المستقبلية.
- انقر فوق تشغيل الفحص. سيؤدي ذلك إلى المطالبة بتحديد موقع تخزين ملف النتيجة.
- حدد الموقع لحفظ ملف النتيجة.
- احفظ الملف بتاريخ الفحص وانقر فوق بدء التشغيل.
- ضع خرطوشة المستشعر ولوحة الأداة المساعدة على الدرج وانقر فوق "أنا مستعد لبدء المعايرة".
- قبل بدء المعايرة، تأكد من إزالة غطاء الخرطوشة، ووضع خرطوشة المستشعر في الاتجاه الصحيح على لوحة الأداة المساعدة. ستستغرق هذه الخطوة من 10 إلى 20 دقيقة ، وبمجرد اكتمالها ، سيعرض البرنامج مربع الحوار Load Cell Plate .
7. الحصول على صور برايتفيلد
ملاحظة: هذه الخطوة اختيارية. في حالة عدم توفر معدات تصوير، انتقل إلى الخطوة 8.

الشكل 4: يتصل برنامج التصوير الخلوي بقارئ التصوير من خلال الكمبيوتر. يمكن تصوير الخلايا الموجودة في الصفيحة الدقيقة قبل وبعد الفحص ، ويتم الحصول على عدد الخلايا / البئر بعد الفحص لتطبيع البيانات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- افتح برنامج تصوير الخلايا على الكمبيوتر.
- تأكد من تشغيل جهاز تصوير اللوحة الدقيقة وتوصيل المنافذ بالكمبيوتر.
- تحقق من شريط الحالة في أسفل يسار الشاشة للتأكد من ضبط درجة الحرارة على 37 درجة مئوية وأنه يجب تمييز حالة الاتصال باللون الأخضر كجاهزة.
- امسح الرمز الشريطي للوحة لبدء عملية التصوير.
- أدخل اسما إلى لوحة الخلية واضغط على حفظ (هذا هو الاسم الذي سيتم فيه حفظ كل من الحقل الساطع والصور الفلورية). انقر فوق إجراء مسح برايتفيلد.
- تعرض الشاشة التالية واللوحة وقائمة المسح الضوئي خيارات التصوير. قبل الفحص، حدد بدء فحص برايتفيلد.
- ضع الصفيحة الدقيقة لزراعة الخلايا مع غطاء/غطاء اللوحة على حامل الدرج وقم بمحاذاة A1 جيدا مع علامة A1. انقر على إغلاق الدرج.
- تظهر الشاشة التالية، اكتساب صورة برايتفيلد، مع خريطة لوحة. انقر فوق مسح جميع الآبار ، والذي يبدأ عملية تهيئة النظام متبوعة ب 30 إلى 35 دقيقة من الفحص.
- بعد فحص brightfield ، قم بإزالة الصفيحة الدقيقة لزراعة الخلايا وضعها في المحلل لإجراء الفحص.
8. تشغيل الفحص
- بمجرد اكتمال المعايرة، يعرض البرنامج مربع الحوار لوحة خلية التحميل .
- انقر فوق فتح الدرج لاستبدال درج الأدوات المساعدة بلوحة صغيرة لزراعة الخلايا. تأكد من إزالة الغطاء وتناسب A1 من اللوحة في الاتجاه الصحيح.
- ثم انقر فوق تحميل لوحة الخلية لبدء الفحص. ستبقى خرطوشة المستشعر داخل المحلل لحقن الفحص.
- انتظر حتى يبدأ الفحص ويعرض الوقت المقدر للإكمال.
- عند الانتهاء من الفحص ، يعرض البرنامج مربع حوار Unload Sensor Cartridge . انقر فوق إخراج وإزالة microplate مزرعة الخلايا من المحلل.
- قم بإزالة خرطوشة المستشعر بعناية واستبدل غطاء لوحة الخلية. الخلايا جاهزة للتصوير الفلوري وعد الخلايا.
- بعد إزالة لوحة الخلية وخرطوشة المستشعر، يظهر مربع الحوار إكمال المقايسة .
- انقر فوق عرض النتائج لفتح ملف نتيجة الفحص وتطبيع البيانات على الفور أو انقر فوق الصفحة الرئيسية.
9. الحصول على صور التألق وتطبيعها
ملاحظة: هذه الخطوة هي طريقة اختيارية ولكنها مفضلة لتطبيع BMSCs و osteoblasts. إذا لم تكن معدات التصوير متوفرة ، فيجب إجراء طريقة تطبيع أخرى ، مثل عزل البروتين أو الحمض النووي وتحديده كميا.

الشكل 5: صور تمثيلية من برنامج التصوير المستخدم لتطبيع البيانات من الفحص . (أ) صورة حقل ساطع مخيطة تظهر التقاء الخلية في جميع أنحاء البئر بأكمله. (ب) صورة فلورية مخيطة تظهر نوى هويخت الملطخة بالخلايا العظمية المستخدمة في عد أعداد الخلايا لتطبيع نتائج الفحص. هذه هي الخلايا العظمية بعد 7 أيام من التمايز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- بعد الانتهاء من الفحص ، امسح الرمز الشريطي للوحة باستخدام قارئ الباركود المحمول باليد. إذا تم تصوير اللوحة بالفعل ، فلن تتطلب اسما جديدا.
- حدد التألق وعدد الخلايا ، ضع لوحة الخلية على حامل الدرج ، وانقر فوق إغلاق الدرج.
- في نافذة الحصول على الصورة، حدد مسح جميع الآبار ضوئيا لبدء التصوير. يستغرق التصوير الفلوري حوالي 15-20 دقيقة لمسح اللوحة بأكملها. لاحظ علامة التجزئة الخضراء التي تشير إلى اكتمال الفحص.
- راجع الصور الفلورية وعدد الخلايا في تطبيق التصوير وتصوير الخلايا عن طريق النقر عشوائيا على اثنين من الآبار.
ملاحظة: هناك خيار لعرض الخلايا التي تم حسابها في أسفل يسار الشاشة. يعرض هذا الخيار صورة مقنعة، مع تمييز الكائنات التي تم حسابها. - بمجرد اكتمال التصوير الفلوري ، قم بتصدير الصور للحصول على مراجع إضافية.
- بمجرد اكتمال التصوير وعدد الخلايا ، افتح ملف النتائج وانقر فوق تطبيع. ستعطي شاشة التطبيع تخطيط اللوحة وخيارا لاستيراد عدد الخلايا.
- انقر فوق استيراد وحدد تطبيق للحصول على برنامج سطح المكتب لتطبيع الفحص مع عدد الخلايا تلقائيا.
Access restricted. Please log in or start a trial to view this content.
النتائج
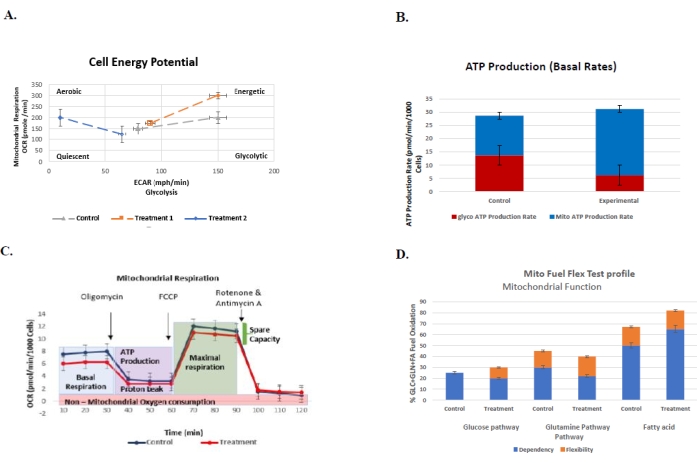
الشكل 6: الرسوم البيانية التمثيلية للفحوصات التي يتم إجراؤها بشكل روتيني لفهم ملف تعريف الطاقة الحيوية الخلوية لمجموعة التحكم مقابل العلاج مع الأخطاء القياسية الخاصة بكل منها . (أ) اختب...
Access restricted. Please log in or start a trial to view this content.
Discussion
يمكن استخدام محلل التدفق الأيضي للخلايا في الوقت الفعلي لاستكشاف الطاقة الخلوية في ظل ظروف مختلفة. يوضح البروتوكول العزل الفعال ل BMSCs ، وزراعة الخلايا في لوحات زراعة الخلايا المناسبة ، وتمايزها إلى الخلايا العظمية الناضجة ، والتي يمكن استخدامها لمختلف الفحوصات باستخدام محلل التدفق خارج ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل المعهد الوطني للصحة (NIH) والمعهد الوطني لالتهاب المفاصل والأمراض العضلية الهيكلية والجلدية (NIAMS) منحة AR072123 والمعهد الوطني للشيخوخة (NIA) منحة AG069795 (إلى ERR).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma - Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma - Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma - Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma - Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma - Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma - Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma - Aldrich | O3008 | |
| Oligomycin A - 5 mg | Sigma - Aldrich | 75351 | |
| Rotenone | Sigma - Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies - BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
References
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073(2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, Clifton, N.J. 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1(2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918(2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081(2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511(2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- What are the advantages of using Seahorse XF technology. , Available from: https://www.agilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- XF cell energy phenotype test. , Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021).
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, Clifton, N.J. 285-293 (2018).
- XF ATP rate assay. , Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021).
- XF cell mito stress test. , Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021).
- XF cell mito fuel flex test. , Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021).
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750(2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004(2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved