Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Osteoblast Biyoenerjetik Teknolojilerini İzlemek için Gerçek Zamanlı Hücre Metabolik Akı Analizörünü Kullanma
Bu Makalede
Özet
Gerçek zamanlı hücre metabolik akısı testi, pH ve oksijen sensörlerini kullanarak mitokondriyal ve glikolitik adenozin trifosfat üretimine karşılık gelen oksijen tüketim oranını ve hücre dışı asitleşme oranını ölçer. Bu yazıda osteoblastların enerji durumunu ve hücresel biyoenerjetik durumun karakterizasyonu ve yorumlanmasını anlamak için bir yöntem açıklanmaktadır.
Özet
Osteoblastlarla kemik oluşumu, iskelet homeostazını korumak ve nihayetinde kırılmayı önlemek için uygun kemik edinimi ve kemik döngüsü için gerekli bir süreçtir. Hem pik kemik kütlesini optimize etmek hem de çeşitli kas-iskelet sistemi hastalıklarıyla (yani menopoz sonrası osteoporoz, anoreksiya nervoza, tip 1 ve 2 diabetes mellitus) mücadele etmek amacıyla, kemik biyolojisi alanında, osteoblastları farklılaşma süreçleri boyunca tam olarak karakterize etmek için inanılmaz çabalar sarf edilmiştir. Olgun osteoblastların matriks proteinlerini ve mineralizasyon veziküllerini salgılamadaki birincil rolü göz önüne alındığında, bu işlemlerin inanılmaz miktarda hücresel enerji veya adenozin trifosfat (ATP) aldığı belirtilmiştir. Genel hücresel enerji durumu genellikle hücresel biyoenerjetik olarak adlandırılır ve hücresel ihtiyaçları karşılamak için ATP'yi türetmek için substrat kullanılabilirliğini algılayan bir dizi metabolik reaksiyon içerir. Bu nedenle, mevcut yöntem, osteoblast farklılaşmasının çeşitli aşamalarında Gerçek zamanlı hücre metabolik akı analizörü kullanarak birincil, murin kemik iliği stromal hücrelerinin (BMSC'ler) izole edilmesi ve biyoenerjetik durumlarının izlenmesi sürecini detaylandırmaktadır. Önemli olarak, bu veriler metabolik profilin osteoblast farklılaşması boyunca dramatik bir şekilde değiştiğini göstermiştir. Bu nedenle, fizyolojik olarak ilgili bu hücre tipinin kullanılması, bir hücrenin biyoenerjetik durumunun genel işlevi nasıl düzenleyebileceğini tam olarak anlamak için gereklidir.
Giriş
Osteoblast tarafından kemik oluşumuna, kemiklerin osteoklastlar tarafından koordineli yıkımı veya emilimi eşlik eder. Osteoblastik kemik oluşumu ve osteoklast rezorpsiyonu arasındaki denge, iskelet homeostazı için gerekli olan kemik döngüsünü veya yeniden şekillenmesini tanımlayan birleştirilmiş bir süreçtir. Osteoblast disfonksiyonu kemik oluşumunun bozulmasına yol açar ve osteoporoz 1,2,3 dahil olmak üzere çeşitli hastalıklarla sonuçlanır. Kemik iliği stromal kök hücrelerinin (BMSC'ler) osteoblast öncüllerine ve olgun osteoblastlara ex vivo/in vitro farklılaşması, zamanla kültür damarında mineralize kemik matriksinin oluşması ve birikmesi ile sonuçlanır 4,5,6. Osteoblast tarafından yapılan bu kemik oluşumu önemli miktarda hücresel enerji gerektirir. Spesifik olarak, kollajen sentezi ve sekresyonunun hücresel ATP'ye büyük ölçüde dayandığı gösterilmiştir: ADP oranları ve muhtemelen mineralize vezikül kaçakçılığı ve sekresyonu ek ATP 7,8,9,10,11 gerektirir. Birçok araştırmacı, osteoblastogenez ve osteoblast fonksiyonu sürecinin, kemik oluşumunun metabolik talebini karşılamak için yeterli bir enerji kaynağı gerektirdiğini göstermiştir 12,13,14,15,16. Bu nedenle, bu yöntemin amacı, gerçek zamanlı hücre metabolik akı analizörünü kullanarak osteoblast farklılaşması boyunca birincil, murin stromal hücrelerin biyoenerjetik durumunu karakterize etmektir. Bu teknikler, iskelet homeostazının daha iyi anlaşılmasına yardımcı olur ve bu da sonuçta iskelet bozukluklarını iyileştirebilecek yeni terapötik seçeneklerin geliştirilmesine yol açabilir.
Gerçek zamanlı hücre metabolik akısı analizörü, sırasıyla mitokondriyal ve glikolitik ATP üretimine karşılık gelen canlı osteoblastların oksijen tüketim hızını (OCR) ve hücre dışı asitleşme hızını (ECAR) ölçmek için kullanılabilir. Bu metodolojinin temeli, glikozun laktata dönüştürülmesinde glikoliz sırasında laktat başına bir H + iyonunun salınmasıdır ve bu da ECAR değerlerine yansıyan ortam pH'ını değiştirir. Tersine, TCA (trikarboksilik asit) döngüsü sırasında, mitokondri yoluyla oksidatif fosforilasyon, oksijen kullanarak veya tüketerek CO2 üretir ve bu nedenle OCR'nin izlenmesi bu metabolik süreci yansıtır. Analizör, hücre dışı mikro ortamda hem OCR hem de ECAR'ı aynı anda ve gerçek zamanlı olarak ölçer, bu da hücresel biyoenerjetik 6,17'yi incelerken muazzam bir potansiyele izin verir. Ek olarak, bu tahlillerin yapılması nispeten basittir ve deneysel hedefe bağlı olarak kolayca özelleştirilebilir. Benzer teknikler, bağışıklık sisteminin T hücresi metabolik regülasyonunu18,19, kanser başlangıcını ve progresyonunu 20 ve metabolik sendromlara katkıda bulunan diğer birçok hücre tipi21,22'yi daha iyi anlamak için kullanılmıştır.
Gerçek zamanlı metabolik akı analizörünün alternatif tekniklere göre avantajları arasında (1) canlı hücrelerin hücresel biyoenerjetik değerlerini gerçek zamanlı olarak ölçme yeteneği, (2) nispeten az sayıda hücreyle tahlil yapabilme yeteneği (5.000 hücre kadar düşük hücre gerektirir), (3) yüksek verimli 96 kuyucuklu bir sistemde birden fazla tedaviyi paralel olarak manipüle etmek için enjeksiyon portları, (4) normalizasyon için radyoaktif etiketsiz otomatik hücre görüntüleyicisinin kullanılması18, 23,24. Aşağıdaki yöntemler, analizörü kullanarak osteoblast farklılaşması boyunca murin BMSC'lerde hücresel biyoenerjetik izlemenin genelleştirilmiş ancak ayrıntılı bir tanımını sağlamayı amaçlamaktadır. Rutin olarak gerçekleştirilen tahlilleri içerecektir; Bununla birlikte, birçok teknik ve yöntemde olduğu gibi, bireysel laboratuvarların deneyleri için belirli ayrıntıları belirlemeleri şiddetle tavsiye edilir.
Tahlil seçimi ve mevcut farklı tahlil türleri: Deneysel sonuçların güvenilirliğini ve tutarlılığını sağlarken, hücrelerin biyoenerjetik özelliklerini incelemek için çok çeşitli tahlil kitleri ve reaktifleri mevcuttur. Ek olarak, masaüstü yazılımı kolayca özelleştirilebilen tahlil şablonları da sunar. Tahlil, kullanıcının farklı metabolik parametreleri ölçme ihtiyaçlarına göre tanımlanabilir. Bu tahliller, deneysel hedefe ve / veya bilimsel soruya dayanarak çeşitli şekillerde değiştirilebilir. Örneğin, dört enjeksiyon portuyla, her metabolik yola özgü hücresel yanıtı analiz etmek için tahlil ortamına birden fazla bileşik enjekte edilebilir.
Hücre enerjisi fenotip testi: Bu tahlil, canlı hücrelerin metabolik fenotipini ve metabolik potansiyelini ölçer. Bu tahlil, yola özgü metabolizma hakkında genelleştirilmiş bir fikir edinmek için ilk adım olarak da önerilir. Hücre enerji potansiyelini anlamak için oligomisin A-ATP sentaz inhibitörü ve Karbonil siyanür 4-(triflorometoksi) fenilhidrazon (FCCP)-bir mitokondriyal ayrışma ajanı karışımı enjekte edilir. Oligomisin A enjeksiyonu, ATP'nin sentezini inhibe eder, bu da hücrelerin enerji taleplerini karşılamalarını sağlamak için glikoliz (ECAR) oranında bir artışa neden olur; Öte yandan, FCCP enjeksiyonu, mitokondriyal membranın depolarizasyonu nedeniyle daha yüksek OCR ile sonuçlanır. Temel olarak, bu tahlil bazal metabolik solunumu ve ikili enjeksiyonları, itmeleri veya stresleri takiben metabolik yanıtı gösterir. Bu parametrelere dayanarak, yazılım daha sonra hücreleri aerobik, sessiz, glikolitik veya zaman içindeenerjik durum 25,26 olarak sınıflandırarak hücrelerin OCR ve ECAR'ını çizer.
ATP gerçek zamanlı üretim hızı testi: Bu, hücresel ATP üretimini aynı anda glikoliz ve mitokondriyal solunumdan ölçer. Bu tahlil, iki enerji yolundan metabolik kaymaları nicel olarak ölçer ve zaman içinde mitokondriyal ve glikolitik ATP üretim oranları hakkında veri sağlar. Tahlil, bazal OCR ve ECAR verilerini elde eder, ardından oligomisin A enjeksiyonu yoluyla mitokondriyal ATP üretim hızını ve rotenon + antimisin A karışımı enjeksiyonu yoluyla glikolitik ATP üretim hızını hesaplar (mitokondriyal fonksiyonun toplam inhibisyonu), mitokondriyal asitleşme ile sonuçlanır17,27.
Hücre mitokondrisi stres testi (veya hücre mito stres testi): Bu, ATP'ye bağlı solunum yoluyla mitokondriyal fonksiyonu ölçer, hücresel biyoenerjetik faktörleri nicelleştirir, mitokondriyal disfonksiyonu tanımlar ve hücrelerin strese tepkisini ölçer. Bir tahlilde bazal ve yedek solunum kapasitesi, ATP'ye bağlı solunum, maksimal solunum ve mitokondriyal olmayan oksijen tüketimi gibi çeşitli parametreler elde edilebilir. Bu tahlil, oligomisin A, FCCP (mitokondriyal ayrışma ajanı), bunların mitokondriyal fonksiyon üzerindeki etkisini etkili bir şekilde analiz etmek için rotenon / antimisin A inhibitörlerinin bir karışımı olan sıralı enjeksiyonları içerir28.
Esneklik mito yakıt esnek testi: Bu, mitokondriyal solunum hızını, üç birincil mitokondriyal yakıtın inhibitörlerinin varlığı ve yokluğu ile oksidasyonu ile ölçer. Glikoz, glutamin ve yağ asitlerinin sıralı inhibisyonu, hücrelerin bağımlılığını, kapasitesini ve esnekliğini ve enerji talebini karşılamak için hücrelerin çeşitli hücresel yollara bağımlılığını ölçmeye yardımcı olur. Mitokondri, diğer yakıtları oksitleyerek tıkanmış ilgi yolunun taleplerini karşılayamadığında, hücreler bağımlılık durumuna girer. Hücrelerin kapasitesi, diğer iki alternatif yolun inhibisyonu ve ardından ilgilenilen yolun inhibisyonu ile hesaplanır. Hücrelerin esnekliği, mitokondrinin inhibe edilmiş yolun yakıt ihtiyaçlarını telafi etme ve karşılama yeteneğini anlamada yardımcı olur. Hücrelerin bağımlılığının hücrelerin kapasitesinden çıkarılmasıyla hesaplanır. Tahlil parametrelerini etkili bir şekilde hesaplamak için üç farklı inhibitör bağımsız olarak veya ikisinin karışımı olarak kullanılır. 2-siyano-3-(1-fenil-1H-indol-3-il)-2-propenoik asit (UK5099), glikolizde piruvat taşıyıcısını bloke ederek glikozun oksidasyonunu inhibe eder. Bis-2-(5-fenilasetamido-1,3,4-tiadiazol-2-il) (BPTES) etil sülfür glutamin oksidasyon yolunu inhibe eder ve etomoksir uzun zincirli yağ asitlerinin oksidasyonunu inhibe eder29.
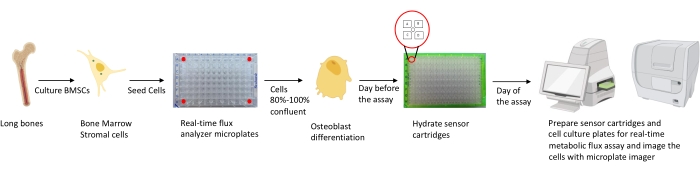
Şekil 1: Osteoblastların kültürlenmesi ve analiz için hazırlanması için metodolojinin şematik gösterimi. Murin BMSC'ler uzun kemiklerden izole edilir, kültürlenir ve 25.000 hücre / kuyu yoğunluğunda 96 kuyucuklu plakalarda tohumlanır. Bu hücrelerin Osteoblast spesifik ortamlarda kültürlenmesi, farklılaşmalarına başlamak için% 80-100 akıcılığa ulaştıklarında başlar. Tahliller farklılaşmanın farklı aşamalarında gerçekleştirilir. Kartuş plakaları tahlilden bir gün önce nemlendirilir. Tahlil gününde, sensör kartuşlarının portlarına tahlil gereksinimlerine göre farklı inhibitörler enjekte edilir ve 96 delikli kalibrasyon plakasına bir kalibrasyon tamponu eklenir. Kalibrasyondan sonra, gerçek zamanlı hücre metabolik akı testi yapılır, ardından gerçek zamanlı hücre metabolik akı analizörü verilerini hücre sayısı ile normalleştirmek için mikroplaka görüntüleyiciyi kullanarak hücre kültürü mikroplakası görüntülenir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
Tüm prosedürler, Vanderbilt Üniversitesi Tıp Merkezi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin kılavuzlarına ve onayına dayanıyordu.
1. Reaktiflerin hazırlanması ve tahlil kurulumu
- Kemik iliği stromal hücrelerinin izolasyonu ve kültürlenmesi (ayrıca önceki makale30'a bakınız).
- Minimum esansiyel medyayı alfa modifikasyonu ile %10 FBS (fetal sığır serumu), 100 U/mL penisilin ve 100 μg/mL streptomisin ile destekleyerek tam alfa minimum esansiyel medya (αMEM) hücre kültürü ortamı hazırlayın.
- 0,6 mL'lik bir mikrosantrifüj tüpünün ucunu keserek kemik iliği toplama tüpünü hazırlayın, böylece hücreler geçebilir ve 100 μL tam αMEM içeren 1,5 mL'lik bir mikrosantrifüj tüpüne yerleştirir.
- CO2 tedavisini kullanarak fareleri aşağıdaki gibi ötenazileştirin. Hayvanı CO 2 odasına2-3 dakika veya solunum durana kadar yerleştirin. Fareleri odadan çıkarmak ve servikal olarak yerinden çıkarmak için hayvan bilinçsiz hale geldikten sonra en az 1 dakika bekleyin.
- Steril forseps ve bir çift makas kullanarak, küçük bir kesi yapmak için ötenazi farelerinin alt karnını kesin. Farelerin uzun kemiklerini (femur, tibia ve iliak tepe) izole edin.
- Tüm yumuşak dokuları çıkarmak için uzun kemikleri kesin. Kemik temizlendikten sonra, iliğin akması için bir açıklık oluşturmak için distal ve proksimal uçlardan ~ 1-2 mm kesin.
NOT: Bu açıklık, dışarı akmasına izin verirken iliği kaybetmemek için konservatif olmalıdır. - Toplam kemik iliğini izole etmek için kemikleri 100 μL 1x steril PBS (fosfat tamponlu salin) içeren bir toplama tüpüne yerleştirin.
- İliği oda sıcaklığında 15-20 s için 10.000 x g'de santrifüjleme ile yıkayın. Tüpün dibinde ilik hücreleri peleti.
- Kemik boşluğu beyaz görünene ve çoğu ilik elemanından yoksun olana kadar santrifüjlemeyi tekrarlayın. Karışık kemik iliği popülasyonunu hafifçe yukarı ve aşağı pipetleyerek yeniden askıya alın.
- Bir hayvandan (hem femur hem de tibia) gelen hücreleri 75cm2'lik bir hücre kültürü şişesinde 10 mL hücre kültürü ortamında kültüre alın ve% 5 CO2 ile bir hücre kültürü inkübatöründe 37 ° C'de inkübe edin. 2-3 hayvandan hücreleri bir araya getiriyorsanız, 150cm2 hücre kültürü şişesi kullanın (önerilir).
- Karışık popülasyonun 24-48 saatlik inkübasyonunu takiben, kültür ortamında bulunan yapışkan olmayan hematopoetik hücre popülasyonunu aspire edin ve yapışkan hücreleri 1x PBS ile yıkayın.
- BMSC'lerden hücre tohumlaması ve osteoblast farklılaşması
- Şişe yüzeyini hafifçe örtmek için yeterli% 0.25 tripsin-EDTA (yaklaşık 3-4 mL) ekleyerek yapışkan hücreleri tripsinize edin, ardından 37 ° C'de 3 dakikalık bir inkübasyon yapın.
- Şişeye/tripsine 6-7 mL tam αMEM ekleyerek yapışkan BMSC'leri dikkatlice yukarı ve aşağı pipetleyerek, yeniden askıya alın. BMSC süspansiyonunu konik bir santrifüj tüpüne aktarın.
- BMSC süspansiyonunun 50 μL alikotunu çıkarın ve üzerine 50 μL tripan mavisi (1:1 seyreltme) ekleyin. Bu karışımın 10 μL'sini bir hemositometreye pipetleyerek ve mikroskop altında gözlemleyerek boyayı hariç tutan toplam canlı hücre sayısını sayın. Mavi renkli görünen ölü veya sağlıksız hücreleri saymayın (% <10 hücre).
- Hücre sayısına dayanarak, plaka başına en az 10 mL'lik toplam hacim için 2,4 x 106 hücre/mL'lik bir nihai konsantrasyon için gereken tam αMEM'deki hücre süspansiyonunun hacmini hesaplayın.

Şekil 2: Analizör için özel olarak tasarlanmış hücre kültürü mikroplakası . (A) Dört arka plan düzeltme kuyusu, A1, A12, H1, H12, vurgulanmıştır. Bu kuyular sadece herhangi bir hücre içermeyen tahlil ortamı içerir. (B) Görüntüleme okuyucusunu ve analizörü kullanarak plakayı taramak için plakanın yan tarafındaki barkod. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Konik tüpteki hücreleri 5 dakika boyunca 1.000 x g'de santrifüj edin ve hücreleri istenen son konsantrasyon olan 2.4 x 106 hücre / mL'ye kadar askıya alın.
- Hücre süspansiyonunu bir rezervuara aktarın ve çok kanallı bir pipet kullanarak, homojen bir hücre karışımı sağlamak için hücreleri dikkatlice yeniden askıya alın.
- 80 μL tam αMEM ile 96 delikli hücre kültürü mikroplakasında kuyu başına 2,5 x 104 hücre tohumu. Arka plan düzeltme kuyularındaki hücreleri tohumlamayın (A1, A12, H1, H12); bunun yerine, ortamı bu dört kuyuya ekleyin.
NOT: Tahliller için BMSC'ler, sensör kartuşlarıyla birlikte analizör için tasarlanmış 96 delikli hücre kültürü mikro plakası ile kaplanmıştır. Bu plakaların yüzey alanı, normal bir 96 kuyucuklu plakadan farklıdır. Plakadaki her bir kuyucuğun yüzey alanı, tipik 96 kuyucuklu plaka alanının yaklaşık% 40'ı olan 0.106cm2'dir. Optimal hücre tohumlama yoğunluğu, hücre tipine göre seçilir. Tipik olarak, analizör kuyu başına 0,5-4 x 104 hücre tespit edebilir. Osteoblastların etkili bir şekilde ayırt edilebilmesi için temas halinde olmaları gerekir; Bu amaçla, 80 μL tam αMEM'de 2,0 x 10 4-3,0 x 104 BMSC/kuyucuk arasında kaplama seçilmiştir. - Kuyucuklardaki hücrelerin eşit dağılımını sağlamak için plakayı yavaşça çalkalayın ve 37 ° C'de,% 5 CO2'de inkübe edin. 48 saat sonra mikroskop altında hücrelerin büyümesini ve hücre akıcılığını kontrol edin. Gerekirse hücre kültürü ortamını değiştirin.
- Tahlilin amacına bağlı olarak, BMSC'ler% 60-80 oranında (tipik olarak 48-72 saat) olduğunda, hücre kültürü ortamını osteoblast farklılaşma ortamına değiştirerek osteoblast farklılaşmasını başlatır (5 mM β-gliserol fosfat ve 50 μg / mL L-askorbik asit ile desteklenmiş tam αMEM).
- Diferansiye edilmemiş stromal hücreler (Gün 0) analiz edilecekse, hücreleri tam αMEM altında tutun.
- Osteoblast farklılaşma ortamını her gün değiştirin ve analiz gününe kadar sağlıklı olduklarından emin olmak için hücreleri mikroskop altında görselleştirin. Tercihen, planlanan tahlilden 24 saat önce, medyayı değiştirin ve tutarlı bir orta değişim programı uygulayın (önerilir).
NOT: Plakaları bir açıyla hafifçe eğerek ortamı dikkatlice değiştirin; bu, pipet uçlarının hücre kültürü plakalarına yanlışlıkla temas etmesini ve hücrelerin tek katmanının bozulmasını önler.
2. Hücre dışı akı kalibrasyonu için sensör kartuşunun hazırlanması
- Sensör kartuşlarını analiz gününden önce hücre dışı tahlil kitinden nemlendirin. Sensör kartuşlarını (yeşil plaka) çıkarın ve sensörleri baş aşağı yerleştirin.
- Çok kanallı bir pipet kullanarak, yardımcı plakanın her bir kuyucuğuna200μL H 2 O ekleyin. Sensör kartuşlarını dikkatlice yardımcı plakaya geri yerleştirin ve plakayı gece boyunca oda sıcaklığında inkübe edin.
NOT: Üretici, sensör kartuşlarının CO2 37 °C olmayan bir inkübatörde gece boyunca inkübe edilmesini önerir. Bununla birlikte, sensör kartuşlarında önemli ölçüde buharlaşma meydana gelebilir. Bu durumda, sensör kartuşları oda sıcaklığında inkübe edilebilir. Bu plakalar en az 4 saat ve maksimum 72 saat boyunca inkübe edilmelidir. - Tahlil gününde, H2O'yu yardımcı plakadan atın ve 200 μL kalizant ekleyin. Yardımcı plakayı tahlilden önce en az 1 saat boyunca inkübe edin.
3. Gerçek zamanlı hücre metabolik akı analizörü ortam hazırlığı
- Tahlili BMSC'lerle çalıştırmak için fenol kırmızısı serbest DMEM ortamını önceden ayarlanmış pH 7.4 (önerilen) ile kullanın.
- DMEM ortamını 1 mM sodyum piruvat, 2 mM glutamin, 10 mM glikoz, 200 nM insülin, 50-200 μM oleik asit BSA ile destekleyerek 80 mL tahlil ortamı hazırlayın.
- Tüm tahlil ortamını bir su banyosunda 37 ° C'de inkübe edin.
4. Sensör kartuşları için bileşiklerin hazırlanması
- Oligomisin A, rotenon ve antimisin A'yı buz üzerinde çözün. Kullanmadan önce bileşikleri çözündürmek için yukarı ve aşağı pipet.
- Her tüpe 3 mL hazırlanmış tahlil ortamı ekleyin, ardından ilgili bileşik tüp A'nın eklenmesi: 26.4 μL 2.5 mM oligomisin A; B tüpü: 3.1 μL 12.67 mM rotenon + 4.1 μL 9.4 mM antimisin A + 30 μL Hoechst lekesi.
- Bu inhibitörlerin 10x konsantrasyonunu ilgili porta yükleyin. Gerekli enjeksiyon çözeltilerinin son konsantrasyonu 2 μM oligomisin A, 1 μM rotenon ve 4.1 μM antimisin A'dır.
NOT: Hoechst, görüntüleme ve normalizasyon amacıyla çekirdekleri floresan olarak boyamak için son enjeksiyon portuna eklenir. Bu konsantrasyonlar hücre tipine göre optimize edilebilir. - Bu bileşiklerin 20 μL'sini 180 μL tahlil ortamındaki hücrelere yükleyin.
5. Tahlil için hücre kültürü mikroplakası hazırlayın
- Hücre kültürü mikroplakasını 37 °C inkübatörden çıkarın ve mikroskop altındaki hücreleri gözlemleyin.
- Tahlil ortamını su banyosundan çıkarın.
- Hücreleri iki kez 200 μL tahlil ortamı ile nazikçe yıkayın ve kuyu başına 200 μL tahlil ortamı ekleyin.
NOT: Son tahlil ortamı hücrelere eklendikten sonra, plakaların analizöre girmesi çok önemlidir. Bu nedenle, aşağıdaki adımlar 1 saat içinde gerçekleştirilene kadar ortamı değiştirmeye başlamayın. - Hücrelerin kuyucuklara yapışmış kalmasını sağlamak için mikroskop altındaki hücreleri kontrol edin.
- D5 ve E8'deki hücrelerin tutarlı bir tek katmanla yapıştırıldığından ve yıkama sırasında yıkanmadığından emin olun. Hücre görüntüleme yazılımı, otomatik odaklama ve otomatik pozlamayı ayarlamak için bu iki kuyuyu kullanır.
NOT: Üretici, plakanın CO2 37 °C olmayan bir inkübatörde 1 saat boyunca inkübe edilmesini önerir; otomatik görüntüleme tercih edilirse bu adım atlanabilir. Örneğin, mikro plakalı görüntüleyici kapalı bir odada aynı koşulları korur ve hücreler parlak bir alan altında görüntülenebilir.
6. Tahlil ve görüntülemenin ayarlanması
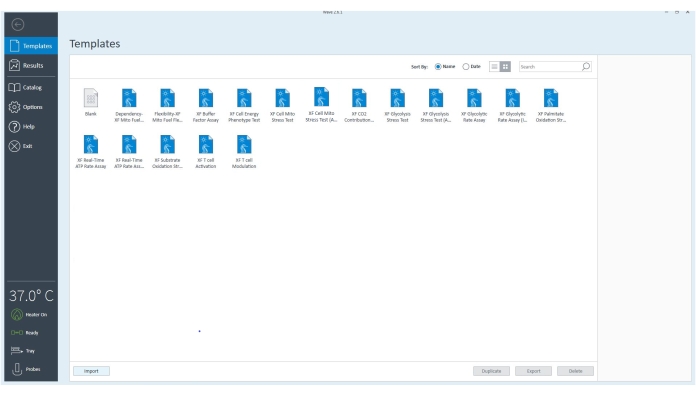
Şekil 3: Oyun kumandası yazılımı. Yazılım, ekipmanın bağlı olduğunu ve 37 °C'ye ayarlandığını doğrular. Hücre dışı akı analizörü ile gerçekleştirilebilecek farklı tahliller için şablon dosyaları, deneyi deneysel hedeflere göre daha da özelleştirmek için seçilebilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Bilgisayarda ekipmanın yanındaki masaüstü yazılımını açın.
- Oyun kumandası yazılımının sol alt köşesindeki bağlantı durumunu kontrol edin.
- Şablonlar'a gidin ve XF ATP Hız Testi şablon dosyasını veya uygun tahlil şablonunu seçin.
- Ekranın üst kısmındaki Grup Tanımları'nı seçin ve grupları tanımlayın.
- Plaka Haritası Düzeni'ni seçin ve tanımlanan gruplara bağlı olarak kuyuları atayın.
- Cihaz protokolünü doğrulayın, eklenen bileşiklerin doğru listelendiğinden emin olun ve gelecekteki referanslar için proje bilgilerini ekleyin.
- Tahlil Çalıştır'a tıklayın; bu, sonuç dosyası depolama konumunun seçilmesini ister.
- Sonuç dosyasının kaydedileceği konumu seçin.
- Dosyayı tahlil tarihiyle kaydedin ve Çalıştırmayı Başlat'a tıklayın.
- Sensör kartuşunu ve yardımcı program plakasını tepsiye yerleştirin ve kalibrasyonu başlatmak için Hazırım'a tıklayın.
- Kalibrasyona başlamadan önce, kartuş kapağının çıkarıldığından ve sensör kartuşunun yardımcı plaka üzerinde doğru yönde yerleştirildiğinden emin olun. Bu adım 10-20 dakika sürecek ve tamamlandığında, yazılım Hücre Plakasını Yükle iletişim kutusunu görüntüleyecektir.
7. Parlak alan görüntüleri elde edin
NOT: Bu adım isteğe bağlıdır. Görüntüleme ekipmanı yoksa, adım 8'e atlayın.

Şekil 4: Hücre görüntüleme yazılımı, bilgisayar aracılığıyla görüntüleme okuyucusuna iletişim kurar. Mikroplakadaki hücreler tahlilden önce ve sonra görüntülenebilir ve verileri normalleştirmek için tahlilden sonra hücre sayısı / kuyusu elde edilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Bilgisayardaki hücre görüntüleme yazılımını açın.
- Mikro plakalı görüntüleyicinin açık olduğundan ve bağlantı noktalarının bilgisayara bağlı olduğundan emin olun.
- Sıcaklığın 37 °C'ye ayarlandığından ve bağlantı durumunun hazır olarak yeşil renkle vurgulanması gerektiğinden emin olmak için ekranın sol alt köşesindeki durum çubuğunu kontrol edin.
- Görüntüleme işlemini başlatmak için plaka barkodunu tarayın.
- Hücre plakasına bir ad verin ve Kaydet'e basın (Bu, hem parlak alan hem de floresan görüntülerin kaydedileceği addır). Brightfield Taraması Yap'a tıklayın.
- Bir sonraki ekran, plaka ve tarama menüsü, görüntüleme seçeneklerini gösterir. Tahlilden önce Brightfield Taramasını Başlat'ı seçin.
- Hücre kültürü mikro plakasını, plaka kapağı/kapağı ile birlikte tepsi tutucuya yerleştirin ve A1 İşareti ile A1'i iyice hizalayın. Tepsiyi Kapat'a tıklayın.
- Bir sonraki ekranda, parlak alan görüntü alımı, bir plaka haritası ile birlikte görünür. Sistem başlatma işlemini başlatan ve ardından 30 ila 35 dakikalık bir tarama yapan Tüm Kuyuları Tara'ya tıklayın.
- Parlak alan taramasından sonra, hücre kültürü mikroplakasını çıkarın ve tahlili gerçekleştirmek için analizöre yerleştirin.
8. Tahlilin yürütülmesi
- Kalibrasyon tamamlandıktan sonra, yazılım Yük Hücresi Plakası iletişim kutusunu görüntüler.
- Yardımcı program tepsisini bir hücre kültürü mikro plakasıyla değiştirmek için Tepsiyi Aç'a tıklayın. Kapağın çıkarıldığından ve plakanın A1'inin doğru yönde oturduğundan emin olun.
- Ardından, tahlili başlatmak için Yük Hücre Plakası'na tıklayın. Sensör kartuşu, tahlil enjeksiyonları için analizörün içinde kalacaktır.
- Tahlil başlayana ve tahmini tamamlanma süresini görüntüleyene kadar bekleyin.
- Tahlil tamamlandıktan sonra, yazılım Sensör Kartuşunu Boşalt iletişim kutusunu görüntüler. Çıkar'a tıklayın ve hücre kültürü mikroplakasını analizörden çıkarın.
- Sensör kartuşunu dikkatlice çıkarın ve hücre plakası kapağını yerine takın. Hücreler floresan görüntüleme ve hücre sayımı için hazırdır.
- Hücre plakasını ve sensör kartuşunu çıkardıktan sonra, Tahlil Tamamlandı iletişim kutusu görüntülenir.
- Tahlil sonuç dosyasını açmak ve verileri hemen normalleştirmek için Sonuçları Görüntüle'ye tıklayın veya Ana Sayfa'ya tıklayın.
9. Floresan görüntüler elde edin ve normalleştirin
NOT: Bu adım, BMSC'lerin ve osteoblastların normalleştirilmesi için isteğe bağlı ancak tercih edilen bir yöntemdir. Görüntüleme ekipmanı yoksa, protein veya DNA izolasyonu ve nicelleştirme gibi başka bir normalleştirme yönteminin uygulanması gerekir.

Şekil 5: Tahlilden elde edilen verilerin normalleştirilmesi için kullanılan görüntüleme yazılımından temsili görüntüler . (A) Tüm kuyu boyunca hücre birleşimini gösteren dikişli parlak alan görüntüsü. (B) Tahlil sonuçlarını normalleştirmek için hücre sayılarını saymak için kullanılan osteoblastların Hoechst lekeli çekirdeklerini gösteren dikişli floresan görüntüsü. Bunlar 7 günlük farklılaşmadan sonra osteoblastlardır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Tahlil tamamlandıktan sonra, el tipi barkod okuyucu ile plaka barkodunu tarayın. Plaka zaten görüntülenmişse, yeni bir isim gerektirmez.
- Floresan ve Hücre Sayısı'nı seçin, hücre plakasını tepsi tutucuya yerleştirin ve Tepsiyi Kapat'a tıklayın.
- Görüntü alma penceresinde, görüntülemeye başlamak için Tüm Kuyuları Tara'yı seçin. Floresan görüntülemenin tüm plakayı taraması yaklaşık 15-20 dakika sürer. Taramanın tamamlandığını belirten yeşil onay işaretine dikkat edin.
- Görüntüleme ve hücre görüntüleme uygulamasındaki floresan görüntüleri ve hücre sayımlarını, birkaç kuyucuğa rastgele tıklayarak gözden geçirin.
NOT: Ekranın sağ alt köşesinde sayılan hücreleri görüntüleme seçeneği vardır. Bu seçenek, sayılan nesneleri vurgulayarak maskelenmiş bir görüntü gösterir. - Floresan görüntüleme tamamlandıktan sonra, ek referanslar için görüntüleri dışa aktarın.
- Görüntüleme ve hücre sayımı tamamlandıktan sonra, Sonuçlar dosyasını açın ve Normalleştir'e tıklayın. Normalleştirme ekranı, plaka düzenini ve hücre sayısını içe aktarma seçeneği sunar.
- İçe Aktar'a tıklayın ve tahlili hücre sayısıyla otomatik olarak normalleştirmek için masaüstü yazılımı için Uygula'yı seçin.
Sonuçlar
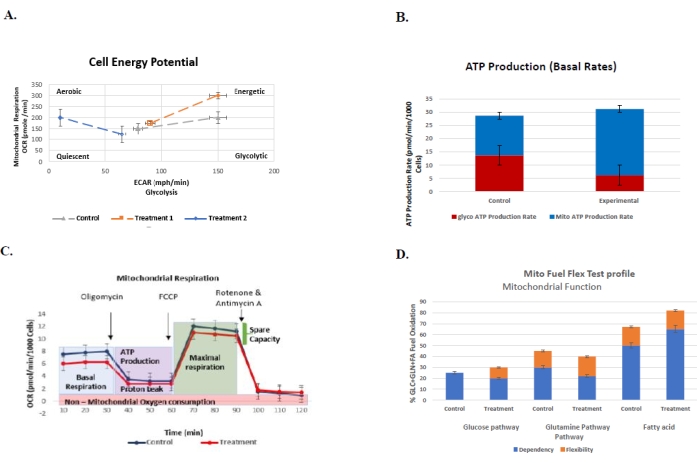
Şekil 6: Kontrol ve tedavi grubunun hücresel biyoenerjetik profilini kendi standart hatalarıyla anlamak için rutin olarak yapılan analizler için temsili grafikler . (A) Hücre enerjisi fenotip testi. Grafik, kontrolün glikolizini (ECAR) ve mitokondriyal solunumu (OCR) ve iki tedavi grubunu (n = 3) temsil eder. Oligomis...
Tartışmalar
Gerçek zamanlı hücre metabolik akı analizörü, farklı koşullar altında hücresel enerjileri keşfetmek için kullanılabilir. Protokol, BMSC'lerin verimli izolasyonunu, hücrelerin uygun hücre kültürü plakalarında kültürlenmesini ve hücre dışı akı analizörü kullanılarak çeşitli tahliller için kullanılabilecek olgun osteoblastlara farklılaşmasını göstermektedir. Ayrıca, sensör kartuşlarının hidrasyonu, enjeksiyon portlarının yüklenmesi, tahlilin yapılması, verilerin normalleştiri...
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüsü (NIH) Ulusal Artrit ve Kas-İskelet ve Deri Hastalıkları Enstitüsü (NIAMS) Grant AR072123 ve Ulusal Yaşlanma Enstitüsü (NIA) Grant AG069795 (ERR'ye) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma - Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma - Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma - Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma - Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma - Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma - Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma - Aldrich | O3008 | |
| Oligomycin A - 5 mg | Sigma - Aldrich | 75351 | |
| Rotenone | Sigma - Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies - BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
Referanslar
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır