需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用实时细胞代谢通量分析仪监测成骨细胞生物能量学
摘要
实时细胞代谢通量测定使用pH和氧传感器测量耗氧速率和细胞外酸化速率,这对应于线粒体和糖酵解三磷酸腺苷的产生。该手稿解释了一种了解成骨细胞能量状态的方法以及细胞生物能量状态的表征和解释。
摘要
成骨细胞的骨形成是正确获得骨骼和骨更新以维持骨骼稳态并最终防止骨折的必要过程。为了优化峰值骨量和对抗各种肌肉骨骼疾病(即绝经后骨质疏松症,神经性厌食症,1型和2型糖尿病),在骨生物学领域做出了令人难以置信的努力,以在整个分化过程中充分表征成骨细胞。鉴于成熟成骨细胞分泌基质蛋白和矿化囊泡的主要作用,已经注意到这些过程需要令人难以置信的细胞能量,或三磷酸腺苷(ATP)。整体细胞能量状态通常被称为细胞生物能量学,它包括一系列代谢反应,这些反应感知底物的可用性,以获得ATP以满足细胞需求。因此,目前的方法详细介绍了分离原代、小鼠骨髓基质细胞(BMSCs)的过程,并使用实时细胞代谢通量分析仪在成骨细胞分化的各个阶段监测其生物能量状态。重要的是,这些数据表明,在整个成骨细胞分化过程中,代谢谱发生了巨大变化。因此,使用这种生理相关的细胞类型需要充分了解细胞的生物能量状态如何调节整体功能。
引言
成骨细胞形成的骨骼伴随着破骨细胞对骨骼的协调破坏或再吸收。成骨细胞骨形成和破骨细胞再吸收之间的平衡是描述骨转换或重塑的耦合过程,这对于骨骼稳态至关重要。成骨细胞功能障碍导致骨骼形成受损并导致各种疾病,包括骨质疏松症1,2,3。骨髓基质干细胞(BMSCs)到成骨细胞前体和成熟成骨细胞的 离体/体外 分化导致矿化骨基质随着时间的推移在培养血管中形成和沉积4,5,6。成骨细胞形成的这种骨骼需要大量的细胞能量。具体而言,胶原蛋白的合成和分泌已被证明严重依赖于细胞ATP:ADP比率,并且可能,矿化囊泡运输和分泌需要额外的ATP7,8,9,10,11。许多研究人员已经证明,成骨细胞生成和成骨细胞功能的过程需要足够的能量供应来满足骨形成的代谢需求12,13,14,15,16。因此,该方法的目标是使用实时细胞代谢通量分析仪表征原代,小鼠基质细胞在整个成骨细胞分化过程中的生物能量状态。这些技术有助于更好地了解骨骼稳态,这可能最终导致能够改善骨骼疾病的新型治疗方案的发展。
实时细胞代谢通量分析仪可用于测量活成骨细胞的耗氧速率(OCR)和细胞外酸化速率(ECAR),分别对应于线粒体和糖酵解ATP的产生。这种方法的基础是,在糖酵解过程中,每个乳酸释放一个H + 离子,将葡萄糖转化为乳酸盐,这会改变ECAR值中反映的培养基pH值。相反,在TCA(三羧酸)循环期间, 通过 线粒体的氧化磷酸化通过利用或消耗氧气产生CO2 ,因此监测OCR反映了这种代谢过程。该分析仪同时实时测量细胞外微环境中的OCR和ECAR,这在研究细胞生物能量学时具有巨大的潜力6,17。此外,进行这些测定相对简单,并且易于根据实验目标进行定制。已经采用类似的技术来进一步了解免疫系统的T细胞代谢调节18,19,癌症的发生和进展20,以及导致代谢综合征的多种其他细胞类型21,22。
与替代技术相比,实时代谢通量分析仪的优势包括:(1)能够实时测量活细胞的细胞生物能量,(2)能够对相对较少的细胞进行测定(需要低至5,000个细胞),(3)注射端口在高通量96孔系统中并行操作多个处理,(4)使用无放射性标记的自动细胞成像仪进行归一化18,23,24.以下方法旨在提供使用分析仪在整个成骨细胞分化过程中监测小鼠BMSC中细胞生物能量学的广义但详细的描述。它将包括常规进行的测定;然而,与许多技术和方法一样,强烈建议各个实验室确定其实验的具体细节。
可选择测定和不同类型的测定:提供多种测定试剂盒和试剂,用于研究细胞的生物能量学,同时确保实验结果的可靠性和一致性。此外,桌面软件还提供可轻松定制的分析模板。该测定可以根据用户测量不同代谢参数的需要来定义。这些测定可以根据实验目标和/或科学问题以各种方式进行修改。例如,使用四个进样端口,可以将多种化合物注射到测定培养基中,以分析特定于每个代谢途径的细胞反应。
细胞能量表型测试: 该测定法测量活细胞的代谢表型和代谢潜力。该测定也被推荐作为获得通路特异性代谢的广义概念的第一步。注入寡霉素A-ATP合酶抑制剂和羰基氰化物4-(三氟甲氧基)苯腙(FCCP)-线粒体解偶联剂的混合物以了解细胞能量电位。注射寡霉素A抑制ATP的合成,导致糖酵解速率(ECAR)的增加,使细胞能够满足其能量需求;另一方面,由于线粒体膜的去极化,FCCP的注射导致更高的OCR。从本质上讲,该测定描绘了基础代谢呼吸,并在双重注射,推或应激之后,代谢反应。基于这些参数,软件然后通过将细胞分类为有氧,静止,糖酵解或能量状态来绘制细胞的OCR和ECAR,时间跨度25,26。
ATP实时产率测定: 这测量细胞ATP同时从糖酵解和线粒体呼吸产生的。该测定定量测量来自两个能量途径的代谢变化,并提供有关线粒体和糖酵解ATP产生速率随时间变化的数据。该测定获得基础OCR和ECAR数据,然后通过注射寡霉素A计算线粒体ATP产生速率,通过注射鱼藤酮+抗霉素A混合物计算糖酵解ATP产生速率(完全抑制线粒体功能),导致线粒体酸化17,27。
细胞线粒体负荷试验(或细胞丝粒体负荷试验): 这通过ATP连接的呼吸测量线粒体功能,量化细胞生物能量,识别线粒体功能障碍,并测量细胞对压力的反应。一次测定即可获得各种参数,包括基础和备用呼吸能力、ATP 相关呼吸、最大呼吸和非线粒体耗氧量。该测定涉及序贯注射寡霉素A,FCCP(线粒体解偶联剂),鱼藤酮/抗霉素A抑制剂的混合物,以有效分析这些抑制剂对线粒体功能的影响28。
柔韧性水母燃料柔性测试: 这通过三种主要线粒体燃料的存在和不存在抑制剂的氧化来测量线粒体呼吸速率。葡萄糖,谷氨酰胺和脂肪酸的顺序抑制有助于测量细胞的依赖性,容量和柔韧性以及细胞在各种细胞途径中的依赖性,以满足能量需求。当线粒体不能通过氧化其他燃料来满足阻塞的靶向途径的需求时,细胞进入依赖状态。细胞的容量是通过抑制其他两种替代途径,然后抑制感兴趣的途径来计算的。细胞的灵活性有助于了解线粒体补偿和满足抑制途径的燃料需求的能力。它是通过从单元的容量中减去单元的依赖性来计算的。独立使用三种不同的抑制剂或作为两种抑制剂的混合物来有效计算测定参数。2-氰基-3-(1-苯基-1H-吲哚-3-基)-2-丙烯酸(UK5099)通过阻断糖酵解中的丙酮酸盐载体来抑制葡萄糖的氧化。双-2-(5-苯基乙酰氨基-1,3,4-噻二唑-2-基)(BPTES)乙基硫醚抑制谷氨酰胺氧化途径,依托莫西抑制长链脂肪酸的氧化29。
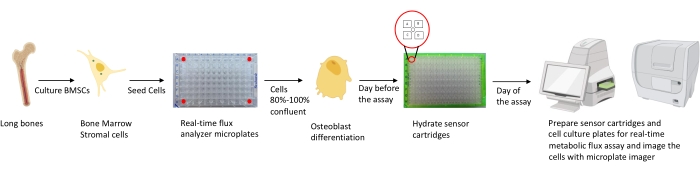
图1:用于培养和制备成骨细胞进行分析的方法示意图。 从长骨中分离出小鼠BMSC,培养并接种在96孔板中,密度为25,000个细胞/ 孔。当这些细胞达到80%-100%汇合以开始分化时,就开始在成骨细胞特异性培养基中培养这些细胞。测定在不同的分化阶段进行。在测定前一天将筒板水合。在测定当天,根据测定要求将不同的抑制剂注射到传感器盒的端口中,并将校准缓冲液添加到96孔校准板中。校准后,进行实时细胞代谢通量测定,然后使用微孔板成像仪对细胞培养微孔板进行成像,以使用细胞计数对实时细胞代谢通量分析仪数据进行归一化。 请点击此处查看此图的大图。
研究方案
所有程序均基于范德比尔特大学医学中心机构动物护理和使用委员会的指导方针和批准。
1. 试剂制备和测定设置
- 骨髓基质细胞的分离和培养(另见上一篇文章30)。
- 制备完全α最小必需培养基(αMEM)细胞培养基,方法是用10%FBS(胎牛血清),100 U / mL青霉素和100μg/ mL链霉素补充具有α修饰的最小必需培养基。
- 通过修剪0.6 mL微量离心管的末端来制备骨髓收集管,以便细胞可以通过并将其插入含有100μL完全αMEM的1.5mL微量离心管中。
- 使用CO2 处理对小鼠实施安乐死,如下所示。将动物置于CO2 室中2-3分钟或直到呼吸停止。在动物失去知觉后等待至少1分钟,将小鼠从腔室中取出并颈部脱位。
- 使用无菌镊子和一把剪刀,切开安乐死小鼠的下腹部做一个小切口。分离小鼠的长骨(股骨,胫骨和髂嵴)。
- 修剪长骨以去除所有软组织。一旦骨头被清洁,从远端和近端切开约1-2毫米,为骨髓冲洗创造一个开口。
注意:这个开口应该是保守的,以避免失去骨髓,同时让它冲洗出来。 - 将骨骼置于含有100μL1x无菌PBS(磷酸盐缓冲盐水)的收集管中,以分离总骨髓。
- 通过在室温下以10,000× g 离心15-20秒冲洗骨髓。骨髓细胞在管的底部沉淀。
- 重复离心,直到骨腔看起来是白色的,没有大多数骨髓元素。通过上下轻轻移液来重悬混合的骨髓群体。
- 将来自一种动物(股骨和胫骨)的细胞在75cm2 细胞培养瓶中培养10mL细胞培养基中的细胞,并在37°C下在具有5%CO2的细胞培养箱中孵育。如果从2-3只动物中汇集细胞,请使用150cm2 细胞培养瓶(推荐)。
- 在混合群体的孵育24-48小时后,吸出培养基中含有的非贴壁造血细胞群,并用1x PBS洗涤贴壁细胞。
- 骨髓细胞接种和成骨细胞分化
- 胰蛋白酶消化通过加入足够的0.25%胰蛋白酶- EDTA(约3-4mL)以略微覆盖烧瓶表面,然后在37°C下孵育3分钟。
- 向烧瓶/胰蛋白酶中加入6-7 mL完全αMEM,通过小心地上下移液来重悬粘附的BMSC。将BMSC悬浮液转移到锥形离心管中。
- 取出50μL等分试样的BMSC悬浮液,并向其加入50μL台盼蓝(1:1稀释液)。通过将10μL该混合物移液到血细胞计数器并在显微镜下观察来计算排除染料的活细胞的总数。不要计算任何看起来是蓝色的死亡或不健康的细胞(<10%细胞)。
- 根据细胞计数,计算最终浓度为2.4 x 106 个细胞/ mL所需的完全αMEM中的细胞悬浮液体积,每个板的总体积至少为10 mL。

图2:专为分析仪设计的细胞培养微孔板。 (A)突出显示了四个背景校正孔A1,A12,H1,H12。这些孔仅含有不含任何细胞的测定培养基。(B)板的侧面条形码使用成像读取器和分析仪扫描板。 请点击此处查看此图的大图。
- 将锥形管中的细胞以1,000× g 离心5分钟,并将细胞重悬至所需的最终浓度2.4×106 细胞/ mL。
- 将细胞悬浮液转移到储液器中,并使用多通道移液管小心地重悬细胞以确保细胞的均匀混合物。
- 用80μL完全αMEM在96孔细胞培养微孔板中每孔接种2.5×104 个细胞。不要在背景校正孔(A1,A12,H1,H12)中接种细胞;相反,只需在这四个孔中加入培养基即可。
注意:用于测定的BMSC接种在为分析仪设计的96孔细胞培养微孔板中,并与传感器盒一起。这些板的表面积与常规的96孔板不同。板中每个孔的表面积为0.106 cm2,约为典型96孔板面积的40%。根据细胞类型选择最佳的细胞接种密度。通常,分析仪每孔可以检测0.5-4 x 104个细胞。成骨细胞需要接触才能有效区分;为此,选择了在80μL完全αMEM中进行2.0 x 104-3.0 x 4 BMSCs /孔之间的电镀。 - 轻轻搅拌板以确保孔中细胞均匀分布,并在37°C,5%CO2下孵育。48小时后在显微镜下检查细胞的生长和细胞汇合度。如果需要,更换细胞培养基。
- 根据测定的目标,当BMSC汇合60%-80%(通常为48-72小时)时,通过将细胞培养基改为成骨细胞分化培养基(补充5mM β-甘油磷酸和50μg/ mL L-抗坏血酸的完全αMEM)来启动成骨细胞分化。
- 如果要分析未分化的基质细胞(第0天),请将细胞维持在完全αMEM下。
- 每隔一天更换一次成骨细胞分化培养基,并在显微镜下可视化细胞,以确保它们在测定当天之前是健康的。优选地,在预定测定前24小时,更换培养基并保持一致的培养基更换时间表(推荐)。
注:通过以一定角度稍微倾斜板来小心更换介质;这避免了移液器吸头与细胞培养板的意外接触和单层细胞的破坏。
2. 制备用于细胞外通量校准的传感器盒
- 在测定当天之前,将细胞外测定试剂盒中的传感器盒水合。卸下传感器盒(绿板),然后将传感器倒置。
- 使用多通道移液器,向实用板的每个孔中加入200μL H2O。小心地将传感器盒放回实用板上,并在室温下将板孵育过夜。
注:制造商建议将传感器盒在非 CO2 37 °C 培养箱中孵育过夜。但是,传感器盒可能会发生显着蒸发。如果发生这种情况,传感器盒可以在室温下孵育。这些板应孵育至少4小时,最多72小时。 - 在测定当天,从实用板中丢弃H2O并加入200μL校准剂。在测定前将实用板孵育至少1小时。
3. 实时细胞代谢通量分析仪培养基制备
- 使用预调节pH值为7.4(推荐)的无酚红DMEM培养基,用BMSC进行测定。
- 通过用1mM丙酮酸钠,2mM谷氨酰胺,10mM葡萄糖,200nM胰岛素,50-200μM油酸BSA补充DMEM培养基,制备80mL测定培养基。
- 将完整的测定培养基在37°C下在水浴中孵育。
4. 传感器盒的化合物制备
- 在冰上解冻寡霉素A,鱼藤酮和抗霉素A。上下移液以在使用前溶解化合物。
- 向每个试管中加入3mL制备的测定培养基,然后加入相应的化合物管A:26.4μL 2.5mM寡霉素A;试管 B:3.1 μL 12.67 mM 鱼藤酮 + 4.1 μL 9.4 mM 抗霉素 A + 30 μL Hoechst 染色剂。
- 在相应的端口中加载10倍浓度的这些抑制剂。所需的注射液的最终浓度为2μM寡霉素A,1μM鱼藤酮和4.1μM抗霉素A。
注意:Hoechst被添加到最终的进样口,用于荧光染色细胞核,用于成像和归一化目的。这些浓度可以根据细胞类型进行优化。 - 在180μL测定培养基中将这些化合物上样20μL到细胞中。
5.准备用于测定的细胞培养微孔板
- 从37°C培养箱中取出细胞培养微孔板,并在显微镜下观察细胞。
- 从水浴中取出测定培养基。
- 用200μL测定培养基轻轻洗涤细胞两次,每孔加入200μL测定培养基。
注意:一旦最终的测定培养基被添加到细胞中,板进入分析仪的时间至关重要。因此,在1小时内执行以下步骤之前,请勿开始更换介质。 - 在显微镜下检查细胞,以确保细胞保持粘附在孔上。
- 确保D5和E8中的细胞粘附在一致的单层上,并且在洗涤步骤中没有被冲走。细胞成像软件使用这两个孔来设置自动对焦和自动曝光。
注意:制造商建议将板在非CO2 37°C培养箱中孵育1小时;如果首选自动映像,则可以跳过此步骤。例如,微孔板成像仪在封闭的腔室中保持相同的条件,并且可以在明场下对细胞进行成像。
6. 设置测定和成像
图3:控制器软件。该软件验证设备是否已连接并设置为37°C。 可以选择可以使用细胞外通量分析仪进行的不同测定的模板文件,以根据实验目标进一步定制测定。 请点击此处查看此图的大图。
- 在设备旁边的计算机中打开桌面软件。
- 检查控制器软件左下角的连接状态。
- 转到 模板 并选择 XF ATP率测定 模板文件或适当的测定模板。
- 选择屏幕顶部的 组定义 并定义组。
- 选择板 块布局 并根据定义的组分配孔。
- 验证仪器协议,确保添加的化合物正确列出,并包括项目信息以供将来参考。
- 点击 运行分析;这将提示选择结果文件存储位置。
- 选择保存结果文件的位置。
- 保存带有测定日期的文件,然后单击" 开始运行"。
- 将传感器盒和实用程序板放在托盘上,然后单击" 我已准备好" 以启动校准。
- 在开始校准之前,请确保已卸下墨盒盖,并将传感器墨盒放置在实用程序板上的正确位置。此步骤需要10-20分钟,完成后,软件将显示 "称重传感器板 "对话框。
7. 获取明场图像
注意:此步骤是可选的。如果没有可用的成像设备,请跳到步骤 8。

图4:细胞成像软件通过计算机与成像读取器进行通信。 可以在测定之前和之后对微孔板中的细胞进行成像,并且在测定后获得细胞计数/孔以使数据正常化。 请点击此处查看此图的大图。
- 在计算机上打开细胞成像软件。
- 确保微孔板成像仪已打开,并且端口已连接到计算机。
- 检查屏幕左下角的状态栏,确保温度设置为 37 °C,并且连接状态应以绿色突出显示为就绪。
- 扫描板条形码以启动成像过程。
- 为细胞板提供一个名称并点击 "保存" (这是将保存明场和荧光图像的名称)。单击执行 明场扫描。
- 下一个屏幕、印版和扫描菜单显示成像选项。在检测之前,选择 开始明场扫描。
- 将细胞培养微孔板与板盖/盖子一起放在托盘架上,并将A1与A1标记对齐。单击关闭 托盘。
- 下一个屏幕,明场图像采集,带有板块图出现。单击" 扫描所有孔",这将启动系统初始化过程,然后进行30至35分钟的扫描。
- 明场扫描后,取出细胞培养微孔板并将其置于分析仪中以进行测定。
8. 运行检测
- 校准完成后,软件将显示 "称重传感器板 "对话框。
- 单击打开 托盘 ,用细胞培养微孔板替换实用程序托盘。确保盖已取下,并且板的A1适合正确的方向。
- 然后,单击 称重传感器板 以启动测定。传感器盒将保留在分析仪内用于分析进样。
- 等到测定开始并显示估计的完成时间。
- 分析完成后,软件将显示 "卸载传感器盒 "对话框。单击 "弹出" 并从分析仪中取出细胞培养微孔板。
- 小心地卸下传感器盒并盖上电池板盖。细胞已准备好进行荧光成像和细胞计数。
- 取出细胞板和传感器盒后,出现" 检测完成 "对话框。
- 单击" 查看结果 "以打开测定结果文件并立即对数据进行归一化,或单击" 主页"。
9. 获取荧光图像并归一化
注意:此步骤是BMSC和成骨细胞正常化的可选但首选的方法。如果没有可用的成像设备,则需要执行另一种归一化方法,例如蛋白质或DNA分离和定量。

图5:来自成像软件的代表性图像,用于对来自测定的数据进行归一化。 (A)拼接明场图像,显示整个孔中的细胞汇合度。(B)缝合荧光图像,显示用于计数细胞数量的Hoechst染色的成骨细胞核以使测定结果正常化。这些是分化 7 天后的成骨细胞。 请点击此处查看此图的大图。
- 测定完成后,用手持式条形码阅读器扫描板条形码。如果板材已经过成像,则不需要新名称。
- 选择 荧光和细胞计数,将细胞板放在托盘支架上,然后单击关闭 托盘。
- 在图像采集窗口中,选择扫描 所有孔 以开始成像。荧光成像需要大约15-20分钟才能扫描整个板。观察绿色刻度线,表示扫描已完成。
- 通过随机单击几个孔来查看成像和细胞成像应用程序中的荧光图像和细胞计数。
注意:屏幕右下角有一个选项可以查看计数的单元格。此选项显示蒙版图像,突出显示已计数的对象。 - 荧光成像完成后,导出图像以供参考。
- 成像和细胞计数完成后,打开 结果 文件,然后单击" 归一化"。归一化屏幕将提供板布局和导入细胞计数的选项。
- 单击 "导入 ",然后选择 "应用 ",以便使用细胞计数自动对测定进行归一化。
结果
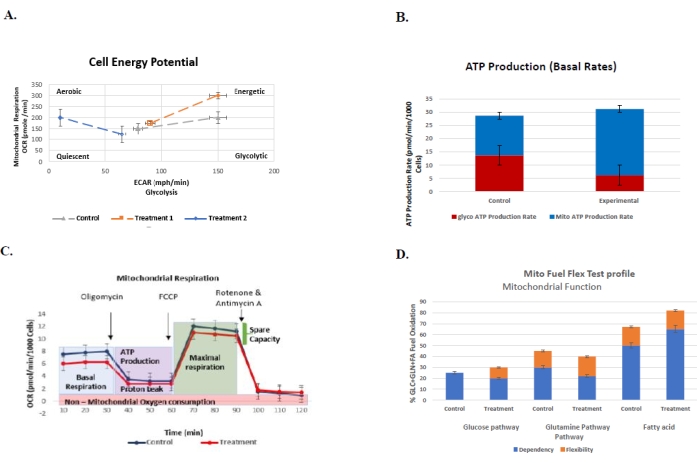
图6:常规检测的代表性图表,以了解对照组与治疗组的细胞生物能量谱及其各自的标准误差。该图表示对照组的糖酵解 (ECAR) 与线粒体呼吸 (OCR) 与两个治疗组 (n = 3)。注射寡霉素A和FCCP应激源可提高基线活性,由开放符号表示,而封闭符号表...
讨论
实时细胞代谢通量分析仪可用于探索不同条件下的细胞能量学。该协议说明了BMSC的有效分离,在适当的细胞培养板中培养细胞,以及它们分化为成熟的成骨细胞,这可用于使用细胞外通量分析仪进行各种测定。此外,还详细解释了实时细胞代谢通量测定的关键步骤,包括传感器盒的水合,注射端口的加载,执行测定,数据归一化和数据分析。该测定评估成骨细胞对不同线粒体和糖酵解抑制剂的反...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了美国国立卫生研究院(NIH)国家关节炎和肌肉骨骼和皮肤病研究所(NIAMS)拨款AR072123和国家衰老研究所(NIA)拨款AG069795(ERR)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma - Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma - Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma - Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma - Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma - Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma - Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma - Aldrich | O3008 | |
| Oligomycin A - 5 mg | Sigma - Aldrich | 75351 | |
| Rotenone | Sigma - Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies - BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
参考文献
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。