Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование анализатора метаболического потока клеток в реальном времени для мониторинга биоэнергетики остеобластов
В этой статье
Резюме
Анализ метаболического потока клеток в режиме реального времени измеряет скорость потребления кислорода и скорость внеклеточного подкисления, что соответствует производству митохондриальных и гликолитических аденозинтрифосфатов с использованием датчиков pH и кислорода. Рукопись объясняет метод понимания энергетического статуса остеобластов, а также характеристику и интерпретацию клеточного биоэнергетического статуса.
Аннотация
Формирование кости остеобластами является важным процессом для правильного приобретения кости и оборота кости для поддержания скелетного гомеостаза и, в конечном счете, предотвращения перелома. В интересах оптимизации пиковой костной массы и борьбы с различными заболеваниями опорно-двигательного аппарата (например, постменопаузальным остеопорозом, нервной анорексией, сахарным диабетом 1 и 2 типа) в области костной биологии были предприняты невероятные усилия для полной характеристики остеобластов на протяжении всего процесса их дифференцировки. Учитывая основную роль зрелых остеобластов в секреции матричных белков и минерализующих везикул, было отмечено, что эти процессы забирают невероятное количество клеточной энергии, или аденозинтрифосфата (АТФ). Общий клеточный энергетический статус часто называют клеточной биоэнергетикой, и он включает в себя ряд метаболических реакций, которые ощущают доступность субстрата для получения АТФ для удовлетворения клеточных потребностей. Таким образом, текущий метод детализирует процесс выделения первичных стромальных клеток мыщеричного мозга (BMSCs) и мониторинга их биоэнергетического статуса с использованием анализатора метаболического потока клеток в реальном времени на различных стадиях дифференцировки остеобластов. Важно отметить, что эти данные продемонстрировали, что метаболический профиль резко меняется на протяжении всей дифференциации остеобластов. Таким образом, использование этого физиологически значимого типа клеток необходимо для полного понимания того, как биоэнергетический статус клетки может регулировать общую функцию.
Введение
Образование кости остеобластом сопровождается скоординированным разрушением или рассасыванием костей остеокластами. Баланс между остеобластным формированием кости и резорбцией остеокластов представляет собой связанный процесс, описывающий оборот или ремоделирование кости, который необходим для скелетного гомеостаза. Дисфункция остеобластов приводит к нарушению костеобразования и приводит к различным заболеваниям, в том числеостеопорозу 1,2,3. Дифференцировка стромальных стволовых клеток костного мозга (BMSCs) ex vivo/in vitro к предшественникам остеобластов и зрелым остеобластам приводит к образованию и отложению минерализованного костного матрикса в культуральном сосуде с течением времени 4,5,6. Это костное образование остеобластом требует значительного количества клеточной энергии. В частности, было показано, что синтез и секреция коллагена в значительной степени зависят от клеточных соотношений АТФ: АДФ, и, по-видимому, минерализованный пузырчатый трафик и секреция требуют дополнительного АТФ 7,8,9,10,11. Многие исследователи продемонстрировали, что процесс остеобластогенеза и функции остеобластов требует адекватного запаса энергии для удовлетворения метаболической потребности в формировании костей 12,13,14,15,16. Поэтому целью данного метода является характеристика биоэнергетического статуса первичных, мышиных стромальных клеток на протяжении дифференцировки остеобластов с помощью анализатора метаболического потока клеток реального времени. Эти методы помогают в развитии лучшего понимания скелетного гомеостаза, что в конечном итоге может привести к разработке новых терапевтических вариантов, способных улучшить скелетные расстройства.
Анализатор метаболического потока клеток в реальном времени может быть использован для измерения скорости потребления кислорода (OCR) и скорости внеклеточного подкисления (ECAR) живых остеобластов, что соответствует митохондриальной и гликолитической продукции АТФ соответственно. Основополагающим для этой методологии является тот факт, что один ион H+ на лактат высвобождается во время гликолиза при превращении глюкозы в лактат, что изменяет рН среды, отраженный в значениях ECAR. И наоборот, во время цикла TCA (трикарбоновой кислоты) окислительное фосфорилирование через митохондрии производит CO2 путем использования или потребления кислорода, и поэтому мониторинг OCR отражает этот метаболический процесс. Анализатор измеряет как OCR, так и ECAR во внеклеточной микросреде одновременно и в режиме реального времени, что позволяет использовать огромный потенциал при изучении клеточной биоэнергетики 6,17. Кроме того, выполнение этих анализов относительно просто и легко настраивается в зависимости от экспериментальной цели. Аналогичные методы были использованы для дальнейшего понимания метаболической регуляции Т-клеток иммунной системы18,19, инициации рака и прогрессирования20, наряду с несколькими другими типами клеток, способствующими метаболическим синдромам21,22.
Преимущества анализатора метаболических потоков в реальном времени перед альтернативными методами включают (1) возможность измерения клеточной биоэнергетики живых клеток в режиме реального времени, (2) способность выполнять анализ с относительно небольшим количеством клеток (требуется всего 5000 клеток), (3) инъекционные порты для параллельного манипулирования несколькими обработками в высокопроизводительной 96-луночной системе, (4) использование автоматического тепловизора без радиоактивных меток для нормализации18, 23,24. Следующие методы направлены на обобщенное, но подробное описание мониторинга клеточной биоэнергетики в мышиных BMSC на протяжении дифференцировки остеобластов с помощью анализатора. Он будет включать в себя регулярно выполняемые анализы; однако, как и во многих техниках и методах, настоятельно рекомендуется, чтобы отдельные лаборатории определяли конкретные детали для своих экспериментов.
Выбор анализов и различные типы анализов доступны: Доступно большое разнообразие наборов для анализа и реагентов для изучения биоэнергетики клеток, обеспечивая при этом надежность и согласованность экспериментальных результатов. Кроме того, настольное программное обеспечение также предлагает шаблоны анализа, которые можно легко настроить. Анализ может быть определен на основе потребностей пользователя в измерении различных метаболических параметров. Эти анализы могут быть модифицированы различными способами на основе экспериментальной цели и/или научного вопроса. Например, с четырьмя инъекционными портами несколько соединений могут быть введены в пробирную среду для анализа клеточного ответа, специфичного для каждого метаболического пути.
Тест фенотипа клеточной энергии: Этот анализ измеряет метаболический фенотип живых клеток и метаболический потенциал. Этот анализ также рекомендуется в качестве первого шага для получения обобщенного представления о метаболизме, специфичном для пути. Смесь олигомицина А-ингибитора АТФ-синтазы и карбонилцианида 4-(трифторметокси)фенилгидразона (FCCP)-митохондриального разъединяющего агента вводят для понимания энергетического потенциала клетки. Инъекция олигомицина А ингибирует синтез АТФ, что приводит к увеличению скорости гликолиза (ЭКАР), чтобы позволить клеткам удовлетворить свои энергетические потребности; с другой стороны, инъекция FCCP приводит к более высокому OCR из-за деполяризации митохондриальной мембраны. По сути, этот анализ изображает базальное метаболическое дыхание и после двойных инъекций, толчков или стрессов метаболическую реакцию. Основываясь на этих параметрах, программное обеспечение затем строит ГРАФИК OCR и ECAR клеток, классифицируя клетки как аэробное, покоящееся, гликолитическое или энергетическое состояние с течением времени25,26.
Анализ скорости производства АТФ в режиме реального времени: Это измеряет выработку клеточной АТФ одновременно от гликолиза и митохондриального дыхания. Этот анализ количественно измеряет метаболические сдвиги от двух энергетических путей и предоставляет данные о скорости производства митохондриальной и гликолитической АТФ с течением времени. Анализ получает базальные данные OCR и ECAR с последующим расчетом скорости производства митохондриальной АТФ путем инъекции олигомицина А и гликолитической скорости производства АТФ путем инъекции смеси ротенона + антимицина А (полное ингибирование митохондриальной функции), что приводит к митохондриальному подкислению17,27.
Клеточный митохондриальный стресс-тест (или клеточный мито-стресс-тест): Он измеряет митохондриальную функцию через АТФ-связанное дыхание, количественно оценивает клеточную биоэнергетику, идентифицирует митохондриальную дисфункцию и измеряет реакцию клеток на стресс. Различные параметры, включая базальную и запасную дыхательную способность, АТФ-связанное дыхание, максимальное дыхание и немитохондриальное потребление кислорода, могут быть получены в одном анализе. Этот анализ включает последовательные инъекции олигомицина А, FCCP (митохондриального разъединяющего агента), смеси ингибиторов ротенона/ антимицина А для эффективного анализа их влияния на митохондриальную функцию28.
Тест на гибкость топлива: Это измеряет скорость митохондриального дыхания путем окисления трех основных митохондриальных топлив присутствием и отсутствием их ингибиторов. Последовательное ингибирование глюкозы, глутамина и жирных кислот помогает измерить зависимость, емкость и гибкость клеток, а также зависимость клеток в различных клеточных путях для удовлетворения потребности в энергии. Когда митохондрии не могут удовлетворить требования заблокированного пути, представляющего интерес, путем окисления других видов топлива, клетки входят в состояние зависимости. Емкость клеток рассчитывается путем ингибирования двух других альтернативных путей с последующим ингибированием интересующего пути. Гибкость клеток помогает понять способность митохондрий компенсировать и удовлетворять потребности в топливе ингибированного пути. Он рассчитывается путем вычитания зависимости ячеек из емкости ячеек. Три различных ингибитора используются независимо или в виде смеси двух для эффективного расчета параметров анализа. 2-циан-3-(1-фенил-1Н-индол-3-ил)-2-пропеновая кислота (UK5099) ингибирует окисление глюкозы, блокируя пируват-носитель в гликолизе. Бис-2-(5-фенилацетамидо-1,3,4-тиадиазол-2-ил) (BPTES) этилсульфид ингибирует путь окисления глутамина, а этомоксир ингибирует окисление длинноцепочечных жирных кислот29.
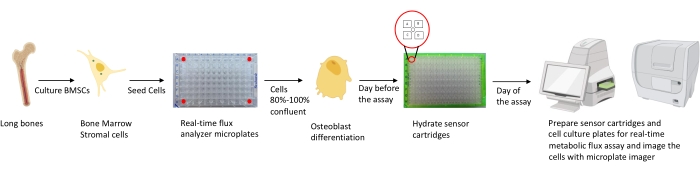
Рисунок 1: Схематическое представление методологии культивирования и подготовки остеобластов к анализу. Мышиные BMSC выделяют из длинных костей, культивируют и засеивают в 96-луночные пластины с плотностью 25 000 клеток на лунку. Культивирование этих клеток в специфических средах остеобластов начинается, когда они достигают 80%-100% конфлюзии, чтобы начать их дифференцировку. Анализы выполняются на разных этапах дифференцировки. Картриджные пластины гидратируются за один день до анализа. В день анализа различные ингибиторы вводятся в порты картриджей датчиков в зависимости от требований анализа, а к калибровочной пластине на 96 скважин добавляется калибровочный буфер. После калибровки выполняется анализ метаболического потока клеток в реальном времени, после чего выполняется визуализация микропластины клеточной культуры с использованием микропластичного тепловизора для нормализации данных анализатора метаболического потока клеток в реальном времени с количеством клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
Все процедуры были основаны на руководящих принципах и одобрении Институционального комитета по уходу за животными и их использованию в Медицинском центре Университета Вандербильта.
1. Подготовка реагентов и пробирная установка
- Выделение и культивирование стромальных клеток костного мозга (см. также предыдущую статью30).
- Получают полную альфа-минимальную незаменимую среду (αMEM) клеточной культуры, дополняя минимальную необходимую среду альфа-модификацией 10% FBS (фетальная бычья сыворотка), 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина.
- Подготовьте трубку для сбора костного мозга, обрезав конец микроцентрифужной трубки объемом 0,6 мл, чтобы клетки могли пройти через нее, и вставив ее в микроцентрифужную трубку объемом 1,5 мл, содержащую 100 мкл полной αMEM.
- Усыплите мышей, используя обработку CO2 следующим образом. Поместите животное в камеруСО2 на 2-3 мин или до прекращения дыхания. Подождите не менее 1 минуты после того, как животное потеряет сознание, чтобы удалить мышей из камеры и вывихнуться из шейки матки.
- Используя стерильные щипцы и ножницы, разрезайте нижнюю часть живота усыпленных мышей, чтобы сделать небольшой разрез. Изолируйте длинные кости (бедренная кость, большеберцовая кость и подвздошный гребень) мышей.
- Обрежьте длинные кости, чтобы удалить все мягкие ткани. После того, как кость очищена, отрежьте ~ 1-2 мм от дистального и проксимального концов, чтобы создать отверстие для промывки костного мозга.
ПРИМЕЧАНИЕ: Это отверстие должно быть консервативным, чтобы избежать потери костного мозга, позволяя ему смываться. - Поместите кости в сборную трубку, содержащую 100 мкл 1x стерильного PBS (фосфатно-буферный физиологический раствор), чтобы изолировать общий костный мозг.
- Промыть костный мозг центрифугированием при 10 000 х г в течение 15-20 с при комнатной температуре. Клетки костного мозга гранулируются в нижней части трубки.
- Повторяют центрифугирование до тех пор, пока костная полость не станет белой и лишенной большинства элементов костного мозга. Повторное суспендирование смешанной популяции костного мозга путем осторожной пипетки вверх и вниз.
- Культивируйте клетки одного животного (как бедренной, так и большеберцовой костей) в колбе для культивирования клетокобъемом 75 см2 в 10 мл среды клеточной культуры и инкубируйте при 37 °C в инкубаторе клеточной культуры с 5% CO2. При объединении клеток от 2-3 животных используйте колбу для культивирования клеток размером 150см2 (рекомендуется).
- После 24-48 ч инкубации смешанной популяции аспирируют неадгезивную популяцию кроветворных клеток, содержащуюся в культуральной среде, и промывают адгезивные клетки 1x PBS.
- Посев клеток из BMSC и дифференцировка остеобластов
- Трипсинизируют адгезивные клетки, добавляя достаточное количество 0,25% трипсина-ЭДТА (примерно 3-4 мл), чтобы слегка покрыть поверхность колбы, с последующей 3-минутной инкубацией при 37 °C.
- Добавьте 6-7 мл полного αMEM в колбу/трипсин, чтобы повторно суспендировать адгезивные BMSC путем тщательной пипетки вверх и вниз. Перенесите суспензию BMSC в коническую центрифужную трубку.
- Удалите 50 мкл аликвоты суспензии BMSC и добавьте к ней 50 мкл трипан-синего (разведение 1:1). Подсчитайте общее количество жизнеспособных клеток, исключающих краситель, путем пипетирования 10 мкл этой смеси на гемоцитометр и наблюдения за ним под микроскопом. Не подсчитывайте мертвые или нездоровые клетки, которые кажутся синими (<10% клеток).
- Основываясь на количестве ячеек, рассчитайте объем клеточной суспензии в полной αMEM, необходимой для конечной концентрации 2,4 х 106 клеток/мл для общего объема не менее 10 мл на пластину.

Рисунок 2: Микропластина клеточной культуры, специально разработанная для анализатора. (A) Выделены четыре фоновые коррекционные ямки, A1, A12, H1, H12. Эти скважины содержат только пробирные среды без каких-либо клеток. (B) Штрих-код на боковой стороне пластины для сканирования пластины с помощью считывателя изображений и анализатора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Центрифугируют клетки в конической трубке при 1000 х г в течение 5 мин и повторно суспендируют клетки до желаемой конечной концентрации 2,4 х 106 клеток/мл.
- Переложить клеточную суспензию в резервуар и, используя многоканальный пипетку, аккуратно повторно суспендировать ячейки, чтобы обеспечить однородную смесь клеток.
- Семена 2,5 х 104 клетки на скважину в 96-луночной микропластине клеточной культуры с 80 мкл полной αMEM. Не засевают клетки в фоновые коррекционные колодцы (А1, А12, Н1, Н12); вместо этого просто добавьте среду в эти четыре скважины.
ПРИМЕЧАНИЕ: BMSC для анализов покрыты микропластиной 96-луночной клеточной культуры, предназначенной для анализатора, совместно с картриджами датчиков. Площадь поверхности этих плит отличается от обычной 96-луночной плиты. Площадь поверхности каждой скважины в плите составляет 0,106см2, что составляет примерно 40% от типичной площади плиты из 96 скважин. Оптимальная плотность посева клеток выбирается в зависимости от типа клетки. Как правило, анализатор может обнаружить от 0,5 до 4 х 104 ячеек на лунку. Остеобласты должны быть в контакте, чтобы эффективно дифференцироваться; для этой цели было выбрано покрытие размером от 2,0 х 10 4-3,0 х 104 БМСК/скважина в 80 мкл полной αMEM. - Аккуратно перемешивают пластину, чтобы обеспечить равномерное распределение клеток в лунках и инкубируют при 37 °C, 5% CO2. Проверьте рост клеток и их слияние под микроскопом через 48 ч. При необходимости измените носитель клеточного культуры.
- В зависимости от цели анализа, когда BMSC являются 60%-80% сливающимися (обычно 48-72 ч), инициируют дифференцировку остеобластов путем изменения среды клеточного культуры на среду дифференцировки остеобластов (полный αMEM, дополненный 5 мМ β-глицеринфосфатом и 50 мкг/мл L-аскорбиновой кислоты).
- Если недифференцированные стромальные клетки (день 0) должны быть проанализированы, поддерживайте клетки под полным αMEM.
- Изменяйте среду дифференцировки остеобластов через день и визуализируйте клетки под микроскопом, чтобы убедиться, что они здоровы до дня анализа. Предпочтительно, за 24 часа до запланированного анализа, измените носитель и поддерживайте последовательный график изменения среды (рекомендуется).
ПРИМЕЧАНИЕ: Осторожно измените носитель, слегка наклонив пластины под углом; это позволяет избежать случайного контакта кончиков пипетки с пластинами клеточной культуры и нарушения работы монослоя клеток.
2. Подготовка картриджа датчика для внеклеточной калибровки потока
- Гидратируйте картриджи датчиков из набора для внеклеточного анализа до дня анализа. Извлеките картриджи датчиков (зеленая пластина) и поместите датчики вверх ногами.
- Используя многоканальный пипетку, добавьте 200 мкл H2O к каждой скважине полезной пластины. Осторожно поместите картриджи датчика обратно на полезную пластину и высиживайте пластину в течение ночи при комнатной температуре.
ПРИМЕЧАНИЕ: Производитель рекомендует инкубировать картриджи датчиков в инкубаторе без CO2 37 °C в течение ночи. Однако может произойти значительное испарение сенсорных картриджей. Если это произойдет, картриджи датчиков могут быть инкубированы при комнатной температуре. Эти пластины должны инкубироваться в течение минимум 4 ч и максимум 72 ч. - В день анализа отбросьтеH2O с полезной пластины и добавьте 200 мкл калибранта. Инкубируйте полезную пластину в течение не менее 1 ч перед анализом.
3. Подготовка среды анализатора метаболического потока клеток в режиме реального времени
- Используйте фенольную красную свободную DMEM-среду с предварительно отрегулированным рН 7,4 (рекомендуется) для проведения анализа с помощью BMSCs.
- Приготовьте 80 мл пробирной среды, дополнив среду DMEM пируватом натрия 1 мМ, глютамином 2 мМ, глюкозой 10 мМ, инсулином 200 нМ, олеиновой кислотой BSA 50-200 мкМ.
- Инкубируйте полную пробирную среду при 37 °C на водяной бане.
4. Подготовка составов для сенсорных картриджей
- Разморозьте олигомицин А, ротенон и антимицин А на льду. Пипетка вверх и вниз для солюбилизации соединений перед использованием.
- Добавляют 3 мл подготовленной пробирной среды в каждую пробирку с последующим добавлением соответствующего соединения-пробирки А: 26,4 мкл 2,5 мМ олигомицина А; трубка B: 3,1 мкл ротенона 12,67 мМ + 4,1 мкл 9,4 мМ антимицина А + 30 мкл пятна Хохста.
- Загрузите 10-кратную концентрацию этих ингибиторов в соответствующий порт. Конечная концентрация необходимых инъекционных растворов составляет 2 мкМ олигомицина А, 1 мкМ ротенона и 4,1 мкМ антимицина А.
ПРИМЕЧАНИЕ: Hoechst добавляется в конечный инжекционный порт для флуоресцентного окрашивания ядер для целей визуализации и нормализации. Эти концентрации могут быть оптимизированы в зависимости от типа клетки. - Загрузите 20 мкл этих соединений в клетки в 180 мкл пробирной среды.
5. Подготовьте микропластинку клеточной культуры к анализу
- Извлеките микропластинку клеточной культуры из инкубатора с температурой 37 °C и понаблюдайте за клетками под микроскопом.
- Снимите пробирную среду с водяной бани.
- Аккуратно промыть клетки 200 мкл пробирной среды дважды и добавить 200 мкл пробирной среды на лунку.
ПРИМЕЧАНИЕ: После добавления окончательной среды анализа в ячейки решающее значение имеет время, пока пластины не попадут в анализатор. Поэтому не начинайте замену носителя до тех пор, пока в течение 1 часа не будут выполнены следующие действия. - Проверьте клетки под микроскопом, чтобы убедиться, что клетки остаются прикрепленными к лункам.
- Убедитесь, что ячейки в D5 и E8 прикреплены к последовательному монослою и не смываются во время этапа стирки. Программное обеспечение для визуализации клеток использует эти две скважины для настройки автофокуса и автоэкспозиции.
ПРИМЕЧАНИЕ: Завод-изготовитель рекомендует инкубировать пластину в инкубаторе безСО2 37°С в течение 1 ч; Этот шаг можно пропустить, если предпочтение отдается автоматическому созданию образов. Например, микропластинчатый тепловизор поддерживает те же условия в закрытой камере, и клетки могут быть визуализированы под ярким полем.
6. Настройка анализа и визуализации
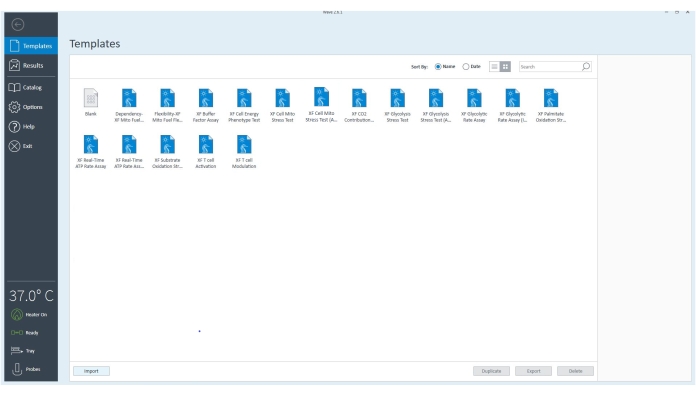
Рисунок 3: Программное обеспечение контроллера. Программное обеспечение проверяет, подключено ли оборудование и установлено на 37 °C. Файлы шаблонов для различных анализов, которые могут быть выполнены с помощью внеклеточного анализатора потока, могут быть выбраны для дальнейшей настройки анализа на основе экспериментальных целей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Откройте настольное программное обеспечение на компьютере рядом с оборудованием.
- Проверьте состояние подключения в левом нижнем углу программного обеспечения контроллера.
- Перейдите в раздел Шаблоны и выберите файл шаблона XF ATP Rate Assay или соответствующий шаблон анализа.
- Выберите Определения групп в верхней части экрана и определите группы.
- Выберите макет карты плит и назначьте скважины в зависимости от определенных групп.
- Проверьте протокол прибора, убедитесь, что добавленные соединения перечислены правильно, и включите информацию о проекте для будущих ссылок.
- Нажмите на Run Assay; это приведет к выбору места хранения результирующего файла.
- Выберите расположение для сохранения результирующего файла.
- Сохраните файл с датой анализа и нажмите « Начать запуск».
- Поместите картридж датчика и пластину утилиты на лоток и нажмите «Я готов начать калибровку».
- Перед началом калибровки убедитесь, что крышка картриджа снята, а картридж датчика размещен в правильной ориентации на вспомогательной пластине. Этот шаг займет 10-20 минут, и после завершения программное обеспечение отобразит диалоговое окно Load Cell Plate .
7. Получение изображений яркого поля
ПРИМЕЧАНИЕ: Этот шаг является необязательным. Если оборудование для обработки изображений недоступно, перейдите к шагу 8.

Рисунок 4: Программное обеспечение для визуализации клеток взаимодействует со считывателем изображений через компьютер. Клетки в микропластине могут быть визуализированы до и после анализа, а количество клеток / скважина получено после анализа для нормализации данных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Откройте программное обеспечение для визуализации клеток на компьютере.
- Убедитесь, что тепловизор микропластин включен, а порты подключены к компьютеру.
- Проверьте строку состояния в левом нижнем углу экрана, чтобы убедиться, что температура установлена на 37 °C и что состояние подключения должно быть выделено зеленым цветом как готовое.
- Отсканируйте штрих-код пластины, чтобы начать процесс визуализации.
- Введите имя ячейке и нажмите Сохранить (это имя, в котором будут сохранены как яркие поля, так и флуоресцентные изображения). Нажмите Выполнить сканирование Brightfield.
- На следующем экране, табличке и в меню сканирования отображаются параметры визуализации. Перед анализом выберите Начать сканирование Brightfield.
- Поместите микропластинку клеточной культуры вместе с крышкой/крышкой пластины на держатель лотка и выровняйте колодец A1 с маркировкой A1. Нажмите закрыть лоток.
- Появится следующий экран, получение изображения яркого поля, с картой пластин. Нажмите « Сканировать все скважины», что инициирует процесс инициализации системы, за которым следует от 30 до 35 минут сканирования.
- После сканирования brightfield извлеките микропластинку клеточной культуры и поместите ее в анализатор для выполнения анализа.
8. Проведение анализа
- После завершения калибровки программное обеспечение отображает диалоговое окно Тензодатчик Пластина .
- Нажмите « Открыть лоток», чтобы заменить вспомогательный лоток микропластинкой клеточной культуры. Убедитесь, что крышка снята, а A1 пластины помещается в правильной ориентации.
- Затем нажмите на пластину тензодатчика , чтобы начать анализ. Картридж датчика останется внутри анализатора для пробирных инъекций.
- Дождитесь начала анализа и отобразите предполагаемое время завершения.
- После завершения анализа программное обеспечение отображает диалоговое окно Выгрузить картридж датчика . Нажмите кнопку Извлечь и извлеките микропластинку клеточной культуры из анализатора.
- Осторожно снимите картридж датчика и замените крышку пластины ячейки. Клетки готовы к флуоресцентной визуализации и подсчету клеток.
- После извлечения ячейки и картриджа датчика появится диалоговое окно Анализ завершен .
- Нажмите «Просмотреть результаты», чтобы открыть файл результатов анализа и немедленно нормализовать данные, или нажмите « Главная».
9. Получение флуоресцентных изображений и нормализация
ПРИМЕЧАНИЕ: Этот шаг является необязательным, но предпочтительным методом нормализации BMSC и остеобластов. Если оборудование для визуализации недоступно, необходимо выполнить другой метод нормализации, такой как выделение и количественная оценка белка или ДНК.

Рисунок 5: Репрезентативные изображения из программного обеспечения для визуализации, используемого для нормализации данных из анализа. (A) Сшитое изображение яркого поля, показывающее слияние клеток по всей скважине. (B) Сшитое флуоресцентное изображение, показывающее окрашенные Хёхстом ядра остеобластов, используемые для подсчета числа клеток для нормализации результатов анализа. Это остеобласты после 7 дней дифференцировки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- После завершения анализа отсканируйте штрих-код пластины с помощью портативного считывателя штрих-кодов. Если пластина уже была изображена, она не потребует нового имени.
- Выберите «Флуоресценция и количество ячеек», поместите ячейку на держатель лотка и нажмите « Закрыть лоток».
- В окне получения изображения выберите Сканировать все скважины, чтобы начать визуализацию. Флуоресцентная визуализация занимает около 15-20 минут для сканирования всей пластины. Обратите внимание на зеленую галочку, обозначающую, что сканирование завершено.
- Просмотрите флуоресцентные изображения и количество клеток в приложении визуализации и визуализации клеток, случайным образом щелкнув по паре лунок.
ПРИМЕЧАНИЕ: Есть возможность просмотра подсчитанных ячеек в правом нижнем углу экрана. Этот параметр показывает маскированное изображение, выделяя объекты, которые были подсчитаны. - После завершения флуоресцентной визуализации экспортируйте изображения для получения дополнительных ссылок.
- После завершения обработки изображений и подсчета ячеек откройте файл результатов и нажмите « Нормализовать». Экран нормализации даст макет пластины и возможность импортировать количество ячеек.
- Нажмите «Импорт» и выберите «Применить для настольного программного обеспечения», чтобы автоматически нормализовать анализ с количеством ячеек.
Access restricted. Please log in or start a trial to view this content.
Результаты
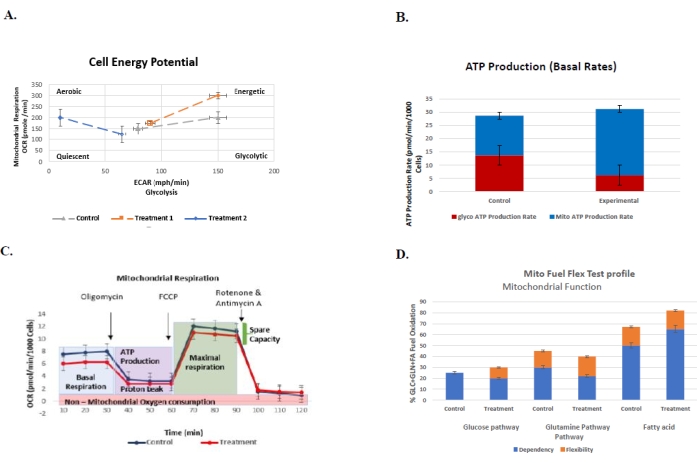
Рисунок 6: Репрезентативные графики для регулярно выполняемых анализов для понимания клеточного биоэнергетического профиля контрольной и лечебной группы с их соответствующими стандартными ошибками....
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Анализатор метаболического потока клеток в реальном времени может быть использован для изучения клеточной энергетики в различных условиях. Протокол иллюстрирует эффективную изоляцию BMSC, культивирование клеток в соответствующих пластинах клеточной культуры и их дифференцировку в з?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом Национального института здравоохранения (NIH), Национальным институтом артрита и заболеваний опорно-двигательного аппарата и кожных заболеваний (NIAMS) AR072123 и грантом Национального института по проблемам старения (NIA) AG069795 (для ERR).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma - Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma - Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma - Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma - Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma - Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma - Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma - Aldrich | O3008 | |
| Oligomycin A - 5 mg | Sigma - Aldrich | 75351 | |
| Rotenone | Sigma - Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies - BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
Ссылки
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073(2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, Clifton, N.J. 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1(2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918(2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081(2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511(2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- What are the advantages of using Seahorse XF technology. , Available from: https://www.agilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018).
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- XF cell energy phenotype test. , Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021).
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, Clifton, N.J. 285-293 (2018).
- XF ATP rate assay. , Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021).
- XF cell mito stress test. , Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021).
- XF cell mito fuel flex test. , Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021).
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750(2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004(2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены