Method Article
أنسجة رئوية هندسية محضرة من شرائح رئوية منزوعة الخلايا
In This Article
Summary
يصف هذا البروتوكول طريقة لتوليد أنسجة رئوية هندسية قابلة للتكرار على نطاق صغير، عن طريق إعادة ملء شرائح الرئة الدقيقة المقطوعة بدقة مع الخلايا الظهارية السنخية من النوع 2، والخلايا الليفية، والخلايا البطانية.
Abstract
هناك حاجة إلى تحسين نماذج الرئة ثلاثية الأبعاد (3D) التي تلخص التعقيد المعماري والخلوي للحويصلات الهوائية الرئوية الأصلية خارج الجسم الحي. سهلت النماذج العضوية التي تم تطويرها مؤخرا توسيع ودراسة السلف الظهاري الرئوي في المختبر ، ولكن هذه المنصات تعتمد عادة على مصفوفة و / أو مصل مشتق من ورم الفئران ، وتتضمن سلالة خلوية واحدة أو اثنتين فقط. هنا ، نصف بروتوكولا لتوليد أنسجة الرئة الهندسية (ELTs) استنادا إلى إعادة التجميع متعدد السلالات لشرائح الرئة المقطوعة بدقة (PCLS). تحتوي ELTs على هياكل تشبه السنخية تضم ظهارة سنخية ، ولحمة متوسطة ، وبطانة ، داخل ركيزة مصفوفة خارج الخلية (ECM) تشبه إلى حد كبير تلك الموجودة في الرئة الأصلية. لتوليد الأنسجة ، يتم تضخيم رئتي الفئران باستخدام الأغاروز ، وتقطيعها إلى شرائح بسماكة 450 ميكرومتر ، وتقطيعها إلى شرائح ، وإزالة خلاياها. ثم يتم إعادة زرع سقالات ECM اللاخلوية الناتجة بالخلايا البطانية الأولية والخلايا الليفية والخلايا الظهارية السنخية من النوع 2 (AEC2s). يمكن الحفاظ على AEC2s في ثقافة ELT لمدة 7 أيام على الأقل باستخدام وسط نمو خال من المصل ومحدد كيميائيا. طوال عملية تحضير الأنسجة وزراعتها ، يتم قص الشرائح في نظام كاسيت يسهل التعامل مع العديد من ELTs وبذرها بشكل موحد بالتوازي. تمثل ELTs هذه منصة استزراع عضوي من شأنها تسهيل التحقيقات في تفاعلات الخلايا الخلوية ومصفوفة الخلايا داخل الأسناخ بالإضافة إلى الإشارات الكيميائية الحيوية التي تنظم AEC2s ومكانتها.
Introduction
الحويصلات الهوائية هي الوحدات الوظيفية للرئة البعيدة ، التي تضم شبكة من المساحات الهوائية المتبادلة للغاز التي تصطف على جانبيها الخلايا الظهارية السنخية من النوع 1 (AEC1s) وخلايا النوع 2 (AEC2s). يوجد وراء الظهارة شبكة كثيفة من الشعيرات الدموية بالإضافة إلى اللحمة المتوسطة الداعمة ، وكلها مدعومة بسقالة مصفوفة خارج الخلية (ECM) توفر القوة والمرونة لهذه الأكياس الهوائية الحساسة1. الحويصلات الهوائية هي أيضا موقع الإصابة في العديد من أمراض الرئة ، بما في ذلك التليف الرئوي مجهول السبب2 ، ومتلازمة الضائقة التنفسية الحادة3 ، ومرض فيروس كورونا الوخيم-19 (COVID-19)4. على الرغم من أن العمل على مدى العقد الماضي قد كشف عن مرونة ملحوظة داخل ظهارة الرئة ، إلا أن الآليات التي تمكن من إصلاح الرئة البعيدة في بعض البيئات - والتي تمنع الإصلاح في أماكن أخرى - لا تزال مجالا للتحقيق المكثف5. إن تطوير منصات محسنة في المختبر لنمذجة الحويصلات الهوائية من شأنه أن يسهل دراسات البيولوجيا السنخية والتجديد والعلاجات.
AEC2s تجديد ذاتي وتمييز في AEC1s ، وبالتالي تعتبر الخلية الجذعية الأولية للرئة البعيدة6،7،8. ومع ذلك ، تشكل هذه الخلايا تحديا خاصا للدراسة في المختبر نظرا للصعوبات المرتبطة بزراعة AEC2s الأولية دون فقدان النمط الظاهري9. في الثقافة التقليدية ثنائية الأبعاد (2D) ، تقوم AEC2s بتسطيح واعتماد بعض ميزات الخلايا الشبيهة ب AEC110. في المقابل ، تدعم استراتيجيات الاستزراع ثلاثي الأبعاد ، وهي الأكثر شيوعا من المواد العضوية ، الحفاظ على الميزات المتباينة في AEC2s الأولية 6,11,12 وتسمح بزراعة طويلة الأجل للخلايا الجذعية متعددة القدرات (PSC) المشتقة من AEC2s13,14. تم استخدام المواد العضوية لنمذجة تطور الرئة البعيدة 15 ، والعدوى الفيروسية11،15 ، والأمراض الوراثية المرتبطة ب AEC213،16،17 ، مما يتيح رؤى مهمة في بيولوجيا AEC2 والتجديد. ومع ذلك ، فإن نماذج الثقافة هذه تتكون عادة من سلالة خلوية واحدة أو اثنتين فقط ، وتقوم بتضمين الخلايا في مصفوفات من نوع الهلام تفشل في تلخيص إما البنية أو الركيزة ECM للحويصلات الهوائية الرئوية الأصلية.
ECM هو منظم حاسم للنمط الظاهري للخلية والسلوك عبر الإشارات الجزيئية والطبولوجية والميكانيكية. يضم مكونا رئيسيا من المنافذ الخاصة بالأنسجة التي تنظم مصير الخلايا الجذعية ؛ ويعمل كخزان يعدل توافر عوامل النمو المفرزة محليا18،19،20،21. وبالتالي ، فإن زراعة الخلايا على ECM الأصلي قد تزيد من القدرة التنبؤية للأنظمة المختبرية لنمذجة بيولوجيا الأنسجة في الجسم الحي. يمكن أن تحافظ إزالة الخلايا ، وهي عملية تزيل المواد الخلوية من الأنسجة عبر المنظفات أو الإنزيمات أو الطرق الفيزيائية أو غيرها ، على سقالات ECM للعضو الأصلي ، عند تنفيذها بعناية22,23. يمكن إعادة توطين هذه السقالات بخلايا لثقافة المحاكاة الحيوية 3D. ومع ذلك ، في حين أن السقالات المنزوعة الخلايا تستخدم على نطاق واسع لتطبيقات هندسة الأنسجة ، إلا أن استخدامها لزراعة الخلايا الروتينية كان محدودا. وقد أبلغت العديد من الدراسات السابقة عن إزالة الخلايا وإعادة التوطين لشرائح الرئة أو أجزاء أنسجة الرئة الصغيرة. بالإضافة إلى دراسات إثبات المفهوم24،25،26 ، تم استخدام شرائح الرئة المعاد تجميعها لدراسة التصاق مصفوفة الخلايا الليفية 27،28 والتحقيق في تأثير مصفوفات الرئة المريضة على النمط الظاهري للخلايا الليفية27،29. مع التقنيات المحسنة المتاحة لتوليد شرائح الأنسجة المقطوعة بدقة ، يمكن أن توفر شرائح الرئة المنزوعة الخلايا منصة مريحة وصغيرة النطاق لزراعة الخلايا ، مع الحفاظ على الهياكل الفرعية السنخية ومجرى الهواء والأوعية الدموية. دمج أنواع متعددة من الخلايا من شأنه أن يمكن من دراسات التفاعلات بين الخلايا والخلايا داخل بيئة 3D ذات الصلة من الناحية الفسيولوجية. ومع ذلك ، هناك حاجة إلى استراتيجيات محسنة لتسهيل التعامل مع الأنسجة طوال عملية الزراعة ، وضمان البذر المتحكم فيه والقابل للتكرار للأنسجة ذات الأعداد المعروفة من الخلايا.
هنا ، نقدم بروتوكولا لتوليد أنسجة الرئة الهندسية (ELTs) عن طريق إعادة ملء شرائح الرئة المقطوعة بدقة (PCLS) مع الخلايا البطانية الأولية ، AEC2s ، والخلايا الليفية. في تكييف لنظام أنسجة القلب الهندسيالموصوف سابقا 30 واستراتيجيات إزالة الخلايا وإعادة الخلية الكاملة للرئة 22,31 ، نصف إجراءات لقطع PCLS من رئتي الفئران وقص الشرائح إلى أشرطة زراعة الأنسجة القابلة لإعادة الاستخدام التي تبسط وتوحد التلاعب في المصب. يتم إزالة الشرائح المقطوعة لتشكيل سقالات ECM غير الخلوية ، والتي يتم إعادة تعبئتها في حمامات البذر المخصصة. تحافظ سقالات شرائح الرئة على مكونات وبنية ECM المهمة ، وتدعم نمو AEC2s داخل هياكل تشبه السنخية متعددة السلالات لمدة 7 أيام على الأقل. تمثل ELTs نظاما جديدا للزراعة المشتركة السنخية ضمن مصفوفة ثلاثية الأبعاد ذات صلة من الناحية الفسيولوجية ، والتي يجب أن تدعم تطوير استراتيجيات هندسة أنسجة الرئة ، مع تسهيل الدراسات البيولوجية الأساسية ل AEC2s والأسناخ.
Protocol
تمت الموافقة على جميع إجراءات التجارب على الحيوانات الموصوفة في هذه الورقة من قبل لجنة ييل المؤسسية لرعاية الحيوانات واستخدامها.
1. إنشاء أشرطة زراعة الأنسجة وحمامات البذر
ملاحظة: بمجرد صنعها، يمكن تعقيم أشرطة زراعة الأنسجة وحمامات البذر وإعادة استخدامها في الجولات المتكررة من ثقافة ELT.
-
أشرطة كاسيت زراعة الأنسجة
- استخدم قاطع ليزر لقطع إطارات كاسيت زراعة الأنسجة ومشابك من البولي تترافلورو إيثيلين (PTFE) بسمك 3/32 بوصة وفقا للتصميمات الواردة في الملف التكميلي 1 والملف التكميلي 2 ، على التوالي. استخدم قاطع ليزر لقطع علامات تبويب كاسيت زراعة الأنسجة من PTFE بسماكة 1/16 بوصة وفقا للملف التكميلي 3. يحدد القطع 3x باستخدام 80٪ من الطاقة و 15٪ من السرعة (لقاطع ليزر 30 واط).
-
حمامات البذر
- استخدم ملفات CAD لحمام البذر (الملف التكميلي 4 والملف التكميلي 5) لطباعة قاعدة وحلقة قالب حمام البذر ثلاثي الأبعاد ، على التوالي ، باستخدام راتنج شفاف.
- نقع القوالب في محلول من 10٪ poloxamer 407 في الماء المقطر بين عشية وضحاها قبل الاستخدام للمساعدة في إطلاق PDMS. اتركي الهواء يجف ، ثم ضعي الحلقة فوق قاعدة القالب ولفها في طبقة بلاستيكية مرنة للمساعدة في منع التسرب.
- تحضير ما لا يقل عن 60 غرام لكل قالب من polydimethylsiloxane (PDMS) عن طريق خلط المطاط الصناعي PDMS في نسبة 10: 1 مع عامل المعالجة ، وتصب في القالب المطبوع 3D. قم بتفريغ PDMS في مجفف فراغ لمدة 30 دقيقة لإزالة أي فقاعات هواء.
- خبز حمامات البذر في 60 درجة مئوية لمدة 8 ساعات.
2. إعداد شرائح الرئة المقطوعة بدقة من رئتي الفئران
- حصاد الأعضاء
- قم بإعداد نظام تروية مقسم يضم أطرافا تعمل بالجاذبية والمضخة، كما هو موضح في الشكل 1. قم بتوصيل قنية الشريان الرئوي (PA) بنهاية الأنبوب ، والتي تتكون من موصل Y شائك 1/16 بوصة متصل بطول 1/2 بوصة من أنابيب السيليكون LS 14 وموصل قفل luer 3/32 بوصة أنثى (انظر الشكل 1). لا تقم بإرفاق صمام فحص بالقنية في الوقت الحالي.
- قم بتعبئة الخطوط التي تحتوي على PBS التي تحتوي على 100 U / mL heparin و 0.01 mg / mL sodium nitroprusside (SNP) لمنع التخثر وتوسع الأوعية ، على التوالي. اضبط مضخة التروية مسبقا على 30 مل / دقيقة.
ملاحظة: أضف SNP طازجا إلى محلول الهيبارين واحتفظ به محميا من الضوء. - جرعة شخص بالغ (8-12 أسبوعا ، حوالي 300-350 جم) من فأر Sprague-Dawley مع حقن داخل الصفاق (IP) من 400 U / kg heparin لمكافحة التخثر ، تليها حقنة IP من الكيتامين (75 mg / kg) و xylazine (5 mg / kg) للتخدير. تأكد من وجود مستوى جراحي للتخدير عن طريق عدم الاستجابة للتحفيز الضار (قرصة إصبع القدم).
- تقليم الصدر والبطن من الفراء باستخدام قص الشعر. ثم رش مع 70٪ الإيثانول ومسح 3x مع 10٪ البوفيدون اليود.
- أمسك الجلد تحت مستوى الحجاب الحاجز باستخدام ملقط أسنان الفئران. ثم قم بعمل شق عرضي 1/2 بوصة في الجلد باستخدام مقص مدبب بدقة. أمسك اللفافة البطنية المكشوفة باستخدام الملقط ، وقم بعمل شق عرضي 1/2 بوصة في اللفافة ، ثم قم بتمديد الشق عبر الجلد واللفافة عبر عرض الجزء العلوي من البطن.
- استخدم طرف المقص الدقيق لإجراء شق صغير (لا يزيد عن 1/8 بوصة) في وسط الحجاب الحاجز الأمامي ، مما يتسبب في تراجع الرئتين في الصدر. قم بتمديد الشق في الحجاب الحاجز عبر العرض الكامل للصدر.
- قم بعمل شقين عموديين من خلال الارتفاع الكامل للقفص الصدري نحو الرقبة ، مع الحرص على عدم إتلاف الرئتين. قم بتمديد الشق من خلال الأضلاع اليسرى لقطع عظمة الترقوة وعلى طول جانب الرقبة إلى مستوى الحنجرة ، مما يعرض القصبة الهوائية.
- تشريح القصبة الهوائية خالية من النسيج الضام المحيط ومن المريء. قم بعمل شق عرضي عبر النصف الأمامي من القصبة الهوائية بين حلقتين غضروفيتين ، بالقرب من الحنجرة. خيط خياطة من البولي بروبيلين 4-0 خلف القصبة الهوائية ، أسفل مستوى الشق ، وربط النصف الأول من عقدة الجراح بشكل فضفاض مع اثنين من اللفات.
- ضع قنية تتكون من موصل Y شائك مقاس 1/16 بوصة متصل بصمام فحص أحادي الاتجاه وبطول 1/2 بوصة من أنابيب السيليكون LS 14 مع موصل قفل luer أنثوي مقاس 3/32 بوصة (انظر الشكل 1) في القصبة الهوائية عن طريق إدخال طرف واحد من موصل Y في شق القصبة الهوائية باتجاه الرئتين.
- ضع حلقة الخياطة المربوطة مسبقا حول القصبة الهوائية على مستوى القنية المدرجة وقم بإحكامها حول موصل Y المدرج لتثبيت القنية في مكانها. أضف رميتين أحاديتي الالتواء من الخيط لإكمال العقدة.
- املأ حقنة 10 مل بالهواء واتصل بقفل luer في قنية القصبة الهوائية.
- قم بتثبيت الوريد الأجوف السفلي بالقرب من الحجاب الحاجز باستخدام مرقئ منحني ، ثم حقن القلب ب 150 U heparin (1000 U / mL) عبر البطين الأيمن (RV).
- افتح جزئيا خط الجاذبية ، لإنتاج قطرة بطيئة ولكن ثابتة من PBS / الهيبارين / SNP من قنية PA المعدة في الخطوة 2.1.1.
- خيط إبرة خياطة البولي بروبيلين 4-0 خلف قاعدة PA حيث تخرج من RV. استخدم النصف الأول من عقدة الجراح لربط حلقة فضفاضة من الخيط حول قاعدة PA.
- قم بعمل شق صغير (لا يزيد عن 1/8 بوصة) في RV أسفل PA مباشرة وعموديا على PA باستخدام مقص دقيق ، ثم أدخل طرفا واحدا من موصل Cannula Y-connector PA في قاعدة PA. قم بتأمين الخيط حول PA والموصل المدرج وأضف رمية أحادية الالتواء لإكمال عقدة الجراح.
ملاحظة: يمنع تعليب PA تحت التدفق إدخال فقاعات الهواء إلى الأوعية الدموية التي يمكن أن تمنع التطهير الكافي للرئتين. - قم بتوصيل صمام أحادي الاتجاه بالطرف الآخر من موصل قسطرة PA Y، ثم اقطع قمة القلب للسماح بتدفق الدم عبر البطين الأيسر.
ملاحظة: الفشل في قطع قمة القلب قبل الاختراق عبر المضخة يمكن أن يسبب تلفا لحاجز غاز الدم، مما يؤدي إلى تسرب السوائل إلى المجالات الجوية. - قم بتبديل خط التروية إلى جانب المضخة باستخدام مفتاح التوقف الذي يربط الخطين، ثم قم بتشغيل المضخة بسرعة 30 ملليلتر/دقيقة. أثناء اختراق الرئتين عبر PA ، قم بتهوية الرئتين يدويا عبر حقنة القصبة الهوائية سعة 10 مل في حوالي 10-15 نفسا / دقيقة ، لتسهيل تطهير الرئتين من الدم. قم بدمج الرئتين حتى تتحول إلى اللون الأبيض في الغالب ، وعادة ما تتطلب 40 مل من PBS / الهيبارين / SNP أو أقل.
ملاحظة: قد يؤدي عدم كفاية تطهير رئتي الدم إلى إضعاف إزالة الخلايا من المصب. - قطع القصبة الهوائية الخلفية فوق مستوى قنية القصبة الهوائية مباشرة ، ثم تشريح الرئتين والقلب خالية من جميع الأنسجة الضامة المتبقية واستخراج الرئتين والقلب في كتلة.
- املأ حقنة سعة 10 مل بأغاروز منخفض درجة الانصهار بنسبة 2٪ في محلول الملح المتوازن من هانك (HBSS) بدون أحمر الفينول ، مع تسخينه مسبقا إلى 42 درجة مئوية.
ملاحظة: يختلف الحجم الدقيق للأغاروز المطلوب حسب حجم الرئة. تتطلب الرئتين الأكبر (أي من الفئران التي يزيد حجمها عن 400 جم) أكثر من 10 مل من الأغاروز. - قم بتضخيم الرئتين المستخرجتين يدويا 3x مع 10 مل من الهواء (أي إلى إجمالي سعة الرئة تقريبا) عبر قنية القصبة الهوائية للمساعدة في تجنيد حمة منهارة.
- قم بتضخيم الرئتين على الفور باستخدام حقنة الأغاروز المحضرة عن طريق حقن الأغاروز يدويا عبر قنية القصبة الهوائية بمعدل 40 مل / دقيقة تقريبا ، فقط حتى يتم تضخيم الأطراف الأكثر بعدا من فصوص الرئة. إذا ظلت المناطق البعيدة من الرئة منهارة ، فقم بحقن 1-2 مل إضافي من الأغارو.
- قم بتغطية القصبة الهوائية عن طريق إرفاق الغطاء الأبيض من ستوبكوك 4 اتجاهات إلى قفل اللوير الأنثوي لقنية القصبة الهوائية. ضع الرئة في طبق بتري 150 مم على الجليد للسماح للأغاروز بالتصلب.
ملاحظة: تضخم الرئة بعد فترة وجيزة من الاستخراج أمر بالغ الأهمية لضمان ملء موحد لحمة الرئة ، وما يتبع ذلك من تقطيع الأنسجة بنجاح. إذا انتفخت الرئة بشكل غير متساو للغاية ، فلا تمضي قدما في تقطيع الرئة لأن جودة الشريحة ستكون رديئة.
- تقطيع الرئة
ملاحظة: قد يلزم تكييف إجراء التقطيع الدقيق استنادا إلى الميكروتوم الاهتزازي (الاهتزازي) المستخدم؛ تم نشر أمثلة إضافية لإعداد PCLS مع مقسمات الأنسجة المختلفة سابقا 32،33،34.- قم بتبريد كتلة التبريد المعدنية مسبقا عند -20 درجة مئوية واحتفظ بها على الجليد عند عدم استخدامها طوال عملية التقطيع.
- استخدم قطرة صغيرة من غراء سيانواكريليت لتوصيل شفرة بحامل الشفرة. قم بتوصيل حامل الشفرة بعناية بالاهتزاز باستخدام مفتاح Allen بحيث يصطف فقط مع نهاية أنبوب العينة المدرج في درج التخزين المؤقت.
- تحضير 6 أطباق جيدة مع 3 مل لكل بئر معقمة الجليد الباردة HBSS دون الفينول الأحمر لجمع الشرائح.
- باستخدام مشرط ، قطع قطعة من أنسجة الرئة حوالي 1-1.5 سم3.
ملاحظة: أنسجة الرئة من الأجزاء السفلية والمتوسطة من الفص الأيسر، وكذلك من الفصوص الوسطى والسفلية اليمنى، تنتج بسهولة شرائح أنسجة أكبر تزيد من المساحة السنخية. في حالة وجود مناطق الأنسجة غير المتضخمة أو مناطق النسيج الضام ، إما أن تقليم هذا النسيج بالمقص أو توجه لأسفل نحو المكبس ؛ هذه الأنسجة لا تميل إلى قطع نظيفة. - ضع قطرة صغيرة من غراء سيانو أكريليت على مكبس أنبوب العينة. ضعي مناديل الرئة على منديل ورقي لإزالة الرطوبة الزائدة، ثم ضعي أنسجة الرئة على الفور فوق المكبس باستخدام زوج من الملقط.
- حرك الأنبوب المعدني لأنبوب العينة حتى مستوى الجزء العلوي من الأنسجة واحتفظ به في مكانه ، مع انحسار المكبس. قامت ماصة بتسخين 2٪ من الأغاروز مسبقا في HBSS في الجزء العلوي من الأنبوب لإحاطة الأنسجة بالكامل.
- ضع كتلة التبريد الباردة حول الأنسجة لمدة 1 دقيقة تقريبا للسماح للأغاروز بالتصلب.
- أدخل أنبوب العينة في درج المخزن المؤقت. املأ الدرج ب PBS البارد المثلج في منتصف الطريق حتى كتلة الأنسجة. أدر مفتاح صندوق المحرك إلى الأمام السريع (FF) لدفع مكبس صندوق المحرك بحيث يلمس فقط قاعدة أنبوب العينة.
- اضبط الإعدادات المطلوبة لسمك الشريحة وسرعة القطع وتردد التذبذب ، على سبيل المثال ، سمك 450 ميكرومتر والسرعة 4 وتردد التذبذب 5. حدد الوضع المستمر، ثم اقلب المفتاح إلى تشغيل لبدء التقطيع.
- عندما تسقط شرائح الأنسجة في الدرج العازل ، انقلها إلى ألواح 6 آبار محضرة باستخدام حلقة تطعيم أو ملعقة.
- توقف عن التقطيع عندما يبقى سمك الأنسجة ~ 2 مم في أنبوب العينة ، لتجنب إتلاف الشفرة أو قطع الأنسجة التي تحتوي على الغراء.
- كرر الخطوات المذكورة أعلاه لتقطيع أنسجة رئوية إضافية ، حسب الرغبة.
- قم بإزالة الشرائح على الفور لإعداد السقالة ، أو قم بتجميدها وتخزينها عند -80 درجة مئوية لمدة تصل إلى 2 أشهر. للتجميد ، انقل 4-6 شرائح إلى طبق بتري 35 مم واستنشق بعناية أي سوائل زائدة من حول الشرائح. ضع الأطباق في حمام من الثلج الجاف والإيثانول بنسبة 100٪ لتجميدها ، ثم لفها في رقائق معدنية ، وأغلقها في كيس بلاستيكي ، وانقلها إلى -80 درجة مئوية.
ملاحظة: لا تضع شرائح طازجة مباشرة في الفريزر -80 درجة مئوية لأن معدل التجميد البطيء نسبيا يمكن أن يتسبب في تكوين بلورات ثلج يمكن أن تلحق الضرر بالأنسجة.
3. إعداد سقالات أنسجة الرئة
- إعداد المواد وحلول إزالة الخلايا
- إطارات الأوتوكلاف والمقاطع وعلامات التبويب.
- إعداد حلول إزالة الخلايا على النحو المبين في الجدول 1.
ملاحظة: أضف نوكلياز البنزوناز إلى المخزن المؤقت الذي تم تسخينه مسبقا مباشرة قبل الاستخدام ومرشح معقم. قم بإعداد محاليل Triton X-100 و deoxycholate الصوديوم (SDC) في غضون 24-48 ساعة من إجراء إزالة الخلايا. تحضير حلول المضادات الحيوية / المضادة للفطريات والعازلة البنزوناز تصل إلى 30 د مقدما وتخزينها في 4 درجات مئوية.
- قطع وقص شرائح الرئة
ملاحظة: في حين أن القطع والقطع يمكن أن يتم بشكل غير معقم على سطح الطاولة ، يجب إجراء خطوات إزالة الخلايا في القسم 3.3 وجميع المناولة اللاحقة لسقالات الأنسجة في غطاء تدفق صفائحي.- املأ طبق بتري 100 مم حوالي الثلث ممتلئا ب PBS. انقل الكاسيت (إطارات تحتوي على مقطعين لكل منهما) وعلامات تبويب إلى الطبق باستخدام الملقط.
- إذا كنت تستخدم شرائح مجمدة ، فقم بإذابة طبق واحد في كل مرة عن طريق صب PBS في درجة حرارة الغرفة في الطبق لتغطية الشرائح. احتفظ بالأطباق المتبقية على الثلج الجاف.
- انقل شريحة مذابة إلى طبق بتري 150 مم. قم بفتح الشريحة بلطف باستخدام ملقط ناعم ، إذا لزم الأمر ، بحيث تكون مسطحة ، ثم استطلع PBS الزائد بعناية من حول الأنسجة.
- استخدم شفرة حلاقة، مع مسطرة كدليل، لقطع شريط بعرض 3 مم من الشريحة عن طريق الضغط على كامل طول الشفرة بإحكام على الطبق وهزه قليلا من جانب إلى آخر مع تثبيت حافة الشفرة في مكانها. بدلا من ذلك ، استخدم قاطعا دوارا تم تحديثه بشفرات متوازية 2 مفصولة بفاصل مخصص 3 مم (على سبيل المثال ، مصنوع من الأسيتال [polyoxymethylene]) لقطع شرائط الأنسجة. تجنب أي تمزقات أو ثقوب أو ممرات هوائية أو أوعية كبيرة أو نسيج ضام سميك.
ملاحظة: للقص الناجح، يجب ألا يقل طول الشريط عن 9 مم. - باستخدام الملقط ، انقل شريط الأنسجة إلى طبق بتري 100 مم المحضر.
- قم بقص شريط الأنسجة في الكاسيت: قم بتعويم الأنسجة فوق الكاسيت ، مع توسيط الأنسجة لتعليق الثقوب الموجودة في المشابك في كلا الطرفين. باستخدام ملقط ناعم ، ضع علامة تبويب جزئيا في الفتحة في أحد طرفيها ، وقم بتصويب الأنسجة بلطف ، ثم ضع علامة التبويب الثانية. باستخدام الملقط في كل يد ، اضغط على كل علامة تبويب بالكامل لتأمين الأنسجة.
ملاحظة: إذا كنت تواجه صعوبة في الحفاظ على الأنسجة في مكانها قبل القص ، فقم بسحب بعض PBS من الطبق لخفض مستوى السوائل. احرص على عدم تمدد الأنسجة في وضع المقطع الثاني ، لأن هذا قد يؤدي إلى تمزق. - كرر إجراء الذوبان والقطع والقطع في الخطوات 3.2.2-3.2.6 لأكبر عدد ممكن من الأنسجة حسب الرغبة.
- إزالة الخلايا من الشرائح
- بمجرد قص جميع الشرائح ، انقل الطبق مقاس 100 مم الذي يحتوي على الكاسيت إلى غطاء تدفق صفائحي.
- ابدأ الخطوة 1 من بروتوكول إزالة الخلايا (انظر الجدول 2): باستخدام مرقئ منحني للإمساك بالجوانب المحززة لكل كاسيت ، ونقل الكاسيت إلى ألواح 6 آبار ( 2 أنسجة / بئر) مملوءة ب 3 مل من PBS + أيونات + مضادات حيوية / مضادات فطرية لكل بئر (انظر وصفة الحل في الجدول 1).
- ضع ألواح البئر على شاكر مداري عند 30 دورة في الدقيقة لمدة 10 دقائق.
- استمر في الخطوة 2 من بروتوكول إزالة الخلايا (انظر الجدول 2): استنشق السائل من كل بئر ، ثم استبدله ب 3 مل / بئر PBS + أيونات ، وضع لوحة على الاهتزاز المداري عند 30 دورة في الدقيقة ، واحتضنها لمدة 5 دقائق.
- كرر الخطوة 3.3.4 لكل من الحلول والفترات المقابلة كما هو موضح في بروتوكول إزالة الخلايا في الجدول 2.
- بعد خطوة الشطف النهائية باستخدام PBS + المضادات الحيوية / مضادات الفطريات (الخطوة 20 من الجدول 2) ، انقل الأنسجة إلى ألواح معقمة من 6 آبار مع PBS + مضادات حيوية / مضادات فطرية طازجة ، واحتضنها عند 37 درجة مئوية لمدة 48 ساعة.
ملاحظة: بعد التعقيم بالمضادات الحيوية / مضادات الفطريات ، يمكن زرع سقالات أنسجة الرئة على الفور ، أو تخزينها في 4 درجات مئوية لمدة تصل إلى 30 د.
4. شريحة إعادة التجميع والثقافة
ملاحظة: يبين الشكل 2 جدولا زمنيا مقترحا لبذر الأنسجة واستزراعها، حيث تزرع الشرائح أولا بخلايا بطانة الأوعية الدموية الدقيقة لرئة الفئران وتزرع في وسط بطاني منخفض المصل؛ ثم زرعت مع الفئران AEC2s والخلايا الليفية الرئوية الفئران مع وسط نمو AEC2 خالية من المصل (مقتبسة من Jacob et al.13 و You et al.35) ؛ راجع ملاحظات إضافية حول مصادر الخلايا المستخدمة في تفاصيل وسائط النتائج والثقافة في الجدول 3. تنتج هذه الاستراتيجية هياكل تشبه السنخية تحتوي على طبقات أحادية AEC2.
- تحضير سقالات الأنسجة للبذر (اليوم -4 أو -3)
- إذا كنت تستخدم سقالات الأنسجة المخزنة عند 4 درجات مئوية ، فقم باحتضان السقالات بين عشية وضحاها عند 37 درجة مئوية باستخدام PBS + المضادات الحيوية / مضادات الفطريات الطازجة (10٪ البنسلين / الستربتومايسين ، 4٪ الأمفوتريسين B ، 0.4٪ الجنتاميسين في PBS) قبل البذر.
- شطف السقالات 3x مع PBS معقمة (5 مل / بئر) ، 5 دقائق لكل منهما.
- افحص السقالات تحت مجهر تباين الطور عند تكبير 5x لاختيار الأنسجة للبذر.
ملاحظة: أفضل السقالات للبذر ليس لها دموع أو ثقوب ولا تحتوي على ممرات هوائية أو أوعية كبيرة. في حين أن السقالات ذات الميزات قد يتم زرعها بنجاح ، فقد تختلف أنماط إعادة التوطين عن تلك التي لوحظت في المناطق السنخية.
- بذر الخلايا البطانية (اليوم -3)
- عد الخلايا البطانية باستخدام مقياس خلايا الدم وقم بإعداد تعليق الخلايا البطانية في الوسط البطاني (انظر الجدول 3) عند 5 × 10 6 خلايا / مل ، مع خلايا كافية لزرع 500000 خلية بطانية لكل شريحة (على سبيل المثال ، بالنسبة ل 12 شريحة ، أعد تعليق 6 × 106 خلايا في وسط 1.2 مل).
- ضع حمامات البذر المعقمة في أطباق بتري 100 ملم. انقل السقالات المغسولة رأسا على عقب إلى حمامات البذر: استخدم مرقئ منحني ناعم للإمساك بالكاسيت من الجوانب المحززة ، واستخدم مرقئا مستقيما أو ملقطا للإمساك بأحد طرفي الكاسيت (مع الحرص على عدم لمس الأنسجة نفسها) وقلبها ، ثم أمسك الكاسيت مرة أخرى بأطراف المرقئ المنحني الناعم عبر الثقوب على طول الجوانب المحززة ، ووضعها في حمام البذر جيدا. كرر ذلك مع أشرطة الكاسيت المتبقية.
ملاحظة: عند وضعها بشكل صحيح ، سيتم تمركز السقالات ، رأسا على عقب ، في الجزء السفلي من كل بئر. إذا لزم الأمر ، اضغط برفق على زاوية الكاسيت مع أطراف الإرقاء للتأكد من أن الكاسيت يجلس بشكل مسطح في البئر. يمكن أن يؤدي الجلوس غير السليم للكاسيت إلى سوء بذر الأنسجة. من المقبول إذا كان البئر يحتوي على كمية صغيرة من PBS. - قم بتدوير تعليق الخلية المحضر بلطف للخلط ، ثم استخدم ماصة يدوية لماصة خلايا 100 ميكرولتر مباشرة فوق كل نسيج في قاعدة البئر ، مع الحرص على عدم إتلاف الأنسجة بطرف الماصة.
- نقل الأنسجة البذرية إلى حاضنة زراعة الخلايا عند 37 درجة مئوية / 5٪ CO2.
- بعد 2 ساعة ، أضف 900 ميكرولتر من وسط الاستزراع المسخن مسبقا إلى كل بئر باستخدام ماصة يدوية ، ثم عد إلى الحاضنة. إذا أصبح الكاسيت غير جالس (يطفو) عند إضافة وسيط ، فاضغط برفق لأسفل على زاوية الكاسيت بطرف الماصة بحيث يقع مسطحا في البئر.
- تغيير الوسط في اليوم -2. قم بإزالة الوسط عن طريق إمالة طبق بتري وسحبه يدويا باستخدام طرف ماصة يوضع بخفة في زاوية البئر ، حتى لا تزعج الكاسيت. استبدل ب 1 مل من الوسط البطاني الطازج لكل بئر.
- AEC2 وزرع الخلايا الليفية وزراعة الأنسجة (اليوم 0)
- عد AEC2s والخلايا الليفية باستخدام مقياس الدم. قم بإعداد تعليق خلوي بنسبة 1: 1 من AEC2s والخلايا الليفية في وسط نمو AEC2 (وسط القاعدة الظهارية + مكملات AEC2 ؛ انظر الجدول 3) عند 5 × 10 6 خلايا إجمالية / مل ، مع خلايا كافية لزرع 500000 خلية (250000 AEC2s و 250000 من الخلايا الليفية) لكل شريحة (على سبيل المثال ، بالنسبة ل 12 شريحة ، أعد تعليق 3 × 10 6 AEC2s + 3 × 10 6 الخلايا الليفية معا في وسط 1.2 مل).
- امسحي الوسط من كل بئر من حوض البذر كما هو موضح في الخطوة 4.2.6. قم بتدوير تعليق الخلية المحضر بلطف للخلط ، ثم قم بماصة خلايا 100 ميكرولتر مباشرة فوق كل نسيج في قاعدة البئر.
ملاحظة: من المقبول أن تبقى كمية صغيرة من الوسط البطاني في البئر قبل بذر AEC2 / الخلايا الليفية. - نقل الأنسجة البذرية إلى حاضنة زراعة الخلايا عند 37 درجة مئوية / 5٪ CO2.
- بعد 2 ساعة ، أضف 900 ميكرولتر من وسط نمو AEC2 المسخن مسبقا إلى كل بئر ، ثم عد إلى الحاضنة.
- بعد 24 ساعة من الثقافة (اليوم الأول) ، قم بإعداد طبق من 12 بئرا مع 1 مل من متوسط نمو AEC2 المسخن مسبقا لكل بئر لكل كاسيت.
- ماصة 800 ميكرولتر من الوسط من كل بئر من حمام البذر. قم بإزالة الكاسيت من حمام البذر: أمسك بكل منها بمرقئ منحني ناعم عبر الثقوب على طول الجوانب المحززة ، وانقلها إلى مرقئ مستقيم أو ملقط للإمساك بالكاسيت في أحد طرفيه وقلبه ، ثم استخدم المرقئ المنحني للإمساك بالكاسيت عبر الجوانب المحززة ونقل الجانب الأيمن لأعلى ، واحد لكل بئر ، إلى اللوحة المعدة المكونة من 12 بئرا.
- تغيير وسط الثقافة في طبق 12 بئرا كل يومين حتى اليوم 7 أو لطول الثقافة المطلوب: استخدم ماصة باستور الزجاجية لشفط الوسط من كل بئر ، مع الحرص على عدم لمس الأنسجة ؛ ماصة في 1 مل طازجة AEC2 متوسط النمو لكل بئر.
ملاحظة: يمكن مراقبة درجة إعادة توطين الأنسجة عن طريق الفحص المجهري لتباين الطور عند تكبير 5x طوال مدة الزرع.
5. حصاد الأنسجة وتحليل العينات
- لإصلاح ELTs لعلم الأنسجة وتلطيخ الفلورسنت المناعي ، قم بنقل أشرطة زراعة الأنسجة إلى 10٪ من الفورمالين المحايد المخزن مؤقتا واحتضانها لمدة 3-4 ساعات في درجة حرارة الغرفة على هزاز. قم بإزالة الأنسجة من أشرطة الكاسيت باستخدام طرف ملقط مدبب بدقة لقطع الأنسجة حيث تلتقي بعلامات التبويب. معالجة الأنسجة وفقا للطرق الروتينية لتضمين البارافين والأنسجة ؛ ليست هناك حاجة إلى تقنيات متخصصة.
- لمعالجة ELTs ل qRT-PCR ، اشطف الأنسجة في أشرطة كاسيت في PBS 2x ، ثم قم بإزالة الأنسجة وتجميد المفاجئة أو المضي قدما في التحلل لاستخراج الحمض النووي الريبي.
ملاحظة: تجميع ما لا يقل عن شريحتين مزروعتين مع 1 × 106 خلايا ومستزرعة لمدة 7 أيام يجب أن ينتج عنه حمض نووي ريبي وافر لتحليل تفاعل البوليميراز المتسلسل في المراحل النهائية.
النتائج
ويرد في الشكل 3 لمحة عامة عن عملية توليد ELTs - التي تشمل تقطيع الرئة، وقطع الشرائح وإزالة الخلايا، وإعادة توطين السقالات. تم استزراع ELTs المعروضة هنا باستخدام الخلايا البطانية الوعائية الدقيقة الأولية لرئة الفئران (انظر جدول المواد) ، والفئران الوليدية AEC2s ، والخلايا الليفية الرئوية للفئران حديثي الولادة الغنية بالخلايا الليفية للفئران الوليدية36. تم عزل AEC2s حديثا عن طريق الفرز المغناطيسي القائم على الخرز كما هو موضح سابقا37 ؛ تم تفصيل بروتوكولات العزل البديلة ومناقشتها في أماكن أخرى38،39،40. يمكن تقييم نقاء الفئران المعزولة AEC2s عن طريق قياس التدفق الخلوي لعلامة سطح AEC2 الخاصة بالفئران RTII-7041 ، أو عن طريق تلطيخ عينة خلية الطرد المركزي الخلوي ل RTII-70 أو البروتين المؤيد للفاعل بالسطح C (pSPC). تم عزل الخلايا الليفية لرئة الفئران من جراء الفئران بعد يوم ما بعد الولادة 7-9 وفقا لتكييف بروتوكولمنشور 42 واستخدامها في الممر 1-2 ؛ تم وصف بروتوكولات العزل البديلة في مكان آخر43,44. يمكن تقييم نقاء الخلايا الليفية المعزولة عن طريق تلطيخ الخلايا المستزرعة أو الطرد المركزي الخلوي لفيمنتين علامة اللحمة المتوسطة ، ويمكن تقييم إثراء lipofibroblast عن طريق تلطيخ الزيت الأحمر O45.
عندما يتم تضخيم أنسجة الرئة بشكل موحد باستخدام الأغاروز ، ويتم اختيار قطع الأنسجة بشكل استراتيجي وتوجيهها للتقطيع إلى شرائح لزيادة مساحة الأنسجة الكلية والمتنية إلى أقصى حد ، قد تنتج رئة فئران واحدة أنسجة ل >100 ELTs السنخية. تظهر شرائط PCLS سلامة ميكانيكية كافية ليتم قصها في أشرطة الأنسجة مع عدد قليل (<5٪) من حالات التمزق (الشكل 3B).
يعتمد بروتوكول إزالة الخلايا من شرائح الرئة بشكل وثيق على بروتوكول إزالة الخلايا الرئوية الكامل المنشور سابقا ، والذي ثبت من خلال البروتينات الكمية أنه يحافظ على العديد من مكونات ECM بمستويات لا تختلف اختلافا كبيرا عن تلك الموجودة في الرئة الأصلية22. تحافظ سقالات الشرائح منزوعة الخلايا على البنية الأصلية للحويصلات الهوائية ، كما هو موضح في تلطيخ الهيماتوكسيلين والإيوسين (H & E) (الشكل 4A ، B) والمجهر المتباين المرحلي (الشكل 4C). عادة ما نستبعد السقالات التي تحتوي على ممرات هوائية أو أوعية كبيرة (الشكل 4D) أو الدموع ، على الرغم من أنه يمكن تضمين الأولى إذا كانت ذات أهمية للباحث. تؤدي إزالة الخلايا إلى انخفاض بنسبة 96٪ في محتوى الحمض النووي للأنسجة كما تم قياسه من خلال فحص الحمض النووي المزدوج (انظر جدول المواد ؛ 0.50 ميكروغرام / ملغ ± 0.073 ميكروغرام / ملغ مقابل 0.018 ميكروغرام / ملغ ± 0.0035 ميكروغرام / ملغ في الأنسجة الأصلية مقابل الأنسجة الخلوية ، على التوالي ، يعني ± SEM) (الشكل 5A) ، مع عدم وجود حمض نووي مرئي بواسطة تلطيخ الهيماتوكسيلين (الشكل 4B). يكشف التلطيخ النسيجي والفلورسنت المناعي للسقالات منزوعة الخلايا عن الحفاظ على بروتينات ECM الكولاجين والإيلاستين والكولاجين الرابع واللامينين مع بنية وكمية مماثلة لتلك الموجودة في شرائح الرئة الأصلية (الشكل 5B-E). لاحظ أن نوى الأنسجة الأصلية تلطخ باللون الأزرق / الأسود مع بقع trichome (للكولاجين) و EVG (للإيلاستين). تم إجراء تلطيخ الفلورسنت المناعي كما هو موضح سابقا ، باستخدام الطرق القياسية لتلطيخ الأنسجة37. وترد في الجدول 4 الأجسام المضادة المستخدمة وتركيزات كل منها.
تؤدي إعادة توطين السقالة الناجحة إلى ELTs عالية الخلوية بعد 7 أيام ، مع نمط إعادة توطين يشبه السنخية مرئي بواسطة المجهر الضوئي (الشكل 6A-C). في بعض الحالات ، مع خلوية عالية جدا ، قد تكون الهياكل العضوية مرئية (الشكل 6A ، B). يمكن تصور بذر الأنسجة غير الناجح بواسطة الفحص المجهري لتباين الطور أثناء الزراعة (الشكل 6C). بعد زراعة سقالات الأنسجة باستخدام AEC2s والخلايا الليفية والخلايا البطانية ، يتم إعادة توطين ELTs بكثافة بهياكل تشبه السنخية تضم جميع سلالات الخلايا الثلاثة (الشكل 6D ، E). في اليوم 7 أو 8 ، تحافظ AEC2s على التشكل التكعيبي وتعبر عن بروتين الفاعل بالسطح B (SPB) وبروتين الجسم الرقائقي ABCA3 ، دون دليل على وجود تمايز كبير مع AEC1s (الشكل 6E ، F). AEC2s هي عالية الانتشار في ELTs ، كما هو موضح في دمج 5-ethynyl-2'-deoxyuridine (EdU) بعد نبضة 2 ساعة عند 10 ميكرومتر (الشكل 6G).
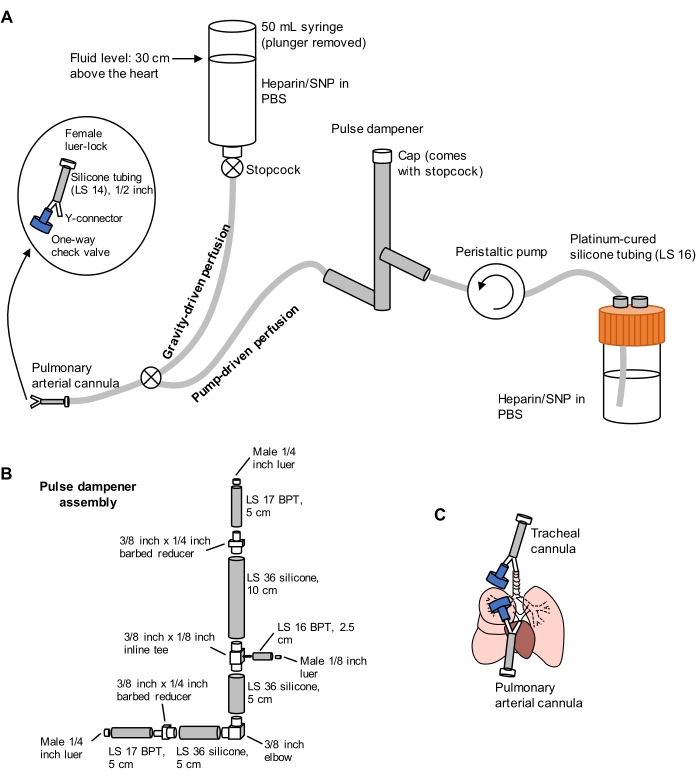
الشكل 1: مخطط نظام التروية لاستخراج الرئة وتطهيرها. (أ) يتألف نظام التروية من طرف يحركه الجاذبية، يستخدم للتقنين الأولي للشريان الرئوي تحت التدفق؛ (ب) يتألف نظام التروية من طرف يحركه الجاذبية، يستخدم للتقنين الأولي للشريان الرئوي تحت التدفق؛ (ب) يتألف نظام التروية من طرف يحركه الجاذبية، يستخدم للتعليب الأولي للشريان الرئوي تحت التدفق؛ (ب) يتألف نظام التروية من طرف يحركه الجاذبية، يستخدم للتعليب الأولي للشريان الرئوي تحت التدفق؛ (ب) يتألف نظام التروية من طرف يحركه الجاذبية، يستخدم للتعليب الأولي للشر وطرف يحركه المضخة، يستخدم لتنظيف الرئتين بكفاءة بعد القنية الأولية. يتضمن خط المضخة "مثبط النبض" الذي يخفف من ارتفاع الضغط الناجم عن المضخة. تصميم القنية الشريانية القصبية والرئوية مفصل على اليسار. SNP = نيتروبروسيد الصوديوم. (ب) تفاصيل تجميع مثبط النبض. يشير BPT والسيليكون إلى أنواع الأنابيب. (ج) مواضع القنية الشريانية القصبية والرئوية الموضوعة أثناء استخراج الرئة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: الجدول الزمني للثقافة لإعادة النسب الثلاثي. الجدول الزمني المقترح لبذر ELT ثلاثي السلالات واستزراعه ، بما في ذلك توقيت البذر على مرحلتين. يشار إلى أعداد الخلايا للبذر ووسط الاستزراع لكل مرحلة. انظر تفاصيل وسائط الثقافة في الجدول 3. AEC2 = خلية ظهارية من النوع 2 السنخية. EC = الخلية البطانية. FB = الخلايا الليفية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
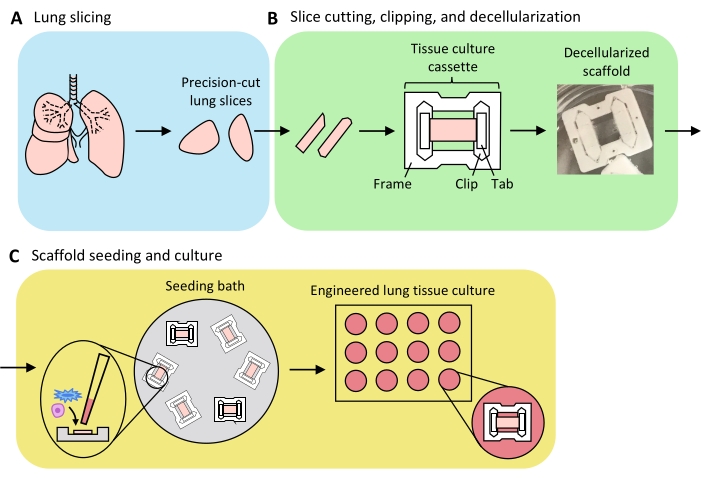
الشكل 3: مخطط لإعداد أنسجة الرئة الهندسية. (أ) يتم قطع أنسجة الرئة الأصلية إلى شرائح باستخدام اهتزاز. (ب) تقطع شرائح الرئة المقطوعة بدقة إلى شرائح موحدة بعرض 3 مم، وتقطع إلى أشرطة استزراع الأنسجة المتعددة تترافلوريثلين (PTFE)، وتزيل الخلايا بالمنظفات لإنتاج سقالات مصفوفة خارج الخلية اللاخلوية. (ج) يتم إعادة زرع السقالات في حمامات البذر المتخصصة التي تحصر منطقة البذر في منطقة الأنسجة ، ثم يتم استزراعها في صفيحة بئر قياسية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
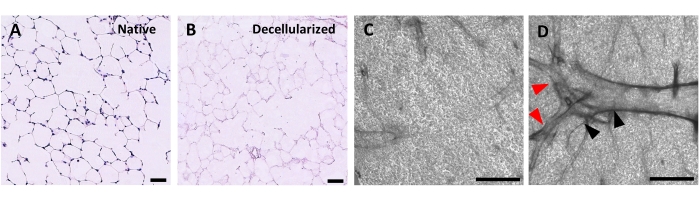
الشكل 4: هيكل سقالات الرئة المنزوعة الخلايا. تلطيخ H & E لشرائح الرئة الأصلية (A) و decellularized (B) التي تظهر الحفاظ على العمارة السنخية بعد إزالة الخلايا. (ج، د) أمثلة على سقالات ECM منزوعة الخلايا ينظر إليها عند التكبير 5x بواسطة المجهر المتباين الطوري ، الذي يتكون في الغالب من الأنسجة السنخية (C) أو يحتوي على ممرات هوائية وأوعية متفرعة كبيرة (D ورؤوس أسهم سوداء وحمراء). أشرطة المقياس ، 50 ميكرومتر (A ، B) ؛ 500 ميكرومتر (C ، D). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
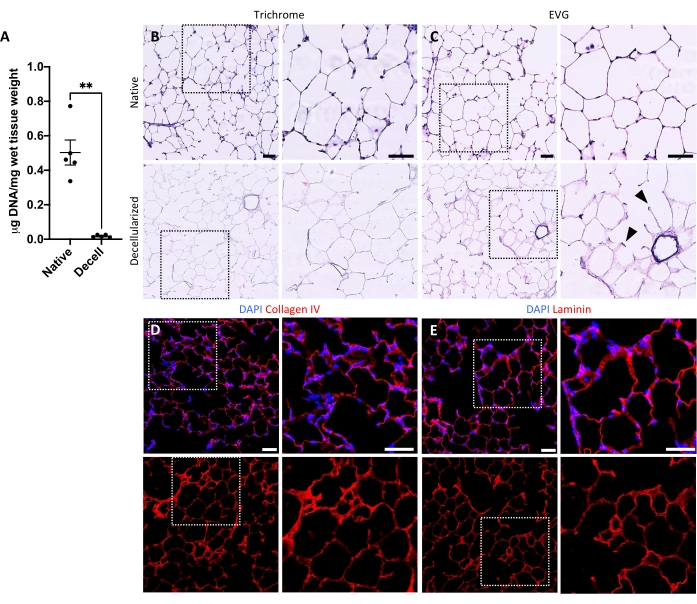
الشكل 5: إزالة الحمض النووي وحفظ المصفوفة في سقالات الرئة منزوعة الخلايا. (أ) تحديد كمية الحمض النووي في شرائح الرئة الأصلية وغير الخلوية (متوسط ± SEM ، n = 5). اختبار ويلش t ، ** P < 0.01. Decell = decellularized. (ب، ج) تلطيخ نسيجي لشرائح الرئة الأصلية والخلوية للكولاجين (B) والإيلاستين (C). رؤوس السهام ، الإيلاستين المحفوظ في حلقات المدخل السنخي للأنسجة غير الخلوية. (دال، هاء) تلطيخ الفلورسنت المناعي لشرائح الرئة الأصلية والخلوية للكولاجين IV (D) و laminin (E). أشرطة المقياس ، 50 ميكرومتر. في كل اللوحات، تحدد المربعات المنقطة منطقة الصورة التي يتم تكبيرها إلى اليمين في كل لوحة على حدة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: إعادة التوطين الخلوي لأنسجة الرئة الهندسية. (أ-ج) أمثلة على ELTs المعاد خلاياها في اليوم 7 من الثقافة ، كما تم تصورها أثناء الزراعة بواسطة الفحص المجهري المتباين المرحلي. يعكس نمط إعادة الخلية البنية السنخية للأنسجة. في بعض المناطق ذات الخلوية العالية ، قد تتشكل هياكل تشبه العضوية (رؤوس أسهم). (أ) و (ب) يمثلان إعادة توطين الخلايا بنجاح ، في حين أن (ج) يمثل مستوى ضعيفا من إعادة التجميع بعد 7 أيام من الزرع. (D-G) تلطيخ ELTs المعاد خلاياها في اليوم 7 أو 8 من الثقافة. (د) تلطيخ H&E يظهر إعادة التوطين الخلوي للحاجز السنخي. (ه) ملصقات تلطيخ الفلورسنت المناعي المغطاة بالخلايا الليفية proCollagenIα1+ و ABCA3 + AEC2s و CD31+ الخلايا البطانية. (و) تحتوي الأنسجة على SPB + AEC2s وفيرة ولكن عدد قليل من RTI-40 (podoplanin) + AEC1s في ظل هذه الظروف. (ز) العديد من AEC2s تنتشر في ELTs ، كما تم قياسها من خلال دمج EdU. أشرطة المقياس ، 500 ميكرومتر (A-C) ؛ 25 ميكرومتر (D-G). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: حلول إزالة الخلايا. تفاصيل التحضير لحلول إزالة الخلايا. يرجى النقر هنا لتنزيل هذا الجدول.
الجدول 2: بروتوكول إزالة الخلايا. تفاصيل بروتوكول إزالة شرائح الرئة من الخلايا. يرجى النقر هنا لتنزيل هذا الجدول.
الجدول 3: الإعلام الثقافي. تفاصيل التحضير لوسائط النمو البطانية و AEC2. يرجى النقر هنا لتنزيل هذا الجدول.
الجدول 4: الأجسام المضادة المستخدمة للتلطيخ المناعي. تفاصيل الأجسام المضادة وتركيزاتها المستخدمة للتلطيخ المناعي. يرجى النقر هنا لتنزيل هذا الجدول.
الملف التكميلي 1: تصميم لقطع الأنسجة بالليزر زرع إطارات كاسيت. يرجى النقر هنا لتنزيل هذا الملف.
الملف التكميلي 2: تصميم لقطع الأنسجة بالليزر زرع مقاطع كاسيت. يرجى النقر هنا لتنزيل هذا الملف.
الملف التكميلي 3: تصميم لقطع الأنسجة بالليزر زراعة أشرطة التبويب. يرجى النقر هنا لتنزيل هذا الملف.
الملف التكميلي 4: ملف CAD لبذر قاعدة قالب الحمام. يرجى النقر هنا لتنزيل هذا الملف.
الملف التكميلي 5: ملف CAD لحلقة قالب حمام البذر. يرجى النقر هنا لتنزيل هذا الملف.
Discussion
تصف هذه الورقة استخدام شرائح الرئة المقطعة بدقة كمنصة لتوليد أنسجة رئوية هندسية في المختبر ، والتي تحتوي على هياكل تشبه السنخية متعددة السلالات. من خلال الجمع بين الاستراتيجيات التي طورناها سابقا لإعادة ملء سقالات الرئة ECM اللاخلوية عالية الدقة لهندسة الرئة الكاملة 22,31 ، مع نظامنا القوي لزراعة أنسجة القلب الهندسية على نطاق صغير 30 ، يتيح هذا البروتوكول استخدام ECM الرئوي ذي الصلة من الناحية الفسيولوجية كركيزة لزراعة الأنسجة ، بطريقة قابلة للتكرار ومعتدلة الإنتاجية.
الطرق المعروضة هنا تفصل إعداد سقالة ELT من رئتي الفئران ، والتي يمكن تحقيقها بسهولة ، ويمكن استخراجها بشكل جماعي مع إمكانية الوصول المباشر إلى الشعب الهوائية السليمة لتضخم الأغاروز ، وهي ذات حجم أكبر من رئة الفأر. ومع ذلك ، يمكن استخدام أي أنسجة رئوية يمكن نفخها باستخدام الأغاروز وشرائح إنتاجية لا يقل طولها عن 9 مم داخل هذا النظام. بغض النظر عن مصدر الأنسجة ، فإن التضخم الموحد لأنسجة الرئة مع الأغاروز هو الخطوة الأكثر أهمية لضمان نجاح تقطيع الأنسجة وقصها ومعالجتها. تميل أنسجة الرئة غير المنتفخة إلى التقطيع بشكل نظيف ، في حين أن الأنسجة المنتفخة بشكل مفرط قد تتمزق أثناء القطع. بعد هلام الأغاروز ، تكون مناطق الأنسجة المتضخمة بشكل مناسب ثابتة ولكنها توفر القليل من العطاء عند الضغط عليها بلطف باستخدام الملقط. بالنسبة لرئتي الفئران السليمين ، وجدنا أن النفخ المسبق للرئتين المستخرجتين بالهواء عدة مرات ، يليه تضخم الأغاروز في أقرب وقت ممكن بعد الاستخراج ، يؤدي إلى أفضل نتائج التقطيع وأفضل جودة لسقالات الأنسجة الناتجة. يجب تحسين الحجم المناسب من الأغاروز تجريبيا ؛ بالنسبة لرئة الفئران ، يبلغ الحجم المطلوب لتضخيم الرئة إلى إجمالي سعة الرئة حوالي 30 مل / كجم من الكتلة الحيوانية (على سبيل المثال ، 10.5 مل من الأغاروز للرئتين من فأر 350 جم). بالنسبة لأنسجة الرئة الأكبر حجما مع وصول أقل مباشرة إلى مجرى الهواء (مثل تلك الموجودة من متبرعين بشريين) ، قد يكون من الضروري إجراء بعض عمليات استكشاف الأخطاء وإصلاحها الإضافية لتضخيم الأنسجة عبر الشعب الهوائية32. أثناء تقطيع الرئة اللاحق ، يعد اختيار وتوجيه الأنسجة على المكبس خطوة مهمة أخرى ل 1) التأكد من أن الشرائح كبيرة بما يكفي لتوليد شرائط الأنسجة التي يمكن قصها في أشرطة زراعة الأنسجة و 2) زيادة مساحة الأنسجة المتنية (السنخية) ، باستثناء الشعب الهوائية الكبيرة أو الأوعية.
يمكن أن يكون قص PCLS في أشرطة زراعة الأنسجة خطوة صعبة في البداية ، ولكن الكاسيت يبسط إلى حد كبير التعامل مع الأنسجة أثناء إزالة الخلايا والبذر. هناك مشكلتان محتملتان قد تنشآن هما تمزق الأنسجة (إما أثناء عملية القطع ، أو أثناء إزالة الخلايا) ، أو وضع الأنسجة في المقاطع التي تؤدي إلى ضعف البذر في المصب (على سبيل المثال ، عدم البذر ، أو البذر فقط في النهايات). قد يكون التمزق نتيجة للتضخم المفرط في الأغاروز ، أو الإفراط في تمدد الأنسجة أثناء إدخال علامة التبويب ، أو ترك القليل جدا من التراكم لتوفير قبضة كافية على الأنسجة عند إدخال علامات التبويب. لاحظ أن الشرائح التي تمزق في نهاية مقطع واحد قد يتم زرعها بنجاح ، ومع ذلك ، يصعب تصورها تحت المجهر أثناء الزراعة لأن الأنسجة ليست مسطحة. من المحتمل أن يكون ضعف بذر الأنسجة (مثل ذلك الوارد في الشكل 6C) نتيجة لعدم وجود شريحة مسطحة بين المقطعين ، وبالتالي ضعف الاتصال بقاعدة حمام البذر جيدا عند قلبها رأسا على عقب. سبب آخر محتمل هو الجلوس غير السليم للكاسيت في الجزء السفلي من حمام البذر جيدا. من حيث القطع ، ضع المزيد من التوتر قليلا في الأنسجة عند وضع المقطع الثاني لمساعدته على الاستلقاء. بعض الشرائح لها تقعر طفيف. في هذه الحالات ، قم بقص الشريحة مع الجانب المحدب لأعلى. مع الممارسة ، عادة ما نواجه البذر الفاشل مع أقل من 2٪ من الشرائح.
أحد قيود هذا البروتوكول هو متطلبات بعض المعدات المتخصصة - قاطع ليزر وطابعة 3D - لتوليد المواد الأولية لإعداد ELT. ومع ذلك ، بمجرد إنشاء أشرطة زراعة الأنسجة وحمامات البذر ، لا يلزم وجود مواد خاصة إضافية. تستغرق خطوات تقطيع الرئة وإزالة الخلايا من إعداد سقالة ELT وقتا معتدلا. ومع ذلك ، يمكن تنفيذ هذه الخطوات مقدما ، أو بأعداد كافية للتحضير لتجارب متعددة في نفس الوقت. يمكن قطع العديد من PCLS (>100 إذا تم تحسينها للمناطق المتني) من رئة واحدة وتجميدها المفاجئة لاستخدامها لاحقا. في حين أن دورة تجميد ذوبان واحدة قد تسبب أضرارا طفيفة فوق الهيكلية ل ECM46 ، فقد ثبت أنه حتى دورات التجميد والذوبان المتعددة لا تسبب خسارة كبيرة في ECM23,47. يمكن أيضا قص PCLS وإزالة خلاياه قبل التجربة ، لاستخدامها في غضون شهر واحد. (والجدير بالذكر أن بروتوكول إزالة الخلايا الموصوف يمكن إنجازه في حوالي 6 ساعات ، مما يمثل ميزة كبيرة على الطرق الموصوفة سابقا والتي تتطلب يوما أو أكثر27,28.) بمجرد إعداد السقالات ، تكون عملية بذر الخلايا بسيطة وسريعة ، ولا تتطلب ثقافة ELTs تقنيات متخصصة.
أحد التحذيرات من طريقة ELT الموصوفة هو عدم وجود بذر خاص بالمنطقة ، أي توصيل AEC2s على وجه التحديد إلى الفضاء السنخي ، أو الخلايا البطانية على وجه التحديد إلى الفضاء الوعائي. ومع ذلك ، على الرغم من أن الخلايا تزرع ببساطة فوق سقالات الأنسجة ، إلا أن نمط إعادة التكاثر غير عشوائي ، مع بعض مظاهر التنظيم الشبيه بالسنخية ، بما في ذلك الحلقات الظهارية. نحن نشك في أن التفاعلات بين الخلايا الخلوية ، وكذلك الاختلافات المحلية في تكوين ECM والهندسة20,21 ، من المحتمل أن تسهم في أنماط إعادة الخلية الملحوظة. ودعما لهذه الفرضية، أظهرت دراسة نشرت سابقا، حيث تم زرع الخلايا الليفية بشكل غير محدد على شرائح الرئة منزوعة الخلايا، أن نمط إعادة توطين الأنسجة والأنماط الظاهرية الخلوية المرتبطة بها يختلف اختلافا كبيرا حسب منطقة الأنسجة المجهرية ومصدر سقالة ECM (على سبيل المثال، صحي مقابل مريض)27. كما لوحظ أن الخلايا الليفية تغزو الخلالي - الموقع الذي تقيم فيه في أنسجة الرئة الأصلية 1,27. الطريقة البديلة الأساسية التي يمكننا تخيلها لزراعة الخلايا على شرائح الرئة بطريقة خاصة بالمنطقة حقا ستستلزم بذر رئتين منزوعة الخلايا سليمة عبر مجرى الهواء31,48 ومقصورات الأوعية الدموية 49,50 ، ثم تقطيع الأنسجة المعاد خلاياها. ومع ذلك، فإن هذا البديل 1) أكثر استهلاكا للتكلفة والوقت والموارد؛ 2) هو انخفاض الإنتاجية؛ 3) يتطلب زيادة أعداد الحيوانات ؛ و 4) يرتبط بزيادة خطر التلوث بسبب تحديات زراعة الرئة بأكملها والتقطيع اللاحق للرئة البذورية. على الرغم من أنها لا تلخص جميع جوانب التنظيم الخلوي الأصلي ، إلا أن منصة ELT تمكن من زراعة خلايا الرئة على ركيزة ECM ذات الصلة من الناحية الفسيولوجية ، بطريقة يمكن الوصول إليها من قبل العديد من المختبرات.
تعد مرونة نظام ELT ميزة رئيسية لهذه المنصة ، ويجب أن تسمح بزراعة أنسجة الرئة على نطاق صغير مع أي عدد من سقالات الأنسجة أو الخلايا أو وسائط الثقافة ذات الاهتمام. قد يسمح استخدام السقالات المشتقة من الأنسجة المريضة أو من نماذج الإصابة بدراسة تفاعلات الخلايا الخلوية أو مصفوفة الخلايا في إعداد ECM27,29,51 المعدل بالمرض. ومع ذلك، لاحظ أن بروتوكول إزالة الخلايا قد يحتاج إلى تكييف لمراعاة الاختلافات في المصفوفة بين الأنواع52. يمكن استخدام استراتيجية البذر الموصوفة لأي نوع من الخلايا ، ويتم تكييف الجدول الزمني للزراعة ليناسب احتياجات الباحث. كنقطة انطلاق ، يجب أن تنتج 1 × 106 خلايا لكل سقالة نسيجا عالي الخلايا في غضون 7 أيام من الزرع ، في حين أن 1 × 105 خلايا إجمالية تؤدي إلى ضعف الخلوية. في أي تكييف للجدول الزمني ، يجب إزالة أشرطة زراعة الأنسجة من حمام البذر 24 ساعة بعد آخر بذر للأنسجة. هنا ، بهدف نمذجة بعض التعقيد الخلوي لأسناخ الرئة ، نصف استراتيجية إعادة توطين ثلاثية الثقافات تدعم الحفاظ على AEC2s حديثي الولادة المتمايزة جيدا في هياكل تشبه السنخية لمدة 7 أيام على الأقل. تظهر نتائجنا أيضا نجاح تطعيم كل من الخلايا الليفية والخلايا البطانية داخل ELTs ، مع التأكيد على التطبيق الواسع للركيزة المستزرعة وملاءمتها لدراسات الزراعة المشتركة. قد يسهل بذر الخلايا البالغة في ELTs نمذجة الهياكل السنخية الأكثر هدوءا ، في حين أن بذر AEC2s البشري المشتق من PSC ، بما في ذلك تلك التي تحتوي على تعديلات وراثية ، يمكن أن يسهل الدراسات الانتقالية للأمراض البشرية13,53. بشكل عام ، يوفر النهج التصاعدي الذي تتيحه منصة ELT الفرصة للتحقيق في مساهمات أنواع معينة من الخلايا في القراءات ذات الأهمية - مثل انتشار AEC2 أو حالة التمايز.
باختصار ، يحدد هذا البروتوكول نظاما قويا لتوليد أنسجة رئوية هندسية لدراسات الزراعة المشتركة ل AEC2s والخلايا الليفية والخلايا البطانية داخل سقالات شرائح الرئة ECM اللاخلوية. تمثل ELTs استراتيجية جديدة للثقافة ثلاثية الأبعاد ل AEC2s الأولية ، والتي اعتمدت حتى الآن عادة على مصفوفات من نوع هلام أقل فسيولوجية للحفاظ على نمط ظاهري متمايز جيدا 6,11,12. تعتمد المنصة الحالية على العمل السابق في إعادة توطين شرائح الرئة الخالية من الخلايا 24،25،26،27،28،29 ، ولكنها توفر العديد من المزايا: 1) نظام كاسيت زراعة الأنسجة لتسهيل التعامل مع ELT أثناء إزالة الخلايا ، والبذر ، والثقافة. 2) حمام بذر مخصص لزرع عدد معروف من الخلايا بدقة على كل سقالة شريحة ؛ و 3) استراتيجية إعادة البذر الثلاثي التي تمكن من إعادة توطين الأنسجة السنخية مع الخلايا الظهارية والوسيطة والبطانية. وبالتالي ، تمثل ELTs خطوة مهمة إلى الأمام نحو إنشاء نماذج قابلة للتكرار في المختبر تلتقط التعقيد الخلوي والركيزة للحويصلات الهوائية الأصلية ومكانة الخلايا الجذعية AEC2.
Disclosures
L.E.N. هو مؤسس ومساهم في Humacyte، Inc، وهي شركة للطب التجديدي. تنتج Humacyte أوعية دموية هندسية من خلايا العضلات الملساء الخيفية لجراحة الأوعية الدموية. زوج L.E.N. لديه أسهم في Humacyte ، ويعمل L.E.N. في مجلس إدارة Humacyte. L.E.N. هي مخترعة على براءات الاختراع المرخصة لشركة Humacyte والتي تنتج إتاوات ل L.E.N. L.E.N. تلقت هدية بحثية غير مقيدة لدعم البحث في مختبرها في جامعة ييل. لم يؤثر Humacyte على سلوك أو وصف أو تفسير النتائج الواردة في هذا التقرير.
Acknowledgements
يود المؤلفون أن يشكروا لورينزو سيوانان وخورخي نونيز على عملهما في تطوير تصميم كاسيت زراعة الأنسجة المستخدم في هذا البروتوكول ، ومختبر كامينسكي لاستخدام الاهتزاز الخاص بهما ، وماوريتسيو تشيوتشيولي وجيسيكا نوس للمساعدة في تقطيع الرئة ، وآلي لاروكو للمساعدة في التجارب التجريبية الأولية ، وهونغ تشيان على القراءة المتأنية للبروتوكول. تم دعم هذا العمل من خلال منح المعاهد الوطنية للصحة F30HL143880 (K.L.L.) ، ومنحة تدريب برنامج تدريب العلماء الطبيين T32GM136651 (K.L.L.) ، و U01HL145567 (L.E.N.) ؛ ومن خلال هدية بحثية غير مقيدة من شركة Humacyte Inc. (L.E.N.).
Materials
| Name | Company | Catalog Number | Comments |
| 3D Printer: Form 2 | Formlabs | ||
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | |
| 8-Bromo cAMP | Sigma | B7880 | |
| Agarose, UltraPure LMP | Invitrogen | 15517-014 | |
| Amphotericin B | Sigma | A2942 | |
| Barbed reducer fitting, 3/8 inch x 1/4 inch | McMaster-Carr | 5121K271 | |
| Benzonase nuclease | Sigma | E1014 | |
| Bovine serum albumin (BSA) Fraction V | Gemini | 700-104P | For AEC2 growth medium |
| Bovine serum albumin (BSA), standard grade | Gemini | 700-100P | For benzonase buffer |
| Check valve, polypropylene, 1/8 inch hose barb | Cole-Parmer | SK-98553-10 | |
| CHIR99021 | PeproTech | 2520691 | |
| Clear Resin, 1 L | Formlabs | RS-F2-GPCL-04 | |
| Cyanoacrylate glue, such as Krazy Maximum Bond Permanent Glue | Any hardware, craft, or drug store | KG483 or similar | |
| Dexamethasone | Sigma | D4902 | |
| DMEM (low glucose) | Gibco | 11885-084 | |
| DMEM (high glucose) | Gibco | 11965-092 | |
| DNA assay (Quant-iT PicoGreen dsDNA Assay Kit) | Invitrogen | P7589 | |
| EDTA, 0.5 M, pH 8.0 | AmericanBio | AB00502-01000 | |
| EdU kit (Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647) | Invitrogen | C10340 | Used according to manufacturer's directions |
| Elbow fitting, 3/8 inch | McMaster-Carr | 5121K907 | |
| F12 | Gibco | 11765-054 | |
| Fetal bovine serum (FBS), characterized | Hyclone | SH30071.03 | |
| Gentamicin sulfate | Gemini | 400-100P | Reconstituted in diH2O for a stock solution at 50 mg/mL |
| Hair clippers | Wahl | MiniArco | |
| Hank's balanced salt solution (HBSS), Phenol Red Free | Gibco | 14175-095 | |
| Heparin sodium injection, USP, 1000 U/mL | Sagent | NDC: 25021-400-30 | For intraperitoneal and intracardiac injection |
| Heparin sodium salt | Sigma | H4784 | For pulmonary artery perfusion; prepare stock solution at 100 U/mL in PBS |
| HEPES Buffer | Corning | 25-060-Cl | |
| Inline tee fitting, 3/8 inch x 1/8 inch | McMaster-Carr | 5121K851 | |
| Inoculating loop, disposable | Fisherbrand | 22-363-600 | |
| Insulin from bovine pancreas | Sigma | I6634 | |
| Ketamine injection, 100 mg/mL | Covetrus (Butler Animal Health) | 010177 | |
| KGF, recombinant human | PeproTech | 100-19 | |
| Laser cutter, VLS 3.50 30 watt | Universal Laser Systems | ||
| L-glutamine | Gibco | 25030-081 | |
| Luer-lock, female, 3/32 inch | Cole-Parmer | 45508-02 | |
| Luer-lock, male, 1/8 inch | Cole-Parmer | 30800-24 | |
| Luer-lock, male, 1/4 inch | McMaster-Carr | 51525K146 | |
| MCDB-131 Complete without serum | VEC Technologies | MCDB-131 WOFBS | |
| Magnesium chloride (MgCl2), 1 M | AmericanBio | AB09006-00100 | |
| NaCl | American Bioananalytical | AB01915 | |
| Phosphate buffered saline (PBS), without Ca2+ and Mg2+, 10X | Sigma | D1408 | Reconstitute to 1X with diH2O |
| Phosphate buffered saline (PBS), with Ca2+ and Mg2+ | Gibco | 21300-058 | |
| PDMS - SYLGARD 184 Silicone Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Penicillin/Streptomycin (10,000 U/mL penicillin/10,000 μg/mL streptomycin) | Gibco | 15140-122 | |
| Petri dish, 150 mm | Falcon | 351058 | |
| Plastic film (parafilm) | Bemis | PM-996 | |
| Pharmed BPT tubing, LS 16 | Masterflex | 06508-16 | |
| Pharmed BPT tubing, LS 17 | Masterflex | 06508-17 | |
| Platinum-cured silicone tubing, LS 14 | Masterflex | 96420-14 | |
| Platinum-cured silicone tubing, LS 16 | Masterflex | 96420-16 | |
| Platinum-cured silicone tubing, LS 36 | Masterflex | 96410-36 | |
| Poloxamer 407 (Pluronic F-127) | Sigma | P2443 | |
| Povidone/iodine prep pads, 10% | Dynarex Corporation | 1108 | |
| PTFE sheet, 0.060 inch (1/16 inch) thick | ePlastics | PTFENAT0.060X12X12 | For tissue culture cassette tabs |
| PTFE sheet, 0.093 inch (3/32 inch) thick | ePlastics | PTFENAT0.093X12X12 | For tissue culture cassette frames and clips |
| Peristaltic pump drive: Masterflex L/S Variable-Speed Digital Drive | Cole-Parmer | ZM-07528-30 | |
| Peristaltic pump head: Masterflex L/S Easy-Load II Pump Head | Cole-Parmer | EW-77202-60 | |
| Rat, Sprague Dawley | Charles River | Strain Code: 400 | |
| Razor blade | Any hardware or craft store | Personna 94-120-71 or similar | |
| Retinoic acid | Sigma | R2625 | |
| Rotary blades, 28 mm | Omnigrid | 2046 | |
| Rotary cutter, 28 mm | Olfa | Model 9551 | |
| Sodium deoxycholate (SDC) | Sigma | D6750 | |
| Sodium nitrorusside (SNP) | Sigma | 71778 | |
| Stopcock, 4-way | Edwards | 594WSC | |
| Suture, 4-0 monofilament polypropylene | Covidien | VP-557-X | |
| Syringe, 10 mL | BD | 302995 | |
| Syringe, 50 mL | BD | 309653 | |
| Tissue culture dish, 35 mm | Falcon | 353001 | |
| Tissue culture dish, 100 mm | Corning | 430167 | |
| Tissue culture plate, 6-well | Falcon | 353046 | |
| Tissue culture plate 12-well | Falcon | 353043 | |
| Transferrin human | Sigma | T8158 | |
| Tris, 1 M solution, pH 8.0 | AmericanBio | AB14043-01000 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| Vibratome, Compresstome VF-300-0Z | Precisionary Instruments LLC | ||
| Xylazine, 100 mg/mL | Henry Schein | NDC: 11695-4022-1 | |
| Y-connector, 1/16 inch barbed | Cole-Parmer | 30614-43 |
References
- Burri, P. H. Morphology and respiratory function of the alveolar unit. International Archives of Allergy and Applied Immunology. 76, Suppl 1 2-12 (1985).
- Barkauskas, C. E., Noble, P. W. Cellular Mechanisms of Tissue Fibrosis. 7. New insights into the cellular mechanisms of pulmonary fibrosis. American Journal of Physiology. Cell Physiology. 306 (11), 987-996 (2014).
- Taylor, M. S., et al. A Conserved Distal Lung Regenerative Pathway in Acute Lung Injury. American Journal of Pathology. 188 (5), 1149-1160 (2018).
- Carsana, L., et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infectious Diseases. 20 (10), 1135-1140 (2020).
- Basil, M. C., et al. The Cellular and Physiological Basis for Lung Repair and Regeneration: Past, Present, and Future. Cell Stem Cell. 26 (4), 482-502 (2020).
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Desai, T. J., Brownfield, D. G., Krasnow, M. A. Alveolar progenitor and stem cells in lung development, renewal and cancer. Nature. 507 (7491), 190-194 (2014).
- Evans, M. J., Cabral, L. J., Stephens, R. J., Freeman, G. Renewal of alveolar epithelium in the rat following exposure to NO2. The American Journal of Pathology. 70 (2), 1-24 (1973).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Borok, Z., et al. Keratinocyte growth factor modulates alveolar epithelial cell phenotype in vitro: expression of aquaporin 5. American Journal of Respiratory Cell and Molecular Biology. 18 (4), 554-561 (1998).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Sucre, J. M. S., et al. Successful establishment of primary Type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Stem Cell. 21 (4), 472-488 (2017).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nature Methods. 14 (11), 1097-1106 (2017).
- Chen, Y. W., et al. A three-dimensional model of human lung development and disease from pluripotent stem cells. Nature Cell Biology. 19 (5), 542-549 (2017).
- Korogi, Y., et al. In vitro disease modeling of hermansky-pudlak syndrome Type 2 using human induced pluripotent stem cell-derived alveolar organoids. Stem Cell Reports. 12 (3), 431-440 (2019).
- Strikoudis, A., et al. Modeling of fibrotic lung disease using 3D organoids derived from human pluripotent stem cells. Cell Reports. 27 (12), 3709-3723 (2019).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Chapman, H. A. Epithelial responses to lung injury: Role of the extracellular matrix. Proceedings of the American Thoracic Society. 9 (3), 89-95 (2012).
- Guilak, F., et al. Control of stem cell fate by physical interactions with the extracellular matrix. Cell Stem Cell. 5 (1), 17-26 (2009).
- Zhou, Y., et al. Extracellular matrix in lung development, homeostasis and disease. Matrix Biology. 73, 77-104 (2018).
- Calle, E. A., et al. Targeted proteomics effectively quantifies differences between native lung and detergent-decellularized lung extracellular matrices. Acta Biomaterialia. 46, 91-100 (2016).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Bonvillain, R. W., et al. A nonhuman primate model of lung regeneration: Detergent-mediated decellularization and initial in vitro recellularization with mesenchymal stem cells. Tissue Engineering Part A. 18 (23-24), 2437-2452 (2012).
- O'Neill, J. D., et al. Decellularization of human and porcine lung tissues for pulmonary tissue engineering. The Annals of Thoracic Surgery. 96 (3), 1055(2013).
- Wagner, D. E., et al. Three-dimensional scaffolds of acellular human and porcine lungs for high throughput studies of lung disease and regeneration. Biomaterials. 35 (9), 2664-2679 (2014).
- Burgstaller, G., et al. Distinct niches within the extracellular matrix dictate fibroblast function in (cell free) 3D lung tissue cultures. American Journal of Physiology-Lung Cellular and Molecular Physiology. 314 (5), 708-723 (2018).
- Sun, H., et al. Fibroblast engraftment in the decellularized mouse lung occurs via a β1-integrin-dependent, FAK-dependent pathway that is mediated by ERK and opposed by AKT. American Journal of Physiology-Lung Cellular and Molecular Physiology. 306 (6), 463-475 (2014).
- Booth, A. J., et al. Acellular normal and fibrotic human lung matrices as a culture system for in vitro investigation. American Journal of Respiratory and Critical Care Medicine. 186 (9), 866-876 (2012).
- Schwan, J., et al. Anisotropic engineered heart tissue made from laser-cut decellularized myocardium. Scientific Reports. 6, 32068(2016).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Gerckens, M., et al. Generation of Human 3D Lung Tissue Cultures (3D-LTCs) for Disease Modeling. Journal of Visualized Experiments. (144), (2019).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465(2017).
- Neuhaus, V., et al. Assessment of the cytotoxic and immunomodulatory effects of substances in human precision-cut lung slices. Journal of Visualized Experiments. (135), e57042(2018).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (6), 1315-1321 (2002).
- Vaccaro, C., Brody, J. S. Ultrastructure of developing alveoli. I. The role of the interstitial fibroblast. The Anatomical Record. 192 (4), 467-479 (1978).
- Calle, E. A., et al. Fate of distal lung epithelium cultured in a decellularized lung extracellular matrix. Tissue Engineering Part A. 21 (11-12), 1916-1928 (2015).
- Dobbs, L. G., Gonzalez, R., Williams, M. C. An improved method for isolating type II cells in high yield and purity. American Review of Respiratory Disease. 134 (1), 141-145 (1986).
- Dobbs, L. G. Isolation and culture of alveolar type II cells. American Journal of Physiology. 258, 134-147 (1990).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Dobbs, L. G., Pian, M. S., Maglio, M., Dumars, S., Allen, L. Maintenance of the differentiated type II cell phenotype by culture with an apical air surface. The American Journal of Physiology. 273 (2), 347-354 (1997).
- Bruce, M. C., Honaker, C. E. Transcriptional regulation of tropoelastin expression in rat lung fibroblasts: changes with age and hyperoxia. American Journal of Physiology. 274 (6), 940-950 (1998).
- Berk, J. L., Franzblau, C., Goldstein, R. H. Recombinant interleukin-1 beta inhibits elastin formation by a neonatal rat lung fibroblast subtype. Journal of Biological Chemistry. 266 (5), 3192-3197 (1991).
- Schultz, C. J., Torres, E., Londos, C., Torday, J. S. Role of adipocyte differentiation-related protein in surfactant phospholipid synthesis by type II cells. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (2), 288-296 (2002).
- Maksvytis, H. J., et al. In vitro characteristics of the lipid-filled interstitial cell associated with postnatal lung growth: evidence for fibroblast heterogeneity. Journal of Cellular Physiology. 118, 113-123 (1984).
- Hopkinson, A., et al. Optimization of amniotic membrane (AM) denuding for tissue engineering. Tissue Engineering Part C: Methods. 14 (4), 371-381 (2008).
- Fernandez-Perez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Scientific Reports. 9 (1), 14933(2019).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nature medicine. 16 (8), 927-933 (2010).
- Le, A. V., et al. Efficient and Functional Endothelial Repopulation of Whole Lung Organ Scaffolds. ACS Biomaterials Science & Engineering. 3 (9), 2000-2010 (2017).
- Ren, X., et al. Engineering pulmonary vasculature in decellularized rat and human lungs. Nature Biotechnology. 33 (10), 1097-1102 (2015).
- Wagner, D. E., et al. Comparative decellularization and recellularization of normal versus emphysematous human lungs. Biomaterials. 35 (10), 3281-3297 (2014).
- Balestrini, J. L., et al. Comparative biology of decellularized lung matrix: Implications of species mismatch in regenerative medicine. Biomaterials. 102, 220-230 (2016).
- Alysandratos, K. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved