Method Article
Tecidos pulmonares projetados preparados a partir de fatias pulmonares descelularizadas
Neste Artigo
Resumo
Este protocolo descreve um método para gerar tecidos pulmonares projetíveis, de pequena escala, repovoando fatias pulmonares descelularizadas cortadas com células epiteliais tipo 2 alveolares, fibroblastos e células endoteliais.
Resumo
Há necessidade de modelos pulmonares tridimensionais (3D) melhorados que recapitulem a complexidade arquitetônica e celular do alvéolo-de-pulmão nativo ex vivo. Modelos organoides recentemente desenvolvidos facilitaram a expansão e o estudo de progenitores epiteliais pulmonares in vitro, mas essas plataformas normalmente dependem de matriz e/ou soro derivados de tumores do rato, e incorporam apenas uma ou duas linhagens celulares. Aqui, descrevemos um protocolo para geração de tecidos pulmonares projetados (ELTs) baseado na recelularização multi-linhagem de fatias pulmonares descelularizadas cortadas com precisão (PCLS). Os ELTs contêm estruturas alveolares que compreendem epitélio alveolar, mesenquime e endotélio, dentro de um substrato de matriz extracelular (ECM) que se assemelha intimamente ao do pulmão nativo. Para gerar os tecidos, os pulmões de ratos são inflados com agarose, fatiados em fatias de 450 μm de espessura, cortados em tiras e descelularizados. Os andaimes Acellular ECM resultantes são então ressegados com células endoteliais primárias, fibroblastos e células epiteliais alveolares tipo 2 (AEC2s). Os AEC2s podem ser mantidos na cultura ELT por pelo menos 7 dias com um meio de crescimento quimicamente definido e livre de soro. Durante todo o processo de preparação e cultura do tecido, as fatias são cortadas em um sistema de fita que facilita o manuseio e a semeadura celular padronizada de múltiplos ELTs em paralelo. Esses ELTs representam uma plataforma de cultura organotípica que deve facilitar investigações de interações célula-célula e matriz celular dentro do alveolus, bem como sinais bioquímicos que regulam os AEC2s e seu nicho.
Introdução
Alvéolos são as unidades funcionais do pulmão distal, compreendendo uma malha de espaços aéreos de troca de gás forrados por células epiteliais alveolares tipo 1 (AEC1s) e células tipo 2 (AEC2s). Por trás do epitélio está uma densa rede de capilares, bem como apoiando mesenchyme, tudo apoiado por um andaime de matriz extracelular (ECM) que fornece força e flexibilidade a esses delicados sacos de ar1. Os alvéolos também são o local de lesão em inúmeras patologias pulmonares, incluindo fibrose pulmonaridiopática 2, síndrome de angústia respiratória aguda3 e doença coronavírus grave-19 (COVID-19)4. Embora o trabalho na última década tenha descoberto uma notável plasticidade dentro do epitélio pulmonar, os mecanismos que permitem a reparação pulmonar distal em alguns cenários - e que impedem a reparação em outros - permanecem uma área de intensa investigação5. O desenvolvimento de plataformas in vitro aprimoradas para modelar o alveolus facilitaria estudos de biologia alveolar, regeneração e terapêutica.
AEC2s auto-renovam e diferenciam-se em AEC1s, sendo, portanto, considerada a célula-tronco primária do pulmão distal 6,7,8. No entanto, essas células representam um desafio particular ao estudo in vitro, dadas as dificuldades associadas à cultura de AEC2s primários sem a perda do fenótipo9. Na cultura 2D convencional bidimensional(2D), os AEC2s achatam e adotam algumas características das células semelhantes a AEC110. Em contraste, as estratégias de cultura 3D, mais comumente organoides, apoiam a manutenção de características diferenciadas em AEC2sprimários 6,11,12 e permitem cultura de longo prazo de células-tronco pluripotentes (PSC) derivadas AEC2s 13,14. Os organoides têm sido usados para modelar o desenvolvimento pulmonar distal15, infecção viral11,15 e doença genética relacionada ao AEC2 13,16,17, permitindo insights importantes sobre a biologia e regeneração AEC2. No entanto, esses modelos de cultura normalmente compreendem apenas uma ou duas linhagens celulares, e incorporam as células em matrizes do tipo gel que não conseguem recapitular a arquitetura ou o substrato ECM do alvéolo pulmonar nativo.
O ECM é um regulador crítico do fenótipo celular e comportamento através de pistas moleculares, topológicas e mecânicas; compreende um componente-chave de nichos específicos do tecido que regulam o destino das células-tronco; e serve como um reservatório que modula a disponibilidade de fatores de crescimento secretos localmente 18,19,20,21. As células de cultivo no ECM nativo podem, assim, aumentar a capacidade preditiva de sistemas in vitro para modelar a biologia dos tecidos in vivo. A descelularização, processo que remove material celular de tecidos através de detergentes, enzimas ou métodos físicos ou outros, pode preservar em grande parte o andaime ECM de um órgão nativo, quando cuidadosamente realizado22,23. Esses andaimes podem ser repovoados com células para cultura biomimética 3D. No entanto, embora os andaimes descelularizados sejam amplamente utilizados para aplicações de engenharia de tecidos, seu uso para a cultura celular rotineira tem sido limitado. Vários estudos anteriores relataram a descelularização e recelularização de fatias pulmonares ou pequenos segmentos de tecido pulmonar. Além de estudos de prova de conceito 24,25,26, fatias pulmonares repovoadas têm sido utilizadas para estudar a adesão da matriz fibroblasto27,28 e investigar o efeito de matriz pulmonar doente no fenótipo27,29 do fibroblasto. Com tecnologias aprimoradas disponíveis para a geração de fatias de tecido cortadas com precisão, as fatias pulmonares descelularizadas poderiam oferecer uma plataforma conveniente e de pequena escala com a qual as células de cultura, preservando as subestruturas alveolares, as vias aéreas e vasculares. A incorporação de vários tipos de células permitiria estudos de interações célula-células dentro de um ambiente 3D fisiologicamente relevante. No entanto, estratégias aprimoradas são necessárias para facilitar o manuseio de tecidos durante todo o processo cultural, e para garantir a semeadura controlada e reprodutível de tecidos com número conhecido de células.
Aqui, apresentamos um protocolo para gerar tecidos pulmonares projetados (ELTs) repovoando fatias pulmonares descelularizadas cortadas com precisão (PCLS) com células endoteliais primárias, AEC2s e fibroblastos. Em uma adaptação do nosso sistema de tecido cardíaco projetado anteriormente30 e estratégias inteiras de descelularizaçãopulmonar-recelularização pulmonar 22,31, descrevemos procedimentos para cortar o PCLS de pulmões de ratos e cortar as fatias em fitas de cultura de tecido reutilizável que simplificam e padronizam manipulações a jusante. As fatias cortadas são descelularizadas para formar andaimes ECM acelulares, que são repovoados em banhos personalizados de semeadura. Os andaimes de fatia pulmonar preservam componentes e arquitetura eCM críticos e suportam o crescimento de AEC2s dentro de estruturas alveolares de várias linhagens por pelo menos 7 dias. Os ELTs representam um novo sistema de cocultura alveolar dentro de uma matriz 3D fisiologicamente relevante, que deve apoiar o desenvolvimento de estratégias de engenharia de tecidos pulmonares, ao mesmo tempo em que facilita estudos biológicos básicos de AEC2s e alvéolos.
Protocolo
Todos os procedimentos experimentais animais descritos neste artigo foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais de Yale.
1. Criação de de Cultura tecidual e Banhos de Semeadura
NOTA: Uma vez feitas, de cultura tecidual e banhos de semeadura podem ser autoclavados e reutilizados para rodadas repetidas da cultura ELT.
-
de Cultura de Tecidos
- Use um cortador a laser para cortar quadros de de cultura tecidual e clipes de politefluoroetileno de 3/32 polegadas de espessura (PTFE) de acordo com os desenhos fornecidos no Arquivo Suplementar 1 e Arquivo Suplementar 2, respectivamente. Use um cortador a laser para cortar abas de de cultura tecidual de 1/16 polegadas de espessura PTFE de acordo com o Arquivo Suplementar 3. O corte descreve 3x usando 80% de potência e 15% de velocidade (para um cortador a laser de 30 W).
-
Banhos semeados
- Use os arquivos CAD de banho de semeadura (Arquivo Suplementar 4 e Arquivo Suplementar 5) para imprimir em 3D a base e o anel do molde de banho de semeadura, respectivamente, utilizando resina clara.
- Mergulhe os moldes em uma solução de 10% poloxamer 407 em água destilada durante a noite antes de usar para ajudar na liberação de PDMS. Deixe o ar secar, em seguida, encaixe o anel sobre a base do molde e enrole em filme plástico flexível para ajudar a evitar vazamentos.
- Prepare pelo menos 60 g por molde de polidimtilsiloxano (PDMS) misturando elastômero PDMS em uma proporção de 10:1 com agente de cura, e despeje no molde impresso em 3D. Desgas o PDMS em um desiccator de vácuo por 30 minutos para remover quaisquer bolhas de ar.
- Asse banhos de semeadura a 60 °C por 8h.
2. Preparação de fatias pulmonares cortadas com precisão de pulmões de ratos
- Colheita de Órgãos
- Prepare um sistema de perfusão dividido que compreende membros movidos à gravidade e à bomba, como retratado na Figura 1. Conecte uma cânula de artéria pulmonar (PA) até o final da tubulação, compreendendo um conector Y-conector Y barbeado de 1/16 polegadas ligado a um comprimento de 1/2 polegada de tubo de silicone LS 14 e um conector de trava de luer fêmea de 3/32 polegadas (ver Figura 1). Não conecte uma válvula de sepse à cânula neste momento.
- Prime as linhas com PBS contendo heparina de 100 U/mL e 0,01 mg/mL de nitroprusside de sódio (SNP) para anticoagulação e vasodilatação, respectivamente. Pré-defina a bomba de perfusão para 30 mL/min.
NOTA: Adicione SNP fresco à solução de heparina e mantenha-se protegido contra a luz. - Dose um adulto (8-12 semanas de idade, aproximadamente 300-350 g) Rato Sprague-Dawley com uma injeção intraperitoneal (IP) de 400 U/kg de heparina para anticoagulação, seguido de injeção IP de cetamina (75 mg/kg) e xilazina (5 mg/kg) para anestesia. Confirme um plano cirúrgico de anestesia por falta de resposta a estímulos nocivos (beliscão do dedo do pé).
- Corte o peito e o abdômen de pele usando cortadores de cabelo. Em seguida, borrife com 70% de etanol e limpe 3x com 10% de povidone-iodo.
- Segure a pele abaixo do nível do diafragma com fórceps de dentes de rato. Em seguida, faça uma incisão transversal de 1/2 polegada na pele com uma tesoura fina. Segure a fáscia abdominal exposta com os fórceps, faça uma incisão transversal de 1/2 polegada na fáscia e, em seguida, estenda a incisão através da pele e fáscia através da largura do abdômen superior.
- Use a ponta da tesoura fina para fazer uma pequena incisão (não mais de 1/8 polegada) no centro do diafragma anterior, fazendo com que os pulmões se retraiam no tórax. Estenda a incisão no diafragma através da largura total do peito.
- Faça duas incisões verticais através da altura total da caixa torácica em direção ao pescoço, tomando cuidado para não danificar os pulmões. Estenda a incisão através das costelas esquerdas para cortar a clavícula e ao longo da lateral do pescoço até o nível da laringe, expondo a traqueia.
- Disseque a traqueia livre do tecido conjuntivo circundante e do esôfago. Faça uma incisão transversal na metade anterior da traqueia entre dois anéis de cartilagem, perto da laringe. Enfie uma sutura de polipropileno 4-0 atrás da traqueia, abaixo do nível da incisão, e pré-amarre vagamente a primeira metade do nó de um cirurgião com duas torções.
- Coloque uma cânula composta por um conector Y-conecter Y de 1/16 polegadas barbeado conectado a uma válvula de verificação unidirecional e um comprimento de 1/2 polegada de tubo de silicone LS 14 com um conector de 3/32 polegadas fêmea luer-lock (ver Figura 1) na traqueia inserindo um membro do conector Y na incisão traqueal em direção à direção dos pulmões.
- Posicione a alça de sutura pré-amarrada ao redor da traqueia ao nível da cânula inserida e aperte ao redor do conector Y inserido para fixar a cânula no lugar. Adicione dois lances de torção única da sutura para completar o nó.
- Encha uma seringa de 10 mL com ar e conecte-se ao luer-lock da cânula traqueal.
- Fixar a veia cava inferior perto do diafragma usando um hemostato curvo, em seguida, injetar o coração com heparina de 150 U (1000 U/mL) através do ventrículo direito (RV).
- Abra parcialmente a torneira da linha de gravidade, para produzir um gotejamento lento, mas constante, de PBS/heparin/SNP da cânula pa preparada na etapa 2.1.1.
- Enfie a agulha de uma sutura de polipropileno 4-0 atrás da base do PA onde sai do RV. Use a primeira metade do nó de um cirurgião para pré-amarrar um laço solto de sutura ao redor da base do PA.
- Faça uma pequena incisão (não mais que 1/8 polegada) no RV logo abaixo e perpendicular ao PA usando uma tesoura fina, em seguida, insira um membro do conector de cânula PA Y na base do PA. Fixar a sutura ao redor do PA e do conector inserido e adicionar um lançamento de uma única torção para completar o nó do cirurgião.
NOTA: A cânulação do PA sob fluxo impede a introdução de bolhas de ar na vasculatura que podem impedir a limpeza adequada dos pulmões. - Conecte uma válvula unidirecional à outra extremidade do conector Y-cateter Y do PA e, em seguida, corte o ápice do coração para permitir o fluxo sanguíneo efflux através do ventrículo esquerdo.
NOTA: A não isentação do ápice do coração antes de perfumar através da bomba pode causar danos à barreira de gás sanguíneo, levando ao vazamento de fluido nos espaços aéreos. - Mude a linha de perfusão para o lado da bomba usando a torneira que conecta as duas linhas e ligue a bomba a 30 mL/min. Ao perfundar os pulmões através do PA, ventile manualmente os pulmões através da seringa traqueal de 10 mL a aproximadamente 10-15 respirações/min, para facilitar a limpeza dos pulmões de sangue. Perfunda os pulmões até ficarem majoritariamente brancos, geralmente exigindo 40 mL de PBS/heparina/SNP ou menos.
NOTA: A limpeza inadequada dos pulmões do sangue pode prejudicar a descelularização a jusante. - Corte a traqueia posterior um pouco acima do nível da cânula traqueal, e depois disseque os pulmões e o coração livres de todo o tecido conjuntivo restante e extraia os pulmões e o coração em bloco.
- Encha uma seringa de 10 mL com 2% de baixo ponto de fusão na solução de sal balanceada (HBSS) da Hank sem fenol vermelho, pré-mar a 42 °C.
NOTA: O volume exato de agarose necessário variará de acordo com o tamanho do pulmão. Pulmões maiores (ou seja, de ratos maiores que 400 g) exigirão mais de 10 mL de agarose. - Inflar manualmente os pulmões extraídos 3x com 10 mL de ar (ou seja, para aproximadamente capacidade pulmonar total) através da cânula traquea para ajudar a recrutar parenchyma colapsado.
- Infle imediatamente os pulmões com a seringa preparada de agarose injetando manualmente a agarose através da cânula traquea a uma taxa de aproximadamente 40 mL/min, apenas até que as pontas mais distais dos lóbulos pulmonares sejam infladas. Se as regiões distais do pulmão permanecerem colapsadas, injete mais 1-2 mL de agarose.
- Tampe a traqueia anexando a tampa branca de uma torneira de 4 vias à presa fêmea da cânula traqueal. Coloque o pulmão em uma placa de Petri de 150 mm no gelo para permitir que a agarose se solidifique.
NOTA: A inflação do pulmão logo após a extração é fundamental para garantir o preenchimento uniforme do parenchyma pulmonar e o subsequente corte de tecido bem sucedido. Se o pulmão inflar de forma muito desigual, não proceda com o corte pulmonar, pois a qualidade da fatia será ruim.
- Fatiamento pulmonar
NOTA: O procedimento exato de corte pode precisar ser adaptado com base no microtome vibratório (vibratome) que está sendo utilizado; exemplos adicionais de preparação do PCLS com vários cortadores de tecido foram publicados anteriormente 32,33,34.- Pré-esfrie o bloco de refrigeração metálico a -20 °C e mantenha no gelo quando não estiver usando durante todo o procedimento de corte.
- Use uma pequena gota de cola cianoacrilato para fixar uma lâmina ao suporte da lâmina. Conecte cuidadosamente o suporte da lâmina ao vibratome usando uma chave allen de modo que ela apenas se a linha com a extremidade de um tubo de espécime inserido na bandeja de tampão.
- Prepare placas de 6 poços com 3 mL por HBSS bem estéril estéril sem vermelho fenol para coletar as fatias.
- Usando um bisturi, corte um pedaço de tecido pulmonar aproximadamente 1-1,5 cm3.
NOTA: O tecido pulmonar das porções inferior e média do lobo esquerdo, bem como dos lobos médio e inferior direito, produz mais facilmente fatias de tecido maiores que maximizam a área alveolar. Se estão presentes regiões teciduais não infladas ou áreas de tecido conjuntivo, corte este tecido com uma tesoura ou oriente para baixo em direção ao êmbolo; esse tecido tende a não cortar limpo. - Coloque uma pequena gota de cola cianoacrilato no êmbolo do tubo de espécime. Tecido pulmonar dab em uma limpeza de papel para remover o excesso de umidade, e, em seguida, imediatamente colocar o tecido pulmonar em cima do êmbolo usando um par de fórceps.
- Deslize o tubo de metal do tubo da amostra até o nível da parte superior do tecido e mantenha no lugar, com o êmbolo recuado. Pipeta pré-aquecida 2% surgiu no HBSS na parte superior do tubo para cercar completamente o tecido.
- Coloque o bloco de frio em torno do tecido por cerca de 1 minuto para permitir que a agarose se solidifique.
- Insira o tubo da amostra na bandeja de tampão. Encha a bandeja com PBS gelado até o meio do bloco de tecido. Gire o interruptor da caixa do motor para avançar rapidamente (FF) para avançar o êmbolo da caixa do motor para que ele esteja apenas tocando a base do tubo de espécime.
- Defina as configurações desejadas para espessura de fatia, velocidade de corte e frequência de oscilação, por exemplo, 450 μm de espessura, velocidade 4 e frequência de oscilação 5. Selecione o modo Contínuo e, em seguida, gire o interruptor para ligar para começar a cortar.
- À medida que as fatias de tecido caem na bandeja de tampão, transfira-as para as placas preparadas de 6 poços usando um laço ou espátula inoculante.
- Pare de cortar quando a espessura de ~2 mm do tecido permanecer no tubo da amostra, para evitar danificar a lâmina ou cortar tecido contendo cola.
- Repita os passos acima para cortar tecido pulmonar adicional, conforme desejado.
- Descelularize as fatias imediatamente para a preparação do andaime, ou snap-freeze e armazene a -80 °C por até 2 meses. Para congelar, transfira 4-6 fatias para uma placa de Petri de 35 mm e aspire cuidadosamente qualquer excesso de fluido ao redor das fatias. Coloque os pratos em um banho de gelo seco e 100% etanol para congelar, em seguida, enrole em papel alumínio, lacre em um saco plástico e transfira para -80 °C.
NOTA: Não coloque fatias frescas diretamente em um congelador de -80 °C, pois a taxa relativamente lenta de congelamento pode fazer com que cristais de gelo se formem que podem danificar o tecido.
3. Preparação de andaimes de tecido pulmonar
- Elaboração de Soluções de Materiais e Descelularização
- Quadros, clipes e guias automáticos.
- Prepare soluções de descelularização conforme descrito na Tabela 1.
NOTA: Adicione nuclease de benzonase ao buffer pré-aquecido imediatamente antes do uso e filtro estéril. Prepare as soluções Triton X-100 e desoxicolato de sódio (SDC) dentro de 24-48 h do procedimento de descelularização. Prepare soluções antibiótico/antimíctica e tampão de benzonase com até 30 d de antecedência e armazene a 4 °C.
- Cortando e cortando fatias pulmonares
NOTA: Embora o corte e o recorte possam ser feitos sem estéril no banco, as etapas de descelularização na seção 3.3 e todo o manuseio subsequente dos andaimes de tecido devem ser realizados em uma coifa de fluxo laminar.- Encha uma placa de Petri de 100 mm cerca de um terço cheia com PBS. Transfira (quadros contendo dois clipes cada) e abas para o prato usando fórceps.
- Se usar fatias congeladas, descongele um prato de cada vez, despejando PBS de temperatura ambiente no prato para cobrir as fatias. Mantenha os pratos restantes em gelo seco.
- Transfira uma fatia descongelada para uma placa de Petri de 150 mm. Desdobre suavemente a fatia usando fórceps finos, se necessário, de modo que ela fique plana, em seguida, aspira cuidadosamente o excesso de PBS ao redor do tecido.
- Use uma lâmina de barbear, com uma régua como guia, para cortar uma tira de 3 mm de largura da fatia pressionando o comprimento total da lâmina firmemente contra o prato e balançando-a ligeiramente lado a lado com a borda da lâmina mantida no lugar. Alternativamente, use um cortador rotativo adaptado com 2 lâminas paralelas separadas por um espaçador feito sob medida de 3 mm (por exemplo, feito de acetal [polioximetileno]) para cortar tiras de tecido. Evite lágrimas, furos, grandes vias aéreas ou vasos, ou tecido conjuntivo espesso.
NOTA: Para um recorte bem sucedido, a tira deve ter pelo menos 9 mm de comprimento. - Usando fórceps, transfira a tira de tecido para a placa de Petri de 100 mm preparada.
- Corte a tira de tecido na fita: flutue o tecido acima da fita, centralizando o tecido para saliência dos orifícios nos clipes em cada extremidade. Com fórceps finos, coloque uma guia parcialmente no orifício em uma extremidade, endireitar suavemente o tecido e, em seguida, coloque a segunda guia. Usando fórceps em cada mão, pressione cada guia completamente para fixar o tecido.
NOTA: Se tiver dificuldade em manter o tecido no lugar antes do corte, aspire um pouco de PBS do prato para baixar o nível do fluido. Tenha cuidado para não esticar o tecido na colocação do segundo clipe, pois isso pode levar à ruptura. - Repita o procedimento de descongelamento, corte e recorte nas etapas 3.2.2-3.2.6 para quantos tecidos desejarem.
- Descelularização de fatias
- Uma vez que todas as fatias são cortadas, transfira o prato de 100 mm contendo as fitas para um capô de fluxo laminar.
- Inicie o passo 1 do protocolo de descelularização (ver Tabela 2): usando um hemostat curvo para agarrar os lados entalhados de cada, transfira para placas de 6 poços (2 tecidos/bem) preenchidos com 3 mL de PBS + íons + antibióticos/antimípticos por poço (ver receita de solução na Tabela 1).
- Coloque placas de poço em um agitador orbital a 30 rpm por 10 minutos.
- Continue com o passo 2 do protocolo de descelularização (ver Tabela 2): aspire o fluido de cada poço, depois substitua por 3 mL/well PBS + íons, coloque placa no agitador orbital a 30 rpm e incubar por 5 min.
- Repita o passo 3.3.4 para cada uma das soluções e as durações correspondentes conforme descrito no protocolo de descelularização na Tabela 2.
- Após a etapa final de lavagem com PBS + antibióticos/antimípticos (etapa 20 da Tabela 2), transfira tecidos para placas estéreis de 6 poços com PBS fresco + antibióticos/antimípticos, e incubar a 37 °C por 48 h.
NOTA: Após a esterilização com antibióticos/antimípticos, os andaimes de tecido pulmonar podem ser semeados imediatamente, ou armazenados a 4 °C por até 30 d.
4. Recelularização e Cultura de Fatias
NOTA: A Figura 2 mostra uma linha do tempo proposta para a semeadura e cultura tecidual, na qual as fatias são semeadas primeiro com células endoteliais microvasculares pulmonares de ratos e cultivadas em meio endotelial de baixo soro; em seguida, semeado com AEC2s de rato e fibroblastos pulmonares de rato com um meio de crescimento AEC2 sem soro (adaptado de Jacob et al.13 e You et al.35); consulte notas adicionais sobre fontes de celular usadas em resultados e detalhes da mídia de cultura na Tabela 3. Esta estratégia produz estruturas alveolares contendo monocamadas AEC2.
- Preparando andaimes de tecido para semeadura (Dia -4 ou -3)
- Se usar andaimes de tecido armazenados a 4 °C, incubar andaimes durante a noite a 37 °C com PBS fresco + antibióticos/antimicóticos (10% penicilina/estreptomicina, 4% anfotericina B, 0,4% gentamicina na PBS) antes da semeadura.
- Enxágüe andaimes 3x com PBS estéril (5 mL/well), 5 min cada.
- Examine andaimes sob um microscópio de contraste de fase na ampliação de 5x para selecionar tecidos para semeadura.
NOTA: Os melhores andaimes para semeadura não possuem lágrimas ou orifícios e não contêm grandes vias aéreas ou embarcações. Embora andaimes com as características possam ser semeados com sucesso, os padrões de repopulação podem diferir daqueles observados em áreas alveolares.
- Semeadura de Células Endoteliais (Dia -3)
- Conte células endoteliais usando um hemótmetro e prepare a suspensão da célula endotelial em meio endotelial (ver Tabela 3) a 5 x 106 células/mL, com células suficientes para semear 500.000 células endoteliais por fatia (por exemplo, para 12 fatias, resuspende 6 x 106 células em 1,2 mL médio).
- Coloque banhos de semeadura autoclaved em pratos petri de 100 mm. Transfira andaimes enxaguados de cabeça para baixo para banhos de semeadura: use um hemostat curvo fino para agarrar uma fita pelos lados entalhados, use um hemostat reto ou fórceps para agarrar uma extremidade da fita (tomando cuidado para não tocar no tecido em si) e depois agarrar a fita novamente com as pontas do hemostat curvo fino através dos orifícios ao longo dos lados entalhados, e coloque em um banho de semeadura bem. Repita para as fitas restantes.
NOTA: Quando colocados corretamente, os andaimes serão centrados, de cabeça para baixo, na parte inferior de cada poço. Se necessário, pressione suavemente no canto da fita com as pontas de um hemostat para garantir que o esteja sentado no poço. Assentos inadequados da fita pode levar à má semeadura de tecido. É aceitável se o poço contiver uma pequena quantidade de PBS. - Gire a suspensão celular preparada suavemente para misturar, em seguida, use uma pipeta manual para pipeta 100 μL células diretamente em cima de cada tecido na base do poço, tomando cuidado para não danificar o tecido com a ponta da pipeta.
- Transfira tecidos semeados para a incubadora de cultura celular a 37 °C/5% de CO2.
- Depois de 2h, adicione 900 μL de cultura pré-aquecida em cada poço usando uma pipeta manual e, em seguida, retorne à incubadora. Se um ficar desatado (flutua) ao adicionar meio, pressione suavemente para baixo no canto da fita com a ponta da pipeta para que ele fique liso no poço.
- Mude de meio no dia -2. Retire o meio inclinando a placa de Petri e tubo manualmente com uma ponta de pipeta levemente colocada no canto do poço, para não perturbar o. Substitua por 1 mL de meio endotelial fresco por poço.
- AEC2 e Fibroblast Sementes e Cultura de Tecidos (Dia 0)
- Conte AEC2s e fibroblastos usando um hemótmetro. Prepare uma suspensão celular 1:1 de AEC2s e fibroblastos em meio de crescimento AEC2 (média de base epitelial + suplementos AEC2; ver Tabela 3) em 5 x 106 células totais/mL, com células suficientes para semear 500.000 células (250.000 AEC2s e 250.000 fibroblastos) por fatia (por exemplo, para 12 fatias, resuspend 3 x 106 AEC2s + 3 x 106 fibroblastos juntos em 1,2 mL médio).
- Pipeta para fora o meio de cada poço do banho de semeadura, conforme descrito na etapa 4.2.6. Gire a suspensão celular preparada suavemente para misturar, em seguida, pipeta 100 μL células diretamente em cima de cada tecido na base do poço.
NOTA: É aceitável se uma pequena quantidade de meio endotelial permanecer no poço antes da semeadura de AEC2/fibroblasto. - Transfira tecidos semeados para a incubadora de cultura celular a 37 °C/5% de CO2.
- Depois de 2h, adicione 900 μL de crescimento AEC2 pré-aquecido para cada poço e, em seguida, retorne à incubadora.
- Após 24h de cultura (dia 1), prepare uma placa de 12 poços com 1 mL de meio de crescimento AEC2 pré-aquecido por poço por.
- Pipeta 800 μL de médio de cada poço do banho de semeadura. Remova as fitas do banho de semeadura: segure cada um com um hemostat curvo fino através dos orifícios ao longo dos lados entalhados, transfira para um hemostat reto ou fórceps para agarrar o em uma extremidade e virar, em seguida, use o hemostat curvo para agarrar o através dos lados entalhados e transferir para o lado direito para cima, um por bem, para a placa de 12 poços preparada.
- Mude o meio de cultura na placa de 12 poços a cada dois dias até o dia 7 ou pelo comprimento desejado da cultura: use uma pipeta pasteur de vidro para aspirar o meio de cada poço, tomando cuidado para não tocar no tecido; pipeta em 1 mL de crescimento AEC2 fresco por poço.
NOTA: O grau de repopulação tecidual pode ser monitorado através de microscopia de contraste de fase a 5x de ampliação durante toda a duração da cultura.
5. Colheita de tecidos e Análise de Amostras
- Para corrigir ELTs para histologia e coloração imunofluorescente, transfira de cultura tecidual para formalina 10% neutra e incubar por 3-4 h à temperatura ambiente em um roqueiro. Remova os tecidos das fitas usando a ponta de um fórceps fino para cortar o tecido onde ele encontra as abas. Tecido de processo de acordo com métodos rotineiros para incorporação de parafina e histologia; não são necessárias técnicas especializadas.
- Para processar ELTs para qRT-PCR, enxágue tecidos em em PBS 2x, depois remova tecidos e encaixe congelar ou proceda com lise para extração de RNA.
NOTA: A junção de pelo menos 2 fatias semeadas com 1 x 106 células e cultivadas por 7 dias deve produzir um RNA amplo para análise de PCR a jusante.
Resultados
Uma visão geral do processo para gerar ELTs - compreendendo corte pulmonar, recorte de fatias e descelularização e repopulação de andaimes - é apresentada na Figura 3. Os ELTs aqui apresentados foram cultivados usando células endoteliais microvasculares primárias pulmonares (ver Tabela de Materiais), aC2s de rato neonatal e fibroblastos neonatais de rato enriquecidos com lipofibroblast36. Os AEC2 foram recentemente isolados por meio de classificação baseada em contas magnéticas, como descrito anteriormente37; protocolos alternativos de isolamento foram detalhados e discutidos em outros lugares 38,39,40. A pureza dos AEC2s de ratos isolados pode ser avaliada através de citometria de fluxo para o marcador de superfície AEC2 específico para ratos RTII-7041, ou através da coloração de uma amostra celular citocentrifada para RTII-70 ou proteína pro-surfactante C (pSPC). Os fibroblastos pulmonares de ratos foram isolados do pós-natal 7-9 filhotes de ratos de acordo com uma adaptação de um protocolo publicado42 e usado na passagem 1-2; protocolos alternativos de isolamento foram descritos em outros lugares43,44. A pureza de fibroblastos isolados pode ser avaliada através da coloração de células cultivadas ou citocentrifadas para vimentina de marcador mesenquimal, e o enriquecimento lipofibroblast pode ser avaliado através de coloração para Óleo Vermelho O45.
Quando o tecido pulmonar é uniformemente inflado com agarose, e peças de tecido estrategicamente selecionadas e orientadas para o corte, de modo a maximizar a área total e parenchímal do tecido, um pulmão de rato pode produzir tecido para elts >100 alveolares. As tiras de PCLS exibem integridade mecânica suficiente para serem cortadas em fitas de tecido com poucos (<5%) casos de rasgo (Figura 3B).
O protocolo para descelularizar as fatias pulmonares baseia-se de perto no nosso protocolo de descelularização pulmonar anteriormente publicado, que por proteômica quantitativa foi demonstrado para preservar muitos componentes de ECM em níveis não significativamente diferentes daqueles no pulmão nativo22. Andaimes descelularizados preservam a arquitetura nativa dos alvéolos, como visto pela coloração de hematoxilina e eosina (Figura 4A,B) e por microscopia de contraste de fase (Figura 4C). Normalmente excluímos andaimes contendo grandes vias aéreas ou vasos (Figura 4D) ou lágrimas, embora o primeiro possa ser incluído se forem de interesse do pesquisador. A descelularização leva a uma redução de 96% no conteúdo de DNA tecidual medida por um ensaio para DNA de dupla derivação (ver Tabela de Materiais; 0,50 μg/mg ± 0,073 μg/mg vs 0,018 μg/mg ± 0,0035 μg/mg em tecido nativo vs descelularizado, respectivamente, média ± SEM) (Figura 5A), sem DNA visível pela coloração de hematoxiclina (Figura 4B). A coloração histológica e imunofluorescente de andaimes descelularizados revela a manutenção de proteínas ECM colágeno, elastina, colágeno IV e laminina com arquitetura e quantidade semelhante à das fatias pulmonares nativas (Figura 5B-E). Observe que os núcleos de tecidos nativos mancham manchas azul/preto com trichome (para colágeno) e EVG (para elastina). A coloração imunofluorescente foi realizada como descrito anteriormente, utilizando métodos padrão para coloração de tecidos37. Os anticorpos utilizados e suas respectivas concentrações estão listados na Tabela 4.
A repopulação bem-sucedida leva a ELTs altamente celulares após 7 dias, com um padrão de repopulação alveolar visível pela microscopia de luz (Figura 6A-C). Em alguns casos, com uma celularidade muito alta, estruturas do tipo organoide podem ser visíveis (Figura 6A,B). A semeadura de tecido mal sucedida pode ser visualizada por microscopia de contraste de fase durante a cultura (Figura 6C). Após a cultura de andaimes teciduais com AEC2s, fibroblastos e células endoteliais, os ELTs são densamente repovoados com estruturas alveolares que compreendem todas as três linhagens celulares (Figura 6D,E). No dia 7 ou 8, os AEC2 mantêm a morfologia cuboidal e a proteína surfactante expressa-B (SPB) e a proteína corporal lamelar ABCA3, sem evidência de diferenciação significativa aos AEC1s (Figura 6E,F). Os AEC2s são altamente proliferativos em ELTs, como demonstrado pela incorporação de 5-ethynyl-2'-deoxyuridina (EdU) após um pulso de 2 h a 10 μM (Figura 6G).
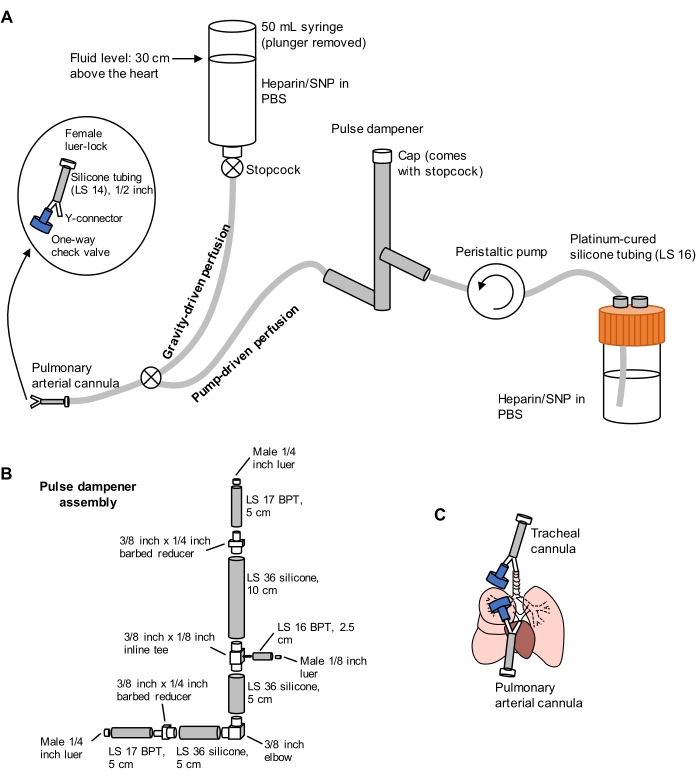
Figura 1: Esquema de sistema de perfusão para extração e limpeza pulmonar. (A) O sistema de perfusão compreende um membro movido à gravidade, utilizado para a cannulação inicial da artéria pulmonar sob fluxo; e um membro movido a bomba, usado para limpar os pulmões eficientemente após a cannulação inicial. A linha da bomba inclui um "amortecedor de pulso" que amortece os picos de pressão causados pela bomba. O desenho das cânulas arterials traqueais e pulmonares é detalhado à esquerda. SNP = nitroprusside de sódio. (B) Detalhes do conjunto do amortecedor de pulso. BPT e silicone referem-se a tipos de tubulação. (C) Posições de cânulas arterials traqueais e pulmonares colocadas durante a extração pulmonar. Clique aqui para ver uma versão maior desta figura.

Figura 2: Cronograma cultural para recelularização de tri-linhagem. Cronograma proposto para semeadura e cultura de três linhagens, incluindo o tempo de semeadura em duas fases. São indicados números celulares para semeadura e meio de cultura para cada fase. Veja os detalhes da mídia cultural na Tabela 3. AEC2 = célula epitelial alveolar tipo 2. EC = célula endotelial. FB = fibroblasto. Clique aqui para ver uma versão maior desta figura.
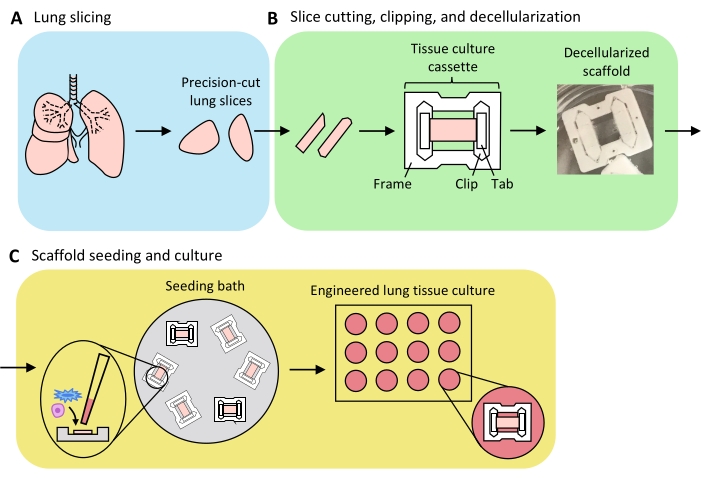
Figura 3: Esquema de preparação de tecido pulmonar projetado. (A) Tecido pulmonar nativo é cortado em fatias usando um vibratome. (B) As fatias pulmonares cortadas com precisão são cortadas em tiras padronizadas de 3 mm de largura, cortadas em fitas de cultura tecidual (PTFE) politetrafluoretileno (PTFE) e detergente-decelularizada para produzir andaimes de matriz extracelular acelular. (C) Os andaimes são ressecados em banhos especializados de semeadura que limitam a área de semeadura à área do tecido e, em seguida, cultivados em uma placa de poço padrão. Clique aqui para ver uma versão maior desta figura.
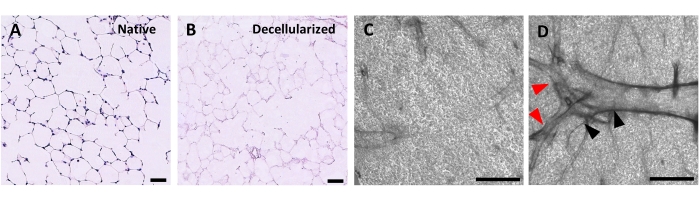
Figura 4: Estrutura de andaimes pulmonares descelularizados. Manchas de H&E de fatias pulmonares nativas (A) e descelularizadas (B) mostrando preservação da arquitetura alveolar após a descelularização. (C,D) Exemplos de andaimes ECM descelularizados vistos em 5x de ampliação por microscopia de contraste de fase, compreendendo tecido predominantemente alveolar (C) ou contendo grandes vias aéreas e vasos ramificados (D, cabeças de flecha pretas e ruivas). Barras de escala, 50 μm (A,B); 500 μm (C,D). Clique aqui para ver uma versão maior desta figura.
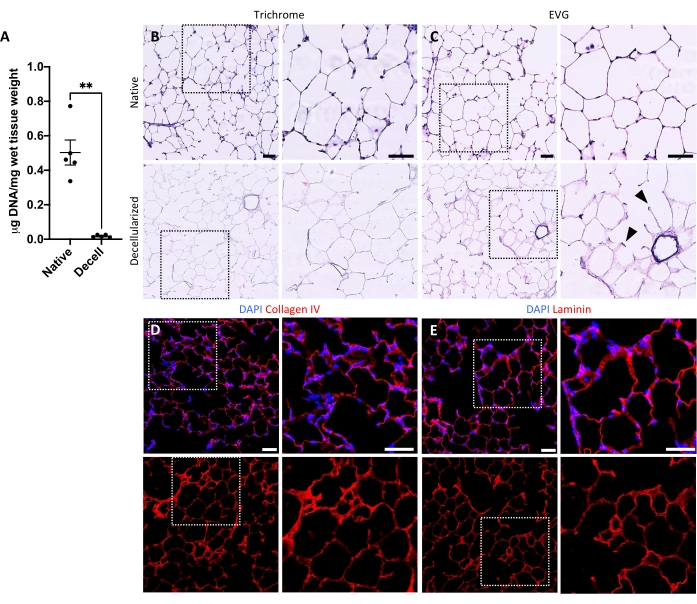
Figura 5: Remoção de DNA e preservação de matriz em andaimes pulmonares descelularizados. (A) Quantificação do DNA em fatias pulmonares nativas e descelularizadas (média ± SEM, n = 5). Teste de welch , **P < 0,01. Decell = descelularizado. (B,C) Mancha histológica de fatias pulmonares nativas e descelularizadas para colágeno (B) e elastina (C). Pontas de flecha, elastina preservada em anéis de entrada alveolar de tecido descelularizado. (D,E) Coloração imunofluorescente de fatias pulmonares nativas e descelularizadas para colágeno IV (D) e laminina (E). Barras de escala, 50 μm. Em todos os painéis, as caixas pontilhadas delineiam a região da imagem que é ampliada à direita em cada painel respectivo. Clique aqui para ver uma versão maior desta figura.

Figura 6: Repopulação celular de tecidos pulmonares projetados. (A-C) Exemplos de ELTs recelularizados no 7º dia da cultura, conforme visualizado durante a cultura por microscopia de contraste de fase. O padrão de recelularização espelha a estrutura alveolar do tecido. Em algumas áreas de alta celularidade, estruturas organoides podem se formar (pontas de flecha). (A) e (B) representam repopulação celular bem sucedida, enquanto (C) representa um baixo nível de recelularização após 7 dias de cultura. (D-G) Mancha de ELTs recelularizados no dia 7 ou 8 da cultura. (D) Manchas de H&E mostrando repopulação celular da septa alveolar. (E) Etiquetas de coloração imunofluorescentes engrafadas proCollagenIα1+ fibroblastos, AEC2s ABCA3+ e células endoteliais CD31+ . (F) Os tecidos contêm AEC2s SPB+ abundantes, mas poucos RTI-40 (podoplanin)+ AEC1s nessas condições. (G) Muitos AEC2s estão proliferando em ELTs, medidos pela incorporação da EdU. Barras de escala, 500 μm (A-C); 25 μm (D-G). Clique aqui para ver uma versão maior desta figura.
Tabela 1: Soluções de descelularização. Detalhes de preparação para soluções de descelularização. Clique aqui para baixar esta Tabela.
Tabela 2: Protocolo de descelularização. Detalhes do protocolo para descelularizar fatias pulmonares. Clique aqui para baixar esta Tabela.
Tabela 3: Mídia cultural. Detalhes de preparação para mídia de crescimento endotelial e AEC2. Clique aqui para baixar esta Tabela.
Tabela 4: Anticorpos usados para imunossuagem. Detalhes de anticorpos e suas concentrações usadas para imunossuagem. Clique aqui para baixar esta Tabela.
Arquivo complementar 1: Projeto para estruturas de fita de cultura de corte a laser. Clique aqui para baixar este Arquivo.
Arquivo complementar 2: Projeto para clipes de fita de cultura de tecido de corte a laser. Clique aqui para baixar este Arquivo.
Arquivo complementar 3: Projeto para abas de de cultura de tecido de corte a laser. Clique aqui para baixar este Arquivo.
Arquivo complementar 4: Arquivo CAD para semeadura base de molde de banho. Clique aqui para baixar este Arquivo.
Arquivo complementar 5: Arquivo CAD para semeadura de anel de mofo de banho. Clique aqui para baixar este Arquivo.
Discussão
Este artigo descreve o uso de fatias pulmonares descelularizadas cortadas com precisão como uma plataforma para gerar tecidos pulmonares projetados in vitro, que contêm estruturas alveolares de várias linhagens. Ao combinar estratégias que desenvolvemos anteriormente para repovoar andaimes pulmonares Acellulares ECM de alta fidelidade para toda a engenharia pulmonar22,31, com nosso sistema robusto para cultivar tecidos cardíacos projetados em pequena escala30, este protocolo permite o uso de ECM pulmonar fisiologicamente relevante como um substrato de cultura tecidual, de forma repetível e moderadamente de rendimento.
Os métodos aqui apresentados detalham a preparação do andaime ELT de pulmões de ratos, que são facilmente alcançáveis, podem ser extraídos em bloco com acesso direto às vias aéreas intactas para a inflação de ágarose, e são de tamanho maior do que o pulmão do rato. No entanto, qualquer tecido pulmonar que possa ser inflado com agarose e produzir fatias de pelo menos 9 mm de comprimento pode ser usado dentro deste sistema. Independentemente da fonte de tecido, a inflação uniforme do tecido pulmonar com agarose é o passo mais crítico para garantir o sucesso do corte de tecido a jusante, recorte e manuseio de tecidos. O tecido pulmonar subinflado tende a não cortar limpo, enquanto o tecido superinflado pode rasgar durante o recorte. Após a gelação de agarose, regiões de tecido apropriadamente infladas são firmes, mas fornecem um pouco de dar quando suavemente pressionadas com fórceps. Para pulmões de ratos intactos, descobrimos que pré-inflar os pulmões extraídos com ar várias vezes, seguido pela inflação de agarose o mais rápido possível após a extração, resulta nos melhores resultados de corte e melhor qualidade dos andaimes de tecido resultantes. O volume adequado de agarose precisa ser otimizado empiricamente; para um pulmão de rato o volume necessário para inflar o pulmão para a capacidade pulmonar total é de aproximadamente 30 mL/kg de massa animal (por exemplo, 10,5 mL agarose para pulmões de um rato de 350 g). Para tecidos pulmonares ressecados maiores com acesso menos simples das vias aéreas (como os de doadores humanos), alguns problemas adicionais podem ser necessários para inflar o tecido através de um brônquio32. Durante o corte pulmonar subsequente, a seleção e orientação do tecido no êmbolo é outro passo importante para 1) garantir que as fatias sejam grandes o suficiente para gerar tiras de tecido que podem ser cortadas em de cultura tecidual e 2) maximizar a área de tecido parenchímal (alveolar), excluindo grandes vias aéreas ou vasos.
Cortar o PCLS em fitas de cultura tecidual pode ser um passo desafiador inicialmente, mas as fitas simplificam muito o manuseio de tecidos durante a descelularização e semeadura. Dois problemas potenciais que podem surgir são a ruptura tecidual (seja durante o processo de corte, ou durante a descelularização), ou o posicionamento tecidual nos clipes que resulta em má semeadura a jusante (por exemplo, sem semeadura ou semeadura apenas nas extremidades). Rasgar pode ser o resultado da superinflação agarose, alongamento excessivo do tecido durante a inserção da guia, ou deixar muito pouca saliência para fornecer aderência adequada do tecido ao inserir as abas. Note que fatias que rasgam em uma extremidade de clipe podem ser semeadas com sucesso, no entanto, elas são difíceis de visualizar sob o microscópio durante a cultura, pois o tecido não é plano. A semeadura de tecido ruim (como a da Figura 6C) é provavelmente o resultado da fatia não deitada plana entre os dois clipes, e assim fazendo contato ruim com a base do banho de semeadura bem quando virado de cabeça para baixo. Outra possível causa é o assento inadequado do no fundo do banho de semeadura. Em termos de recorte, aplique um pouco mais de tensão no tecido ao colocar o segundo clipe para ajudá-lo a ficar liso. Algumas fatias têm uma leve concavidade; nestes casos, corte a fatia com o lado convexo para cima. Com a prática, normalmente experimentamos semeaduras com menos de 2% de fatias.
Uma limitação deste protocolo é a exigência de que alguns equipamentos especializados - um cortador a laser e uma impressora 3D - gerem os materiais iniciais para a preparação do ELT. No entanto, uma vez que as fitas de cultura tecidual e banhos de semeadura são criados, nenhum material especial adicional é necessário. As etapas de corte e descelularização pulmonar da preparação do andaime ELT são moderadamente demoradas; no entanto, essas etapas podem ser realizadas com antecedência, ou em números suficientes para se preparar para múltiplos experimentos ao mesmo tempo. Muitos PCLS (>100 se otimizando para regiões parenchymal) podem ser cortados de um único pulmão e congelados por snap para uso posterior. Embora um único ciclo de congelamento possa causar pequenos danos ultraestruturais ao ECM46, mesmo vários ciclos de congelamento foram demonstrados para não causar uma perda significativa no ECM 23,47. O PCLS também pode ser cortado e descelularizado antes de um experimento, a ser usado dentro de um mês. (Notavelmente, o protocolo de descelularização descrito pode ser realizado em aproximadamente 6 horas, o que representa uma vantagem significativa em relação aos métodos descritos anteriormente que requerem um dia ou maisde 27,28.) Uma vez que os andaimes são preparados, o processo de semeadura celular é simples e rápido, e a cultura dos ELTs não requer técnicas especializadas.
Uma ressalva do método ELT descrito é a falta de semeadura específica da região, ou seja, a entrega de AEC2s especificamente ao espaço alveolar, ou células endoteliais especificamente ao espaço vascular. No entanto, embora as células sejam simplesmente semeadas em cima dos andaimes de tecido, o padrão de recelularização não é aleatório, com alguma aparência de organização alveolar, incluindo anéis epiteliais. Suspeitamos que as interações célula-célula, bem como diferenças locais na composição e geometria do ECM20,21, provavelmente contribuem para os padrões de recelularização observados. Em apoio a essa hipótese, um estudo publicado anteriormente, no qual os fibroblastos foram semeados não especificamente em fatias pulmonares descelularizadas, demonstrou que o padrão de repopulação tecidual e fenótipos celulares associados variaram significativamente por região de tecido microscópico e fonte de andaime ECM (por exemplo, saudável versus doente)27. Também foram observados fibroblastos para invadir o interstício - local onde residem no tecido pulmonar nativo 1,27. O método alternativo primário que podemos imaginar para cultivar células em fatias pulmonares de uma maneira verdadeiramente específica da região implicaria semear pulmões intactos descelularizados através das vias aéreas31,48 e compartimentos vasculares 49,50, e, em seguida, cortar o tecido recelularizado. No entanto, essa alternativa 1) é significativamente mais econômica, de tempo e de recursos; 2) é menor rendimento; 3) requer aumento do número de animais; e 4) está associada a um risco aumentado de contaminação devido aos desafios de toda a cultura pulmonar e posterior fatiamento do pulmão semeado. Embora não recapitulando todos os aspectos da organização celular nativa, a plataforma ELT permite a cultura das células pulmonares em um substrato ECM fisiologicamente relevante, de uma maneira acessível a muitos outros laboratórios.
A flexibilidade do sistema ELT é uma grande vantagem desta plataforma, e deve permitir a cultura de tecido pulmonar em pequena escala com qualquer número de andaimes de tecido, células ou meios de cultura de interesse. O uso de andaimes derivados de tecido doente ou de modelos de lesões pode permitir o estudo de interações célula-célula ou matriz celular no cenário de ECM alterado pela doença 27,29,51. No entanto, note que o protocolo de descelularização pode precisar ser adaptado para explicar as diferenças matricial entre as espécies52. A estratégia de semeadura descrita pode ser usada para qualquer tipo de célula, e a linha do tempo da cultura adaptada para atender às necessidades do pesquisador. Como ponto de partida, 1 x 106 células por andaime devem produzir um tecido altamente celular dentro de 7 dias de cultura, enquanto 1 x 105 células totais resultam em má celularidade. Em qualquer adaptação da linha do tempo, as fitas de cultura tecidual devem ser removidas do banho de semeadura 24 h após a última semeadura tecidual. Aqui, com o objetivo de modelar um pouco da complexidade celular do alvéolo pulmonar, descrevemos uma estratégia de recelularização tricultura que apoia a manutenção de AEC2s neonatais bem diferenciados em estruturas alveolares por pelo menos 7 dias. Nossos resultados também demonstram o enxerto bem-sucedido tanto de fibroblastos quanto de células endoteliais dentro dos ELTs, enfatizando a ampla aplicabilidade do substrato cultural e sua adequação para estudos de cocultura. A semeadura de células adultas em ELTs pode facilitar a modelagem de estruturas alveolares mais quiescentes, enquanto a semeadura de AEC2s derivadas de PSC humanos, incluindo aquelas com modificações genéticas, poderia facilitar estudos translacionais da doença humana13,53. Em geral, a abordagem de baixo para cima habilitada pela plataforma ELT apresenta a oportunidade de investigar as contribuições de determinados tipos de células para leituras de interesse - como o estado de proliferação ou diferenciação do AEC2.
Em resumo, este protocolo descreve um sistema robusto para a geração de tecidos pulmonares projetados para estudos de co-cultura de AEC2s, fibroblastos e células endoteliais dentro de andaimes de fatia pulmonar Acellular ECM. Os ELTs representam uma nova estratégia de cultura 3D para AEC2s primários, que até hoje dependem de matrizes menos fisiológicas do tipo gel para manter um fenótipo bem diferenciado 6,11,12. A plataforma atual baseia-se em trabalhos anteriores na repopulação de fatias pulmonares descelularizadas 24,25,26,27,28,29, mas oferece várias vantagens: 1) um sistema de de cultura tecidual para facilitar o manuseio de ELT durante a descelularização, semeadura e cultura; 2) um banho de semeadura personalizado para semear precisamente um número conhecido de células em cada andaime de fatia; e 3) uma estratégia de ressedação de três culturas que permite a repopulação do tecido alveolar com células epiteliais, mesenquimais e endoteliais. Assim, os ELTs representam um importante passo em frente para a criação de modelos in vitro reprodutíveis que capturam a complexidade celular e substrato do alvéolo nativo e do nicho de células-tronco AEC2.
Divulgações
L.E.N. é um fundador e acionista da Humacyte, Inc, que é uma empresa de medicina regenerativa. Humacyte produz vasos sanguíneos projetados a partir de células musculares aogenéticas lisas para cirurgia vascular. O cônjuge de L.E.N. tem equidade em Humacyte, e L.E.N. atua no Conselho de Administração da Humacyte. L.E.N. é uma inventora de patentes licenciadas para Humacyte e que produzem royalties para L.E.N. L.E.N. recebeu um presente de pesquisa irrestrito para apoiar a pesquisa em seu laboratório em Yale. Humacyte não influenciou a conduta, descrição ou interpretação dos achados deste relatório.
Agradecimentos
Os autores gostariam de agradecer a Lorenzo Sewanan e Jorge Nunez por seu trabalho desenvolvendo o projeto de fita de cultura tecidual usado neste protocolo, o laboratório Kaminski para o uso de seu vibratome, Maurizio Chioccioli e Jessica Nouws por assistência com o corte pulmonar, Allie LaRocco para assistência com experimentos piloto iniciais, e Hong Qian para leitura cuidadosa do protocolo. Este trabalho foi apoiado pelas bolsas NIH F30HL143880 (K.L.L.), o Programa de Treinamento de Cientistas Médicos Grant T32GM136651 (K.L.L.) e U01HL145567 (L.E.N.); e por um presente de pesquisa irrestrito da Humacyte Inc. (L.E.N.).
Materiais
| Name | Company | Catalog Number | Comments |
| 3D Printer: Form 2 | Formlabs | ||
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | |
| 8-Bromo cAMP | Sigma | B7880 | |
| Agarose, UltraPure LMP | Invitrogen | 15517-014 | |
| Amphotericin B | Sigma | A2942 | |
| Barbed reducer fitting, 3/8 inch x 1/4 inch | McMaster-Carr | 5121K271 | |
| Benzonase nuclease | Sigma | E1014 | |
| Bovine serum albumin (BSA) Fraction V | Gemini | 700-104P | For AEC2 growth medium |
| Bovine serum albumin (BSA), standard grade | Gemini | 700-100P | For benzonase buffer |
| Check valve, polypropylene, 1/8 inch hose barb | Cole-Parmer | SK-98553-10 | |
| CHIR99021 | PeproTech | 2520691 | |
| Clear Resin, 1 L | Formlabs | RS-F2-GPCL-04 | |
| Cyanoacrylate glue, such as Krazy Maximum Bond Permanent Glue | Any hardware, craft, or drug store | KG483 or similar | |
| Dexamethasone | Sigma | D4902 | |
| DMEM (low glucose) | Gibco | 11885-084 | |
| DMEM (high glucose) | Gibco | 11965-092 | |
| DNA assay (Quant-iT PicoGreen dsDNA Assay Kit) | Invitrogen | P7589 | |
| EDTA, 0.5 M, pH 8.0 | AmericanBio | AB00502-01000 | |
| EdU kit (Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647) | Invitrogen | C10340 | Used according to manufacturer's directions |
| Elbow fitting, 3/8 inch | McMaster-Carr | 5121K907 | |
| F12 | Gibco | 11765-054 | |
| Fetal bovine serum (FBS), characterized | Hyclone | SH30071.03 | |
| Gentamicin sulfate | Gemini | 400-100P | Reconstituted in diH2O for a stock solution at 50 mg/mL |
| Hair clippers | Wahl | MiniArco | |
| Hank's balanced salt solution (HBSS), Phenol Red Free | Gibco | 14175-095 | |
| Heparin sodium injection, USP, 1000 U/mL | Sagent | NDC: 25021-400-30 | For intraperitoneal and intracardiac injection |
| Heparin sodium salt | Sigma | H4784 | For pulmonary artery perfusion; prepare stock solution at 100 U/mL in PBS |
| HEPES Buffer | Corning | 25-060-Cl | |
| Inline tee fitting, 3/8 inch x 1/8 inch | McMaster-Carr | 5121K851 | |
| Inoculating loop, disposable | Fisherbrand | 22-363-600 | |
| Insulin from bovine pancreas | Sigma | I6634 | |
| Ketamine injection, 100 mg/mL | Covetrus (Butler Animal Health) | 010177 | |
| KGF, recombinant human | PeproTech | 100-19 | |
| Laser cutter, VLS 3.50 30 watt | Universal Laser Systems | ||
| L-glutamine | Gibco | 25030-081 | |
| Luer-lock, female, 3/32 inch | Cole-Parmer | 45508-02 | |
| Luer-lock, male, 1/8 inch | Cole-Parmer | 30800-24 | |
| Luer-lock, male, 1/4 inch | McMaster-Carr | 51525K146 | |
| MCDB-131 Complete without serum | VEC Technologies | MCDB-131 WOFBS | |
| Magnesium chloride (MgCl2), 1 M | AmericanBio | AB09006-00100 | |
| NaCl | American Bioananalytical | AB01915 | |
| Phosphate buffered saline (PBS), without Ca2+ and Mg2+, 10X | Sigma | D1408 | Reconstitute to 1X with diH2O |
| Phosphate buffered saline (PBS), with Ca2+ and Mg2+ | Gibco | 21300-058 | |
| PDMS - SYLGARD 184 Silicone Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Penicillin/Streptomycin (10,000 U/mL penicillin/10,000 μg/mL streptomycin) | Gibco | 15140-122 | |
| Petri dish, 150 mm | Falcon | 351058 | |
| Plastic film (parafilm) | Bemis | PM-996 | |
| Pharmed BPT tubing, LS 16 | Masterflex | 06508-16 | |
| Pharmed BPT tubing, LS 17 | Masterflex | 06508-17 | |
| Platinum-cured silicone tubing, LS 14 | Masterflex | 96420-14 | |
| Platinum-cured silicone tubing, LS 16 | Masterflex | 96420-16 | |
| Platinum-cured silicone tubing, LS 36 | Masterflex | 96410-36 | |
| Poloxamer 407 (Pluronic F-127) | Sigma | P2443 | |
| Povidone/iodine prep pads, 10% | Dynarex Corporation | 1108 | |
| PTFE sheet, 0.060 inch (1/16 inch) thick | ePlastics | PTFENAT0.060X12X12 | For tissue culture cassette tabs |
| PTFE sheet, 0.093 inch (3/32 inch) thick | ePlastics | PTFENAT0.093X12X12 | For tissue culture cassette frames and clips |
| Peristaltic pump drive: Masterflex L/S Variable-Speed Digital Drive | Cole-Parmer | ZM-07528-30 | |
| Peristaltic pump head: Masterflex L/S Easy-Load II Pump Head | Cole-Parmer | EW-77202-60 | |
| Rat, Sprague Dawley | Charles River | Strain Code: 400 | |
| Razor blade | Any hardware or craft store | Personna 94-120-71 or similar | |
| Retinoic acid | Sigma | R2625 | |
| Rotary blades, 28 mm | Omnigrid | 2046 | |
| Rotary cutter, 28 mm | Olfa | Model 9551 | |
| Sodium deoxycholate (SDC) | Sigma | D6750 | |
| Sodium nitrorusside (SNP) | Sigma | 71778 | |
| Stopcock, 4-way | Edwards | 594WSC | |
| Suture, 4-0 monofilament polypropylene | Covidien | VP-557-X | |
| Syringe, 10 mL | BD | 302995 | |
| Syringe, 50 mL | BD | 309653 | |
| Tissue culture dish, 35 mm | Falcon | 353001 | |
| Tissue culture dish, 100 mm | Corning | 430167 | |
| Tissue culture plate, 6-well | Falcon | 353046 | |
| Tissue culture plate 12-well | Falcon | 353043 | |
| Transferrin human | Sigma | T8158 | |
| Tris, 1 M solution, pH 8.0 | AmericanBio | AB14043-01000 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| Vibratome, Compresstome VF-300-0Z | Precisionary Instruments LLC | ||
| Xylazine, 100 mg/mL | Henry Schein | NDC: 11695-4022-1 | |
| Y-connector, 1/16 inch barbed | Cole-Parmer | 30614-43 |
Referências
- Burri, P. H. Morphology and respiratory function of the alveolar unit. International Archives of Allergy and Applied Immunology. 76, Suppl 1 2-12 (1985).
- Barkauskas, C. E., Noble, P. W. Cellular Mechanisms of Tissue Fibrosis. 7. New insights into the cellular mechanisms of pulmonary fibrosis. American Journal of Physiology. Cell Physiology. 306 (11), 987-996 (2014).
- Taylor, M. S., et al. A Conserved Distal Lung Regenerative Pathway in Acute Lung Injury. American Journal of Pathology. 188 (5), 1149-1160 (2018).
- Carsana, L., et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infectious Diseases. 20 (10), 1135-1140 (2020).
- Basil, M. C., et al. The Cellular and Physiological Basis for Lung Repair and Regeneration: Past, Present, and Future. Cell Stem Cell. 26 (4), 482-502 (2020).
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Desai, T. J., Brownfield, D. G., Krasnow, M. A. Alveolar progenitor and stem cells in lung development, renewal and cancer. Nature. 507 (7491), 190-194 (2014).
- Evans, M. J., Cabral, L. J., Stephens, R. J., Freeman, G. Renewal of alveolar epithelium in the rat following exposure to NO2. The American Journal of Pathology. 70 (2), 1-24 (1973).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Borok, Z., et al. Keratinocyte growth factor modulates alveolar epithelial cell phenotype in vitro: expression of aquaporin 5. American Journal of Respiratory Cell and Molecular Biology. 18 (4), 554-561 (1998).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Sucre, J. M. S., et al. Successful establishment of primary Type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Stem Cell. 21 (4), 472-488 (2017).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nature Methods. 14 (11), 1097-1106 (2017).
- Chen, Y. W., et al. A three-dimensional model of human lung development and disease from pluripotent stem cells. Nature Cell Biology. 19 (5), 542-549 (2017).
- Korogi, Y., et al. In vitro disease modeling of hermansky-pudlak syndrome Type 2 using human induced pluripotent stem cell-derived alveolar organoids. Stem Cell Reports. 12 (3), 431-440 (2019).
- Strikoudis, A., et al. Modeling of fibrotic lung disease using 3D organoids derived from human pluripotent stem cells. Cell Reports. 27 (12), 3709-3723 (2019).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Chapman, H. A. Epithelial responses to lung injury: Role of the extracellular matrix. Proceedings of the American Thoracic Society. 9 (3), 89-95 (2012).
- Guilak, F., et al. Control of stem cell fate by physical interactions with the extracellular matrix. Cell Stem Cell. 5 (1), 17-26 (2009).
- Zhou, Y., et al. Extracellular matrix in lung development, homeostasis and disease. Matrix Biology. 73, 77-104 (2018).
- Calle, E. A., et al. Targeted proteomics effectively quantifies differences between native lung and detergent-decellularized lung extracellular matrices. Acta Biomaterialia. 46, 91-100 (2016).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Bonvillain, R. W., et al. A nonhuman primate model of lung regeneration: Detergent-mediated decellularization and initial in vitro recellularization with mesenchymal stem cells. Tissue Engineering Part A. 18 (23-24), 2437-2452 (2012).
- O'Neill, J. D., et al. Decellularization of human and porcine lung tissues for pulmonary tissue engineering. The Annals of Thoracic Surgery. 96 (3), 1055(2013).
- Wagner, D. E., et al. Three-dimensional scaffolds of acellular human and porcine lungs for high throughput studies of lung disease and regeneration. Biomaterials. 35 (9), 2664-2679 (2014).
- Burgstaller, G., et al. Distinct niches within the extracellular matrix dictate fibroblast function in (cell free) 3D lung tissue cultures. American Journal of Physiology-Lung Cellular and Molecular Physiology. 314 (5), 708-723 (2018).
- Sun, H., et al. Fibroblast engraftment in the decellularized mouse lung occurs via a β1-integrin-dependent, FAK-dependent pathway that is mediated by ERK and opposed by AKT. American Journal of Physiology-Lung Cellular and Molecular Physiology. 306 (6), 463-475 (2014).
- Booth, A. J., et al. Acellular normal and fibrotic human lung matrices as a culture system for in vitro investigation. American Journal of Respiratory and Critical Care Medicine. 186 (9), 866-876 (2012).
- Schwan, J., et al. Anisotropic engineered heart tissue made from laser-cut decellularized myocardium. Scientific Reports. 6, 32068(2016).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Gerckens, M., et al. Generation of Human 3D Lung Tissue Cultures (3D-LTCs) for Disease Modeling. Journal of Visualized Experiments. (144), (2019).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465(2017).
- Neuhaus, V., et al. Assessment of the cytotoxic and immunomodulatory effects of substances in human precision-cut lung slices. Journal of Visualized Experiments. (135), e57042(2018).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (6), 1315-1321 (2002).
- Vaccaro, C., Brody, J. S. Ultrastructure of developing alveoli. I. The role of the interstitial fibroblast. The Anatomical Record. 192 (4), 467-479 (1978).
- Calle, E. A., et al. Fate of distal lung epithelium cultured in a decellularized lung extracellular matrix. Tissue Engineering Part A. 21 (11-12), 1916-1928 (2015).
- Dobbs, L. G., Gonzalez, R., Williams, M. C. An improved method for isolating type II cells in high yield and purity. American Review of Respiratory Disease. 134 (1), 141-145 (1986).
- Dobbs, L. G. Isolation and culture of alveolar type II cells. American Journal of Physiology. 258, 134-147 (1990).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Dobbs, L. G., Pian, M. S., Maglio, M., Dumars, S., Allen, L. Maintenance of the differentiated type II cell phenotype by culture with an apical air surface. The American Journal of Physiology. 273 (2), 347-354 (1997).
- Bruce, M. C., Honaker, C. E. Transcriptional regulation of tropoelastin expression in rat lung fibroblasts: changes with age and hyperoxia. American Journal of Physiology. 274 (6), 940-950 (1998).
- Berk, J. L., Franzblau, C., Goldstein, R. H. Recombinant interleukin-1 beta inhibits elastin formation by a neonatal rat lung fibroblast subtype. Journal of Biological Chemistry. 266 (5), 3192-3197 (1991).
- Schultz, C. J., Torres, E., Londos, C., Torday, J. S. Role of adipocyte differentiation-related protein in surfactant phospholipid synthesis by type II cells. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (2), 288-296 (2002).
- Maksvytis, H. J., et al. In vitro characteristics of the lipid-filled interstitial cell associated with postnatal lung growth: evidence for fibroblast heterogeneity. Journal of Cellular Physiology. 118, 113-123 (1984).
- Hopkinson, A., et al. Optimization of amniotic membrane (AM) denuding for tissue engineering. Tissue Engineering Part C: Methods. 14 (4), 371-381 (2008).
- Fernandez-Perez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Scientific Reports. 9 (1), 14933(2019).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nature medicine. 16 (8), 927-933 (2010).
- Le, A. V., et al. Efficient and Functional Endothelial Repopulation of Whole Lung Organ Scaffolds. ACS Biomaterials Science & Engineering. 3 (9), 2000-2010 (2017).
- Ren, X., et al. Engineering pulmonary vasculature in decellularized rat and human lungs. Nature Biotechnology. 33 (10), 1097-1102 (2015).
- Wagner, D. E., et al. Comparative decellularization and recellularization of normal versus emphysematous human lungs. Biomaterials. 35 (10), 3281-3297 (2014).
- Balestrini, J. L., et al. Comparative biology of decellularized lung matrix: Implications of species mismatch in regenerative medicine. Biomaterials. 102, 220-230 (2016).
- Alysandratos, K. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636(2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados