Method Article
Desellülerize Akciğer Dilimlerinden Hazırlanan Mühendislik Akciğer Dokuları
Bu Makalede
Özet
Bu protokol, desellülarize hassas kesilmiş akciğer dilimlerini alveoler epitel tip 2 hücreleri, fibroblastlar ve endotel hücreleri ile yeniden doldurarak tekrarlanabilir, küçük ölçekli mühendislik ürünü akciğer dokuları oluşturmak için bir yöntemi açıklar.
Özet
Doğal akciğer alveolus ex vivo'nun mimari ve hücresel karmaşıklığını özetleyen geliştirilmiş 3 boyutlu (3D) akciğer modellerine ihtiyaç vardır. Son zamanlarda geliştirilen organoid modeller, akciğer epitel progenitörlerinin in vitro olarak genişlemesini ve incelenmesini kolaylaştırmıştır, ancak bu platformlar tipik olarak fare tümöründen türetilmiş matris ve / veya seruma dayanır ve sadece bir veya iki hücresel soyu içerir. Burada, desellülarize hassas kesimli akciğer dilimlerinin (PCLS) çok soylu resellülarizasyonuna dayanan mühendislik ürünü akciğer dokuları (ELT'ler) üretmek için bir protokol açıklanmaktadır. ELT'ler, doğal akciğerinkine çok benzeyen hücre dışı matriks (ECM) substratı içinde alveoler epitel, mezenkim ve endotelden oluşan alveolar benzeri yapılar içerir. Dokuları oluşturmak için, sıçan akciğerleri agaroz ile şişirilir, 450 μm kalınlığında dilimler halinde dilimlenir, şeritler halinde kesilir ve hücresellikten arındırılır. Elde edilen asellüler ECM iskeleleri daha sonra primer endotel hücreleri, fibroblastlar ve alveoler epitel tip 2 hücreleri (AEC2'ler) ile yeniden tohumlanır. AEC2'ler ELT kültüründe serumsuz, kimyasal olarak tanımlanmış bir büyüme ortamı ile en az 7 gün muhafaza edilebilir. Doku hazırlama ve kültür süreci boyunca, dilimler paralel olarak birden fazla ELT'nin işlenmesini ve standartlaştırılmış hücre tohumlamasını kolaylaştıran bir kaset sistemine kırpılır. Bu ELT'ler, alveol içindeki hücre-hücre ve hücre-matris etkileşimlerinin yanı sıra AEC2'leri ve nişlerini düzenleyen biyokimyasal sinyallerin araştırılmasını kolaylaştırması gereken organotipik bir kültür platformunu temsil eder.
Giriş
Alveoller, distal akciğerin fonksiyonel birimleridir ve alveoler epitel tip 1 hücreleri (AEC1'ler) ve tip 2 hücreleri (AEC2'ler) ile kaplı gaz alışverişi yapan hava sahalarının bir örgüsünü içerir. Epitelin altında yoğun bir kılcal damar ağı ve mezenkimi destekler, hepsi bu hassas hava keseciklerine hem güç hem de esneklik sağlayan hücre dışı bir matris (ECM) iskelesi ile desteklenir1. Alveoller ayrıca idiyopatik pulmoner fibroz2, akut solunum sıkıntısı sendromu3 ve şiddetli koronavirüs hastalığı-19 (COVID-19)4 dahil olmak üzere birçok akciğer patolojisinde yaralanma yeridir. Son on yıldaki çalışmalar akciğer epitelinde dikkate değer bir plastisite ortaya çıkarmış olsa da, bazı ortamlarda distal akciğer onarımını sağlayan - ve diğerlerinde onarımı engelleyen - mekanizmalar yoğun bir araştırma alanı olmaya devam etmektedir5. Alveolusu modellemek için geliştirilmiş in vitro platformların geliştirilmesi, alveolar biyoloji, rejenerasyon ve terapötiklerin çalışmalarını kolaylaştıracaktır.
AEC2'ler kendiliğinden yenilenir ve AEC1'lere farklılaşır ve böylece distal akciğerin birincil kök hücresi olarak kabul edilir 6,7,8. Bununla birlikte, bu hücreler, fenotip9 kaybı olmadan primer AEC2'lerin kültürlenmesiyle ilgili zorluklar göz önüne alındığında, in vitro çalışmaya özel bir zorluk teşkil etmektedir. Geleneksel 2 boyutlu (2D) kültürde, AEC2'ler düzleşir ve AEC1 benzeri hücrelerin bazı özelliklerini benimser10. Buna karşılık, 3D kültür stratejileri, en yaygın organoidler, birincil AEC2s6,11,12'deki farklılaşmış özelliklerin korunmasını destekler ve pluripotent kök hücre (PSC) kaynaklı AEC2s 13,14'ün uzun vadelikültürüne izin verir. Organoidler, distal akciğer gelişimi 15, viral enfeksiyon11,15 ve AEC2 ile ilişkili genetik hastalık13,16,17'yi modellemek için kullanılmış ve AEC2 biyolojisi ve rejenerasyonu hakkında önemli bilgiler sağlamıştır. Bununla birlikte, bu kültür modelleri tipik olarak sadece bir veya iki hücresel soydan oluşur ve hücreleri, doğal akciğer alveolusunun mimarisini veya ECM substratını özetleyemeyen jel tipi matrislere gömer.
ECM, moleküler, topolojik ve mekanik ipuçları yoluyla hücre fenotipinin ve davranışının kritik bir düzenleyicisidir; kök hücre kaderini düzenleyen dokuya özgü nişlerin önemli bir bileşenini içerir; ve yerel olarak salgılanan büyüme faktörlerinin kullanılabilirliğini modüle eden bir rezervuar görevi görür 18,19,20,21. Doğal ECM üzerindeki hücrelerin kültürlenmesi, in vivo dokuların biyolojisini modellemek için in vitro sistemlerin prediktif kapasitesini artırabilir. Hücresel materyali deterjanlar, enzimler veya fiziksel veya diğer yöntemlerle dokulardan uzaklaştıran bir işlem olan desellülarizasyon, dikkatli bir şekilde gerçekleştirildiğinde doğal bir organın ECM iskelesini büyük ölçüde koruyabilir22,23. Bu tür iskeleler 3D biyomimetik kültür için hücrelerle yeniden doldurulabilir. Bununla birlikte, desellülarize iskeleler doku mühendisliği uygulamaları için yaygın olarak kullanılırken, rutin hücre kültürü için kullanımları sınırlı kalmıştır. Daha önce yapılan birkaç çalışmada, akciğer dilimlerinin veya küçük akciğer dokusu segmentlerinin desellülarizasyonu ve resellülarizasyonu bildirilmiştir. Kavram kanıtı çalışmaları 24,25,26'ya ek olarak, fibroblast-matriks adezyonu 27,28'i incelemek ve hastalıklı akciğer matrislerinin fibroblast fenotip 27,29 üzerindeki etkisini araştırmak için yeniden doldurulmuş akciğer dilimleri kullanılmıştır. Hassas kesilmiş doku dilimleri oluşturmak için mevcut gelişmiş teknolojilerle, desellülarize akciğer dilimleri, alveolar, hava yolu ve vasküler alt yapıları korurken, hücreleri kültürlemek için uygun ve küçük ölçekli bir platform sunabilir. Birden fazla hücre tipinin dahil edilmesi, fizyolojik olarak ilgili bir 3D ortamda hücre-hücre etkileşimlerinin incelenmesini sağlayacaktır. Bununla birlikte, kültür süreci boyunca dokuların işlenmesini kolaylaştırmak ve bilinen sayıda hücreye sahip dokuların kontrollü ve tekrarlanabilir tohumlanmasını sağlamak için geliştirilmiş stratejilere ihtiyaç vardır.
Burada, desellülarize hassas kesimli akciğer dilimlerini (PCLS) primer endotel hücreleri, AEC2'ler ve fibroblastlarla yeniden doldurarak mühendislik akciğer dokuları (ELT'ler) oluşturmak için bir protokol sunuyoruz. Daha önce tarif edilen mühendislik ürünü kalp dokusu sistemi30 ve tüm akciğer desellülarizasyon-resellülarizasyon stratejilerimiz 22,31'in bir uyarlamasında, PCLS'yi sıçan akciğerlerinden kesmek ve dilimleri aşağı akış manipülasyonlarını basitleştiren ve standartlaştıran yeniden kullanılabilir doku kültürü kasetlerine kırpmak için prosedürleri açıklıyoruz. Kırpılmış dilimler, özelleştirilmiş tohumlama banyolarında yeniden doldurulan asellüler ECM iskeleleri oluşturmak için hücresellikten arındırılır. Akciğer dilim iskeleleri, kritik ECM bileşenlerini ve mimarisini korur ve AEC2'lerin çok soylu alveolar benzeri yapılar içinde büyümesini en az 7 gün boyunca destekler. ELT'ler, fizyolojik olarak ilgili bir 3D matris içinde, akciğer dokusu mühendisliği stratejilerinin gelişimini desteklemesi gereken ve AEC2'lerin ve alveollerin temel biyolojik çalışmalarını kolaylaştıran yeni bir alveolar ko-kültür sistemini temsil eder.
Protokol
Bu makalede açıklanan tüm hayvan deney prosedürleri Yale Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır.
1. Doku Kültürü Kasetlerinin ve Tohumlama Banyolarının Oluşturulması
NOT: Bir kez yapıldıktan sonra, doku kültürü kasetleri ve tohumlama banyoları otoklavlanabilir ve tekrarlanan ELT kültürü turları için tekrar kullanılabilir.
-
Doku Kültürü Kasetleri
- Doku kültürü kaset çerçevelerini ve klipslerini sırasıyla Ek Dosya 1 ve Ek Dosya 2'de sağlanan tasarımlara göre 3/32 inç kalınlığındaki politetrafloroetilenden (PTFE) kesmek için bir lazer kesici kullanın. Ek Dosya 3'e göre doku kültürü kaset tırnaklarını 1/16 inç kalınlığındaki PTFE'den kesmek için bir lazer kesici kullanın. Cut, %80 güç ve %15 hız (30 W lazer kesici için) kullanarak 3 katın ana hatlarını çizer.
-
Tohumlama Banyoları
- Tohumlama banyosu CAD dosyalarını (Ek Dosya 4 ve Ek Dosya 5) kullanarak, sırasıyla tohumlama banyosu kalıbının tabanını ve halkasını 3D yazdırmak için kullanın.
- PDMS salınımına yardımcı olmak için kullanmadan önce kalıpları% 10'luk bir poloksamer 407 çözeltisine batırın. Havanın kurumasını bekleyin, ardından halkayı kalıbın tabanına takın ve sızıntıyı önlemeye yardımcı olmak için esnek plastik filme sarın.
- PDMS elastomerini kürleme maddesi ile 10: 1 oranında karıştırarak polidimetilsiloksan (PDMS) kalıbı başına en az 60 g hazırlayın ve 3D baskılı kalıba dökün. Hava kabarcıklarını gidermek için PDMS'yi vakumlu bir kurutucuda 30 dakika boyunca gazdan arındırın.
- Tohumlama banyolarını 60 °C'de 8 saat pişirin.
2. Sıçan Akciğerlerinden Hassas Kesimli Akciğer Dilimlerinin Hazırlanması
- Organ Toplama
- Şekil 1'de gösterildiği gibi yerçekimi ve pompa tahrikli uzuvlardan oluşan bölünmüş bir perfüzyon sistemi hazırlayın. Tüpün ucuna, 1/2 inç uzunluğundaki LS 14 silikon boruya bağlı 1/16 inç dikenli Y konektörü ve 3/32 inç dişi luer-lock konektöründen oluşan bir pulmoner arter (PA) kanülü bağlayın (bkz. Şekil 1). Şu anda kanüle çekvalf takmayın.
- PBS ile sırasıyla 100 U/mL heparin ve 0.01 mg/mL sodyum nitroprussid (SNP) içeren hatları antikoagülasyon ve vazodilatasyon için astarlayın. Perfüzyon pompasını 30 mL/dk olarak önceden ayarlayın.
NOT: Heparin çözeltisine taze SNP ekleyin ve ışıktan koruyun. - Anti-koagülasyon için 400 U/kg heparin intraperitoneal (IP) enjeksiyonu ile bir yetişkin (8-12 haftalık, yaklaşık 300-350 g) Sprague-Dawley sıçanı dozlayın, ardından anestezi için ketamin (75 mg / kg) ve ksilazin (5 mg / kg) IP enjeksiyonu. Zararlı uyaranlara yanıt eksikliği (ayak parmağı sıkışması) yoluyla cerrahi anestezi düzlemini onaylayın.
- Saç kesme makineleri kullanarak kürkün göğsünü ve karnını kesin. Ardından% 70 etanol ile püskürtün ve% 10 povidon-iyot ile 3x'i silin.
- Sıçan dişi forseps ile diyafram seviyesinin altındaki cildi kavrayın. Daha sonra ince sivri uçlu makasla ciltte 1/2 inç enine bir kesi yapın. Maruz kalan abdominal fasyayı forsepslerle kavrayın, fasyada 1/2 inçlik bir enine kesi yapın ve ardından insizyonu üst karın genişliği boyunca deri ve fasyadan uzatın.
- Ön diyaframın merkezinde küçük bir kesi (1/8 inçten fazla olmayan) yapmak için ince makasın ucunu kullanın ve akciğerlerin toraksta geri çekilmesine neden olun. Diyaframdaki kesiyi göğsün tam genişliği boyunca uzatın.
- Göğüs kafesinin tam yüksekliğinden boyuna doğru iki dikey kesi yapın, akciğerlere zarar vermemeye dikkat edin. Köprücük kemiğini kesmek için insizyonu sol kaburgalardan ve boynun yan tarafı boyunca gırtlak seviyesine kadar uzatarak trakeayı açığa çıkarın.
- Trakeayı çevreleyen bağ dokusundan ve yemek borusundan arındırın. Trakeanın ön yarısı boyunca, iki kıkırdak halkası arasında, gırtlaklara yakın bir şekilde enine bir kesi yapın. Trakeanın arkasına, insizyon seviyesinin altına 4-0'lık bir polipropilen sütür geçirin ve bir cerrahın düğümünün ilk yarısını iki bükümle gevşek bir şekilde önceden bağlayın.
- Tek yönlü bir çekvalfe bağlı 1/16 inç dikenli Y-bağlayıcı ve 3/32 inç dişi luer-lock konektörlü 1/2 inç uzunluğunda LS 14 silikon borudan oluşan bir kanülü (bkz. Şekil 1) trakeaya, Y konektörünün bir uzvunu akciğerlerin yönüne doğru trakea insizyonuna sokarak yerleştirin.
- Önceden bağlanmış sütür halkasını trakeanın etrafına yerleştirilen kanül seviyesinde konumlandırın ve kanülü yerine sabitlemek için takılan Y konektörünün etrafını sıkın. Düğümü tamamlamak için dikişin iki adet tek bükümlü atışını ekleyin.
- 10 mL'lik bir şırıngayı hava ile doldurun ve trakea kanülünün luer kilidine bağlayın.
- Kavisli bir hemostat kullanarak inferior vena kavayı diyaframa yakın bir şekilde kelepçeleyin, ardından kalbe sağ ventrikül (RV) yoluyla 150 U heparin (1000 U / mL) enjekte edin.
- Adım 2.1.1'de hazırlanan PA kanülünden PBS / heparin / SNP'nin yavaş ama istikrarlı bir şekilde damlamasını sağlamak için yerçekimi hattı durdurma musluğunu kısmen açın.
- 4-0'lık bir polipropilen süürün iğnesini, PA'nın tabanının arkasına, RV'den çıktığı yere geçirin.
- RV'de hemen aşağıda ve ince makas kullanarak PA'ya dik küçük bir kesi (1/8 inçten fazla olmayan) yapın, ardından PA kanül Y-konektörünün bir uzvunu PA'nın tabanına yerleştirin. Dikişi PA'nın ve takılı konektörün etrafına sabitleyin ve cerrahın düğümünü tamamlamak için tek bükümlü bir atış ekleyin.
NOT: PA'nın akış altında toplanması, akciğerlerin yeterli şekilde temizlenmesini engelleyebilecek hava kabarcıklarının vaskülatüre girmesini önler. - PA kateter Y konektörünün diğer ucuna tek yönlü bir kapak takın, ardından sol ventrikülden kan akışının akmasına izin vermek için kalbin tepesini kesin.
NOT: Pompa aracılığıyla perfüzyondan önce kalbin tepesinin kesilmemesi, kan-gaz bariyerine zarar verebilir ve hava sahalarına sıvı sızıntısına neden olabilir. - İki hattı birbirine bağlayan durdurma musluğunu kullanarak perfüzyon hattını pompa tarafına geçirin, ardından pompayı 30 mL/dak'da açın. Akciğerleri PA yoluyla perfüze ederken, akciğerleri kanın temizlenmesini kolaylaştırmak için akciğerleri 10 mL trakea şırıngası aracılığıyla yaklaşık 10-15 nefes / dak'da manuel olarak havalandırın. Akciğerleri çoğunlukla beyaza dönene kadar perfüze edin, genellikle 40 mL PBS / heparin / SNP veya daha azını gerektirir.
NOT: Akciğerlerin yetersiz temizlenmesi, aşağı akış desellülarizasyonunu bozabilir. - Arka trakeayı trakea kanülünün hemen üzerinde kesin ve daha sonra akciğerleri ve kalbi kalan tüm bağ dokusundan arındırın ve akciğerleri ve kalbi blok halinde çıkarın.
- 10 mL'lik bir şırıngayı, 42 ° C'ye kadar önceden ısıtılmış, fenol kırmızısı içermeyen Hank'in dengeli tuz çözeltisinde (HBSS) %2 düşük erime noktalı agarozla doldurun.
NOT: Gerekli agarozun tam hacmi akciğer boyutuna göre değişecektir. Daha büyük akciğerler (yani, 400 g'dan büyük sıçanlardan) 10 mL'den fazla agaroz gerektirecektir. - Çıkarılan akciğerleri, çökmüş parankimin işe alınmasına yardımcı olmak için trakea kanülü aracılığıyla 10 mL hava ile (yani yaklaşık toplam akciğer kapasitesine) 3 kat manuel olarak şişirin.
- Akciğerleri, trakea kanülü yoluyla yaklaşık 40 mL / dak hızında, akciğer loblarının en distal uçları şişirilene kadar manuel olarak enjekte ederek hazırlanan agaroz şırıngası ile derhal şişirin. Akciğerin distal bölgeleri çökmeye devam ederse, ilave 1-2 mL agaroz enjekte edin.
- Beyaz kapağı 4 yönlü bir stopcock'tan trakea kanülünün dişi luer kilidine takarak trakeayı kapatın. Agarozun katılaşmasını sağlamak için akciğeri buz üzerine 150 mm'lik bir Petri kabına yerleştirin.
NOT: Ekstraksiyondan kısa bir süre sonra akciğerin şişmesi, akciğer parankiminin düzgün bir şekilde doldurulmasını ve ardından başarılı doku dilimlemesini sağlamak için kritik öneme sahiptir. Akciğer çok düzensiz şişerse, dilim kalitesi düşük olacağından akciğer dilimlemeye devam etmeyin.
- Akciğer Dilimleme
NOT: Tam dilimleme prosedürünün, kullanılan titreşimli mikrotoma (vibratom) bağlı olarak uyarlanması gerekebilir; Çeşitli doku dilimleyicilerle PCLS preparasyonunun ek örnekleri daha önce yayınlanmıştır32,33,34.- Metal soğutma bloğunu -20 °C'de önceden soğutun ve dilimleme prosedürü boyunca kullanmadığınızda buzda tutun.
- Bıçak tutucuya bir bıçak takmak için küçük bir damla siyanoakrilat yapıştırıcı kullanın. Bıçak tutucuyu bir Allen anahtarı kullanarak vibratoma dikkatlice takın, böylece tampon tepsisine yerleştirilmiş bir numune tüpünün ucuyla aynı hizaya gelir.
- Dilimleri toplamak için fenol kırmızısı olmadan kuyu başına 3 mL ile 6 delikli plakalar hazırlayın steril buz gibi soğuk HBSS.
- Bir neşter kullanarak, bir parça akciğer dokusunu yaklaşık 1-1.5cm3 kesin.
NOT: Sol lobun alt ve orta kısımlarından ve ayrıca sağ orta ve alt loblardan akciğer dokusu, en kolay şekilde alveoler alanı en üst düzeye çıkaran daha büyük doku dilimleri verir. Şişirilmemiş doku bölgeleri veya bağ dokusu alanları varsa, bu dokuyu makasla kesin veya pistona doğru aşağı doğru yönlendirin; bu doku temiz kesilme eğiliminde değildir. - Numune tüpünün pistonuna küçük bir damla siyanoakrilat yapıştırıcı yerleştirin. Aşırı nemi gidermek için akciğer mendilini bir kağıt mendil üzerine dökün ve ardından akciğer dokusunu hemen bir çift forseps kullanarak pistonun üzerine yerleştirin.
- Numune tüpünün metal tüpünü dokunun üst kısmına kadar kaydırın ve piston çekilmiş olarak yerinde tutun. Pipet, dokuyu tamamen çevrelemek için HBSS'de% 2 agarozu tüpün üst kısmına önceden ısıtır.
- Agarozun katılaşmasına izin vermek için buz gibi soğuk soğutma bloğunu dokunun etrafına yaklaşık 1 dakika yerleştirin.
- Numune tüpünü tampon tepsisine yerleştirin. Doku bloğunun ortasına kadar tepsiyi buz gibi soğuk PBS ile doldurun. Motor kutusu pistonunu sadece numune borusunun tabanına dokunacak şekilde ilerletmek için motor kutusu anahtarını ileri sarmaya (FF) çevirin.
- Dilim kalınlığı, kesme hızı ve salınım frekansı için istenen ayarları yapın, örneğin 450 μm kalınlık, hız 4 ve salınım frekansı 5. Sürekli mod'u seçin ve dilimlemeye başlamak için anahtarı Açık konumuna getirin.
- Doku dilimleri tampon tepsisine düştükçe, bunları bir aşılama döngüsü veya spatula kullanarak hazırlanan 6 delikli plakalara aktarın.
- Bıçağa zarar vermemek veya tutkal içeren dokuyu kesmek için numune tüpünde ~ 2 mm kalınlığında doku kaldığında dilimlemeyi durdurun.
- İstediğiniz gibi ek akciğer dokusunu dilimlemek için yukarıdaki adımları tekrarlayın.
- İskele hazırlığı için dilimleri hemen hücreselleştirin veya çıtçıtlayın ve 2 aya kadar -80 ° C'de saklayın. Donmak için, 4-6 dilimi 35 mm'lik bir Petri kabına aktarın ve dilimlerin etrafındaki fazla sıvıyı dikkatlice aspire edin. Bulaşıkları kuru buz ve% 100 etanol banyosuna koyarak dondurun, ardından folyoya sarın, plastik bir torbaya kapatın ve -80 ° C'ye aktarın.
NOT: Taze dilimleri doğrudan -80 °C'lik bir dondurucuya koymayın, çünkü nispeten yavaş donma hızı dokuya zarar verebilecek buz kristallerinin oluşmasına neden olabilir.
3. Akciğer Doku İskelelerinin Hazırlanması
- Malzemelerin ve Desellülarizasyon Çözeltilerinin Hazırlanması
- Otoklav çerçeveleri, klipler ve sekmeler.
- Tablo 1'de belirtildiği gibi hücresellikten arındırma çözeltileri hazırlayın.
NOT: Benzonaz nükleazı kullanımdan hemen önce önceden ısıtılmış tampona ve steril filtreye ekleyin. Triton X-100 ve sodyum deoksikolat (SDC) çözeltilerini desellülarizasyon prosedüründen sonraki 24-48 saat içinde hazırlayın. Önceden 30 d'ye kadar antibiyotik/antimikotik çözeltiler ve benzonaz tamponu hazırlayın ve 4 °C'de saklayın.
- Akciğer Dilimlerinin Kesilmesi ve Kesilmesi
NOT: Kesme ve kırpma tezgah üstünde steril olmayan bir şekilde yapılabilirken, bölüm 3.3'teki hücreselleştirme adımları ve doku iskelelerinin sonraki tüm işlemleri laminer akışlı bir davlumbazda yapılmalıdır.- 100 mm'lik bir Petri kabını yaklaşık üçte biri PBS ile doldurun. Forseps kullanarak kasetleri (her biri iki klip içeren çerçeveler) ve tırnakları tabağa aktarın.
- Dondurulmuş dilimler kullanıyorsanız, dilimleri örtmek için oda sıcaklığında PBS'yi kabın içine dökerek her seferinde bir tabağı çözün. Kalan bulaşıkları kuru buz üzerinde tutun.
- Çözülmüş bir dilimi 150 mm'lik bir Petri kabına aktarın. Gerekirse, ince forseps kullanarak dilimi yavaşça açın, böylece düz durun, ardından dokunun etrafındaki fazla PBS'yi dikkatlice aspire edin.
- Bıçağın tüm uzunluğunu tabağa sıkıca bastırarak ve bıçak kenarı yerinde tutularak hafifçe yan yana sallayarak dilimden 3 mm genişliğinde bir şerit kesmek için kılavuz olarak cetvel içeren bir tıraş bıçağı kullanın. Alternatif olarak, doku şeritlerini kesmek için 3 mm'lik özel yapım bir ara parça (örneğin, asetal [polioksimetilen ]) ile ayrılmış 2 paralel bıçakla güçlendirilmiş bir döner kesici kullanın. Gözyaşı, delik, büyük hava yolları veya damarlar veya kalın bağ dokusundan kaçının.
NOT: Başarılı bir kırpma için, şerit en az 9 mm uzunluğunda olmalıdır. - Forseps kullanarak, doku şeridini hazırlanan 100 mm Petri kabına aktarın.
- Doku şeridini kasete klipsleyin: Dokuyu kasetin üzerinde yüzdürün, dokuyu ortalayarak her iki uçtaki klipslerdeki delikleri sarkıtın. İnce forsepslerle, bir ucundaki deliğe kısmen bir sekme yerleştirin, dokuyu yavaşça düzeltin ve ardından ikinci tırnağı yerleştirin. Her elinizde forseps kullanarak, dokuyu sabitlemek için her tırnağa tamamen basın.
NOT: Kırpmadan önce dokuyu yerinde tutmakta zorluk çekiyorsanız, sıvı seviyesini düşürmek için çanaktan bir miktar PBS aspire edin. İkinci klipsi yerleştirirken dokuyu germemeye dikkat edin, çünkü bu yırtılmaya neden olabilir. - Çözme, kesme ve kırpma prosedürünü 3.2.2-3.2.6 adımlarında istediğiniz kadar doku için tekrarlayın.
- Dilim Desellülarizasyon
- Tüm dilimler kırpıldıktan sonra, kasetleri içeren 100 mm'lik kabı laminer bir akış başlığına aktarın.
- Desellülarizasyon protokolünün 1. adımına başlayın (bakınız Tablo 2): Her kasetin çentikli taraflarını kavramak için kavisli bir hemostat kullanarak, kasetleri kuyu başına 3 mL PBS + iyon + antibiyotik / antimikotiklerle dolu 6 delikli plakalara ( 2 doku / kuyu) aktarın ( Tablo 1'deki çözelti tarifine bakınız).
- Kuyu plakalarını 10 dakika boyunca 30 rpm'de yörüngesel bir çalkalayıcıya yerleştirin.
- Desellülarizasyon protokolünün 2. adımıyla devam edin (bakınız Tablo 2): sıvıyı her bir kuyucuktan aspire edin, ardından 3 mL / kuyu PBS + iyonları ile değiştirin, plakayı 30 rpm'de yörüngesel çalkalayıcıya yerleştirin ve 5 dakika boyunca inkübe edin.
- Çözümlerin her biri ve Tablo 2'deki hücresellikten arındırma protokolünde özetlenen karşılık gelen süreler için adım 3.3.4'ü yineleyin.
- PBS + antibiyotikler / antimikotikler ile son durulama adımından sonra ( Tablo 2'nin 20. adımı), dokuları taze PBS + antibiyotikler / antimikotikler içeren steril 6 delikli plakalara aktarın ve 48 saat boyunca 37 ° C'de inkübe edin.
NOT: Antibiyotikler/antimikotiklerle sterilizasyondan sonra, akciğer dokusu iskeleleri hemen tohumlanabilir veya 4 °C'de 30 d'ye kadar saklanabilir.
4. Dilim Resellülarizasyon ve Kültür
NOT: Şekil 2 , dilimlerin önce sıçan akciğer mikrovasküler endotel hücreleri ile tohumlandığı ve düşük serum endotel ortamında kültürlendiği doku tohumlama ve kültür için önerilen bir zaman çizelgesini göstermektedir; daha sonra serumsuz AEC2 büyüme ortamına sahip sıçan AEC2'leri ve sıçan akciğer fibroblastları ile tohumlanır (Jacob ve ark.13 ve You ve ark.35'ten uyarlanmıştır); Tablo 3'teki Sonuçlar ve kültür ortamı ayrıntılarında kullanılan hücre kaynakları hakkında ek notlara bakın. Bu strateji, AEC2 monokatmanları içeren alveolar benzeri yapılar verir.
- Tohumlama için Doku İskelelerinin Hazırlanması (Gün -4 veya -3)
- 4 °C'de depolanan doku iskeleleri kullanılıyorsa, tohumlamadan önce iskeleleri 37 °C'de gece boyunca taze PBS + antibiyotikler / antimikotiklerle (% 10 penisilin / streptomisin,% 4 amfoterisin B,% 0.4 gentamisin) kuluçkaya yatırın.
- İskeleleri steril PBS (5 mL/kuyu) ile 3 kat, her biri 5 dakika durulayın.
- İskeleleri, tohumlama için dokuları seçmek için 5x büyütmede bir faz kontrast mikroskobu altında inceleyin.
NOT: Tohumlama için en iyi iskelelerin gözyaşı veya deliği yoktur ve büyük hava yolları veya kaplar içermez. Özelliklere sahip iskeleler başarılı bir şekilde tohumlanabilirken, yeniden popülasyon paternleri alveolar bölgelerde gözlenenlerden farklı olabilir.
- Endotel Hücre Tohumlaması (Gün -3)
- Bir hemositometre kullanarak endotel hücrelerini sayın ve endotel hücre süspansiyonunu endotel ortamında (bakınız Tablo 3) 5 x 10 6 hücre / mL'de, dilim başına 500.000 endotel hücresi tohumlamak için yeterli hücreyle hazırlayın (örneğin, 12 dilim için, 1.2 mL ortamında6 x 106 hücreyi yeniden askıya alın).
- Otoklavlanmış tohumlama banyolarını 100 mm Petri tabaklarına yerleştirin. Durulanmış iskeleleri baş aşağı tohumlama banyolarına aktarın: çentikli kenarlardan bir kaseti kavramak için ince kavisli bir hemostat kullanın, kasetin bir ucunu kavramak için düz bir hemostat veya forseps kullanın (dokunun kendisine dokunmamaya dikkat ederek) ve çevirin ve ardından kaseti çentikli kenarlardaki deliklerden ince kavisli hemostatın uçlarıyla tekrar kavrayın, ve bir tohumlama banyosuna iyice yerleştirin. Kalan kasetler için bu işlemi tekrarlayın.
NOT: Doğru yerleştirildiğinde, iskeleler her bir kuyucuğun dibinde baş aşağı ortalanacaktır. Gerekirse, kasetin kuyuya düz oturduğundan emin olmak için kasetin köşesine hemostat uçlarıyla hafifçe bastırın. Kasetin yanlış oturtulması, zayıf doku tohumlamasına neden olabilir. Kuyunun az miktarda PBS içermesi kabul edilebilir. - Hazırlanan hücre süspansiyonunu karıştırmak için hafifçe döndürün, ardından pipet ucuyla dokuya zarar vermemeye dikkat ederek, 100 μL hücreleri doğrudan kuyunun tabanındaki her bir dokunun üzerine pipetlemek için manuel bir pipet kullanın.
- Tohumlanmış dokuları hücre kültürü inkübatörüne 37 °C / % 5 CO2'de aktarın.
- 2 saat sonra, manuel pipet kullanarak her bir kuyucuğa 900 μL önceden ısıtılmış kültür ortamı ekleyin, ardından inkübatöre geri dönün. Bir kaset orta yerleştirildikten sonra oturmaz (yüzer) hale gelirse, kuyucukta düz durması için pipet ucu ile kasetin köşesine hafifçe bastırın.
- -2. günde ortamı değiştirin. Petri kabını eğerek ve kaseti rahatsız etmemek için kuyunun köşesine hafifçe yerleştirilmiş bir pipet ucuyla manuel olarak pipetleyerek, ortamı çıkarın. Kuyucuk başına 1 mL taze endotel ortamı ile değiştirin.
- AEC2 ve Fibroblast Tohumlama ve Doku Kültürü (Gün 0)
- Bir hemositometre kullanarak AEC2'leri ve fibroblastları sayın. AEC2 büyüme ortamında AEC2'lerin ve fibroblastların 1: 1 hücre süspansiyonunu hazırlayın (epitel baz ortamı + AEC2 takviyeleri; bakınız Tablo 3) 5 x 10 6 toplam hücre / mL'de, dilim başına 500.000 hücreyi (250.000 AEC2 ve 250.000 fibroblast) tohumlamak için yeterli hücre ile (örneğin, 12 dilim için, 3 x 10 6 AEC2s + 3 x 10 6 fibroblastı 1.2 mL ortamda birlikte askıya alın).
- Ortamın pipeti, tohumlama banyosunun her bir kuyucuğundan adım 4.2.6'da açıklandığı gibi çıkarın. Hazırlanan hücre süspansiyonunu karıştırmak için hafifçe döndürün, ardından kuyunun tabanındaki her bir dokunun üzerine doğrudan 100 μL hücreleri pipetleyin.
NOT: AEC2 / fibroblast tohumlamasından önce kuyuda az miktarda endotel ortamının kalması kabul edilebilir. - Tohumlanmış dokuları hücre kültürü inkübatörüne 37 °C / % 5 CO2'de aktarın.
- 2 saat sonra, her bir kuyucuğa 900 μL önceden ısıtılmış AEC2 büyüme ortamı ekleyin, ardından inkübatöre geri dönün.
- 24 saatlik kültürden sonra (1. gün), kaset başına kuyucuk başına 1 mL önceden ısıtılmış AEC2 büyüme ortamı içeren 12 delikli bir plaka hazırlayın.
- Tohumlama banyosunun her bir kuyucuğundan 800 μL orta pipet. Kasetleri tohumlama banyosundan çıkarın: her birini çentikli kenarlar boyunca deliklerden ince kavisli bir hemostatla kavrayın, bir ucundaki kaseti kavramak ve çevirmek için düz bir hemostata veya forsepslere aktarın, ardından kaseti çentikli kenarlardan kavramak için kavisli hemostatı kullanın ve hazırlanan 12 delikli plakaya her kuyu için bir tane olmak üzere sağ tarafı yukarı doğru aktarın.
- 7. güne kadar her gün 12 delikli plakadaki kültür ortamını değiştirin veya istenen kültür uzunluğu için: dokuya dokunmamaya dikkat ederek, ortamı her bir kuyudan aspire etmek için bir cam Pasteur pipeti kullanın; kuyu başına 1 mL taze AEC2 büyüme ortamında pipet.
NOT: Doku yeniden popülasyonunun derecesi, kültür süresi boyunca 5x büyütmede faz kontrast mikroskobu ile izlenebilir.
5. Doku Hasadı ve Numune Analizi
- Histoloji ve immünofloresan boyama için ELT'leri sabitlemek için, doku kültürü kasetlerini% 10 nötr tamponlu formaline aktarın ve bir rocker üzerinde oda sıcaklığında 3-4 saat boyunca inkübe edin. Dokuyu tırnaklarla buluştuğu yerde kesmek için ince sivri uçlu forsepslerin ucunu kullanarak dokuları kasetlerden çıkarın. Parafin gömme ve histoloji için rutin yöntemlere göre proses dokusu; özel tekniklere gerek yoktur.
- ELT'leri qRT-PCR için işlemek için, PBS 2x'teki kasetlerdeki dokuları durulayın, ardından dokuları çıkarın ve dondurun veya RNA ekstraksiyonu için lizize işlemine devam edin.
NOT: 1 x 106 hücre ile tohumlanmış ve 7 gün boyunca kültürlenmiş en az 2 dilimin bir araya getirilmesi, aşağı akış PCR analizi için bol miktarda RNA vermelidir.
Sonuçlar
Akciğer dilimleme, dilimleme kırpma ve desellülarizasyon ve iskele yeniden popülasyonunu içeren ELT'leri üretme sürecine genel bir bakış Şekil 3'te sunulmuştur. Burada sunulan ELT'ler primer sıçan akciğer mikrovasküler endotel hücreleri (bakınız Malzeme Tablosu), yenidoğan sıçan AEC2'ler ve lipofibroblastla zenginleştirilmiş yenidoğan sıçan akciğer fibroblastları36 kullanılarak kültürlenmiştir. AEC2'ler, daha önce tarif edildiği gibi manyetik boncuk bazlı sıralama yoluyla yeni izole edildi37; alternatif izolasyon protokolleri başka yerlerde detaylandırılmış ve tartışılmıştır38,39,40. İzole sıçan AEC2'lerin saflığı, sıçana özgü AEC2 yüzey belirteci RTII-7041 için akış sitometrisi veya RTII-70 veya pro-yüzey aktif madde protein C (pSPC) için sitosantrifüjlü bir hücre örneğinin boyanması yoluyla değerlendirilebilir. Sıçan akciğer fibroblastları, yayınlanmış bir protokol42'nin uyarlanmasına göre doğum sonrası gün 7-9 sıçan yavrularından izole edildi ve pasaj 1-2'de kullanıldı; alternatif izolasyon protokolleri başka bir yerde tanımlanmıştır43,44. İzole fibroblastların saflığı, mezenkimal belirteç vimentin için kültürlenmiş veya sitosantrifüj hücrelerin boyanması yoluyla değerlendirilebilir ve lipofibroblast zenginleştirmesi, Yağ Kırmızı O45 için boyama yoluyla değerlendirilebilir.
Akciğer dokusu agaroz ile düzgün bir şekilde şişirildiğinde ve doku parçaları toplam ve parankimal doku alanını en üst düzeye çıkarmak için stratejik olarak seçildiğinde ve dilimleme için yönlendirildiğinde, bir sıçan akciğeri >100 alveoler ELT için doku verebilir. PCLS şeritleri, az sayıda (%<5) yırtılma örneği ile doku kasetlerine kırpılmak için yeterli mekanik bütünlük sergiler (Şekil 3B).
Akciğer dilimlerini desellülarize etme protokolü, daha önce yayınlanmış olan tüm akciğer desellülarizasyon protokolümüze yakından dayanmaktadır; kantitatif proteomikler tarafından birçok ECM bileşenini doğal akciğer 22'dekilerden önemli ölçüde farklı olmayan seviyelerde koruduğu gösterilmiştir. Desellülarize dilim iskeleleri, hematoksilin ve eozin (H & E) boyama (Şekil 4A, B) ve faz kontrast mikroskobu (Şekil 4C) ile görüldüğü gibi, alveollerin doğal mimarisini korur. Genellikle büyük hava yolları veya damarlar (Şekil 4D) veya gözyaşları içeren iskeleleri hariç tutarız, ancak birincisi araştırmacının ilgisini çekiyorsa dahil edilebilir. Desellülarizasyon, çift sarmallı DNA için yapılan bir tahlille ölçülen doku DNA içeriğinde% 96'lık bir azalmaya yol açar (bkz. Malzeme Tablosu; 0.50 μg / mg ± 0.073 μg / mg vs 0.018 μg / mg ± 0.0035 μg / mg doğal ve desellülarize dokuda, sırasıyla, ortalama ± SEM) (Şekil 5A), hematoksilin boyama ile görülebilen DNA yoktur (Şekil 4B). Desellülarize iskelelerin histolojik ve immünofloresan boyanması, ECM proteinleri kollajen, elastin, kollajen IV ve lamininin doğal akciğer dilimlerindekine benzer mimari ve miktarla korunduğunu ortaya koymaktadır (Şekil 5B-E). Doğal dokuların çekirdeklerinin trikomon (kollajen için) ve EVG (elastin için) lekeleri ile mavi / siyah boyadığını unutmayın. İmmünofloresan boyama, dokuları boyamak için standart yöntemler kullanılarak daha önce tarif edildiği gibi gerçekleştirilmiştir37. Kullanılan antikorlar ve konsantrasyonları Tablo 4'te listelenmiştir.
Başarılı iskele repopulasyonu, 7 gün sonra yüksek hücresel ELT'lere yol açar ve ışık mikroskobu ile görülebilen alveolar benzeri bir repopulasyon paterni vardır (Şekil 6A-C). Bazı durumlarda, çok yüksek hücresellikte, organoid tipi yapılar görülebilir (Şekil 6A, B). Başarısız doku tohumlaması, kültür sırasında faz-kontrast mikroskopisi ile görselleştirilebilir (Şekil 6C). Doku iskelelerinin AEC2'ler, fibroblastlar ve endotel hücreleri ile kültürlenmesinden sonra, ELT'ler üç hücre soyunun tümünü içeren alveolar benzeri yapılarla yoğun bir şekilde yeniden doldurulur (Şekil 6D, E). 7. veya 8. günlerde, AEC2'ler küboidal morfolojiyi korur ve AEC1'lere önemli bir farklılaşma kanıtı olmadan sürfaktan protein-B (SPB) ve lamel vücut proteini ABCA3'ü eksprese eder (Şekil 6E, F). AEC2'ler, 10 μM'de 2 saatlik bir darbeyi takiben 5-etinil-2'-deoksiüridin (EdU) birleşmesi ile gösterildiği gibi, ELT'lerde oldukça proliferatiftir (Şekil 6G).
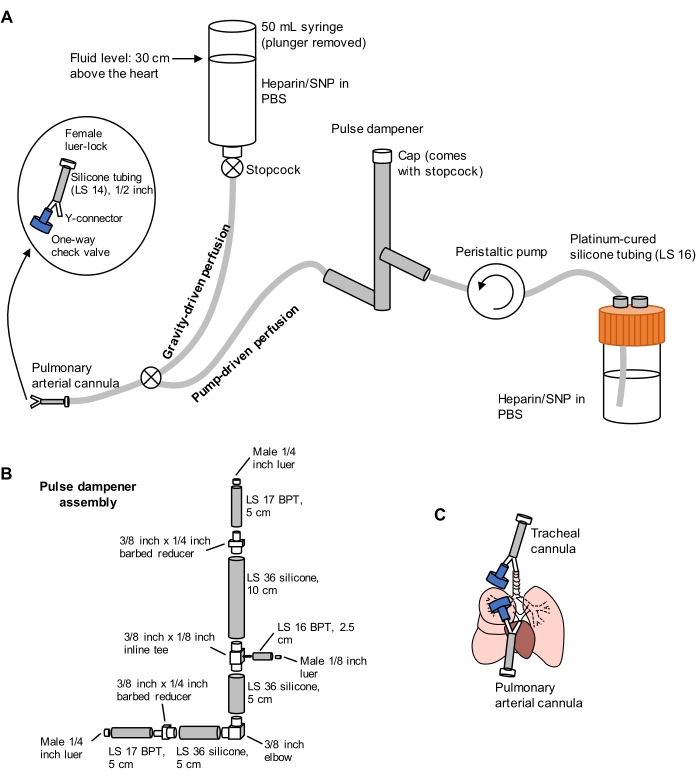
Şekil 1: Akciğer ekstraksiyonu ve temizlenmesi için perfüzyon sisteminin şeması. (A) Perfüzyon sistemi, pulmoner arterin akış altındaki ilk kanülasyonu için kullanılan yerçekimi güdümlü bir uzuvdan oluşur; ve ilk kanülasyondan sonra akciğerleri verimli bir şekilde temizlemek için kullanılan pompa tahrikli bir uzuv. Pompa hattı, pompanın neden olduğu basınçtaki ani artışları sönümleyen bir "darbe sönümleyici" içerir. Trakeal ve pulmoner arteriyel kanüllerin tasarımı solda detaylandırılmıştır. SNP = sodyum nitroprussid. (B) Darbe sönümleyici tertibatının detayları. BPT ve silikon, boru tiplerini ifade eder. (C) Akciğer ekstraksiyonu sırasında yerleştirilen trakeal ve pulmoner arteriyel kanüllerin pozisyonları. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Üç soylu hücreselleştirme için kültür zaman çizelgesi. İki fazlı tohumlamanın zamanlaması da dahil olmak üzere üç soylu ELT tohumlaması ve kültürü için önerilen zaman çizelgesi. Her faz için tohumlama ve kültür ortamı için hücre sayıları belirtilmiştir. Kültür medyası ayrıntılarına Tablo 3'te bakın. AEC2 = alveoler epitel tip 2 hücre. EC = endotel hücresi. FB = fibroblast. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
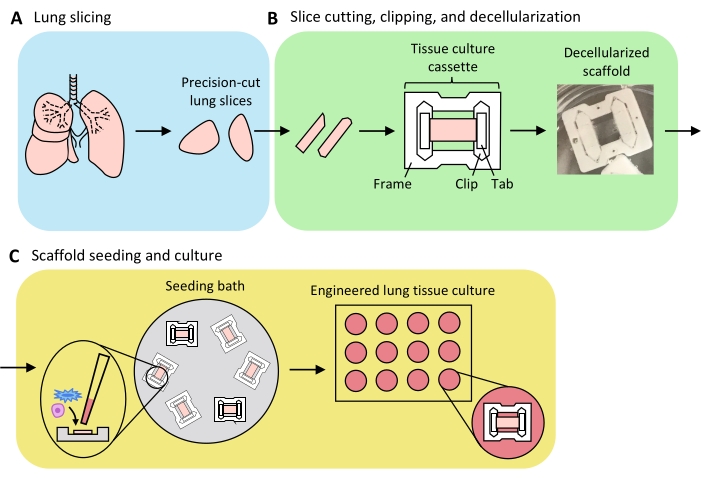
Şekil 3: Mühendislik ürünü akciğer dokusu preparatının şeması . (A) Doğal akciğer dokusu bir vibratom kullanılarak dilimler halinde kesilir. (B) Hassas kesimli akciğer dilimleri, standartlaştırılmış 3 mm genişliğinde şeritler halinde kesilir, politetrafloretilen (PTFE) doku kültürü kasetlerine kırpılır ve asellüler hücre dışı matris iskeleleri üretmek için deterjandan arındırılır. (C) İskeleler, tohumlama alanını doku alanıyla sınırlayan özel tohumlama banyolarında yeniden tohumlanır ve daha sonra standart bir kuyu plakasında kültürlenir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
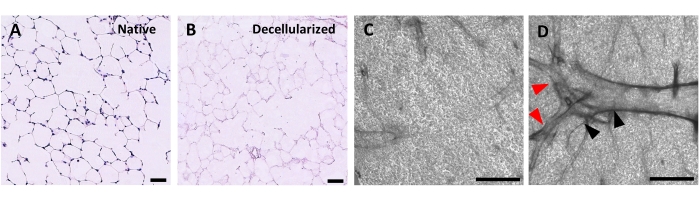
Resim 4: Desellülere akciğer iskelelerinin yapısı. Doğal (A) ve desellülarize (B) akciğer dilimlerinin H&E boyaması, desellülarizasyon sonrası alveoler mimarinin korunduğunu göstermektedir. (C,D) Faz kontrast mikroskobu ile 5x büyütmede görülen, ağırlıklı olarak alveoler dokudan (C) oluşan veya büyük dallanan hava yolları ve damarlar (D, siyah ve kırmızı ok uçları) içeren desellülarize ECM iskelelerinin örnekleri. Ölçek çubukları, 50 μm (A,B); 500 μm (C,D). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
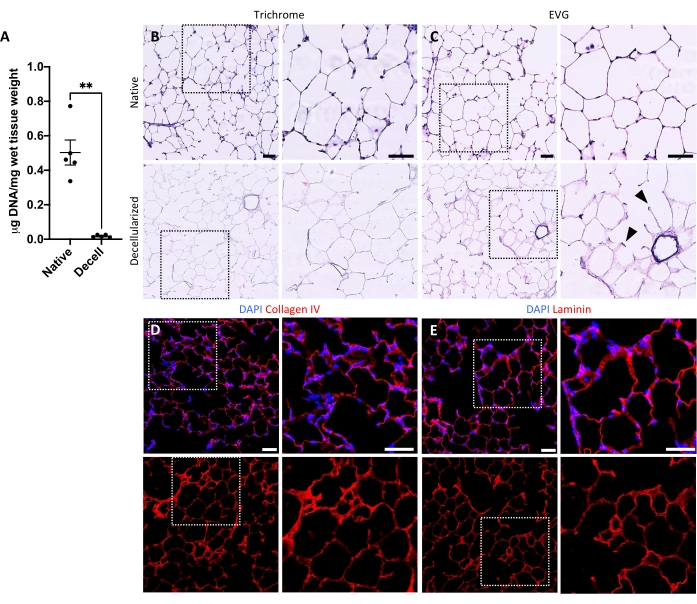
Şekil 5: Desellülerize akciğer iskelelerinde DNA çıkarılması ve matriks korunması. (A) Doğal ve desellülarize akciğer dilimlerinde DNA'nın nicelleştirilmesi (ortalama ± SEM, n = 5). Welch'in t testi, **P < 0.01. Decell = decellularized. (B,C) Kollajen (B) ve elastin (C) için doğal ve desellülere akciğer dilimlerinin histolojik boyanması. Ok uçları, desellülarize dokunun alveolar giriş halkalarında korunmuş elastin. (D,E) Kollajen IV (D) ve laminin (E) için doğal ve desellülarize akciğer dilimlerinin immünofloresan boyanması. Ölçek çubukları, 50 μm. Tüm panellerde, noktalı kutular ilgili her panelde sağa doğru büyütülen görüntü bölgesini ana hatlarıyla belirtir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 6: Mühendislik ürünü akciğer dokularının hücresel yeniden popülasyonu. (A-C) Kültürün 7. gününde resellülarize edilmiş ELT örnekleri, kültür sırasında faz kontrast mikroskobu ile görselleştirildiği gibi. Resellülarizasyon paterni, dokunun alveolar yapısını yansıtır. Yüksek hücreselliğin bazı bölgelerinde, organoid benzeri yapılar oluşabilir (ok uçları). (A) ve (B) başarılı hücre yeniden popülasyonunu temsil ederken, (C) 7 günlük kültürden sonra zayıf bir resellülarizasyon seviyesini temsil eder. (D-G) Resellülarize ELT'lerin kültürün 7. veya 8. gününde boyanması. (D) Alveoler septanın hücresel repopulasyonunu gösteren H&E boyaması. (E) İmmünofloresan boyama etiketleri aşılanmış proCollagenIα1+ fibroblastlar, ABCA3+ AEC2'ler ve CD31+ endotel hücreleri. (F) Dokular bol miktarda SPB + AEC2 içerir, ancak bu koşullar altında az sayıda RTI-40 (podoplanin) + AEC1 içerir. (G) Birçok AEC2, EdU kuruluşu ile ölçülen ELT'lerde çoğalmaktadır. Ölçek çubukları, 500 μm (A-C); 25 μm (D-G). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tablo 1: Desellülarizasyon çözümleri. Desellülarizasyon çözeltileri için hazırlık detayları. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 2: Decellularizasyon protokolü. Akciğer dilimlerini desellülarize etmek için protokol detayları. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 3: Kültür medyası. Endotel ve AEC2 büyüme ortamı için hazırlık detayları. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 4: İmmün boyama için kullanılan antikorlar. Antikorların detayları ve immün boyama için kullanılan konsantrasyonları. Bu tabloyu indirmek için lütfen tıklayınız.
Ek Dosya 1: Lazer kesim doku kültürü kaset çerçeveleri için tasarım. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 2: Lazer kesim doku kültürü kaset klipsleri için tasarım. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 3: Lazer kesim doku kültürü kaset tırnakları için tasarım. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 4: Banyo kalıp tabanının tohumlanması için CAD dosyası. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 5: Banyo kalıp halkasının tohumlanması için CAD dosyası. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Bu yazıda, desellülarize hassas kesimli akciğer dilimlerinin, çok soylu alveolar benzeri yapılar içeren in vitro mühendislik akciğer dokuları oluşturmak için bir platform olarak kullanımı açıklanmaktadır. Tüm akciğer mühendisliği22,31 için yüksek doğrulukta asellüler ECM akciğer iskelelerini yeniden doldurmak için daha önce geliştirdiğimiz stratejileri, küçük ölçekli mühendislik kalpdokularını kültürlemek için sağlam sistemimizle birleştirerek, bu protokol fizyolojik olarak ilgili akciğer ECM'sinin bir doku kültürü substratı olarak, tekrarlanabilir ve orta verimli bir şekilde kullanılmasını sağlar.
Burada sunulan yöntemler, sıçan akciğerlerinden kolayca ulaşılabilen, agaroz inüflemesi için sağlam hava yollarına doğrudan erişimi olan en blok halinde ekstrakte edilebilen ve fare akciğerinden daha büyük boyutta olan ELT iskele preparatını detaylandırmaktadır. Ancak agaroz ile şişirilebilen ve en az 9 mm uzunluğunda dilimler verebilen herhangi bir akciğer dokusu bu sistem içerisinde kullanılabilir. Doku kaynağından bağımsız olarak, agarozlu akciğer dokusunun homojen şişirilmesi, aşağı akış doku dilimleme, kırpma ve doku işlemenin başarısını sağlamak için en kritik adımdır. Az şişirilmiş akciğer dokusu temiz bir şekilde dilimlenmeme eğilimindedir, aşırı şişirilmiş doku kırpma sırasında yırtılabilir. Agaroz jelasyonunu takiben, uygun şekilde şişirilmiş doku bölgeleri sağlamdır, ancak forseps ile hafifçe bastırıldığında biraz verir. Sağlam sıçan akciğerleri için, ekstrakte edilen akciğerlerin birkaç kez hava ile önceden şişirilmesinin, ardından ekstraksiyondan sonra mümkün olan en kısa sürede agaroz enflasyonunun takip edilmesinin, en iyi dilimleme sonuçları ve ortaya çıkan doku iskelelerinin en iyi kalitesi ile sonuçlandığını bulduk. Uygun agaroz hacminin ampirik olarak optimize edilmesi gerekir; Bir sıçan akciğeri için akciğeri toplam akciğer kapasitesine şişirmek için gereken hacim yaklaşık 30 mL / kg hayvan kütlesidir (örneğin, 350 g'lık bir sıçandan akciğerler için 10.5 mL agaroz). Daha az basit hava yolu erişimine sahip daha büyük rezeke akciğer dokuları için (insan donörlerinden gelenler gibi), dokuyu bronş32 yoluyla şişirmek için bazı ek sorun giderme gerekli olabilir. Sonraki akciğer dilimleme sırasında, piston üzerindeki dokunun seçimi ve oryantasyonu, 1) dilimlerin doku kültürü kasetlerine kırpılabilecek doku şeritleri oluşturacak kadar büyük olmasını sağlamak ve 2) büyük hava yolları veya damarlar hariç parankimal (alveolar) doku alanını en üst düzeye çıkarmak için bir başka önemli adımdır.
PCLS'yi doku kültürü kasetlerine kırpmak başlangıçta zor bir adım olabilir, ancak kasetler desellülarizasyon ve tohumlama sırasında doku kullanımını büyük ölçüde basitleştirir. Ortaya çıkabilecek iki potansiyel sorun, doku yırtılması (kırpma işlemi sırasında veya hücresellikten arındırma sırasında) veya klipslerde zayıf aşağı akış tohumlamasına neden olan doku konumlandırmasıdır (örneğin, tohumlama yok veya sadece uçlarda tohumlama). Yırtılma, agaroz aşırı şişirilmesinin, sekme yerleştirme sırasında dokunun aşırı gerilmesinin veya tırnakları yerleştirirken yeterli doku tutuşu sağlamak için çok az çıkıntı bırakmanın bir sonucu olabilir. Bir klips ucunda yırtılan dilimlerin başarılı bir şekilde tohumlanabileceğini, ancak doku düz olmadığı için kültür sırasında mikroskop altında görselleştirilmesinin zor olduğunu unutmayın. Zayıf doku tohumlaması ( Şekil 6C'deki gibi) muhtemelen dilimin iki klips arasında düz durmamasının ve böylece baş aşağı çevrildiğinde tohumlama banyosunun tabanıyla zayıf temas etmesinin sonucudur. Diğer bir olası neden, kasetin tohumlama banyosunun dibinde yanlış oturmasıdır. Kırpma açısından, düz durmasına yardımcı olmak için ikinci klipsi yerleştirirken dokuya biraz daha fazla gerginlik uygulayın. Bazı dilimler hafif bir konkaviteye sahiptir; Bu durumlarda dilimi dışbükey tarafı yukarı bakacak şekilde kırpın. Uygulamada, tipik olarak% 2'den daha az dilimle başarısız tohumlama yaşarız.
Bu protokolün bir sınırlaması, ELT hazırlığı için ilk malzemeleri üretmek için bazı özel ekipmanların - bir lazer kesici ve bir 3D yazıcı - gerekliliğidir. Bununla birlikte, doku kültürü kasetleri ve tohumlama banyoları oluşturulduktan sonra, ek özel materyallere gerek yoktur. ELT iskele preparasyonunun akciğer dilimleme ve desellülarizasyon adımları orta derecede zaman alıcıdır; ancak, bu adımlar önceden veya aynı anda birden fazla deneye hazırlanmak için yeterli sayıda gerçekleştirilebilir. Birçok PCLS (parankimal bölgeler için optimize edilirse >100) tek bir akciğerden kesilebilir ve daha sonra kullanılmak üzere dondurulabilir. Tek bir donma-çözülme döngüsü ECM46'da küçük ultrayapısal hasara neden olabilirken, birden fazla donma-çözülme döngüsünün bile ECM 23,47'de önemli bir kayba neden olmadığı gösterilmiştir. PCLS ayrıca bir ay içinde kullanılmak üzere bir deneyden önce kırpılabilir ve hücreselden arındırılabilir. (Özellikle, açıklanan hücreselleştirme protokolü yaklaşık 6 saat içinde gerçekleştirilebilir, bu da bir gün veya daha fazla gerektiren daha önce açıklanan yöntemlere göre önemli bir avantaj sağlar27,28.) İskeleler hazırlandıktan sonra, hücre tohumlama işlemi basit ve hızlıdır ve ELT kültürü özel teknikler gerektirmez.
Tanımlanan ELT yönteminin bir uyarısı, bölgeye özgü tohumlamanın olmaması, yani AEC2'lerin özellikle alveoler boşluğa veya endotel hücrelerinin özellikle vasküler boşluğa verilmesidir. Bununla birlikte, hücreler basitçe doku iskelelerinin üzerine tohumlanmasına rağmen, resellülarizasyon paterni, epitel halkaları da dahil olmak üzere alveolar benzeri organizasyonun bir benzerliği ile rastgele değildir. Hücre-hücre etkileşimlerinin yanı sıra ECM bileşimi ve geometri20,21'deki yerel farklılıkların, gözlemlenen resellülarizasyon paternlerine katkıda bulunduğundan şüpheleniyoruz. Bu hipotezi desteklemek için, fibroblastların spesifik olmayan bir şekilde desellülarize akciğer dilimlerine tohumlandığı daha önce yayınlanmış bir çalışma, doku repopulasyonu ve ilişkili hücresel fenotiplerin paterninin mikroskobik doku bölgesi ve ECM iskele kaynağı (örneğin, sağlıklı ve hastalıklı) ile önemli ölçüde değiştiğini göstermiştir27. Fibroblastların ayrıca interstisiyuma invaze olduğu gözlendi - doğal akciğer dokusunda bulundukları yer 1,27. Akciğer dilimleri üzerindeki hücreleri gerçekten bölgeye özgü bir şekilde kültürlemek için hayal edebileceğimiz birincil alternatif yöntem, bozulmamış desellülarize akciğerlerin hava yolu31,48 ve vasküler bölmeler 49,50 yoluyla tohumlanmasını ve daha sonra resellülarize dokunun dilimlenmesini gerektirecektir. Bununla birlikte, bu alternatif 1) önemli ölçüde daha fazla maliyet, zaman ve kaynak yoğundur; 2) daha düşük verimdir; 3) artan sayıda hayvan gerektirir; ve 4) tüm akciğer kültürünün zorlukları ve daha sonra tohumlanmış akciğerin dilimlenmesi nedeniyle artan kontaminasyon riski ile ilişkilidir. Doğal hücresel organizasyonun tüm yönlerini özetlemese de, ELT platformu, fizyolojik olarak ilgili bir ECM substratı üzerinde, daha birçok laboratuvarın erişebileceği bir şekilde akciğer hücre kültürünü mümkün kılar.
ELT sisteminin esnekliği bu platformun önemli bir avantajıdır ve herhangi bir sayıda doku iskelesi, hücre veya kültür ortamı ile küçük ölçekli akciğer dokusu kültürüne izin vermelidir. Hastalıklı dokudan veya yaralanma modellerinden türetilen iskelelerin kullanılması, hastalıkla değiştirilmiş ECM 27,29,51 ortamında hücre-hücre veya hücre-matris etkileşimlerinin incelenmesine izin verebilir. Bununla birlikte, desellülarizasyon protokolünün,52. türler arasındaki matris farklılıklarını hesaba katmak için uyarlanması gerekebileceğini unutmayın. Açıklanan tohumlama stratejisi, herhangi bir hücre tipi için kullanılabilir ve kültür zaman çizelgesi, araştırmacının ihtiyaçlarına uyacak şekilde uyarlanmıştır. Başlangıç noktası olarak, iskele başına 1 x 106 hücre, kültürden sonraki 7 gün içinde yüksek hücresel bir doku vermelidir, oysa 1 x 105 toplam hücre zayıf hücreselliğe neden olur. Zaman çizelgesinin herhangi bir adaptasyonunda, doku kültürü kasetleri, son doku tohumlamasından 24 saat sonra tohumlama banyosundan çıkarılmalıdır. Burada, akciğer alveolünün hücresel karmaşıklığının bir kısmını modellemek amacıyla, alveolar benzeri yapılarda iyi diferansiye yenidoğan AEC2'lerin en az 7 gün boyunca korunmasını destekleyen üç kültürlü bir resellülarizasyon stratejisi tanımlamaktayız. Sonuçlarımız ayrıca, ELT'ler içindeki hem fibroblastların hem de endotel hücrelerinin başarılı bir şekilde engraftasyonunu göstererek, kültür substratının geniş uygulanabilirliğini ve ko-kültür çalışmaları için uygunluğunu vurgulamaktadır. ELT'lerde yetişkin hücrelerin tohumlanması, daha sessiz alveolar yapıların modellenmesini kolaylaştırabilirken, genetik modifikasyonları olanlar da dahil olmak üzere insan PSC kaynaklı AEC2'lerin tohumlanması, insan hastalığının translasyonel çalışmalarını kolaylaştırabilir13,53. Genel olarak, ELT platformu tarafından sağlanan aşağıdan yukarıya yaklaşım, belirli hücre tiplerinin AEC2 proliferasyonu veya farklılaşma durumu gibi ilgi çekici okumalara katkılarını araştırma fırsatı sunar.
Özetle, bu protokol, asellüler ECM akciğer dilim iskeleleri içindeki AEC2'lerin, fibroblastların ve endotel hücrelerinin ko-kültür çalışmaları için tasarlanmış akciğer dokuları üretmek için sağlam bir sistemi özetlemektedir. ELT'ler, birincil AEC2'ler için yeni bir 3D kültür stratejisini temsil eder; bunlar, bugüne kadar iyi farklılaşmış bir fenotip 6,11,12'yi korumak için tipik olarak daha az fizyolojik jel tipi matrislere güvenmiştir. Mevcut platform, desellülarize akciğer dilimlerinin 24,25,26,27,28,29 yeniden popülasyonunda yapılan önceki çalışmalara dayanmaktadır, ancak çeşitli avantajlar sunmaktadır: 1) desellülarizasyon, tohumlama ve kültür sırasında ELT kullanımını kolaylaştırmak için bir doku kültürü kaset sistemi; 2) Her dilim iskelesinde bilinen sayıda hücreyi tam olarak tohumlamak için özelleştirilmiş bir tohumlama banyosu; ve 3) epitelyal, mezenkimal ve endotel hücreleri ile alveoler doku repopulasyonunu sağlayan bir üçlü kültür yeniden tohumlama stratejisi. Bu nedenle, ELT'ler, doğal alveolus ve AEC2 kök hücre nişinin hücresel ve substrat karmaşıklığını yakalayan tekrarlanabilir in vitro modeller oluşturmaya yönelik önemli bir adımı temsil etmektedir.
Açıklamalar
L.E.N., rejeneratif bir tıp şirketi olan Humacyte, Inc.'in kurucusu ve hissedarıdır. Humacyte, vasküler cerrahi için allojenik düz kas hücrelerinden tasarlanmış kan damarları üretir. L.E.N.'nin eşinin Humacyte'de özsermayesi vardır ve L.E.N. Humacyte'nin Yönetim Kurulu'nda görev yapmaktadır. L.E.N., Humacyte'ye lisanslı ve L.E.N. L.E.N. için telif hakkı üreten patentlerin mucididir ve Yale'deki laboratuvarında araştırmaları desteklemek için sınırsız bir araştırma hediyesi almıştır. Humacyte, bu rapordaki bulguların davranışını, tanımını veya yorumlanmasını etkilemedi.
Teşekkürler
Yazarlar, Lorenzo Sewanan ve Jorge Nunez'e bu protokolde kullanılan doku kültürü kaset tasarımını geliştiren çalışmaları için, vibratomlarının kullanımı için Kaminski laboratuvarına, akciğer dilimleme konusunda yardım için Maurizio Chioccioli ve Jessica Nouws'a, ilk pilot deneylerde yardım için Allie LaRocco'ya ve protokolün dikkatli bir şekilde okunması için Hong Qian'a teşekkür etmek istiyor. Bu çalışma NIH hibeleri F30HL143880 (K.L.L.), Tıbbi Bilim İnsanı Eğitim Programı Eğitim Hibe T32GM136651 (KLL) ve U01HL145567 (L.E.N.) tarafından desteklenmiştir; ve Humacyte Inc.'den (L.E.N.) sınırsız bir araştırma hediyesi ile.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3D Printer: Form 2 | Formlabs | ||
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | |
| 8-Bromo cAMP | Sigma | B7880 | |
| Agarose, UltraPure LMP | Invitrogen | 15517-014 | |
| Amphotericin B | Sigma | A2942 | |
| Barbed reducer fitting, 3/8 inch x 1/4 inch | McMaster-Carr | 5121K271 | |
| Benzonase nuclease | Sigma | E1014 | |
| Bovine serum albumin (BSA) Fraction V | Gemini | 700-104P | For AEC2 growth medium |
| Bovine serum albumin (BSA), standard grade | Gemini | 700-100P | For benzonase buffer |
| Check valve, polypropylene, 1/8 inch hose barb | Cole-Parmer | SK-98553-10 | |
| CHIR99021 | PeproTech | 2520691 | |
| Clear Resin, 1 L | Formlabs | RS-F2-GPCL-04 | |
| Cyanoacrylate glue, such as Krazy Maximum Bond Permanent Glue | Any hardware, craft, or drug store | KG483 or similar | |
| Dexamethasone | Sigma | D4902 | |
| DMEM (low glucose) | Gibco | 11885-084 | |
| DMEM (high glucose) | Gibco | 11965-092 | |
| DNA assay (Quant-iT PicoGreen dsDNA Assay Kit) | Invitrogen | P7589 | |
| EDTA, 0.5 M, pH 8.0 | AmericanBio | AB00502-01000 | |
| EdU kit (Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647) | Invitrogen | C10340 | Used according to manufacturer's directions |
| Elbow fitting, 3/8 inch | McMaster-Carr | 5121K907 | |
| F12 | Gibco | 11765-054 | |
| Fetal bovine serum (FBS), characterized | Hyclone | SH30071.03 | |
| Gentamicin sulfate | Gemini | 400-100P | Reconstituted in diH2O for a stock solution at 50 mg/mL |
| Hair clippers | Wahl | MiniArco | |
| Hank's balanced salt solution (HBSS), Phenol Red Free | Gibco | 14175-095 | |
| Heparin sodium injection, USP, 1000 U/mL | Sagent | NDC: 25021-400-30 | For intraperitoneal and intracardiac injection |
| Heparin sodium salt | Sigma | H4784 | For pulmonary artery perfusion; prepare stock solution at 100 U/mL in PBS |
| HEPES Buffer | Corning | 25-060-Cl | |
| Inline tee fitting, 3/8 inch x 1/8 inch | McMaster-Carr | 5121K851 | |
| Inoculating loop, disposable | Fisherbrand | 22-363-600 | |
| Insulin from bovine pancreas | Sigma | I6634 | |
| Ketamine injection, 100 mg/mL | Covetrus (Butler Animal Health) | 010177 | |
| KGF, recombinant human | PeproTech | 100-19 | |
| Laser cutter, VLS 3.50 30 watt | Universal Laser Systems | ||
| L-glutamine | Gibco | 25030-081 | |
| Luer-lock, female, 3/32 inch | Cole-Parmer | 45508-02 | |
| Luer-lock, male, 1/8 inch | Cole-Parmer | 30800-24 | |
| Luer-lock, male, 1/4 inch | McMaster-Carr | 51525K146 | |
| MCDB-131 Complete without serum | VEC Technologies | MCDB-131 WOFBS | |
| Magnesium chloride (MgCl2), 1 M | AmericanBio | AB09006-00100 | |
| NaCl | American Bioananalytical | AB01915 | |
| Phosphate buffered saline (PBS), without Ca2+ and Mg2+, 10X | Sigma | D1408 | Reconstitute to 1X with diH2O |
| Phosphate buffered saline (PBS), with Ca2+ and Mg2+ | Gibco | 21300-058 | |
| PDMS - SYLGARD 184 Silicone Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Penicillin/Streptomycin (10,000 U/mL penicillin/10,000 μg/mL streptomycin) | Gibco | 15140-122 | |
| Petri dish, 150 mm | Falcon | 351058 | |
| Plastic film (parafilm) | Bemis | PM-996 | |
| Pharmed BPT tubing, LS 16 | Masterflex | 06508-16 | |
| Pharmed BPT tubing, LS 17 | Masterflex | 06508-17 | |
| Platinum-cured silicone tubing, LS 14 | Masterflex | 96420-14 | |
| Platinum-cured silicone tubing, LS 16 | Masterflex | 96420-16 | |
| Platinum-cured silicone tubing, LS 36 | Masterflex | 96410-36 | |
| Poloxamer 407 (Pluronic F-127) | Sigma | P2443 | |
| Povidone/iodine prep pads, 10% | Dynarex Corporation | 1108 | |
| PTFE sheet, 0.060 inch (1/16 inch) thick | ePlastics | PTFENAT0.060X12X12 | For tissue culture cassette tabs |
| PTFE sheet, 0.093 inch (3/32 inch) thick | ePlastics | PTFENAT0.093X12X12 | For tissue culture cassette frames and clips |
| Peristaltic pump drive: Masterflex L/S Variable-Speed Digital Drive | Cole-Parmer | ZM-07528-30 | |
| Peristaltic pump head: Masterflex L/S Easy-Load II Pump Head | Cole-Parmer | EW-77202-60 | |
| Rat, Sprague Dawley | Charles River | Strain Code: 400 | |
| Razor blade | Any hardware or craft store | Personna 94-120-71 or similar | |
| Retinoic acid | Sigma | R2625 | |
| Rotary blades, 28 mm | Omnigrid | 2046 | |
| Rotary cutter, 28 mm | Olfa | Model 9551 | |
| Sodium deoxycholate (SDC) | Sigma | D6750 | |
| Sodium nitrorusside (SNP) | Sigma | 71778 | |
| Stopcock, 4-way | Edwards | 594WSC | |
| Suture, 4-0 monofilament polypropylene | Covidien | VP-557-X | |
| Syringe, 10 mL | BD | 302995 | |
| Syringe, 50 mL | BD | 309653 | |
| Tissue culture dish, 35 mm | Falcon | 353001 | |
| Tissue culture dish, 100 mm | Corning | 430167 | |
| Tissue culture plate, 6-well | Falcon | 353046 | |
| Tissue culture plate 12-well | Falcon | 353043 | |
| Transferrin human | Sigma | T8158 | |
| Tris, 1 M solution, pH 8.0 | AmericanBio | AB14043-01000 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| Vibratome, Compresstome VF-300-0Z | Precisionary Instruments LLC | ||
| Xylazine, 100 mg/mL | Henry Schein | NDC: 11695-4022-1 | |
| Y-connector, 1/16 inch barbed | Cole-Parmer | 30614-43 |
Referanslar
- Burri, P. H. Morphology and respiratory function of the alveolar unit. International Archives of Allergy and Applied Immunology. 76, Suppl 1 2-12 (1985).
- Barkauskas, C. E., Noble, P. W. Cellular Mechanisms of Tissue Fibrosis. 7. New insights into the cellular mechanisms of pulmonary fibrosis. American Journal of Physiology. Cell Physiology. 306 (11), 987-996 (2014).
- Taylor, M. S., et al. A Conserved Distal Lung Regenerative Pathway in Acute Lung Injury. American Journal of Pathology. 188 (5), 1149-1160 (2018).
- Carsana, L., et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infectious Diseases. 20 (10), 1135-1140 (2020).
- Basil, M. C., et al. The Cellular and Physiological Basis for Lung Repair and Regeneration: Past, Present, and Future. Cell Stem Cell. 26 (4), 482-502 (2020).
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Desai, T. J., Brownfield, D. G., Krasnow, M. A. Alveolar progenitor and stem cells in lung development, renewal and cancer. Nature. 507 (7491), 190-194 (2014).
- Evans, M. J., Cabral, L. J., Stephens, R. J., Freeman, G. Renewal of alveolar epithelium in the rat following exposure to NO2. The American Journal of Pathology. 70 (2), 1-24 (1973).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Borok, Z., et al. Keratinocyte growth factor modulates alveolar epithelial cell phenotype in vitro: expression of aquaporin 5. American Journal of Respiratory Cell and Molecular Biology. 18 (4), 554-561 (1998).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Sucre, J. M. S., et al. Successful establishment of primary Type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Stem Cell. 21 (4), 472-488 (2017).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nature Methods. 14 (11), 1097-1106 (2017).
- Chen, Y. W., et al. A three-dimensional model of human lung development and disease from pluripotent stem cells. Nature Cell Biology. 19 (5), 542-549 (2017).
- Korogi, Y., et al. In vitro disease modeling of hermansky-pudlak syndrome Type 2 using human induced pluripotent stem cell-derived alveolar organoids. Stem Cell Reports. 12 (3), 431-440 (2019).
- Strikoudis, A., et al. Modeling of fibrotic lung disease using 3D organoids derived from human pluripotent stem cells. Cell Reports. 27 (12), 3709-3723 (2019).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Chapman, H. A. Epithelial responses to lung injury: Role of the extracellular matrix. Proceedings of the American Thoracic Society. 9 (3), 89-95 (2012).
- Guilak, F., et al. Control of stem cell fate by physical interactions with the extracellular matrix. Cell Stem Cell. 5 (1), 17-26 (2009).
- Zhou, Y., et al. Extracellular matrix in lung development, homeostasis and disease. Matrix Biology. 73, 77-104 (2018).
- Calle, E. A., et al. Targeted proteomics effectively quantifies differences between native lung and detergent-decellularized lung extracellular matrices. Acta Biomaterialia. 46, 91-100 (2016).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Bonvillain, R. W., et al. A nonhuman primate model of lung regeneration: Detergent-mediated decellularization and initial in vitro recellularization with mesenchymal stem cells. Tissue Engineering Part A. 18 (23-24), 2437-2452 (2012).
- O'Neill, J. D., et al. Decellularization of human and porcine lung tissues for pulmonary tissue engineering. The Annals of Thoracic Surgery. 96 (3), 1055(2013).
- Wagner, D. E., et al. Three-dimensional scaffolds of acellular human and porcine lungs for high throughput studies of lung disease and regeneration. Biomaterials. 35 (9), 2664-2679 (2014).
- Burgstaller, G., et al. Distinct niches within the extracellular matrix dictate fibroblast function in (cell free) 3D lung tissue cultures. American Journal of Physiology-Lung Cellular and Molecular Physiology. 314 (5), 708-723 (2018).
- Sun, H., et al. Fibroblast engraftment in the decellularized mouse lung occurs via a β1-integrin-dependent, FAK-dependent pathway that is mediated by ERK and opposed by AKT. American Journal of Physiology-Lung Cellular and Molecular Physiology. 306 (6), 463-475 (2014).
- Booth, A. J., et al. Acellular normal and fibrotic human lung matrices as a culture system for in vitro investigation. American Journal of Respiratory and Critical Care Medicine. 186 (9), 866-876 (2012).
- Schwan, J., et al. Anisotropic engineered heart tissue made from laser-cut decellularized myocardium. Scientific Reports. 6, 32068(2016).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Gerckens, M., et al. Generation of Human 3D Lung Tissue Cultures (3D-LTCs) for Disease Modeling. Journal of Visualized Experiments. (144), (2019).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465(2017).
- Neuhaus, V., et al. Assessment of the cytotoxic and immunomodulatory effects of substances in human precision-cut lung slices. Journal of Visualized Experiments. (135), e57042(2018).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (6), 1315-1321 (2002).
- Vaccaro, C., Brody, J. S. Ultrastructure of developing alveoli. I. The role of the interstitial fibroblast. The Anatomical Record. 192 (4), 467-479 (1978).
- Calle, E. A., et al. Fate of distal lung epithelium cultured in a decellularized lung extracellular matrix. Tissue Engineering Part A. 21 (11-12), 1916-1928 (2015).
- Dobbs, L. G., Gonzalez, R., Williams, M. C. An improved method for isolating type II cells in high yield and purity. American Review of Respiratory Disease. 134 (1), 141-145 (1986).
- Dobbs, L. G. Isolation and culture of alveolar type II cells. American Journal of Physiology. 258, 134-147 (1990).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Dobbs, L. G., Pian, M. S., Maglio, M., Dumars, S., Allen, L. Maintenance of the differentiated type II cell phenotype by culture with an apical air surface. The American Journal of Physiology. 273 (2), 347-354 (1997).
- Bruce, M. C., Honaker, C. E. Transcriptional regulation of tropoelastin expression in rat lung fibroblasts: changes with age and hyperoxia. American Journal of Physiology. 274 (6), 940-950 (1998).
- Berk, J. L., Franzblau, C., Goldstein, R. H. Recombinant interleukin-1 beta inhibits elastin formation by a neonatal rat lung fibroblast subtype. Journal of Biological Chemistry. 266 (5), 3192-3197 (1991).
- Schultz, C. J., Torres, E., Londos, C., Torday, J. S. Role of adipocyte differentiation-related protein in surfactant phospholipid synthesis by type II cells. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (2), 288-296 (2002).
- Maksvytis, H. J., et al. In vitro characteristics of the lipid-filled interstitial cell associated with postnatal lung growth: evidence for fibroblast heterogeneity. Journal of Cellular Physiology. 118, 113-123 (1984).
- Hopkinson, A., et al. Optimization of amniotic membrane (AM) denuding for tissue engineering. Tissue Engineering Part C: Methods. 14 (4), 371-381 (2008).
- Fernandez-Perez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Scientific Reports. 9 (1), 14933(2019).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nature medicine. 16 (8), 927-933 (2010).
- Le, A. V., et al. Efficient and Functional Endothelial Repopulation of Whole Lung Organ Scaffolds. ACS Biomaterials Science & Engineering. 3 (9), 2000-2010 (2017).
- Ren, X., et al. Engineering pulmonary vasculature in decellularized rat and human lungs. Nature Biotechnology. 33 (10), 1097-1102 (2015).
- Wagner, D. E., et al. Comparative decellularization and recellularization of normal versus emphysematous human lungs. Biomaterials. 35 (10), 3281-3297 (2014).
- Balestrini, J. L., et al. Comparative biology of decellularized lung matrix: Implications of species mismatch in regenerative medicine. Biomaterials. 102, 220-230 (2016).
- Alysandratos, K. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636(2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır