Method Article
Инженерные легочные ткани, полученные из децеллюляризированных срезов легких
В этой статье
Резюме
Этот протокол описывает метод получения воспроизводимых, мелкомасштабных инженерных легочных тканей путем повторного заселения децеллюляризованных прецизионных срезов легких альвеолярными эпителиальными клетками типа 2, фибробластами и эндотелиальными клетками.
Аннотация
Существует потребность в улучшенных 3-мерных (3D) моделях легких, которые повторяют архитектурную и клеточную сложность нативной альвеолы легких ex vivo. Недавно разработанные органоидные модели облегчили расширение и изучение предшественников эпителия легких in vitro, но эти платформы обычно полагаются на матрицу и / или сыворотку, полученную из опухоли мыши, и включают только одну или две клеточные линии. Здесь мы описываем протокол генерации инженерных легочных тканей (ELT), основанный на многолинейной рецеллюляризации децеллюляризированных прецизионных срезов легких (PCLS). ELT содержат альвеоляроподобные структуры, включающие альвеолярный эпителий, мезенхиму и эндотелий, в субстрате внеклеточного матрикса (ECM), очень напоминающем субстрат нативного легкого. Для генерации тканей легкие крыс раздувают агарозой, нарезают на ломтики толщиной 450 мкм, разрезают на полоски и децеллюляризируют. Полученные бесклеточные каркасы ECM затем пересеивают первичными эндотелиальными клетками, фибробластами и альвеолярными эпителиальными клетками типа 2 (AEC2s). AEC2s можно поддерживать в культуре ELT в течение не менее 7 дней с несывороточной, химически определенной питательной средой. На протяжении всего процесса подготовки ткани и культивирования срезы обрезаются в кассетную систему, которая облегчает обработку и стандартизированное посев клеток нескольких ELT параллельно. Эти ELT представляют собой органотипическую культуральную платформу, которая должна облегчить исследования клеточно-клеточных и клеточно-матричных взаимодействий в альвеоле, а также биохимических сигналов, регулирующих AEC2 и их нишу.
Введение
Альвеолы являются функциональными единицами дистального легкого, состоящими из сетки газообменных воздушных пространств, выстланных альвеолярными эпителиальными клетками типа 1 (AEC1s) и клетками типа 2 (AEC2s). В основе эпителия лежит плотная сеть капилляров, а также поддерживающая мезенхима, поддерживаемая каркасом внеклеточного матрикса (ECM), который обеспечивает как прочность, так и гибкость этим тонким воздушным мешочкам1. Альвеолы также являются местом повреждения при многочисленных патологиях легких, включая идиопатический легочный фиброз2, острый респираторный дистресс-синдром3 и тяжелую коронавирусную болезнь-19 (COVID-19)4. Хотя работа за последнее десятилетие выявила замечательную пластичность в эпителии легких, механизмы, которые позволяют дистальное восстановление легких в некоторых условиях - и которые исключают восстановление в других - остаются областью интенсивного исследования5. Разработка улучшенных платформ in vitro для моделирования альвеол облегчит исследования альвеолярной биологии, регенерации и терапии.
AEC2s самообновляются и дифференцируются в AEC1s, и, таким образом, считаются первичной стволовой клеткой дистального легкого 6,7,8. Тем не менее, эти клетки представляют собой особую проблему для исследования in vitro, учитывая трудности, связанные с культивированием первичных AEC2 без потери фенотипа9. В обычной 2-мерной (2D) культуре AEC2s сплющиваются и принимают некоторые особенности AEC1-подобных клеток10. Напротив, стратегии 3D-культур, чаще всего органоиды, поддерживают поддержание дифференцированных признаков в первичных AEC2s 6,11,12 и позволяют долгосрочную культивирование AEC2s13,14, полученной из плюрипотентных стволовых клеток (PSC). Органоиды были использованы для моделирования дистального развития легких15, вирусной инфекции 11,15 и связанных с AEC2 генетических заболеваний 13,16,17, что позволяет получить важную информацию о биологии и регенерации AEC2. Однако эти модели культур обычно содержат только одну или две клеточные линии и встраивают клетки в матрицы гелевого типа, которые не могут повторить ни архитектуру, ни СУБСТРАТ ECM нативной альвеолы легких.
ECM является критическим регулятором фенотипа и поведения клеток с помощью молекулярных, топологических и механических сигналов; содержит ключевой компонент тканеспецифических ниш, регулирующих судьбу стволовых клеток; и служит резервуаром, модулирующим наличие локально секретируемых факторов роста 18,19,20,21. Таким образом, культивирование клеток на нативном ECM может увеличить прогностическую способность систем in vitro моделировать биологию тканей in vivo. Децеллюляризация, процесс, который удаляет клеточный материал из тканей с помощью моющих средств, ферментов или физических или других методов, может в значительной степени сохранить каркас ECM нативного органа при тщательном выполнении22,23. Такие каркасы могут быть повторно заселены клетками для 3D биомиметической культуры. Однако, в то время как децеллюляризованные каркасы широко используются для тканевой инженерии, их использование для рутинной клеточной культуры было ограничено. В нескольких предыдущих исследованиях сообщалось о децеллюляризации и рецеллюляризации срезов легких или небольших сегментов легочной ткани. В дополнение к доказательствам концепцииисследований 24,25,26, повторно заселенные срезы легких были использованы для изучения адгезии фибробласт-матрикс 27,28 и для изучения влияния больных матриц легких на фенотип фибробластов 27,29. Благодаря улучшенным технологиям, доступным для создания прецизионных срезов тканей, децеллюляризированные срезы легких могут предложить удобную и мелкомасштабную платформу для культивирования клеток, сохраняя при этом альвеолярные, дыхательные и сосудистые субструктуры. Включение нескольких типов клеток позволит проводить исследования клеточных взаимодействий в физиологически значимой 3D-среде. Тем не менее, необходимы улучшенные стратегии для облегчения обработки тканей на протяжении всего процесса культивирования и для обеспечения контролируемого и воспроизводимого посева тканей известным количеством клеток.
Здесь мы представляем протокол для генерации инженерных легочных тканей (ELT) путем повторного заселения децеллюляризованных прецизионных срезов легких (PCLS) первичными эндотелиальными клетками, AEC2 и фибробластами. В адаптации нашей ранее описанной инженерной системысердечной ткани 30 и стратегий децеллюляризации-рецеллюляризации всего легкого22,31 мы описываем процедуры по вырезанию PCLS из легких крыс и обрезанию срезов в многоразовые кассеты культуры тканей, которые упрощают и стандартизируют последующие манипуляции. Обрезанные ломтики децеллюляризируются с образованием бесклеточных каркасов ECM, которые повторно заполняются в специальных посевных ваннах. Каркасы среза легких сохраняют критические компоненты и архитектуру ECM и поддерживают рост AEC2 в многолинейных альвеолярных структурах в течение не менее 7 дней. ELT представляют собой новую альвеолярную кокультурную систему в физиологически значимой 3D-матрице, которая должна поддерживать разработку стратегий инженерии легочной ткани, одновременно облегчая основные биологические исследования AEC2s и альвеол.
протокол
Все экспериментальные процедуры на животных, описанные в этой статье, были одобрены Йельским институциональным комитетом по уходу за животными и их использованию.
1. Создание кассет для посева тканей и посевных ванн
ПРИМЕЧАНИЕ: После изготовления кассеты для посева тканей и посевные ванны могут быть автоклавированы и повторно использованы для повторных раундов культуры ELT.
-
Кассеты для культивирования тканей
- Используйте лазерный резак для вырезания кассетных рамок и зажимов для культивирования тканей из политетрафторэтилена (PTFE) толщиной 3/32 дюйма в соответствии с конструкциями, представленными в Дополнительном файле 1 и Дополнительном файле 2, соответственно. Используйте лазерный резак для вырезания кассетных язычков тканевых культур из PTFE толщиной 1/16 дюйма в соответствии с дополнительным файлом 3. Очертания 3 раза с использованием мощности 80% и скорости 15% (для лазерного резака мощностью 30 Вт).
-
Посевные ванны
- Используйте файлы CAD для посевной ванны (Дополнительный файл 4 и Дополнительный файл 5) для 3D-печати основания и кольца формы для посевной ванны соответственно с использованием прозрачной смолы.
- Замочите формы в растворе 10% полоксамера 407 в дистиллированной воде на ночь перед использованием, чтобы помочь в высвобождении PDMS. Дайте воздуху высохнуть, затем установите кольцо над основанием формы и оберните в гибкую пластиковую пленку, чтобы предотвратить утечку.
- Приготовьте не менее 60 г на форму полидиметилсилоксана (PDMS), смешивая эластомер PDMS в соотношении 10:1 с отверждающим агентом, и переливают в 3D-печатную форму. Дегазируйте PDMS в вакуумном осушителе в течение 30 минут, чтобы удалить пузырьки воздуха.
- Выпекать семенные ванны при 60 °C в течение 8 ч.
2. Приготовление прецизионных срезов легких из легких крыс
- Извлечение органов
- Подготовьте разделенную перфузионную систему, включающую гравитационные и насосные конечности, как показано на рисунке 1. Подключите канюлю легочной артерии (PA) к концу трубки, содержащую 1/16-дюймовый колючий Y-образный разъем, прикрепленный к силиконовой трубке LS 14 длиной 1/2 дюйма и 3/32-дюймовый разъем luer-lock (см. Рисунок 1). Не прикрепляйте обратный клапан к канюле в это время.
- Загрунтуйте линии PBS, содержащими 100 Ед/мл гепарина и 0,01 мг/мл нитропруссида натрия (SNP) для антикоагуляции и вазодилатации соответственно. Предварительно установите перфузионный насос на 30 мл/мин.
ПРИМЕЧАНИЕ: Добавьте SNP свежим в раствор гепарина и защитите от света. - Доза для взрослой (8-12 недель, примерно 300-350 г) крысы Sprague-Dawley с внутрибрюшинной (IP) инъекцией 400 Ед/кг гепарина для антикоагуляции, с последующей инъекцией Кетамина (75 мг/кг) и ксилазина (5 мг/кг) для анестезии. Подтвердите хирургическую плоскость анестезии через отсутствие реакции на вредный раздражитель (защемление пальца ноги).
- Подстригите грудь и брюшко меха с помощью машинок для стрижки волос. Затем опрыскать 70% этанолом и протереть 3 раза 10% повидон-йодом.
- Обхватите кожу ниже уровня диафрагмы щипцами крысиных зубов. Затем сделайте 1/2 дюйма поперечный разрез в коже тонкоконечными ножницами. Схватите обнаженную абдоминальную фасцию щипцами, сделайте поперечный разрез на 1/2 дюйма в фасции, а затем протяните разрез через кожу и фасцию по всей ширине верхней части живота.
- Используйте кончик мелких ножниц, чтобы сделать небольшой разрез (не более 1/8 дюйма) в центре передней диафрагмы, заставляя легкие втягиваться в грудную клетку. Вытяните разрез в диафрагме по всей ширине грудной клетки.
- Сделайте два вертикальных разреза по всей высоте грудной клетки по направлению к шее, стараясь не повредить легкие. Вытяните разрез через левые ребра, чтобы разрезать ключицу и вдоль боковой части шеи до уровня гортани, обнажив трахею.
- Рассекните трахею свободной от окружающей соединительной ткани и от пищевода. Сделайте поперечный разрез через переднюю половину трахеи между двумя хрящевыми кольцами, близко к гортани. Проденьте полипропиленовый шов 4-0 за трахеей, ниже уровня разреза, и свободно завяжите первую половину хирургического узла двумя скручиваниями.
- Поместите канюлю, содержащую 1/16-дюймовый колючий Y-соединительный соединитель, соединенный с односторонним обратным клапаном, и силиконовую трубку LS 14 длиной 1/2 дюйма с 3/32-дюймовым женским разъемом luer-lock (см. Рисунок 1) в трахею, вставив одну конечность Y-разъема в разрез трахеи в направлении легких.
- Расположите предварительно завязанную шовную петлю вокруг трахеи на уровне вставленной канюли и затяните вокруг вставленного Y-образного разъема, чтобы закрепить канюлю на месте. Добавьте два однокручиваемых броска шва, чтобы завершить узел.
- Наполните шприц объемом 10 мл воздухом и подключите к люер-замку трахеальной канюли.
- Зажмите нижнюю полую вену близко к диафрагме с помощью изогнутого гемостата, затем введите в сердце 150 Ед гепарина (1000 Ед / мл) через правый желудочек (RV).
- Частично откройте запорный кран гравитационной линии, чтобы произвести медленное, но устойчивое капание PBS/гепарина/SNP из канюли PA, приготовленной на этапе 2.1.1.
- Проденьте иглу полипропиленового шва 4-0 за основанием ПА, где она выходит из RV. Используйте первую половину хирургического узла, чтобы предварительно связать свободную петлю шва вокруг основания ПА.
- Сделайте небольшой разрез (не более 1/8 дюйма) в RV чуть ниже и перпендикулярно ПА с помощью тонких ножниц, затем вставьте одну конечность канюли PA Y-образного разъема в основание PA. Закрепите шов вокруг ПА и вставленного разъема и добавьте один поворот, чтобы завершить узел хирурга.
ПРИМЕЧАНИЕ: Канюляция ПА под потоком предотвращает введение пузырьков воздуха в сосудистую систему, что может препятствовать адекватному очищению легких. - Прикрепите односторонний клапан к другому концу Y-соединителя катетера PA, затем отрежьте вершину сердца, чтобы обеспечить поток крови через левый желудочек.
ПРИМЕЧАНИЕ: Неспособность отрезать вершину сердца перед перфузией через насос может привести к повреждению гематогазового барьера, что приведет к утечке жидкости в воздушное пространство. - Переключите перфузионную линию на сторону насоса с помощью запорного крана, соединяющего две линии, затем включите насос со скоростью 30 мл /мин. Во время перфузии легких через ПА вручную проветривайте легкие через трахеальный шприц объемом 10 мл примерно на 10-15 вдохов / мин, чтобы облегчить очистку легких от крови. Перфузируйте легкие до тех пор, пока они не станут в основном белыми, обычно требуя 40 мл PBS / гепарина / SNP или менее.
ПРИМЕЧАНИЕ: Недостаточное очищение легких от крови может ухудшить последующую децеллюляризацию. - Отрежьте заднюю трахею чуть выше уровня канюли трахеи, а затем рассекните легкие и сердце, свободные от всей оставшейся соединительной ткани, и извлеките легкие и сердце в блоке.
- Заполните шприц объемом 10 мл 2% агарозой с низкой температурой плавления в сбалансированном растворе соли Хэнка (HBSS) без фенольного красного цвета, предварительно разогретого до 42 °C.
ПРИМЕЧАНИЕ: Точный объем требуемой агарозы будет варьироваться в зависимости от размера легких. Более крупные легкие (т.е. от крыс размером более 400 г) потребуют более 10 мл агарозы. - Вручную надувайте извлеченные легкие в 3 раза с 10 мл воздуха (т. Е. Примерно до общей емкости легких) через канюлю трахеи, чтобы помочь набрать разрушенную паренхиму.
- Немедленно надуйте легкие подготовленным шприцем агарозы, вручную введя агарозу через канюлю трахеи со скоростью примерно 40 мл / мин, только до тех пор, пока самые дистальные кончики долей легких не будут раздуты. Если дистальные области легкого остаются коллапсированными, вводят дополнительно 1-2 мл агарозы.
- Заколочите трахею, прикрепив белую колпачок от 4-полосного стопкора к женскому замоку трахеи. Поместите легкое в чашку Петри толщиной 150 мм на льду, чтобы агароза затвердела.
ПРИМЕЧАНИЕ: Инфляция легкого вскоре после экстракции имеет решающее значение для обеспечения равномерного заполнения паренхимы легкого и последующего успешного разрезания тканей. Если легкое надувается очень неравномерно, не приступайте к нарезке легких, так как качество среза будет плохим.
- Нарезка легких
ПРИМЕЧАНИЕ: Точная процедура нарезки может потребоваться адаптировать на основе используемого вибрационного микротома (вибратома); Дополнительные примеры препарата PCLS с различными тканевыми слайсерами были опубликованы ранее 32,33,34.- Предварительно охладите металлический охлаждающий блок при -20 °C и держите на льду, когда он не используется на протяжении всей процедуры нарезки.
- Используйте небольшую каплю цианоакрилатного клея, чтобы прикрепить лезвие к держателю лезвия. Осторожно прикрепите держатель лезвия к вибратому с помощью гаечного ключа Аллена, чтобы он просто выровнялся с концом трубки образца, вставленной в буферный лоток.
- Приготовьте 6-луночные пластины по 3 мл на стерильный ледяной HBSS без фенольного красного цвета для сбора ломтиков.
- С помощью скальпеля вырежьте кусочек легочной ткани примерно на 1-1,5см3.
ПРИМЕЧАНИЕ: Легочная ткань из нижней и средней частей левой доли, а также из правой средней и нижней долей, наиболее легко дает более крупные срезы ткани, которые максимизируют альвеолярную площадь. Если присутствуют невоздутые области ткани или участки соединительной ткани, либо обрежьте эту ткань ножницами, либо ориентируйтесь вниз к плунжеру; такая ткань имеет тенденцию не рубиться чисто. - Поместите небольшую каплю цианоакрилатного клея на поршень пробки образца. Нанесите легочную ткань на бумажную салфетку, чтобы удалить лишнюю влагу, а затем сразу же поместите легочную ткань поверх поршня, используя пару щипцов.
- Сдвиньте металлическую трубку образца трубки до уровня верхней части ткани и удерживайте на месте, при этом плунжер отступил. Пипетка предварительно нагревала 2% агарозы в HBSS в верхней части трубки, чтобы полностью окружить ткань.
- Поместите ледяной охлаждающий блок вокруг ткани примерно на 1 мин, чтобы агароза затвердела.
- Вставьте пробку образца в буферный лоток. Заполните лоток ледяным PBS до середины тканевого блока. Поверните переключатель коробки двигателя на быстрый переход вперед (FF), чтобы продвинуть плунжер коробки двигателя так, чтобы он просто касался основания трубки образца.
- Установите требуемые настройки толщины среза, скорости резания и частоты колебаний, например, толщина 450 мкм, скорость 4 и частота колебаний 5. Выберите Непрерывный режим, а затем переверните переключатель в положение Вкл. , чтобы начать нарезку.
- Когда срезы ткани попадут в буферный лоток, переложите их на подготовленные 6-луночные пластины с помощью инокуляционной петли или шпателя.
- Прекратите нарезку, когда в пробке образца остается толщина ткани ~ 2 мм, чтобы избежать повреждения лезвия или разрезания ткани, содержащей клей.
- Повторите вышеуказанные шаги, чтобы разрезать дополнительную легочную ткань по желанию.
- Немедленно децеллюляризуйте ломтики для приготовления каркаса или заморозьте и храните при -80 °C в течение 2 месяцев. Чтобы заморозить, переложите 4-6 ломтиков в чашку Петри 35 мм и тщательно аспирируйте лишнюю жидкость вокруг ломтиков. Поместите посуду в ванну с сухим льдом и 100% этанолом, чтобы заморозить, затем заверните в фольгу, запечатайте в полиэтиленовый пакет и переведите до -80 °C.
ПРИМЕЧАНИЕ: Не помещайте свежие ломтики непосредственно в морозильную камеру с температурой -80 °C, так как относительно медленная скорость замораживания может привести к образованию кристаллов льда, которые могут повредить ткань.
3. Подготовка каркасов легочной ткани
- Подготовка материалов и решений для децеллюляризации
- Рамки автоклава, клипы и вкладки.
- Подготовьте растворы для децеллюляризации, как показано в таблице 1.
ПРИМЕЧАНИЕ: Добавьте нуклеазу бензоназы в предварительно нагретый буфер непосредственно перед использованием и стерильный фильтр. Готовят растворы Triton X-100 и дезоксихолата натрия (SDC) в течение 24-48 ч после процедуры децеллюляризации. Готовят антибиотики/антимикотические растворы и бензоназный буфер до 30 д заранее и хранят при 4 °C.
- Резка и обрезка легочных ломтиков
ПРИМЕЧАНИЕ: В то время как резка и обрезка могут выполняться нестерильно на столешнице, этапы децеллюляризации, описанные в разделе 3.3, и все последующие обработки тканевых каркасов должны выполняться в ламинарной вытяжке.- Заполните 100-миллиметровую чашку Петри примерно на треть, заполненную PBS. Перенесите кассеты (рамки, содержащие по два зажима в каждой) и вкладки на блюдо с помощью щипцов.
- Если вы используете замороженные ломтики, размораживайте по одному блюду за раз, вливая в блюдо PBS комнатной температуры, чтобы покрыть ломтики. Держите оставшуюся посуду на сухом льду.
- Переложите размороженный ломтик на чашку Петри толщиной 150 мм. Аккуратно разверните срез с помощью мелких щипцов, если это необходимо, чтобы он лежал ровно, затем осторожно аспирируйте избыток PBS вокруг ткани.
- Используйте лезвие бритвы с линейкой в качестве направляющей, чтобы вырезать полосу шириной 3 мм из среза, плотно прижав лезвие по всей длине к блюду и слегка покачивая его из стороны в сторону с краем лезвия, удерживаемым на месте. В качестве альтернативы, используйте поворотный резак, модернизированный 2 параллельными лезвиями, разделенными 3-миллиметровой прокладкой (например, изготовленной из ацеталя [полиоксиметилена]), для разрезания полосок ткани. Избегайте любых разрывов, отверстий, больших дыхательных путей или сосудов или толстой соединительной ткани.
ПРИМЕЧАНИЕ: Для успешной обрезки полоса должна иметь длину не менее 9 мм. - С помощью щипцов переложите полоску ткани на приготовленную 100 мм чашку Петри.
- Зажмите полоску ткани в кассету: поместите ткань над кассетой, центрируя ткань, чтобы навесить отверстия в зажимах на обоих концах. Тонкими щипцами поместите вкладку частично в отверстие на одном конце, аккуратно выпрямите ткань, а затем поместите вторую вкладку. Используя щипцы в каждой руке, нажмите на каждую вкладку полностью, чтобы закрепить ткань.
ПРИМЕЧАНИЕ: Если у вас возникли трудности с удержанием ткани на месте перед обрезкой, аспирируйте немного PBS из чашки, чтобы снизить уровень жидкости. Будьте осторожны, чтобы не растянуть ткань при размещении второго зажима, так как это может привести к разрыву. - Повторите процедуру размораживания, разрезания и обрезки на этапах 3.2.2-3.2.6 для необходимого количества тканей.
- Децеллюляризация срезов
- После того, как все ломтики будут обрезаны, перенесите 100-миллиметровую тарелку, содержащую кассеты, на ламинарный вытяжку.
- Начните этап 1 протокола децеллюляризации (см. Таблицу 2): используя изогнутый гемостат для захвата зубчатых сторон каждой кассеты, перенесите кассеты на 6-луночные пластины (2 ткани/лунка), заполненные 3 мл PBS + ионов + антибиотиков / антимикотиков на лунку (см. рецепт раствора в таблице 1).
- Поместите пластины колодца на орбитальный шейкер при 30 об/мин в течение 10 мин.
- Продолжайте с этапом 2 протокола децеллюляризации (см. Таблицу 2): аспирируйте жидкость из каждой скважины, затем замените 3 мл/лунку PBS + ионами, поместите пластину на орбитальный шейкер при 30 об/мин и инкубируйте в течение 5 мин.
- Повторите шаг 3.3.4 для каждого из решений и соответствующих длительностей, как указано в протоколе децеллюляризации в таблице 2.
- После заключительной стадии промывки ПБС+ антибиотиками/антимикотиками (стадия 20 таблицы 2) переносят ткани на стерильные 6-луночные пластины со свежими ПБС+ антибиотиками/антимикотиками и инкубируют при 37 °С в течение 48 ч.
ПРИМЕЧАНИЕ: После стерилизации антибиотиками/антимикотиками каркасы легочной ткани могут быть немедленно посеяны или сохранены при температуре 4 °C в течение до 30 сут.
4. Рецеллюляризация и культивирование срезов
ПРИМЕЧАНИЕ: На рисунке 2 показана предлагаемая временная шкала для посева и культивирования тканей, в которой срезы сначала засевают микрососудистыми эндотелиальными клетками легких крыс и культивируют в эндотелиальной среде с низким содержанием сыворотки; затем засеивают крысиными AEC2s и фибробластами легких крыс с несывороточной питательной средой AEC2 (адаптировано из Jacob et al.13 и You et al.35); Дополнительные примечания об источниках клеток, используемых в разделе Результаты и питательные материалы приведены в таблице 3. Эта стратегия дает альвеолярные структуры, содержащие монослои AEC2.
- Подготовка тканевых каркасов к посеву (день -4 или -3)
- При использовании тканевых каркасов, хранящихся при 4 °C, инкубируйте каркасы в течение ночи при 37 °C со свежими антибиотиками / антимикотиками (10% пенициллина / стрептомицина, 4% амфотерицина B, 0,4% гентамицина в PBS) перед посевом.
- Смойте каркасы 3 раза стерильным PBS (5 мл/лунка), по 5 мин каждый.
- Исследуйте каркасы под фазово-контрастным микроскопом с 5-кратным увеличением, чтобы выбрать ткани для посева.
ПРИМЕЧАНИЕ: Лучшие каркасы для посева не имеют разрывов или отверстий и не содержат больших дыхательных путей или сосудов. В то время как каркасы с признаками могут быть успешно засеяны, модели повторного заселения могут отличаться от тех, которые наблюдаются в альвеолярных областях.
- Посев эндотелиальных клеток (День -3)
- Подсчитайте эндотелиальные клетки с помощью гемоцитометра и приготовьте суспензию эндотелиальных клеток в эндотелиальной среде (см. Таблицу 3) при 5 x 106 клетках/мл, с достаточным количеством клеток для посева 500 000 эндотелиальных клеток на срез (например, для 12 ломтиков, повторное суспендирование 6 x 106 клеток в среде 1,2 мл).
- Поместите автоклавные посевные ванны в 100 мм чашки Петри. Перенесите промытые леса вверх ногами в ванны для посева: используйте тонко изогнутый гемостат, чтобы схватить кассету за зубчатые стороны, используйте прямой гемостат или щипцы, чтобы схватить один конец кассеты (стараясь не коснуться самой ткани) и перевернуть, а затем снова схватить кассету кончиками тонко изогнутого гемостата через отверстия вдоль зубчатых сторон, и поместить в семенную ванну хорошо. Повторите для остальных кассет.
ПРИМЕЧАНИЕ: При правильном размещении строительные леса будут центрированы, вверх ногами, в нижней части каждой скважины. При необходимости осторожно надавите на угол кассеты кончиками гемостата, чтобы кассета была установлена ровно в колодце. Неправильная посадка кассеты может привести к плохому посеву тканей. Это приемлемо, если скважина содержит небольшое количество PBS. - Аккуратно перемешайте приготовленную клеточную суспензию, затем используйте ручную пипетку для пипетки 100 мкл клеток непосредственно поверх каждой ткани у основания лунки, стараясь не повредить ткань кончиком пипетки.
- Перенос семенных тканей в инкубатор клеточных культур при 37 °C/5% CO2.
- Через 2 ч добавьте 900 мкл предварительно нагретой питательной среды в каждую лунку с помощью ручной пипетки, затем верните в инкубатор. Если кассета расстегивается (плавает) при добавлении среды, осторожно надавите на угол кассеты наконечником пипетки так, чтобы она лежала ровно в колодце.
- Смена среды на день -2. Снимите среду, наклонив чашку Петри и вручную пипеткой наконечником пипетки, слегка помещенным в угол колодца, чтобы не потревожить кассету. Заменить 1 мл свежей эндотелиальной среды на лунку.
- AEC2 и посев фибробластов и культура тканей (День 0)
- Подсчитайте AEC2s и фибробласты с помощью гемоцитометра. Приготовьте 1:1-клеточную суспензию AEC2 и фибробластов в питательной среде AEC2 (эпителиальная базовая среда + добавки AEC2; см. Таблицу 3) при 5 x 106 общих клетках/мл, с достаточным количеством клеток для посева 500 000 клеток (250 000 AEC2s и 250 000 фибробластов) на срез (например, для 12 ломтиков, повторно суспендировать 3 x 106 AEC2s + 3 x 106 фибробластов вместе в среде 1,2 мл).
- Выбрасывайте среду из каждого колодца посевной ванны, как описано на этапе 4.2.6. Аккуратно перемешайте приготовленную клеточную суспензию, затем пипетку 100 мкл клеток непосредственно поверх каждой ткани у основания лунки.
ПРИМЕЧАНИЕ: Это приемлемо, если небольшое количество эндотелиальной среды остается в скважине до посева AEC2/фибробластов. - Перенос семенных тканей в инкубатор клеточных культур при 37 °C/5% CO2.
- Через 2 ч добавляют в каждую лунку 900 мкл предварительно нагретой питательной среды AEC2, затем возвращают в инкубатор.
- Через 24 ч культуры (день 1) готовят 12-луночную пластину с 1 мл предварительно нагретой питательной среды AEC2 на лунку на кассету.
- Пипетка 800 мкл среды из каждой лунки посевной ванны. Извлеките кассеты из посевной ванны: захватите каждую из них тонким изогнутым гемостатом через отверстия вдоль зубчатых сторон, переведите на прямой гемостат или щипцы, чтобы схватить кассету на одном конце и перевернуть, затем используйте изогнутый гемостат, чтобы захватить кассету через зубчатые стороны и перенесите правую сторону вверх, по одной на лунку, на подготовленную 12-луночную пластину.
- Меняйте культуральную среду в 12-луночной тарелке через день до 7 дня или на нужную длину культуры: используйте стеклянную пипетку Пастера для аспирации среды из каждой лунки, стараясь не прикасаться к ткани; пипетка в 1 мл свежей питательной среды AEC2 на лунку.
ПРИМЕЧАНИЕ: Степень репопуляции тканей может контролироваться с помощью фазово-контрастной микроскопии при 5-кратном увеличении на протяжении всего периода культивирования.
5. Сбор ткани и анализ образцов
- Для фиксации ЭЛТ для гистологического и иммунофлуоресцентного окрашивания переносят кассеты культуры тканей на 10% нейтрально-буферизованный формалин и инкубируют в течение 3-4 ч при комнатной температуре на коромысле. Удалите ткани из кассет, используя кончик мелкоконечных щипцов, чтобы разрезать ткань там, где она встречается с вкладками. Обработка тканей по рутинным методам встраивания парафина и гистологии; никаких специализированных методов не требуется.
- Чтобы обработать ELT для qRT-PCR, промойте ткани в кассетах в PBS 2x, затем удалите ткани и заморозьте или приступайте к лизису для экстракции РНК.
ПРИМЕЧАНИЕ: Объединение по крайней мере 2 ломтиков, засеянных 1 х 106 клетками и культивируемых в течение 7 дней, должно дать достаточно РНК для последующего анализа ПЦР.
Результаты
Обзор процесса создания ELT, включающего нарезку легких, обрезание и децеллюляризацию срезов, а также репопуляцию каркасов, представлен на рисунке 3. ПРЕДСТАВЛЕННЫЕ здесь ELT культивировали с использованием первичных микрососудистых эндотелиальных клеток легких крыс (см. Таблицу материалов), AEC2 неонатальных крыс и обогащенных липофибробластами неонатальных фибробластов легких крыс36. AEC2 были недавно выделены с помощью магнитной сортировки на основе шариков, как описано ранее37; альтернативные протоколы изоляции были подробно описаны и обсуждены в другом месте 38,39,40. Чистота изолированных крыс AEC2s может быть оценена с помощью проточной цитометрии для крысиного поверхностного маркера AEC2 RTII-7041 или путем окрашивания образца цитоцентрифугированной клетки для RTII-70 или профрактантного белка C (pSPC). Фибробласты легких крыс выделяли из детенышей крыс на 7-9-й день в соответствии с адаптацией опубликованного протокола42 и использовали при прохождении 1-2; альтернативные протоколы изоляции были описаны в других местах43,44. Чистота изолированных фибробластов может быть оценена путем окрашивания культивируемых или цитоцентрифугированных клеток для мезенхимального маркера виментина, а обогащение липофибробластов может быть оценено путем окрашивания для Oil Red O45.
Когда легочная ткань равномерно раздувается агарозой, а кусочки ткани стратегически подобраны и ориентированы на нарезку таким образом, чтобы максимизировать общую и паренхиматозную площадь ткани, одно легкое крысы может дать ткань для альвеолярных ELT >100. Полоски PCLS демонстрируют достаточную механическую целостность, чтобы быть обрезанными в тканевые кассеты с небольшим количеством (<5%) случаев разрыва (рисунок 3B).
Протокол децеллюляризации срезов легких тесно связан с нашим ранее опубликованным протоколом децеллюляризации всего легкого, который, как было продемонстрировано количественной протеомикой, сохраняет многие компоненты ECM на уровнях, существенно не отличающихся от уровней в нативном легком22. Децеллюляризованные каркасы срезов сохраняют естественную архитектуру альвеол, что видно по окрашиванию гематоксилином и эозином (H &E) (рисунок 4A, B) и фазовой контрастной микроскопии (рисунок 4C). Обычно мы исключаем каркасы, содержащие большие дыхательные пути или сосуды (рисунок 4D) или разрывы, хотя первые могут быть включены, если они представляют интерес для исследователя. Децеллюляризация приводит к снижению содержания ДНК в тканях на 96%, измеренному анализом для двухцепочечной ДНК (см. Таблицу материалов; 0,50 мкг/мг ± 0,073 мкг/мг против 0,018 мкг/мг ± 0,0035 мкг/мг в нативной и децеллюляризированной ткани, соответственно, среднее ± SEM) (Рисунок 5A), при этом ДНК не видна при окрашивании гематоксилином (Рисунок 4B). Гистологическое и иммунофлуоресцентное окрашивание децеллюляризованных каркасов выявляет поддержание белков ECM коллагена, эластина, коллагена IV и ламинина с архитектурой и количеством, аналогичным таковым в нативных срезах легких (рисунок 5B-E). Обратите внимание, что ядра нативных тканей окрашиваются в синий/черный цвет с трихомными (для коллагена) и EVG (для эластина) пятнами. Иммунофлуоресцентное окрашивание выполняли, как описано ранее, с использованием стандартных методов окрашивания тканей37. Используемые антитела и их соответствующие концентрации перечислены в таблице 4.
Успешная репопуляция каркаса приводит к высококлеточным ЭЛТ через 7 дней, с альвеолярной картиной репопуляции, видимой с помощью световой микроскопии (рисунок 6A-C). В некоторых случаях при очень высокой клеточности могут быть видны структуры органоидного типа (рисунок 6A,B). Неудачный посев тканей можно визуализировать с помощью фазово-контрастной микроскопии во время посева (рисунок 6С). После культивирования тканевых каркасов с AEC2s, фибробластами и эндотелиальными клетками, ELT плотно заселяют альвеолярными структурами, включающими все три клеточные линии (рисунок 6D, E). На 7 или 8 день AEC2s сохраняют кубоидальную морфологию и экспрессируют сурфактантный белок-B (SPB) и ламеллярный белок тела ABCA3, без признаков значительной дифференцировки к AEC1s (рисунок 6E, F). AEC2 являются высокопролиферативными в ELT, о чем свидетельствует включение 5-этинил-2'-дезоксиуридина (EdU) после 2-часового импульса при 10 мкМ (рисунок 6G).
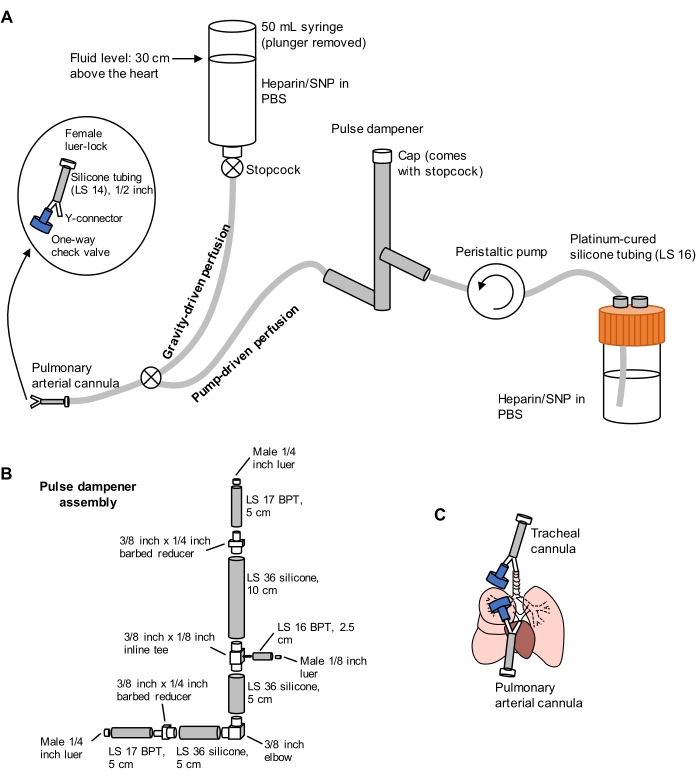
Рисунок 1: Схема перфузионной системы для извлечения и очистки легких. (А) Перфузионная система содержит гравитационную конечность, используемую для начальной канюляции легочной артерии под потоком; и конечность с насосным приводом, используемая для эффективного очищения легких после первоначальной канюляции. Насосная линия включает в себя «импульсный демпфер», который гасит скачки давления, вызванные насосом. Конструкция трахеальных и легочных артериальных канюль детализирована слева. SNP = нитропруссид натрия. (B) Детали импульсного демпфера в сборе. BPT и силикон относятся к типам трубок. (C) Положения трахеальных и легочных артериальных канюль, помещенных во время извлечения легких. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Временная шкала культуры для трехлинейной рецеллюляризации. Предлагаемая временная шкала для трехлинейного посева и культивирования ELT, включая сроки двухфазного посева. Указаны номера клеток для посева и питательной среды для каждой фазы. Подробные сведения о питательных средах приведены в таблице 3. AEC2 = альвеолярная эпителиальная клетка типа 2. EC = эндотелиальная клетка. FB = фибробласт. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
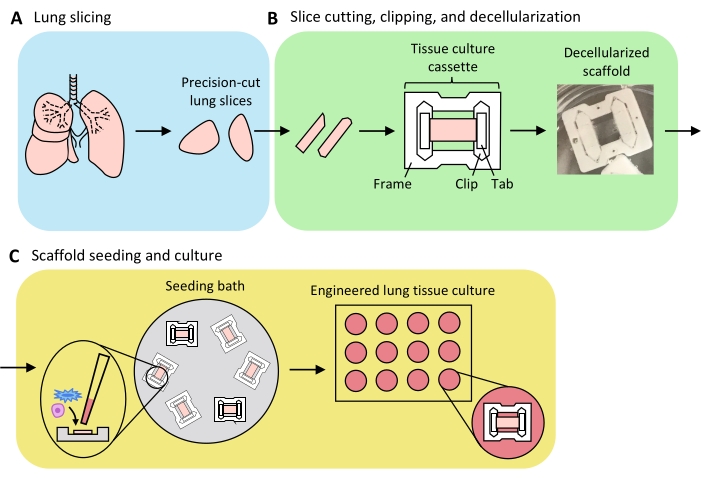
Рисунок 3: Схема инженерного препарата легочной ткани. (А) Нативная легочная ткань разрезается на срезы с помощью вибратома. (B) Прецизионно разрезанные срезы легких разрезаются на стандартизированные полоски шириной 3 мм, обрезаются в пластинафторэтиленовые (PTFE) тканевые кассеты и детергент-децеллюляризируются для получения бесклеточных внеклеточных матричных каркасов. (C) Каркасы пересеивают в специализированные посевные ванны, которые ограничивают площадь посева областью ткани, а затем культивируют в стандартной колодце. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
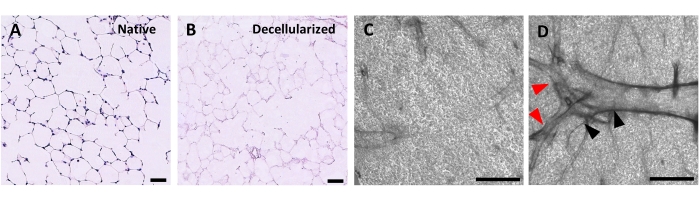
Рисунок 4: Структура децеллюляризованных каркасов легких. H&E окрашивание нативных (A) и децеллюляризированных (B) срезов легких, показывающее сохранение альвеолярной архитектуры после децеллюляризации. (С,Г) Примеры децеллюляризированных каркасов ECM, рассматриваемых при 5-кратном увеличении с помощью фазово-контрастной микроскопии, содержащих преимущественно альвеолярную ткань (C) или содержащих крупные разветвленные дыхательные пути и сосуды (D, черные и красные наконечники стрел). Шкала стержней, 50 мкм (A,B); 500 мкм (C,D). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
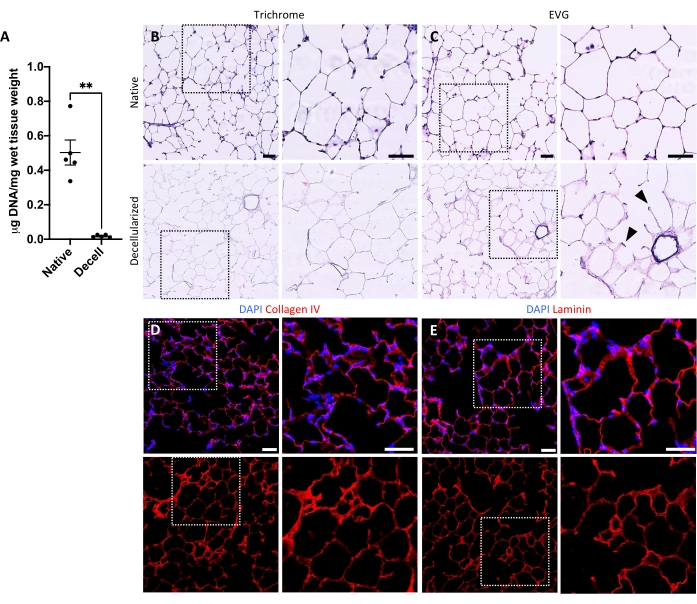
Рисунок 5: Удаление ДНК и сохранение матрицы в децеллюляризованных каркасах легких. (A) Количественная оценка ДНК в нативных и децеллюляризованных срезах легких (среднее ± SEM, n = 5). Тест Уэлча t , **P < 0,01. Decell = децеллюляризированный. (В,С) Гистологическое окрашивание нативных и децеллюляризованных срезов легких на коллаген (В) и эластин (С). Наконечники стрел, эластин сохранился в альвеолярных входных кольцах децеллюляризированной ткани. (Д,Д) Иммунофлуоресцентное окрашивание нативных и децеллюляризованных срезов легких на коллаген IV (D) и ламинин (E). Шкала стержней, 50 мкм. На всех панелях пунктирные поля обрисовывают область изображения, которая увеличивается вправо на каждой соответствующей панели. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Клеточная репопуляция инженерных тканей легких. (А-С) Примеры рецеллюляризованных ЭЛТ на 7 день культивирования, визуализируемые во время культивирования с помощью фазовой контрастной микроскопии. Паттерн рецеллюляризации отражает альвеолярную структуру ткани. В некоторых областях высокой клеточности могут образовываться органоидоподобные структуры (наконечники стрел). (A) и (B) представляют собой успешную репопуляцию клеток, тогда как (C) представляют собой низкий уровень рецеллюляризации после 7 дней культивирования. (Д-Г) Окрашивание рецеллюляризованных ЭЛТ на 7 или 8 день посева. (D) Окрашивание H&E, показывающее клеточную репопуляцию альвеолярных перегородок. (E) Иммунофлуоресцентные окрашивающие этикетки приживляют фибробласты proCollagenIα1+ , ABCA3+ AEC2s и CD31+ эндотелиальные клетки. (F) Ткани содержат обильные SPB + AEC2, но мало RTI-40 (подопланин) + AEC1 в этих условиях. (G) Многие AEC2 распространяются в ELT, что измеряется включением EdU. Шкала стержней, 500 мкм (A-C); 25 мкм (D-G). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Решения для децеллюляризации. Детали подготовки к растворам для децеллюляризации. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Протокол децеллюляризации. Детали протокола децеллюляризации срезов легких. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 3: Питательные среды. Сведения о препаратах для эндотелиальных и AEC2 питательных сред. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 4: Антитела, используемые для иммуноокрашивания. Сведения об антителах и их концентрациях, используемых для иммуноокрашивания. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительный файл 1: Дизайн для лазерной резки кассетных рамок для культуры тканей. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Конструкция для лазерной резки кассетных зажимов для культуры тканей. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 3: Конструкция для лазерной резки тканевых культур кассетных вкладок. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 4: CAD файл для посева основания формы ванны. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 5: CAD файл для посева кольца формы ванны. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В этой статье описывается использование децеллюляризированных прецизионных срезов легких в качестве платформы для создания инженерных легочных тканей in vitro, которые содержат многолинейные альвеолярные структуры. Комбинируя стратегии, которые мы ранее разработали для повторного заселения высокоточных бесклеточных каркасов легких ECM для всей легочной инженерии22,31, с нашей надежной системой культивирования мелкомасштабных инженерных тканей сердца30, этот протокол позволяет использовать физиологически релевантный ECM легких в качестве субстрата культуры тканей повторяемым и умеренно-пропускным способом.
Методы, представленные здесь, детализируют подготовку каркаса ELT из легких крыс, которые легко достижимы, могут быть извлечены блоком с прямым доступом к интактным дыхательным путям для инфляции агарозы и имеют больший размер, чем легкие мыши. Однако любая легочная ткань, которая может быть раздута агарозой и дает срезы длиной не менее 9 мм, может быть использована в этой системе. Независимо от источника ткани, равномерное раздувание легочной ткани с агарозой является наиболее важным шагом для обеспечения успеха последующего нарезки тканей, клипирования и обработки тканей. Недодутая легочная ткань, как правило, не разрезается чисто, в то время как перекачанная ткань может порваться во время клипирования. После гелеобразования агарозы соответствующим образом раздутые участки ткани становятся твердыми, но обеспечивают небольшую отдачу при мягком надавливании щипцами. Для интактных легких крыс мы обнаружили, что предварительное раздувание извлеченных легких воздухом несколько раз с последующим напылением агарозы как можно скорее после экстракции приводит к лучшим результатам нарезки и лучшему качеству полученных тканевых каркасов. Соответствующий объем агарозы нуждается в эмпирической оптимизации; для легкого крысы объем, необходимый для раздувания легкого до общей емкости легкого, составляет приблизительно 30 мл / кг массы животных (например, 10,5 мл агарозы для легких от крысы весом 350 г). Для более крупных резецированных легочных тканей с менее простым доступом к дыхательным путям (например, от доноров-людей) может потребоваться некоторое дополнительное устранение неполадок для раздувания ткани через бронх32. Во время последующей нарезки легких выбор и ориентация ткани на плунжере является еще одним важным шагом для 1) обеспечения того, чтобы срезы были достаточно большими, чтобы генерировать полоски ткани, которые могут быть обрезаны в кассеты культуры тканей и 2) максимизировать паренхиматозную (альвеолярную) область ткани, исключая крупные дыхательные пути или сосуды.
Обрезание PCLS в кассеты культуры тканей может быть сложным этапом на начальном этапе, но кассеты значительно упрощают обработку тканей во время децеллюляризации и посева. Двумя потенциальными проблемами, которые могут возникнуть, являются разрыв ткани (либо в процессе обрезки, либо во время децеллюляризации), или позиционирование ткани в клипсах, что приводит к плохому посеву вниз по течению (например, отсутствие посева или посев только на концах). Разрыв может быть результатом чрезмерной агарозы, перерастяжения ткани во время вставки вкладки или оставления слишком небольшого свеса, чтобы обеспечить адекватное сцепление ткани при вставке вкладок. Обратите внимание, что срезы, которые разрываются на одном конце зажима, могут быть успешно засеяны, однако их трудно визуализировать под микроскопом во время культивирования, так как ткань не плоская. Плохой посев тканей (например, на рисунке 6C), вероятно, является результатом того, что срез не лежит плоско между двумя зажимами и, таким образом, плохо контактирует с основанием посевной ванны при переворачивании вверх дном. Еще одной возможной причиной является неправильное размещение кассеты в нижней части колодца для посева ванны. С точки зрения обрезки, примените немного больше напряжения в ткани при размещении второго зажима, чтобы помочь ему лежать ровно. Некоторые срезы имеют небольшую вогнутость; в этих случаях обрежьте фрагмент выпуклой стороной вверх. С практикой мы обычно испытываем неудачный посев с менее чем 2% ломтиков.
Одним из ограничений этого протокола является требование к некоторому специализированному оборудованию - лазерному резаку и 3D-принтеру - для генерации исходных материалов для подготовки к ELT. Однако, как только кассеты для посева тканей и семенные ванны созданы, никаких дополнительных специальных материалов не требуется. Этапы нарезки легких и децеллюляризации препарата ELT являются умеренно трудоемкими; однако эти шаги могут быть выполнены заранее или в количестве, достаточном для подготовки к нескольким экспериментам одновременно. Многие PCLS (>100, если оптимизированы для паренхиматозных областей) могут быть вырезаны из одного легкого и заморожены для последующего использования. В то время как один цикл замораживания-оттаивания может привести к незначительным ультраструктурным повреждениям ECM46, было продемонстрировано, что даже несколько циклов замораживания-оттаивания не вызывают значительных потерь в ECM 23,47. PCLS также может быть обрезан и децеллюляризирован до начала эксперимента, который будет использоваться в течение одного месяца. (Примечательно, что описанный протокол децеллюляризации может быть выполнен примерно за 6 часов, что представляет собой значительное преимущество перед ранее описанными методами, которые требуют суток или более 27,28.) После того, как каркасы подготовлены, процесс посева клеток прост и быстр, а культивирование ELT не требует специализированных методов.
Предостережением описанного метода ELT является отсутствие регионально-специфического посева, т.е. доставки AEC2s конкретно в альвеолярное пространство, или эндотелиальные клетки конкретно в сосудистое пространство. Тем не менее, хотя клетки просто засеяны поверх тканевых каркасов, картина рецеллюляризации неслучайна, с некоторым подобием альвеолярной организации, включая эпителиальные кольца. Мы подозреваем, что клеточно-клеточные взаимодействия, а также локальные различия в составе и геометрии ECM20,21, вероятно, способствуют наблюдаемым паттернам рецеллюляризации. В поддержку этой гипотезы ранее опубликованное исследование, в котором фибробласты были посеяны неспецифически на децеллюляризованные срезы легких, продемонстрировало, что картина репопуляции тканей и связанные с ней клеточные фенотипы значительно различаются в зависимости от микроскопической области ткани и источника каркаса ECM (например, здоровый и больной)27. Также наблюдалось, что фибробласты вторгаются в интерстиций - место, в котором они находятся в нативнойлегочной ткани 1,27. Основной альтернативный метод, который мы можем себе представить для культивирования клеток на срезах легких действительно специфичным для региона способом, повлечет за собой посев неповрежденных децеллюляризованных легких через дыхательные пути31,48 и сосудистые компартменты49,50, а затем разрезание рецеллюляризированной ткани. Однако эта альтернатива 1) значительно более затратная, трудоемкая и ресурсоемкая; 2) имеет меньшую пропускную способность; 3) требует увеличения численности животных; и 4) связано с повышенным риском загрязнения из-за проблем с культурой целых легких и последующей нарезкой семенного легкого. Не повторяя все аспекты нативной клеточной организации, платформа ELT позволяет культивировать клетки легких на физиологически значимом субстрате ECM таким образом, чтобы это было доступно для многих других лабораторий.
Гибкость системы ELT является основным преимуществом этой платформы и должна позволять проводить мелкомасштабную культуру легочной ткани с любым количеством тканевых каркасов, клеток или культуральных сред, представляющих интерес. Использование каркасов, полученных из пораженной ткани или из моделей повреждения, может позволить изучить взаимодействия клетки-клетки или клетки-матрицы в условиях измененного заболеванием ECM 27,29,51. Однако обратите внимание, что протокол децеллюляризации, возможно, потребуется адаптировать для учета матричных различий между видами52. Описанная стратегия посева может быть использована для любого типа клеток, а временная шкала культуры адаптирована к потребностям исследователя. В качестве отправной точки 1 х 106 клеток на каркас должны дать высококлеточную ткань в течение 7 дней после культивирования, тогда как 1 х 105 общих клеток приводят к плохой клеточности. При любой адаптации временной шкалы кассеты тканевых культур должны быть удалены из посевной ванны через 24 ч после последнего посева ткани. Здесь, с целью моделирования некоторой клеточной сложности альвеолы легких, мы описываем стратегию рецеллюляризации трехкультур, которая поддерживает поддержание хорошо дифференцированных неонатальных AEC2s в альвеолярных структурах в течение не менее 7 дней. Наши результаты также демонстрируют успешное приживление как фибробластов, так и эндотелиальных клеток в ELT, подчеркивая широкую применимость субстрата культуры и его пригодность для совместных исследований культур. Посев взрослых клеток в ELT может облегчить моделирование более спокойных альвеолярных структур, в то время как посев AEC2, полученных из PSC человека, в том числе с генетическими модификациями, может облегчить трансляционные исследования заболеваний человека13,53. В целом, подход «снизу вверх», поддерживаемый платформой ELT, предоставляет возможность исследовать вклад конкретных типов клеток в считывание, представляющее интерес, такое как пролиферация AEC2 или состояние дифференцировки.
Таким образом, этот протокол описывает надежную систему для генерации инженерных легочных тканей для совместных исследований AEC2s, фибробластов и эндотелиальных клеток в бесклеточных каркасах среза легких ECM. ELT представляют собой новую стратегию 3D-культуры для первичных AEC2, которые на сегодняшний день обычно полагаются на менее физиологические матрицы гелевого типа для поддержания хорошо дифференцированного фенотипа 6,11,12. Текущая платформа основывается на предыдущей работе по репопуляции децеллюляризированных срезов легких 24,25,26,27,28,29, но предлагает несколько преимуществ: 1) кассетную систему тканевой культуры для облегчения обработки ELT во время децеллюляризации, посева и культивирования; 2) индивидуальная посевная ванна для точного засева известного количества клеток на каждом срезе каркаса; и 3) стратегия повторного посева трехкультур, которая позволяет альвеолярной ткани повторно заселяться эпителиальными, мезенхимальными и эндотелиальными клетками. Таким образом, ELT представляют собой важный шаг вперед на пути к созданию воспроизводимых моделей in vitro, которые охватывают клеточную и субстратную сложность нативной альвеолы и ниши стволовых клеток AEC2.
Раскрытие информации
L.E.N. является основателем и акционером Humacyte, Inc, которая является компанией регенеративной медицины. Хумацит производит инженерные кровеносные сосуды из аллогенных гладкомышечных клеток для сосудистой хирургии. Супруга L.E.N. имеет долю в Humacyte, а L.E.N. входит в Совет директоров Humacyte. Л.Е.Н. является изобретателем патентов, которые лицензированы для Humacyte и которые производят роялти для L.E.N. L.E.N. получила неограниченный исследовательский подарок для поддержки исследований в своей лаборатории в Йельском университете. Хумацит не повлиял на поведение, описание или интерпретацию выводов, содержащихся в настоящем докладе.
Благодарности
Авторы хотели бы поблагодарить Лоренцо Севанана и Хорхе Нуньеса за их работу по разработке конструкции кассеты тканевой культуры, используемой в этом протоколе, лабораторию Камински за использование их вибратома, Маурицио Кьоччоли и Джессику Ноус за помощь в нарезке легких, Элли ЛаРокко за помощь в первоначальных пилотных экспериментах и Хун Цяня за внимательное чтение протокола. Эта работа была поддержана грантами NIH F30HL143880 (K.L.L.), грантом программы подготовки ученых-медиков T32GM136651 (K.L.L.) и U01HL145567 (L.E.N.); и неограниченным исследовательским подарком от Humacyte Inc. (L.E.N.).
Материалы
| Name | Company | Catalog Number | Comments |
| 3D Printer: Form 2 | Formlabs | ||
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | |
| 8-Bromo cAMP | Sigma | B7880 | |
| Agarose, UltraPure LMP | Invitrogen | 15517-014 | |
| Amphotericin B | Sigma | A2942 | |
| Barbed reducer fitting, 3/8 inch x 1/4 inch | McMaster-Carr | 5121K271 | |
| Benzonase nuclease | Sigma | E1014 | |
| Bovine serum albumin (BSA) Fraction V | Gemini | 700-104P | For AEC2 growth medium |
| Bovine serum albumin (BSA), standard grade | Gemini | 700-100P | For benzonase buffer |
| Check valve, polypropylene, 1/8 inch hose barb | Cole-Parmer | SK-98553-10 | |
| CHIR99021 | PeproTech | 2520691 | |
| Clear Resin, 1 L | Formlabs | RS-F2-GPCL-04 | |
| Cyanoacrylate glue, such as Krazy Maximum Bond Permanent Glue | Any hardware, craft, or drug store | KG483 or similar | |
| Dexamethasone | Sigma | D4902 | |
| DMEM (low glucose) | Gibco | 11885-084 | |
| DMEM (high glucose) | Gibco | 11965-092 | |
| DNA assay (Quant-iT PicoGreen dsDNA Assay Kit) | Invitrogen | P7589 | |
| EDTA, 0.5 M, pH 8.0 | AmericanBio | AB00502-01000 | |
| EdU kit (Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647) | Invitrogen | C10340 | Used according to manufacturer's directions |
| Elbow fitting, 3/8 inch | McMaster-Carr | 5121K907 | |
| F12 | Gibco | 11765-054 | |
| Fetal bovine serum (FBS), characterized | Hyclone | SH30071.03 | |
| Gentamicin sulfate | Gemini | 400-100P | Reconstituted in diH2O for a stock solution at 50 mg/mL |
| Hair clippers | Wahl | MiniArco | |
| Hank's balanced salt solution (HBSS), Phenol Red Free | Gibco | 14175-095 | |
| Heparin sodium injection, USP, 1000 U/mL | Sagent | NDC: 25021-400-30 | For intraperitoneal and intracardiac injection |
| Heparin sodium salt | Sigma | H4784 | For pulmonary artery perfusion; prepare stock solution at 100 U/mL in PBS |
| HEPES Buffer | Corning | 25-060-Cl | |
| Inline tee fitting, 3/8 inch x 1/8 inch | McMaster-Carr | 5121K851 | |
| Inoculating loop, disposable | Fisherbrand | 22-363-600 | |
| Insulin from bovine pancreas | Sigma | I6634 | |
| Ketamine injection, 100 mg/mL | Covetrus (Butler Animal Health) | 010177 | |
| KGF, recombinant human | PeproTech | 100-19 | |
| Laser cutter, VLS 3.50 30 watt | Universal Laser Systems | ||
| L-glutamine | Gibco | 25030-081 | |
| Luer-lock, female, 3/32 inch | Cole-Parmer | 45508-02 | |
| Luer-lock, male, 1/8 inch | Cole-Parmer | 30800-24 | |
| Luer-lock, male, 1/4 inch | McMaster-Carr | 51525K146 | |
| MCDB-131 Complete without serum | VEC Technologies | MCDB-131 WOFBS | |
| Magnesium chloride (MgCl2), 1 M | AmericanBio | AB09006-00100 | |
| NaCl | American Bioananalytical | AB01915 | |
| Phosphate buffered saline (PBS), without Ca2+ and Mg2+, 10X | Sigma | D1408 | Reconstitute to 1X with diH2O |
| Phosphate buffered saline (PBS), with Ca2+ and Mg2+ | Gibco | 21300-058 | |
| PDMS - SYLGARD 184 Silicone Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Penicillin/Streptomycin (10,000 U/mL penicillin/10,000 μg/mL streptomycin) | Gibco | 15140-122 | |
| Petri dish, 150 mm | Falcon | 351058 | |
| Plastic film (parafilm) | Bemis | PM-996 | |
| Pharmed BPT tubing, LS 16 | Masterflex | 06508-16 | |
| Pharmed BPT tubing, LS 17 | Masterflex | 06508-17 | |
| Platinum-cured silicone tubing, LS 14 | Masterflex | 96420-14 | |
| Platinum-cured silicone tubing, LS 16 | Masterflex | 96420-16 | |
| Platinum-cured silicone tubing, LS 36 | Masterflex | 96410-36 | |
| Poloxamer 407 (Pluronic F-127) | Sigma | P2443 | |
| Povidone/iodine prep pads, 10% | Dynarex Corporation | 1108 | |
| PTFE sheet, 0.060 inch (1/16 inch) thick | ePlastics | PTFENAT0.060X12X12 | For tissue culture cassette tabs |
| PTFE sheet, 0.093 inch (3/32 inch) thick | ePlastics | PTFENAT0.093X12X12 | For tissue culture cassette frames and clips |
| Peristaltic pump drive: Masterflex L/S Variable-Speed Digital Drive | Cole-Parmer | ZM-07528-30 | |
| Peristaltic pump head: Masterflex L/S Easy-Load II Pump Head | Cole-Parmer | EW-77202-60 | |
| Rat, Sprague Dawley | Charles River | Strain Code: 400 | |
| Razor blade | Any hardware or craft store | Personna 94-120-71 or similar | |
| Retinoic acid | Sigma | R2625 | |
| Rotary blades, 28 mm | Omnigrid | 2046 | |
| Rotary cutter, 28 mm | Olfa | Model 9551 | |
| Sodium deoxycholate (SDC) | Sigma | D6750 | |
| Sodium nitrorusside (SNP) | Sigma | 71778 | |
| Stopcock, 4-way | Edwards | 594WSC | |
| Suture, 4-0 monofilament polypropylene | Covidien | VP-557-X | |
| Syringe, 10 mL | BD | 302995 | |
| Syringe, 50 mL | BD | 309653 | |
| Tissue culture dish, 35 mm | Falcon | 353001 | |
| Tissue culture dish, 100 mm | Corning | 430167 | |
| Tissue culture plate, 6-well | Falcon | 353046 | |
| Tissue culture plate 12-well | Falcon | 353043 | |
| Transferrin human | Sigma | T8158 | |
| Tris, 1 M solution, pH 8.0 | AmericanBio | AB14043-01000 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| Vibratome, Compresstome VF-300-0Z | Precisionary Instruments LLC | ||
| Xylazine, 100 mg/mL | Henry Schein | NDC: 11695-4022-1 | |
| Y-connector, 1/16 inch barbed | Cole-Parmer | 30614-43 |
Ссылки
- Burri, P. H. Morphology and respiratory function of the alveolar unit. International Archives of Allergy and Applied Immunology. 76, Suppl 1 2-12 (1985).
- Barkauskas, C. E., Noble, P. W. Cellular Mechanisms of Tissue Fibrosis. 7. New insights into the cellular mechanisms of pulmonary fibrosis. American Journal of Physiology. Cell Physiology. 306 (11), 987-996 (2014).
- Taylor, M. S., et al. A Conserved Distal Lung Regenerative Pathway in Acute Lung Injury. American Journal of Pathology. 188 (5), 1149-1160 (2018).
- Carsana, L., et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infectious Diseases. 20 (10), 1135-1140 (2020).
- Basil, M. C., et al. The Cellular and Physiological Basis for Lung Repair and Regeneration: Past, Present, and Future. Cell Stem Cell. 26 (4), 482-502 (2020).
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Desai, T. J., Brownfield, D. G., Krasnow, M. A. Alveolar progenitor and stem cells in lung development, renewal and cancer. Nature. 507 (7491), 190-194 (2014).
- Evans, M. J., Cabral, L. J., Stephens, R. J., Freeman, G. Renewal of alveolar epithelium in the rat following exposure to NO2. The American Journal of Pathology. 70 (2), 1-24 (1973).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Borok, Z., et al. Keratinocyte growth factor modulates alveolar epithelial cell phenotype in vitro: expression of aquaporin 5. American Journal of Respiratory Cell and Molecular Biology. 18 (4), 554-561 (1998).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Sucre, J. M. S., et al. Successful establishment of primary Type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Stem Cell. 21 (4), 472-488 (2017).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nature Methods. 14 (11), 1097-1106 (2017).
- Chen, Y. W., et al. A three-dimensional model of human lung development and disease from pluripotent stem cells. Nature Cell Biology. 19 (5), 542-549 (2017).
- Korogi, Y., et al. In vitro disease modeling of hermansky-pudlak syndrome Type 2 using human induced pluripotent stem cell-derived alveolar organoids. Stem Cell Reports. 12 (3), 431-440 (2019).
- Strikoudis, A., et al. Modeling of fibrotic lung disease using 3D organoids derived from human pluripotent stem cells. Cell Reports. 27 (12), 3709-3723 (2019).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Chapman, H. A. Epithelial responses to lung injury: Role of the extracellular matrix. Proceedings of the American Thoracic Society. 9 (3), 89-95 (2012).
- Guilak, F., et al. Control of stem cell fate by physical interactions with the extracellular matrix. Cell Stem Cell. 5 (1), 17-26 (2009).
- Zhou, Y., et al. Extracellular matrix in lung development, homeostasis and disease. Matrix Biology. 73, 77-104 (2018).
- Calle, E. A., et al. Targeted proteomics effectively quantifies differences between native lung and detergent-decellularized lung extracellular matrices. Acta Biomaterialia. 46, 91-100 (2016).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Bonvillain, R. W., et al. A nonhuman primate model of lung regeneration: Detergent-mediated decellularization and initial in vitro recellularization with mesenchymal stem cells. Tissue Engineering Part A. 18 (23-24), 2437-2452 (2012).
- O'Neill, J. D., et al. Decellularization of human and porcine lung tissues for pulmonary tissue engineering. The Annals of Thoracic Surgery. 96 (3), 1055(2013).
- Wagner, D. E., et al. Three-dimensional scaffolds of acellular human and porcine lungs for high throughput studies of lung disease and regeneration. Biomaterials. 35 (9), 2664-2679 (2014).
- Burgstaller, G., et al. Distinct niches within the extracellular matrix dictate fibroblast function in (cell free) 3D lung tissue cultures. American Journal of Physiology-Lung Cellular and Molecular Physiology. 314 (5), 708-723 (2018).
- Sun, H., et al. Fibroblast engraftment in the decellularized mouse lung occurs via a β1-integrin-dependent, FAK-dependent pathway that is mediated by ERK and opposed by AKT. American Journal of Physiology-Lung Cellular and Molecular Physiology. 306 (6), 463-475 (2014).
- Booth, A. J., et al. Acellular normal and fibrotic human lung matrices as a culture system for in vitro investigation. American Journal of Respiratory and Critical Care Medicine. 186 (9), 866-876 (2012).
- Schwan, J., et al. Anisotropic engineered heart tissue made from laser-cut decellularized myocardium. Scientific Reports. 6, 32068(2016).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Gerckens, M., et al. Generation of Human 3D Lung Tissue Cultures (3D-LTCs) for Disease Modeling. Journal of Visualized Experiments. (144), (2019).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465(2017).
- Neuhaus, V., et al. Assessment of the cytotoxic and immunomodulatory effects of substances in human precision-cut lung slices. Journal of Visualized Experiments. (135), e57042(2018).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (6), 1315-1321 (2002).
- Vaccaro, C., Brody, J. S. Ultrastructure of developing alveoli. I. The role of the interstitial fibroblast. The Anatomical Record. 192 (4), 467-479 (1978).
- Calle, E. A., et al. Fate of distal lung epithelium cultured in a decellularized lung extracellular matrix. Tissue Engineering Part A. 21 (11-12), 1916-1928 (2015).
- Dobbs, L. G., Gonzalez, R., Williams, M. C. An improved method for isolating type II cells in high yield and purity. American Review of Respiratory Disease. 134 (1), 141-145 (1986).
- Dobbs, L. G. Isolation and culture of alveolar type II cells. American Journal of Physiology. 258, 134-147 (1990).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Dobbs, L. G., Pian, M. S., Maglio, M., Dumars, S., Allen, L. Maintenance of the differentiated type II cell phenotype by culture with an apical air surface. The American Journal of Physiology. 273 (2), 347-354 (1997).
- Bruce, M. C., Honaker, C. E. Transcriptional regulation of tropoelastin expression in rat lung fibroblasts: changes with age and hyperoxia. American Journal of Physiology. 274 (6), 940-950 (1998).
- Berk, J. L., Franzblau, C., Goldstein, R. H. Recombinant interleukin-1 beta inhibits elastin formation by a neonatal rat lung fibroblast subtype. Journal of Biological Chemistry. 266 (5), 3192-3197 (1991).
- Schultz, C. J., Torres, E., Londos, C., Torday, J. S. Role of adipocyte differentiation-related protein in surfactant phospholipid synthesis by type II cells. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (2), 288-296 (2002).
- Maksvytis, H. J., et al. In vitro characteristics of the lipid-filled interstitial cell associated with postnatal lung growth: evidence for fibroblast heterogeneity. Journal of Cellular Physiology. 118, 113-123 (1984).
- Hopkinson, A., et al. Optimization of amniotic membrane (AM) denuding for tissue engineering. Tissue Engineering Part C: Methods. 14 (4), 371-381 (2008).
- Fernandez-Perez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Scientific Reports. 9 (1), 14933(2019).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nature medicine. 16 (8), 927-933 (2010).
- Le, A. V., et al. Efficient and Functional Endothelial Repopulation of Whole Lung Organ Scaffolds. ACS Biomaterials Science & Engineering. 3 (9), 2000-2010 (2017).
- Ren, X., et al. Engineering pulmonary vasculature in decellularized rat and human lungs. Nature Biotechnology. 33 (10), 1097-1102 (2015).
- Wagner, D. E., et al. Comparative decellularization and recellularization of normal versus emphysematous human lungs. Biomaterials. 35 (10), 3281-3297 (2014).
- Balestrini, J. L., et al. Comparative biology of decellularized lung matrix: Implications of species mismatch in regenerative medicine. Biomaterials. 102, 220-230 (2016).
- Alysandratos, K. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636(2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены