Method Article
Tissus pulmonaires modifiés préparés à partir de tranches pulmonaires décellularisées
Dans cet article
Résumé
Ce protocole décrit une méthode pour générer des tissus pulmonaires modifiés reproductibles à petite échelle, en repeuplant des tranches pulmonaires décellularisées coupées avec précision avec des cellules épithéliales alvéolaires de type 2, des fibroblastes et des cellules endothéliales.
Résumé
Il est nécessaire d’améliorer les modèles pulmonaires en 3 dimensions (3D) qui récapitulent la complexité architecturale et cellulaire de l’alvéole pulmonaire native ex vivo. Des modèles organoïdes récemment développés ont facilité l’expansion et l’étude des progéniteurs épithéliaux pulmonaires in vitro, mais ces plates-formes reposent généralement sur une matrice et/ou un sérum dérivés de tumeurs de souris et n’incorporent qu’une ou deux lignées cellulaires. Nous décrivons ici un protocole de génération de tissus pulmonaires modifiés (ELT) basé sur la recellularisation multi-lignée de tranches pulmonaires décellularisées coupées avec précision (PCLS). Les ELT contiennent des structures de type alvéolaire comprenant l’épithélium alvéolaire, le mésenchyme et l’endothélium, dans un substrat de matrice extracellulaire (ECM) ressemblant étroitement à celui du poumon natif. Pour générer les tissus, les poumons de rat sont gonflés avec de l’agarose, tranchés en tranches de 450 μm d’épaisseur, coupés en bandes et décellularisés. Les échafaudages ECM acellulaires résultants sont ensuite réensemencés avec des cellules endothéliales primaires, des fibroblastes et des cellules épithéliales alvéolaires de type 2 (AEC2). Les AEC2 peuvent être maintenus en culture ELT pendant au moins 7 jours avec un milieu de croissance sans sérum et chimiquement défini. Tout au long du processus de préparation et de culture des tissus, les tranches sont clipsées dans un système de cassette qui facilite la manipulation et l’ensemencement cellulaire normalisé de plusieurs ELT en parallèle. Ces ELT représentent une plateforme de culture organotypique qui devrait faciliter l’étude des interactions cellule-cellule et cellule-matrice au sein de l’alvéole ainsi que des signaux biochimiques régulant les AEC2 et leur niche.
Introduction
Les alvéoles sont les unités fonctionnelles du poumon distal, comprenant un maillage d’espaces aériens échangeant des gaz bordés de cellules épithéliales alvéolaires de type 1 (AEC1) et de cellules de type 2 (AEC2). Derrière l’épithélium se trouve un réseau dense de capillaires ainsi que du mésenchyme de soutien, le tout soutenu par un échafaudage à matrice extracellulaire (ECM) qui fournit à la fois force et flexibilité à ces sacs aériens délicats1. Les alvéoles sont également le site de blessures dans de nombreuses pathologies pulmonaires, y compris la fibrose pulmonaire idiopathique2, le syndrome de détresse respiratoire aiguë3 et la maladie à coronavirus sévère-19 (COVID-19)4. Bien que les travaux de la dernière décennie aient révélé une plasticité remarquable dans l’épithélium pulmonaire, les mécanismes qui permettent la réparation pulmonaire distale dans certains contextes - et qui empêchent la réparation dans d’autres - restent un domaine d’investigation intense5. Le développement de plateformes in vitro améliorées pour modéliser l’alvéole faciliterait les études de biologie alvéolaire, de régénération et de thérapeutique.
Les AEC2 s’auto-renouvellent et se différencient en AEC1, et sont donc considérés comme la cellule souche primaire du poumon distal 6,7,8. Cependant, ces cellules posent un défi particulier à l’étude in vitro étant donné les difficultés associées à la culture d’AEC2 primaires sans perte de phénotype9. Dans la culture conventionnelle en 2 dimensions (2D), les AEC2 s’aplatissent et adoptent certaines caractéristiques des cellules de type AEC110. En revanche, les stratégies de culture 3D, le plus souvent des organoïdes, soutiennent le maintien de caractéristiques différenciées dans les AEC2 primaires 6,11,12 et permettent la culture à long terme d’AEC2s dérivés de cellules souches pluripotentes (PSC)13,14. Les organoïdes ont été utilisés pour modéliser le développement pulmonaire distal15, l’infection virale11,15 et la maladie génétique liée à l’AEC2 13,16,17, permettant ainsi d’obtenir des informations importantes sur la biologie et la régénération de l’AEC2. Cependant, ces modèles de culture ne comprennent généralement qu’une ou deux lignées cellulaires et intègrent les cellules dans des matrices de type gel qui ne parviennent pas à récapituler l’architecture ou le substrat ECM de l’alvéole pulmonaire native.
L’ECM est un régulateur critique du phénotype et du comportement cellulaires via des indices moléculaires, topologiques et mécaniques; comprend un élément clé des niches spécifiques aux tissus régulant le devenir des cellules souches; et sert de réservoir qui module la disponibilité des facteurs de croissance sécrétés localement 18,19,20,21. La culture de cellules sur ECM natif peut ainsi augmenter la capacité prédictive des systèmes in vitro à modéliser la biologie des tissus in vivo. La décellularisation, un processus qui élimine le matériel cellulaire des tissus via des détergents, des enzymes ou des méthodes physiques ou autres, peut préserver en grande partie l’échafaudage ECM d’un organe natif, lorsqu’elle est soigneusement effectuée22,23. De tels échafaudages peuvent être repeuplés avec des cellules pour la culture biomimétique 3D. Cependant, bien que les échafaudages décellularisés soient largement utilisés pour les applications d’ingénierie tissulaire, leur utilisation pour la culture cellulaire de routine a été limitée. Plusieurs études antérieures ont rapporté la décellularisation et la recellularisation de tranches pulmonaires ou de petits segments de tissu pulmonaire. En plus des études de preuve de concept 24,25,26, des tranches pulmonaires repeuplées ont été utilisées pour étudier l’adhésion de la matrice des fibroblastes 27,28 et pour étudier l’effet des matrices pulmonaires malades sur le phénotype de fibroblastes27,29. Grâce aux technologies améliorées disponibles pour générer des tranches de tissu découpées avec précision, les tranches pulmonaires décellularisées pourraient offrir une plate-forme pratique et à petite échelle avec laquelle cultiver des cellules, tout en préservant les sous-structures alvéolaires, des voies respiratoires et vasculaires. L’intégration de plusieurs types de cellules permettrait d’étudier les interactions cellule-cellule dans un environnement 3D physiologiquement pertinent. Cependant, des stratégies améliorées sont nécessaires pour faciliter la manipulation des tissus tout au long du processus de culture et pour assurer un ensemencement contrôlé et reproductible des tissus avec un nombre connu de cellules.
Ici, nous présentons un protocole pour générer des tissus pulmonaires modifiés (ELT) en repeuplant des tranches pulmonaires décellularisées coupées avec précision (PCLS) avec des cellules endothéliales primaires, des AEC2 et des fibroblastes. Dans une adaptation de notre système de tissu cardiaque30 et de nos stratégies de décellularisation-recellularisation des poumons entiers22,31, nous décrivons les procédures permettant de couper le PCLS des poumons de rats et de clipser les tranches dans des cassettes de culture tissulaire réutilisables qui simplifient et normalisent les manipulations en aval. Les tranches coupées sont décellularisées pour former des échafaudages ECM acellulaires, qui sont repeuplés dans des bains de semis personnalisés. Les échafaudages en tranches pulmonaires préservent les composants et l’architecture critiques de l’ECM et soutiennent la croissance des AEC2 dans des structures alvéolaires multi-lignées pendant au moins 7 jours. Les ELT représentent un nouveau système de co-culture alvéolaire au sein d’une matrice 3D physiologiquement pertinente, qui devrait soutenir le développement de stratégies d’ingénierie tissulaire pulmonaire, tout en facilitant les études biologiques de base des AEC2 et de l’alvéole.
Protocole
Toutes les procédures expérimentales sur les animaux décrites dans cet article ont été approuvées par le Yale Institutional Animal Care and Use Committee.
1. Création de cassettes de culture tissulaire et de bains d’ensemencement
REMARQUE: Une fois fabriquées, les cassettes de culture tissulaire et les bains d’ensemencement peuvent être autoclavés et réutilisés pour des cycles répétés de culture ELT.
-
Cassettes de culture tissulaire
- Utilisez une découpeuse laser pour découper des cadres et des clips de cassettes de culture tissulaire en polytétrafluoroéthylène (PTFE) de 3/32 pouce d’épaisseur selon les conceptions fournies dans les fichiers supplémentaires 1 et 2, respectivement. Utilisez une découpeuse laser pour découper des languettes de cassette de culture tissulaire en PTFE de 1/16 pouce d’épaisseur conformément au fichier supplémentaire 3. Contours de coupe 3x en utilisant 80% de puissance et 15% de vitesse (pour une découpeuse laser de 30 W).
-
Bains d’ensemencement
- Utilisez les fichiers CAO du bain d’ensemencement (fichier supplémentaire 4 et fichier supplémentaire 5) pour imprimer en 3D la base et l’anneau du moule du bain d’ensemencement, respectivement, à l’aide de résine transparente.
- Faire tremper les moules dans une solution de 10% de poloxamère 407 dans de l’eau distillée pendant la nuit avant utilisation pour aider à la libération de PDMS. Laissez sécher à l’air, puis placez l’anneau sur la base du moule et enveloppez-le dans un film plastique flexible pour éviter les fuites.
- Préparer au moins 60 g par moule de polydiméthylsiloxane (PDMS) en mélangeant l’élastomère PDMS dans un rapport 10:1 avec un agent de durcissement, et verser dans le moule imprimé en 3D. Dégazez le PDMS dans un dessiccateur sous vide pendant 30 minutes pour éliminer les bulles d’air.
- Cuire les bains d’ensemencement à 60 °C pendant 8 h.
2. Préparation de tranches de poumons coupées avec précision à partir de poumons de rat
- Prélèvement d’organes
- Préparez un système de perfusion fractionné comprenant des membres entraînés par gravité et par pompe, comme illustré à la figure 1. Connectez une canule d’artère pulmonaire (PA) à l’extrémité du tube, comprenant un connecteur en Y barbelé de 1/16 pouce attaché à un tube en silicone LS 14 de longueur de 1/2 pouce et un connecteur luer-lock femelle de 3/32 pouce (voir Figure 1). N’attachez pas de clapet anti-retour à la canule pour le moment.
- Amorcer les lignes avec du PBS contenant 100 U/mL d’héparine et 0,01 mg/mL de nitroprusside de sodium (SNP) pour l’anticoagulation et la vasodilatation, respectivement. Réglez la pompe de perfusion à 30 mL/min.
REMARQUE: Ajouter SNP frais à la solution d’héparine et garder à l’abri de la lumière. - Doser un rat Sprague-Dawley adulte (8-12 semaines, environ 300-350 g) avec une injection intrapéritonéale (IP) de 400 U/kg d’héparine pour l’anticoagulant, suivie d’une injection IP de kétamine (75 mg/kg) et de xylazine (5 mg/kg) pour l’anesthésie. Confirmer un plan chirurgical d’anesthésie par manque de réponse à un stimulus nocif (pincement des orteils).
- Coupez la poitrine et l’abdomen de la fourrure à l’aide de tondeuses à cheveux. Ensuite, vaporisez avec 70% d’éthanol et essuyez 3x avec 10% de povidone-iode.
- Saisissez la peau sous le niveau du diaphragme avec une pince à dents de rat. Ensuite, faites une incision transversale de 1/2 pouce dans la peau avec des ciseaux fins. Saisissez le fascia abdominal exposé avec la pince, faites une incision transversale de 1/2 pouce dans le fascia, puis étendez l’incision à travers la peau et le fascia sur toute la largeur de l’abdomen supérieur.
- Utilisez la pointe des ciseaux fins pour faire une petite incision (pas plus de 1/8 de pouce) au centre du diaphragme antérieur, provoquant la rétraction des poumons dans le thorax. Étendez l’incision dans le diaphragme sur toute la largeur de la poitrine.
- Faites deux incisions verticales à travers toute la hauteur de la cage thoracique vers le cou, en prenant soin de ne pas endommager les poumons. Étendez l’incision à travers les côtes gauches pour couper à travers la clavicule et le long du côté du cou jusqu’au niveau du larynx, exposant la trachée.
- Disséquez la trachée libre du tissu conjonctif environnant et de l’œsophage. Faites une incision transversale à travers la moitié antérieure de la trachée entre deux anneaux cartilagineux, près du larynx. Enfilez une suture de polypropylène 4-0 derrière la trachée, sous le niveau de l’incision, et pré-attachez lâchement la première moitié du nœud d’un chirurgien avec deux torsions.
- Placez une canule comprenant un connecteur en Y barbelé de 1/16 pouce relié à un clapet anti-retour unidirectionnel et un tube en silicone LS 14 d’une longueur de 1/2 pouce avec un connecteur luer-lock femelle de 3/32 pouce (voir figure 1) dans la trachée en insérant un membre du connecteur en Y dans l’incision trachéale vers la direction des poumons.
- Placez la boucle de suture pré-attachée autour de la trachée au niveau de la canule insérée et serrez autour du connecteur en Y inséré pour fixer la canule en place. Ajouter deux jets à simple torsion de la suture pour compléter le nœud.
- Remplissez une seringue de 10 mL avec de l’air et connectez-vous au verrou de la canule trachéale.
- Serrez la veine cave inférieure près du diaphragme à l’aide d’un hémostat incurvé, puis injectez au cœur 150 U d’héparine (1000 U / mL) via le ventricule droit (RV).
- Ouvrez partiellement le robinet d’arrêt de la ligne de gravité pour produire un écoulement lent mais régulier de PBS/héparine/SNP à partir de la canule PA préparée à l’étape 2.1.1.
- Enfilez l’aiguille d’une suture en polypropylène 4-0 derrière la base du PA où elle sort du VR. Utilisez la première moitié du nœud d’un chirurgien pour pré-attacher une boucle de suture lâche autour de la base du PA.
- Faites une petite incision (pas plus de 1/8 de pouce) dans le VR juste en dessous et perpendiculairement au PA à l’aide de ciseaux fins, puis insérez un membre du connecteur en Y de la canule PA dans la base du PA. Fixez la suture autour du PA et du connecteur inséré et ajoutez un lancer à une seule torsion pour compléter le nœud du chirurgien.
REMARQUE: La cannulation du PA sous l’écoulement empêche l’introduction de bulles d’air dans le système vasculaire qui peuvent empêcher un nettoyage adéquat des poumons. - Fixez une valve unidirectionnelle à l’autre extrémité du connecteur en Y du cathéter PA, puis coupez l’apex du cœur pour permettre l’efflux du flux sanguin via le ventricule gauche.
REMARQUE: Le fait de ne pas couper l’apex du cœur avant de perfuser via la pompe peut endommager la barrière hémato-gazeuse, entraînant une fuite de liquide dans les espaces aériens. - Basculez la conduite de perfusion du côté de la pompe à l’aide du robinet d’arrêt reliant les deux lignes, puis allumez la pompe à 30 mL / min. Tout en perfusant les poumons via l’AP, ventilez manuellement les poumons via la seringue trachéale de 10 mL à environ 10-15 respirations / min, pour faciliter l’élimination des poumons du sang. Perfuser les poumons jusqu’à ce qu’ils deviennent principalement blancs, nécessitant généralement 40 mL de PBS / héparine / SNP ou moins.
REMARQUE: Un nettoyage inadéquat des poumons du sang peut nuire à la décellularisation en aval. - Coupez la trachée postérieure juste au-dessus du niveau de la canule trachéale, puis disséquez les poumons et le cœur libres de tout tissu conjonctif restant et extrayez les poumons et le cœur en bloc.
- Remplissez une seringue de 10 mL avec 2 % d’agarose à faible point de fusion dans la solution saline équilibrée (HBSS) de Hank sans rouge phénol, préavertiée à 42 °C.
REMARQUE: Le volume exact d’agarose requis varie en fonction de la taille des poumons. Les poumons plus gros (c.-à-d. de rats de plus de 400 g) nécessiteront plus de 10 ml d’agarose. - Gonfler manuellement les poumons extraits 3x avec 10 mL d’air (c.-à-d. à une capacité pulmonaire approximativement totale) via la canule de la trachée pour aider à recruter le parenchyme effondré.
- Gonflez immédiatement les poumons avec la seringue préparée d’agarose en injectant manuellement l’agarose via la canule de la trachée à un taux d’environ 40 mL / min, jusqu’à ce que les extrémités les plus distales des lobes pulmonaires soient gonflées. Si les régions distales du poumon restent effondrées, injectez 1 à 2 mL supplémentaires d’agarose.
- Coiffez la trachée en attachant le capuchon blanc d’un robinet d’arrêt à 4 voies à la serrure femelle de la canule trachéale. Placez le poumon dans une boîte de Petri de 150 mm sur de la glace pour permettre à l’agarose de se solidifier.
REMARQUE: Le gonflage du poumon peu de temps après l’extraction est essentiel pour assurer un remplissage uniforme du parenchyme pulmonaire et un tranchage ultérieur réussi des tissus. Si le poumon se gonfle de manière très inégale, ne procédez pas au tranchage des poumons car la qualité des tranches sera médiocre.
- Tranchage pulmonaire
REMARQUE: La procédure de tranchage exacte peut devoir être adaptée en fonction du microtome vibratoire (vibratome) utilisé; d’autres exemples de préparation de PCLS avec diverses trancheuses de tissus ont été publiés précédemment 32,33,34.- Pré-refroidir le bloc de refroidissement métallique à -20 °C et le conserver sur la glace lorsqu’il n’est pas utilisé tout au long de la procédure de tranchage.
- Utilisez une petite goutte de colle cyanoacrylate pour fixer une lame au porte-lame. Fixez soigneusement le porte-lame au vibratome à l’aide d’une clé Allen afin qu’il s’aligne simplement avec l’extrémité d’un tube d’échantillon inséré dans le bac tampon.
- Préparer des assiettes de 6 puits avec 3 mL par HBSS glacé stérile sans phénol rouge pour recueillir les tranches.
- À l’aide d’un scalpel, couper un morceau de tissu pulmonaire d’environ 1 à 1,5 cm3.
REMARQUE: Le tissu pulmonaire des parties inférieure et moyenne du lobe gauche, ainsi que des lobes moyen et inférieur droits, donne le plus facilement de plus grandes tranches de tissu qui maximisent la zone alvéolaire. Si des régions tissulaires non gonflées ou des zones de tissu conjonctif sont présentes, coupez ce tissu avec des ciseaux ou orientez-vous vers le bas vers le piston; ces tissus ont tendance à ne pas couper proprement. - Placez une petite goutte de colle cyanoacrylate sur le piston du tube d’échantillonnage. Tamponnez le tissu pulmonaire sur une lingette en papier pour éliminer l’excès d’humidité, puis placez immédiatement le tissu pulmonaire sur le dessus du piston à l’aide d’une pince.
- Faites glisser le tube métallique du tube d’échantillon jusqu’au niveau du haut du tissu et maintenez-le en place, le piston reculant. Pipette préchauffée à 2% d’agarose dans HBSS dans le haut du tube pour entourer complètement le tissu.
- Placez le bloc de refroidissement glacé autour du tissu pendant environ 1 min pour permettre à l’agarose de se solidifier.
- Insérez le tube d’échantillon dans le bac tampon. Remplissez le plateau avec du PBS glacé jusqu’à mi-chemin du bloc de tissu. Tournez l’interrupteur du boîtier du moteur vers l’avant rapide (FF) pour faire avancer le piston du boîtier du moteur de sorte qu’il ne touche que la base du tube de l’échantillon.
- Définissez les paramètres souhaités pour l’épaisseur de la tranche, la vitesse de coupe et la fréquence d’oscillation, par exemple, l’épaisseur de 450 μm, la vitesse 4 et la fréquence d’oscillation 5. Sélectionnez Mode continu, puis basculez le commutateur sur Activé pour commencer le découpage.
- Lorsque les tranches de tissu tombent dans le plateau tampon, transférez-les dans les plaques préparées à 6 puits à l’aide d’une boucle d’inoculation ou d’une spatule.
- Arrêtez de trancher lorsqu’il reste environ 2 mm d’épaisseur de tissu dans le tube d’échantillon, pour éviter d’endommager la lame ou de couper le tissu contenant de la colle.
- Répétez les étapes ci-dessus pour trancher du tissu pulmonaire supplémentaire, comme vous le souhaitez.
- Décellularisez immédiatement les tranches pour la préparation de l’échafaudage, ou congelez-les et conservez-les à -80 °C jusqu’à 2 mois. Pour congeler, transférer 4 à 6 tranches dans une boîte de Petri de 35 mm et aspirer soigneusement tout excès de liquide autour des tranches. Placez la vaisselle dans un bain de glace carbonique et d’éthanol à 100% pour les congeler, puis enveloppez-les dans du papier d’aluminium, scellez-les dans un sac en plastique et transférez-les à -80 °C.
REMARQUE: Ne placez pas les tranches fraîches directement dans un congélateur à -80 ° C, car le taux de congélation relativement lent peut provoquer la formation de cristaux de glace pouvant endommager les tissus.
3. Préparation des échafaudages de tissu pulmonaire
- Préparation des matériaux et des solutions de décellularisation
- Cadres, clips et onglets d’autoclave.
- Préparer des solutions de décellularisation comme indiqué dans le tableau 1.
REMARQUE: Ajouter la nucléase benzonase au tampon préchauffé immédiatement avant utilisation et au filtre stérile. Préparer des solutions de Triton X-100 et de désoxycholate de sodium (SDC) dans les 24 à 48 heures suivant la procédure de décellularisation. Préparer des solutions antibiotiques/antimycotiques et un tampon benzonase jusqu’à 30 d à l’avance et conserver à 4 °C.
- Couper et couper des tranches de poumon
REMARQUE: Bien que la coupe et le découpage puissent être effectués de manière non stérile sur la paillasse, les étapes de décellularisation de la section 3.3 et toute manipulation ultérieure des échafaudages tissulaires doivent être effectuées dans une hotte à flux laminaire.- Remplissez une boîte de Petri de 100 mm d’environ un tiers avec du PBS. Transférez les cassettes (cadres contenant deux clips chacun) et les languettes dans le plat à l’aide de pinces.
- Si vous utilisez des tranches congelées, décongelez un plat à la fois en versant du PBS à température ambiante dans le plat pour couvrir les tranches. Gardez les plats restants sur de la glace sèche.
- Transférer une tranche décongelée dans une boîte de Petri de 150 mm. Déplier doucement la tranche à l’aide d’une pince fine, si nécessaire, afin qu’elle reste à plat, puis aspirer soigneusement l’excès de PBS autour du tissu.
- Utilisez une lame de rasoir, avec une règle comme guide, pour couper une bande de 3 mm de large de la tranche en appuyant fermement sur toute la longueur de la lame contre le plat et en la berçant légèrement d’un côté à l’autre avec le bord de la lame maintenu en place. Vous pouvez également utiliser une fraise rotative équipée de 2 lames parallèles séparées par une entretoise sur mesure de 3 mm (par exemple, en acétal [polyoxyméthylène]) pour couper des bandes de tissu. Évitez les déchirures, les trous, les grandes voies respiratoires ou les vaisseaux, ou le tissu conjonctif épais.
REMARQUE: Pour un découpage réussi, la bande doit avoir une longueur d’au moins 9 mm. - À l’aide d’une pince, transférer la bande de tissu dans la boîte de Petri de 100 mm préparée.
- Clipsez la bande de tissu dans la cassette: faites flotter le tissu au-dessus de la cassette, en centrant le tissu pour surplomber les trous dans les clips à chaque extrémité. Avec une pince fine, placez une languette en partie dans le trou à une extrémité, redressez doucement le tissu, puis placez la deuxième languette. À l’aide de pinces dans chaque main, appuyez complètement sur chaque languette pour fixer le tissu.
REMARQUE: Si vous avez de la difficulté à maintenir le tissu en place avant de couper, aspirez un peu de PBS de la boîte pour abaisser le niveau de liquide. Veillez à ne pas étirer le tissu en plaçant le deuxième clip, car cela pourrait entraîner une déchirure. - Répétez la procédure de décongélation, de coupe et de tonte aux étapes 3.2.2 à 3.2.6 pour autant de tissus que vous le souhaitez.
- Décellularisation en tranches
- Une fois toutes les tranches coupées, transférer le plat de 100 mm contenant les cassettes dans une hotte à écoulement laminaire.
- Début de l’étape 1 du protocole de décellularisation (voir tableau 2) : à l’aide d’un hémostat incurvé pour saisir les côtés entaillés de chaque cassette, transférez les cassettes sur des plaques à 6 puits (2 tissus/puits) remplies de 3 mL de PBS + ions + antibiotiques/antimycotiques par puits (voir la recette de la solution dans le tableau 1).
- Placez les plaques de puits sur un agitateur orbital à 30 tr/min pendant 10 min.
- Passez à l’étape 2 du protocole de décellularisation (voir tableau 2) : aspirer le fluide de chaque puits, puis le remplacer par 3 mL/puits PBS + ions, placer la plaque sur le shaker orbital à 30 tr/min, et incuber pendant 5 min.
- Répétez l’étape 3.3.4 pour chacune des solutions et les durées correspondantes, comme indiqué dans le protocole de décellularisation du tableau 2.
- Après la dernière étape de rinçage avec PBS + antibiotiques/antimycotiques (étape 20 du tableau 2), transférer les tissus dans des plaques stériles à 6 puits avec du PBS frais + antibiotiques/antimycotiques, et incuber à 37 °C pendant 48 h.
REMARQUE: Après la stérilisation avec des antibiotiques / antimycotiques, les échafaudages de tissu pulmonaire peuvent être ensemencés immédiatement ou stockés à 4 ° C jusqu’à 30 d.
4. Recellularisation et culture des tranches
REMARQUE : La figure 2 montre un calendrier proposé pour l’ensemencement et la culture de tissus, dans lequel les tranches sont d’abord ensemencées avec des cellules endothéliales microvasculaires pulmonaires de rat et cultivées dans un milieu endothélial à faible sérum; puis ensemencés avec des AEC2 de rat et des fibroblastes pulmonaires de rat avec un milieu de croissance AEC2 sans sérum (adapté de Jacob et al.13 et You et al.35); voir les notes supplémentaires sur les sources cellulaires utilisées dans les résultats et les détails des milieux de culture dans le tableau 3. Cette stratégie donne des structures de type alvéolaire contenant des monocouches AEC2.
- Préparation des échafaudages tissulaires pour l’ensemencement (Jour -4 ou -3)
- Si vous utilisez des échafaudages tissulaires stockés à 4 °C, incuber les échafaudages pendant la nuit à 37 °C avec du PBS frais + antibiotiques/antimycotiques (10 % de pénicilline/streptomycine, 4 % d’amphotéricine B, 0,4 % de gentamicine dans le PBS) avant l’ensemencement.
- Rincer les échafaudages 3x avec du PBS stérile (5 mL/puits), 5 min chacun.
- Examinez les échafaudages sous un microscope à contraste de phase à un grossissement de 5x pour sélectionner les tissus à ensemencer.
REMARQUE: Les meilleurs échafaudages pour l’ensemencement n’ont pas de déchirures ou de trous et ne contiennent pas de grandes voies respiratoires ou de vaisseaux. Bien que les échafaudages présentant les caractéristiques puissent être ensemencés avec succès, les modèles de repeuplement peuvent différer de ceux observés dans les zones alvéolaires.
- Ensemencement des cellules endothéliales (Jour -3)
- Compter les cellules endothéliales à l’aide d’un hémocytomètre et préparer la suspension de cellules endothéliales dans un milieu endothélial (voir tableau 3) à 5 x 106 cellules/mL, avec suffisamment de cellules pour ensemencer 500 000 cellules endothéliales par tranche (p. ex., pour 12 tranches, remettre en suspension 6 x 106 cellules dans un milieu de 1,2 mL).
- Placez les bains d’ensemencement autoclavés dans des boîtes de Petri de 100 mm. Transférer les échafaudages rincés à l’envers vers les bains d’ensemencement: utilisez un hémostat finement incurvé pour saisir une cassette par les côtés entaillés, utilisez un hémostat droit ou une pince pour saisir une extrémité de la cassette (en prenant soin de ne pas toucher le tissu lui-même) et retournez, puis saisissez à nouveau la cassette avec les extrémités de l’hémostat incurvé fin via les trous le long des côtés entaillés, et bien placer dans un bain de semis. Répétez l’opération pour les cassettes restantes.
REMARQUE: Lorsqu’ils sont correctement placés, les échafaudages seront centrés, à l’envers, dans le fond de chaque puits. Si nécessaire, appuyez doucement sur le coin de la cassette avec les extrémités d’un hémostat pour vous assurer que la cassette est assise à plat dans le puits. Une mauvaise assise de la cassette peut entraîner un mauvais ensemencement des tissus. Il est acceptable si le puits contient une petite quantité de PBS. - Faites tourbillonner doucement la suspension cellulaire préparée pour la mélanger, puis utilisez une pipette manuelle pour pipeter des cellules de 100 μL directement sur chaque tissu à la base du puits, en prenant soin de ne pas endommager le tissu avec la pointe de la pipette.
- Transférer les tissus ensemencés dans l’incubateur de culture cellulaire à 37 °C/5 % de CO2.
- Après 2 h, ajouter 900 μL de milieu de culture préchauffé à chaque puits à l’aide d’une pipette manuelle, puis retourner à l’incubateur. Si une cassette se détache (flotte) lors de l’ajout de support, appuyez doucement sur le coin de la cassette avec l’embout de la pipette afin qu’elle se trouve à plat dans le puits.
- Changer de support le jour -2. Retirez le milieu en inclinant la boîte de Petri et en pipetant manuellement avec une pointe de pipette légèrement placée dans le coin du puits, afin de ne pas déranger la cassette. Remplacer par 1 mL de milieu endothélial frais par puits.
- AEC2 et ensemencement de fibroblastes et culture tissulaire (Jour 0)
- Comptez les AEC2 et les fibroblastes à l’aide d’un hémocytomètre. Préparer une suspension cellulaire 1:1 d’AEC2 et de fibroblastes dans un milieu de croissance AEC2 (milieu de base épithélial + suppléments d’AEC2; voir tableau 3) à 5 x 106 cellules totales/mL, avec suffisamment de cellules pour ensemencer 500 000 cellules (250 000 AEC2 et 250 000 fibroblastes) par tranche (par exemple, pour 12 tranches, remettre en suspension 3 x 106 AEC2s + 3 x 106 fibroblastes ensemble dans un milieu de 1,2 mL).
- Pipeter le milieu de chaque puits du bain d’ensemencement comme décrit à l’étape 4.2.6. Faire tourbillonner doucement la suspension cellulaire préparée pour mélanger, puis pipeter des cellules de 100 μL directement sur chaque tissu à la base du puits.
REMARQUE: Il est acceptable si une petite quantité de milieu endothélial reste dans le puits avant l’ensemencement de l’AEC2 / fibroblaste. - Transférer les tissus ensemencés dans l’incubateur de culture cellulaire à 37 °C/5 % de CO2.
- Après 2 h, ajouter 900 μL de milieu de croissance AEC2 préchauffé à chaque puits, puis retourner à l’incubateur.
- Après 24 h de culture (jour 1), préparer une plaque de 12 puits avec 1 mL de milieu de croissance AEC2 préchauffé par puits et par cassette.
- Pipette 800 μL de milieu de chaque puits du bain d’ensemencement. Retirer les cassettes du bain d’ensemencement: saisissez chacune avec un hémostat incurvé fin via les trous le long des côtés entaillés, transférez-les sur un hémostat droit ou une pince pour saisir la cassette à une extrémité et retournez, puis utilisez l’hémostat incurvé pour saisir la cassette via les côtés entaillés et transférez le côté droit, un par puits, sur la plaque préparée à 12 puits.
- Changer le milieu de culture dans la plaque de 12 puits tous les deux jours jusqu’au jour 7 ou pour la durée de culture souhaitée: utilisez une pipette Pasteur en verre pour aspirer le milieu de chaque puits, en prenant soin de ne pas toucher le tissu; pipette dans 1 mL de milieu de croissance frais AEC2 par puits.
REMARQUE: Le degré de repeuplement des tissus peut être surveillé par microscopie à contraste de phase à un grossissement de 5x pendant toute la durée de la culture.
5. Prélèvement de tissus et analyse d’échantillons
- Pour fixer les ELT pour l’histologie et la coloration immunofluorescente, transférez les cassettes de culture tissulaire à 10% de formol tamponné neutre et incubez pendant 3 à 4 h à température ambiante sur une bascule. Retirez les mouchoirs des cassettes à l’aide de la pointe d’une pince fine pour couper le tissu là où il rencontre les languettes. Traiter les tissus selon les méthodes de routine pour l’incorporation de paraffine et l’histologie; aucune technique spécialisée n’est requise.
- Pour traiter les ELT pour la qRT-PCR, rincez les tissus dans des cassettes dans PBS 2x, puis retirez les tissus et enclenchez le gel ou procédez à la lyse pour l’extraction de l’ARN.
REMARQUE: La mise en commun d’au moins 2 tranches ensemencées avec 1 x 106 cellules et cultivées pendant 7 jours devrait donner suffisamment d’ARN pour l’analyse PCR en aval.
Résultats
La figure 3 présente un aperçu du processus de génération d’ELT - comprenant le tranchage des poumons, l’écrêtage et la décellularisation des tranches et le repeuplement de l’échafaudage. Les ELT présentées ici ont été cultivées à l’aide de cellules endothéliales microvasculaires microvasculaires primaires de rat (voir tableau des matériaux), d’AEC2 de rat néonatal et de fibroblastes pulmonaires néonatals de rat enrichis en lipofibroblastes36. Les AEC2 ont été fraîchement isolés par tri magnétique à base de billes, comme décrit précédemment37; d’autres protocoles d’isolement ont été détaillés et discutés ailleurs 38,39,40. La pureté des AEC2 isolés chez le rat peut être évaluée par cytométrie en flux pour le marqueur de surface AEC2 spécifique au rat RTII-7041, ou par coloration d’un échantillon de cellules cytocentrifugées pour RTII-70 ou protéine pro-tensioactif C (pSPC). Les fibroblastes pulmonaires de rat ont été isolés chez des ratons postnatals de jour 7 à 9 selon une adaptation d’un protocole42 publié et utilisés aux passages 1-2; d’autres protocoles d’isolement ont été décrits ailleurs43,44. La pureté des fibroblastes isolés peut être évaluée par coloration de cellules cultivées ou cytocentrifugées pour la vimentine marqueur mésenchymateux, et l’enrichissement en lipofibroblastes peut être évalué par coloration pour Oil Red O45.
Lorsque le tissu pulmonaire est uniformément gonflé avec de l’agarose et que des morceaux de tissu sont stratégiquement sélectionnés et orientés pour le tranchage afin de maximiser la surface totale et parenchymateuse du tissu, un poumon de rat peut produire du tissu pour >100 ELT alvéolaires. Les bandes de PCLS présentent une intégrité mécanique suffisante pour être clipsées dans des cassettes de tissu avec peu (<5%) cas de déchirure (figure 3B).
Le protocole de décellularisation des tranches pulmonaires est étroitement basé sur notre protocole de décellularisation pulmonaire entière publié précédemment, qui, par protéomique quantitative, a démontré qu’il préserve de nombreux composants ECM à des niveaux non significativement différents de ceux du poumon natif22. Les échafaudages en tranches décellularisées préservent l’architecture native des alvéoles, telle que vue par coloration à l’hématoxyline et à l’éosine (H & E) (Figure 4A, B) et par microscopie à contraste de phase (Figure 4C). Nous excluons généralement les échafaudages contenant de grandes voies respiratoires ou des vaisseaux (figure 4D) ou des déchirures, bien que les premiers puissent être inclus s’ils intéressent le chercheur. La décellularisation entraîne une réduction de 96 % de la teneur en ADN tissulaire mesurée par un essai pour l’ADN double brin (voir tableau des matériaux; 0,50 μg/mg ± 0,073 μg/mg vs 0,018 μg/mg ± 0,0035 μg/mg dans les tissus natifs vs décellularisés, respectivement, moyenne ± SEM) (Figure 5A), sans ADN visible par coloration à l’hématoxyline (Figure 4B). La coloration histologique et immunofluorescente des échafaudages décellularisés révèle le maintien des protéines ECM collagène, élastine, collagène IV et laminine avec une architecture et une quantité similaires à celles des tranches pulmonaires natives (Figure 5B-E). Notez que les noyaux des tissus natifs tachent en bleu/noir avec des taches de trichome (pour le collagène) et d’EVG (pour l’élastine). La coloration immunofluorescente a été effectuée comme décrit précédemment, en utilisant des méthodes standard pour colorer les tissus37. Les anticorps utilisés et leurs concentrations respectives sont énumérés dans le tableau 4.
Un repeuplement réussi de l’échafaudage conduit à des ELT hautement cellulaires après 7 jours, avec un modèle de repeuplement de type alvéolaire visible par microscopie optique (Figure 6A-C). Dans certains cas, avec une très grande cellularité, des structures de type organoïde peuvent être visibles (Figure 6A,B). L’ensemencement tissulaire infructueux peut être visualisé par microscopie à contraste de phase pendant la culture (Figure 6C). Après avoir cultivé des échafaudages tissulaires avec des AEC2, des fibroblastes et des cellules endothéliales, les ELT sont densément repeuplés avec des structures alvéolaires comprenant les trois lignées cellulaires (Figure 6D, E). Au jour 7 ou 8, les AEC2 maintiennent la morphologie cuboïdale et expriment la protéine B du surfactant (SPB) et la protéine du corps lamellaire ABCA3, sans preuve de différenciation significative par rapport aux AEC1 (Figure 6E,F). Les AEC2 sont très prolifératifs dans les ELT, comme le démontre l’incorporation de 5-éthynyl-2'-désoxyuridine (EdU) après une impulsion de 2 h à 10 μM (Figure 6G).
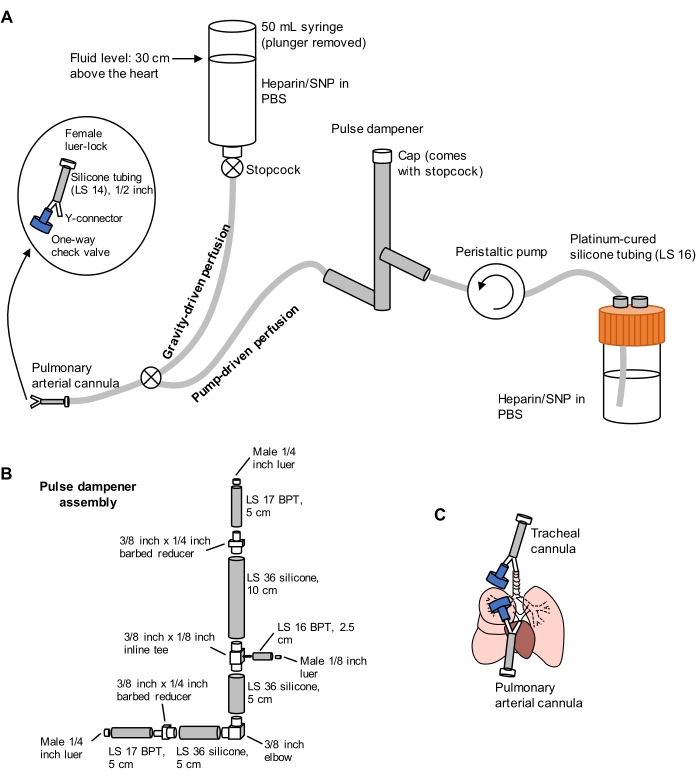
Figure 1: Schéma du système de perfusion pour l’extraction et le nettoyage des poumons. (A) Le système de perfusion comprend un membre gravitaire, utilisé pour la canulation initiale de l’artère pulmonaire sous écoulement; et un membre entraîné par pompe, utilisé pour nettoyer efficacement les poumons après la canulation initiale. La conduite de pompe comprend un « amortisseur d’impulsions » qui amortit les pics de pression causés par la pompe. La conception des canules artérielles trachéales et pulmonaires est détaillée à gauche. SNP = nitroprusside de sodium. (B) Détails de l’ensemble de l’amortisseur d’impulsions. BpT et silicone se réfèrent à des types de tubes. (C) Positions des canules artérielles trachéales et pulmonaires placées lors de l’extraction pulmonaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Chronologie de la culture pour la recellularisation des trilignes. Calendrier proposé pour l’ensemencement et la culture d’ELT tri-lignées, y compris le calendrier de l’ensemencement en deux phases. Le nombre de cellules pour l’ensemencement et le milieu de culture pour chaque phase sont indiqués. Voir les détails des milieux culturels dans le tableau 3. AEC2 = cellule épithéliale alvéolaire de type 2. EC = cellule endothéliale. FB = fibroblaste. Veuillez cliquer ici pour voir une version agrandie de cette figure.
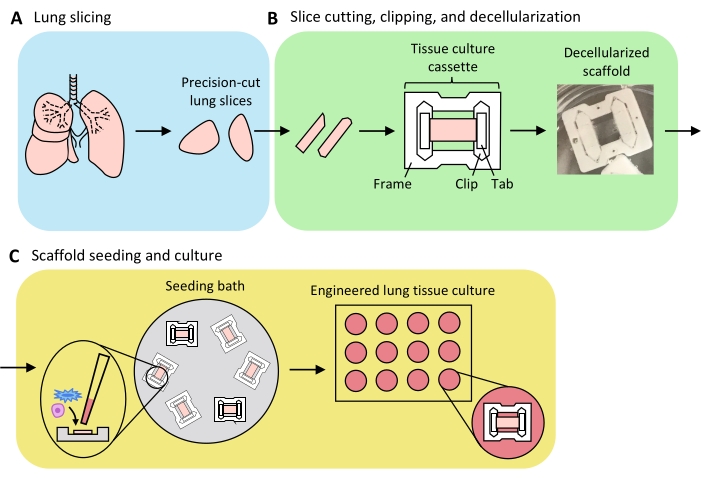
Figure 3: Schéma de la préparation du tissu pulmonaire modifié. (A) Le tissu pulmonaire natif est coupé en tranches à l’aide d’un vibratome. (B) Les tranches pulmonaires coupées avec précision sont découpées en bandes normalisées de 3 mm de large, clipsées dans des cassettes de culture tissulaire en polytétrafluoréthylène (PTFE) et décellularisées par détergent pour produire des échafaudages de matrice extracellulaire acellulaire. (C) Les échafaudages sont réensemencés dans des bains d’ensemencement spécialisés qui confinent la zone d’ensemencement à la zone du tissu, puis cultivés dans une plaque de puits standard. Veuillez cliquer ici pour voir une version agrandie de cette figure.
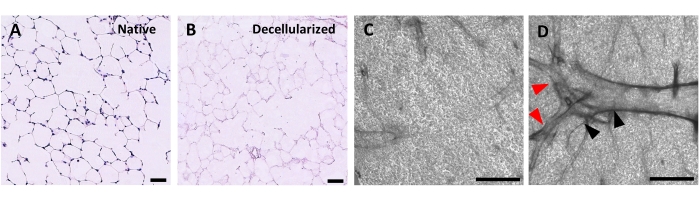
Figure 4 : Structure des échafaudages pulmonaires décellularisés. Coloration H&E des tranches pulmonaires natives (A) et décellularisées (B) montrant la préservation de l’architecture alvéolaire après décellularisation. (C,D) Exemples d’échafaudages ECM décellularisés vus à grossissement 5x par microscopie à contraste de phase, comprenant principalement du tissu alvéolaire (C) ou contenant de grandes voies respiratoires et vaisseaux ramifiés (D, pointes de flèches noires et rouges). Barres d’échelle, 50 μm (A,B); 500 μm (C,D). Veuillez cliquer ici pour voir une version agrandie de cette figure.
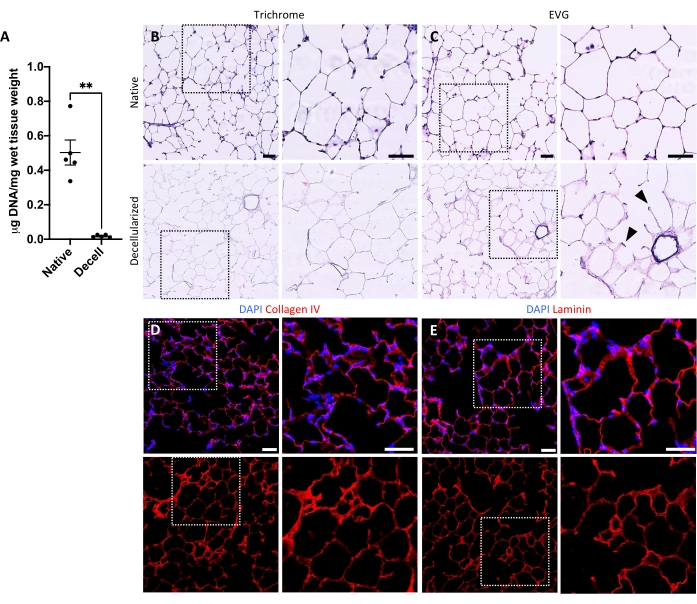
Figure 5 : Retrait de l’ADN et préservation de la matrice dans les échafaudages pulmonaires décellularisés. (A) Quantification de l’ADN dans les tranches pulmonaires natives et décellularisées (moyenne ± SEM, n = 5). Test t de Welch, **P < 0,01. Decell = décellularisé. (B,C) Coloration histologique des tranches pulmonaires natives et décellularisées pour le collagène (B) et l’élastine (C). Pointes de flèches, élastine conservée dans des anneaux d’entrée alvéolaires de tissu décellularisé. (D,E) Coloration immunofluorescente de tranches pulmonaires natives et décellularisées pour le collagène IV (D) et la laminine (E). Barres d’échelle, 50 μm. Dans tous les panneaux, des zones en pointillés dessinent la région de l’image agrandie vers la droite dans chaque panneau respectif. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Repeuplement cellulaire des tissus pulmonaires modifiés. (A-C) Exemples d’ELT recellularisées au jour 7 de la culture, telles que visualisées pendant la culture par microscopie à contraste de phase. Le modèle de recellularisation reflète la structure alvéolaire du tissu. Dans certaines zones de haute cellularité, des structures organoïdes peuvent se former (pointes de flèche). (A) et (B) représentent un repeuplement cellulaire réussi, tandis que (C) représente un faible niveau de recellularisation après 7 jours de culture. (D-G) Coloration des ELT recellularisées au jour 7 ou 8 de la culture. (D) Coloration H&E montrant un repeuplement cellulaire des septa alvéolaires. (E) Étiquettes de coloration immunofluorescente greffées de fibroblastes proCollagenIα1+, d’ABCA3+ AEC2 et de cellules endothéliales CD31+. (F) Les tissus contiennent des SPB+ AEC2 abondants mais peu de RTI-40 (podoplanine)+ AEC1 dans ces conditions. (G) De nombreux AEC2 prolifèrent dans les ELT, tels que mesurés par l’incorporation d’EdU. Barres d’échelle, 500 μm (A-C); 25 μm (D-G). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Solutions de décellularisation. Détails de préparation pour les solutions de décellularisation. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Protocole de décellularisation. Détails du protocole de décellularisation des tranches pulmonaires. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3 : Milieux culturels. Détails de préparation pour les milieux de croissance endothéliaux et AEC2. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4 : Anticorps utilisés pour l’immunocoloration. Détails des anticorps et de leurs concentrations utilisés pour l’immunocoloration. Veuillez cliquer ici pour télécharger ce tableau.
Dossier supplémentaire 1 : Conception pour la découpe au laser de cadres de cassettes de culture tissulaire. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 2 : Conception pour la découpe au laser de clips de cassettes de culture tissulaire. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 3 : Conception pour la découpe laser d’onglets de cassettes de culture tissulaire. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 4 : Fichier CAO pour la base de moule de bain d’ensemencement. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 5 : Fichier CAO pour l’anneau de moule de bain d’ensemencement. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Cet article décrit l’utilisation de tranches pulmonaires décellularisées coupées avec précision comme plate-forme pour générer des tissus pulmonaires modifiés in vitro, qui contiennent des structures alvéolaires multi-lignées. En combinant les stratégies que nous avons précédemment développées pour repeupler des échafaudages pulmonaires ECM acellulaires haute fidélité pour l’ingénierie pulmonaire entière22,31, avec notre système robuste pour la culture de tissus cardiaques modifiés à petite échelle30, ce protocole permet l’utilisation d’ECM pulmonaire physiologiquement pertinent comme substrat de culture tissulaire, de manière reproductible et à débit modéré.
Les méthodes présentées ici détaillent la préparation de l’échafaudage ELT à partir de poumons de rat, qui sont facilement accessibles, peuvent être extraites en bloc avec un accès direct aux voies respiratoires intactes pour l’inflation de l’agarose, et sont de plus grande taille que le poumon de souris. Cependant, tout tissu pulmonaire qui peut être gonflé avec de l’agarose et donner des tranches d’au moins 9 mm de longueur peut être utilisé dans ce système. Quelle que soit la source de tissu, le gonflage uniforme du tissu pulmonaire avec l’agarose est l’étape la plus critique pour assurer le succès du tranchage, de l’écrêtage et de la manipulation des tissus en aval. Le tissu pulmonaire sous-gonflé a tendance à ne pas trancher proprement, tandis que le tissu surgonflé peut se déchirer lors de la coupe. Après la gélification de l’agarose, les régions tissulaires gonflées de manière appropriée sont fermes, mais donnent un peu de répit lorsqu’elles sont pressées doucement avec une pince. Pour les poumons de rats intacts, nous avons constaté que le prégonflage des poumons extraits avec de l’air plusieurs fois, suivi d’une inflation de l’agarose dès que possible après l’extraction, donne les meilleurs résultats de tranchage et la meilleure qualité des échafaudages tissulaires résultants. Le volume approprié d’agarose doit être optimisé empiriquement; pour un poumon de rat, le volume nécessaire pour gonfler le poumon à la capacité pulmonaire totale est d’environ 30 mL/kg de masse animale (p. ex., 10,5 ml d’agarose pour les poumons d’un rat de 350 g). Pour les tissus pulmonaires réséqués plus gros avec un accès moins simple aux voies respiratoires (comme ceux de donneurs humains), un dépannage supplémentaire peut être nécessaire pour gonfler le tissu via une bronche32. Lors du tranchage ultérieur des poumons, la sélection et l’orientation du tissu sur le piston est une autre étape importante pour 1) s’assurer que les tranches sont suffisamment grandes pour générer des bandelettes de tissu qui peuvent être clipsées dans des cassettes de culture tissulaire et 2) maximiser la zone tissulaire parenchymateuse (alvéolaire), à l’exclusion des grandes voies respiratoires ou des vaisseaux.
Couper le PCLS dans des cassettes de culture tissulaire peut être une étape difficile au début, mais les cassettes simplifient considérablement la manipulation des tissus pendant la décellularisation et l’ensemencement. Deux problèmes potentiels qui peuvent survenir sont la déchirure des tissus (soit pendant le processus de coupe, soit pendant la décellularisation), ou le positionnement des tissus dans les clips qui entraîne un mauvais ensemencement en aval (par exemple, pas d’ensemencement ou ensemencement juste aux extrémités). La déchirure peut être le résultat d’une surinflation de l’agarose, d’un étirement excessif du tissu lors de l’insertion de la languette ou d’un surplomb trop faible pour fournir une adhérence adéquate des tissus lors de l’insertion des languettes. Notez que les tranches qui se déchirent à une extrémité du clip peuvent être ensemencées avec succès, cependant, elles sont difficiles à visualiser au microscope pendant la culture car le tissu n’est pas plat. Un mauvais ensemencement des tissus (comme celui de la figure 6C) est probablement le résultat du fait que la tranche ne se trouve pas à plat entre les deux clips et qu’elle entre donc mal en contact avec la base du bain d’ensemencement lorsqu’elle est retournée à l’envers. Une autre cause possible est une mauvaise assise de la cassette dans le fond du puits de bain d’ensemencement. En termes de coupe, appliquez un peu plus de tension dans le tissu lorsque vous placez le deuxième clip pour l’aider à rester à plat. Certaines tranches ont une légère concavité; dans ces cas, coupez la tranche avec le côté convexe vers le haut. Avec de la pratique, nous constatons généralement un ensemencement raté avec moins de 2% de tranches.
L’une des limites de ce protocole est l’exigence d’un équipement spécialisé - une découpeuse laser et une imprimante 3D - pour générer les matériaux initiaux pour la préparation elT. Cependant, une fois que les cassettes de culture tissulaire et les bains d’ensemencement sont créés, aucun matériau spécial supplémentaire n’est nécessaire. Les étapes de tranchage et de décellularisation des poumons de la préparation de l’échafaudage ELT prennent modérément du temps; cependant, ces étapes peuvent être effectuées à l’avance, ou en nombre suffisant pour préparer plusieurs expériences en même temps. De nombreux PCLS (>100 si l’optimisation pour les régions parenchymateuses) peuvent être coupés à partir d’un seul poumon et congelés pour une utilisation ultérieure. Bien qu’un seul cycle de gel-dégel puisse causer des dommages ultrastructuraux mineurs à l’ECM46, il a été démontré que même plusieurs cycles de gel-dégel ne causent pas de perte significative dans l’ECM 23,47. Le PCLS peut également être coupé et décellularisé avant une expérience, pour être utilisé dans un délai d’un mois. (Notamment, le protocole de décellularisation décrit peut être accompli en environ 6 heures, ce qui représente un avantage significatif par rapport aux méthodes décrites précédemment qui nécessitent un jour ou plus27,28.) Une fois les échafaudages préparés, le processus d’ensemencement cellulaire est simple et rapide, et la culture des ELT ne nécessite pas de techniques spécialisées.
Une mise en garde de la méthode ELT décrite est l’absence d’ensemencement spécifique à la région, c’est-à-dire l’administration d’AEC2 spécifiquement à l’espace alvéolaire ou de cellules endothéliales spécifiquement à l’espace vasculaire. Néanmoins, bien que les cellules soient simplement ensemencées au-dessus des échafaudages tissulaires, le modèle de recellularisation n’est pas aléatoire, avec un semblant d’organisation alvéolaire, y compris des anneaux épithéliaux. Nous soupçonnons que les interactions cellule-cellule, ainsi que les différences locales dans la composition et la géométrieecm 20,21, contribuent probablement aux modèles de recellularisation observés. À l’appui de cette hypothèse, une étude publiée précédemment, dans laquelle les fibroblastes ont été ensemencés non spécifiquement sur des tranches pulmonaires décellularisées, a démontré que le modèle de repeuplement tissulaire et les phénotypes cellulaires associés variaient considérablement selon la région tissulaire microscopique et la source d’échafaudage ECM (par exemple, sain ou malade)27. On a également observé que les fibroblastes envahissaient l’interstitium - l’endroit où ils résident dans le tissu pulmonaire natif 1,27. La principale méthode alternative que nous pouvons imaginer pour cultiver des cellules sur des tranches de poumon d’une manière vraiment spécifique à la région consisterait à ensemencer des poumons décellularisés intacts via les voies respiratoires31,48 et les compartiments vasculaires49,50, puis à trancher le tissu recellularisé. Cependant, cette solution de rechange 1) est beaucoup plus coûteuse, plus longue et plus coûteuse en ressources; 2) est un débit inférieur; 3) nécessite un nombre accru d’animaux; et 4) est associé à un risque accru de contamination en raison des défis liés à la culture pulmonaire entière et au tranchage ultérieur du poumon ensemencé. Bien qu’elle ne récapitule pas tous les aspects de l’organisation cellulaire native, la plate-forme ELT permet la culture de cellules pulmonaires sur un substrat ECM physiologiquement pertinent, d’une manière accessible à de nombreux autres laboratoires.
La flexibilité du système ELT est un avantage majeur de cette plate-forme et devrait permettre la culture de tissus pulmonaires à petite échelle avec un nombre illimité d’échafaudages tissulaires, de cellules ou de milieux de culture d’intérêt. L’utilisation d’échafaudages dérivés de tissus malades ou de modèles de blessures peut permettre d’étudier les interactions cellule-cellule ou cellule-matrice dans le cadre de l’ECM 27,29,51 altéré par la maladie. Cependant, notez que le protocole de décellularisation devra peut-être être adapté pour tenir compte des différences matricielles entre les espèces52. La stratégie d’ensemencement décrite peut être utilisée pour n’importe quel type de cellule et la chronologie de culture adaptée aux besoins du chercheur. Comme point de départ, 1 x 106 cellules par échafaudage devraient produire un tissu hautement cellulaire dans les 7 jours suivant la culture, tandis que 1 x 105 cellules totales entraînent une mauvaise cellularité. Dans toute adaptation de la chronologie, les cassettes de culture tissulaire doivent être retirées du bain d’ensemencement 24 heures après le dernier ensemencement tissulaire. Ici, dans le but de modéliser une partie de la complexité cellulaire de l’alvéole pulmonaire, nous décrivons une stratégie de recellularisation tri-culture qui soutient le maintien d’AEC2 néonatals bien différenciés dans des structures alvéolaires pendant au moins 7 jours. Nos résultats démontrent également la greffe réussie de fibroblastes et de cellules endothéliales dans les ELT, soulignant la large applicabilité du substrat de culture et sa pertinence pour les études de co-culture. L’ensemencement de cellules adultes dans des ELT peut faciliter la modélisation de structures alvéolaires plus reposantes, tandis que l’ensemencement d’AEC2 humains dérivés de PSC, y compris ceux présentant des modifications génétiques, pourrait faciliter les études translationnelles de la maladie humaine13,53. En général, l’approche ascendante permise par la plate-forme ELT offre la possibilité d’étudier les contributions de types de cellules particuliers à des lectures d’intérêt - telles que l’état de prolifération ou de différenciation AEC2.
En résumé, ce protocole décrit un système robuste pour générer des tissus pulmonaires modifiés pour des études de co-culture d’AEC2, de fibroblastes et de cellules endothéliales dans des échafaudages de tranches pulmonaires ECM acellulaires. Les ELT représentent une nouvelle stratégie de culture 3D pour les AEC2 primaires, qui jusqu’à présent se sont généralement appuyées sur des matrices de type gel moins physiologiques pour maintenir un phénotype 6,11,12 bien différencié. La plate-forme actuelle s’appuie sur des travaux antérieurs dans le repeuplement de tranches pulmonaires décellularisées 24,25,26,27,28,29, mais offre plusieurs avantages: 1) un système de cassette de culture tissulaire pour faciliter la manipulation de l’ELT pendant la décellularisation, l’ensemencement et la culture; 2) un bain d’ensemencement personnalisé pour ensemencer avec précision un nombre connu de cellules sur chaque échafaudage de tranches; et 3) une stratégie de réensemencement en trois cultures qui permet le repeuplement des tissus alvéolaires avec des cellules épithéliales, mésenchymateuses et endothéliales. Ainsi, les ELT représentent une étape importante vers la création de modèles in vitro reproductibles qui capturent la complexité cellulaire et du substrat de l’alvéole native et de la niche des cellules souches AEC2.
Déclarations de divulgation
L.E.N. est fondateur et actionnaire de Humacyte, Inc., une société de médecine régénérative. Humacyte produit des vaisseaux sanguins artificiels à partir de cellules musculaires lisses allogéniques pour la chirurgie vasculaire. Le conjoint de L.E.N. détient des participations dans Humacyte, et L.E.N. siège au conseil d’administration de Humacyte. L.E.N. est une inventrice de brevets concédés sous licence à Humacyte et qui produisent des redevances pour L.E.N. L.E.N. a reçu un don de recherche sans restriction pour soutenir la recherche dans son laboratoire de Yale. Humacyte n’a pas influencé la conduite, la description ou l’interprétation des conclusions du présent rapport.
Remerciements
Les auteurs tiennent à remercier Lorenzo Sewanan et Jorge Nunez pour leur travail de développement de la conception de cassettes de culture tissulaire utilisée dans ce protocole, le laboratoire Kaminski pour l’utilisation de leur vibratome, Maurizio Chioccioli et Jessica Nouws pour l’aide au tranchage des poumons, Allie LaRocco pour l’aide aux expériences pilotes initiales et Hong Qian pour la lecture attentive du protocole. Ce travail a été soutenu par les subventions des NIH F30HL143880 (K.L.L.), la subvention de formation du programme de formation des scientifiques médicaux T32GM136651 (K.L.L.) et U01HL145567 (L.E.N.); et par un don de recherche sans restriction de Humacyte Inc. (L.E.N.).
matériels
| Name | Company | Catalog Number | Comments |
| 3D Printer: Form 2 | Formlabs | ||
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | |
| 8-Bromo cAMP | Sigma | B7880 | |
| Agarose, UltraPure LMP | Invitrogen | 15517-014 | |
| Amphotericin B | Sigma | A2942 | |
| Barbed reducer fitting, 3/8 inch x 1/4 inch | McMaster-Carr | 5121K271 | |
| Benzonase nuclease | Sigma | E1014 | |
| Bovine serum albumin (BSA) Fraction V | Gemini | 700-104P | For AEC2 growth medium |
| Bovine serum albumin (BSA), standard grade | Gemini | 700-100P | For benzonase buffer |
| Check valve, polypropylene, 1/8 inch hose barb | Cole-Parmer | SK-98553-10 | |
| CHIR99021 | PeproTech | 2520691 | |
| Clear Resin, 1 L | Formlabs | RS-F2-GPCL-04 | |
| Cyanoacrylate glue, such as Krazy Maximum Bond Permanent Glue | Any hardware, craft, or drug store | KG483 or similar | |
| Dexamethasone | Sigma | D4902 | |
| DMEM (low glucose) | Gibco | 11885-084 | |
| DMEM (high glucose) | Gibco | 11965-092 | |
| DNA assay (Quant-iT PicoGreen dsDNA Assay Kit) | Invitrogen | P7589 | |
| EDTA, 0.5 M, pH 8.0 | AmericanBio | AB00502-01000 | |
| EdU kit (Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647) | Invitrogen | C10340 | Used according to manufacturer's directions |
| Elbow fitting, 3/8 inch | McMaster-Carr | 5121K907 | |
| F12 | Gibco | 11765-054 | |
| Fetal bovine serum (FBS), characterized | Hyclone | SH30071.03 | |
| Gentamicin sulfate | Gemini | 400-100P | Reconstituted in diH2O for a stock solution at 50 mg/mL |
| Hair clippers | Wahl | MiniArco | |
| Hank's balanced salt solution (HBSS), Phenol Red Free | Gibco | 14175-095 | |
| Heparin sodium injection, USP, 1000 U/mL | Sagent | NDC: 25021-400-30 | For intraperitoneal and intracardiac injection |
| Heparin sodium salt | Sigma | H4784 | For pulmonary artery perfusion; prepare stock solution at 100 U/mL in PBS |
| HEPES Buffer | Corning | 25-060-Cl | |
| Inline tee fitting, 3/8 inch x 1/8 inch | McMaster-Carr | 5121K851 | |
| Inoculating loop, disposable | Fisherbrand | 22-363-600 | |
| Insulin from bovine pancreas | Sigma | I6634 | |
| Ketamine injection, 100 mg/mL | Covetrus (Butler Animal Health) | 010177 | |
| KGF, recombinant human | PeproTech | 100-19 | |
| Laser cutter, VLS 3.50 30 watt | Universal Laser Systems | ||
| L-glutamine | Gibco | 25030-081 | |
| Luer-lock, female, 3/32 inch | Cole-Parmer | 45508-02 | |
| Luer-lock, male, 1/8 inch | Cole-Parmer | 30800-24 | |
| Luer-lock, male, 1/4 inch | McMaster-Carr | 51525K146 | |
| MCDB-131 Complete without serum | VEC Technologies | MCDB-131 WOFBS | |
| Magnesium chloride (MgCl2), 1 M | AmericanBio | AB09006-00100 | |
| NaCl | American Bioananalytical | AB01915 | |
| Phosphate buffered saline (PBS), without Ca2+ and Mg2+, 10X | Sigma | D1408 | Reconstitute to 1X with diH2O |
| Phosphate buffered saline (PBS), with Ca2+ and Mg2+ | Gibco | 21300-058 | |
| PDMS - SYLGARD 184 Silicone Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Penicillin/Streptomycin (10,000 U/mL penicillin/10,000 μg/mL streptomycin) | Gibco | 15140-122 | |
| Petri dish, 150 mm | Falcon | 351058 | |
| Plastic film (parafilm) | Bemis | PM-996 | |
| Pharmed BPT tubing, LS 16 | Masterflex | 06508-16 | |
| Pharmed BPT tubing, LS 17 | Masterflex | 06508-17 | |
| Platinum-cured silicone tubing, LS 14 | Masterflex | 96420-14 | |
| Platinum-cured silicone tubing, LS 16 | Masterflex | 96420-16 | |
| Platinum-cured silicone tubing, LS 36 | Masterflex | 96410-36 | |
| Poloxamer 407 (Pluronic F-127) | Sigma | P2443 | |
| Povidone/iodine prep pads, 10% | Dynarex Corporation | 1108 | |
| PTFE sheet, 0.060 inch (1/16 inch) thick | ePlastics | PTFENAT0.060X12X12 | For tissue culture cassette tabs |
| PTFE sheet, 0.093 inch (3/32 inch) thick | ePlastics | PTFENAT0.093X12X12 | For tissue culture cassette frames and clips |
| Peristaltic pump drive: Masterflex L/S Variable-Speed Digital Drive | Cole-Parmer | ZM-07528-30 | |
| Peristaltic pump head: Masterflex L/S Easy-Load II Pump Head | Cole-Parmer | EW-77202-60 | |
| Rat, Sprague Dawley | Charles River | Strain Code: 400 | |
| Razor blade | Any hardware or craft store | Personna 94-120-71 or similar | |
| Retinoic acid | Sigma | R2625 | |
| Rotary blades, 28 mm | Omnigrid | 2046 | |
| Rotary cutter, 28 mm | Olfa | Model 9551 | |
| Sodium deoxycholate (SDC) | Sigma | D6750 | |
| Sodium nitrorusside (SNP) | Sigma | 71778 | |
| Stopcock, 4-way | Edwards | 594WSC | |
| Suture, 4-0 monofilament polypropylene | Covidien | VP-557-X | |
| Syringe, 10 mL | BD | 302995 | |
| Syringe, 50 mL | BD | 309653 | |
| Tissue culture dish, 35 mm | Falcon | 353001 | |
| Tissue culture dish, 100 mm | Corning | 430167 | |
| Tissue culture plate, 6-well | Falcon | 353046 | |
| Tissue culture plate 12-well | Falcon | 353043 | |
| Transferrin human | Sigma | T8158 | |
| Tris, 1 M solution, pH 8.0 | AmericanBio | AB14043-01000 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| Vibratome, Compresstome VF-300-0Z | Precisionary Instruments LLC | ||
| Xylazine, 100 mg/mL | Henry Schein | NDC: 11695-4022-1 | |
| Y-connector, 1/16 inch barbed | Cole-Parmer | 30614-43 |
Références
- Burri, P. H. Morphology and respiratory function of the alveolar unit. International Archives of Allergy and Applied Immunology. 76, Suppl 1 2-12 (1985).
- Barkauskas, C. E., Noble, P. W. Cellular Mechanisms of Tissue Fibrosis. 7. New insights into the cellular mechanisms of pulmonary fibrosis. American Journal of Physiology. Cell Physiology. 306 (11), 987-996 (2014).
- Taylor, M. S., et al. A Conserved Distal Lung Regenerative Pathway in Acute Lung Injury. American Journal of Pathology. 188 (5), 1149-1160 (2018).
- Carsana, L., et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infectious Diseases. 20 (10), 1135-1140 (2020).
- Basil, M. C., et al. The Cellular and Physiological Basis for Lung Repair and Regeneration: Past, Present, and Future. Cell Stem Cell. 26 (4), 482-502 (2020).
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Desai, T. J., Brownfield, D. G., Krasnow, M. A. Alveolar progenitor and stem cells in lung development, renewal and cancer. Nature. 507 (7491), 190-194 (2014).
- Evans, M. J., Cabral, L. J., Stephens, R. J., Freeman, G. Renewal of alveolar epithelium in the rat following exposure to NO2. The American Journal of Pathology. 70 (2), 1-24 (1973).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Borok, Z., et al. Keratinocyte growth factor modulates alveolar epithelial cell phenotype in vitro: expression of aquaporin 5. American Journal of Respiratory Cell and Molecular Biology. 18 (4), 554-561 (1998).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Sucre, J. M. S., et al. Successful establishment of primary Type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Stem Cell. 21 (4), 472-488 (2017).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nature Methods. 14 (11), 1097-1106 (2017).
- Chen, Y. W., et al. A three-dimensional model of human lung development and disease from pluripotent stem cells. Nature Cell Biology. 19 (5), 542-549 (2017).
- Korogi, Y., et al. In vitro disease modeling of hermansky-pudlak syndrome Type 2 using human induced pluripotent stem cell-derived alveolar organoids. Stem Cell Reports. 12 (3), 431-440 (2019).
- Strikoudis, A., et al. Modeling of fibrotic lung disease using 3D organoids derived from human pluripotent stem cells. Cell Reports. 27 (12), 3709-3723 (2019).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Chapman, H. A. Epithelial responses to lung injury: Role of the extracellular matrix. Proceedings of the American Thoracic Society. 9 (3), 89-95 (2012).
- Guilak, F., et al. Control of stem cell fate by physical interactions with the extracellular matrix. Cell Stem Cell. 5 (1), 17-26 (2009).
- Zhou, Y., et al. Extracellular matrix in lung development, homeostasis and disease. Matrix Biology. 73, 77-104 (2018).
- Calle, E. A., et al. Targeted proteomics effectively quantifies differences between native lung and detergent-decellularized lung extracellular matrices. Acta Biomaterialia. 46, 91-100 (2016).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Bonvillain, R. W., et al. A nonhuman primate model of lung regeneration: Detergent-mediated decellularization and initial in vitro recellularization with mesenchymal stem cells. Tissue Engineering Part A. 18 (23-24), 2437-2452 (2012).
- O'Neill, J. D., et al. Decellularization of human and porcine lung tissues for pulmonary tissue engineering. The Annals of Thoracic Surgery. 96 (3), 1055(2013).
- Wagner, D. E., et al. Three-dimensional scaffolds of acellular human and porcine lungs for high throughput studies of lung disease and regeneration. Biomaterials. 35 (9), 2664-2679 (2014).
- Burgstaller, G., et al. Distinct niches within the extracellular matrix dictate fibroblast function in (cell free) 3D lung tissue cultures. American Journal of Physiology-Lung Cellular and Molecular Physiology. 314 (5), 708-723 (2018).
- Sun, H., et al. Fibroblast engraftment in the decellularized mouse lung occurs via a β1-integrin-dependent, FAK-dependent pathway that is mediated by ERK and opposed by AKT. American Journal of Physiology-Lung Cellular and Molecular Physiology. 306 (6), 463-475 (2014).
- Booth, A. J., et al. Acellular normal and fibrotic human lung matrices as a culture system for in vitro investigation. American Journal of Respiratory and Critical Care Medicine. 186 (9), 866-876 (2012).
- Schwan, J., et al. Anisotropic engineered heart tissue made from laser-cut decellularized myocardium. Scientific Reports. 6, 32068(2016).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Gerckens, M., et al. Generation of Human 3D Lung Tissue Cultures (3D-LTCs) for Disease Modeling. Journal of Visualized Experiments. (144), (2019).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465(2017).
- Neuhaus, V., et al. Assessment of the cytotoxic and immunomodulatory effects of substances in human precision-cut lung slices. Journal of Visualized Experiments. (135), e57042(2018).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (6), 1315-1321 (2002).
- Vaccaro, C., Brody, J. S. Ultrastructure of developing alveoli. I. The role of the interstitial fibroblast. The Anatomical Record. 192 (4), 467-479 (1978).
- Calle, E. A., et al. Fate of distal lung epithelium cultured in a decellularized lung extracellular matrix. Tissue Engineering Part A. 21 (11-12), 1916-1928 (2015).
- Dobbs, L. G., Gonzalez, R., Williams, M. C. An improved method for isolating type II cells in high yield and purity. American Review of Respiratory Disease. 134 (1), 141-145 (1986).
- Dobbs, L. G. Isolation and culture of alveolar type II cells. American Journal of Physiology. 258, 134-147 (1990).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Dobbs, L. G., Pian, M. S., Maglio, M., Dumars, S., Allen, L. Maintenance of the differentiated type II cell phenotype by culture with an apical air surface. The American Journal of Physiology. 273 (2), 347-354 (1997).
- Bruce, M. C., Honaker, C. E. Transcriptional regulation of tropoelastin expression in rat lung fibroblasts: changes with age and hyperoxia. American Journal of Physiology. 274 (6), 940-950 (1998).
- Berk, J. L., Franzblau, C., Goldstein, R. H. Recombinant interleukin-1 beta inhibits elastin formation by a neonatal rat lung fibroblast subtype. Journal of Biological Chemistry. 266 (5), 3192-3197 (1991).
- Schultz, C. J., Torres, E., Londos, C., Torday, J. S. Role of adipocyte differentiation-related protein in surfactant phospholipid synthesis by type II cells. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (2), 288-296 (2002).
- Maksvytis, H. J., et al. In vitro characteristics of the lipid-filled interstitial cell associated with postnatal lung growth: evidence for fibroblast heterogeneity. Journal of Cellular Physiology. 118, 113-123 (1984).
- Hopkinson, A., et al. Optimization of amniotic membrane (AM) denuding for tissue engineering. Tissue Engineering Part C: Methods. 14 (4), 371-381 (2008).
- Fernandez-Perez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Scientific Reports. 9 (1), 14933(2019).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nature medicine. 16 (8), 927-933 (2010).
- Le, A. V., et al. Efficient and Functional Endothelial Repopulation of Whole Lung Organ Scaffolds. ACS Biomaterials Science & Engineering. 3 (9), 2000-2010 (2017).
- Ren, X., et al. Engineering pulmonary vasculature in decellularized rat and human lungs. Nature Biotechnology. 33 (10), 1097-1102 (2015).
- Wagner, D. E., et al. Comparative decellularization and recellularization of normal versus emphysematous human lungs. Biomaterials. 35 (10), 3281-3297 (2014).
- Balestrini, J. L., et al. Comparative biology of decellularized lung matrix: Implications of species mismatch in regenerative medicine. Biomaterials. 102, 220-230 (2016).
- Alysandratos, K. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636(2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon