Method Article
Tejidos pulmonares diseñados preparados a partir de rodajas pulmonares descelularizadas
En este artículo
Resumen
Este protocolo describe un método para generar tejidos pulmonares reproducibles y diseñados a pequeña escala, mediante la repoblación de rodajas pulmonares descelularizadas cortadas con precisión con células epiteliales alveolares tipo 2, fibroblastos y células endoteliales.
Resumen
Existe la necesidad de mejorar los modelos pulmonares en 3 dimensiones (3D) que recapitulan la complejidad arquitectónica y celular del alvéolo pulmonar nativo ex vivo. Los modelos organoides desarrollados recientemente han facilitado la expansión y el estudio de progenitores epiteliales pulmonares in vitro, pero estas plataformas generalmente se basan en la matriz y / o suero derivado de tumores de ratón, e incorporan solo uno o dos linajes celulares. Aquí, describimos un protocolo para generar tejidos pulmonares diseñados (ELT) basado en la recelularización multilinaje de cortes pulmonares de corte de precisión descelularizados (PCLS). Los ELT contienen estructuras similares a las alveolares que comprenden epitelio alveolar, mesénquima y endotelio, dentro de un sustrato de matriz extracelular (ECM) muy parecido al del pulmón nativo. Para generar los tejidos, los pulmones de las ratas se inflan con agarosa, se cortan en rodajas de 450 μm de espesor, se cortan en tiras y se descelularizan. Los andamios de ECM acelulares resultantes se vuelven a sembrar con células endoteliales primarias, fibroblastos y células epiteliales alveolares tipo 2 (AEC2). Los AEC2 se pueden mantener en cultivo con ELT durante al menos 7 días con un medio de crecimiento libre de suero y definido químicamente. A lo largo del proceso de preparación y cultivo de tejidos, las rodajas se recortan en un sistema de casete que facilita el manejo y la siembra celular estandarizada de múltiples ELT en paralelo. Estos ELT representan una plataforma de cultivo organotípica que debería facilitar las investigaciones de las interacciones célula-célula y célula-matriz dentro del alvéolo, así como las señales bioquímicas que regulan los AEC2 y su nicho.
Introducción
Los alvéolos son las unidades funcionales del pulmón distal, que comprenden una malla de espacios aéreos de intercambio de gases revestidos por células epiteliales alveolares tipo 1 (AEC1) y células tipo 2 (AEC2). Detrás del epitelio hay una densa red de capilares, así como un mesénquima de soporte, todo reforzado por un andamio de matriz extracelular (ECM) que proporciona fuerza y flexibilidad a estos delicados sacos de aire1. Los alvéolos también son el sitio de lesión en numerosas patologías pulmonares, incluida la fibrosis pulmonar idiopática2, el síndrome de dificultad respiratoria aguda3 y la enfermedad grave por coronavirus-19 (COVID-19)4. Aunque el trabajo realizado durante la última década ha descubierto una notable plasticidad dentro del epitelio pulmonar, los mecanismos que permiten la reparación pulmonar distal en algunos entornos, y que impiden la reparación en otros, siguen siendo un área de intensa investigación5. El desarrollo de plataformas in vitro mejoradas para modelar el alvéolo facilitaría los estudios de biología alveolar, regeneración y terapéutica.
Los AEC2 se autorrenuevan y se diferencian en AEC1, y por lo tanto se consideran la célula madre primaria del pulmón distal 6,7,8. Sin embargo, estas células plantean un desafío particular para el estudio in vitro dadas las dificultades asociadas con el cultivo de AEC2 primarios sin una pérdida del fenotipo9. En el cultivo convencional de 2 dimensiones (2D), los AEC2 se aplanan y adoptan algunas características de las células similares a AEC110. Por el contrario, las estrategias de cultivo 3D, más comúnmente organoides, apoyan el mantenimiento de características diferenciadas en AEC2 primarios 6,11,12 y permiten el cultivo a largo plazo de AEC2 derivados de células madre pluripotentes (PSC)13,14. Los organoides se han utilizado para modelar el desarrollo pulmonar distal15, la infección viral11,15 y la enfermedad genética relacionada con AEC2 13,16,17, lo que permite obtener información importante sobre la biología y la regeneración de AEC2. Sin embargo, estos modelos de cultivo generalmente comprenden solo uno o dos linajes celulares, e incrustan las células en matrices de tipo gel que no logran recapitular ni la arquitectura ni el sustrato de ECM del alvéolo pulmonar nativo.
El ECM es un regulador crítico del fenotipo y el comportamiento celular a través de señales moleculares, topológicas y mecánicas; comprende un componente clave de nichos específicos de tejidos que regulan el destino de las células madre; y sirve como reservorio que modula la disponibilidad de factores de crecimiento secretados localmente 18,19,20,21. Por lo tanto, el cultivo de células en ECM nativa puede aumentar la capacidad predictiva de los sistemas in vitro para modelar la biología de los tejidos in vivo. La descelularización, un proceso que elimina el material celular de los tejidos a través de detergentes, enzimas o métodos físicos o de otro tipo, puede preservar en gran parte el andamiaje de ECM de un órgano nativo, cuando se realiza cuidadosamente22,23. Tales andamios se pueden repoblar con células para el cultivo biomimético 3D. Sin embargo, mientras que los andamios descelularizados son ampliamente utilizados para aplicaciones de ingeniería de tejidos, su uso para el cultivo celular de rutina ha sido limitado. Varios estudios previos han reportado la descelularización y recelularización de cortes pulmonares o pequeños segmentos de tejido pulmonar. Además de los estudios de prueba de concepto 24,25,26, se han utilizado lonchas pulmonares repobladas para estudiar la adhesión fibroblasto-matriz 27,28 e investigar el efecto de las matrices pulmonares enfermas sobre el fenotipo27,29 de fibroblastos. Con tecnologías mejoradas disponibles para generar cortes de tejido cortados con precisión, los cortes de pulmón descelularizados podrían ofrecer una plataforma conveniente y a pequeña escala con la que cultivar células, al tiempo que preservan las subestructuras alveolares, respiratorias y vasculares. La incorporación de múltiples tipos de células permitiría estudios de interacciones célula-célula dentro de un entorno 3D fisiológicamente relevante. Sin embargo, se necesitan estrategias mejoradas para facilitar el manejo de los tejidos durante todo el proceso de cultivo y para garantizar la siembra controlada y reproducible de tejidos con un número conocido de células.
Aquí, presentamos un protocolo para generar tejidos pulmonares diseñados (ELT) mediante la repoblación de rodajas pulmonares descelularizadas cortadas con precisión (PCLS) con células endoteliales primarias, AEC2 y fibroblastos. En una adaptación de nuestro sistema de tejido cardíaco de ingeniería previamente descrito30 y las estrategias de descelularización-recelularización pulmonar completa22,31, describimos procedimientos para cortar el PCLS de los pulmones de rata y para cortar las rebanadas en casetes de cultivo de tejidos reutilizables que simplifican y estandarizan las manipulaciones posteriores. Las rodajas recortadas se descelularizan para formar andamios ecm acelulares, que se repoblan en baños de siembra personalizados. Los andamios de corte pulmonar preservan los componentes y la arquitectura críticos de ECM, y apoyan el crecimiento de AEC2 dentro de estructuras alveolares de múltiples linajes durante al menos 7 días. Los ELT representan un nuevo sistema de cocultivo alveolar dentro de una matriz 3D fisiológicamente relevante, que debería apoyar el desarrollo de estrategias de ingeniería de tejidos pulmonares, al tiempo que facilita los estudios biológicos básicos de AEC2 y el alvéolo.
Protocolo
Todos los procedimientos experimentales con animales descritos en este documento fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de Yale.
1. Creación de casetes de cultivo de tejidos y baños de siembra
NOTA: Una vez hechos, los casetes de cultivo de tejidos y los baños de siembra pueden ser autoclavados y reutilizados para rondas repetidas de cultivo de ELT.
-
Casetes de cultivo de tejidos
- Utilice un cortador láser para cortar los marcos y clips de casete de cultivo de tejidos de politetrafluoroetileno (PTFE) de 3/32 pulgadas de espesor de acuerdo con los diseños proporcionados en el Archivo Suplementario 1 y el Archivo Suplementario 2, respectivamente. Use un cortador láser para cortar las pestañas de casete de cultivo de tejidos de PTFE de 1/16 de pulgada de grosor de acuerdo con el Archivo Suplementario 3. El corte se delinea 3x usando 80% de potencia y 15% de velocidad (para un cortador láser de 30 W).
-
Baños de siembra
- Utilice los archivos CAD del baño de siembra (Archivo suplementario 4 y Archivo complementario 5) para imprimir en 3D la base y el anillo del molde del baño de siembra, respectivamente, utilizando resina transparente.
- Remoje los moldes en una solución de poloxámero 407 al 10% en agua destilada durante la noche antes de usarlos para ayudar en la liberación de PDMS. Deje secar al aire, luego coloque el anillo sobre la base del molde y envuélvalo en una película de plástico flexible para ayudar a evitar fugas.
- Prepare al menos 60 g por molde de polidimetilsiloxano (PDMS) mezclando elastómero PDMS en una proporción de 10: 1 con agente de curado y vierta en el molde impreso en 3D. Desgasifica el PDMS en un desecador al vacío durante 30 minutos para eliminar cualquier burbuja de aire.
- Hornea los baños de siembra a 60 °C durante 8 h.
2. Preparación de rodajas de pulmón cortadas con precisión de pulmones de rata
- Sustracción de órganos
- Prepare un sistema de perfusión dividida que comprenda extremidades impulsadas por gravedad y bomba, como se muestra en la Figura 1. Conecte una cánula de arteria pulmonar (AP) al extremo del tubo, que comprende un conector Y de púas de 1/16 de pulgada conectado a una longitud de 1/2 pulgada de tubo de silicona LS 14 y un conector luer-lock hembra de 3/32 pulgadas (consulte la Figura 1). No conecte una válvula de retención a la cánula en este momento.
- Cebar las líneas con PBS que contenga 100 U/mL de heparina y 0,01 mg/ml de nitroprusiato sódico (SNP) para la anticoagulación y vasodilatación, respectivamente. Ajuste previamente la bomba de perfusión a 30 ml/min.
NOTA: Agregue SNP fresco a la solución de heparina y manténgalo protegido de la luz. - Dosifique a una rata Sprague-Dawley adulta (8-12 semanas de edad, aproximadamente 300-350 g) con una inyección intraperitoneal (IP) de 400 U/kg de heparina para la anticoagulación, seguida de una inyección IP de ketamina (75 mg/kg) y xilazina (5 mg/kg) para la anestesia. Confirmar un plano quirúrgico de anestesia por falta de respuesta al estímulo nocivo (pellizco del dedo del pie).
- Recorte el pecho y el abdomen de la piel con cortapelos. Luego rocíe con 70% de etanol y limpie 3x con 10% de povidona yodada.
- Agarre la piel por debajo del nivel del diafragma con fórceps de dientes de rata. Luego haga una incisión transversal de 1/2 pulgada en la piel con tijeras de punta fina. Agarre la fascia abdominal expuesta con las pinzas, haga una incisión transversal de 1/2 pulgada en la fascia y luego extienda la incisión a través de la piel y la fascia a lo ancho de la parte superior del abdomen.
- Use la punta de las tijeras finas para hacer una pequeña incisión (no más de 1/8 de pulgada) en el centro del diafragma anterior, lo que hace que los pulmones se retraigan en el tórax. Extienda la incisión en el diafragma a lo largo de todo el ancho del tórax.
- Haga dos incisiones verticales a través de toda la altura de la caja torácica hacia el cuello, teniendo cuidado de no dañar los pulmones. Extienda la incisión a través de las costillas izquierdas para cortar a través de la clavícula y a lo largo del lado del cuello hasta el nivel de la laringe, exponiendo la tráquea.
- Diseccionar la tráquea libre del tejido conectivo circundante y del esófago. Haga una incisión transversal a través de la mitad anterior de la tráquea entre dos anillos de cartílago, cerca de la laringe. Enhebrar una sutura de polipropileno 4-0 detrás de la tráquea, por debajo del nivel de la incisión, y atar libremente la primera mitad del nudo de un cirujano con dos giros.
- Coloque una cánula que comprende un conector en Y de púas de 1/16 de pulgada conectado a una válvula de retención unidireccional y una longitud de 1/2 pulgada de tubo de silicona LS 14 con un conector luer-lock hembra de 3/32 pulgadas (consulte la Figura 1) en la tráquea insertando una extremidad del conector Y en la incisión traqueal hacia la dirección de los pulmones.
- Coloque el lazo de sutura preatado alrededor de la tráquea al nivel de la cánula insertada y apriete alrededor del conector Y insertado para asegurar la cánula en su lugar. Agregue dos lanzamientos de una sola vuelta de la sutura para completar el nudo.
- Llene una jeringa de 10 ml con aire y conéctela a la cerradura luer de la cánula traqueal.
- Sujete la vena cava inferior cerca del diafragma con un hemostático curvo, luego inyecte al corazón 150 U de heparina (1000 U / ml) a través del ventrículo derecho (RV).
- Abrir parcialmente la llave de paso de la línea de gravedad, para producir un goteo lento pero constante de PBS/heparina/SNP de la cánula PA preparada en el paso 2.1.1.
- Enhebra la aguja de una sutura de polipropileno 4-0 detrás de la base de la AP donde sale de la RV. Use la primera mitad del nudo de un cirujano para atar previamente un lazo suelto de sutura alrededor de la base de la PA.
- Haga una pequeña incisión (no más de 1/8 de pulgada) en el RV justo debajo y perpendicular al PA usando tijeras finas, luego inserte una extremidad del conector Y de la cánula PA en la base del PA. Asegure la sutura alrededor del PA y el conector insertado y agregue un lanzamiento de un solo giro para completar el nudo del cirujano.
NOTA: La canulación de la AF bajo flujo evita la introducción de burbujas de aire en la vasculatura que pueden impedir la limpieza adecuada de los pulmones. - Conecte una válvula unidireccional al otro extremo del conector Y del catéter PA, luego corte el ápice del corazón para permitir el flujo sanguíneo a través del ventrículo izquierdo.
NOTA: No cortar el ápice del corazón antes de perfundir a través de la bomba puede causar daño a la barrera de gases en sangre, lo que lleva a la fuga de líquido en los espacios aéreos. - Cambie la línea de perfusión al lado de la bomba utilizando la llave de paso que conecta las dos líneas, luego encienda la bomba a 30 ml / min. Mientras perfunde los pulmones a través de la AP, ventile manualmente los pulmones a través de la jeringa traqueal de 10 ml a aproximadamente 10-15 respiraciones / min, para facilitar la limpieza de los pulmones de sangre. Perfundir los pulmones hasta que se vuelvan en su mayoría blancos, generalmente requiriendo 40 ml de PBS / heparina / SNP o menos.
NOTA: La limpieza inadecuada de los pulmones de la sangre puede afectar la descelularización aguas abajo. - Corte la tráquea posterior justo por encima del nivel de la cánula traqueal, y luego diseccione los pulmones y el corazón libres de todo el tejido conectivo restante y extraiga los pulmones y el corazón en bloque.
- Llene una jeringa de 10 ml con agarosa de bajo punto de fusión al 2% en la solución salina equilibrada (HBSS) de Hank sin rojo fenol, precalentada a 42 °C.
NOTA: El volumen exacto de agarosa requerido variará según el tamaño del pulmón. Los pulmones más grandes (es decir, de ratas mayores de 400 g) requerirán más de 10 ml de agarosa. - Inflar manualmente los pulmones extraídos 3 veces con 10 ml de aire (es decir, aproximadamente la capacidad pulmonar total) a través de la cánula de la tráquea para ayudar a reclutar el parénquima colapsado.
- Infle inmediatamente los pulmones con la jeringa preparada de agarosa inyectando manualmente la agarosa a través de la cánula de la tráquea a una velocidad de aproximadamente 40 ml / min, solo hasta que se inflen las puntas más distales de los lóbulos pulmonares. Si las regiones distales del pulmón permanecen colapsadas, inyecte 1-2 ml adicionales de agarosa.
- Cubra la tráquea uniendo la tapa blanca de una llave de paso de 4 vías a la cerradura luer hembra de la cánula traqueal. Coloque el pulmón en una placa de Petri de 150 mm sobre hielo para permitir que la agarosa se solidifique.
NOTA: El inflado del pulmón poco después de la extracción es fundamental para garantizar el llenado uniforme del parénquima pulmonar y el posterior corte de tejido exitoso. Si el pulmón se infla de manera muy desigual, no proceda con el corte pulmonar, ya que la calidad de la rebanada será pobre.
- Corte pulmonar
NOTA: Es posible que sea necesario adaptar el procedimiento de corte exacto en función del microtomo vibratorio (vibrátomo) que se está utilizando; ejemplos adicionales de preparación de PCLS con varias cortadoras de tejido se han publicado anteriormente 32,33,34.- Enfríe previamente el bloque de enfriamiento de metal a -20 ° C y manténgalo en hielo cuando no se use durante todo el procedimiento de corte.
- Use una pequeña gota de pegamento de cianoacrilato para unir una cuchilla al soporte de la cuchilla. Fije cuidadosamente el soporte de la cuchilla al vibrátomo con una llave Allen para que se alinee con el extremo de un tubo de muestra insertado en la bandeja de amortiguación.
- Prepare placas de 6 pocillos con 3 ml por hbss helado estéril estéril sin rojo fenol para recoger las rodajas.
- Con un bisturí, corte un trozo de tejido pulmonar de aproximadamente 1-1,5 cm3.
NOTA: El tejido pulmonar de las porciones inferior y media del lóbulo izquierdo, así como de los lóbulos medio e inferior derecho, produce más fácilmente cortes de tejido más grandes que maximizan el área alveolar. Si hay regiones de tejido no inflado o áreas de tejido conectivo, recorte este tejido con tijeras u indíquese hacia abajo hacia el émbolo; dicho tejido tiende a no cortar limpiamente. - Coloque una pequeña gota de pegamento de cianoacrilato sobre el émbolo del tubo de muestra. Aplique el tejido pulmonar en una toallita de papel para eliminar el exceso de humedad y luego coloque inmediatamente el tejido pulmonar en la parte superior del émbolo con un par de fórceps.
- Deslice el tubo de metal del tubo de muestra hasta el nivel de la parte superior del tejido y manténgalo en su lugar, con el émbolo retrocediendo. Pipeta precalentada 2% de agarosa en HBSS en la parte superior del tubo para rodear completamente el tejido.
- Coloque el bloque de enfriamiento helado alrededor del tejido durante aproximadamente 1 minuto para permitir que la agarosa se solidifique.
- Inserte el tubo de muestra en la bandeja de amortiguación. Llene la bandeja con PBS helado hasta la mitad del bloque de tejido. Gire el interruptor de la caja del motor a avance rápido (FF) para avanzar el émbolo de la caja del motor de modo que solo toque la base del tubo de muestra.
- Establezca los ajustes deseados para el grosor de la rebanada, la velocidad de corte y la frecuencia de oscilación, por ejemplo, espesor de 450 μm, velocidad 4 y frecuencia de oscilación 5. Seleccione Modo continuo y, a continuación, gire el interruptor a Activado para comenzar a cortar.
- A medida que las rodajas de tejido caen en la bandeja tampón, transfiéralas a las placas de 6 pocillos preparadas usando un lazo inocular o espátula.
- Deje de cortar cuando queden ~2 mm de espesor de tejido en el tubo de la muestra, para evitar dañar la cuchilla o cortar el tejido que contiene pegamento.
- Repita los pasos anteriores para cortar tejido pulmonar adicional, según lo desee.
- Descelularizar las rodajas inmediatamente para la preparación del andamio, o congelarlas a presión y almacenarlas a -80 °C durante un máximo de 2 meses. Para congelar, transfiera 4-6 rebanadas a una placa de Petri de 35 mm y aspire cuidadosamente cualquier exceso de líquido alrededor de las rebanadas. Coloque los platos en un baño de hielo seco y etanol 100% para congelarlos, luego envuélvalos en papel de aluminio, selle en una bolsa de plástico y transfiéralos a -80 ° C.
NOTA: No coloque rodajas frescas directamente en un congelador de -80 ° C, ya que la tasa relativamente lenta de congelación puede hacer que se formen cristales de hielo que pueden dañar el tejido.
3. Preparación de andamios de tejido pulmonar
- Preparación de Materiales y Soluciones de Descelularización
- Fotogramas, clips y pestañas de autoclave.
- Preparar soluciones de descelularización como se describe en la Tabla 1.
NOTA: Agregue la nucleasa benzonasa al tampón precalentado inmediatamente antes de usar y al filtro estéril. Preparar soluciones de Tritón X-100 y desoxicolato de sodio (SDC) dentro de las 24-48 h del procedimiento de descelularización. Preparar soluciones antibióticas/antimicóticas y tampón de benzonasa hasta 30 d por adelantado y conservar a 4 °C.
- Corte y recorte de rodajas pulmonares
NOTA: Si bien el corte y el recorte se pueden realizar de forma no estéril en la mesa de trabajo, los pasos de descelularización en la sección 3.3 y todo el manejo posterior de los andamios de tejido deben realizarse en una campana de flujo laminar.- Llene una placa de Petri de 100 mm aproximadamente un tercio llena con PBS. Transfiera casetes (marcos que contienen dos clips cada uno) y pestañas al plato usando fórceps.
- Si usa rebanadas congeladas, descongele un plato a la vez vertiendo PBS a temperatura ambiente en el plato para cubrir las rebanadas. Mantenga los platos restantes en hielo seco.
- Transfiera una rodaja descongelada a una placa de Petri de 150 mm. Despliegue suavemente la rebanada con fórceps finos, si es necesario, para que quede plana, luego aspire cuidadosamente el exceso de PBS alrededor del tejido.
- Use una cuchilla de afeitar, con una regla como guía, para cortar una tira de 3 mm de ancho de la rodaja presionando la longitud completa de la cuchilla firmemente contra el plato y meciéndola ligeramente de lado a lado con el borde de la cuchilla mantenido en su lugar. Alternativamente, use un cortador rotativo adaptado con 2 cuchillas paralelas separadas por un espaciador personalizado de 3 mm (por ejemplo, hecho de acetal [polioximetileno]) para cortar tiras de tejido. Evite cualquier desgarro, agujeros, vías respiratorias o vasos grandes, o tejido conectivo grueso.
NOTA: Para un recorte exitoso, la tira debe tener al menos 9 mm de largo. - Con fórceps, transfiera la tira de tejido a la placa de Petri de 100 mm preparada.
- Recorte la tira de tejido en el cassette: flote el tejido sobre el cassette, centrando el tejido para que sobresalga de los orificios en los clips en cada extremo. Con fórceps finos, coloque una pestaña parcialmente en el orificio en un extremo, enderece suavemente el tejido y luego coloque la segunda pestaña. Usando fórceps en cada mano, presione cada pestaña completamente para asegurar el tejido.
NOTA: Si tiene dificultades para mantener el tejido en su lugar antes del recorte, aspire un poco de PBS del plato para reducir el nivel de líquido. Tenga cuidado de no estirar el tejido al colocar el segundo clip, ya que esto puede provocar desgarro. - Repita el procedimiento de descongelación, corte y recorte en los pasos 3.2.2-3.2.6 para tantos tejidos como desee.
- Descelularización de rebanadas
- Una vez que se hayan recortado todas las rodajas, transfiera el plato de 100 mm que contiene los casetes a una campana de flujo laminar.
- Comience el paso 1 del protocolo de descelularización (ver Tabla 2): usando un hemostático curvo para agarrar los lados con muescas de cada cassette, transfiera cassettes a placas de 6 pocillos (2 tejidos/pozo) llenas de 3 mL de PBS + iones + antibióticos/antimicóticos por pozo (ver receta de solución en la Tabla 1).
- Coloque las placas de pozo en un agitador orbital a 30 rpm durante 10 min.
- Continúe con el paso 2 del protocolo de descelularización (ver Tabla 2): aspire el líquido de cada pozo, luego reemplace con 3 ml / pocillo PBS + iones, coloque la placa en el agitador orbital a 30 rpm e incube durante 5 min.
- Repita el paso 3.3.4 para cada una de las soluciones y duraciones correspondientes como se describe en el protocolo de descelularización de la Tabla 2.
- Después de la etapa final de enjuague con PBS + antibióticos / antimicóticos (paso 20 de la Tabla 2), transfiera los tejidos a placas estériles de 6 pocillos con PBS + antibióticos / antimicóticos frescos e incube a 37 ° C durante 48 h.
NOTA: Después de la esterilización con antibióticos/antimicóticos, los andamios de tejido pulmonar se pueden sembrar inmediatamente o almacenarse a 4 °C hasta 30 d.
4. Recelularización y cultivo de rodajas
NOTA: La Figura 2 muestra una línea de tiempo propuesta para la siembra y el cultivo de tejidos, en la que las rebanadas se siembran primero con células endoteliales microvasculares de pulmón de rata y se cultivan en medio endotelial de bajo suero; luego se sembraron con AEC2 de rata y fibroblastos pulmonares de rata con un medio de crecimiento AEC2 libre de suero (adaptado de Jacob et al.13 y You et al.35); consulte notas adicionales sobre las fuentes de celdas utilizadas en Resultados y detalles de los medios de cultivo en la Tabla 3. Esta estrategia produce estructuras similares a las alveolares que contienen monocapas AEC2.
- Preparación de andamios de tejido para la siembra (día -4 o -3)
- Si utiliza andamios tisulares almacenados a 4 °C, incube los andamios durante la noche a 37 °C con PBS + antibióticos/antimicóticos frescos (10% de penicilina/estreptomicina, 4% de anfotericina B, 0,4% de gentamicina en PBS) antes de la siembra.
- Enjuague los andamios 3x con PBS estéril (5 ml/pocillo), 5 min cada uno.
- Examine los andamios bajo un microscopio de contraste de fase a un aumento de 5x para seleccionar los tejidos para la siembra.
NOTA: Los mejores andamios para la siembra no tienen desgarros ni agujeros y no contienen vías respiratorias o vasos grandes. Si bien los andamios con las características pueden sembrarse con éxito, los patrones de repoblación pueden diferir de los observados en áreas alveolares.
- Siembra de células endoteliales (Día -3)
- Contar las células endoteliales usando un hemocitómetro y preparar la suspensión de células endoteliales en medio endotelial (ver Tabla 3) a 5 x 106 células/ml, con células suficientes para sembrar 500.000 células endoteliales por rebanada (por ejemplo, para 12 rebanadas, resuspendir 6 x 106 células en medio de 1,2 ml).
- Coloque los baños de siembra en autoclave en placas de Petri de 100 mm. Transfiera los andamios enjuagados boca abajo a los baños de siembra: use un hemostático curvo fino para agarrar un cassette por los lados con muescas, use un hemostático recto o fórceps para agarrar un extremo del cassette (teniendo cuidado de no tocar el tejido en sí) y voltee, y luego agarre el cassette nuevamente con las puntas del hemostático curvo fino a través de los orificios a lo largo de los lados con muescas, y colocar en un pozo de baño de siembra. Repita para los casetes restantes.
NOTA: Cuando se colocan correctamente, los andamios estarán centrados, boca abajo, en la parte inferior de cada pozo. Si es necesario, presione suavemente hacia abajo en la esquina del cassette con las puntas de un hemostático para asegurarse de que el cassette esté sentado en el pozo. El asiento inadecuado del casete puede conducir a una mala siembra de tejido. Es aceptable si el pozo contiene una pequeña cantidad de PBS. - Agite suavemente la suspensión celular preparada para mezclar, luego use una pipeta manual para pipetear células de 100 μL directamente sobre cada tejido en la base del pozo, teniendo cuidado de no dañar el tejido con la punta de la pipeta.
- Transfiera los tejidos sembrados a la incubadora de cultivo celular a 37 °C/5% CO2.
- Después de 2 h, agregue 900 μL de medio de cultivo precalentado a cada pozo con una pipeta manual, luego regrese a la incubadora. Si un cassette se dessembra (flota) al agregar medio, presione suavemente hacia abajo en la esquina del cassette con la punta de la pipeta para que quede plana en el pozo.
- Cambiar de medio el día -2. Retire el medio inclinando la placa de Petri y canalizando manualmente con una punta de pipeta ligeramente colocada en la esquina del pozo, para no molestar al cassette. Reemplace con 1 ml de medio endotelial fresco por pozo.
- AEC2 y siembra de fibroblastos y cultivo de tejidos (Día 0)
- Cuente AEC2 y fibroblastos usando un hemocitómetro. Preparar una suspensión celular 1:1 de AEC2 y fibroblastos en medio de crecimiento AEC2 (medio base epitelial + suplementos de AEC2; ver Tabla 3) a 5 x 106 células totales/ml, con células suficientes para sembrar 500.000 células (250.000 AEC2 y 250.000 fibroblastos) por rebanada (por ejemplo, para 12 rebanadas, resuspender 3 x 106 AEC2s + 3 x 106 fibroblastos juntos en medio de 1,2 mL).
- Saque el medio de cada pozo del baño de siembra como se describe en el paso 4.2.6. Gire la suspensión celular preparada suavemente para mezclar, luego pipetee las células de 100 μL directamente sobre cada tejido en la base del pozo.
NOTA: Es aceptable si una pequeña cantidad de medio endotelial permanece en el pozo antes de la siembra de AEC2/fibroblastos. - Transfiera los tejidos sembrados a la incubadora de cultivo celular a 37 °C/5% CO2.
- Después de 2 h, agregue 900 μL de medio de crecimiento AEC2 precalentado a cada pozo, luego regrese a la incubadora.
- Después de 24 h de cultivo (día 1), prepare una placa de 12 pocillos con 1 ml de medio de crecimiento AEC2 precalentado por pocillo por casete.
- Pipeta 800 μL de medio de cada pocillo del baño de siembra. Retire los casetes del baño de siembra: agarre cada uno con un hemostático curvo fino a través de los orificios a lo largo de los lados con muescas, transfiera a un hemostático recto o fórceps para agarrar el cassette en un extremo y voltee, luego use el hemostático curvo para agarrar el cassette a través de los lados con muescas y transfiera el lado derecho hacia arriba, uno por pozo, a la placa de 12 pocillos preparada.
- Cambie el medio de cultivo en la placa de 12 pocillos cada dos días hasta el día 7 o durante la duración deseada del cultivo: use una pipeta Pasteur de vidrio para aspirar el medio de cada pozo, teniendo cuidado de no tocar el tejido; pipeta en medio de crecimiento AEC2 fresco de 1 ml por pozo.
NOTA: El grado de repoblación tisular puede ser monitoreado a través de microscopía de contraste de fase a un aumento de 5x durante toda la duración del cultivo.
5. Recolección de tejidos y análisis de muestras
- Para fijar los ELT para la histología y la tinción inmunofluorescente, transfiera los casetes de cultivo de tejidos al 10% de formalina tamponada neutra e incube durante 3-4 h a temperatura ambiente en un balancín. Retire los tejidos de los casetes usando la punta de un fórceps de punta fina para cortar el tejido donde se encuentra con las pestañas. Procesar el tejido de acuerdo con los métodos de rutina para la incrustación de parafina y la histología; no se requieren técnicas especializadas.
- Para procesar ELT para qRT-PCR, enjuague los tejidos en casetes en PBS 2x, luego retire los tejidos y congele por chasquido o proceda con la lisis para la extracción de ARN.
NOTA: Agrupar al menos 2 rebanadas sembradas con 1 x 106 células y cultivadas durante 7 días debería producir un amplio ARN para el análisis de PCR aguas abajo.
Resultados
En la Figura 3 se presenta una visión general del proceso para generar ELT, que comprende el corte pulmonar, el recorte y la descelularización de cortes, y la repoblación de andamios. Los ELT aquí presentados se cultivaron utilizando células endoteliales microvasculares primarias de pulmón de rata (ver Tabla de Materiales), AEC2 de rata neonatal y fibroblastos pulmonares de rata neonatal enriquecidos con lipofibroblastos36. Los AEC2 fueron recién aislados mediante clasificación magnética basada en perlas como se describió anteriormente37; se han detallado y discutido protocolos alternativos de aislamiento en otros lugares 38,39,40. La pureza de los AEC2 aislados de rata se puede evaluar mediante citometría de flujo para el marcador de superficie AEC2 específico de la rata RTII-7041, o mediante la tinción de una muestra de células citocentrifugadas para RTII-70 o proteína prosurfactante C (pSPC). Los fibroblastos pulmonares de rata se aislaron de cachorros de rata postnatales de día 7-9 de acuerdo con una adaptación de un protocolo publicado42 y se utilizaron en el pasaje 1-2; en otra parte se han descrito protocolos alternativos de aislamiento43,44. La pureza de los fibroblastos aislados se puede evaluar mediante la tinción de células cultivadas o citocentrifugadas para el marcador mesenquimal vimentina, y el enriquecimiento de lipofibroblastos se puede evaluar mediante tinción para Oil Red O45.
Cuando el tejido pulmonar se infla uniformemente con agarosa y las piezas de tejido se seleccionan estratégicamente y se orientan para el corte a fin de maximizar el área de tejido total y parenquimatoso, un pulmón de rata puede producir tejido para > 100 ELT alveolares. Las tiras de PCLS exhiben suficiente integridad mecánica para ser enganchadas en casetes de tejido con pocos (<5%) casos de desgarro (Figura 3B).
El protocolo para descelularizar las rebanadas pulmonares se basa estrechamente en nuestro protocolo de descelularización pulmonar completa publicado anteriormente, que mediante proteómica cuantitativa se demostró que preserva muchos componentes de ECM a niveles no significativamente diferentes de los del pulmón nativo22. Los andamios de rodajas descelularizados preservan la arquitectura nativa de los alvéolos, vista por tinción de hematoxilina y eosina (H&E) (Figura 4A, B) y por microscopía de contraste de fase (Figura 4C). Por lo general, excluimos los andamios que contienen vías respiratorias o vasos grandes (Figura 4D) o lágrimas, aunque los primeros pueden incluirse si son de interés para el investigador. La descelularización conduce a una reducción del 96% en el contenido de ADN tisular medido por un ensayo para ADN de doble cadena (ver Tabla de Materiales; 0.50 μg / mg ± 0.073 μg / mg vs 0.018 μg / mg ± 0.0035 μg / mg en tejido nativo vs descelularizado, respectivamente, promedio ± SEM) (Figura 5A), sin ADN visible por tinción de hematoxilina (Figura 4B). La tinción histológica e inmunofluorescente de andamios descelularizados revela el mantenimiento de las proteínas ECM colágeno, elastina, colágeno IV y laminina con una arquitectura y cantidad similar a la de las rodajas pulmonares nativas (Figura 5B-E). Tenga en cuenta que los núcleos de los tejidos nativos se tiñen de azul / negro con tinciones de tricoma (para colágeno) y EVG (para elastina). La tinción inmunofluorescente se realizó como se describió anteriormente, utilizando métodos estándar para teñir tejidos37. Los anticuerpos utilizados y sus respectivas concentraciones se enumeran en la Tabla 4.
La repoblación exitosa de andamios conduce a ELT altamente celulares después de 7 días, con un patrón de repoblación similar alveolar visible por microscopía de luz (Figura 6A-C). En algunos casos, con una celularidad muy alta, las estructuras de tipo organoide pueden ser visibles (Figura 6A, B). La siembra de tejido fallida se puede visualizar mediante microscopía de contraste de fase durante el cultivo (Figura 6C). Después de cultivar andamios de tejido con AEC2, fibroblastos y células endoteliales, los ELT se repoblan densamente con estructuras similares a las alveolares que comprenden los tres linajes celulares (Figura 6D, E). En los días 7 u 8, los AEC2 mantienen la morfología cuboidal y expresan la proteína surfactante-B (SPB) y la proteína corporal lamelar ABCA3, sin evidencia de diferenciación significativa a AEC1s (Figura 6E,F). Los AEC2 son altamente proliferativos en los ELT, como lo demuestra la incorporación de 5-etinil-2'-desoxiuridina (EdU) después de un pulso de 2 h a 10 μM (Figura 6G).
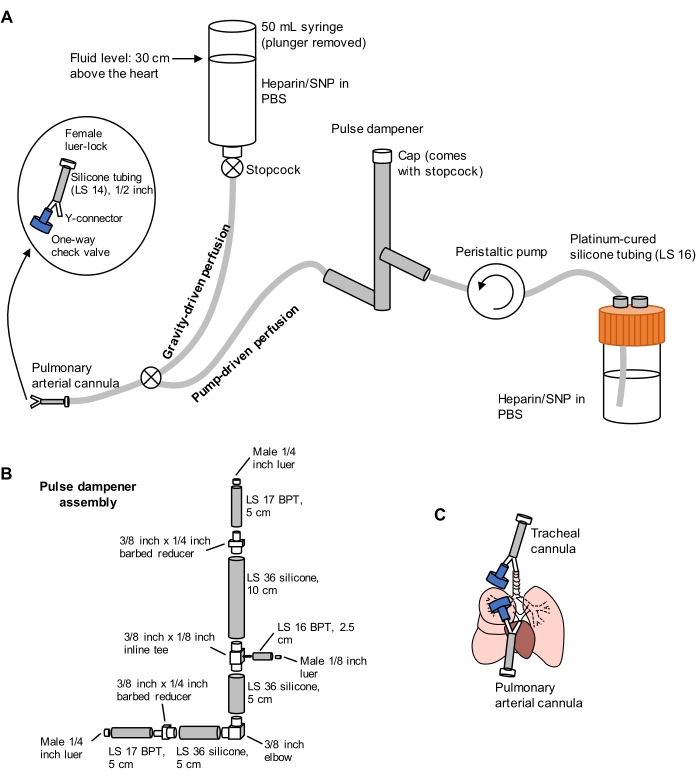
Figura 1: Esquema del sistema de perfusión para la extracción y limpieza pulmonar. (A) El sistema de perfusión comprende una extremidad impulsada por gravedad, utilizada para la canulación inicial de la arteria pulmonar bajo flujo; y una extremidad accionada por bomba, utilizada para limpiar los pulmones de manera eficiente después de la canulación inicial. La línea de bombas incluye un "amortiguador de pulsos" que amortigua los picos de presión causados por la bomba. El diseño de las cánulas arteriales traqueales y pulmonares se detalla a la izquierda. SNP = nitroprusiato de sodio. (B) Detalles del conjunto del amortiguador de impulsos. BPT y silicona se refieren a tipos de tubos. (C) Posiciones de cánulas arteriales traqueales y pulmonares colocadas durante la extracción pulmonar. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Cronología del cultivo para la recelularización de tres linajes. Cronograma propuesto para la siembra y el cultivo de ELT de tres linajes, incluido el momento de la siembra en dos fases. Se indican los números de células para la siembra y el medio de cultivo para cada fase. Consulte los detalles de los medios culturales en la Tabla 3. AEC2 = célula epitelial alveolar tipo 2. EC = célula endotelial. FB = fibroblasto. Haga clic aquí para ver una versión más grande de esta figura.
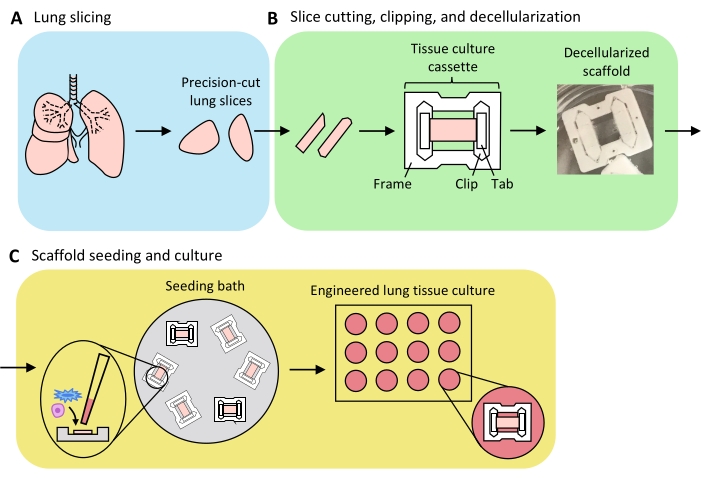
Figura 3: Esquema de la preparación del tejido pulmonar diseñado. (A) El tejido pulmonar nativo se corta en rodajas utilizando un vibratomo. (B) Las rodajas pulmonares cortadas con precisión se cortan en tiras estandarizadas de 3 mm de ancho, se recortan en casetes de cultivo de tejidos de politetrafluoretileno (PTFE) y se descelularizan con detergente para producir andamios de matriz extracelular acelular. (C) Los andamios se vuelven a sembrar en baños de siembra especializados que confinan el área de siembra al área del tejido, y luego se cultivan en una placa de pozo estándar. Haga clic aquí para ver una versión más grande de esta figura.
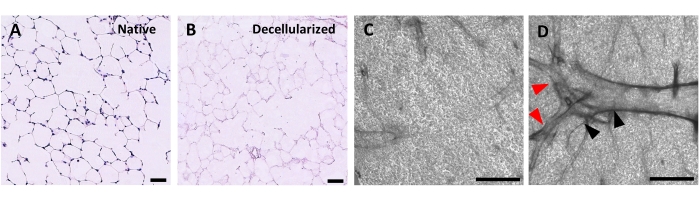
Figura 4: Estructura de andamios pulmonares descelularizados. Tinción H&E de cortes pulmonares nativos (A) y descelularizados (B) que muestran la preservación de la arquitectura alveolar después de la descelularización. (C,D) Ejemplos de andamios ECM descelularizados vistos a un aumento de 5x por microscopía de contraste de fase, que comprenden predominantemente tejido alveolar (C) o que contienen grandes vías respiratorias y vasos ramificados (D, puntas de flecha negras y rojas). Barras de escala, 50 μm (A,B); 500 μm (C,D). Haga clic aquí para ver una versión más grande de esta figura.
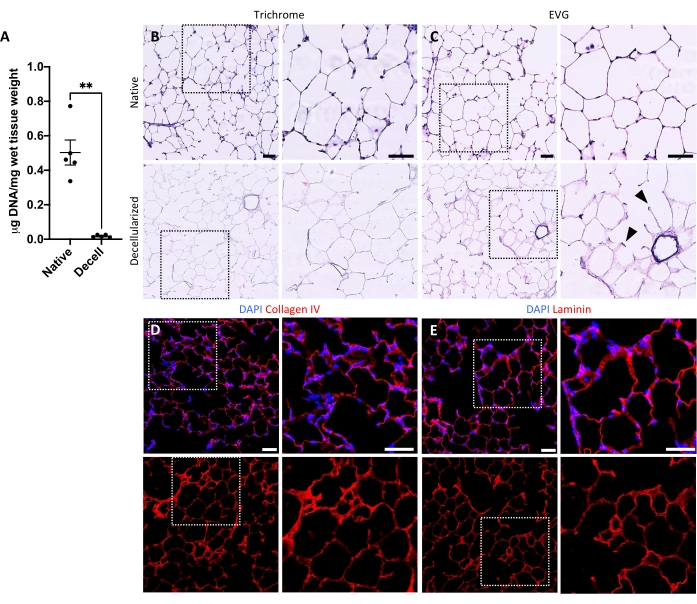
Figura 5: Eliminación de ADN y preservación de matrices en andamios pulmonares descelularizados. (A) Cuantificación de ADN en rodajas pulmonares nativas y descelularizadas (media ± SEM, n = 5). Prueba t de Welch, **P < 0.01. Decelular = descelularizado. (B,C) Tinción histológica de rodajas pulmonares nativas y descelularizadas para colágeno (B) y elastina (C). Puntas de flecha, elastina conservada en anillos de entrada alveolares de tejido descelularizado. (D,E) Tinción inmunofluorescente de rodajas pulmonares nativas y descelularizadas para colágeno IV (D) y laminina (E). Barras de escala, 50 μm. En todos los paneles, los cuadros punteados delinean la región de la imagen que se amplía a la derecha en cada panel respectivo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Repoblación celular de tejidos pulmonares modificados. (A-C) Ejemplos de ELT recelularizados en el día 7 de cultivo, visualizados durante el cultivo por microscopía de contraste de fase. El patrón de recelularización refleja la estructura alveolar del tejido. En algunas áreas de alta celularidad, se pueden formar estructuras similares a organoides (puntas de flecha). (A) y (B) representan una repoblación celular exitosa, mientras que (C) representa un bajo nivel de recelularización después de 7 días de cultivo. (D-G) Tinción de ELTs recelularizados en el día 7 u 8 de cultivo. (D) Tinción de H&E que muestra repoblación celular de los septos alveolares. (E) Etiquetas de tinción inmunofluorescente injertadas proCollagenIα1+ fibroblastos, ABCA3+ AEC2 y células endoteliales CD31+ . (F) Los tejidos contienen abundantes SPB+ AEC2s pero pocos RTI-40 (podoplanin)+ AEC1s en estas condiciones. (G) Muchos AEC2 están proliferando en los ELT, según lo medido por la incorporación de EdU. Barras de escala, 500 μm (A-C); 25 μm (D-G). Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Soluciones de descelularización. Detalles de preparación para soluciones de descelularización. Haga clic aquí para descargar esta tabla.
Tabla 2: Protocolo de descelularización. Detalles del protocolo para descelularizar las rodajas pulmonares. Haga clic aquí para descargar esta tabla.
Tabla 3: Medios de comunicación culturales. Detalles de preparación para medios de crecimiento endoteliales y AEC2. Haga clic aquí para descargar esta tabla.
Tabla 4: Anticuerpos utilizados para la inmunotinción. Detalles de los anticuerpos y sus concentraciones utilizadas para la inmunotinción. Haga clic aquí para descargar esta tabla.
Expediente complementario 1: Diseño para marcos de casete de cultivo de tejidos de corte láser. Haga clic aquí para descargar este archivo.
Expediente Complementario 2: Diseño para clips de casete de cultivo de tejidos de corte láser. Haga clic aquí para descargar este archivo.
Expediente complementario 3: Diseño para pestañas de casete de cultivo de tejidos de corte láser. Haga clic aquí para descargar este archivo.
Expediente complementario 4: Archivo CAD para la siembra de la base del molde del baño. Haga clic aquí para descargar este archivo.
Expediente Complementario 5: Archivo CAD para la siembra del anillo de molde de baño. Haga clic aquí para descargar este archivo.
Discusión
Este artículo describe el uso de cortes pulmonares de corte de precisión descelularizados como plataforma para generar tejidos pulmonares diseñados in vitro, que contienen estructuras alveolares de múltiples linajes. Al combinar estrategias que desarrollamos previamente para repoblar andamios pulmonares ecm acelulares de alta fidelidad para ingeniería pulmonar completa22,31, con nuestro robusto sistema para cultivar tejidos cardíacos diseñados a pequeña escala30, este protocolo permite el uso de ECM pulmonar fisiológicamente relevante como sustrato de cultivo de tejidos, de una manera repetible y de rendimiento moderado.
Los métodos presentados aquí detallan la preparación del andamio ELT de los pulmones de rata, que son fácilmente alcanzables, se pueden extraer en bloque con acceso directo a las vías respiratorias intactas para la inflación de agarosa, y son de mayor tamaño que el pulmón de ratón. Sin embargo, cualquier tejido pulmonar que se pueda inflar con agarosa y cortes de rendimiento de al menos 9 mm de longitud se puede utilizar dentro de este sistema. Independientemente de la fuente de tejido, la inflación uniforme del tejido pulmonar con agarosa es el paso más crítico para garantizar el éxito del corte de tejido aguas abajo, el recorte y el manejo del tejido. El tejido pulmonar poco inflado tiende a no cortarse limpiamente, mientras que el tejido sobreinflado puede desgarrarse durante el recorte. Después de la gelificación de la agarosa, las regiones de tejido adecuadamente infladas son firmes, pero proporcionan un poco de donación cuando se presionan suavemente con fórceps. Para los pulmones de rata intactos, encontramos que la preinflación de los pulmones extraídos con aire varias veces, seguida de la inflación de agarosa tan pronto como sea posible después de la extracción, da como resultado los mejores resultados de corte y la mejor calidad de los andamios de tejido resultantes. El volumen apropiado de agarosa debe optimizarse empíricamente; para un pulmón de rata, el volumen requerido para inflar el pulmón a la capacidad pulmonar total es de aproximadamente 30 ml / kg de masa animal (por ejemplo, 10,5 ml de agarosa para los pulmones de una rata de 350 g). Para los tejidos pulmonares resecados más grandes con un acceso menos directo a las vías respiratorias (como los de donantes humanos), puede ser necesaria una solución de problemas adicional para inflar el tejido a través de un bronquio32. Durante el corte pulmonar posterior, la selección y orientación del tejido en el émbolo es otro paso importante para 1) garantizar que las rodajas sean lo suficientemente grandes como para generar tiras de tejido que se puedan cortar en casetes de cultivo de tejidos y 2) maximizar el área de tejido parenquimatoso (alveolar), excluyendo las vías respiratorias o vasos grandes.
Recortar el PCLS en casetes de cultivo de tejidos puede ser un paso desafiante inicialmente, pero los casetes simplifican en gran medida el manejo de tejidos durante la descelularización y la siembra. Dos problemas potenciales que pueden surgir son el desgarro del tejido (ya sea durante el proceso de recorte o durante la descelularización), o el posicionamiento del tejido en los clips que resulta en una siembra deficiente aguas abajo (por ejemplo, sin siembra o siembra justo en los extremos). El desgarro puede ser el resultado de un sobreinflado de agarosa, un estiramiento excesivo del tejido durante la inserción de la pestaña o dejar muy poco voladizo para proporcionar un agarre adecuado del tejido al insertar las pestañas. Tenga en cuenta que las rodajas que se desgarran en un extremo del clip pueden sembrarse con éxito, sin embargo, son difíciles de visualizar bajo el microscopio durante el cultivo, ya que el tejido no es plano. La siembra de tejido deficiente (como la de la Figura 6C) es probablemente el resultado de que la rebanada no se encuentre plana entre los dos clips y, por lo tanto, haga un contacto deficiente con la base del baño de siembra cuando se voltea boca abajo. Otra posible causa es el asiento inadecuado del cassette en el fondo del pozo del baño de siembra. En términos de recorte, aplique un poco más de tensión en el tejido al colocar el segundo clip para ayudarlo a que quede plano. Algunas rebanadas tienen una ligera concavidad; en estos casos, recorte la rebanada con el lado convexo hacia arriba. Con la práctica, generalmente experimentamos siembra fallida con menos del 2% de las rebanadas.
Una limitación de este protocolo es el requisito de que algunos equipos especializados, un cortador láser y una impresora 3D, generen los materiales iniciales para la preparación de ELT. Sin embargo, una vez que se crean los casetes de cultivo de tejidos y los baños de siembra, no se requieren materiales especiales adicionales. Los pasos de corte pulmonar y descelularización de la preparación del andamio ELT consumen un tiempo moderado; sin embargo, estos pasos pueden realizarse con anticipación o en números suficientes para prepararse para múltiples experimentos al mismo tiempo. Muchos PCLS (>100 si se optimizan para regiones parenquimatosas) se pueden cortar de un solo pulmón y congelar para su uso posterior. Si bien un solo ciclo de congelación-descongelación puede causar daños ultraestructurales menores a la ECM46, incluso se ha demostrado que múltiples ciclos de congelación-descongelación no causan una pérdida significativa en ecM 23,47. El PCLS también se puede recortar y descelularizar antes de un experimento, para ser utilizado dentro de un mes. (En particular, el protocolo de descelularización descrito se puede lograr en aproximadamente 6 horas, lo que representa una ventaja significativa sobre los métodos descritos anteriormente que requieren un día o más27,28). Una vez que se preparan los andamios, el proceso de siembra celular es simple y rápido, y el cultivo de ELT no requiere técnicas especializadas.
Una advertencia del método ELT descrito es la falta de siembra específica de la región, es decir, la entrega de AEC2 específicamente al espacio alveolar, o células endoteliales específicamente al espacio vascular. Sin embargo, aunque las células simplemente se siembran en la parte superior de los andamios de tejido, el patrón de recelularización no es aleatorio, con cierta apariencia de organización similar a la alveolar, incluidos los anillos epiteliales. Sospechamos que las interacciones célula-célula, así como las diferencias locales en la composición y geometría de ecM20,21, probablemente contribuyen a los patrones de recelularización observados. En apoyo de esta hipótesis, un estudio publicado anteriormente, en el que los fibroblastos se sembraron no específicamente en rodajas pulmonares descelularizadas, demostró que el patrón de repoblación tisular y los fenotipos celulares asociados variaron significativamente según la región microscópica del tejido y la fuente de andamio ECM (por ejemplo, sanos versus enfermos)27. También se observó que los fibroblastos invaden el intersticio, la ubicación en la que residen en el tejido pulmonar nativo 1,27. El método alternativo primario que podemos imaginar para cultivar células en rodajas pulmonares de una manera verdaderamente específica de la región implicaría sembrar pulmones descelularizados intactos a través de las vías respiratorias 31,48 y compartimentos vasculares49,50, y luego cortar el tejido recelularizado. Sin embargo, esta alternativa 1) es significativamente más costosa, intensiva en tiempo y recursos; 2) es un rendimiento más bajo; 3) requiere un mayor número de animales; y 4) se asocia con un mayor riesgo de contaminación debido a los desafíos del cultivo de pulmón entero y el posterior corte del pulmón sembrado. Si bien no recapitula todos los aspectos de la organización celular nativa, la plataforma ELT permite el cultivo de células pulmonares en un sustrato de ECM fisiológicamente relevante, de una manera que es accesible para muchos más laboratorios.
La flexibilidad del sistema ELT es una gran ventaja de esta plataforma, y debe permitir el cultivo de tejido pulmonar a pequeña escala con cualquier número de andamios de tejido, células o medios de cultivo de interés. El uso de andamios derivados de tejidos enfermos o de modelos de lesiones puede permitir el estudio de las interacciones célula-célula o célula-matriz en el contexto de la ECM alterada por la enfermedad 27,29,51. Sin embargo, tenga en cuenta que el protocolo de descelularización puede necesitar ser adaptado para tener en cuenta las diferencias de la matriz entre las especies52. La estrategia de siembra descrita se puede utilizar para cualquier tipo de célula, y la línea de tiempo de cultivo se adapta a las necesidades del investigador. Como punto de partida, 1 x 106 células por andamio debe producir un tejido altamente celular dentro de los 7 días posteriores al cultivo, mientras que 1 x 105 células totales dan como resultado una celularidad deficiente. En cualquier adaptación de la línea de tiempo, los casetes de cultivo de tejidos deben retirarse del baño de siembra 24 h después de la última siembra de tejidos. Aquí, con el objetivo de modelar parte de la complejidad celular del alvéolo pulmonar, describimos una estrategia de recelularización de tres cultivos que apoya el mantenimiento de AEC2 neonatales bien diferenciadas en estructuras similares a las alveolares durante al menos 7 días. Nuestros resultados también demuestran el injerto exitoso de fibroblastos y células endoteliales dentro de los ELT, enfatizando la amplia aplicabilidad del sustrato de cultivo y su idoneidad para estudios de cocultivo. La siembra de células adultas en ELT puede facilitar el modelado de estructuras alveolares más inactivas, mientras que la siembra de AEC2 derivadas de PSC humanos, incluidas aquellas con modificaciones genéticas, podría facilitar los estudios traslacionales de enfermedades humanas13,53. En general, el enfoque de abajo hacia arriba habilitado por la plataforma ELT presenta la oportunidad de investigar las contribuciones de tipos de células particulares a lecturas de interés, como la proliferación de AEC2 o el estado de diferenciación.
En resumen, este protocolo describe un sistema robusto para generar tejidos pulmonares diseñados para estudios de cocultivo de AEC2, fibroblastos y células endoteliales dentro de andamios de corte pulmonar ECM acelular. Los ELT representan una nueva estrategia de cultivo 3D para los AEC2 primarios, que hasta la fecha se han basado típicamente en matrices de tipo gel menos fisiológicas para mantener un fenotipobien diferenciado 6,11,12. La plataforma actual se basa en trabajos previos en la repoblación de rodajas pulmonares descelularizadas 24,25,26,27,28,29, pero ofrece varias ventajas: 1) un sistema de casete de cultivo de tejidos para facilitar el manejo de ELT durante la descelularización, siembra y cultivo; 2) un baño de siembra personalizado para sembrar con precisión un número conocido de células en cada andamio de rebanadas; y 3) una estrategia de resiembra de tricultivo que permite la repoblación de tejido alveolar con células epiteliales, mesenquimales y endoteliales. Por lo tanto, los ELT representan un importante paso adelante hacia la creación de modelos reproducibles in vitro que capturan la complejidad celular y de sustrato del alvéolo nativo y el nicho de células madre AEC2.
Divulgaciones
L.E.N. es fundador y accionista de Humacyte, Inc, que es una compañía de medicina regenerativa. El humacite produce vasos sanguíneos modificados a partir de células alogénicas del músculo liso para la cirugía vascular. El cónyuge de L.E.N. tiene equidad en Humacyte, y L.E.N. es miembro de la Junta Directiva de Humacyte. L.E.N. es una inventora de patentes que tienen licencia para Humacyte y que producen regalías para L.E.N. L.E.N. ha recibido un regalo de investigación sin restricciones para apoyar la investigación en su laboratorio en Yale. Humacyte no influyó en la conducta, descripción o interpretación de los hallazgos de este informe.
Agradecimientos
Los autores desean agradecer a Lorenzo Sewanan y Jorge Núñez por su trabajo desarrollando el diseño de casete de cultivo de tejidos utilizado en este protocolo, al laboratorio Kaminski por el uso de su vibratomo, Maurizio Chioccioli y Jessica Nouws por su ayuda con el corte pulmonar, a Allie LaRocco por la asistencia con los experimentos piloto iniciales y a Hong Qian por la lectura cuidadosa del protocolo. Este trabajo fue apoyado por las subvenciones de los NIH F30HL143880 (K.L.L.), la Beca de Capacitación del Programa de Capacitación de Científicos Médicos T32GM136651 (K.L.L.) y U01HL145567 (L.E.N.); y por un regalo de investigación sin restricciones de Humacyte Inc. (L.E.N.).
Materiales
| Name | Company | Catalog Number | Comments |
| 3D Printer: Form 2 | Formlabs | ||
| 3-Isobutyl-1-methylxanthine (IBMX) | Sigma | I5879 | |
| 8-Bromo cAMP | Sigma | B7880 | |
| Agarose, UltraPure LMP | Invitrogen | 15517-014 | |
| Amphotericin B | Sigma | A2942 | |
| Barbed reducer fitting, 3/8 inch x 1/4 inch | McMaster-Carr | 5121K271 | |
| Benzonase nuclease | Sigma | E1014 | |
| Bovine serum albumin (BSA) Fraction V | Gemini | 700-104P | For AEC2 growth medium |
| Bovine serum albumin (BSA), standard grade | Gemini | 700-100P | For benzonase buffer |
| Check valve, polypropylene, 1/8 inch hose barb | Cole-Parmer | SK-98553-10 | |
| CHIR99021 | PeproTech | 2520691 | |
| Clear Resin, 1 L | Formlabs | RS-F2-GPCL-04 | |
| Cyanoacrylate glue, such as Krazy Maximum Bond Permanent Glue | Any hardware, craft, or drug store | KG483 or similar | |
| Dexamethasone | Sigma | D4902 | |
| DMEM (low glucose) | Gibco | 11885-084 | |
| DMEM (high glucose) | Gibco | 11965-092 | |
| DNA assay (Quant-iT PicoGreen dsDNA Assay Kit) | Invitrogen | P7589 | |
| EDTA, 0.5 M, pH 8.0 | AmericanBio | AB00502-01000 | |
| EdU kit (Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647) | Invitrogen | C10340 | Used according to manufacturer's directions |
| Elbow fitting, 3/8 inch | McMaster-Carr | 5121K907 | |
| F12 | Gibco | 11765-054 | |
| Fetal bovine serum (FBS), characterized | Hyclone | SH30071.03 | |
| Gentamicin sulfate | Gemini | 400-100P | Reconstituted in diH2O for a stock solution at 50 mg/mL |
| Hair clippers | Wahl | MiniArco | |
| Hank's balanced salt solution (HBSS), Phenol Red Free | Gibco | 14175-095 | |
| Heparin sodium injection, USP, 1000 U/mL | Sagent | NDC: 25021-400-30 | For intraperitoneal and intracardiac injection |
| Heparin sodium salt | Sigma | H4784 | For pulmonary artery perfusion; prepare stock solution at 100 U/mL in PBS |
| HEPES Buffer | Corning | 25-060-Cl | |
| Inline tee fitting, 3/8 inch x 1/8 inch | McMaster-Carr | 5121K851 | |
| Inoculating loop, disposable | Fisherbrand | 22-363-600 | |
| Insulin from bovine pancreas | Sigma | I6634 | |
| Ketamine injection, 100 mg/mL | Covetrus (Butler Animal Health) | 010177 | |
| KGF, recombinant human | PeproTech | 100-19 | |
| Laser cutter, VLS 3.50 30 watt | Universal Laser Systems | ||
| L-glutamine | Gibco | 25030-081 | |
| Luer-lock, female, 3/32 inch | Cole-Parmer | 45508-02 | |
| Luer-lock, male, 1/8 inch | Cole-Parmer | 30800-24 | |
| Luer-lock, male, 1/4 inch | McMaster-Carr | 51525K146 | |
| MCDB-131 Complete without serum | VEC Technologies | MCDB-131 WOFBS | |
| Magnesium chloride (MgCl2), 1 M | AmericanBio | AB09006-00100 | |
| NaCl | American Bioananalytical | AB01915 | |
| Phosphate buffered saline (PBS), without Ca2+ and Mg2+, 10X | Sigma | D1408 | Reconstitute to 1X with diH2O |
| Phosphate buffered saline (PBS), with Ca2+ and Mg2+ | Gibco | 21300-058 | |
| PDMS - SYLGARD 184 Silicone Elastomer Kit | Dow Corning Corporation | 4019862 | |
| Penicillin/Streptomycin (10,000 U/mL penicillin/10,000 μg/mL streptomycin) | Gibco | 15140-122 | |
| Petri dish, 150 mm | Falcon | 351058 | |
| Plastic film (parafilm) | Bemis | PM-996 | |
| Pharmed BPT tubing, LS 16 | Masterflex | 06508-16 | |
| Pharmed BPT tubing, LS 17 | Masterflex | 06508-17 | |
| Platinum-cured silicone tubing, LS 14 | Masterflex | 96420-14 | |
| Platinum-cured silicone tubing, LS 16 | Masterflex | 96420-16 | |
| Platinum-cured silicone tubing, LS 36 | Masterflex | 96410-36 | |
| Poloxamer 407 (Pluronic F-127) | Sigma | P2443 | |
| Povidone/iodine prep pads, 10% | Dynarex Corporation | 1108 | |
| PTFE sheet, 0.060 inch (1/16 inch) thick | ePlastics | PTFENAT0.060X12X12 | For tissue culture cassette tabs |
| PTFE sheet, 0.093 inch (3/32 inch) thick | ePlastics | PTFENAT0.093X12X12 | For tissue culture cassette frames and clips |
| Peristaltic pump drive: Masterflex L/S Variable-Speed Digital Drive | Cole-Parmer | ZM-07528-30 | |
| Peristaltic pump head: Masterflex L/S Easy-Load II Pump Head | Cole-Parmer | EW-77202-60 | |
| Rat, Sprague Dawley | Charles River | Strain Code: 400 | |
| Razor blade | Any hardware or craft store | Personna 94-120-71 or similar | |
| Retinoic acid | Sigma | R2625 | |
| Rotary blades, 28 mm | Omnigrid | 2046 | |
| Rotary cutter, 28 mm | Olfa | Model 9551 | |
| Sodium deoxycholate (SDC) | Sigma | D6750 | |
| Sodium nitrorusside (SNP) | Sigma | 71778 | |
| Stopcock, 4-way | Edwards | 594WSC | |
| Suture, 4-0 monofilament polypropylene | Covidien | VP-557-X | |
| Syringe, 10 mL | BD | 302995 | |
| Syringe, 50 mL | BD | 309653 | |
| Tissue culture dish, 35 mm | Falcon | 353001 | |
| Tissue culture dish, 100 mm | Corning | 430167 | |
| Tissue culture plate, 6-well | Falcon | 353046 | |
| Tissue culture plate 12-well | Falcon | 353043 | |
| Transferrin human | Sigma | T8158 | |
| Tris, 1 M solution, pH 8.0 | AmericanBio | AB14043-01000 | |
| Triton X-100 | American Bioanalytical | AB02025-00500 | |
| Vibratome, Compresstome VF-300-0Z | Precisionary Instruments LLC | ||
| Xylazine, 100 mg/mL | Henry Schein | NDC: 11695-4022-1 | |
| Y-connector, 1/16 inch barbed | Cole-Parmer | 30614-43 |
Referencias
- Burri, P. H. Morphology and respiratory function of the alveolar unit. International Archives of Allergy and Applied Immunology. 76, Suppl 1 2-12 (1985).
- Barkauskas, C. E., Noble, P. W. Cellular Mechanisms of Tissue Fibrosis. 7. New insights into the cellular mechanisms of pulmonary fibrosis. American Journal of Physiology. Cell Physiology. 306 (11), 987-996 (2014).
- Taylor, M. S., et al. A Conserved Distal Lung Regenerative Pathway in Acute Lung Injury. American Journal of Pathology. 188 (5), 1149-1160 (2018).
- Carsana, L., et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study. Lancet Infectious Diseases. 20 (10), 1135-1140 (2020).
- Basil, M. C., et al. The Cellular and Physiological Basis for Lung Repair and Regeneration: Past, Present, and Future. Cell Stem Cell. 26 (4), 482-502 (2020).
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- Desai, T. J., Brownfield, D. G., Krasnow, M. A. Alveolar progenitor and stem cells in lung development, renewal and cancer. Nature. 507 (7491), 190-194 (2014).
- Evans, M. J., Cabral, L. J., Stephens, R. J., Freeman, G. Renewal of alveolar epithelium in the rat following exposure to NO2. The American Journal of Pathology. 70 (2), 1-24 (1973).
- Beers, M. F., Moodley, Y. When is an alveolar type 2 cell an alveolar type 2 cell? A conundrum for lung stem cell biology and regenerative medicine. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 18-27 (2017).
- Borok, Z., et al. Keratinocyte growth factor modulates alveolar epithelial cell phenotype in vitro: expression of aquaporin 5. American Journal of Respiratory Cell and Molecular Biology. 18 (4), 554-561 (1998).
- Salahudeen, A. A., et al. Progenitor identification and SARS-CoV-2 infection in human distal lung organoids. Nature. 588 (7839), 670-675 (2020).
- Sucre, J. M. S., et al. Successful establishment of primary Type 2 alveolar epithelium with 3D organotypic co-culture. American Journal of Respiratory Cell and Molecular Biology. 59 (2), 158-166 (2018).
- Jacob, A., et al. Differentiation of human pluripotent stem cells into functional lung alveolar epithelial cells. Stem Cell. 21 (4), 472-488 (2017).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nature Methods. 14 (11), 1097-1106 (2017).
- Chen, Y. W., et al. A three-dimensional model of human lung development and disease from pluripotent stem cells. Nature Cell Biology. 19 (5), 542-549 (2017).
- Korogi, Y., et al. In vitro disease modeling of hermansky-pudlak syndrome Type 2 using human induced pluripotent stem cell-derived alveolar organoids. Stem Cell Reports. 12 (3), 431-440 (2019).
- Strikoudis, A., et al. Modeling of fibrotic lung disease using 3D organoids derived from human pluripotent stem cells. Cell Reports. 27 (12), 3709-3723 (2019).
- Bissell, M. J., Hall, H. G., Parry, G. How does the extracellular matrix direct gene expression. Journal of Theoretical Biology. 99 (1), 31-68 (1982).
- Chapman, H. A. Epithelial responses to lung injury: Role of the extracellular matrix. Proceedings of the American Thoracic Society. 9 (3), 89-95 (2012).
- Guilak, F., et al. Control of stem cell fate by physical interactions with the extracellular matrix. Cell Stem Cell. 5 (1), 17-26 (2009).
- Zhou, Y., et al. Extracellular matrix in lung development, homeostasis and disease. Matrix Biology. 73, 77-104 (2018).
- Calle, E. A., et al. Targeted proteomics effectively quantifies differences between native lung and detergent-decellularized lung extracellular matrices. Acta Biomaterialia. 46, 91-100 (2016).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Bonvillain, R. W., et al. A nonhuman primate model of lung regeneration: Detergent-mediated decellularization and initial in vitro recellularization with mesenchymal stem cells. Tissue Engineering Part A. 18 (23-24), 2437-2452 (2012).
- O'Neill, J. D., et al. Decellularization of human and porcine lung tissues for pulmonary tissue engineering. The Annals of Thoracic Surgery. 96 (3), 1055(2013).
- Wagner, D. E., et al. Three-dimensional scaffolds of acellular human and porcine lungs for high throughput studies of lung disease and regeneration. Biomaterials. 35 (9), 2664-2679 (2014).
- Burgstaller, G., et al. Distinct niches within the extracellular matrix dictate fibroblast function in (cell free) 3D lung tissue cultures. American Journal of Physiology-Lung Cellular and Molecular Physiology. 314 (5), 708-723 (2018).
- Sun, H., et al. Fibroblast engraftment in the decellularized mouse lung occurs via a β1-integrin-dependent, FAK-dependent pathway that is mediated by ERK and opposed by AKT. American Journal of Physiology-Lung Cellular and Molecular Physiology. 306 (6), 463-475 (2014).
- Booth, A. J., et al. Acellular normal and fibrotic human lung matrices as a culture system for in vitro investigation. American Journal of Respiratory and Critical Care Medicine. 186 (9), 866-876 (2012).
- Schwan, J., et al. Anisotropic engineered heart tissue made from laser-cut decellularized myocardium. Scientific Reports. 6, 32068(2016).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Gerckens, M., et al. Generation of Human 3D Lung Tissue Cultures (3D-LTCs) for Disease Modeling. Journal of Visualized Experiments. (144), (2019).
- Lyons-Cohen, M. R., Thomas, S. Y., Cook, D. N., Nakano, H. Precision-cut mouse lung slices to visualize live pulmonary dendritic cells. Journal of Visualized Experiments. (122), e55465(2017).
- Neuhaus, V., et al. Assessment of the cytotoxic and immunomodulatory effects of substances in human precision-cut lung slices. Journal of Visualized Experiments. (135), e57042(2018).
- You, Y., Richer, E. J., Huang, T., Brody, S. L. Growth and differentiation of mouse tracheal epithelial cells: selection of a proliferative population. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (6), 1315-1321 (2002).
- Vaccaro, C., Brody, J. S. Ultrastructure of developing alveoli. I. The role of the interstitial fibroblast. The Anatomical Record. 192 (4), 467-479 (1978).
- Calle, E. A., et al. Fate of distal lung epithelium cultured in a decellularized lung extracellular matrix. Tissue Engineering Part A. 21 (11-12), 1916-1928 (2015).
- Dobbs, L. G., Gonzalez, R., Williams, M. C. An improved method for isolating type II cells in high yield and purity. American Review of Respiratory Disease. 134 (1), 141-145 (1986).
- Dobbs, L. G. Isolation and culture of alveolar type II cells. American Journal of Physiology. 258, 134-147 (1990).
- Gonzalez, R. F., Dobbs, L. G. Isolation and culture of alveolar epithelial Type I and Type II cells from rat lungs. Methods in Molecular Biology. 945, 145-159 (2013).
- Dobbs, L. G., Pian, M. S., Maglio, M., Dumars, S., Allen, L. Maintenance of the differentiated type II cell phenotype by culture with an apical air surface. The American Journal of Physiology. 273 (2), 347-354 (1997).
- Bruce, M. C., Honaker, C. E. Transcriptional regulation of tropoelastin expression in rat lung fibroblasts: changes with age and hyperoxia. American Journal of Physiology. 274 (6), 940-950 (1998).
- Berk, J. L., Franzblau, C., Goldstein, R. H. Recombinant interleukin-1 beta inhibits elastin formation by a neonatal rat lung fibroblast subtype. Journal of Biological Chemistry. 266 (5), 3192-3197 (1991).
- Schultz, C. J., Torres, E., Londos, C., Torday, J. S. Role of adipocyte differentiation-related protein in surfactant phospholipid synthesis by type II cells. American Journal of Physiology-Lung Cellular and Molecular Physiology. 283 (2), 288-296 (2002).
- Maksvytis, H. J., et al. In vitro characteristics of the lipid-filled interstitial cell associated with postnatal lung growth: evidence for fibroblast heterogeneity. Journal of Cellular Physiology. 118, 113-123 (1984).
- Hopkinson, A., et al. Optimization of amniotic membrane (AM) denuding for tissue engineering. Tissue Engineering Part C: Methods. 14 (4), 371-381 (2008).
- Fernandez-Perez, J., Ahearne, M. The impact of decellularization methods on extracellular matrix derived hydrogels. Scientific Reports. 9 (1), 14933(2019).
- Ott, H. C., et al. Regeneration and orthotopic transplantation of a bioartificial lung. Nature medicine. 16 (8), 927-933 (2010).
- Le, A. V., et al. Efficient and Functional Endothelial Repopulation of Whole Lung Organ Scaffolds. ACS Biomaterials Science & Engineering. 3 (9), 2000-2010 (2017).
- Ren, X., et al. Engineering pulmonary vasculature in decellularized rat and human lungs. Nature Biotechnology. 33 (10), 1097-1102 (2015).
- Wagner, D. E., et al. Comparative decellularization and recellularization of normal versus emphysematous human lungs. Biomaterials. 35 (10), 3281-3297 (2014).
- Balestrini, J. L., et al. Comparative biology of decellularized lung matrix: Implications of species mismatch in regenerative medicine. Biomaterials. 102, 220-230 (2016).
- Alysandratos, K. D., et al. Patient-specific iPSCs carrying an SFTPC mutation reveal the intrinsic alveolar epithelial dysfunction at the inception of interstitial lung disease. Cell Reports. 36 (9), 109636(2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados