A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصور الكاسباز الالتهابي الناجم عن القرب في البلاعم المشتقة من الخلايا الأحادية البشرية
In This Article
Summary
يصف هذا البروتوكول سير العمل للحصول على البلاعم المشتقة من الخلايا الأحادية (MDM) من عينات الدم البشرية ، وهي طريقة بسيطة لإدخال مراسلي تكملة الفلور ثنائي الجزيئية (BiFC) بكفاءة إلى MDM البشري دون المساس بصلاحية الخلايا وسلوكها ، ونهج قائم على التصوير لقياس تنشيط كاسباز الالتهابي في الخلايا الحية.
Abstract
تشمل الكاسباس الالتهابية كاسباز-1 و-4 و-5 و-11 و-12 وتنتمي إلى المجموعة الفرعية من كاسباس البادئ. مطلوب Caspase-1 لضمان التنظيم الصحيح للإشارات الالتهابية ويتم تنشيطه عن طريق التثبيط الناجم عن القرب بعد التجنيد للالتهابات. Caspase-1 وفير في سلالة الخلايا الأحادية ويحفز نضج السيتوكينات المؤيدة للالتهابات interleukin (IL)-1β و IL-18 إلى جزيئات إفرازية نشطة. الكاسباس الالتهابي الآخر ، caspase-4 و -5 (و caspase-11 المتجانسة الفئران) تعزز إطلاق IL-1β عن طريق تحفيز pyroptosis. Caspase Bimolecular Fluorescence Complementation (BiFC) هي أداة تستخدم لقياس القرب الناجم عن كاسباز الالتهابي كقراءة لتنشيط كاسباز. يندمج المجال الكاسبازي-1 أو -4 أو -5 ، الذي يحتوي على المنطقة التي ترتبط بالالتهاب ، مع شظايا غير فلورية من بروتين الفلورسنت الأصفر فينوس (Venus-N [VN] أو Venus-C [VC]) التي ترتبط بإصلاح مجمع الزهرة الفلوري عندما تخضع الكاسباس للقرب المستحث. يصف هذا البروتوكول كيفية إدخال هؤلاء المراسلين في البلاعم الأولية المشتقة من الخلايا الأحادية (MDM) البشرية باستخدام النيوكليوفيكتيون ، وعلاج الخلايا للحث على تنشيط كاسباز الالتهابي ، وقياس تنشيط كاسباز باستخدام التألق والمجهر البؤري. ميزة هذا النهج هي أنه يمكن استخدامه لتحديد المكونات والمتطلبات وتوطين مجمع تنشيط كاسباز الالتهابي في الخلايا الحية. ومع ذلك ، يجب النظر في ضوابط دقيقة لتجنب المساس ببقاء الخلايا وسلوكها. هذه التقنية هي أداة قوية لتحليل تفاعلات كاسباز الديناميكية على مستوى الالتهاب وكذلك لاستجواب شلالات الإشارات الالتهابية في MDM الحية والخلايا الوحيدة المشتقة من عينات الدم البشرية.
Introduction
ال caspases هي عائلة من بروتياز الأسبارتات السيستين التي يمكن تجميعها في كاسباس البادئ وكاسباس الجلاد. تتكون كاسباس الجلاد من كاسباز-3 و-6 و-7. توجد بشكل طبيعي في الخلايا على شكل دايمرات ويتم شقها بواسطة كاسباس البادئ لتنفيذ موت الخلايا المبرمج1. تشمل كاسباس المبادر كاسباز الإنسان -1 و -2 و -4 و -5 و -8 و -9 و -10 و -12. تم العثور عليها على أنها zymogens غير نشطة (pro-caspases) التي يتم تنشيطها عن طريق dimerization الناجم عن القرب وتثبيتها بواسطة الانقسام الذاتي للتحلل البروتيني 2,3. الكاسباس الالتهابي هو مجموعة فرعية من كاسباس البادئ 2 ويشمل كاسباز-1 و -4 و-5 و -12 في البشر ، و كاسباز-1 و -11 و -12 في الفأر 4,5. بدلا من دور الاستماتة ، فإنها تلعب دورا مركزيا في الالتهاب. إنها تتوسط في المعالجة البروتينية وإفراز pro-interleukin (IL)-1β و pro-IL-18 6,7 ، والتي تعد أول سيتوكينات يتم إطلاقها استجابة للغزاة المسببين للأمراض 8,9. يتم تنشيط Caspase-1 عند التوظيف في منصة التنشيط الخاصة به ؛ مركب بروتيني كبير الوزن الجزيئي يسمى الالتهاب (الشكل 1A)10. يحدث تعتيم كاسباز-4 و-5 و-11 بشكل مستقل عن هذه المنصات من خلال مسار التهابي غير قانوني11,12.
الالتهابات القانونية هي مجمعات بروتين متعددة الكريات الخلوية تتكون من بروتين استشعار ملتهب ، وبروتين محول ASC (بروتين يشبه البقع المرتبط بموت الخلايا المبرمج يحتوي على CARD) ، والبروتين المستجيب caspase-110. أكثر الالتهابات القانونية دراسة جيدة هي عائلة المستقبلات الشبيهة ب NOD التي تحتوي على مجال البيرين (NLRP) و NLRP1 و NLRP3 ، وعائلة NLR التي تحتوي على CARD (NLRC) ، NLRC4 ، والغائبة في سرطان الجلد 2 (AIM2). يحتوي كل منها على مجال pyrin أو CARD أو كلا المجالين. يتوسط نطاق CARD التفاعل بين caspases المحتوية على CARD ومنشطات المنبع الخاصة بها. لذلك ، فإن جزيء السقالة ASC ، الذي يتكون من مجال pyrin N-terminal (PYD) وزخارف C-terminal CARD 13,14 ، مطلوب لتوظيف caspase-1 إلى NLRP110 و NLRP315 و AIM216 الالتهابات.
سمي كل ملتهب على اسم بروتين الاستشعار الفريد الذي يتعرف على المحفزات المؤيدة للالتهابات المتميزة (الشكل 1B). يطلق على منشطات هذا المسار المحفزات الأساسية. تعمل الالتهابات كأجهزة استشعار للمكونات الميكروبية وإجهاد الأنسجة ، وتتجمع لتحفيز استجابة التهابية قوية من خلال تنشيط الشذرات الالتهابية17. يبدأ تجميع Inflammasome تنشيط caspase-1 للتوسط في نضج وإفراز ركائزه الرئيسية المؤيدة ل IL-1β و pro-IL-18. تحدث هذه العملية عبر آلية من خطوتين. أولا ، ينظم الحافز التحضيري التعبير عن بعض البروتينات الالتهابية و pro-IL-1β من خلال تنشيط مسار NF-κB. ثانيا ، يحفز الحافز داخل الخلايا (الأساسي) على تجميع الالتهابات وتجنيد procaspase-1 6,7.
Caspase-4 و caspase-5 هي تقويم العظام البشري ل murine caspase-1111. يتم تنشيطها بطريقة مستقلة عن الالتهابات بواسطة عديد السكاريد الشحمي داخل الخلايا (LPS) ، وهو جزيء موجود في الغشاء الخارجي للبكتيريا سالبة الجرام18،19،20 ، وبواسطة الهيم خارج الخلية ، وهو نتاج انحلال الدم في خلايا الدم الحمراء 21. وقد اقترح أن LPS يرتبط مباشرة بفكرة CARD لهذه البروتينات ويحفز قلة القلة20. تنشيط caspase-4 أو caspase-5 يعزز إطلاق IL-1β عن طريق تحفيز شكل التهابي من موت الخلايا يسمى pyroptosis من خلال انقسام البروتين المكون للمسام gasdermin D (GSDMD) 18,19. بالإضافة إلى ذلك ، فإن تدفق أيونات البوتاسيوم الناتجة عن كاسباز-4 والموت الحراري بوساطة GSDMD يحفز تنشيط الالتهاب NLRP3 والتنشيط اللاحق ل caspase-122,23. لذلك ، تعتبر caspase-4 و -5 و -11 أجهزة استشعار داخل الخلايا ل LPS قادرة على تحفيز pyroptosis وتنشيط caspase-1 استجابة لمحفزات محددة11,24.
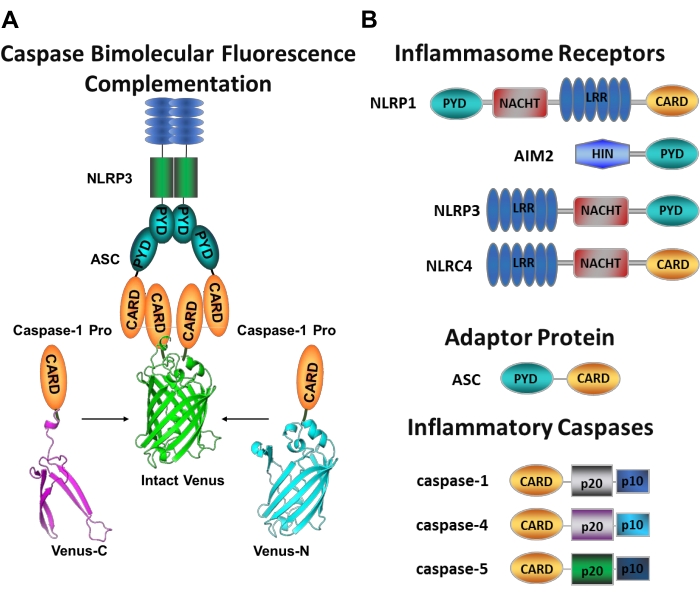
الشكل 1: كاسباس التهابي واختبار تكملة التألق ثنائي الجزيئية (BiFC) (A) رسم بياني يوضح نظام caspase-BiFC ، حيث يتم تجنيد اثنين من prodomains caspase-1 (C1-pro) مرتبطين بكل جزء غير فلورسنت من Venus (Venus-C أو Venus-N) إلى منصة تنشيط NLRP3 ، مما يجبر كوكب الزهرة على الارتداد والفلوريس. يظهر هذا المركب كبقعة خضراء تحت المجهر ويعمل كقراءة للقرب الناجم عن كاسباز الالتهابي ، وهي الخطوة الأولى في تنشيط كاسباز البادئ. (ب) مخطط يوضح تنظيم المجال للمكونات الالتهابية والكباسات الالتهابية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
من الصعب قياس تنشيط كاسباس البادئ المحدد ، ولا توجد العديد من الطرق المتاحة للقيام بذلك عن طريق أساليب التصوير. يمكن استخدام تكملة التألق ثنائي الجزيئية Caspase (BiFC) لتصور تنشيط كاسباز الالتهابي مباشرة في الخلايا الحية (الشكل 1A)25. وقد تم تكييف هذه التقنية مؤخرا لاستخدامها في البلاعم البشرية المشتقة من الخلايا الأحادية (MDM)21. يقيس Caspase BiFC الخطوة الأولى في تنشيط كاسباز الالتهابي ، القرب الناجم عن تسهيل التعتيم. يتم استخدام التعبير عن البلازميدات التي تشفر المجال الكاسبازي المحتوي على بطاقة والذي يندمج في شظايا غير فلورسنتية من البروتين الفلوري الأصفر القابل للتصوير Venus (Venus-C [VC]) و Venus-N [VN]). عندما يتم تجنيد اثنين من prodomains caspase إلى منصة التنشيط الخاصة بهم أو الخضوع للقرب المستحث ، يتم جلب نصفي كوكب الزهرة على مقربة وإجبارهم على الارتداد والفلوريس (انظر الشكل 1A ، B). هذا يوفر قراءة في الوقت الحقيقي لتنشيط كاسباز التهابي محدد.
يعبر MDM البشري بكثرة عن الجينات الالتهابية ومستقبلات التعرف على الأنماط التي تحدد إشارات الخطر ومنتجات مسببات الأمراض. وهذا يوفر نوعا مثاليا من الخلايا لاستجواب مسارات كاسباز الالتهابية. بالإضافة إلى ذلك ، يمكن اشتقاقها من الدم المحيطي وحتى من عينات المرضى لتقييم تنشيط كاسباز الالتهابي في حالة مرضية معينة. يصف هذا البروتوكول كيفية إدخال مراسلي كاسباز BiFC إلى MDM باستخدام nucleofection ، وهي طريقة نقل قائمة على الكهربية ، وكيفية علاج الخلايا للحث على تنشيط كاسباز التهابي ، وكيفية تصور مجمعات كاسباز النشطة باستخدام أساليب الفحص المجهري. بالإضافة إلى ذلك ، يمكن تكييف هذه المنهجية لتحديد التركيب الجزيئي لهذه المجمعات ، والتوطين تحت الخلوي ، والحركيات ، وحجم هذه الهياكل عالية الترتيب25،26،27.
Access restricted. Please log in or start a trial to view this content.
Protocol
يتبع هذا البروتوكول المبادئ التوجيهية للجنة أخلاقيات البحوث البشرية في كلية بايلور للطب للتلاعب بالعينات البشرية. يتم التعامل مع عينات الدم باتباع إرشادات السلامة المؤسسية للعينات البشرية. يتم الحصول على عينات الدم في بنك دم إقليمي ، حيث يتم جمعها بمحلول سكر العنب فوسفات السترات (CPD). ومع ذلك ، يمكن أيضا استخدام الدم الذي تم جمعه مع مضادات التخثر الأخرى مثل هيبارين الصوديوم أو الهيبارين الليثيوم أو EDTA لهذا البروتوكول28,29.
1. عزل الخلايا الوحيدة البشرية والتمايز إلى بلاعم
- الحصول على الدم المضاد للتخثر من الأفراد الأصحاء غير المحددين في بنك دم إقليمي وعزل خلايا الدم الطرفية أحادية النواة (PBMCs) كما هو موضح أدناه.
ملاحظة: قم بتنفيذ جميع الخطوات في غطاء التدفق الرقائقي لزراعة الأنسجة. استخدم الأنابيب المعقمة فقط وارتد القفازات. أضف 10٪ من المبيض إلى جميع المنتجات المتعلقة بالدم عند التخلص منها. PBS معقمة (1x) أو DPBS (بدون Ca2+ و مج2+) بالتبادل.- تحضير المخزن المؤقت للتخفيف: تكملة 1x PBS معقمة مع 2٪ FBS و 0.5 mM EDTA.
- تحضير وسط الثقافة: تكملة وسط RPMI-1640 مع FBS (10٪ (v / v)) ، glutamax (2 mM) ، والبنسلين / Streptomycin (50 I.U / 50 ميكروغرام / مل)
- قم بتبريد المخزن المؤقت قيد التشغيل (جدول المواد) وفقا لبروتوكول الشركة المصنعة.
- تمييع الدم الكامل مع حجمين من المخزن المؤقت للتخفيف. باستخدام ماصة مصلية ، انقل 15 مل من الدم المضاد للتخثر إلى أنبوب سعة 50 مل يحتوي على 30 مل من مخزن التخزين المؤقت للتخفيف. اخلطي بلطف عن طريق الانعكاس.
- لكل 10 مل من الدم الكامل أو 30 مل من الدم المخفف ، أضف 15 مل من وسط تدرج الكثافة إلى أنبوب فارغ سعة 50 مل.
- ضع طبقة من وسط تدرج الكثافة من الخطوة 1.1.5 مع 30 مل من الدم المخفف ببطء وثبات باستخدام ماصة مصلية سعة 25 مل. احتفظ بطرف الماصة على جدار الأنبوب والأنبوب بزاوية مائلة.
- انقل الأنابيب بعناية إلى جهاز طرد مركزي متأرجح الجرافة. تجنب إزعاج المرحلتين. قم بطرد الأنابيب مركزيا عند 400 × g في درجة حرارة الغرفة (RT) لمدة 25 دقيقة مع ضبط التسارع والتباطؤ على الحد الأدنى للقيمة.
- قم بإزالة طبقة البلازما العلوية (الواضحة) بعناية باستخدام ماصة 10 مل وتخلص منها في وعاء مع التبييض (10٪).
- جمع الطبقة البينية (البيضاء) من خلايا الدم الطرفية أحادية النواة (PBMCs، الشكل 2) باستخدام ماصة 10 مل ونقلها إلى أنبوب جديد سعة 50 مل. امزج الطبقة البيضاء من أنابيب مختلفة من نفس المتبرع في أنبوب 50 مل حتى 30 مل.
- أحضر كل أنبوب إلى حجم إجمالي قدره 50 مل مع المخزن المؤقت للتخفيف من الخطوة 1.1.1 وأجهزة الطرد المركزي عند 300 × g و 4 °C لمدة 10 دقائق. قم بإزالة supernatant باستخدام ماصة 10 مل وتخلص منها في وعاء به مبيض (10٪).
- أعد تعليق كل حبيبة خلية في 1 مل من المخزن المؤقت المبرد مسبقا من الخطوة 1.1.3 باستخدام ماصة دقيقة p1000. الجمع بين تعليق الخلايا من نفس المتبرع في أنبوب جديد 15 مل. ارفع حجم كل أنبوب إلى 15 مل باستخدام مخزن مؤقت للتشغيل مبرد مسبقا واخلطه جيدا عن طريق الانعكاس.
- خذ أليكوت 20 ميكرولتر من تعليق الخلية من الخطوة 1.1.11 وقم بإعداد تخفيف 1:100 باستخدام 1x PBS معقم. حدد رقم الخلية باستخدام مقياس الدم.
- الطرد المركزي تعليق الخلية من الخطوة 1.1.11 عند 300 × g و 4 °C لمدة 10 دقائق وإزالة supernatant مع ماصة 10 مل. إذا لزم الأمر ، استخدم ماصة دقيقة p200 لإزالة supernatant تماما.
- أعد تعليق PBMCs المعزولة في 80 ميكرولتر من المخزن المؤقت MACS المبرد مسبقا لكل خلية 1 × 107 خلايا، مما يضيف ما يصل إلى 800 ميكرولتر كحد أقصى من المخزن المؤقت.
- أضف 20 ميكرولتر من الميكروبيدات CD14 المضادة للإنسان لكل 1 × 107 خلايا أو ما يصل إلى 100 ميكرولتر لكل عينة دم (~ 100 مل من الدم غير المخفف). تخلط جيدا عن طريق الانعكاس وتوضع على دوار أنبوب لمدة 20 دقيقة مع الخلط المستمر عند 4 درجات مئوية.
- قم بإزالة العينات من دوار الأنبوب ، وأضف 10 مل من المخزن المؤقت المبرد مسبقا إلى كل أنبوب ، وأجهزة الطرد المركزي عند 300 × g (التسارع = 5 ، والتباطؤ = 5) و 4 درجات مئوية لمدة 10 دقائق.
- قم بإزالة المادة الفائقة باستخدام ماصة 10 مل وأعد تعليق ما يصل إلى 1 × 10 8 خلايا في 500 ميكرولتر من المخزن المؤقت المبرد مسبقا (2 × 108 / مل).
- قم بإجراء عزل الخلايا الإيجابية CD14 عن طريق فرز الخلايا المغناطيسية باستخدام نظام يدوي أو آلي (جدول المواد) وفقا لتعليمات الشركة المصنعة.
- خذ أليكوت 20 ميكرولتر من تعليق الخلية من الخطوة 1.1.18 بعد الاختيار الإيجابي CD14 وقم بإعداد تخفيف 1:100 باستخدام 1x PBS معقم. حدد رقم الخلية عن طريق حساب الخلايا على مقياس الدم.
- الطرد المركزي للخلايا الموجبة CD14 عند 300 × g و RT لمدة 10 دقائق. قم بإزالة supernatant باستخدام ماصة 10 مل أو نظام فراغ.
- أعد تعليق حبيبات الخلايا من الخطوة 1.1.20 في وسط الاستزراع المسخن مسبقا من الخطوة 1.1.2 إلى كثافة الخلية النهائية البالغة 1 × 107 خلايا/مل.
- زرع الخلايا الوحيدة المعزولة الموجبة CD14 بكثافة خلية تبلغ 5 × 106 خلايا.
- في طبق زراعة الأنسجة الذي يبلغ طوله 10 سم، أضف 10 مل من وسط الاستزراع من الخطوة 1.1.2 مع عامل تحفيز مستعمرة الخلايا المحببة والبلاعم (GM-CSF) بمقدار 50 نانوغرام/مل.
- أضف 0.5 مل من تعليق الخلية من الخطوة 1.1.21 إلى وسط المزرعة بقطرة وقم بتدوير اللوحة بلطف. احتضان الخلايا في حاضنة زراعة الأنسجة الرطبة (37 درجة مئوية ، 5٪ CO2) بين عشية وضحاها.
- في اليوم التالي ، قم بشفط الوسط باستخدام نظام فراغ لإزالة الخلايا التي لم تعلق بين عشية وضحاها. أضف 10 مل من وسط المستنبتات الطازجة المكمل ب GM-CSF (50 نانوغرام / مل) واحتضن الخلايا في حاضنة زراعة الأنسجة الرطبة (37 درجة مئوية ، 5٪ CO2) لمدة 7 أيام للسماح بالتمايز الكامل (انظر الشكل 3A لظهور الخلايا الوحيدة CD14 + في مراحل مختلفة من التمايز في GM-CSF ). تبادل وسيط الثقافة كل 2-3 أيام واستكمله ب GM-CSF الطازج (50 نانوغرام / مل) في كل مرة.
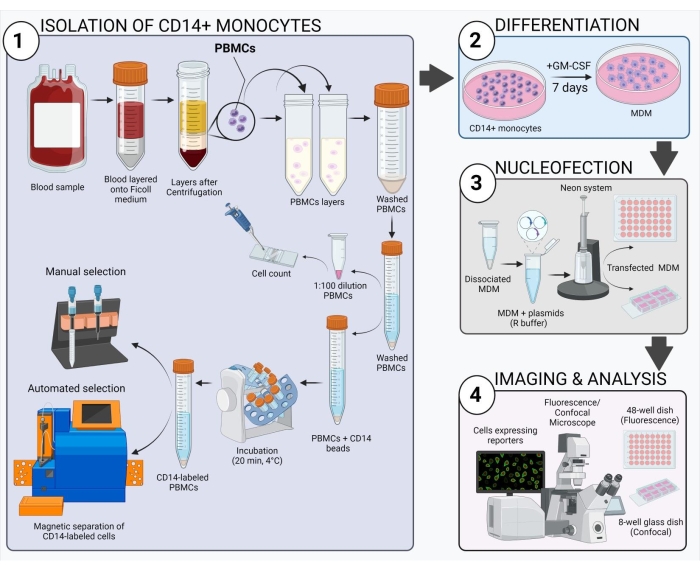
الشكل 2: نظرة عامة تخطيطية على سير العمل التجريبي. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
2. إعداد مكونات الكهربية
ملاحظة: تم تصميم هذا البروتوكول لطرف 10 ميكرولتر-نيون (جدول المواد). لكل عملية نقل ، استخدم 1-2 × 105 خلايا. يوصى بزرع الخلايا المنقولة على طبق من 48 بئرا أو طبق من 8 غرف (10 ميكرولتر من الخلايا المنقولة لكل بئر). يمكن استخدام 1x DPBS المعقمة (بدون Ca2 + و Mg2 +) بدلا من PBS.
- في اليوم 7 ، قم بإعداد وسط خال من المضادات الحيوية عن طريق استكمال وسط RPMI-1640 مع FBS (10٪ (v / v)) و glutamax (2 mM).
- ضع وسط RPMI-1640 الخالي من المصل ، ومحلول التربسين-EDTA (0.25٪) ، و 1x PBS معقم (بدون Ca 2+ و Mg2+) ، ووسط استزراع كامل من الخطوة 1.1.2 في حمام مائي 37 درجة مئوية.
- إذا كنت تستخدم أطباقا ذات قاع زجاجي (للمجهر البؤري) ، فقم بتغطية الأطباق بهيدروبروميد بولي دي ليسين.
- قم بتغطية 8 أطباق جيدة الحجرة ب 200 ميكرولتر من هيدروبروميد بولي دي ليسين (0.1 مجم / مل في 1x PBS معقم) واحتضنها لمدة 5 دقائق في RT.
- استنشق محلول poly-D-lysine واغسل الزجاج مرة واحدة باستخدام 1x PBS معقم. استنشق PBS وتابع الخطوة 2.4.
- أضف 200 ميكرولتر من الوسط الخالي من المضادات الحيوية لكل بئر من طبق البئر 48 أو 8 أطباق جيدة الحجرة واحتضان الخلايا المبللة مسبقا في حاضنة زراعة الأنسجة الرطبة (37 درجة مئوية ، 5٪ CO2) حتى تصبح جاهزة لطلاء الخلايا المنقولة.
3. إعداد الخلايا للكهربية
ملاحظة: يبلغ عائد MDM من طبق 10 سم في نهاية فترة التمايز لمدة 7 أيام حوالي 1.5 × 106 خلايا. يمكن استخدام 1x DPBS المعقمة (بدون Ca2 + و Mg2 +) بدلا من PBS. تم تحسين هذا البروتوكول بحيث يتم فصل معظم البلاعم عن اللوحة مع الحفاظ على صلاحية الخلية وسلامتها. يصعب فصل MDM عن ألواح زراعة الخلايا. لذلك، قد يكون من الضروري تنفيذ الخطوتين 3.2 و 3.3 مرتين لفصل الخلايا. تأكد من أن كل وقت حضانة مع التربسين-EDTA (0.25٪) لا يتجاوز 5 دقائق.
- استنشق الوسائط من البلاعم المتمايزة تماما على أطباق 10 سم واغسل الطبقة الأحادية للخلية بوسط RPMI-1640 الدافئ الخالي من المصل. تأكد من إزالة الوسيط بالكامل.
- حصاد الخلايا عن طريق إضافة 2 مل من محلول التربسين-EDTA الدافئ (0.25٪) لكل طبق 10 سم واحتضانه في حاضنة زراعة الأنسجة الرطبة (37 درجة مئوية ، 5٪ CO2) لمدة 5 دقائق.
- أكمل انفصال الخلايا عن طريق سحب محلول التربسين-EDTA بلطف (0.25٪) لأعلى ولأسفل على كامل منطقة الطبق باستخدام ماصة دقيقة p1000. انقل تعليق الخلية إلى أنبوب مخروطي 15 مل يحتوي على 5 مل من وسط الثقافة الكاملة الدافئة من الخطوة 1.1.2.
- خذ الطبق إلى مجهر ميداني مشرق وتحقق من انفصال الخلايا في مختلف مجالات الرؤية. إذا كان هناك كمية كبيرة من الخلايا لا تزال متصلة، كرر الخطوات 3.2-3.3.
- جهاز طرد مركزي لتعليق الخلية عند 250 × g لمدة 5 دقائق في RT.
- استنشاق الوسط وإعادة تعليق الخلايا في 10 مل من 1x PBS معقمة تم تسخينها مسبقا إلى 37 درجة مئوية. خذ أليكوت 20 ميكرولتر لتحديد رقم الخلية باستخدام مقياس الدم.
- خذ 1-2 × 105 خلايا لكل عملية نقل مقصودة وضعها في أنبوب 15 مل. أحضر إلى الحجم النهائي من 15 مل مع 1x PBS معقمة تم تسخينها مسبقا. جهاز طرد مركزي عند 250 × g لمدة 5 دقائق في RT.
- قم بشفط PBS وأجهزة الطرد المركزي مرة أخرى لمدة 1 دقيقة عند 250 × جم. قم بإزالة أي PBS متبقية من حبيبات الخلية باستخدام ماصة دقيقة p200.
4. نوكليوفيكت مكونات كاسباز BiFC في البلاعم البشرية المشتقة من الخلايا الأحادية
ملاحظة: يتم تنفيذ هذا القسم من البروتوكول باستخدام نظام نقل النيون (جدول المواد). يحدد هذا البروتوكول خطوات نقل 1-2 × 105 خلايا باستخدام طرف نيون 10 ميكرولتر (جدول المواد). إذا كنت تستخدم طرف نيون 100 ميكرولتر ، فقم بتوسيع نطاقه وفقا لذلك. تجنب تعريض الخلايا للمخزن المؤقت R لإعادة التعليق لأكثر من 15 دقيقة، لأن هذا قد يقلل من صلاحية الخلايا وكفاءة النقل.
- قم بتخفيف بلازميد المراسل (أي mCherry أو dsRedmito عند 100 نانوغرام / ميكرولتر) في ماء خال من النوكليز أو مخزن مؤقت 0.5x TE لتصور الخلايا المنقولة.
- قم بتخفيف بلازميدات كاسباز BiFC إلى تركيز مناسب في الماء الخالي من النوكليز أو 0.5x TE المخزن المؤقت ، بحيث لا يتجاوز الحجم الإجمالي للبلازميدات 30٪ من إجمالي حجم النقل البالغ 10 ميكرولتر (أي 300 نانوغرام / ميكرولتر من C1 Pro-VC و 300 نانوغرام / ميكرولتر من C1 Pro-VN).
- قم بإعداد أنبوب مجهري معقم سعة 1.5 مل لكل عملية نقل مقصودة وأضف الكمية المناسبة من بلازميد المراسل (أي 50 نانوغرام أو 0.5 ميكرولتر) وبلازميدات كاسباز BiFC (أي 300 نانوغرام أو 1 ميكرولتر من C1 Pro-VC و 300 نانوغرام أو 1 ميكرولتر من شظية C1 Pro-VN). حافظ على الأنابيب الدقيقة في غطاء المحرك في جميع الأوقات.
- ضع محطة الماصة والجهاز والنصائح وأنابيب الكهربية والماصة في غطاء تدفق صفائحي معقم.
ملاحظة: يتم تضمين محطة الماصة والجهاز والنصائح وأنابيب الكهربية والماصة في نظام نقل النيون. - قم بتوصيل موصل الجهد العالي والمستشعر الموجود في محطة الماصة بالمنافذ الخلفية على الجهاز وفقا لتعليمات الشركة المصنعة. حافظ على محطة الماصة قريبة من الجهاز.
- قم بتوصيل سلك الطاقة بمدخل التيار المتردد الخلفي وتابع توصيل الجهاز بمأخذ التيار الكهربائي. اضغط على مفتاح الطاقة لتشغيل الجهاز.
- أدخل معلمات النقل في شاشة بدء التشغيل المعروضة عند تشغيل الجهاز وتوصيله بشكل مناسب. اضغط على الجهد ، أدخل 1000 ، واضغط على تم لضبط الجهد على 1000 فولت. اضغط على العرض ، أدخل 40 ، واضغط على تم لضبط مدة النبض على 40 مللي ثانية. أخيرا ، اضغط على # نبضات ، وأدخل 2 ، واضغط على تم لتعيين عدد النبضات الكهربائية إلى 2.
- خذ أحد أنابيب الكهربية (المتوفرة في المجموعة) واملأه ب 3 مل من المخزن المؤقت الإلكتروليتي E (لنصائح 10 ميكرولتر والمتوفرة في المجموعة) في RT. أدخل أنبوب الكهربية في حامل الماصة في محطة الماصة. تأكد من أن القطب الكهربائي الموجود على جانب الأنبوب متجه إلى الداخل وأنه يتم سماع صوت نقرة عند إدخال الأنبوب.
- خذ حبيبة الخلية من الخطوة 3.8 وأضف 10 ميكرولتر من المخزن المؤقت R لإعادة التعليق المسخن مسبقا (المتوفر في المجموعة) لكل 1-2 × 105 خلايا. اخلطي بلطف مع ماصة صغيرة p20. أضف 10 ميكرولتر من تعليق الخلية إلى كل أنبوب تم إعداده في الخطوة 4.3 واخلطه بلطف مع ماصة دقيقة p20.
- خذ الماصة وأدخل طرفا بالضغط على زر الضغط على المحطة الثانية. تأكد من أن المشبك يلتقط تماما جذع تركيب المكبس في الطرف وأنه لا توجد فجوة في الرأس العلوي للماصة.
- لاستنشاق العينة، اضغط على زر الضغط على الماصة إلى المحطة الأولى واغمس في الأنبوب الأول الذي يحتوي على خليط الحمض النووي للخلية/البلازميد. استنشق الخليط ببطء في طرف الماصة.
ملاحظة: تجنب فقاعات الهواء لأنها يمكن أن تسبب الانحناء أثناء التفريغ الكهربائي ، وإذا اكتشفها الجهاز ، يمكن أن تمنع توصيل النبضة الكهربائية. إذا لوحظت فقاعات هوائية، فقم بتحرير المحتويات في الأنبوب وحاول الشفط مرة أخرى. - أدخل الماصة مع العينة بعناية فائقة في حامل الماصة. تأكد من نقرات الماصة ووضعها بشكل صحيح.
- اضغط على زر البدء على الشاشة التي تعمل باللمس وانتظر حتى يتم تسليم النبضات الكهربائية. ستشير رسالة على الشاشة إلى الانتهاء.
- قم بإزالة الماصة ببطء من المحطة وأضف على الفور تعليق الخلية المنقولة إلى البئر المقابل مع وسط خال من المضادات الحيوية تم تسخينه مسبقا من الخطوة 2.4 عن طريق الضغط ببطء على زر الضغط إلى المحطة الأولى.
ملاحظة: يمكن إعادة استخدام هذا الطرف حتى ثلاث مرات لنفس البلازميد. خلاف ذلك ، تخلص منه في حاوية نفايات المخاطر البيولوجية عن طريق الضغط على زر الضغط إلى المحطة الثانية. - كرر الخطوات 4.10-4.14 لكل أنبوب يحتوي على خليط الحمض النووي الخلوي/البلازميد.
- هز الصفيحة بلطف مع الخلايا المنقولة وحضانت لمدة 1-3 ساعات في حاضنة زراعة الأنسجة الرطبة (37 درجة مئوية ، 5 ٪ CO2).
- أضف إلى كل بئر 200 ميكرولتر من وسط الاستزراع المسخن مسبقا (الوسط الكامل) من الخطوة 1.1.2. ضع الطبق في حاضنة زراعة الأنسجة الرطبة (37 درجة مئوية ، 5٪ CO2) مرة أخرى. اسمح بما لا يقل عن 24 ساعة للتعبير الجيني.
- في اليوم التالي ، افحص صلاحية الخلية وكفاءة النقل باستخدام مجهر epifluorescence.
- قم بتشغيل مجهر epifluorescence وصندوق مصدر الضوء الفلورسنت وفقا لتعليمات الشركة المصنعة ووضع طبق الثقافة على مرحلة المجهر.
- حدد الهدف 10x أو 20x ومرشح 568 نانومتر (RFP).
- لتقدير صلاحية الخلية، اضغط على زر LED للضوء المرسل (TL) لتصور جميع الخلايا في الحقل المحدد. أثناء النظر إلى عدسة المجهر ، أدر مقبض التركيز البؤري حتى تتم ملاحظة الخلايا وتحقق من وجود ارتباط بالخلايا في الحقل المحدد.
ملاحظة: تمثل الخلايا المرفقة بالكامل الخلايا القابلة للحياة بينما تمثل الخلايا العائمة خلايا غير قابلة للحياة. إذا كان التقاء البئر مرتفعا ، فقد يكون وجود خلايا غير متصلة نتيجة للمبالغة في تقدير عدد الخلايا وليس نتيجة لانخفاض قابلية البقاء. ومع ذلك ، فإن الالتقاء المنخفض المصحوب بمحتوى عال من الخلايا العائمة يدل على انخفاض الجدوى التي قد تنجم عن الانحناء أثناء الكهربية ، أو سمية البلازميد ، أو التعرض المفرط للمخزن المؤقت R لإعادة التعليق. لا تستخدم الآبار التي تعرض السلوك الأخير. - لتقدير كفاءة النقل ، ركز على الخلايا في المجال المحدد تحت الضوء المرسل كما هو موضح أعلاه. حساب العدد الإجمالي للخلايا في الحقل المحدد. عند إيقاف تشغيل مؤشر LED للضوء المرسل (TL)، اضغط على زر مؤشر LED للضوء المنعكس (RL) لتشغيله.
- التركيز الدقيق على التألق الجيني للمراسل (الخلايا الحمراء) وحساب العدد الإجمالي لخلايا الفلورسنت الحمراء. كرر هذه الخطوات (4.18.4-4.18.5) لحقلين آخرين على الأقل لكل بئر.
5. معالجة الحصول على بيانات MDM و caspase BiFC المنقولة
ملاحظة: إذا كنت تخطط لتصوير الخلايا باستخدام المجهر فوق الفلوري أو المجهر البؤري، ينصح بالعلاج باستخدام qVD-OPh (20 ميكرومتر) لمدة 1 ساعة قبل العلاج باستخدام الحافز المختار لمنع موت الخلايا المعتمد على كاسباز (موت الخلايا المبرمج في الغالب). يستخدم هذا في التصوير لمنع الخلايا من الارتقاء بسبب موت الخلايا المبرمج ، مما يجعل من الصعب جدا تصويرها أثناء تحركها خارج المستوى البؤري. لاحظ أن توظيف caspase في منصة التنشيط و caspase BiFC المرتبط بها لا يعتمد على النشاط الحفاز لل caspase ، وبالتالي ، لن يؤثر تثبيط caspase على هذه الخطوة.
- علاج مع الحافز المختار حوالي 24 ساعة بعد نقل الحمل وحضانة طالما كان ذلك ضروريا لكل دواء.
- تحضير وسط التصوير عن طريق استكمال وسط الثقافة من الخطوة 1.1.2 مع Hepes (20 mM ، الرقم الهيدروجيني 7.2-7.5) و 2-mercaptoethanol (55 μM).
- أضف تركيز التحفيز المطلوب إلى وسط التصوير الذي تم تسخينه مسبقا واخلطه بلطف.
- قم بإزالة الوسائط من الخلايا بعناية باستخدام ماصة دقيقة p1000 وأضف 500 ميكرولتر من محلول التحفيز من الخطوة 5.1.2 أسفل جانب البئر.
- لتشغيل آبار التحكم غير المعالجة ، أضف وسط تصوير بدون الحافز.
- احتضان الخلايا في حاضنة زراعة الأنسجة الرطبة (37 درجة مئوية ، 5٪ CO2) طالما هو موضح لكل علاج.
- تصور الخلايا باستخدام المجهر اللامع أو المجهر البؤري.
- قم بتشغيل المجهر ومصدر الضوء الفلورسنت ، باتباع تعليمات الشركة المصنعة.
- حدد الهدف 10x أو 20x وضع طبق الثقافة على مسرح المجهر.
- باستخدام عدسة المجهر ، ابحث عن الخلايا تحت مرشح 568 نانومتر وركز على الخلايا التي تعبر عن مراسل dsRedmito / mCherry (الخلايا الحمراء).
- عد جميع الخلايا الحمراء في المجال المرئي وسجل الرقم.
- أثناء وجودك في نفس المجال البصري ، قم بالتغيير إلى مرشح 488 أو 512 (GFP أو YFP) ، وانتقل إلى حساب عدد الخلايا الحمراء الخضراء أيضا (إيجابية الزهرة أو BiFC الموجبة) وتسجيل الرقم.
- عد ما لا يقل عن 100 dsRedmito / mCherry - خلايا إيجابية من ثلاثة مجالات بصرية فردية على الأقل.
- احسب النسبة المئوية للخلايا المنقولة إيجابية الزهرة لكل مجال بصري ومتوسط النسب المئوية الناتجة لكل علاج (جيد) للحصول على الانحراف المعياري.
- تصوير الخلايا باستخدام مجهر فوق فلوري أو مجهر بؤري
ملاحظة: للحصول على صور متحدة البؤرة باستخدام هدف 20x أو تكبير أكبر ، يجب طلاء الخلايا على أطباق زجاجية ما لم يكن المجهر مجهزا بهدف تمرير طويل.- اتبع الخطوات 5.2.1-5.2.3. إذا كنت تستخدم مجهرا متحد البؤرة مع هدف الزيت 40x أو 60x أو 63x ، فضع قطرة من الزيت على الهدف.
- تصور الصورة الحية للخلايا على شاشة الكمبيوتر كما حصلت عليها الكاميرا. استخدم مصدر الضوء epifluorescence للصور الفلورية أو قم بتبديل مصدر الضوء إلى الليزر للحصول على صور متحدة البؤرة.
- قم بضبط التركيز البؤري وموضع الخلايا باستخدام عجلة التحكم في عصا التحكم والتركيز.
- اضبط النسبة المئوية لطاقة الليزر ووقت التعرض لليزر 512 نانومتر أو 488 نانومتر (YFP أو GFP) و 568 نانومتر (RFP) بحيث تبدو الإشارة في الصورة جيدة ولا تصل إلى التشبع.
- قم بتشغيل الالتقاط المباشر وفحص الصورة الناتجة. تأكد من رؤية ذروة مميزة لكل فلور في المدرج التكراري للشاشة لكلتا القناتين.
- اضبط طاقة الليزر ووقت التعرض حسب الضرورة. حافظ على هذه القيم منخفضة قدر الإمكان مع الاستمرار في القدرة على اكتشاف كل من إشارات الفلورسنت (RFP و GFP / YFP).
- أثناء تصور الصورة الحية للخلايا، التقط صورا تمثيلية متعددة لحقل يحتوي على خلية واحدة أو أكثر تعبر عن مراسل mCherry/dsRedmito لكل بئر من اللوحة واحفظ البيانات.
Access restricted. Please log in or start a trial to view this content.
النتائج
يعطي المخطط الموضح في الشكل 2 نظرة عامة على كيفية الحصول على MDM البشري ونقله وتصويره. بعد حضانة الخلايا الوحيدة CD14 + المختارة مع GM-CSF لمدة 7 أيام ، يتغير مورفولوجيا الخلية على مدار فترة التمايز (الشكل 3A) ، والانتقال من خلايا التعليق الكروية إلى المغزل والمرتبط?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يصف هذا البروتوكول سير العمل للحصول على البلاعم من الخلايا الوحيدة المعزولة من عينات الدم البشرية وطريقة لإدخال مراسلي الكاسباز الالتهابي BiFC بكفاءة في MDM البشري دون المساس بصلاحية الخلايا وسلوكها.
يستفيد هذا البروتوكول من تقنية BiFC35 لوضع علامة على الكاسباس ال?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ويعلن صاحبا البلاغ أنه ليس لديهما مصالح مالية منافسة.
Acknowledgements
نشكر أعضاء مختبر LBH السابقين والحاليين الذين ساهموا في تطوير هذه التقنية. يتم دعم هذا المختبر من قبل NIH / NIDDK T32DK060445 (BEB) ، NIH / NIDDK F32DK121479 (BEB) ، NIH / NIGMS R01GM121389 (LBH). تم رسم الشكل 2 باستخدام برنامج Bionder.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 48 well tissue culture2:34 plates | Genesee Scientific | 25-108 | |
| 10 cm Tissue Culture Dishes | VWR | 25382-166 | |
| 2 Mercaptoethanol 1000x | Thermo Fisher Scientific | 21985023 | |
| 8 well chambered coverglass with 1.5 HP coverglass | Cellvis | c8-1.5H-N | |
| AutoMACS columns | Miltenyi (Biotec) | 130-021-101 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Separator | Miltenyi (Biotec) | 130-092-545 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Washing Solution | Miltenyi (Biotec) | 130-092-987 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Rinsing Solution | Miltenyi (Biotec) | 130-091-222 | For automated separation using AutoMACS Pro Separator only |
| AutoMacs running buffer | Miltenyi (Biotec) | 130-091-221 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| Axio Observer Z1 motorized inverted microscope equipped with a CSU-X1A 5000 spinning disk unit | Zeiss | Any confocal microscope equipped with a laser module fitted with laser lines of 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| AxioObserver A1, Research Grade Inverted Microscope | Zeiss | Any epifluorescence microscope with fluorescence filters capable of exciting 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| CD14+ MICROBEADS | Miltenyi (Biotec) | 130-050-201 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| DPBS without calcium chloride and magnesium chloride | Sigma | D8537-6x500ML | |
| DsRed mito plasmid | Clontech | 632421 | Similar plasmids that can be used as fluorescent reporters can be found on Addgene |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437028 | |
| Ficoll-Paque PLUS 6 x 100 mL | Sigma | GE17-1440-02 | |
| GlutaMAX Supplement (100x) | Thermo Fisher Scientific | 35050079 | |
| GM-CSF | Thermo Fisher Scientific | PHC2011 | |
| Hemin BioXtra, from Porcine, ≥96.0% (HPLC) | Sigma | 51280-1G | |
| HEPES | Thermo Fisher Scientific | 15630106 | |
| Inflammatory caspase BiFC plasmids | Available by request from LBH lab | ||
| LPS-EB Ultrapure | Invivogen | TLRL-3PELPS | |
| LS Columns | Miltenyi (Biotec) | 130-042-401 | For manual separation using QuadroMACS Separator only |
| MACS 15 mL Tube Rack | Miltenyi (Biotec) | 130-091-052 | For manual separation using QuadroMACS Separator only |
| MACS MultiStand | Miltenyi (Biotec) | 130-042-303 | For manual separation using QuadroMACS Separator only |
| mCherry plasmid | Yungpeng Wang Lab | Similar plasmids that can be used as fluorescent reporters can be found on Addgene | |
| Neon Transfection System | Thermo Fisher Scientific | MPK5000 | Includes Neon electroporation device, pipette and pipette station |
| Neon Transfection System 10 µL Kit | Thermo Fisher Scientific | MPK1096 | Includes resuspension buffer R, resuspension buffer T, electrolytic buffer E, 96 x 10 µL Neon tips and Neon electroporation tubes |
| Nigericin sodium salt, ready made solution | Sigma | SML1779-1ML | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-D-Lysine Hydrobromide | Sigma | P7280-5mg | |
| QuadroMACS Separator | Miltenyi (Biotec) | 130-090-976 | For manual separation using QuadroMACS Separator only |
| qVD-OPh | Fisher (ApexBio) | 50-101-3172 | |
| RPMI 1640 Medium | Thermo Fisher Scientific | 11875119 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200072 | |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | 15575020 | |
| Zeiss Zen 2.6 (blue edition) software | Zeiss | Any software used to operate the confocal microscope of choice |
References
- Boatright, K. M., et al. A unified model for apical caspase activation. Molecular Cell. 11 (2), 529-541 (2003).
- Pop, C., Salvesen, G. S. Human caspases: activation, specificity, and regulation. Journal of Biological Chemistry. 284 (33), 21777-21781 (2009).
- Boice, A., Bouchier-Hayes, L. Targeting apoptotic caspases in cancer. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1867 (6), 118688(2020).
- Bolívar, B. E., Vogel, T. P., Bouchier-Hayes, L. Inflammatory caspase regulation: maintaining balance between inflammation and cell death in health and disease. The FEBS Journal. 286 (14), 2628-2644 (2019).
- Martinon, F., Tschopp, J. Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory diseases. Cell. 117 (5), 561-574 (2004).
- Lamkanfi, M., Vishva, M. D. Mechanisms and functions of inflammasomes. Cell. 157 (5), 1013-1022 (2014).
- Viganò, E., et al. Human caspase-4 and caspase-5 regulate the one-step noncanonical inflammasome activation in monocytes. Nature Communications. 6, 8761(2015).
- Cerretti, D. P., et al. Molecular cloning of the interleukin-1 beta converting enzyme. Science. 256 (5053), 97(1992).
- van de Veerdonk, F. L., Netea, M. G., Dinarello, C. A., Joosten, L. A. Inflammasome activation and IL-1β and IL-18 processing during infection. Trends in Immunology. 32 (3), 110-116 (2011).
- Martinon, F., Burns, K., Tschopp, J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Molecular Cell. 10 (2), 417-426 (2002).
- Kayagaki, N., et al. Noncanonical inflammasome activation targets caspase-11. Nature. 479 (7371), 117-121 (2011).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Masumoto, J., et al. ASC, a novel 22-kDa protein, aggregates during apoptosis of human promyelocytic leukemia HL-60 cells. The Journal of Biological Chemistry. 274 (48), 33835-33838 (1999).
- Bertin, J., DiStefano, P. S. The PYRIN domain: a novel motif found in apoptosis and inflammation proteins. Cell Death and Differentiation. 7 (12), 1273-1274 (2000).
- Agostini, L., et al. NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 20 (3), 319-325 (2004).
- Bürckstümmer, T., et al. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nature Immunology. 10 (3), 266-272 (2009).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nature Reviews Immunology. 13 (6), 397-411 (2013).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for noncanonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Bolívar, B. E., et al. Noncanonical Roles of Caspase-4 and Caspase-5 in Heme-Driven IL-1β Release and Cell Death. The Journal of Immunology. 206 (8), 1878-1889 (2021).
- Schmid-Burgk, J. L., et al. Caspase-4 mediates noncanonical activation of the NLRP3 inflammasome in human myeloid cells. European Journal of Immunology. 45 (10), 2911-2917 (2015).
- Baker, P. J., et al. NLRP3 inflammasome activation downstream of cytoplasmic LPS recognition by both caspase-4 and caspase-5. European Journal of Immunology. 45 (10), 2918-2926 (2015).
- Cullen, S. P., Kearney, C. J., Clancy, D. M., Martin, S. J. Diverse activators of the NLRP3 inflammasome promote IL-1β secretion by triggering necrosis. Cell Reports. 11 (10), 1535-1548 (2015).
- Sanders, M. G., et al. Single-cell imaging of inflammatory caspase dimerization reveals differential recruitment to inflammasomes. Cell Death & Disease. 6, 1813(2015).
- Charendoff, C. I., Bouchier-Hayes, L. Lighting up the pathways to caspase activation using bimolecular fluorescence complementation. Journal of Visualized Experiments: JoVE. (133), e57316(2018).
- Bouchier-Hayes, L., et al. Characterization of cytoplasmic caspase-2 activation by induced proximity. Molecular Cell. 35 (6), 830-840 (2009).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral blood mononuclear cells: Isolation, Freezing, thawing, and culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Current Pathobiology Reports. 7 (2), 17-27 (2019).
- Perregaux, D., et al. IL-1 beta maturation: evidence that mature cytokine formation can be induced specifically by nigericin. The Journal of Immunology. 149 (4), 1294-1303 (1992).
- Cheneval, D., et al. Increased mature interleukin-1β (IL-1β) secretion from THP-1 cells induced by nigericin is a result of activation of p45 IL-1β-converting enzyme processing. Journal of Biological Chemistry. 273 (28), 17846-17851 (1998).
- Fernandes-Alnemri, T., et al. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death and Differentiation. 14 (9), 1590-1604 (2007).
- Lu, A., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Muller-Eberhard, U., Javid, J., Liem, H. H., Hanstein, A., Hanna, M. Brief report: Plasma concentrations of hemopexin, haptoglobin and heme in patients with various hemolytic diseases. Blood. 32 (5), 811-815 (1968).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40 (1), 61-66 (2006).
- Thornberry, N. A., et al. A novel heterodimeric cysteine protease is required for interleukin-1βprocessing in monocytes. Nature. 356 (6372), 768-774 (1992).
- Jensen, K., Anderson, J. A., Glass, E. J. Comparison of small interfering RNA (siRNA) delivery into bovine monocyte-derived macrophages by transfection and electroporation. Veterinary Immunology and Immunopathology. 158 (3-4), 224-232 (2014).
- Tada, Y., Sakamoto, M., Fujimura, T. Efficient gene introduction into rice by electroporation and analysis of transgenic plants: use of electroporation buffer lacking chloride ions. Theoretical and Applied Genetics. 80 (4), 475-480 (1990).
- Bhowmik, P., et al. Targeted mutagenesis in wheat microspores using CRISPR/Cas9. Scientific Reports. 8 (1), 6502(2018).
- Sansom, D. M., Manzotti, C. N., Zheng, Y. What's the difference between CD80 and CD86. Trends in Immunology. 24 (6), 314-319 (2003).
- Kurokawa, M., Kornbluth, S. Caspases and kinases in a death grip. Cell. 138 (5), 838-854 (2009).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved