Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Monosit Kaynaklı Makrofajlarda İnflamatuar Kaspazların İndüklenen Yakınlığının Görselleştirilmesi
Bu Makalede
Özet
Bu protokol, insan kan örneklerinden monosit türevi makrofajlar (MDM) elde etmek için iş akışını, enflamatuar kaspaz Bimoleküler Floresan Kompleman (BiFC) muhabirlerini hücre canlılığı ve davranışından ödün vermeden insan MDM'sine verimli bir şekilde tanıtmak için basit bir yöntemi ve canlı hücrelerde enflamatuar kaspaz aktivasyonunu ölçmek için görüntüleme tabanlı bir yaklaşımı açıklamaktadır.
Özet
İnflamatuar kaspazlar kaspaz-1, -4, -5, -11 ve -12'yi içerir ve başlatıcı kaspazların alt grubuna aittir. Kaspaz-1, enflamatuar sinyalizasyonun doğru düzenlenmesini sağlamak için gereklidir ve enflamatuarlara işe alımı takiben yakınlık kaynaklı dimerizasyon ile aktive edilir. Kaspaz-1, monositik hücre soyunda bol miktarda bulunur ve pro-inflamatuar sitokinlerin interlökin (IL)-1β ve IL-18'in aktif salgılanan moleküllere olgunlaşmasını indükler. Diğer inflamatuar kaspazlar, kaspaz-4 ve -5 (ve bunların murin homolog kaspaz-11), pirotozu indükleyerek IL-1β salınımını teşvik eder. Kaspaz Bimoleküler Floresan Komplesyonu (BiFC), kaspaz aktivasyonunun bir okuması olarak inflamatuar kaspaz kaynaklı yakınlığı ölçmek için kullanılan bir araçtır. Enflamatuara bağlanan bölgeyi içeren kaspaz-1, -4 veya -5 prodomain, kaspazlar indüklenen yakınlığa maruz kaldığında floresan Venüs kompleksini reforme etmekle ilişkili sarı floresan protein Venüs'ün (Venüs-N [VN] veya Venüs-C [VC]) floresan olmayan parçalarına kaynaştırılır. Bu protokol, bu muhabirlerin nükleofeksiyon kullanarak birincil insan monosit kaynaklı makrofajlara (MDM) nasıl tanıtılacağını, inflamatuar kaspaz aktivasyonunu indüklemek için hücrelerin nasıl tedavi edileceğini ve floresan ve konfokal mikroskopi kullanarak kaspaz aktivasyonunun nasıl ölçüleceğini açıklamaktadır. Bu yaklaşımın avantajı, canlı hücrelerdeki inflamatuar kaspaz aktivasyon kompleksinin bileşenlerini, gereksinimlerini ve lokalizasyonunu tanımlamak için kullanılabilmesidir. Bununla birlikte, hücre canlılığından ve davranışından ödün vermemek için dikkatli kontrollerin göz önünde bulundurulması gerekir. Bu teknik, enflamatuar düzeyde dinamik kaspaz etkileşimlerinin analizi ve canlı MDM ve insan kan örneklerinden türetilen monositlerdeki inflamatuar sinyal kaskadlarının sorgulanması için güçlü bir araçtır.
Giriş
Kaspazlar, başlatıcı kaspazlar ve cellat kaspazlar olarak gruplandırılabilen bir sistein aspartat proteazlar ailesidir. Cellater kaspazlar kaspaz-3, -6 ve -7'den oluşur. Doğal olarak hücrelerde dimerler olarak bulunurlar ve apoptoz1'i yürütmek için başlatıcı kaspazlar tarafından bölünürler. Başlatıcı kaspazlar insan kaspazı-1, -2, -4, -5, -8, -9, -10 ve -12'yi içerir. Yakınlığa bağlı dimerizasyon ile aktive olan ve otoproteolitik bölünme 2,3 ile stabilize edilen inaktif zimojenler (pro-kaspazlar) olarak bulunurlar. İnflamatuar kaspazlar, başlatıcı kaspaz2'nin bir alt kümesidir ve insanlarda kaspaz-1, -4, -5 ve -12'yi ve fare 4,5'te kaspaz-1, -11 ve -12'yi kapsar. Apoptotik bir rolden ziyade, inflamasyonda merkezi bir rol oynarlar. Patojenik istilacılara yanıt olarak salınan ilk sitokinler olan pro-interlökin (IL)-1β ve pro-IL-18 6,7'nin proteolitik işlenmesine ve salgılanmasına aracılık ederler 8,9. Caspase-1, aktivasyon platformuna işe alındıktan sonra etkinleştirilir; inflamatuar olarak adlandırılan büyük bir moleküler ağırlıklı protein kompleksi (Şekil 1A)10. Kaspaz-4, -5 ve -11'in dimerizasyonu, kanonik olmayan bir enflamatuar yol11,12 aracılığıyla bu platformlardan bağımsız olarak gerçekleşir.
Kanonik enflamatuarlar, bir enflamatuar sensör proteini, adaptör protein ASC (CARD içeren apoptozla ilişkili leke benzeri protein) ve efektör protein kaspaz-110'dan oluşan sitozolik multimerik protein kompleksleridir. En iyi çalışılmış kanonik enflamatuarlar, bir pirin alanı (NLRP), NLRP1 ve NLRP3 içeren NOD benzeri reseptör ailesi, bir CARD (NLRC), NLRC4 içeren NLR ailesi ve melanom 2'de (AIM2) bulunmayanlardır. Her biri bir pirin etki alanı, bir CARD veya her iki etki alanı içerir. CARD etki alanı, CARD içeren kaspazlar ve bunların yukarı akış aktivatörleri arasındaki etkileşime aracılık eder. Bu nedenle, bir N-terminal pirin alanı (PYD) ve bir C-terminal CARD motifi 13,14'ten oluşan iskele molekülü ASC, NLRP1 10, NLRP315 ve AIM216 enflamatuarlarına kaspaz-1'in alınması için gereklidir.
Her enflamatuar, farklı pro-inflamatuar uyaranları tanıyan benzersiz sensör proteininden sonra adlandırılır (Şekil 1B). Bu yolun aktivatörlerine kanonik uyaranlar denir. Enflamatuarlar, mikrobiyal bileşenler ve doku stresi için sensörler görevi görür ve enflamatuar kaspazların aktivasyonu yoluyla sağlam bir enflamatuar yanıtı tetiklemek için bir araya gelir17. Enflamatuar düzenek, ana substratları pro-IL-1β ve pro-IL-18'in olgunlaşmasına ve salgılanmasına aracılık etmek için kaspaz-1 aktivasyonunu başlatır. Bu işlem iki adımlı bir mekanizma ile gerçekleşir. İlk olarak, bir astarlama uyaranı, NF-κB yolunun aktivasyonu yoluyla bazı enflamatuar proteinlerin ve pro-IL-1β'nin ekspresyonunu düzenler. İkincisi, hücre içi (kanonik) bir uyaran, enflamatuar montaja ve prokaspaz-1 6,7'nin işe alınmasına neden olur.
Kaspaz-4 ve kaspaz-5, murin kaspaz-11 11'in insan ortologlarıdır. Gram-negatif bakterilerin dış zarında bulunan bir molekül olan hücre içi lipopolisakkarit (LPS) 18,19,20 ve kırmızı kan hücresi hemolizi 21'in bir ürünü olan hücre dışı heme ile enflamatuardan bağımsız bir şekilde aktive edilirler. LPS'nin doğrudan bu proteinlerin CARD motifine bağlandığı ve oligomerizasyonlarını indüklediği öne sürülmüştür20. Kaspaz-4 veya kaspaz-5'in aktivasyonu, gözenek oluşturan protein gasdermin D'nin (GSDMD) bölünmesi yoluyla piroptoz adı verilen enflamatuar bir hücre ölümü formunu indükleyerek IL-1β salınımını teşvik eder18,19. Ek olarak, kaspaz-4 ve GSDMD aracılı piroptotik ölümden kaynaklanan potasyum iyonlarının efflüksü, NLRP3 enflamatuarının aktivasyonunu ve ardından kaspaz-122,23'ün aktivasyonunu indükler. Bu nedenle, kaspaz-4, -5 ve -11, spesifik uyaranlar 11,24'e yanıt olarak piroptoz ve kaspaz-1 aktivasyonunu indükleyebilen LPS için hücre içi sensörler olarak kabul edilir.
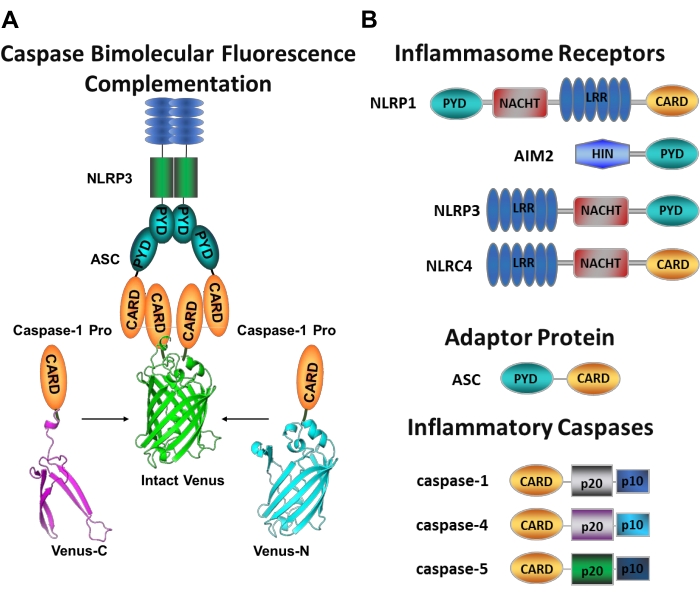
Şekil 1: İnflamatuar kaspazlar ve kaspaz-bimoleküler floresan kompleman (BiFC) testi. (A) Venüs'ün floresan olmayan her bir parçasına (Venüs-C veya Venüs-N) bağlı iki kaspaz-1 prodomaininin (C1-pro) NLRP3 aktivasyon platformuna alındığı ve Venüs'ü refere ve floresan yapmaya zorlayan kaspaz-BiFC sistemini gösteren diyagram. Bu kompleks mikroskop altında yeşil bir nokta olarak görünür ve başlatıcı kaspaz aktivasyonunda ilk adım olan inflamatuar kaspaz kaynaklı yakınlık için bir okuma görevi görür. (B) Enflamatuar bileşenlerin ve inflamatuar kaspazların etki alanı organizasyonunu gösteren şematik. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Spesifik başlatıcı kaspaz aktivasyonunu ölçmek zordur ve görüntüleme yaklaşımlarıyla bunu yapmak için çok fazla yöntem yoktur. Kaspaz Bimoleküler Floresan Komplemanı (BiFC), doğrudan canlı hücrelerde inflamatuar kaspaz aktivasyonunu görselleştirmek için kullanılabilir (Şekil 1A)25. Bu teknik yakın zamanda insan monosit türevi makrofajlarda (MDM) kullanılmak üzere uyarlanmıştır (MDM)21. Kaspaz BiFC, dimerizasyonu kolaylaştırmak için inflamatuar kaspaz aktivasyonundaki ilk adımı, indüklenmiş yakınlığı ölçer. Fotolanabilir sarı floresan protein Venüs'ün (Venüs-C [VC]) ve Venüs-N [VN]) floresan olmayan fragmanlarına kaynaşmış CARD içeren kaspaz prodomainini kodlayan plazmidlerin ekspresyonu kullanılır. İki kaspaz prodomaini aktivasyon platformlarına alındığında veya indüklenmiş yakınlığa maruz kaldığında, Venüs'ün iki yarısı yakına getirilir ve refold ve floresan yapmaya zorlanır (bkz. Şekil 1A, B). Bu, spesifik inflamatuar kaspaz aktivasyonunun gerçek zamanlı bir okumasını sağlar.
İnsan MDM'si, tehlike sinyallerini ve patojen ürünlerini tanımlayan enflamatuar genleri ve patern tanıma reseptörlerini bolca eksprese eder. Bu, inflamatuar kaspaz yolaklarının sorgulanması için ideal bir hücre tipi sağlar. Ek olarak, periferik kandan ve hatta belirli bir hastalık durumunda inflamatuar kaspaz aktivasyonunu değerlendirmek için hasta örneklerinden türetilebilirler. Bu protokol, elektroporasyon tabanlı bir transfeksiyon yöntemi olan nükleofeksiyon kullanılarak BiFC kaspaz muhabirlerinin MDM'ye nasıl tanıtılacağını, inflamatuar kaspaz aktivasyonunu indüklemek için hücrelerin nasıl tedavi edileceğini ve mikroskopi yaklaşımlarını kullanarak aktif kaspaz komplekslerinin nasıl görselleştirileceğini açıklamaktadır. Ek olarak, bu metodoloji, bu komplekslerin moleküler bileşimini, hücre altı lokalizasyonunu, kinetik ve bu yüksek sıralı yapıların büyüklüğünü belirlemek için uyarlanabilir25,26,27.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu protokol, Baylor College of Medicine'in insan örneklerinin manipülasyonu için insan araştırma etik komitesinin yönergelerini takip etmektedir. Kan örnekleri, insan örnekleri için kurumsal güvenlik kurallarına uyularak ele alınır. Kan örnekleri, sitrat fosfat dekstroz (CPD) çözeltisi ile toplandıkları bölgesel bir kan bankasında elde edilir. Bununla birlikte, sodyum heparin, lityum heparin veya EDTA gibi diğer antikoagülanlarla toplanan kan da bu protokoliçin kullanılabilir 28,29.
1. İnsan monositlerinin izolasyonu ve makrofajlara farklılaşması
- Bölgesel bir kan bankasında tanımlanmamış sağlıklı bireylerden antikoagüle kan elde edin ve aşağıda belirtildiği gibi periferik kan mononükleer hücrelerini (PBMC'ler) izole edin.
NOT: Bir doku kültürü laminer akış başlığındaki tüm adımları gerçekleştirin. Sadece steril tüpler kullanın ve eldiven giyin. Atılırken kanla ilgili tüm ürünlere% 10 ağartıcı ekleyin. Steril PBS (1x) veya DPBS (Ca'sız2+ ve Mg2+) birbirinin yerine kullanılabilir.- Seyreltme tamponunu hazırlayın: %2 FBS ve 0,5 mM EDTA ile 1x steril PBS takviyesi yapın.
- Kültür ortamını hazırlayın: FBS (% 10 (v / v)), glutamax (2 mM) ve Penisilin / Streptomisin (50 I.U. / 50 μg / mL) ile RPMI-1640 ortamını destekleyin
- Çalışan tamponu (Malzeme Tablosu) üreticinin protokolüne göre önceden soğutun.
- Tam kanı iki hacimli seyreltme tamponu ile seyreltin. Serolojik bir pipet kullanarak, antikoagüle kanın, 30 mL'lik seyreltme tamponunu içeren 50 mL'lik bir tüpe 15 mL'sini aktarın. Ters çevirerek nazikçe karıştırın.
- Her 10 mL tam kan veya 30 mL seyreltilmiş kan için, 50 mL boş bir tüpe 15 mL yoğunluk gradyanı ortamı ekleyin.
- Yoğunluk gradyan ortamını adım 1.1.5'ten itibaren 25 mL'lik bir serolojik pipet kullanarak 30 mL seyreltilmiş kan ile yavaşça ve istikrarlı bir şekilde katmanlayın. Pipetin ucunu tüpün duvarına ve tüpü eğimli bir açıyla tutun.
- Tüpleri dikkatlice sallanan kovalı bir santrifüje aktarın. İki aşamayı rahatsız etmekten kaçının. Tüpleri oda sıcaklığında (RT) 400 x g'da 25 dakika boyunca santrifüj edin ve hızlanma ve yavaşlama minimum değere ayarlayın.
- Üst (şeffaf) plazma tabakasını 10 mL'lik bir pipet kullanarak dikkatlice çıkarın ve ağartıcı (% 10) içeren bir kaba atın.
- Periferik kan mononükleer hücrelerinin (PBMC'ler, Şekil 2) interfaz (beyaz) tabakasını 10 mL'lik bir pipet ile toplayın ve taze bir 50 mL tüpe aktarın. Aynı donörün farklı tüplerinden beyaz tabakayı 30 mL'ye kadar 50 mL'lik bir tüpte birleştirin.
- Adım 1.1.1'den itibaren seyreltme tamponu ile her tüpü toplam 50 mL hacme getirin ve 10 dakika boyunca 300 x g ve 4 °C'de santrifüj yapın. Süpernatantı 10 mL'lik bir pipet ile çıkarın ve ağartıcı (% 10) içeren bir kaba atın.
- Her hücre peletini bir p1000 mikropipet kullanarak adım 1.1.3'ten itibaren önceden soğutulmuş çalışma tamponunun 1 mL'sinde yeniden askıya alın. Aynı donörden gelen hücre süspansiyonlarını yeni bir 15 mL tüpte birleştirin. Önceden soğutulmuş çalışma tamponu ile her borunun hacmini 15 mL'ye getirin ve ters çevirerek iyice karıştırın.
- Adım 1.1.11'den itibaren hücre süspansiyonunun 20 μL aliquot'unu alın ve 1x steril PBS kullanarak 1:100 seyreltme hazırlayın. Bir hemositometre kullanarak hücre sayısını belirleyin.
- Hücre süspansiyonunu 1.1.11 adımından 300 x g ve 4 °C'de 10 dakika boyunca santrifüj edin ve süpernatantı 10 mL'lik bir pipetle çıkarın. Gerekirse, süpernatantı tamamen çıkarmak için bir p200 mikropipet kullanın.
- İzole edilmiş PBMC'leri, her 1 x 107 hücre için 80 μL önceden soğutulmuş MACS çalışan arabellekte yeniden askıya alın ve arabelleğin maksimum 800 μL'sine kadar ekleyin.
- Her 1 x 107 hücre başına 20 μL anti-insan CD14 Mikro Boncuk veya kan örneği başına 100 μL'ye kadar (~ 100 mL seyreltilmemiş kan) ekleyin. Ters çevirerek iyice karıştırın ve 4 ° C'de sürekli karıştırma ile 20 dakika boyunca bir tüp rotatöre yerleştirin.
- Numuneleri tüp döndürücüsünden çıkarın, her boruya 10 mL önceden soğutulmuş çalışma tamponu ekleyin ve 10 dakika boyunca 300 x g (hızlanma = 5, yavaşlama = 5) ve 4 ° C'de santrifüj yapın.
- Süpernatantı 10 mL'lik bir pipetle çıkarın ve 500 μL önceden soğutulmuş çalışma tamponunda (2 x 10 8/mL) 1 x 108 hücreye kadar yeniden askıya alın.
- CD14-pozitif hücrelerin izolasyonunu, üreticinin talimatlarına göre manuel veya otomatik bir sistem (Malzeme Tablosu) kullanarak manyetik hücre sıralama ile gerçekleştirin.
- CD14 pozitif seçilimden sonra 1.1.18 adımından itibaren hücre süspansiyonunun 20 μL alikotunu alın ve 1x steril PBS kullanarak 1:100 seyreltme hazırlayın. Bir hemositometredeki hücreleri sayarak hücre sayısını belirleyin.
- CD14 pozitif hücreleri 300 x g ve RT'de 10 dakika boyunca santrifüj yapın. 10 mL'lik bir pipet veya vakum sistemi kullanarak süpernatantı çıkarın.
- Hücre peletini önceden ısıtılmış kültür ortamında adım 1.1.20'den adım 1.1.2'den 1 x 107 hücre / mL'lik son hücre yoğunluğuna kadar yeniden askıya alın.
- İzole CD14-pozitif monositleri 5 x 106 hücrelik bir hücre yoğunluğunda tohumlayın.
- 10 cm'lik bir doku kültürü kabı üzerine, 50 ng / mL granülosit-makrofaj koloni uyarıcı faktör (GM-CSF) ile desteklenmiş 1.1.2 adımından 10 mL kültür ortamı ekleyin.
- 1.1.21 adımından itibaren 0,5 mL hücre süspansiyonunu kültür ortamına damla damla ekleyin ve plakayı yavaşça döndürün. Nemlendirilmiş bir doku kültürü inkübatöründe (37 °C,% 5 CO2) hücreleri gece boyunca inkübe edin.
- Ertesi gün, gece boyunca yapışmayan hücreleri çıkarmak için bir vakum sistemi kullanarak ortamı aspire edin. Tam farklılaşmaya izin vermek için 10 mL taze kültür ortamı takviyeli GM-CSF (50 ng / mL) ekleyin ve nemlendirilmiş bir doku kültürü inkübatöründe (37 ° C, % 5 CO2) hücreleri 7 gün boyunca inkübe edin (GM-CSF'de farklılaşmanın çeşitli aşamalarında CD14 + monositlerin ortaya çıkması için Şekil 3A'ya bakınız). Kültür ortamını her 2-3 günde bir değiştirin ve her seferinde taze GM-CSF (50 ng / mL) ile destekleyin.
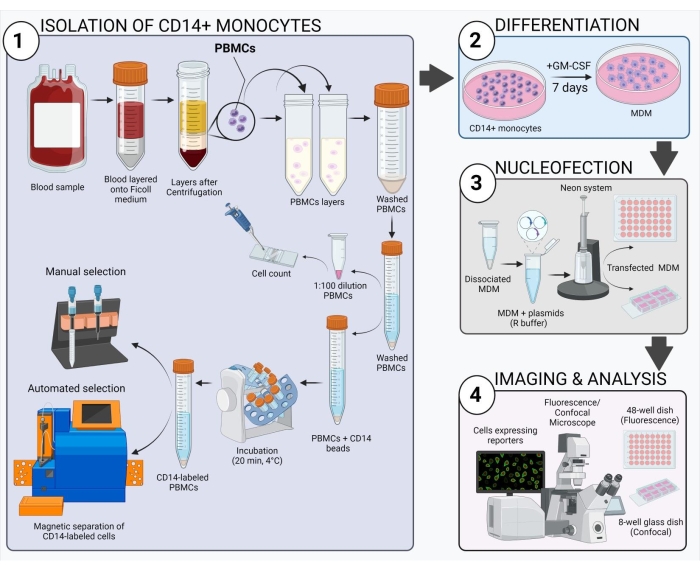
Şekil 2: Deneysel iş akışına şematik genel bakış. Bu şeklin daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Elektroporasyon bileşenlerinin hazırlanması
NOT: Bu protokol 10 μL-Neon uç (Malzeme Tablosu) için tasarlanmıştır. Her transfeksiyon için 1-2 x 105 hücre kullanın. Transfekte hücrelerin 48 delikli bir tabakta veya 8 kuyucuklu bir tabakta (kuyu başına 10 μL-transfekte edilmiş hücreler) tohumlanması önerilir. PBS yerine 1x steril DPBS (Ca2 + ve Mg2+ olmadan) kullanılabilir.
- 7. günde, RPMI-1640 ortamını FBS (% 10 (v / v)) ve glutamax (2 mM) ile destekleyerek antibiyotik içermeyen bir ortam hazırlayın.
- Serumsuz RPMI-1640 ortam, tripsin-EDTA (% 0.25) çözeltisi, 1x steril PBS (Ca 2+ ve Mg2+ olmadan) ve adım 1.1.2'den itibaren tam kültür ortamını 37 ° C'lik bir su banyosuna yerleştirin.
- Cam tabanlı tabaklar kullanılıyorsa (konfokal mikroskopi için) bulaşıkları poli-D-lizin hidrobromür ile kaplayın.
- 8 iyi odacıklı bir kabı 200 μL poli-D-lizin hidrobromür (1x steril PBS'de 0.1 mg / mL) ile kaplayın ve RT'de 5 dakika boyunca inkübe edin.
- Poli-D-lizin çözeltisini aspire edin ve camı 1x steril PBS ile bir kez yıkayın. PBS'yi aspire edin ve adım 2.4 ile devam edin.
- 48 kuyucuklu plakanın veya 8 iyi odacıklı kabın kuyucuğu başına 200 μL antibiyotiksiz ortam ekleyin ve transfekte edilmiş hücreleri plakalamaya hazır olana kadar nemlendirilmiş bir doku kültürü inkübatöründe (37 ° C,% 5 CO2) ön inkübe edin.
3. Elektroporasyon için hücrelerin hazırlanması
NOT: 7 günlük farklılaşma periyodunun sonunda 10 cm'lik bir çanaktan MDM verimi yaklaşık 1,5 x 106 hücredir. PBS yerine 1x steril DPBS (Ca2 + ve Mg2+ olmadan) kullanılabilir. Bu protokol, çoğu makrofajın hücre canlılığı ve bütünlüğünün korunmasıyla plakadan ayrılması için optimize edilmiştir. MDM'nin hücre kültürü plakalarından ayrılması zordur. Bu nedenle, hücreleri ayırmak için 3.2 ve 3.3 adımlarını iki kez gerçekleştirmek gerekebilir. Tripsin-EDTA (% 0.25) ile her kuluçka süresinin 5 dakikayı geçmediğinden emin olun.
- Ortamı 10 cm'lik tabaklarda tamamen farklılaşmış makrofajlardan aspire edin ve hücre tek katmanını ılık serum içermeyen RPMI-1640 ortamı ile yıkayın. Ortamı tamamen çıkardığınızdan emin olun.
- 10 cm'lik bir tabak başına 2 mL sıcak tripsin-EDTA (% 0.25) çözeltisi ekleyerek hücreleri toplayın ve nemlendirilmiş bir doku kültürü inkübatöründe (37 ° C,% 5 CO2) 5 dakika boyunca inkübe edin.
- Bir p1000 mikropipet kullanarak tripsin-EDTA (%0,25) çözeltisini tüm çanak alanı boyunca yukarı ve aşağı doğru nazikçe pipetleyerek hücre ayrılmasını tamamlayın. Hücre süspansiyonunu, adım 1.1.2'den itibaren 5 mL sıcak tam kültür ortamı içeren 15 mL'lik bir konik tüpe aktarın.
- Çanağı parlak bir alan mikroskobuna götürün ve çeşitli görüş alanlarında hücre ayrılmasını kontrol edin. Hala bağlı önemli miktarda hücre varsa, 3.2-3.3 arasındaki adımları tekrarlayın.
- RT'de 5 dakika boyunca hücre süspansiyonunu 250 x g'de santrifüj yapın.
- Ortamı aspire edin ve hücreleri 37 ° C'ye kadar önceden ısıtılmış 10 mL 1x steril PBS'de yeniden askıya alın. Bir hemositometre kullanarak hücre sayısını belirlemek için 20 μL'lik bir aliquot alın.
- Amaçlanan transfeksiyon başına 1-2 x 105 hücre alın ve 15 mL'lik bir tüpe yerleştirin. Önceden ısıtılmış 1x steril PBS ile 15 mL'lik son hacme getirin. RT'de 5 dakika boyunca 250 x g'de santrifüj.
- PBS'yi aspire edin ve 250 x g'de 1 dakika boyunca bir kez daha santrifüj yapın. P200 mikropipet kullanarak hücre peletinden kalan PBS'yi çıkarın.
4. Kaspaz BiFC bileşenlerinin insan monosit türevi makrofajlara nükleofeksiyonu
NOT: Protokolün bu bölümü Neon Transfeksiyon Sistemi (Malzeme Tablosu) kullanılarak gerçekleştirilir. Bu protokol, 10 μL Neon uç (Malzeme Tablosu) kullanarak 1-2 x 105 hücreyi transfekte etme adımlarını özetlemektedir. 100 μL Neon uç kullanıyorsanız, ölçeği buna göre artırın. Hücreleri 15 dakikadan fazla bir süre boyunca resüspansiyon tamponu R'ye maruz bırakmaktan kaçının, çünkü bu hücre canlılığını ve transfeksiyon verimliliğini azaltabilir.
- Transfekte hücreleri görselleştirmek için muhabir plazmidini (yani, 100 ng / μL'de mCherry veya dsRedmito) nükleaz içermeyen suda veya 0.5x TE tamponunda seyreltin.
- Kapaz BiFC plazmidlerini nükleaz içermeyen suda veya 0.5x TE tamponunda uygun bir konsantrasyona kadar seyreltin, böylece toplam plazmid hacmi 10 μL'lik toplam transfeksiyon hacminin% 30'unu geçmez (yani, 300 ng / μL C1 Pro-VC ve 300 ng / μL C1 Pro-VN).
- Amaçlanan transfeksiyon başına 1,5 mL'lik steril bir mikrotüp hazırlayın ve uygun miktarda muhabir plazmidi (yani, 50 ng veya 0,5 μL) ve kaspaz BiFC plazmidleri (yani, 300 ng veya 1 μL C1 Pro-VC ve 300 ng veya 1 μL C1 Pro-VN parçası) ekleyin. Mikrotüpleri her zaman davlumbazda tutun.
- Pipet istasyonunu, cihazı, uçları, elektroporasyon tüplerini ve pipeti steril laminer akış başlığına yerleştirin.
NOT: Pipet istasyonu, cihaz, uçlar, elektroporasyon tüpleri ve pipet Neon Transfeksiyon Sistemine dahil edilmiştir. - Pipet istasyonundaki yüksek voltaj ve sensör konektörünü, üreticinin talimatlarına göre cihazdaki arka bağlantı noktalarına bağlayın. Pipet istasyonunu cihaza yakın tutun.
- Güç kablosunu arka AC girişine bağlayın ve cihazı elektrik prizine bağlamaya devam edin. Cihazı açmak için güç düğmesine basın.
- Aygıt açıldığında ve uygun şekilde bağlandığında görüntülenen başlangıç ekranına aktarma parametrelerini girin. Voltajı 1000 V olarak ayarlamak için Voltaj üzerine basın, 1000 girin ve Bitti düğmesine basın. Son olarak, # Darbeler üzerine basın, 2 girin ve elektrik darbelerinin sayısını 2 olarak ayarlamak için Bitti düğmesine basın.
- RT'de elektroporasyon tüplerinden birini (kit içinde verilir) alın ve 3 mL elektrolitik tampon E (10 μL uçlar için ve kit içinde verilir) ile doldurun. Tüpün yan tarafındaki elektrotun içe dönük olduğundan ve tüp yerleştirildiğinde bir tıklama sesi duyulduğundan emin olun.
- Hücre peletini adım 3.8'den alın ve her 1-2 x 105 hücre için 10 μL önceden ısıtılmış resüsitasyon R tamponu (kit içinde verilir) ekleyin. Bir p20 mikropipet ile nazikçe karıştırın. Adım 4.3'te ayarlanan her tüpe 10 μL hücre süspansiyonu ekleyin ve bir p20 mikropipet ile hafifçe karıştırın.
- Pipetten alın ve Basmalı düğmeye basarak ikinci durağa kadar bir uç takın. Kelepçenin uçtaki pistonun montaj sapını tamamen tuttuğundan ve pipetin üst kafasında boşluk olmadığından emin olun.
- Numuneyi aspire etmek için, pipet üzerindeki Bas düğmesine ilk durağa kadar basın ve hücre/plazmid DNA karışımını içeren ilk tüpe daldırın. Karışımı yavaşça pipet ucuna aspire edin.
NOT: Hava kabarcıklarından kaçının, çünkü elektroporasyon sırasında arklanmaya neden olabilirler ve cihaz tarafından tespit edilirse, elektrik darbesinin iletilmesini önleyebilirler. Hava kabarcıkları gözlenirse, içeriği tüpe bırakın ve tekrar aspirasyon yapmayı deneyin. - Pipet, numuneyle birlikte pipet tutucuya çok dikkatli bir şekilde yerleştirin. Pipetin tıklandığından ve doğru yerleştirildiğinden emin olun.
- Dokunmatik ekranda Başlat'a basın ve elektrik darbeleri teslim edilene kadar bekleyin. Ekrandaki bir mesaj tamamlandığını gösterecektir.
- Pipetleri istasyondan yavaşça çıkarın ve hemen ilk durağa kadar basmalı düğmeye basarak 2.4. adımdan itibaren önceden ısıtılmış antibiyotik içermeyen ortamla transfekte hücre süspansiyonunu ilgili kuyuya ekleyin.
NOT: Bu uç, aynı plazmid için en fazla üç kez yeniden kullanılabilir; aksi takdirde, ikinci durağa Push düğmesine basarak biyolojik tehlike arz eden bir atık kabına atın. - Bir hücre/plazmid DNA karışımı içeren her tüp için 4.10-4.14 arasındaki adımları tekrarlayın.
- Plakayı transfekte hücrelerle nazikçe sallayın ve nemlendirilmiş bir doku kültürü inkübatöründe (37 ° C,% 5 CO2) 1-3 saat boyunca inkübe edin.
- Her bir kuyucuğa, 1.1.2 adımından itibaren 200 μL önceden ısıtılmış kültür ortamı (tam ortam) ekleyin. Kabı nemlendirilmiş doku kültürü inkübatörüne (37 °C, % 5 CO2) tekrar yerleştirin. Gen ekspresyonu için en az 24 saat bekleyin.
- Ertesi gün, bir epifloresan mikroskobu kullanarak hücre canlılığını ve transfeksiyon verimliliğini inceleyin.
- Epifloresan mikroskobu ve floresan ışık kaynağı kutusunu üreticinin talimatlarına göre açın ve kültür kabını mikroskop aşamasına yerleştirin.
- 10x veya 20x hedefini ve 568 nm (RFP) filtresini seçin.
- Hücre canlılığını tahmin etmek için, seçilen alandaki tüm hücreleri görselleştirmek üzere İletilen Işık LED'i (TL) düğmesine basın. Mikroskop göz merceğine bakarken, hücreler gözlemlenene kadar odak düğmesini çevirin ve seçilen alanda hücre bağlantısı olup olmadığını kontrol edin.
NOT: Tamamen bağlı hücreler canlı hücreleri temsil ederken, yüzen hücreler canlı olmayan hücreleri temsil eder. Kuyunun akıcılığı yüksekse, bağlanmamış hücrelerin varlığı, düşük canlılığın sonucu değil, hücre sayısının abartılmasının bir sonucu olabilir. Bununla birlikte, yüksek yüzen hücre içeriğinin eşlik ettiği düşük akıcılık, elektroporasyon sırasında arklanma, plazmid toksisitesi veya resüspansiyon R tamponuna aşırı maruz kalmaktan kaynaklanabilecek düşük canlılığı ifade eder. İkinci davranışı gösteren kuyucuklar kullanmayın. - Transfeksiyon verimliliğini tahmin etmek için, yukarıda açıklandığı gibi iletilen ışık altında seçilen alandaki hücrelere odaklanın. Seçili alandaki toplam hücre sayısını sayın. İletilen Işık LED'i (TL ) kapalıyken, açmak için Yansıyan Işık LED'i düğmesine (RL) basın.
- Muhabir gen floresansına (kırmızı hücreler) odaklanın ve kırmızı floresan hücrelerin toplam sayısını sayın. Kuyu başına en az iki alan daha açmak için bu adımları (4.18.4-4.18.5) yineleyin.
5. Transfekte MDM ve kaspaz BiFC veri toplama tedavisi
NOT: Bir epifloresan veya konfokal mikroskop kullanarak hücreleri görüntülemeyi planlıyorsanız, kaspaza bağımlı hücre ölümünü (ağırlıklı olarak apoptoz) önlemek için seçilen uyaranla 1 saat önceden tedavi için qVD-OPh (20 μM) ile tedavi önerilir. Bu, hücrelerin apoptoz nedeniyle kalkmasını önlemek için görüntülemede kullanılır ve odak düzleminden çıktıklarında görüntülenmesini çok zorlaştırır. Aktivasyon platformuna ve ilişkili kaspaz BiFC'ye kaspaz alımının kaspazın kaspazın katalitik aktivitesine bağlı olmadığını ve sonuç olarak kaspaz inhibisyonunun bu adımı etkilemeyeceğini unutmayın.
- Transfeksiyondan yaklaşık 24 saat sonra seçilen uyaranla tedavi edin ve her ilaç için gerekli olduğu sürece inkübe edin.
- Adım 1.1.2'den itibaren kültür ortamını Hepes (20 mM, pH 7.2-7.5) ve 2-merkaptoetanol (55 μM) ile destekleyerek görüntüleme ortamı hazırlayın.
- Önceden ısıtılmış görüntüleme ortamına istenen konsantrasyonda uyaran ekleyin ve yavaşça karıştırın.
- Ortamı hücrelerden bir p1000 mikropipet ile dikkatlice çıkarın ve kuyucuğun kenarındaki 5.1.2 adımından 500 μL uyaran çözeltisi ekleyin.
- Tedavi edilmemiş kontrol kuyularını çalıştırmak için, uyaran olmadan görüntüleme ortamı ekleyin.
- Hücreleri nemlendirilmiş bir doku kültürü inkübatöründe (37 ° C, % 5 CO2) her tedavi için belirtildiği sürece inkübe edin.
- Bir epifloresan veya konfokal mikroskop kullanarak hücreleri görselleştirin.
- Üreticinin talimatlarını izleyerek mikroskopu ve floresan ışık kaynağını açın.
- 10x veya 20x hedefini seçin ve kültür kabını mikroskop aşamasına yerleştirin.
- Mikroskop göz merceğini kullanarak, 568 nm filtrenin altındaki hücreleri bulun ve dsRedmito / mCherry reporter'ı (kırmızı hücreler) ifade eden hücrelere odaklanın.
- Görme alanındaki tüm kırmızı hücreleri sayın ve sayıyı kaydedin.
- Aynı görme alanındayken, 488 veya 512 filtresine (GFP veya YFP) geçin, aynı zamanda yeşil olan kırmızı hücrelerin sayısını (Venüs pozitif veya BiFC-pozitif) saymaya devam edin ve sayıyı kaydedin.
- En az üç ayrı görsel alandan en az 100 dsRedmito/mCherry pozitif hücre sayın.
- Venüs pozitif transfekte hücrelerin görme alanı başına yüzdesini hesaplayın ve standart sapmayı elde etmek için her tedavi için (iyi) ortaya çıkan yüzdelerin ortalamasını alın.
- Epifloresan veya konfokal mikroskop kullanarak hücreleri görüntüleyin
NOT: 20x hedefi veya daha büyük bir büyütme kullanarak konfokal görüntüler elde etmek için, mikroskop uzun geçiş hedefi ile donatılmadıkça, hücreler cam tabaklar üzerine kaplanmalıdır.- 5.2.1-5.2.3 arasındaki adımları izleyin. 40x, 60x veya 63x yağ hedefi ile konfokal bir mikroskop kullanıyorsanız, hedefe bir damla yağ koyun.
- Bilgisayar ekranındaki hücrelerin canlı görüntüsünü, kamera tarafından elde edildiği şekilde görselleştirin. Floresan görüntüler için epifloresan ışık kaynağını kullanın veya konfokal görüntüler için ışık kaynağını lazerlere geçirin.
- Joystick kontrolünü ve odak tekerleğini kullanarak hücrelerin odağına ve konumuna ince ayar yapın.
- 512 nm veya 488 nm (YFP veya GFP) ve 568 nm (RFP) lazerler için yüzde lazer gücünü ve pozlama süresini, görüntüdeki sinyalin iyi görünmesi ve doygunluğa ulaşmaması için ayarlayın.
- Canlı çekimi açın ve elde edilen görüntüyü inceleyin. Her iki kanal için ekran histogramlarında her flor için ayrı bir tepe noktası görüldüğünden emin olun.
- Lazer gücünü ve pozlama süresini gerektiği gibi ayarlayın. Her iki floresan sinyali de (RFP ve GFP / YFP) algılayabilmekle birlikte bu değerleri mümkün olduğunca düşük tutun.
- Hücrelerin canlı görüntüsünü görselleştirirken, plakanın her bir kuyucuğu için mCherry / dsRedmito muhabirini ifade eden bir veya daha fazla hücre içeren bir alanın birden fazla temsili görüntüsünü alın ve verileri kaydedin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Şekil 2'de gösterilen şema, insan MDM'sinin nasıl elde edileceğine, transfekte edileceğine ve görüntüleneceğine dair genel bir bakış sunmaktadır. seçilen CD14 + monositlerinin GM-CSF ile 7 gün boyunca inkübasyonundan sonra, hücre morfolojisi farklılaşma periyodu boyunca değişir (Şekil 3A), küresel süspansiyon hücrelerinden ve tamamen bağlı (gün 3 ve 4), ve son olarak, tamamen farklılaştığında daha fazla yayılmış hücrelere (7...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu protokol, insan kan örneklerinden izole edilen monositlerden makrofajlar elde etmek için iş akışını ve enflamatuar kaspaz BiFC muhabirlerini hücre canlılığından ve davranışından ödün vermeden insan MDM'sine verimli bir şekilde tanıtmak için bir yöntemi açıklar.
Bu protokol, bölünmüş floresan protein Venüs'ün floresan olmayan fragmanları ile kaspaz işe alım alanındaki (CARD) inflamatuar kaspazları etiketlemek için BiFC tekniği35'ten...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar, rekabet eden finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Bu tekniğin geliştirilmesine katkıda bulunan LBH'nin geçmiş ve şimdiki laboratuvar üyelerine teşekkür ederiz. Bu laboratuvar NIH/NIDDK T32DK060445 (BEB), NIH/NIDDK F32DK121479 (BEB), NIH/NIGMS R01GM121389 (LBH) tarafından desteklenmektedir. Şekil 2, Biorender yazılımı kullanılarak çizilmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 48 well tissue culture2:34 plates | Genesee Scientific | 25-108 | |
| 10 cm Tissue Culture Dishes | VWR | 25382-166 | |
| 2 Mercaptoethanol 1000x | Thermo Fisher Scientific | 21985023 | |
| 8 well chambered coverglass with 1.5 HP coverglass | Cellvis | c8-1.5H-N | |
| AutoMACS columns | Miltenyi (Biotec) | 130-021-101 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Separator | Miltenyi (Biotec) | 130-092-545 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Washing Solution | Miltenyi (Biotec) | 130-092-987 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Rinsing Solution | Miltenyi (Biotec) | 130-091-222 | For automated separation using AutoMACS Pro Separator only |
| AutoMacs running buffer | Miltenyi (Biotec) | 130-091-221 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| Axio Observer Z1 motorized inverted microscope equipped with a CSU-X1A 5000 spinning disk unit | Zeiss | Any confocal microscope equipped with a laser module fitted with laser lines of 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| AxioObserver A1, Research Grade Inverted Microscope | Zeiss | Any epifluorescence microscope with fluorescence filters capable of exciting 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| CD14+ MICROBEADS | Miltenyi (Biotec) | 130-050-201 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| DPBS without calcium chloride and magnesium chloride | Sigma | D8537-6x500ML | |
| DsRed mito plasmid | Clontech | 632421 | Similar plasmids that can be used as fluorescent reporters can be found on Addgene |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437028 | |
| Ficoll-Paque PLUS 6 x 100 mL | Sigma | GE17-1440-02 | |
| GlutaMAX Supplement (100x) | Thermo Fisher Scientific | 35050079 | |
| GM-CSF | Thermo Fisher Scientific | PHC2011 | |
| Hemin BioXtra, from Porcine, ≥96.0% (HPLC) | Sigma | 51280-1G | |
| HEPES | Thermo Fisher Scientific | 15630106 | |
| Inflammatory caspase BiFC plasmids | Available by request from LBH lab | ||
| LPS-EB Ultrapure | Invivogen | TLRL-3PELPS | |
| LS Columns | Miltenyi (Biotec) | 130-042-401 | For manual separation using QuadroMACS Separator only |
| MACS 15 mL Tube Rack | Miltenyi (Biotec) | 130-091-052 | For manual separation using QuadroMACS Separator only |
| MACS MultiStand | Miltenyi (Biotec) | 130-042-303 | For manual separation using QuadroMACS Separator only |
| mCherry plasmid | Yungpeng Wang Lab | Similar plasmids that can be used as fluorescent reporters can be found on Addgene | |
| Neon Transfection System | Thermo Fisher Scientific | MPK5000 | Includes Neon electroporation device, pipette and pipette station |
| Neon Transfection System 10 µL Kit | Thermo Fisher Scientific | MPK1096 | Includes resuspension buffer R, resuspension buffer T, electrolytic buffer E, 96 x 10 µL Neon tips and Neon electroporation tubes |
| Nigericin sodium salt, ready made solution | Sigma | SML1779-1ML | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-D-Lysine Hydrobromide | Sigma | P7280-5mg | |
| QuadroMACS Separator | Miltenyi (Biotec) | 130-090-976 | For manual separation using QuadroMACS Separator only |
| qVD-OPh | Fisher (ApexBio) | 50-101-3172 | |
| RPMI 1640 Medium | Thermo Fisher Scientific | 11875119 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200072 | |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | 15575020 | |
| Zeiss Zen 2.6 (blue edition) software | Zeiss | Any software used to operate the confocal microscope of choice |
Referanslar
- Boatright, K. M., et al. A unified model for apical caspase activation. Molecular Cell. 11 (2), 529-541 (2003).
- Pop, C., Salvesen, G. S. Human caspases: activation, specificity, and regulation. Journal of Biological Chemistry. 284 (33), 21777-21781 (2009).
- Boice, A., Bouchier-Hayes, L. Targeting apoptotic caspases in cancer. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1867 (6), 118688(2020).
- Bolívar, B. E., Vogel, T. P., Bouchier-Hayes, L. Inflammatory caspase regulation: maintaining balance between inflammation and cell death in health and disease. The FEBS Journal. 286 (14), 2628-2644 (2019).
- Martinon, F., Tschopp, J. Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory diseases. Cell. 117 (5), 561-574 (2004).
- Lamkanfi, M., Vishva, M. D. Mechanisms and functions of inflammasomes. Cell. 157 (5), 1013-1022 (2014).
- Viganò, E., et al. Human caspase-4 and caspase-5 regulate the one-step noncanonical inflammasome activation in monocytes. Nature Communications. 6, 8761(2015).
- Cerretti, D. P., et al. Molecular cloning of the interleukin-1 beta converting enzyme. Science. 256 (5053), 97(1992).
- van de Veerdonk, F. L., Netea, M. G., Dinarello, C. A., Joosten, L. A. Inflammasome activation and IL-1β and IL-18 processing during infection. Trends in Immunology. 32 (3), 110-116 (2011).
- Martinon, F., Burns, K., Tschopp, J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Molecular Cell. 10 (2), 417-426 (2002).
- Kayagaki, N., et al. Noncanonical inflammasome activation targets caspase-11. Nature. 479 (7371), 117-121 (2011).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Masumoto, J., et al. ASC, a novel 22-kDa protein, aggregates during apoptosis of human promyelocytic leukemia HL-60 cells. The Journal of Biological Chemistry. 274 (48), 33835-33838 (1999).
- Bertin, J., DiStefano, P. S. The PYRIN domain: a novel motif found in apoptosis and inflammation proteins. Cell Death and Differentiation. 7 (12), 1273-1274 (2000).
- Agostini, L., et al. NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 20 (3), 319-325 (2004).
- Bürckstümmer, T., et al. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nature Immunology. 10 (3), 266-272 (2009).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nature Reviews Immunology. 13 (6), 397-411 (2013).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for noncanonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Bolívar, B. E., et al. Noncanonical Roles of Caspase-4 and Caspase-5 in Heme-Driven IL-1β Release and Cell Death. The Journal of Immunology. 206 (8), 1878-1889 (2021).
- Schmid-Burgk, J. L., et al. Caspase-4 mediates noncanonical activation of the NLRP3 inflammasome in human myeloid cells. European Journal of Immunology. 45 (10), 2911-2917 (2015).
- Baker, P. J., et al. NLRP3 inflammasome activation downstream of cytoplasmic LPS recognition by both caspase-4 and caspase-5. European Journal of Immunology. 45 (10), 2918-2926 (2015).
- Cullen, S. P., Kearney, C. J., Clancy, D. M., Martin, S. J. Diverse activators of the NLRP3 inflammasome promote IL-1β secretion by triggering necrosis. Cell Reports. 11 (10), 1535-1548 (2015).
- Sanders, M. G., et al. Single-cell imaging of inflammatory caspase dimerization reveals differential recruitment to inflammasomes. Cell Death & Disease. 6, 1813(2015).
- Charendoff, C. I., Bouchier-Hayes, L. Lighting up the pathways to caspase activation using bimolecular fluorescence complementation. Journal of Visualized Experiments: JoVE. (133), e57316(2018).
- Bouchier-Hayes, L., et al. Characterization of cytoplasmic caspase-2 activation by induced proximity. Molecular Cell. 35 (6), 830-840 (2009).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral blood mononuclear cells: Isolation, Freezing, thawing, and culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Current Pathobiology Reports. 7 (2), 17-27 (2019).
- Perregaux, D., et al. IL-1 beta maturation: evidence that mature cytokine formation can be induced specifically by nigericin. The Journal of Immunology. 149 (4), 1294-1303 (1992).
- Cheneval, D., et al. Increased mature interleukin-1β (IL-1β) secretion from THP-1 cells induced by nigericin is a result of activation of p45 IL-1β-converting enzyme processing. Journal of Biological Chemistry. 273 (28), 17846-17851 (1998).
- Fernandes-Alnemri, T., et al. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death and Differentiation. 14 (9), 1590-1604 (2007).
- Lu, A., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Muller-Eberhard, U., Javid, J., Liem, H. H., Hanstein, A., Hanna, M. Brief report: Plasma concentrations of hemopexin, haptoglobin and heme in patients with various hemolytic diseases. Blood. 32 (5), 811-815 (1968).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40 (1), 61-66 (2006).
- Thornberry, N. A., et al. A novel heterodimeric cysteine protease is required for interleukin-1βprocessing in monocytes. Nature. 356 (6372), 768-774 (1992).
- Jensen, K., Anderson, J. A., Glass, E. J. Comparison of small interfering RNA (siRNA) delivery into bovine monocyte-derived macrophages by transfection and electroporation. Veterinary Immunology and Immunopathology. 158 (3-4), 224-232 (2014).
- Tada, Y., Sakamoto, M., Fujimura, T. Efficient gene introduction into rice by electroporation and analysis of transgenic plants: use of electroporation buffer lacking chloride ions. Theoretical and Applied Genetics. 80 (4), 475-480 (1990).
- Bhowmik, P., et al. Targeted mutagenesis in wheat microspores using CRISPR/Cas9. Scientific Reports. 8 (1), 6502(2018).
- Sansom, D. M., Manzotti, C. N., Zheng, Y. What's the difference between CD80 and CD86. Trends in Immunology. 24 (6), 314-319 (2003).
- Kurokawa, M., Kornbluth, S. Caspases and kinases in a death grip. Cell. 138 (5), 838-854 (2009).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır