A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיה של קספאזות דלקתיות המושרות קרבה במקרופאגים שמקורם במונוציטים אנושיים
In This Article
Summary
פרוטוקול זה מתאר את זרימת העבודה להשגת מקרופאגים שמקורם במונוציטים (MDM) מדגימות דם אנושיות, שיטה פשוטה להחדרה יעילה של כתבי השלמה פלואורסצנטית דו-עינית (BiFC) של קספאזה דלקתית ל-MDM אנושי מבלי להתפשר על הכדאיות וההתנהגות של התאים, וגישה מבוססת הדמיה למדידת הפעלת קספאזה דלקתית בתאים חיים.
Abstract
קספאזות דלקתיות כוללות קספאזה-1, -4, -5, -11 ו -12 ושייכות לתת-קבוצה של קספאזות יוזמות. Caspase-1 נדרש להבטיח ויסות נכון של איתות דלקתי ומופעל על ידי דימריזציה הנגרמת על ידי קרבה לאחר גיוס לדלקת. קספאז-1 מצוי בשפע בשושלת התאים המונוציטית וגורם להבשלה של הציטוקינים הפרו-דלקתיים אינטרלוקין (IL)-1β ו-IL-18 למולקולות מופרשות פעילות. הקספאזות הדלקתיות האחרות, קספאזה-4 ו--5 -(וההומלוגיה שלהן מורין קספאזה-11) מקדמות את שחרור IL-1β על ידי גרימת פירופטוזיס. השלמה פלואורסצנטית דו-מולקולרית של קספאזה (BiFC) היא כלי המשמש למדידת קרבה הנגרמת על ידי קספאזה דלקתית כקריאה של הפעלת קספאזה. הקספאזה-1, -4 או -5 פרודומיין, המכילה את האזור הנקשר לדלקת, מתמזגת עם שברים לא פלואורסצנטיים של החלבון הפלואורסצנטי הצהוב נוגה (Venus-N [VN] או Venus-C [VC]) הקשורים לרפורמה בקומפלקס נוגה הפלואורסצנטי כאשר הקספאזות עוברות קרבה מושרית. פרוטוקול זה מתאר כיצד להכניס את הכתבים האלה למקרופאגים ראשוניים שמקורם במונוציטים אנושיים (MDM) באמצעות נוקליאופקציה, לטפל בתאים כדי לגרום להפעלת קספאזה דלקתית ולמדוד את הפעלת הקספאזה באמצעות פלואורסצנציה ומיקרוסקופיה קונפוקלית. היתרון של גישה זו הוא שניתן להשתמש בה כדי לזהות את המרכיבים, הדרישות והלוקליזציה של קומפלקס הפעלת הקספאז הדלקתי בתאים חיים. עם זאת, יש לשקול בקרות זהירות כדי למנוע פגיעה בכדאיות ובהתנהגות של התאים. טכניקה זו היא כלי רב עוצמה לניתוח של אינטראקציות קספאז דינמיות ברמה הדלקתית, כמו גם לחקירת מפלי האיתות הדלקתיים ב- MDM חי ובמונוציטים שמקורם בדגימות דם אנושיות.
Introduction
הקספאזות הן משפחה של פרוטאזות ציסטאין אספרטט שניתן לקבץ לתוך קספאזות יוממות וקספאזות תליין. קספאזות תליין כוללות קספאזה-3, -6 ו -7. הם נמצאים באופן טבעי בתאים כדימרים ונבקעים על ידי הקספאזות היוזמות לביצוע אפופטוזיס1. קספאזות יוזמות כוללות קספאזה אנושית-1, -2, -4, -5, -8, -9, -10 ו -12. הם נמצאים כזימוגנים לא פעילים (פרו-קספאזות) המופעלים על ידי דימריזציה הנגרמת על ידי קרבה ומיוצבים על ידי ביקוע פרוטאוליטי אוטומטי 2,3. הקספאזות הדלקתיות הן תת-קבוצה של הקספאזות היוזם2 וכוללות את קספאזה-1, -4, -5 ו-12- בבני אדם, ואת קספאזה-1, -11 ו--12 בעכבר 4,5. במקום תפקיד אפופטוטי, הם ממלאים תפקיד מרכזי בדלקת. הם מתווכים עיבוד פרוטאוליטי והפרשת פרו-אינטרלוקין (IL)-1β ופרו-IL-18 6,7, שהם הציטוקינים הראשונים ששוחררו בתגובה לפולשים פתוגניים 8,9. Caspase-1 מופעלת עם גיוס לפלטפורמת ההפעלה שלה; קומפלקס חלבונים גדול במשקל מולקולרי המכונה הדלקת (איור 1A)10. דימריזציה של קספאזה-4, -5 ו--11- מתרחשת באופן בלתי תלוי בפלטפורמות אלה באמצעות מסלול דלקתי לא קנוני11,12.
דלקת קנונית היא קומפלקסים של חלבונים רב-מתכתיים ציטוזוליים המורכבים מחלבון חיישן מודלק, חלבון המתאם ASC (חלבון דמוי כתם הקשור לאפופטוזיס המכיל CARD), והחלבון המשפיע קספאזה-110. האינפלמזומים הקאנוניים הנחקרים ביותר הם משפחת הקולטנים דמויי ה-NOD המכילים תחום פירין (NLRP), NLRP1 ו-NLRP3, משפחת ה-NLR המכילה כרטיס (NLRC), NLRC4, וההיעדרות במלנומה 2 (AIM2). כל אחד מהם מכיל תחום פירין, כרטיס או שני התחומים. תחום ה-CARD מתווך את האינטראקציה בין קספאזות המכילות כרטיס לבין המפעילים שלהן במעלה הזרם. לכן, מולקולת הפיגום ASC, המורכבת מתחום פירין N-terminal (PYD) וממוטיב C-terminal CARD13,14, נדרשת לגיוס של קספאזה-1 לדלקת NLRP110, NLRP315 ו-AIM216.
כל דלקת נקראת על שם חלבון החיישנים הייחודי שלה שמזהה גירויים פרו-דלקתיים מובהקים (איור 1B). מפעילים של מסלול זה נקראים גירויים קנוניים. דלקות משמשות כחיישנים למרכיבים מיקרוביאליים ולמתח ברקמות, ומורכבות כדי לעורר תגובה דלקתית חזקה באמצעות הפעלה של הקספאזות הדלקתיות17. הרכבה דלקתית יוזמת הפעלת caspase-1 כדי לתווך התבגרות והפרשת המצעים העיקריים שלה pro-IL-1β ו- pro-IL-18. תהליך זה מתרחש באמצעות מנגנון דו-שלבי. ראשית, גירוי ראשוני מעלה את הביטוי של חלבונים דלקתיים מסוימים ופרו-IL-1β באמצעות הפעלה של מסלול NF-κB. שנית, גירוי תוך-תאי (קנוני) משרה הרכבה וגיוס של פרוקספאזה-1 6,7.
קספאזה-4 וקספאזה-5 הם האורתולוגים האנושיים של מורין קספאזה-1111 11. הם מופעלים באופן בלתי תלוי בדלקת על ידי ליפופוליסכריד תוך-תאי (LPS), מולקולה שנמצאת בקרום החיצוני של חיידקים גראם שליליים 18,19,20, ועל ידי heme חוץ-תאי, תוצר של המוליזה של תאי דם אדומים21. הוצע כי LPS נקשר ישירות למוטיב CARD של חלבונים אלה ומשרה את האוליגומריזציה שלהם20. הפעלה של קספאזה-4 או קספאזה-5 מקדמת שחרור IL-1β על ידי גרימת צורה דלקתית של מוות תאי הנקראת פירופטוזיס באמצעות מחשוף של החלבון יוצר הנקבוביות gasdermin D (GSDMD)18,19. בנוסף, השטף של יוני אשלגן הנובע ממוות פירופטוטי בתיווך קספאזה-4 ו-GSDMD גורם להפעלה של דלקת NLRP3 והפעלה לאחר מכן של קספאזה-122,23. לכן, caspase-4, -5 ו--11 נחשבים לחיישנים תוך-תאיים עבור LPS המסוגלים לגרום לפירופטוזיס והפעלת קספאזה-1 בתגובה לגירויים ספציפיים11,24.
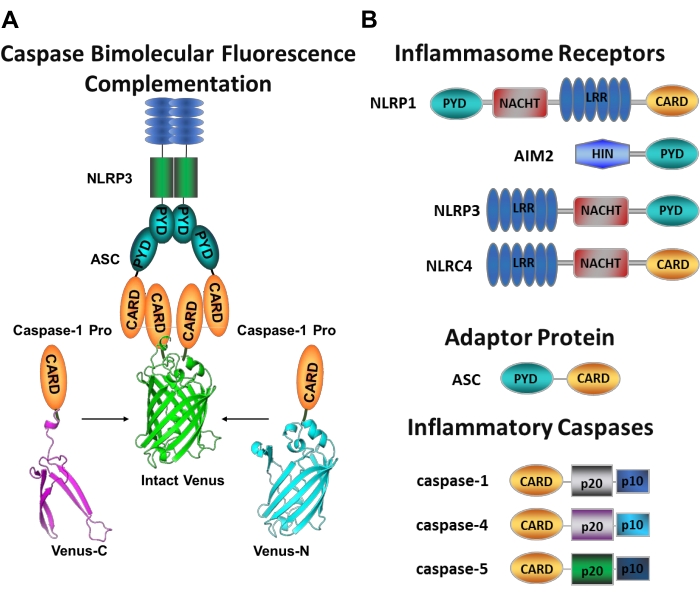
איור 1: קספאזות דלקתיות ובדיקת השלמה פלואורסצנטית של קספאזה-בימולקולרית (BiFC). (A) דיאגרמה המציגה את מערכת הקספאזה-BiFC, שבה שני פרודומיינים של קספאזה-1 (C1-pro) המקושרים לכל מקטע שאינו פלואורסצנטי של נוגה (Venus-C או Venus-N) מגויסים לפלטפורמת ההפעלה NLRP3, מה שמאלץ את נוגה לחזור ולפלואורסצנט. קומפלקס זה מופיע כנקודה ירוקה מתחת למיקרוסקופ ומשמש כקריאה לקרבה דלקתית המושרה על ידי קספאזה, שהיא הצעד הראשון בהפעלת קספאזה יזומה. (B) סכמטי המציג את ארגון התחום של רכיבים דלקתיים וקספאזות דלקתיות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
מדידת הפעלת קספאזות יוזמות ספציפיות היא קשה, ואין הרבה שיטות זמינות לעשות זאת על ידי גישות הדמיה. ניתן להשתמש בהשלמת פלואורסצנציה דו-מולקולרית של קספאזה (BiFC) כדי לדמיין הפעלת קספאזה דלקתית ישירות בתאים חיים (איור 1A)25. טכניקה זו הותאמה לאחרונה לשימוש במקרופאג'ים שמקורם במונוציטים אנושיים (MDM)21. Caspase BiFC מודד את הצעד הראשון בהפעלת קספאזה דלקתית, קרבה מושרית כדי להקל על דימריזציה. נעשה שימוש בביטוי של פלסמידים המקודדים את ה-caspase prodomain המכיל CARD, שהתמזגו עם שברים שאינם פלואורסצנטיים של החלבון הפלואורסצנטי הצהוב הניתן לצילום נוגה (Venus-C [VC]) ו-Venus-N [VN]). כאשר שני הפרודומים של הקספאזה מגויסים לפלטפורמת ההפעלה שלהם או עוברים קרבה מושרית, שני חצאי נוגה מובאים בסמיכות ונאלצים להתאושש ולהפלואורס (ראו איור 1A,B). זה מספק קריאה בזמן אמת של הפעלת קספאזה דלקתית ספציפית.
MDM אנושי מבטא בשפע גנים דלקתיים וקולטנים לזיהוי דפוסים המזהים אותות סכנה ומוצרים פתוגנים. זה מספק סוג תא אידיאלי לחקירת מסלולי קספאזה דלקתיים. בנוסף, הם יכולים להיות נגזרים מדם היקפי ואפילו מדגימות חולים כדי להעריך הפעלת קספאזה דלקתית במצב מחלה מסוים. פרוטוקול זה מתאר כיצד להכניס את כתבי הקספאזה של BiFC ל-MDM באמצעות נוקליאופקציה, שיטת טרנספקציה מבוססת אלקטרופורציה, כיצד לטפל בתאים כדי לגרום להפעלת קספאזה דלקתית, וכיצד לדמיין את קומפלקסי הקספאזה הפעילים באמצעות גישות מיקרוסקופיה. בנוסף, ניתן להתאים מתודולוגיה זו כדי לקבוע את ההרכב המולקולרי של קומפלקסים אלה, לוקליזציה תת-תאית, קינטיקה וגודלם של מבנים מסודרים אלה 25,26,27.
Access restricted. Please log in or start a trial to view this content.
Protocol
פרוטוקול זה תואם את ההנחיות של ועדת האתיקה של המחקר האנושי של מכללת ביילור לרפואה למניפולציה של דגימות אנושיות. דגימות הדם מטופלות בהתאם להנחיות הבטיחות המוסדיות לדגימות אנושיות. דגימות דם מתקבלות בבנק דם אזורי, שם הן נאספות עם תמיסת ציטראט פוספט דקסטרוז (CPD). עם זאת, דם שנאסף עם נוגדי קרישה אחרים כמו נתרן הפרין, ליתיום הפרין, או EDTA יכול לשמש גם עבור פרוטוקול זה28,29.
1. בידוד מונוציטים אנושיים והתמיינות למקרופאגים
- השג דם נוגד קרישה מאנשים בריאים שאינם מזוהים בבנק דם אזורי ובודד תאים חד-גרעיניים בדם היקפי (PBMCs) כפי שמצוין להלן.
הערה: בצע את כל השלבים במכסה זרימה למינרי של תרבית רקמה. השתמשו בצינורות סטריליים בלבד ולבשו כפפות. הוסיפו 10% אקונומיקה לכל המוצרים הקשורים לדם בעת השלכתם. PBS סטרילי (1x) או DPBS (ללא Ca2+ ומ"ג2+) ניתן להשתמש לסירוגין.- הכינו את מאגר הדילול: תוסיפו 1x PBS סטרילי עם 2% FBS ו-0.5 mM EDTA.
- הכינו את מדיום התרבית: תוסף RPMI-1640 בינוני עם FBS (10% (v/v)), גלוטמקס (2 mM) ופניצילין/סטרפטומיצין (50 I.U./50 מיקרוגרם/מ"ל)
- Precool את מאגר הריצה (טבלת חומרים) על פי פרוטוקול היצרן.
- לדלל דם שלם עם שני כרכים של מאגר דילול. באמצעות פיפטה סרולוגית, מעבירים 15 מ"ל של הדם נוגד הקרישה לצינור 50 מ"ל המכיל 30 מ"ל של מאגר הדילול. מערבבים בעדינות על ידי היפוך.
- עבור כל 10 מ"ל של דם שלם או 30 מ"ל של דם מדולל, להוסיף 15 מ"ל של מדיום שיפוע הצפיפות לצינור ריק של 50 מ"ל.
- שכבה את מדיום שיפוע הצפיפות משלב 1.1.5 עם 30 מ"ל של דם מדולל לאט ובהתמדה באמצעות פיפטה סרולוגית של 25 מ"ל. שמור את קצה הפיפטה על דופן הצינור והצינור בזווית מוטה.
- העבר בזהירות את הצינורות לצנטריפוגה של דלי מתנדנד. הימנעו מלהפריע לשני השלבים. צנטריפוגה של הצינורות ב-400 x גרם בטמפרטורת החדר (RT) למשך 25 דקות עם האצה והאטה המוגדרות לערך המינימלי.
- יש להסיר בזהירות את שכבת הפלזמה העליונה (השקופה) באמצעות פיפטה של 10 מ"ל ולהשליך למיכל עם אקונומיקה (10%).
- אספו את השכבה האינטרפאזית (הלבנה) של תאים חד-גרעיניים בדם היקפי (PBMCs, איור 2) עם פיפטה של 10 מ"ל והעבירו לצינור טרי של 50 מ"ל. שלב את השכבה הלבנה מצינורות שונים של אותו תורם בצינור 50 מ"ל עד 30 מ"ל.
- הביאו כל צינור לנפח כולל של 50 מ"ל עם חיץ הדילול משלב 1.1.1 והצנטריפוגה ב-300 x גרם ו-4 מעלות צלזיוס למשך 10 דקות. מוציאים את הסופרנטנט עם פיפטה של 10 מ"ל ומשליכים אותו למיכל עם אקונומיקה (10%).
- בצעו החייאה של כל כדור תא ב-1 מ"ל של מאגר הריצה המקורר מראש משלב 1.1.3 באמצעות מיקרו-פיפט p1000. שלבו את מתלי התאים מאותו תורם בצינור חדש של 15 מ"ל. הביאו את הנפח של כל צינור ל-15 מ"ל עם מאגר ריצה מקורר מראש וערבבו היטב על ידי היפוך.
- קח 20 μL aliquot של תרחיף התא משלב 1.1.11 ולהכין דילול 1:100 באמצעות 1x PBS סטרילי. קבע את מספר התא באמצעות המוציטומטר.
- צנטריפוגה את מתלה התא משלב 1.1.11 ב 300 x g ו 4 °C למשך 10 דקות ולהסיר את supernatant עם pipet 10 מ"ל. במידת הצורך, השתמש במיקרופיפט p200 כדי להסיר את הסופרנטנט לחלוטין.
- בצעו שימוש חוזר במחשבים המבודדים ב-80 μL של מאגר ריצה MACS מקורר מראש עבור כל אחד מ-1 x 107 תאים, והוסיפו עד למקסימום של 800 μL של המאגר.
- הוסף 20 μL של CD14 MicroBeads אנטי-אנושיים לכל אחד 1 x 107 תאים או עד 100 μL לכל דגימת דם (~ 100 מ"ל של דם לא מדולות). ערבבו היטב על ידי היפוך והניחו על סיבוב צינור למשך 20 דקות עם ערבוב רציף בטמפרטורה של 4 מעלות צלזיוס.
- הסר את הדגימות ממסובב הצינור, הוסף 10 מ"ל של מאגר ריצה מקורר מראש לכל צינור, וצנטריפוגה ב- 300 x g (תאוצה = 5, האטה = 5) ו- 4 ° C למשך 10 דקות.
- הסר את ה-supernatant עם פיפטה של 10 מ"ל ובצע החייאה של עד 1 x 108 תאים ב-500 μL של מאגר ריצה מקורר מראש (2 x 108/mL).
- בצע את הבידוד של תאים חיוביים ל-CD14 על-ידי מיון תאים מגנטיים באמצעות מערכת ידנית או אוטומטית (טבלת חומרים) בהתאם להוראות היצרן.
- קח 20 μL aliquot של תרחיף התא משלב 1.1.18 לאחר בחירה חיובית CD14 והכן דילול 1:100 באמצעות 1x PBS סטרילי. קבע את מספר התא על-ידי ספירת התאים בהמוציטומטר.
- צנטריפוגה של התאים החיוביים ל-CD14 ב-300 x g ו-RT למשך 10 דקות. הסר את הסופרנטנט באמצעות פיפט 10 מ"ל או מערכת ואקום.
- בצעו החייאה של גלולת התא משלב 1.1.20 בתווך תרבית שחומם מראש משלב 1.1.2 ועד לצפיפות תאים סופית של 1 x 107 תאים/מ"ל.
- זרעו את המונוציטים המבודדים החיוביים ל-CD14 בצפיפות תאים של 5 x 106 תאים.
- בצלחת תרבית רקמה של 10 ס"מ, הוסיפו 10 מ"ל של מדיום תרבית משלב 1.1.2 בתוספת 50 ננוגרנוציטים-מקרופאגים-גורם מגרה מושבה (GM-CSF).
- הוסיפו 0.5 מ"ל של מתלי התא משלב 1.1.21 למדיום התרבית באופן טיפתי וסובבו בעדינות את הצלחת. דגירה של תאים באינקובטור תרבית רקמה לח (37 °C (37 °C (37 °C, 5% CO2) במהלך הלילה.
- למחרת, שאפו למדיום באמצעות מערכת ואקום כדי להסיר תאים שלא התחברו במשך הלילה. הוסיפו 10 מ"ל של תרבית טרייה עם תוספת GM-CSF (50 ננוגרים/מ"ל) ותאי דגירה באינקובטור תרביות רקמה לח (37 מעלות צלזיוס, 5% CO2) למשך 7 ימים כדי לאפשר התמיינות מלאה (ראו איור 3A להופעת מונוציטים מסוג CD14+ בשלבים שונים של התמיינות ב-GM-CSF). החליפו את מדיום התרבות כל 2-3 ימים והשלימה עם GM-CSF טרי (50 ננוגרם/מ"ל) בכל פעם.
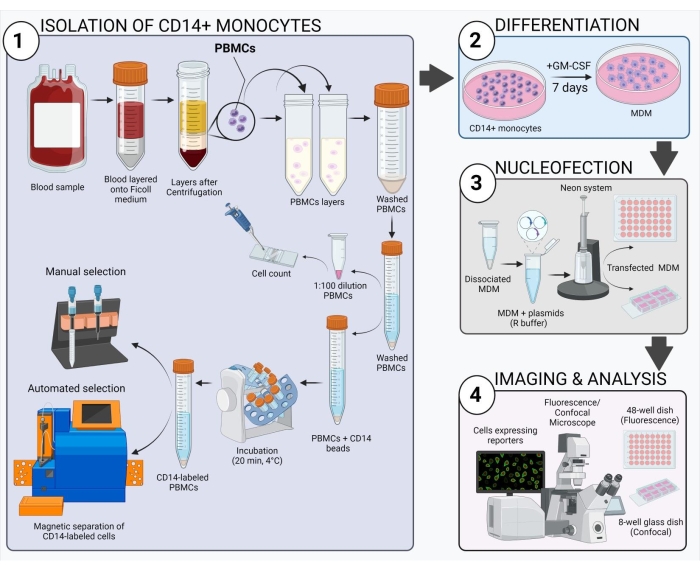
איור 2: סקירה סכמטית של זרימת העבודה הניסויית.אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הכנת רכיבי אלקטרופורציה
הערה: פרוטוקול זה מיועד לקצה של 10 μL-Neon (טבלת חומרים). עבור כל טרנספקציה, השתמש ב- 1-2 x 105 תאים. מומלץ לזרוע תאים שעברו טרנספקציה על צלחת של 48 בארות או על צלחת בעלת 8 תאים (10 תאים שעברו טרנספקטציה של μL לבאר). ניתן להשתמש ב-1x DPBS סטרילי (ללא Ca2+ ו-Mg2+) במקום PBS.
- ביום ה-7, הכינו מדיום ללא אנטיביוטיקה על ידי תוסף RPMI-1640 בינוני עם FBS (10% (v/v)) וגלוטמקס (2 mM).
- יש להניח תמיסת RPMI-1640 בינונית ללא סרום, תמיסת טריפסין-EDTA (0.25%), 1x PBS סטרילי (ללא Ca2+ ו-Mg2+), ומדיום תרבית מלא משלב 1.1.2 באמבט מים של 37 מעלות צלזיוס.
- אם משתמשים בכלים עם תחתית זכוכית (למיקרוסקופיה קונפוקלית) מצפים את הכלים בפולי-D-ליזין הידרוברומיד.
- מצפים 8 צלחת עם 200 μL של פולי-D-ליזין הידרוברומיד (0.1 מ"ג/מ"ל ב-1x PBS סטרילי) ומדגרים למשך 5 דקות ב-RT.
- לשאוף את תמיסת הפולי-D-ליזין ולשטוף את הכוס פעם אחת עם 1x PBS סטרילי. שאפו את ה-PBS והמשיכו עם שלב 2.4.
- הוסיפו 200 μL של מדיום ללא אנטיביוטיקה לכל באר של צלחת הבאר 48 או 8 צלחת עם תאים היטב ודגירה מוקדמת באינקובטור תרביות רקמה לחות (37 °C ,5% CO2) עד שיהיה מוכן לצלוח את התאים שעברו טרנספקטציה.
3. הכנת תאים לאלקטרופורציה
הערה: התפוקה של MDM מצלחת של 10 ס"מ בסוף תקופת ההתמיינות בת 7 הימים היא בערך 1.5 x 106 תאים. ניתן להשתמש ב-1x DPBS סטרילי (ללא Ca2+ ו-Mg2+) במקום PBS. פרוטוקול זה הותאם כך שרוב המקרופאגים מנותקים מהצלחת עם שמירה על הכדאיות והשלמות של התא. קשה לנתק MDM מלוחות תרבית תאים. לכן, ייתכן שיהיה צורך לבצע שלבים 3.2 ו 3.3 פעמיים כדי לנתק את התאים. ודא שכל זמן דגירה עם טריפסין-EDTA (0.25%) לא יעלה על 5 דקות.
- שאפו את המדיה מקרופאגים מובחנים לחלוטין על כלים בקוטר 10 ס"מ ושטפו את חד שכבת התאים במדיום RPMI-1640 חם ללא סרום. הקפידו להסיר לחלוטין את המדיום.
- קוצרים את התאים על ידי הוספת 2 מ"ל של תמיסת טריפסין-EDTA חמה (0.25%) לכל מנה של 10 ס"מ ודגירה באינקובטור תרביות רקמה לח (37 מעלות צלזיוס, 5% CO2) למשך 5 דקות.
- השלם את ניתוק התא על ידי צנרת עדינה של תמיסת טריפסין-EDTA (0.25%) למעלה ולמטה על פני כל אזור המנה באמצעות מיקרופיפט p1000. העבר את מתלי התא לצינור חרוטי של 15 מ"ל המכיל 5 מ"ל של מדיום תרבית מלאה חמה משלב 1.1.2.
- קחו את המנה למיקרוסקופ שדה בהיר ובדקו אם יש ניתוק תאים בתחומי ראייה שונים. אם יש כמות ניכרת של תאים שעדיין מחוברים, חזור על שלבים 3.2-3.3.
- צנטריפוגה את מתלה התא ב 250 x g למשך 5 דקות ב- RT.
- לשאוף את המדיום ולהחיות את התאים ב 10 מ"ל של 1x PBS סטרילי מחומם מראש ל 37 מעלות צלזיוס. קח 20 μL aliquot כדי לקבוע את מספר התא באמצעות המוציטומטר.
- קח 1-2 x 105 תאים לכל טרנספקציה מיועדת והנח בצינור 15 מ"ל. הביאו לנפח סופי של 15 מ"ל עם PBS סטרילי מחומם מראש 1x. צנטריפוגה ב 250 x g במשך 5 דקות ב RT.
- שאפו ל-PBS ולצנטריפוגה פעם נוספת במשך דקה אחת ב-250 x גרם. הסר כל PBS שיורי מכדור התא באמצעות מיקרופיפט p200.
4. נוקלאופציה של רכיבי BiFC קספאזה למקרופאגים שמקורם במונוציטים אנושיים
הערה: חלק זה של הפרוטוקול מבוצע באמצעות מערכת העברת ניאון (טבלת חומרים). פרוטוקול זה מתאר את השלבים להעתקה של תאים בגודל 1-2 x 1010 5 באמצעות קצה ניאון של 10 מיקרול (טבלת חומרים). אם משתמשים בקצה ניאון של 100 μL, הגדל את קנה המידה בהתאם. הימנעו מחשיפת תאים למאגר החייאה R למשך יותר מ-15 דקות, מכיוון שהדבר עלול להפחית את כדאיות התאים ואת יעילות הטרנספקציה.
- דיללו את הפלסמיד של הכתב (כלומר, mCherry או dsRedmito ב-100 ng/μL) במים נטולי נוקלאז או ב-0.5x TE buffer כדי לדמיין את התאים שעברו טרנספקטציה.
- דיללו את הפלסמידים של Caspase BiFC לריכוז מתאים במים נטולי נוקלאזות או במאגר TE של 0.5x, כך שהנפח הכולל של הפלסמידים לא יעלה על 30% מנפח הטרנספקציה הכולל של 10 μL (כלומר, 300 ng/μL של C1 Pro-VC ו-300 ng/μL של C1 Pro-VN).
- הכן מיקרו-צינורית סטרילית של 1.5 מ"ל לכל טרנספקציה מיועדת והוסף את הכמות המתאימה של פלסמיד כתב (כלומר, 50 ננוגרם או 0.5 μL) ופלסמידי BiFC של קספאזה (כלומר, 300 ננוגרם או 1 μL של C1 Pro-VC ו- 300 ng או 1 μL של שבר C1 Pro-VN). שמור את המיקרו-צינוריות במכסה המנוע בכל עת.
- מניחים את תחנת הפיפטה, המכשיר, הקצוות, צינורות האלקטרופורציה והפיפטה במכסה מנוע זרימה למינרי סטרילי.
הערה: תחנת הפיפטה, המכשיר, הטיפים, צינורות האלקטרופורציה והפיפטה כלולים במערכת הניאון טרנספקציה. - חבר את מחבר המתח הגבוה והחיישן בתחנת הפיפטה ליציאות האחוריות בהתקן בהתאם להוראות היצרן. שמור את תחנת הפיפטה קרוב למכשיר.
- חבר את כבל החשמל לכניסת החשמל האחורית והמשך לחבר את ההתקן לשקע החשמל. לחץ על מתג ההפעלה כדי להפעיל את ההתקן.
- הזן את הפרמטרים של Transfection במסך ההפעלה המוצג כאשר ההתקן מופעל ומחובר כראוי. לחץ על מתח, הזן 1000 ולחץ על בוצע כדי להגדיר את המתח ל- 1000 V. לחץ על רוחב, הזן 40 ולחץ על בוצע כדי להגדיר את משך הדופק ל- 40 אלפיות השנייה. לבסוף, לחץ על # פולסים, הזן 2 ולחץ על בוצע כדי להגדיר את מספר הפולסים החשמליים ל -2.
- קח את אחד מצינורות האלקטרופורציה (המסופקים בערכה) ומלא אותו ב-3 מ"ל של חיץ אלקטרוליטי E (עבור 10 μL טיפים ומסופקים בערכה) ב- RT. הכנס את צינור האלקטרופורציה למחזיק הפיפטה בתחנת הפיפטה. ודא כי האלקטרודה בצד הצינור פונה פנימה וכי צליל לחיצה נשמע כאשר הצינור מוכנס.
- קח את גלולת התא משלב 3.8 והוסף 10 μL של חיץ R של החייאה שחוממה מראש (מסופק בערכה) עבור כל 1-2 x 105 תאים. יש לערבב בעדינות עם מיקרופיפט p20. הוסיפו 10 μL של תרחיף התא לכל צינור המוגדר בשלב 4.3 וערבבו בעדינות עם מיקרופיפט p20.
- קח את הפיפטה והוסף קצה על ידי לחיצה על לחצן הלחיצה לתחנה השנייה. יש לוודא שהמהדק מרים לחלוטין את גזע ההרכבה של הבוכנה בקצה וכי לא נצפה רווח בראש העליון של הפיפטה.
- כדי לשאוף לדגימה, לחצו על כפתור הלחיצה בפיפטה לתחנה הראשונה וטבלו בצינור הראשון המכיל את תערובת הדנ"א של התאים/פלסמידים. לאט לאט שואפים את התערובת לתוך קצה הפיפטה.
הערה: הימנעו מבועות אוויר מכיוון שהן עלולות לגרום לקשת במהלך אלקטרופורציה, ואם המכשיר מזהה אותן, הן יכולות למנוע את אספקת הדופק החשמלי. אם נצפות בועות אוויר, שחררו את התוכן לתוך הצינור ונסו לשאוף שוב. - הכנס את הפיפטה עם הדגימה בזהירות רבה לתוך מחזיק הפיפטה. ודא שהפיפטה לוחצת ושהיא ממוקמת כראוי.
- לחץ על התחל במסך המגע והמתן עד שהפולסים החשמליים יימסרו. הודעה על המסך תציין השלמה.
- הסר באיטיות את הפיפטה מהתחנה ומיד הוסף את מתלה התאים המותמר לתוך הבאר המתאימה עם מדיום נטול אנטיביוטיקה שחומם מראש משלב 2.4 על ידי לחיצה איטית על כפתור הלחיצה לתחנה הראשונה.
הערה: ניתן לעשות שימוש חוזר בטיפ זה עד שלוש פעמים עבור אותו פלסמיד; אחרת, השליכו אותו למיכל פסולת ביו-האזרד על ידי לחיצה על כפתור הלחיצה לתחנה השנייה. - חזור על שלבים 4.10-4.14 עבור כל צינור המכיל תערובת DNA של תא/פלסמיד.
- מטלטלים בעדינות את הצלחת עם תאים שעברו טרנספקציה ודגירה במשך 1-3 שעות באינקובטור תרביות רקמה לח (37 מעלות צלזיוס, 5% CO2).
- הוסיפו לכל באר 200 μL של מדיום תרבית מחומם מראש (מדיום שלם) משלב 1.1.2. מניחים את המנה באינקובטור תרביות הרקמה הלח (37 מעלות צלזיוס, 5% CO2) שוב. אפשר לפחות 24 שעות לביטוי גנים.
- למחרת, בדקו את הכדאיות של התא ואת יעילות הטרנספקציה באמצעות מיקרוסקופ אפיפלואורסצנטי.
- הפעילו את מיקרוסקופ האפיפלואורסצנציה ואת תיבת מקור האור הפלואורסצנטי בהתאם להוראות היצרן והניחו את צלחת התרבית על במת המיקרוסקופ.
- בחר את המטרה 10x או 20x ואת המסנן 568 ננומטר (RFP).
- כדי להעריך את כדאיות התאים, לחץ על לחצן נורית LED של אור משודר (TL) כדי להציג באופן חזותי את כל התאים בשדה שנבחר. תוך כדי התבוננות בעינית המיקרוסקופ, סובבו את ידית המיקוד עד שהתאים נצפים ובדקו אם יש חיבור תאים בשדה שנבחר.
הערה: תאים מחוברים במלואם מייצגים את התאים בני הקיימא בעוד שתאים צפים מייצגים תאים שאינם בני קיימא. אם המפגש של הבאר הוא גבוה, נוכחותם של תאים שאינם מחוברים יכולה להיות תוצאה של הערכת יתר של מספר התא ולא תוצאה של כדאיות נמוכה. עם זאת, מפגש נמוך המלווה בתכולה גבוהה של תאים צפים מסמל כדאיות נמוכה שעלולה לנבוע מקשת במהלך אלקטרופורציה, רעילות פלסמיד או חשיפת יתר לחיץ R בהחייאה. אין להשתמש בבארות המציגות את ההתנהגות האחרונה. - כדי להעריך את יעילות הטרנספקציה, התמקדו בתאים בשדה שנבחר תחת אור מועבר כמתואר לעיל. ספירת המספר הכולל של התאים בשדה שנבחר. כאשר נורית האור המשודרת (TL) כבויה, לחצו על הלחצן 'אור מוחזר LED' (RL) כדי להפעיל.
- התמקדו בגנים המדווחים פלואורסצנציה (תאים אדומים) וספרו את המספר הכולל של תאים פלואורסצנטיים אדומים. חזור על שלבים אלה (4.18.4-4.18.5) עבור לפחות שני שדות נוספים בכל באר.
5. טיפול ברכישת נתונים של MDM ו- Caspase BiFC שעברו טרנספקציה ו- Caspase BiFC
הערה: אם מתכננים לדמות את התאים באמצעות אפיפלואורסצנציה או מיקרוסקופ קונפוקלי, מומלץ לטפל ב-qVD-OPh (20 μM) במשך שעה טיפול קודם בגירוי שנבחר כדי למנוע מוות של תאים תלויי קספזה (בעיקר אפופטוזיס). זה משמש בהדמיה כדי למנוע מתאים להתרומם עקב אפופטוזיס, מה שהופך אותם קשים מאוד לדמיון כשהם זזים מחוץ למישור המוקד. שים לב כי גיוס caspase לפלטפורמת ההפעלה ואת הקספאזה הקשורה BiFC אינו תלוי בפעילות הקטליטית של הקספאזה, וכתוצאה מכך, עיכוב caspase לא ישפיע על שלב זה.
- יש לטפל בגירוי שנבחר כ-24 שעות לאחר הטרנספקציה ולדגום כל עוד יש צורך בכל תרופה.
- הכן את מדיום ההדמיה על ידי השלמת מדיום תרבית משלב 1.1.2 עם Hepes (20 mM, pH 7.2-7.5) ו- 2-mercaptoethanol (55 μM).
- מוסיפים את ריכוז הגירוי הרצוי למדיום ההדמיה המחומם מראש ומערבבים בעדינות.
- הסר את המדיה מהתאים בזהירות עם מיקרופיפט p1000 והוסף 500 μL של תמיסת הגירוי משלב 5.1.2 בצד הבאר.
- כדי להפעיל בארות בקרה לא מטופלות, הוסיפו מדיום הדמיה ללא הגירוי.
- דגירה של התאים בחממת תרבית רקמה לחה (37 °C , 5% CO2) למשך זמן רב ככל שצוין עבור כל טיפול.
- דמיינו את התאים באמצעות אפיפלואורסצנציה או מיקרוסקופ קונפוקלי.
- הפעל את המיקרוסקופ ואת מקור האור הפלואורסצנטי, בהתאם להוראות היצרן.
- בחר את המטרה של 10x או 20x והנח את צלחת התרבית על במת המיקרוסקופ.
- באמצעות עינית המיקרוסקופ, מצאו תאים מתחת למסנן 568 ננומטר והתמקדו בתאים המבטאים את כתב dsRedmito/mCherry (תאים אדומים).
- ספרו את כל התאים האדומים בשדה הראייה ותעדו את המספר.
- בעוד באותו שדה ראייה, שנה למסנן 488 או 512 (GFP או YFP), המשך לספור את מספר התאים האדומים שהם גם ירוקים (חיובי לוונוס או חיובי BiFC) ולרשום את המספר.
- ספרו לפחות 100 dsRedmito/mCherry - תאים חיוביים ממינימום של שלושה שדות ראייה בודדים.
- חשב את אחוז התאים החיוביים לוונוס לכל שדה ראייה וממוצע את האחוזים המתקבלים עבור כל טיפול (טוב) כדי לקבל את סטיית התקן.
- דמיינו את התאים באמצעות אפיפלואורסצנציה או מיקרוסקופ קונפוקלי
הערה: כדי להשיג תמונות קונפוקליות באמצעות מטרה של פי 20 או הגדלה גדולה יותר, תאים צריכים להיות מצופים על צלחות זכוכית, אלא אם כן המיקרוסקופ מצויד במטרת מעבר ארוכה.- בצע את השלבים 5.2.1-5.2.3. אם משתמשים במיקרוסקופ קונפוקלי עם מטרת השמן 40x, 60x או 63x, הניחו טיפת שמן על המטרה.
- דמיינו את התמונה החיה של התאים על מסך המחשב כפי שנרכשו על ידי המצלמה. השתמש במקור האור האפיפלואורסצנטי לתמונות פלואורסצנטיות או העבר את מקור האור ללייזרים לתמונות קונפוקליות.
- כוונו את המיקוד והמיקום של התאים באמצעות השליטה והמיקוד של הג'ויסטיק.
- הגדר את אחוז ההספק וזמן החשיפה של לייזר עבור לייזרים של 512 ננומטר או 488 ננומטר (YFP או GFP) ו- 568 ננומטר (RFP) כך שהאות בתמונה ייראה טוב ולא יגיע לרוויה.
- הפעל את הצילום החי ובחן את התמונה המתקבלת. ודא כי שיא מובהק נראה עבור כל פלואור בהיסטוגרמות התצוגה עבור שני הערוצים.
- התאם את עוצמת הלייזר ואת זמן החשיפה לפי הצורך. שמור על ערכים אלה נמוכים ככל האפשר ועדיין תוכל לזהות הן אותות פלואורסצנטיים (RFP והן GFP/YFP).
- תוך כדי הדמיה של התמונה החיה של התאים, צלם מספר תמונות מייצגות של שדה המכיל תא אחד או יותר המבטאים את כתב mCherry/dsRedmito עבור כל באר של הצלחת ושמור את הנתונים.
Access restricted. Please log in or start a trial to view this content.
תוצאות
הסכימה המוצגת באיור 2 נותנת סקירה כללית של אופן ההשגה, ההחלפה והתמונה של MDM אנושי. לאחר הדגירה של המונוציטים שנבחרו ב-CD14+ עם GM-CSF למשך 7 ימים, המורפולוגיה של התא משתנה במהלך תקופת ההתמיינות (איור 3A), ועוברת מתאי השעיה כדוריים למצוברים בצורה קוצנית ומלאה (ימים 3 ו...
Access restricted. Please log in or start a trial to view this content.
Discussion
פרוטוקול זה מתאר את זרימת העבודה להשגת מקרופאגים ממונוציטים שבודדו מדגימות דם אנושיות ושיטה להחדרה יעילה של כתבי ה-BiFC של הקספאזה הדלקתית לתוך MDM אנושי מבלי להתפשר על הכדאיות וההתנהגות של התאים.
פרוטוקול זה מנצל את טכניקת BiFC35 כדי לתייג את הקספאזות הדלקתיות בתחו...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
אנו מודים לחברי המעבדה של LBH בעבר ובהווה שתרמו לפיתוח טכניקה זו. מעבדה זו נתמכת על ידי NIH/NIDDK T32DK060445 (BEB), NIH/NIDDK F32DK12DK121479 (BEB), NIH/NIGMS R01GM121389 (LBH). איור 2 צויר באמצעות תוכנת Biorender.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 48 well tissue culture2:34 plates | Genesee Scientific | 25-108 | |
| 10 cm Tissue Culture Dishes | VWR | 25382-166 | |
| 2 Mercaptoethanol 1000x | Thermo Fisher Scientific | 21985023 | |
| 8 well chambered coverglass with 1.5 HP coverglass | Cellvis | c8-1.5H-N | |
| AutoMACS columns | Miltenyi (Biotec) | 130-021-101 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Separator | Miltenyi (Biotec) | 130-092-545 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Washing Solution | Miltenyi (Biotec) | 130-092-987 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Rinsing Solution | Miltenyi (Biotec) | 130-091-222 | For automated separation using AutoMACS Pro Separator only |
| AutoMacs running buffer | Miltenyi (Biotec) | 130-091-221 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| Axio Observer Z1 motorized inverted microscope equipped with a CSU-X1A 5000 spinning disk unit | Zeiss | Any confocal microscope equipped with a laser module fitted with laser lines of 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| AxioObserver A1, Research Grade Inverted Microscope | Zeiss | Any epifluorescence microscope with fluorescence filters capable of exciting 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| CD14+ MICROBEADS | Miltenyi (Biotec) | 130-050-201 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| DPBS without calcium chloride and magnesium chloride | Sigma | D8537-6x500ML | |
| DsRed mito plasmid | Clontech | 632421 | Similar plasmids that can be used as fluorescent reporters can be found on Addgene |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437028 | |
| Ficoll-Paque PLUS 6 x 100 mL | Sigma | GE17-1440-02 | |
| GlutaMAX Supplement (100x) | Thermo Fisher Scientific | 35050079 | |
| GM-CSF | Thermo Fisher Scientific | PHC2011 | |
| Hemin BioXtra, from Porcine, ≥96.0% (HPLC) | Sigma | 51280-1G | |
| HEPES | Thermo Fisher Scientific | 15630106 | |
| Inflammatory caspase BiFC plasmids | Available by request from LBH lab | ||
| LPS-EB Ultrapure | Invivogen | TLRL-3PELPS | |
| LS Columns | Miltenyi (Biotec) | 130-042-401 | For manual separation using QuadroMACS Separator only |
| MACS 15 mL Tube Rack | Miltenyi (Biotec) | 130-091-052 | For manual separation using QuadroMACS Separator only |
| MACS MultiStand | Miltenyi (Biotec) | 130-042-303 | For manual separation using QuadroMACS Separator only |
| mCherry plasmid | Yungpeng Wang Lab | Similar plasmids that can be used as fluorescent reporters can be found on Addgene | |
| Neon Transfection System | Thermo Fisher Scientific | MPK5000 | Includes Neon electroporation device, pipette and pipette station |
| Neon Transfection System 10 µL Kit | Thermo Fisher Scientific | MPK1096 | Includes resuspension buffer R, resuspension buffer T, electrolytic buffer E, 96 x 10 µL Neon tips and Neon electroporation tubes |
| Nigericin sodium salt, ready made solution | Sigma | SML1779-1ML | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-D-Lysine Hydrobromide | Sigma | P7280-5mg | |
| QuadroMACS Separator | Miltenyi (Biotec) | 130-090-976 | For manual separation using QuadroMACS Separator only |
| qVD-OPh | Fisher (ApexBio) | 50-101-3172 | |
| RPMI 1640 Medium | Thermo Fisher Scientific | 11875119 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200072 | |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | 15575020 | |
| Zeiss Zen 2.6 (blue edition) software | Zeiss | Any software used to operate the confocal microscope of choice |
References
- Boatright, K. M., et al. A unified model for apical caspase activation. Molecular Cell. 11 (2), 529-541 (2003).
- Pop, C., Salvesen, G. S. Human caspases: activation, specificity, and regulation. Journal of Biological Chemistry. 284 (33), 21777-21781 (2009).
- Boice, A., Bouchier-Hayes, L. Targeting apoptotic caspases in cancer. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1867 (6), 118688(2020).
- Bolívar, B. E., Vogel, T. P., Bouchier-Hayes, L. Inflammatory caspase regulation: maintaining balance between inflammation and cell death in health and disease. The FEBS Journal. 286 (14), 2628-2644 (2019).
- Martinon, F., Tschopp, J. Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory diseases. Cell. 117 (5), 561-574 (2004).
- Lamkanfi, M., Vishva, M. D. Mechanisms and functions of inflammasomes. Cell. 157 (5), 1013-1022 (2014).
- Viganò, E., et al. Human caspase-4 and caspase-5 regulate the one-step noncanonical inflammasome activation in monocytes. Nature Communications. 6, 8761(2015).
- Cerretti, D. P., et al. Molecular cloning of the interleukin-1 beta converting enzyme. Science. 256 (5053), 97(1992).
- van de Veerdonk, F. L., Netea, M. G., Dinarello, C. A., Joosten, L. A. Inflammasome activation and IL-1β and IL-18 processing during infection. Trends in Immunology. 32 (3), 110-116 (2011).
- Martinon, F., Burns, K., Tschopp, J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Molecular Cell. 10 (2), 417-426 (2002).
- Kayagaki, N., et al. Noncanonical inflammasome activation targets caspase-11. Nature. 479 (7371), 117-121 (2011).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Masumoto, J., et al. ASC, a novel 22-kDa protein, aggregates during apoptosis of human promyelocytic leukemia HL-60 cells. The Journal of Biological Chemistry. 274 (48), 33835-33838 (1999).
- Bertin, J., DiStefano, P. S. The PYRIN domain: a novel motif found in apoptosis and inflammation proteins. Cell Death and Differentiation. 7 (12), 1273-1274 (2000).
- Agostini, L., et al. NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 20 (3), 319-325 (2004).
- Bürckstümmer, T., et al. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nature Immunology. 10 (3), 266-272 (2009).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nature Reviews Immunology. 13 (6), 397-411 (2013).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for noncanonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Bolívar, B. E., et al. Noncanonical Roles of Caspase-4 and Caspase-5 in Heme-Driven IL-1β Release and Cell Death. The Journal of Immunology. 206 (8), 1878-1889 (2021).
- Schmid-Burgk, J. L., et al. Caspase-4 mediates noncanonical activation of the NLRP3 inflammasome in human myeloid cells. European Journal of Immunology. 45 (10), 2911-2917 (2015).
- Baker, P. J., et al. NLRP3 inflammasome activation downstream of cytoplasmic LPS recognition by both caspase-4 and caspase-5. European Journal of Immunology. 45 (10), 2918-2926 (2015).
- Cullen, S. P., Kearney, C. J., Clancy, D. M., Martin, S. J. Diverse activators of the NLRP3 inflammasome promote IL-1β secretion by triggering necrosis. Cell Reports. 11 (10), 1535-1548 (2015).
- Sanders, M. G., et al. Single-cell imaging of inflammatory caspase dimerization reveals differential recruitment to inflammasomes. Cell Death & Disease. 6, 1813(2015).
- Charendoff, C. I., Bouchier-Hayes, L. Lighting up the pathways to caspase activation using bimolecular fluorescence complementation. Journal of Visualized Experiments: JoVE. (133), e57316(2018).
- Bouchier-Hayes, L., et al. Characterization of cytoplasmic caspase-2 activation by induced proximity. Molecular Cell. 35 (6), 830-840 (2009).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral blood mononuclear cells: Isolation, Freezing, thawing, and culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Current Pathobiology Reports. 7 (2), 17-27 (2019).
- Perregaux, D., et al. IL-1 beta maturation: evidence that mature cytokine formation can be induced specifically by nigericin. The Journal of Immunology. 149 (4), 1294-1303 (1992).
- Cheneval, D., et al. Increased mature interleukin-1β (IL-1β) secretion from THP-1 cells induced by nigericin is a result of activation of p45 IL-1β-converting enzyme processing. Journal of Biological Chemistry. 273 (28), 17846-17851 (1998).
- Fernandes-Alnemri, T., et al. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death and Differentiation. 14 (9), 1590-1604 (2007).
- Lu, A., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Muller-Eberhard, U., Javid, J., Liem, H. H., Hanstein, A., Hanna, M. Brief report: Plasma concentrations of hemopexin, haptoglobin and heme in patients with various hemolytic diseases. Blood. 32 (5), 811-815 (1968).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40 (1), 61-66 (2006).
- Thornberry, N. A., et al. A novel heterodimeric cysteine protease is required for interleukin-1βprocessing in monocytes. Nature. 356 (6372), 768-774 (1992).
- Jensen, K., Anderson, J. A., Glass, E. J. Comparison of small interfering RNA (siRNA) delivery into bovine monocyte-derived macrophages by transfection and electroporation. Veterinary Immunology and Immunopathology. 158 (3-4), 224-232 (2014).
- Tada, Y., Sakamoto, M., Fujimura, T. Efficient gene introduction into rice by electroporation and analysis of transgenic plants: use of electroporation buffer lacking chloride ions. Theoretical and Applied Genetics. 80 (4), 475-480 (1990).
- Bhowmik, P., et al. Targeted mutagenesis in wheat microspores using CRISPR/Cas9. Scientific Reports. 8 (1), 6502(2018).
- Sansom, D. M., Manzotti, C. N., Zheng, Y. What's the difference between CD80 and CD86. Trends in Immunology. 24 (6), 314-319 (2003).
- Kurokawa, M., Kornbluth, S. Caspases and kinases in a death grip. Cell. 138 (5), 838-854 (2009).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved