Method Article
زراعة وفحص الديدان الخيطية الطفيلية النباتية Ditylenchus dipsaci
In This Article
Summary
يصف هذا البروتوكول طريقة موثوقة ومباشرة لزراعة وجمع وفحص Ditylenchus dipsaci.
Abstract
تدمر الديدان الخيطية الطفيلية النباتية (PPNs) أكثر من 12٪ من المحاصيل الغذائية العالمية كل عام ، وهو ما يعادل ما يقرب من 157 مليار دولار أمريكي تضيع سنويا. مع تزايد عدد سكان العالم ومحدودية الأراضي الصالحة للزراعة ، فإن السيطرة على الإصابة ب PPN أمر بالغ الأهمية لإنتاج الغذاء. ومما يضاعف من التحدي المتمثل في زيادة غلة المحاصيل إلى أقصى حد القيود المتزايدة المفروضة على مبيدات الآفات الفعالة بسبب الافتقار إلى انتقائية الديدان الخيطية. وبالتالي، فإن تطوير مبيدات نيماتسيد كيميائية جديدة وآمنة أمر حيوي للأمن الغذائي. في هذا البروتوكول ، يتم عرض استزراع وجمع أنواع PPN Ditylenchus dipsaci . D. dipsaci ضار اقتصاديا ومقاوم نسبيا لمعظم النيماتيدات الحديثة. يشرح العمل الحالي أيضا كيفية استخدام هذه الديدان الخيطية في الشاشات لمبيدات النيماتيدات الصغيرة الجديدة والتقارير حول منهجيات جمع البيانات وتحليلها. يوفر خط الأنابيب المثبتة إنتاجية من آلاف المركبات أسبوعيا ويمكن تكييفها بسهولة للاستخدام مع أنواع PPN الأخرى مثل Pratylenchus Penetrans. يمكن استخدام التقنيات الموصوفة هنا لاكتشاف مبيدات نيماتيسيد جديدة ، والتي بدورها يمكن تطويرها إلى منتجات تجارية انتقائية للغاية تكافح بأمان PPNs للمساعدة في إطعام عالم يزداد جوعا.
Introduction
تشير التقديرات إلى أن الديدان الخيطية الطفيلية النباتية (PPNs) مسؤولة عن فقدان 12.3٪ من الإنتاج الغذائي العالمي وتسبب أضرارا تقدر بنحو 157 مليار دولار سنويا 1,2,3. لسوء الحظ ، فإن القدرة على التحكم في PPNs تتضاءل بسبب حظر مبيدات النيماتسيد الكيميائية الفعالة أو تواجه قيودا متصاعدة بسبب سلامة الإنسان والمخاوف البيئية. ويرجع ذلك في المقام الأول إلى ضعف انتقائية الديدان الخيطية للأجيال السابقة من المبيدات الحشرية4. على مدى السنوات ال 25 الماضية ، تم تجريب ستة مبيدات نيماتسيد كيميائية جديدة أو إدخالها في السوق5. وقد تم بالفعل حظر واحد من هذه في أوروبا ، وآخر تم وقفه أثناء التحقيق في تأثيره على heatlhالإنسان 6,7. وبالتالي ، هناك حاجة ملحة لمبيدات نيماتيسيد جديدة انتقائية للغاية ل PPNs.
الديدان الخيطية الجذعية واللمبة ، Ditylenchus dipsaci (D. dipsaci) هي PPN4. D. dipsaci المؤثرة اقتصاديا تصيب ما يقرب من 500 نوع نباتي عبر 30 سباقا بيولوجيا وتستهدف بعض المحاصيل الأكثر أهمية من الناحية الزراعية مثل الجاودار والشوفان والثوم والبصل والكراث 8,9. على سبيل المثال ، قام D. dipsaci مؤخرا بضرب حقول الثوم في أونتاريو وكيبيك ، مما أدى إلى خسائر تصل إلى 90٪ 10,11. توزيعها الجغرافي في كل مكان تقريبا ويشمل الأمريكتين (بما في ذلك كاليفورنيا وفلوريدا) وأوروبا والكثير من آسيا (بما في ذلك الصين) وأوقيانوسيا9. D. dipsaci هو طفيلي داخلي مهاجر يدخل الثغور على الأوراق أو الجروح والعدس حيث يطلق الإنزيمات لتحطيم جدار الخلية12. مما يضاعف من تأثير D. dipsaci على المحاصيل ، فإن الضرر الناجم عن PPN يجعل النبات عرضة للعدوى الثانوية11. لسوء الحظ ، يظهر D. dipsaci مستويات عالية من التسامح مع مبيدات الديدان الخيطية الحالية مقارنة بسلالات الديدان الخيطية الأخرى13,14.
يصف هذا البروتوكول زراعة D. dipsaci ، واستخدامه في شاشات واسعة النطاق لمبيدات النيماتيسيد المرشحة للجزيئات الصغيرة. باختصار ، يتم الحفاظ على مجموعات D. dipsaci وتوسيعها على نباتات البازلاء المستزرعة في وسائط Gamborg B-5 (GA) المعقمة15. قبل زراعة براعم البذور على وسط GA ، يجب تعقيم البذور من خلال سلسلة من الغسلات وطلائها على أجار المغذيات (NA) للتحقق من التلوث. تعقيم البذور ضروري للكشف عن الملوثات البكتيرية والفطرية التي قد تكون موجودة. ثم يتم نقل البذور غير الملوثة إلى ألواح GA ، حيث تنمو براعم البذور استعدادا للعدوى. تصاب ألواح GA التي تحتوي على براعم البذور بالديدان الخيطية من صفيحة استزراع سابقة عن طريق نقل قطعة من الأجار تحتوي على أنسجة الجذر إلى الألواح الطازجة. بعد 6-8 أسابيع ، يتم استخراج الديدان الخيطية من وسائط GA ويتم تصفيتها من خلال قمع مبطن بمرشح القهوة في كوب مجموعة. يمكن استخدام الديدان الخيطية في العديد من المقايسات الحيوية بمجرد جمع عدد مناسب. تولد التقنية الموصوفة في هذا البروتوكول ما يقرب من 15000 D. dipsaci لكل لوحة استزراع. تم نشر بروتوكولات بديلة لزراعة D. dipsaci 16,17.
كما يتم وصف فحص جزيء صغير في المختبر استنادا إلى العمل السابق18 هنا. كوكيل لصحة الدودة ، يتم فحص حركة 20 ديدان خيطية لكل بئر بعد 5 أيام من التعرض للجزيئات الصغيرة. لتصور حركة الديدان بشكل أفضل ، يضاف NaOH لزيادة حركة الديدان الحية19,20. يسمح هذا البروتوكول بالفحص متوسط الإنتاجية ويوفر بيانات قيمة لتقييم إمكانات النيماتيزم للجزيئات الصغيرة. إذا تم استخدام تقنية مختلفة لجمع الديدان الخيطية16,17 ، يمكن مع ذلك تنفيذ منهجية فحص الجزيئات الصغيرة الموضحة هنا.
Protocol
تم جمع سلالة D. dipsaci G-137 المستخدمة في هذا العمل من الثوم المتنوع Fish Lake 4 في مقاطعة الأمير إدوارد وتم توفيرها من قبل الزراعة والأغذية الزراعية الكندية. إذا بدأت ثقافة جديدة ، فاستشر Poirier et al. للحصول على منهجية التلقيح15.
1. زراعة D. dipsaci
- إعداد الوسائط واللوحات بعد العمل الذي تم الإبلاغ عنه سابقا15.
- قم بإعداد 500 مل من وسائط أجار المغذيات (NA) مع 23 جم / لتر من NA (انظر جدول المواد) والماء فائق النقاء. باستخدام تقنية معقمة ، صب 25 مل من وسائط NA المعقمة في 20 طبقا بتري يمكن التخلص منه (قطره 100 مم × عمقه 15 مم). اسمح للأجار بالتصلب في درجة حرارة الغرفة (22 درجة مئوية) مع تشغيل الغطاء لمدة ~ 2 ساعة واتركه جانبا للاستخدام لاحقا.
- قم بإعداد 500 مل من وسائط Gamborg B-5 (GA) التي تحتوي على 3.2 جم / لتر من الوسط القاعدي GA مع الحد الأدنى من المواد العضوية ، و 20 جم / لتر من السكروز ، و 15 جم / لتر من الأجار ، والماء المقطر (انظر جدول المواد). باستخدام تقنية معقمة ، صب 50 مل من وسائط GA المعقمة في 10 أطباق بتري يمكن التخلص منها (قطرها 100 مم × عمقها 25 مم). اترك الأجار يتصلب في درجة حرارة الغرفة (22 درجة مئوية) مع تشغيل الغطاء لمدة 5 ساعات تقريبا وخزنه في وضع مستقيم في درجة حرارة الغرفة في كيس معقم حتى يتم نقل البرعم.
ملاحظة: يتم تصنيع لوحات الوسائط الزائدة في حالة حدوث تلوث.
- قم بإجراء تعقيم البذور باتباع طريقة معدلة من عمل سابق15.
- الأوتوكلاف كوب واحد سعة 2 لتر مع قضيب تحريك ، ملقطين ، طبق بتري زجاجي ، و 1 لتر من الماء المقطر. قم بإعداد 200 مل من محلول EtOH بنسبة 95٪ و 200 مل من محلول تبييض تجاري بنسبة 15٪.
- استخدم بذور البازلاء (انظر جدول المواد). صب 150 بذرة في كوب معقم سعة 2 لتر مع قضيب تحريك بالقرب من لهب موقد بنسن على مقعد المختبر.
- أضف 200 مل من 95٪ EtOH إلى البذور داخل الكأس ، وحرك بقوة على لوحة التحريك لمدة 5 دقائق ، ثم صب EtOH في حاوية نفايات.
- صب محلول التبييض في الكأس لغمر البذور تماما. يحرك المزيج بقوة على طبق من التقليب لمدة 20 دقيقة ثم يسكب المبيض في وعاء للنفايات.
- يسكب الماء المقطر في الكأس لغمر البذور ويحرك بقوة على طبق التحريك لمدة 20 دقيقة. كرر غسل الماء ثلاث مرات ، صب الماء المقطر بعد كل غسلة. بعد غسل الماء النهائي ، صب البذور المعقمة في طبق بتري الزجاجي.
- للتحقق من وجود تلوث، انقل 6 بذور إلى كل صفيحة NA مقاس 10 سم (محضرة في الخطوة 1.1.1) في غطاء الفيضان الرقائقي باستخدام ملقط معقم. رتب البذور حول محيط اللوحة (تعمل البذور الممتلئة بشكل أفضل). لف الألواح بشكل فردي في فيلم تغليف المختبر واحتضنها في الظلام لمدة 3 أيام عند 26 درجة مئوية.
ملاحظة: سيسمح طلاء بذور أكثر من اللازم بالاستخدام الانتقائي للبذور غير الملوثة.
- قم بإجراء نقل البرعم باتباع الخطوة أدناه.
- في غطاء التدفق الرقائقي، استخدم ملقط معقم لوضع بذورتين غير ملوثتين على كل صفيحة GA (محضرة في الخطوة 1.1.2). لف الألواح بشكل فردي في فيلم تغليف مختبري واحتضنها في درجة حرارة الغرفة لمدة 7-10 أيام للسماح للبذور بالتنبت.
- أداء التربية في المختبر باتباع طريقة معدلة من عمل سابق15.
- تحضير 50 مل من محلول السكروز 20 جم / لتر. مرشح تعقيم محلول السكروز ووضعها جانبا.
- في غطاء التدفق الرقائقي ، قم بقطع قطعة من الأجار تحتوي على أنسجة الجذر (~ 2 سم3) من لوحة ثقافة موجودة. ماصة 500 ميكرولتر من محلول السكروز على لوحة GA جديدة مع شتلات البازلاء ووضع مكعب أجار فوق السكروز. لف الألواح بشكل فردي في فيلم تغليف مختبري وحافظ على الثقافة في صندوق مبطن بورق الألومنيوم في درجة حرارة الغرفة (~ 22 درجة مئوية).
- الديدان الخيطية دون الاستزراع على لوحات GA الطازجة كل 8-9 أسابيع للحفاظ على الثقافة. الديدان الخيطية جاهزة للاستخراج بعد ~ 8 أسابيع.
2. استخراج وجمع D. dipsaci
- قم بإجراء استخراج D. dipsaci باتباع الخطوات أدناه.
- أوتوكلاف كوب 50 مل ، قمع 80 مم ، 150 مل من الماء المقطر ، ومرشحات القهوة. ضع القمع في الكأس وقم بتبطين القمع بفلتر قهوة معقم.
- في غطاء التدفق الرقائقي ، قم بقطع الآجار وأنسجة الجذر إلى 1 سم3 باستخدام مشرط معقم. انقل مكعبات الأجار إلى القمع المبطن بفلتر القهوة وصب الماء المقطر ببطء على الأجار لترطيب فلتر القهوة.
- قم بإزالة القمع المبطن بفلتر القهوة من الكأس واملأ الكأس بالماء المقطر حتى يلمس مستوى الماء الجزء السفلي من الفلتر بمجرد استبدال القمع المبطن بفلتر القهوة.
- قم بتغطية القمع المبطن بفلتر القهوة والكأس بورق الألمنيوم. اتركيه طوال الليل (16 ساعة) على سطح الطاولة للسماح للديدان بالتحرك عبر فلتر القهوة إلى وعاء المجموعة.
ملاحظة: تكون صفيحة زراعة الديدان الخيطية جاهزة للاستخراج عندما تزحف الديدان إلى الأجار عند فحصها باستخدام مجهر التشريح. عادة ما تكون اللوحة جاهزة للاستخراج بعد 6-8 أسابيع من تلقيحها الأولي.
- أداء مجموعة D. dipsaci.
ملاحظة: في اليوم التالي ، ستكون ديدان D. dipsaci قد استقرت في قاع الدورق.- قم بإزالة القمع المبطن بفلتر القهوة واستنشق أعلى 40 مل من الماء من كوب التجميع ؛ التأكد من عدم تعطيل الديدان المستقرة. باستخدام ماصة مصلية بلاستيكية سعة 10 مل ، اجمع السائل المتبقي في أنبوب طرد مركزي مخروطي 15 مل.
ملاحظة: يمكن استخدام هذه المجموعة مباشرة في المقاييس. ضعه في درجة حرارة 4 درجات مئوية إذا لم يتم استخدامها في غضون 24 ساعة. يمكن ترك الديدان لمدة 3 أيام عند 4 درجات مئوية دون أي تأثير واضح على التنقل. قد تؤدي إزالة القمع إلى إزعاج الديدان الموجودة في كوب التجميع. دعهم يستقرون في القاع قبل الجمع.
- قم بإزالة القمع المبطن بفلتر القهوة واستنشق أعلى 40 مل من الماء من كوب التجميع ؛ التأكد من عدم تعطيل الديدان المستقرة. باستخدام ماصة مصلية بلاستيكية سعة 10 مل ، اجمع السائل المتبقي في أنبوب طرد مركزي مخروطي 15 مل.
3. في المختبر شاشة جزيء صغير
- قم بإعداد لوحات الفحص باتباع الخطوات أدناه.
- صب الماء المقطر المعقم في حوض معقم ، وباستخدام ماصة متعددة القنوات ، قم بتوزيع 40 ميكرولتر من الماء المقطر من الحوض الصغير إلى كل بئر من صفيحة 96 بئرا مسطحة القاع.
- تحضير أداة التثبيت وإضافة المواد الكيميائية
- قم بإعداد صواني الدبوس (انظر جدول المواد) بالقرب من لهب موقد بنسن على مقعد المختبر. أضف ما يلي إلى صواني الدبوس المتتالية: 25 مل من محلول تنظيف الدبوس ، و 35 مل من 50٪ DMSO (في الماء) ، و 45 مل من الماء المقطر ، و 55 مل من 70٪ EtOH ، و 65 مل من 95٪ EtOH. ضع قطعة واحدة من ورق النشاف أمام كل درج
- قم بتنظيف أداة التثبيت عن طريق إخراج المسامير في محلول التنظيف وتحريك المسامير لأعلى ولأسفل ثلاث مرات (3x) في المحلول. في هذا البروتوكول ، يتم تعريف "3x" و "10x" على أنهما تحريك القضيب لأعلى ولأسفل في محلول ثلاث أو عشر مرات ، على التوالي. لطخة دبابيس على ورقة النشاف. كرر هذا الإجراء مرة أخرى.
- بعد ذلك ، شطف المسامير 3x في الماء المقطر ، تليها نشاف الدبابيس. كرر الإجراء مرة أخرى.
- أخيرا ، اشطف الدبابيس 3x في 95٪ EtOH ، تليها نشاف الدبابيس. كرر مرة أخرى. لهب الدبوس واسمح للإيثانول بالتبخر.
- أضف مواد كيميائية من ألواح المخزون الكيميائي المكونة من 96 بئرا إلى ألواح الفحص عن طريق تثبيت 3x في اللوحة الكيميائية ، ثم نقل المسامير 10X إلى لوحة الفحص. لطخة على الورق أمام محلول التنظيف.
- تنظيف أداة التثبيت بين الألواح عن طريق الغسيل بالترتيب التالي ، والنشاف بينهما على ورق النشاف: 3x في 50٪ DMSO (مرة واحدة) ، 3x في الماء المقطر (مرة واحدة) ، 3x في 75٪ EtOH (مرة واحدة) ، 3x في 95٪ EtOH (مرتين). لهب الدبوس والسماح للإيثانول بالتبخر.
- كرر الخطوة 3.2.2 عند اكتمال كافة تثبيت.
ملاحظة: تم إجراء الفحص بتركيز نهائي قدره 60 ميكرومتر.
- إضافة الديدان
- احسب عدد الديدان الخيطية من المجموعة عن طريق التعليق أولا ثم سحب 5 ميكرولتر باستخدام نصائح الاحتفاظ المنخفضة على شريحة للمراقبة. احسب عدد الديدان الخيطية في 5 ميكرولتر باستخدام مجهر التشريح.
- اضبط التركيز على 2 ديدان / ميكرولتر باستخدام الماء المقطر المعقم. باستخدام ماصة متعددة القنوات وحوض صغير ، أضف 10 ميكرولتر (~ 20 ديدانا) إلى كل بئر من لوحات 96 بئرا.
ملاحظة: سيتم جمع ما يقرب من 15000 ديميتودا ديبساسي ديباساكي لكل لوحة استزراع باستخدام طريقة الاستزراع والجمع الموصوفة. يتم استخدام عشرين دودة لكل بئر لأن العدد الصغير يسهل التصور والمحاسبة الواضحين للديدان المتنقلة وغير المتحركة.
- اضبط التركيز على 2 ديدان / ميكرولتر باستخدام الماء المقطر المعقم. باستخدام ماصة متعددة القنوات وحوض صغير ، أضف 10 ميكرولتر (~ 20 ديدانا) إلى كل بئر من لوحات 96 بئرا.
- قم بإغلاق الألواح في فيلم تغليف المختبر ولفها بمنشفة ورقية مبللة. ضعيه في صندوق ولصقيه على وسادة لزجة في حاضنة اهتزاز 20 درجة مئوية عند 200 دورة في الدقيقة. تأكد من تثبيت الألواح في الصندوق عن طريق إضافة منشفة ورقية مبللة إضافية لضمان الحد الأدنى من حركة الألواح.
- احسب عدد الديدان الخيطية من المجموعة عن طريق التعليق أولا ثم سحب 5 ميكرولتر باستخدام نصائح الاحتفاظ المنخفضة على شريحة للمراقبة. احسب عدد الديدان الخيطية في 5 ميكرولتر باستخدام مجهر التشريح.
4. جمع البيانات وتحليلها
- راقب اللوحات في اليوم 5 تحت مجهر تشريح. احسب عدد المتنقلين والعدد الإجمالي ل D. dipsaci في ضوابط المذيبات DMSO والآبار المعالجة بالعقاقير.
- إذا كانت الديدان غير متحركة نسبيا ، أضف 2 ميكرولتر من 1 M NaOH إلى تركيز نهائي قدره 40 mM إلى البئر لتحفيز الحركة19,20.
ملاحظة: بعد إضافة NaOH، ستتحرك الديدان على الفور ويجب عرضها في غضون 5 دقائق. سيتم استخدام عدد الديدان المتنقلة والعدد الإجمالي للديدان لحساب نسبة الديدان المتنقلة. قد يتغير طول الفحص اعتمادا على هدف الشاشة.
- إذا كانت الديدان غير متحركة نسبيا ، أضف 2 ميكرولتر من 1 M NaOH إلى تركيز نهائي قدره 40 mM إلى البئر لتحفيز الحركة19,20.
- حساب نسبة الديدان المتنقلة. في شاشات D. dipsaci ، يتم تصنيف الآبار التي أنتجت 0٪ من الديدان المتنقلة بشكل متكرر على أنها ضربات قوية.
ملاحظة: يتم تجنب التعرض المطول للألواح في مرحلة مجاهر التشريح لأن مصدر الضوء يمكن أن يسخن الألواح ويحفز تأثيرات متغيرة على الفحص الحيوي.
النتائج
النسخ المتماثلة المستقلة تكشف عن نتائج قابلة للتكرار
ولتوضيح التباين المتوقع بين شاشات النسخ المتماثل، يتم رسم الوسائل والتباين في حركة العينات من ثلاث لوحات تمثيلية من شاشة حديثة (الشكل 1). تم إجراء ثلاث نسخ طبق الأصل من الشاشة في ثلاثة أيام مختلفة. تحتوي جميع اللوحات الثلاث على عناصر تحكم سلبية (مذيبات فقط) (قضبان أغمق) ، وتحتوي العينات داخل المجموعة على مبيدات نيماتية ثابتة. المركبات المتبقية هي من مكتبة مخصصة يتم وصفها حاليا في مختبر روي. بالمقارنة مع الشاشات المماثلة التي أجريت باستخدام C. elegans مع نفس الجزيئات (SC ، JK ، PJR ، النتائج غير المنشورة) ، فإن معدل الإصابة مع D. dipsaci أقل بكثير ، والعديد من لوحات الأدوية لا تظهر أي نشاط (الشكل 1A). تحتوي بعض اللوحات على ضربات قابلة للتكرار بالكامل (الشكل 1B ، C) ، بينما يختلف البعض الآخر في النشاط (الشكل 1C). بالنسبة للأنواع الأخرى التي تم فحصها (غير معروضة) ، يظهر D. dipsaci تباينا أقل في استجابته للمركبات. بغض النظر عن ذلك ، تعتبر النسخ المتماثلة ضرورية في تحديد الضربات القابلة للتكرار.
تختلف النيماتيسيد الخيطية في قدرتها على شل حركة Ditylenchus dipsaci
من بين المبيدات الخيطية السبعة المميزة التي تم اختبارها ضد D. dipsaci ، يظهر Fluopyram فقط نشاطا قويا في الفحص الموصوف هنا (الشكل 1C). وهذا يتفق مع العمل السابق الذي يظهر أن D. dipsaci متسامح مع مبيدات النيماتسيد13,14. يمنع Fluopyram المركب II من سلسلة نقل الإلكترون بطريقة انتقائية للديدان الخيطية وهو مبيد نيماتسيد تجاري يستخدم للتحكم في مجموعة متنوعة من PPNs ، بما في ذلك Rotylenchulus reniformis و Meloidogyne incognita 4,21,22. تم التحقيق في Fluopyram وأحد مبيدات الديدان الخيطية التي تفتقر إلى النشاط في التركيز الذي تم اختباره (Oxamyl)23 بمزيد من التفصيل من خلال تحليل استجابة الجرعة باستخدام D. dipsaci. يحفز Fluopyram تأثيرا واضحا يعتمد على الجرعة على حركة D. dipsaci مع EC50 من 9.3 ميكرومتر (مع فاصل ثقة 95٪ بين 8.2 إلى 10.5 ميكرومتر) (الشكل 2A ، B). من المتوقع أن تستند هذه النتيجة إلى النتائج المنشورة في المختبر من Storelli et al., 202013. ليس للأوكساميل تأثير كبير على الحركة حتى تركيز 120 ميكرومتر (p = 0.3632 ، اختبار t غير المقترن) (الشكل 2C ، D).
هيدروكسيد الصوديوم يحسن حساسية المقايسة
على النقيض من نشاط السباحة شبه المستمر ل C. elegans في الثقافة السائلة18 ، فإن D. dipsaci أقل حركة بشكل كبير. هذا ليس من غير المألوف بين الديدان الخيطية الطفيلية في الثقافة16. للمساعدة في التمييز بين الديدان "المستريحة" والديدان المريضة ، يتم استخدام 40 mM من NaOH في نقطة نهاية الفحص لتحفيز الحركة لدى الأفراد القادرين (الشكل 3) 19,20. تسمح هذه التقنية بالتحديد الواضح للجزيئات الصغيرة التي تشل حركة الديدان ، بالنظر إلى أن جميع الديدان في آبار التحكم السلبية تتحرك وتنتج خلفية منخفضة بشكل استثنائي من الإيجابيات الكاذبة في الشاشة.
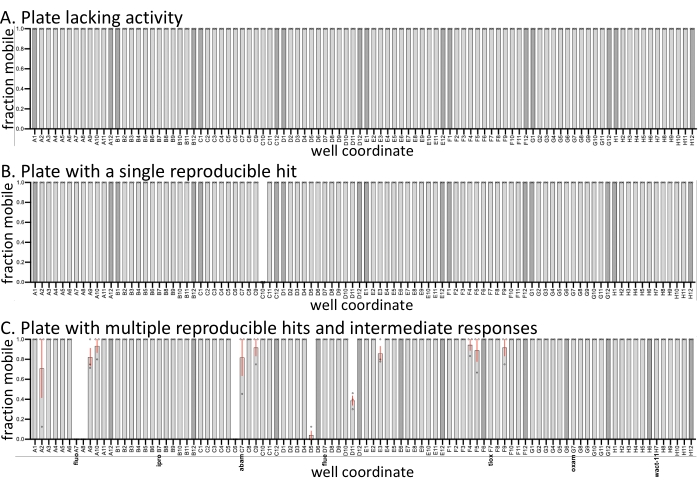
الشكل 1: أمثلة على إخراج الشاشة. تم إجراء ثلاث نسخ بيولوجية (دوائر مفتوحة) مع D. dipsaci ضد الجزيئات الصغيرة (60 ميكرومتر) في كل من الصفائح الثلاث الموضحة. تحتوي جميع اللوحات الثلاث على 0.6٪ من عناصر التحكم في المذيبات DMSO فقط (القضبان الداكنة). ما لم يذكر خلاف ذلك مع ضوابط المذيبات أو مبيدات النيماتيك المعروفة ، تحتوي آبار الألواح الثلاثة على مركبات تشبه الأدوية غير مميزة نسبيا تم شراؤها من البائعين (انظر Burns et al.، 2015)18. (أ) تفتقر صفيحة البئر 96 من مكتبة الجزيئات الصغيرة إلى أي جزيء له نشاط حيوي يمكن ملاحظته ضد D. dipsaci. (ب) تحتوي صفيحة البئر 96 من مكتبة الجزيئات الصغيرة على جزيء واحد يعطل حركة D. dipsaci بشكل متكرر. (ج) صفيحة دواء من 96 بئرا تحتوي على مبيدات النيماتسيد المميزة فلوبيرام (فلو ) ، إيبروديون (إيبرو) ، أبامكتين (أبام) ، فلونسلفون (مداخن) ، تيوكسازافين (تيوكس) ، أوكساميل (أوكسام) ، وواكت - 11. تمثل أشرطة الخطأ الخطأ القياسي للمتوسط. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
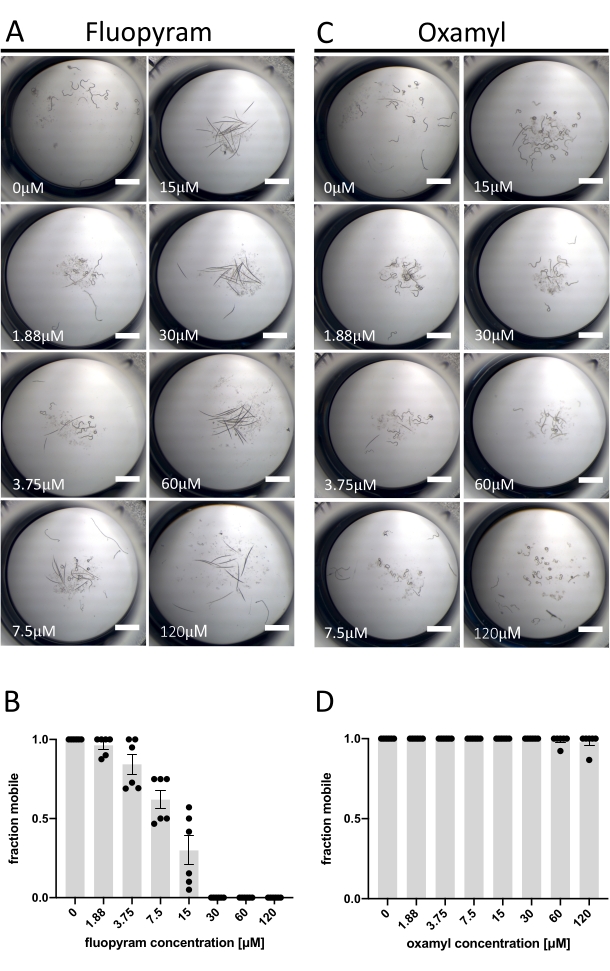
الشكل 2: مثال على النتائج الإيجابية والسلبية باستخدام مقايسة الحركة . (أ) أمثلة على الأنماط الظاهرية الطرفية بعد تعرض D. dipsaci لزيادة تركيزات الفلوروبيرام بعد 5 أيام قبل إضافة NaOH. (ب) تحليل الجرعة والاستجابة لحركة D. dipsaci بعد 5 أيام من التعرض للتركيزات المشار إليها من الفلوبيرام. (ج، د) نفس A ، B ، باستثناء oxamyl. يعرض كل رسم بياني التجارب التي أجريت في يومين منفصلين مع ثلاث نسخ طبق الأصل كل يوم. يشير المحور y لكل رسم بياني إلى الكسر المتحرك للديدان في كل بئر محسوبا على أنه عدد الحيوانات التي تتحرك بالنسبة إلى إجمالي عدد الحيوانات في البئر. تمثل أشرطة الخطأ على كلا الرسمين البيانيين الخطأ القياسي للمتوسط. يمثل شريط المقياس 1 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
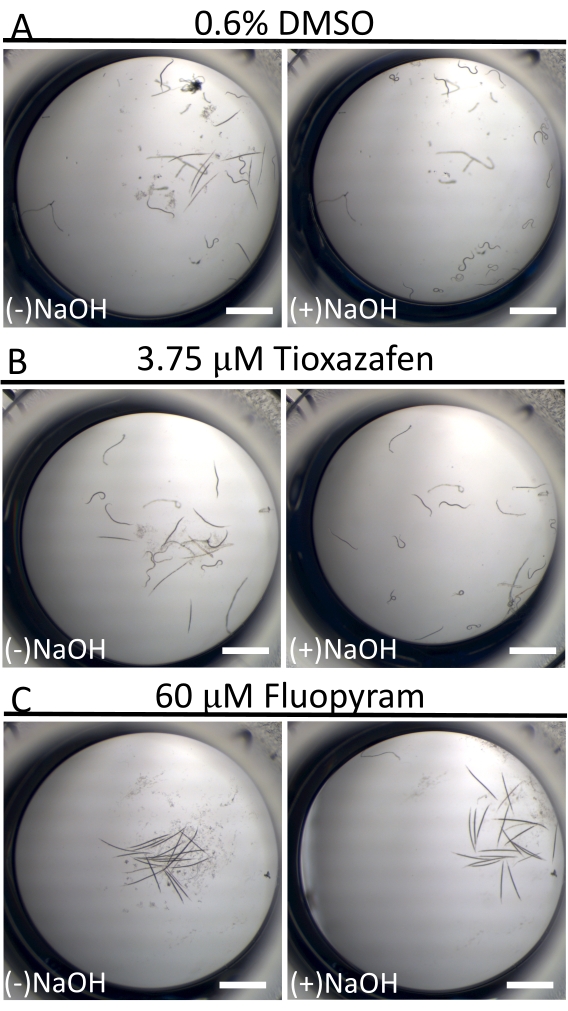
الشكل 3: حركة D. dipsaci بعد إضافة 40 mM من NaOH. تأثير إضافة NaOH إلى عينات D. dipsaci في وجود التحكم في المذيبات فقط (A) أو tioxazafen (B) أو fluopyram (C) بعد 5 أيام من الحضانة المشتركة. يمثل شريط المقياس 1 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
خطوات حاسمة
على الرغم من بساطة البروتوكول ، هناك خطوات حاسمة في البروتوكول تستحق اهتماما إضافيا لزيادة احتمال نجاحه. أولا ، يمكن أن يؤدي الإفراط في تبييض البذور إلى تعطيل نموها. لذلك ، فإن الحد من وقت البذور في محلول التبييض إلى 20 دقيقة أو أقل أمر ضروري. ثانيا ، كما لاحظ سابقا Storelli et al. ، فإن الصحة الظاهرة للديدان الخيطية تنخفض بمرور الوقت عند تخزينها عند 4 درجات مئوية16. يوفر استخدام الديدان الخيطية بعد وقت قصير من جمعها ثقة إضافية بأنه يمكن تحقيق ظروف الفحص المثلى. إذا كان التخزين على المدى الطويل ضروريا ، فتأكد من أن غطاء الأنبوب ليس ضيقا للسماح بتبادل الأكسجين. ثالثا ، إن ضمان نمو البازلاء على ألواح NA للوقت المقترح يمكن المجرب من الحكم على البذور الملوثة. رابعا ، إن الإفراط في نمو البازلاء على ألواح GA قبل إضافة الديدان الخيطية سيضعف العدوى ويقلل من غلة الديدان الخيطية. وأخيرا، يمكن للعديد من العوامل التي يصعب السيطرة عليها أن تؤثر على نتائج الفحص. لذلك ، من الضروري إجراء العديد من شاشات النسخ المتماثل المستقلة في أيام مختلفة ومن الناحية المثالية مع PPNs التي تم جمعها من لوحات ثقافة مختلفة لضمان تكرار النتائج.
قيود الطريقة
أحد القيود المفروضة على البروتوكول هو أنه يفشل في مزامنة المرحلة التنموية للديدان التي تم جمعها ، والتي تتراوح من الأحداث إلى البالغين. وبالتالي ، من المحتمل أن تكون النتائج القوية التي تكشفها أي شاشة فعالة على مراحل متعددة. ومع ذلك ، فإن البروتوكول يزيد من خطر تجاهل الضربات الفعالة الخاصة بالمرحلة. والاعتبار الثاني هو أنه ينبغي اعتبار الفحص في المختبر الخطوة الأولى في خط أنابيب اكتشاف مبيدات الديدان الخيطية؛ تعد الفحوصات القائمة على التربة إضافة ممتازة إلى خط أنابيب لاختبار قابلية ترجمة الزيارات.
أهمية البروتوكول وتطبيقه
البروتوكولات الموضحة هنا بسيطة ويمكن تكرارها بسهولة. علاوة على ذلك ، تم تطبيق هذا البروتوكول بنجاح على PPNs الأخرى في المختبر ، بما في ذلك Pratylenchus penetrans ، من خلال إجراء تعديلات طفيفة فقط. يعد وضع تدابير جديدة وآمنة لمكافحة PPN أمرا ضروريا لضمان الأمن الغذائي العالمي. هذا ينطبق بشكل خاص على أنواع مثل D. dipsaci التي تتحمل عموما مجموعة واسعة من مبيدات النيماتسيد الكيميائية المقبولة حاليا13,14. وبالتالي، فإن البروتوكولات المبينة هنا لديها القدرة على تقديم مساهمة هامة في صحة الإنسان على نطاق عالمي.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
ويقر المؤلفان الدكتور تشينغ يو (الزراعة والأغذية الزراعية في كندا) بتوفيره ثقافة ديتيلنشوس ديبساتشي والمشورة بشأن أساليب الثقافة؛ الدكتور بنجامين ميمي (الزراعة والأغذية الزراعية الكندية) وناتالي دوفينايس (الزراعة والأغذية الزراعية الكندية) للحصول على المشورة بشأن الاستزراع المختبري للديدان الخيطية الطفيلية النباتية؛ الدكتور أندرو بيرنز وشون هارينغتون للحصول على اقتراحات مفيدة حول المشروع والمخطوطة. JK هو باحث دراسات عليا في NSERC ألكسندر غراهام بيل كندا. يتم دعم PJR من خلال منحة مشروع CIHR (313296). PJR هو كرسي أبحاث كندي (المستوى 1) في علم الوراثة الكيميائية.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL tube | Sarstedt | 62.554.205 | |
| 2 forceps | Almedic | 7747-A10-108 | |
| 2L beaker | Pyrex | CLS10002L | |
| 50mL beaker | Pyrex | CLS100050 | |
| 96 well plate | Sarstedt | 83.3924 | |
| aluminium foil | Alcan Plus | ||
| bacteriological agar | BioShop | AGR001.5 | |
| coffee filter | No name brand | 716 | |
| commercial bleach 6% | Lavo Pro 6 | DIN102358107 | |
| disposable petri dishes (10cm x 1.5cm) | Fisherbrand | FB0875712 | |
| disposable petri dishes (10cm x 2.5cm) | Sigma-Aldrich | Z358762 | |
| dissecting scope | Leica | Leica MZ75 | |
| DMSO | Sigma-Aldrich | 472301-500ML | |
| Funnel | VWR | 414004-270 | |
| Gamborg B5 | Sigma-Aldrich | G5893-10L | |
| glass petri dish | VWR | 75845-546 | |
| glass slide | MAGNA | 60-1200 | |
| Lint-Free Blotting Paper | V&P Scientific | VP 522-100 | |
| Low retention pipette tips (200uL) | LABFORCE | 1159M44 | |
| mutlichannel pipette | Eppendorf research plus | 3125000036 | |
| NaOH | Sigma-Aldrich | S8045-500G | |
| nutrient agar | Sigma-Aldrich | 70148-100G | |
| parafilm | Bemis | PM-996 | |
| pea seeds | Ontario Seed Company | D-1995-250G | |
| pin cleaning solutions | V&P Scientific | VP110A | |
| pinner | V&P Scientific | VP381N | |
| pinner rinse trays | V&P Scientific | VP 421 | |
| reagent reservoir with lid for multichannel pipettes | Sigma-Aldrich | BR703459 | |
| shaking incubator | New Brunswick Scientific | I26 | |
| sterile surgical blade | MAGNA | sb21-100-a | |
| stir bar | Fisherbrand | 2109 - 1451359 | |
| sucrose | BioShop | SUC507.1 |
References
- Sasser, J. N., Freckman, D. W. A. world perspective on nematology: the role of the society. Vistas on nematology. , 7-14 (1987).
- Abad, P., et al. Genome sequence of the metazoan plant parasitic nematode Meloidogyne incognita. Nature Biotechnology. 26 (8), 909-915 (2008).
- Auwal, M., Hassan, T. H. P., Hongli, S., Jingwu, Z. Nematodes threats to global food security. Acta Agriculturae Scandinavica, Section B - Soil & Plant Science. 63 (5), 420-425 (2013).
- Chen, Z. X., Chen, S. Y., Dickson, D. W. Nematicides: Past and present uses. Nematology Vol 2, Nematode Management and Utilization. , 1179-1200 (2004).
- Desaeger, J., Wram, C., Zasada, I. New reduced-risk agricultural nematicides - and review. Journal of nematology. 52, (2020).
- Donely, N. The USA lags behind other agricultural nations in banning harmful pesticides. Environmental Health. 18 (1), 44 (2019).
- Polansek, T. Monsanto halts launch of chemical after users complain of rashes. Reuters. , (2017).
- Sturhan, D., Brzeski, M. W. Stem and bulb nematodes, Ditylenchus spp. Manual of agricultural nematology. , 423-464 (1991).
- The European and Mediterranean Plant Protection Organization (EPPO). Data Sheets on Quarantine Pests; Ditylenchus dipsaci. Prepared by CABI and EPPO for the EU under Contract 90/399003. The European and Mediterranean Plant Protection Organization (EPPO). , (2021).
- Quebec (Canada), Agriculture, Pêcherie et Alimentation Quebec. Réseau d'avertissements phytosanitaires (RAP). Avertissement Carotte, Céleri, Laitue, Oignon, Poireau [Warning carrot celery, lettuce, onion, leek]. Quebec (Canada), Agriculture, Pêcherie et Alimentation Quebec. , (2011).
- Abawi, G. S., Moktan, K. Bloat nematode problem on garlic: symptoms, distribution, and management guidelines. Department of Plant Pathology and Plant-microbe Biology, Geneva. , (2010).
- Taylor, R. Chapter 7. Nematodes and other worms. , 143-234 (2019).
- Storelli, A., Keiser, A., Eder, R., Jenni, S., Kiewnick, S. Evaluation of fluopyram for the control of Ditylenchus dipsaci in sugar beet. Journal of nematology. 52, 1-10 (2020).
- Oka, Y. Nematicidal activity of fluensulfone against some migratory nematodes under laboratory conditions. Pest Management Science. 70, 1850 (2014).
- Poirier, S., Dauphinais, N., Van Der Heyden, H., Véronneau, P. Y., Bélair, G., Gravel, V., Mimee, B. Host Range and Genetic Characterization of Ditylenchus dipsaci Populations from Eastern Canada. Plant disease. 103, 456-460 (2019).
- Storelli, A., Kiewnick, S., Daub, M., et al. Virulence and pathogenicity of four Ditylenchus dipsaci populations on sugar beet. Eur J Plant Pathol. 161, 63-71 (2021).
- Kühnhold, V., Kiewnick, S., Sikora, R. A. Development of an in vivo bioassay to identify sugar beet resistance to the stem nematode Ditylenchus dipsaci. Nematology. 8 (5), 641-645 (2006).
- Burns, A., Luciani, G., Musso, G. Caenorhabditis elegans is a useful model for anthelmintic discovery. Nat Communications. 6, (2015).
- Chen, S. Y., Dickson, D. W. A Technique for Determining Live Second-stage Juveniles of Heterodera glycines. Journal of nematology. 32, 117-121 (2000).
- Xiang, N., Lawrence, K. S. Optimization of In Vitro Techniques for Distinguishing between Live and Dead Second Stage Juveniles of Heterodera glycinesand Meloidogyne incognita. PLoS ONE. 11 (5), (2016).
- US EPA. Fluopyram. US EPA. , (2016).
- US EPA. Fluopyram. US EPA. , (2020).
- US EPA. Oxamyl Facts. Prevention, Pesticides and Toxic Substances. US EPA. , (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved