Method Article
Cultivo y cribado del nematodo parásito de la planta Ditylenchus dipsaci
En este artículo
Resumen
El presente protocolo describe un método confiable y directo para cultivar, recolectar y detectar Ditylenchus dipsaci.
Resumen
Los nematodos parásitos de plantas (PPN) destruyen más del 12% de los cultivos alimentarios mundiales cada año, lo que equivale a aproximadamente 157 mil millones de dólares (USD) perdidos anualmente. Con una población mundial en crecimiento y tierras cultivables limitadas, controlar la infestación de PPN es fundamental para la producción de alimentos. Agravando el desafío de maximizar los rendimientos de los cultivos están las crecientes restricciones a los pesticidas efectivos debido a la falta de selectividad de nematodos. Por lo tanto, el desarrollo de nematicidas químicos nuevos y seguros es vital para la seguridad alimentaria. En este protocolo se demuestra el cultivo y la recolección de la especie PPN Ditylenchus dipsaci . D. dipsaci es económicamente perjudicial y relativamente resistente a la mayoría de los nematicidas modernos. El trabajo actual también explica cómo usar estos nematodos en pantallas para nuevos nematicidas de moléculas pequeñas e informa sobre metodologías de recopilación y análisis de datos. La tubería demostrada ofrece un rendimiento de miles de compuestos por semana y se puede adaptar fácilmente para su uso con otras especies de PPN como Pratylenchus penetrans. Las técnicas descritas en este documento se pueden utilizar para descubrir nuevos nematicidas, que pueden, a su vez, desarrollarse aún más en productos comerciales altamente selectivos que combaten de manera segura los PPN para ayudar a alimentar a un mundo cada vez más hambriento.
Introducción
Se estima que los nematodos parásitos de las plantas (PPN) son responsables de la pérdida del 12,3% de la producción mundial de alimentos y causan un daño estimado de 157 mil millones de dólares anuales 1,2,3. Desafortunadamente, la capacidad de controlar los PPN está disminuyendo porque los nematicidas químicos efectivos han sido prohibidos o se enfrentan a restricciones crecientes debido a la seguridad humana y las preocupaciones ambientales. Esto se debe principalmente a la escasa selectividad de nematodos de las generaciones anteriores de plaguicidas4. En los últimos 25 años, se han probado o introducido en el mercado seis nuevos nematicidas químicos5. Uno de ellos ya ha sido prohibido en Europa, y otro ha sido descontinuado mientras se investiga por su impacto en el calor humano 6,7. Por lo tanto, existe una necesidad apremiante de nuevos nematicidas que sean altamente selectivos para los PPN.
El nematodo del tallo y el bulbo, Ditylenchus dipsaci (D. dipsaci) es un PPN4 económicamente impactante. D. dipsaci infecta a casi 500 especies de plantas en 30 razas biológicas y se dirige a algunos de los cultivos más importantes para la agricultura, como el centeno, la avena, el ajo, la cebolla y el puerro 8,9. Por ejemplo, D. dipsaci ha azotado recientemente los campos de ajo en Ontario y Quebec, lo que resulta en pérdidas de hasta el 90%10,11. Su distribución geográfica es casi omnipresente e incluye las Américas (incluyendo California y Florida), Europa, gran parte de Asia (incluyendo China) y Oceanía9. D. dipsaci es un endoparásito migratorio que entra en los estomas en hojas o heridas y lenticelas donde liberan enzimas para romper la pared celular12. Agravando el impacto de D. dipsaci en los cultivos, el daño causado por el PPN hace que la planta sea susceptible a la infección secundaria11. Desafortunadamente, D. dipsaci muestra altos niveles de tolerancia a los nematicidas actuales en comparación con otras cepas de nematodos13,14.
Este protocolo describe el cultivo de D. dipsaci y su uso en pantallas a gran escala para nematicidas candidatos a moléculas pequeñas. Brevemente, las poblaciones de D. dipsaci se mantienen y amplían en plantas de guisantes cultivadas en medios estériles Gamborg B-5 (GA)15. Antes de cultivar brotes de semillas en medio GA, las semillas deben esterilizarse a través de una serie de lavados y enchaparse en agar nutriente (NA) para verificar si hay contaminación. La esterilización de semillas es esencial para detectar contaminantes bacterianos y fúngicos que puedan estar presentes. Las semillas no contaminadas se transfieren a las placas ga, donde los brotes de semillas crecerán en preparación para la infección. Las placas gagénicas que contienen brotes de semillas se infectan con nematodos de una placa de cultivo anterior mediante la transferencia de un trozo de agar que contiene tejido radicular a las placas frescas. Después de 6-8 semanas, los nematodos se extraen de los medios GA y se filtran a través de un embudo forrado con filtro de café en un vaso de precipitados de recolección. Los nematodos se pueden utilizar en varios bioensayos una vez que se ha recogido un número adecuado. La técnica descrita en este protocolo genera aproximadamente 15.000 D. dipsaci por placa de cultivo. Se han publicado protocolos alternativos para cultivar D. dipsaci 16,17.
Aquí también se describe un ensayo de detección de moléculas pequeñas in vitro basado en trabajos anteriores18. Como indicador de la salud del gusano, se examina la movilidad de 20 nematodos por pozo después de 5 días de exposición a moléculas pequeñas. Para visualizar mejor la movilidad de los gusanos, se agrega NaOH para aumentar el movimiento de los gusanos vivos19,20. Este protocolo permite el cribado de rendimiento medio y proporciona datos valiosos para evaluar el potencial nematicida de moléculas pequeñas. Si se utiliza una técnica de recolección de nematodos diferente16,17, se puede implementar la metodología de cribado de moléculas pequeñas descrita en este documento.
Protocolo
La cepa G-137 de D. dipsaci utilizada para el presente trabajo fue recolectada del ajo de la variedad Fish Lake 4 en el condado de Prince Edward y fue proporcionada por Agriculture and Agri-food Canada. Si comienza un cultivo fresco, consulte a Poirier et al. para la metodología de inoculación15.
1. Cultivo de D. dipsaci
- Preparar los medios y las placas después del trabajo previamente reportado15.
- Preparar 500 ml de medios de agar nutriente (NA) con 23 g/L de NA (ver Tabla de Materiales) y agua ultrapura. Utilizando la técnica estéril, vierta 25 ml de medios NA en autoclave en 20 placas de Petri desechables (100 mm de diámetro x 15 mm de profundidad). Deje que el agar se solidifique a temperatura ambiente (22 °C) con la tapa puesta durante ~2 h y reservar para su uso posterior.
- Preparar 500 ml de medios Gamborg B-5 (GA) que contengan 3,2 g/L de medio basal GA con compuestos orgánicos mínimos, 20 g/L de sacarosa, 15 g/L de agar y agua destilada (ver Tabla de Materiales). Utilizando la técnica estéril, vierta 50 ml de medios GA en autoclave en 10 placas de Petri desechables (100 mm de diámetro x 25 mm de profundidad). Deje que el agar se solidifique a temperatura ambiente (22 °C) con la tapa puesta durante ~ 5 h y guárdelo en posición vertical a temperatura ambiente en una bolsa estéril hasta la transferencia del brote.
NOTA: Las placas de medios en exceso se hacen en caso de que ocurra contaminación.
- Realizar la esterilización de semillas siguiendo un método modificado a partir de un trabajo anterior15.
- Autoclave un vaso de precipitados de 2 L con una barra de agitación, 2 pinzas, una placa de Petri de vidrio y 1 L de agua destilada. Prepare 200 ml de solución de EtOH al 95% y 200 ml de una solución de lejía comercial al 15%.
- Use semillas de guisante (ver Tabla de Materiales). Vierta 150 semillas en un vaso de precipitados estéril de 2 L con una barra de agitación cerca de una llama de quemador Bunsen en un banco de laboratorio.
- Agregue 200 ml de EtOH al 95% a las semillas dentro del vaso de precipitados, revuelva vigorosamente en la placa de agitación durante 5 minutos y luego vierta EtOH en un recipiente de desechos.
- Vierta la solución de lejía en el vaso de precipitados para sumergir completamente las semillas. Revuelva vigorosamente en una placa de agitación durante 20 minutos y luego vierta la lejía en un recipiente de desechos.
- Vierta agua destilada en el vaso de precipitados para sumergir las semillas y revuelva vigorosamente en un plato de agitación durante 20 minutos. Repita los lavados con agua tres veces, vertiendo agua destilada después de cada lavado. Después del lavado final con agua, vierta las semillas esterilizadas en la placa de Petri de vidrio.
- Para comprobar si hay contaminación, transfiera 6 semillas a cada placa de NA de 10 cm (preparada en el paso 1.1.1) en la campana de inundación laminar utilizando pinzas esterilizadas. Coloque las semillas alrededor de la circunferencia del plato (las semillas más gruesas funcionan mejor). Envuelva las placas individualmente en una película de envoltura de laboratorio e incube en la oscuridad durante 3 días a 26 ° C.
NOTA: Enchapar más semillas de las necesarias permitirá el uso selectivo de semillas no contaminadas.
- Realice la transferencia de brotes siguiendo el paso a continuación.
- En una campana de flujo laminar, use pinzas esterilizadas para colocar 2 semillas no contaminadas en cada placa GA (preparadas en la etapa 1.1.2). Envuelva las placas individualmente en una película de envoltura de laboratorio e incube a temperatura ambiente durante 7-10 días para permitir que las semillas broten.
- Realizar la cría in vitro siguiendo un método modificado a partir de un trabajo anterior15.
- Preparar 50 ml de solución de sacarosa de 20 g/L. Filtro esterilizar la solución de sacarosa y reservar.
- En una campana de flujo laminar, corte un trozo de agar que contenga tejido radicular (~2 cm3) de una placa de cultivo existente. Pipete 500 μL de solución de sacarosa en una nueva placa de GA con plántulas de guisante y coloque un cubo de agar sobre sacarosa. Envuelva las placas individualmente en una película de envoltura de laboratorio y mantenga el cultivo en una caja forrada con papel de aluminio a temperatura ambiente (~ 22 ° C).
- Subcultivo de nematodos en placas frescas de GA cada 8-9 semanas para mantener el cultivo. Los nematodos están listos para ser extraídos después de ~ 8 semanas.
2. Extracción y recolección de D. dipsaci
- Realice la extracción de D. dipsaci siguiendo los pasos a continuación.
- Autoclave un vaso de precipitados de 50 ml, un embudo de 80 mm, agua destilada de 150 ml y filtros de café. Coloque el embudo en el vaso de precipitados y cubra el embudo con un filtro de café estéril.
- En una campana de flujo laminar, corte el agar y el tejido de la raíz en 1 cm3 con un bisturí estéril. Transfiera los cubos de agar al embudo forrado de filtro de café y vierta lentamente agua destilada en el agar para humedecer el filtro de café.
- Retire el embudo forrado con filtro de café del vaso de precipitados y llene el vaso de precipitados con agua destilada hasta que el nivel de agua toque la parte inferior del filtro una vez que se reemplace el embudo forrado con filtro de café.
- Cubra el embudo y el vaso de precipitados forrados con filtro de café con papel de aluminio. Deje actuar durante la noche (16 h) en la mesa de trabajo para permitir que los gusanos se muevan a través del filtro de café hacia el vaso de precipitados de recolección.
NOTA: Una placa de cultivo de nematodos está lista para la extracción cuando los gusanos se han arrastrado hacia el agar cuando se examinan con un microscopio de disección. Por lo general, una placa está lista para la extracción 6-8 semanas después de su inoculación inicial.
- Realizar la recolección de D. dipsaci.
NOTA: Al día siguiente, los gusanos D. dipsaci se habrán asentado en el fondo del vaso de precipitados.- Retire el embudo forrado con filtro de café y aspire los 40 ml superiores de agua del vaso de precipitados de recolección; asegúrese de no interrumpir los gusanos asentados. Usando una pipeta serológica plástica de 10 ml, recoja el líquido restante en un tubo de centrífuga cónica de 15 ml.
NOTA: Esta colección se puede utilizar directamente en ensayos. Colocar a 4 °C si no se van a utilizar en un plazo de 24 horas. Los gusanos se pueden dejar durante 3 días a 4 °C sin impacto visible en la movilidad. La eliminación del embudo puede perturbar los gusanos en el vaso de precipitados de recolección. Deja que se asienten en el fondo antes de recogerlos.
- Retire el embudo forrado con filtro de café y aspire los 40 ml superiores de agua del vaso de precipitados de recolección; asegúrese de no interrumpir los gusanos asentados. Usando una pipeta serológica plástica de 10 ml, recoja el líquido restante en un tubo de centrífuga cónica de 15 ml.
3. Cribado in vitro de moléculas pequeñas
- Prepare las placas de ensayo siguiendo los pasos a continuación.
- Vierta agua destilada en autoclave en un canal estéril y, utilizando una pipeta multicanal, dispense 40 μL de agua destilada del canal en cada pozo de una placa plana de 96 pocillos.
- Prepare la herramienta de fijación y agregue los productos químicos
- Coloque bandejas de pinner (consulte la Tabla de materiales) cerca de una llama de quemador Bunsen en un banco de laboratorio. Agregue lo siguiente a las sucesivas bandejas de pinzas: 25 mL de solución de limpieza de pines, 35 mL de 50% dmSO (en agua), 45 mL de agua destilada, 55 mL de 70% etOH y 65 mL de 95% etOH. Coloque un pedazo de papel secante frente a cada bandeja
- Limpie la herramienta de fijación colocando los pasadores en la solución de limpieza y moviendo los pasadores hacia arriba y hacia abajo tres veces (3 veces) en la solución. En este protocolo, '3x' y '10x' se definen como mover el pinner hacia arriba y hacia abajo en una solución tres o diez veces, respectivamente. Borre los pines en el papel secante. Repita este procedimiento una vez más.
- A continuación, enjuague los pines 3x en agua destilada, seguido de secar los pines. Repita el procedimiento una vez más.
- Por último, enjuague los pines 3x en 95% EtOH, seguido de secar los pines. Repite una vez más. Flamea el pinner y deja que el etanol se evapore.
- Agregue productos químicos de las placas de stock de productos químicos de 96 pocillos a las placas de ensayo fijando 3x en la placa química, luego transfiriendo los pines 10X a la placa de ensayo. Seque en el papel frente a la solución de limpieza.
- Limpie la herramienta de fijación entre placas lavando en el siguiente orden, secándola entre ellas en papel secante: 3x en 50% DMSO (una vez), 3x en agua destilada (una vez), 3x en 75% EtOH (una vez), 3x en 95% EtOH (dos veces). Encienda el pinner y permita que el etanol se evapore.
- Repita el paso 3.2.2 cuando se complete todo el anclaje.
NOTA: El cribado se realizó a una concentración final de 60 μM.
- Adición de gusanos
- Cuente el número de nematodos de la colección resuspensando primero y luego pipeteando 5 μL usando puntas de baja retención en un portaobjetos para su observación. Cuente el número de nematodos en 5 μL utilizando un microscopio de disección.
- Ajuste la concentración a 2 gusanos/μL usando agua destilada estéril. Usando una pipeta multicanal y un canal, agregue 10 μL (~ 20 gusanos) a cada pozo de las placas de 96 pocillos.
NOTA: Se recolectarán aproximadamente 15,000 nematodos D. dipsaci por placa de cultivo utilizando el método de cultivo y recolección descrito. Se utilizan veinte gusanos por pozo porque el pequeño número facilita la visualización clara y la contabilidad de los móviles e inmóviles.
- Ajuste la concentración a 2 gusanos/μL usando agua destilada estéril. Usando una pipeta multicanal y un canal, agregue 10 μL (~ 20 gusanos) a cada pozo de las placas de 96 pocillos.
- Selle las placas en una película de envoltura de laboratorio y envuélvalas con una toalla de papel húmeda. Colocar en caja y fijar en una almohadilla adhesiva en una incubadora de agitación de 20 °C a 200 rpm. Asegúrese de que las placas estén estabilizadas en la caja agregando una toalla de papel húmeda adicional para garantizar un movimiento mínimo de las placas.
- Cuente el número de nematodos de la colección resuspensando primero y luego pipeteando 5 μL usando puntas de baja retención en un portaobjetos para su observación. Cuente el número de nematodos en 5 μL utilizando un microscopio de disección.
4. Recopilación y análisis de datos
- Observe las placas el día 5 bajo un microscopio de disección. Contar el número de móviles y el número total de D. dipsaci en controles de disolventes DMSO y pozos tratados con fármacos.
- Si los gusanos están relativamente inmóviles, agregue 2 μL de 1 M NaOH a una concentración final de 40 mM al pozo para estimular el movimiento19,20.
NOTA: Después de agregar NaOH, los gusanos se moverán instantáneamente y deberán verse en 5 minutos. El número de gusanos móviles y el número total de gusanos se utilizarán para calcular la proporción de gusanos móviles. La duración del ensayo puede cambiar dependiendo del objetivo de la pantalla.
- Si los gusanos están relativamente inmóviles, agregue 2 μL de 1 M NaOH a una concentración final de 40 mM al pozo para estimular el movimiento19,20.
- Calcule la proporción de gusanos móviles. En las pantallas de D. dipsaci , los pozos que produjeron reproduciblemente 0% de gusanos móviles se clasifican como golpes fuertes.
NOTA: Se evita la exposición prolongada de placas en la etapa de microscopios de disección porque la fuente de luz puede calentar las placas e inducir efectos variables en el bioensayo.
Resultados
Réplicas independientes revelan éxitos reproducibles
Para ilustrar la variación esperada entre las pantallas replicadas, las medias y la variación en la movilidad de la muestra se trazan a partir de tres placas representativas de una pantalla reciente (Figura 1). Se realizaron tres réplicas de la pantalla en tres días diferentes. Las tres placas tienen controles negativos (solo solvente) (barras más oscuras), y las muestras dentro del conjunto contenían nematicidas establecidos. Los compuestos restantes son de una biblioteca personalizada que actualmente se está caracterizando en el laboratorio de Roy. En comparación con pantallas similares realizadas con C. elegans con las mismas moléculas (SC, JK, PJR, resultados no publicados), la tasa de aciertos con D. dipsaci es significativamente menor, y muchas placas de medicamentos no exhiben actividad (Figura 1A). Algunas placas tienen golpes totalmente reproducibles (Figura 1B, C), mientras que otras varían en actividad (Figura 1C). En relación con otras especies examinadas (no mostradas), D. dipsaci muestra menos variabilidad en su respuesta a los compuestos. En cualquier caso, las réplicas se consideran necesarias en la identificación de éxitos reproducibles.
Los nematicidas varían en su capacidad para inmovilizar Ditylenchus dipsaci
De los siete nematicidas caracterizados probados contra D. dipsaci, sólo Fluopyram exhibe una actividad robusta en el ensayo descrito aquí (Figura 1C). Esto es consistente con trabajos previos que muestran que D. dipsaci es tolerante a los nematicidas13,14. El fluopyram inhibe el complejo II de la cadena de transporte de electrones de manera selectiva de nematodos y es un nematicida comercial utilizado para controlar una variedad de PPN, incluidos Rotylenchulus reniformis y Meloidogyne incognita 4,21,22. El fluopyram y uno de los nematicidas que carecían de actividad a la concentración ensayada (Oxamyl)23 se investigaron con más detalle a través de un análisis dosis-respuesta con D. dipsaci. Fluopyram induce un efecto aparente dependiente de la dosis sobre la movilidad de D. dipsaci con un EC50 de 9,3 μM (con un intervalo de confianza del 95% entre 8,2 y 10,5 μM) (Figura 2A,B). Este resultado se espera en base a los resultados publicados in vitro de Storelli et al., 202013. El oxamilo no tiene un efecto significativo sobre la movilidad hasta una concentración de 120 μM (p = 0,3632, prueba t no apareada) (Figura 2C,D).
El hidróxido de sodio mejora la sensibilidad del ensayo
En contraste con la actividad de natación casi continua de C. elegans en cultivo líquido18, los animales de D. dipsaci son dramáticamente menos móviles. Esto no es raro entre los nematodos parásitos en el cultivo16. Para ayudar a distinguir los gusanos "en reposo" de los gusanos enfermos, se utilizan 40 mM de NaOH en el punto final del ensayo para estimular el movimiento en aquellos individuos que son capaces (Figura 3)19,20. Esta técnica permite la identificación clara de pequeñas moléculas que inmovilizan gusanos, dado que todos los gusanos en los pozos de control negativos se mueven y producen un fondo excepcionalmente bajo de falsos positivos en la pantalla.
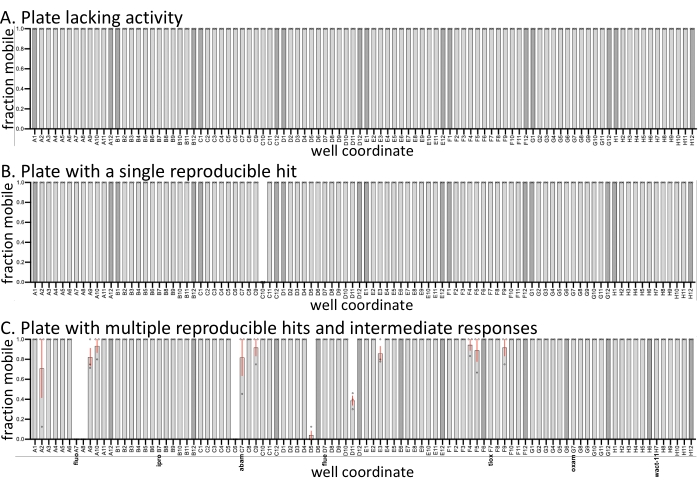
Figura 1: Ejemplos de salida de pantalla. Se realizaron tres réplicas biológicas ( círculos abiertos) con D. dipsaci contra las moléculas pequeñas (60 μM) en cada una de las tres placas mostradas. Las tres placas tienen un 0,6% de controles dmSO solo solventes (barras más oscuras). Excepto cuando se indique lo contrario con controles de solventes o nematicidas conocidos, los pocillos de las tres placas contienen compuestos similares a medicamentos relativamente no caracterizados comprados a vendedores (ver Burns et al., 2015)18. (A) Una placa de 96 pocillos de la biblioteca de moléculas pequeñas carece de cualquier molécula con bioactividad observable contra D. dipsaci. (B) Una placa de 96 pocillos de la biblioteca de moléculas pequeñas tiene una sola molécula que interrumpe reproduciblemente la movilidad de D. dipsaci . (C) Una placa de fármaco de 96 pocillos que contiene los nematicidas caracterizados fluopyram (fluo), iprodiona (ipro), abamectina (abam), fluensulfona (flue), tioxazafeno (tiox), oxamilo (oxam) y wact-11. Las barras de error representan el error estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.
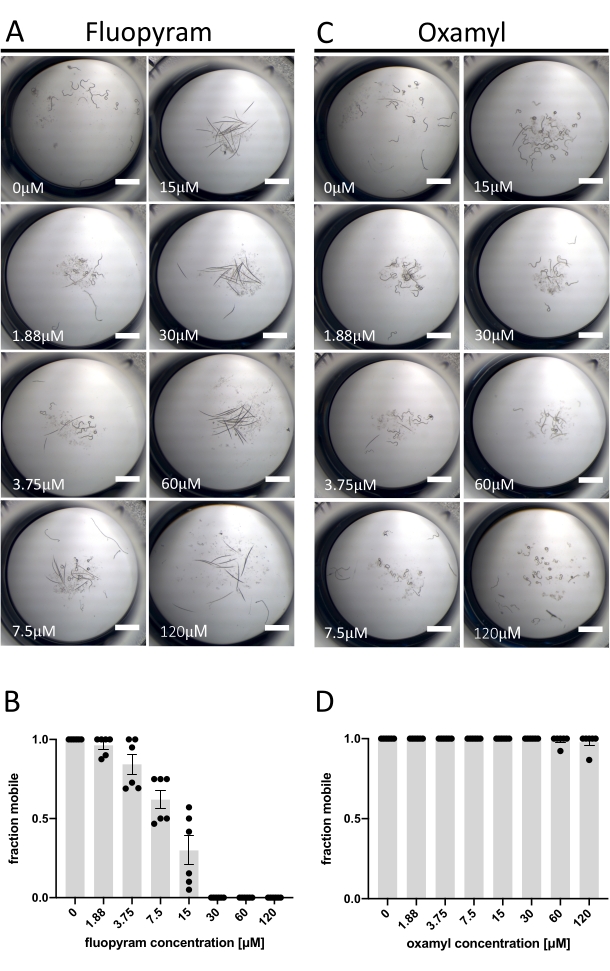
Figura 2: Ejemplo de resultados positivos y negativos utilizando el ensayo de movilidad. (A) Ejemplos de los fenotipos terminales después de la exposición de D. dipsaci a concentraciones crecientes de fluopyram después de 5 días antes de la adición de NaOH. (B) Un análisis dosis-respuesta del movimiento de D. dipsaci después de 5 días de exposición a las concentraciones indicadas de fluopyram. (C,D) Lo mismo que A, B, excepto por el oxamilo. Cada gráfico muestra los ensayos realizados en dos días separados con tres réplicas cada día. El eje y de cada gráfico indica la fracción móvil de los gusanos en cada pozo calculada como el número de animales que se mueven en relación con el número total de animales en el pozo. Las barras de error en ambos gráficos representan el error estándar de la media. La barra de escala representa 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
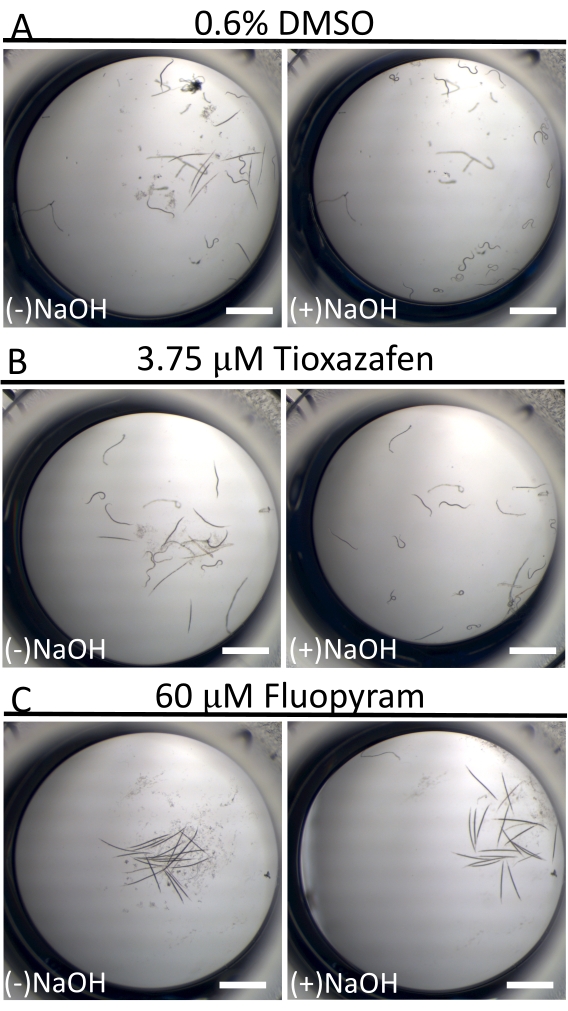
Figura 3: Movilidad de D. dipsaci después de agregar 40 mM de NaOH. El efecto de la adición de NaOH a las muestras de D. dipsaci en presencia de control solo con disolvente (A), tioxazafeno (B) o fluopyram (C) después de 5 días de co-incubación. La barra de escala representa 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Pasos críticos
A pesar de la simplicidad del protocolo, hay pasos críticos en el protocolo que merecen atención adicional para maximizar la probabilidad de éxito. Primero, el blanqueamiento excesivo de las semillas puede interrumpir su crecimiento. Por lo tanto, limitar el tiempo de las semillas en la solución blanqueadora a 20 minutos o menos es esencial. En segundo lugar, como se señaló anteriormente por Storelli et al., la salud aparente de los nematodos disminuye con el tiempo cuando se almacenan a 4 ° C16. El uso de los nematodos poco después de su recolección proporciona confianza adicional de que se pueden lograr condiciones óptimas de detección. Si fuera necesario un almacenamiento a largo plazo, asegúrese de que la tapa del tubo no esté apretada para permitir el intercambio de oxígeno. En tercer lugar, asegurarse de que los guisantes crezcan en las placas de NA durante el tiempo sugerido permite al experimentador juzgar qué semillas están contaminadas. Cuarto, el crecimiento excesivo de los guisantes en las placas de GA antes de agregar los nematodos debilitará la infección y reducirá el rendimiento de los nematodos. Finalmente, muchos factores que son difíciles de controlar pueden afectar los resultados de las pruebas de detección. Por lo tanto, es esencial realizar múltiples pantallas de réplica independientes en diferentes días e idealmente con PPN recolectadas de diferentes placas de cultivo para garantizar la reproducibilidad de los resultados.
Limitaciones del método
Una limitación del protocolo es que no sincroniza la etapa de desarrollo de los gusanos recolectados, que van desde juveniles hasta adultos. Por lo tanto, los golpes fuertes revelados por cualquier pantalla son probablemente efectivos en múltiples etapas. Sin embargo, el protocolo aumenta el riesgo de pasar por alto los golpes efectivos específicos de la etapa. Una segunda consideración es que el cribado in vitro debe considerarse el primer paso en una tubería de descubrimiento de nematicidas; Los ensayos basados en el suelo son una excelente adición a una tubería para probar la traducibilidad de los golpes.
Importancia y aplicación del protocolo
Los protocolos descritos en este documento son simples y fáciles de replicar. Además, este protocolo se ha aplicado con éxito a otros PPN en el laboratorio, incluido Pratylenchus penetrans, haciendo solo ligeras modificaciones. El desarrollo de medidas de control de PPN nuevas y seguras es esencial para garantizar la seguridad alimentaria mundial. Esto es especialmente cierto para especies como D. dipsaci que generalmente son tolerantes a una amplia variedad de nematicidas químicos actualmente aceptables13,14. Por lo tanto, los protocolos descritos aquí tienen el potencial de hacer una contribución importante a la salud humana a escala mundial.
Divulgaciones
Los autores declaran que no hay conflictos de intereses.
Agradecimientos
Los autores reconocen al Dr. Qing Yu (Agricultura y Agroalimentación de Canadá) por proporcionar la cultura Ditylenchus dipsaci y por su asesoramiento sobre los métodos de cultivo; Dr. Benjamin Mimee (Agricultura y Agroalimentación del Canadá) y Nathalie Dauphinais (Agricultura y Agroalimentación del Canadá) para obtener asesoramiento sobre el cultivo in vitro de nematodos parásitos de plantas; Dr. Andrew Burns y Sean Harrington por sugerencias útiles sobre el proyecto y el manuscrito. JK es un NSERC Alexander Graham Bell Canada Graduate Scholar. PJR cuenta con el apoyo de una subvención de proyecto del CIHR (313296). PJR es una Cátedra de Investigación de Canadá (Nivel 1) en Genética Química.
Materiales
| Name | Company | Catalog Number | Comments |
| 15 mL tube | Sarstedt | 62.554.205 | |
| 2 forceps | Almedic | 7747-A10-108 | |
| 2L beaker | Pyrex | CLS10002L | |
| 50mL beaker | Pyrex | CLS100050 | |
| 96 well plate | Sarstedt | 83.3924 | |
| aluminium foil | Alcan Plus | ||
| bacteriological agar | BioShop | AGR001.5 | |
| coffee filter | No name brand | 716 | |
| commercial bleach 6% | Lavo Pro 6 | DIN102358107 | |
| disposable petri dishes (10cm x 1.5cm) | Fisherbrand | FB0875712 | |
| disposable petri dishes (10cm x 2.5cm) | Sigma-Aldrich | Z358762 | |
| dissecting scope | Leica | Leica MZ75 | |
| DMSO | Sigma-Aldrich | 472301-500ML | |
| Funnel | VWR | 414004-270 | |
| Gamborg B5 | Sigma-Aldrich | G5893-10L | |
| glass petri dish | VWR | 75845-546 | |
| glass slide | MAGNA | 60-1200 | |
| Lint-Free Blotting Paper | V&P Scientific | VP 522-100 | |
| Low retention pipette tips (200uL) | LABFORCE | 1159M44 | |
| mutlichannel pipette | Eppendorf research plus | 3125000036 | |
| NaOH | Sigma-Aldrich | S8045-500G | |
| nutrient agar | Sigma-Aldrich | 70148-100G | |
| parafilm | Bemis | PM-996 | |
| pea seeds | Ontario Seed Company | D-1995-250G | |
| pin cleaning solutions | V&P Scientific | VP110A | |
| pinner | V&P Scientific | VP381N | |
| pinner rinse trays | V&P Scientific | VP 421 | |
| reagent reservoir with lid for multichannel pipettes | Sigma-Aldrich | BR703459 | |
| shaking incubator | New Brunswick Scientific | I26 | |
| sterile surgical blade | MAGNA | sb21-100-a | |
| stir bar | Fisherbrand | 2109 - 1451359 | |
| sucrose | BioShop | SUC507.1 |
Referencias
- Sasser, J. N., Freckman, D. W. A. world perspective on nematology: the role of the society. Vistas on nematology. , 7-14 (1987).
- Abad, P., et al. Genome sequence of the metazoan plant parasitic nematode Meloidogyne incognita. Nature Biotechnology. 26 (8), 909-915 (2008).
- Auwal, M., Hassan, T. H. P., Hongli, S., Jingwu, Z. Nematodes threats to global food security. Acta Agriculturae Scandinavica, Section B - Soil & Plant Science. 63 (5), 420-425 (2013).
- Chen, Z. X., Chen, S. Y., Dickson, D. W. Nematicides: Past and present uses. Nematology Vol 2, Nematode Management and Utilization. , 1179-1200 (2004).
- Desaeger, J., Wram, C., Zasada, I. New reduced-risk agricultural nematicides - and review. Journal of nematology. 52, (2020).
- Donely, N. The USA lags behind other agricultural nations in banning harmful pesticides. Environmental Health. 18 (1), 44 (2019).
- Polansek, T. Monsanto halts launch of chemical after users complain of rashes. Reuters. , (2017).
- Sturhan, D., Brzeski, M. W. Stem and bulb nematodes, Ditylenchus spp. Manual of agricultural nematology. , 423-464 (1991).
- The European and Mediterranean Plant Protection Organization (EPPO). Data Sheets on Quarantine Pests; Ditylenchus dipsaci. Prepared by CABI and EPPO for the EU under Contract 90/399003. The European and Mediterranean Plant Protection Organization (EPPO). , (2021).
- Quebec (Canada), Agriculture, Pêcherie et Alimentation Quebec. Réseau d'avertissements phytosanitaires (RAP). Avertissement Carotte, Céleri, Laitue, Oignon, Poireau [Warning carrot celery, lettuce, onion, leek]. Quebec (Canada), Agriculture, Pêcherie et Alimentation Quebec. , (2011).
- Abawi, G. S., Moktan, K. Bloat nematode problem on garlic: symptoms, distribution, and management guidelines. Department of Plant Pathology and Plant-microbe Biology, Geneva. , (2010).
- Taylor, R. Chapter 7. Nematodes and other worms. , 143-234 (2019).
- Storelli, A., Keiser, A., Eder, R., Jenni, S., Kiewnick, S. Evaluation of fluopyram for the control of Ditylenchus dipsaci in sugar beet. Journal of nematology. 52, 1-10 (2020).
- Oka, Y. Nematicidal activity of fluensulfone against some migratory nematodes under laboratory conditions. Pest Management Science. 70, 1850 (2014).
- Poirier, S., Dauphinais, N., Van Der Heyden, H., Véronneau, P. Y., Bélair, G., Gravel, V., Mimee, B. Host Range and Genetic Characterization of Ditylenchus dipsaci Populations from Eastern Canada. Plant disease. 103, 456-460 (2019).
- Storelli, A., Kiewnick, S., Daub, M., et al. Virulence and pathogenicity of four Ditylenchus dipsaci populations on sugar beet. Eur J Plant Pathol. 161, 63-71 (2021).
- Kühnhold, V., Kiewnick, S., Sikora, R. A. Development of an in vivo bioassay to identify sugar beet resistance to the stem nematode Ditylenchus dipsaci. Nematology. 8 (5), 641-645 (2006).
- Burns, A., Luciani, G., Musso, G. Caenorhabditis elegans is a useful model for anthelmintic discovery. Nat Communications. 6, (2015).
- Chen, S. Y., Dickson, D. W. A Technique for Determining Live Second-stage Juveniles of Heterodera glycines. Journal of nematology. 32, 117-121 (2000).
- Xiang, N., Lawrence, K. S. Optimization of In Vitro Techniques for Distinguishing between Live and Dead Second Stage Juveniles of Heterodera glycinesand Meloidogyne incognita. PLoS ONE. 11 (5), (2016).
- US EPA. Fluopyram. US EPA. , (2016).
- US EPA. Fluopyram. US EPA. , (2020).
- US EPA. Oxamyl Facts. Prevention, Pesticides and Toxic Substances. US EPA. , (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados