Method Article
Культивирование и скрининг растений Паразитическая нематода Ditylenchus dipsaci
В этой статье
Резюме
Настоящий протокол описывает надежный и простой метод культивирования, сбора и скрининга Ditylenchus dipsaci.
Аннотация
Растительно-паразитические нематоды (PPN) ежегодно уничтожают более 12% мировых продовольственных культур, что составляет примерно 157 миллиардов долларов США, потерянных ежегодно. С ростом мирового населения и ограниченными пахотными землями борьба с заражением PPN имеет решающее значение для производства продуктов питания. Проблема максимизации урожайности сельскохозяйственных культур усугубляется растущими ограничениями на эффективные пестициды из-за отсутствия селективности нематод. Следовательно, разработка новых и безопасных химических нематицидов имеет жизненно важное значение для продовольственной безопасности. В этом протоколе демонстрируется культура и коллекция видов PPN Ditylenchus dipsaci . D. dipsaci экономически вреден и относительно устойчив к большинству современных нематицидов. Текущая работа также объясняет, как использовать этих нематод на экранах для новых маломолекулярных нематицидов и отчетов о методологиях сбора и анализа данных. Продемонстрированный трубопровод обеспечивает пропускную способность тысяч соединений в неделю и может быть легко адаптирован для использования с другими видами PPN, такими как Pratylenchus penetrans. Методы, описанные в настоящем описании, могут быть использованы для обнаружения новых нематицидов, которые, в свою очередь, могут быть дополнительно развиты в высокоселективные коммерческие продукты, которые безопасно борются с PPN, чтобы помочь накормить все более голодный мир.
Введение
По оценкам, растительно-паразитические нематоды (PPN) несут ответственность за потерю 12,3% мирового производства продуктов питания и наносят ущерб в размере 157 миллиардов долларов в год 1,2,3. К сожалению, способность контролировать PPN ослабевает, потому что эффективные химические нематициды были запрещены или сталкиваются с растущими ограничениями из-за безопасности человека и экологических проблем. Это в первую очередь связано с плохой селективностью нематод предыдущих поколений пестицидов4. За последние 25 лет шесть новых химических нематицидов были опробованы или выведены на рынок5. Один из них уже был запрещен в Европе, а другой был прекращен на предмет его воздействия на здоровье человека 6,7. Следовательно, существует острая потребность в новых нематицидах, которые являются высокоселективными для PPN.
Стеблевая и луковичная нематода, Ditylenchus dipsaci (D. dipsaci) является экономически эффективным PPN4. D. dipsaci заражает почти 500 видов растений в 30 биологических расах и нацелена на некоторые из наиболее важных в сельскохозяйственном отношении культур, таких как рожь, овес, чеснок, лук и лук-порей 8,9. Например, D. dipsaci недавно бичевал чесночные поля в Онтарио и Квебеке, в результате чего потери составили до 90%10,11. Его географическое распространение почти вездесуще и включает Америку (включая Калифорнию и Флориду), Европу, большую часть Азии (включая Китай) и Океанию9. D. dipsaci представляет собой мигрирующий эндопаразит, который входит в устьица на листьях или ранах и чечевицах, где они высвобождают ферменты для разрушения клеточной стенки12. Усугубляя воздействие D. dipsaci на сельскохозяйственные культуры, ущерб, вызванный PPN, делает растение восприимчивым к вторичной инфекции11. К сожалению, D. dipsaci демонстрирует высокие уровни толерантности к современным нематицидам по сравнению с другими штаммами нематод13,14.
Этот протокол описывает культивирование D. dipsaci и его использование в крупномасштабных экранах для малых молекул-кандидатов нематицидов. Вкратце, популяции D. dipsaci поддерживаются и расширяются на растениях гороха, культивируемых в стерильных средах Gamborg B-5 (GA)15. Прежде чем выращивать ростки семян на среде GA, семена должны быть стерилизованы через серию промывок и покрыты питательным агаром (NA), чтобы проверить наличие загрязнения. Стерилизация семян необходима для обнаружения бактериальных и грибковых загрязнений, которые могут присутствовать. Незагрязненные семена затем переносятся на пластины GA, где семенные ростки будут расти при подготовке к инфекции. Пластины GA, содержащие семенные ростки, заражаются нематодами из предыдущей культуральной пластины путем переноса куска агара, содержащего корневую ткань, на свежие пластины. Через 6-8 недель нематоды извлекаются из среды GA и фильтруются через воронку с фильтром кофе в стакан для сбора. Нематоды могут быть использованы в различных биоанализах после того, как будет собрано подходящее количество. Метод, описанный в этом протоколе, генерирует приблизительно 15 000 D. dipsaci на культуральную пластину. Альтернативные протоколы культивирования D. dipsaci были опубликованы16,17.
Здесь также описан скрининговый анализ малых молекул in vitro, основанный на предыдущей работе18. В качестве показателя здоровья червей подвижность 20 нематод на лунку исследуется после 5 дней воздействия малых молекул. Чтобы лучше визуализировать подвижность червей, NaOH добавляется для увеличения движения живых червей19,20. Этот протокол позволяет проводить скрининг со средней пропускной способностью и предоставляет ценные данные для оценки нематицидного потенциала малых молекул. Если используется другой метод сбора нематод16,17, то, тем не менее, может быть реализована методология скрининга малых молекул, описанная в настоящем описании.
протокол
Штамм D. dipsaci G-137, используемый для настоящей работы, был собран из чеснока Fish Lake 4 Variety в округе Принца Эдуарда и был предоставлен Agriculture and Agri-food Canada. Если вы начинаете новую культуру, проконсультируйтесь с Poirier et al. для методологии вакцинации15.
1. Культивирование D. dipsaci
- Подготовьте носители и пластины в соответствии с ранее сообщенной работой15.
- Приготовьте 500 мл среды питательного агара (NA) с 23 г/л NA (см. Таблицу материалов) и сверхчистой водой. Используя стерильную технику, налейте 25 мл автоклавной среды NA в 20 одноразовых чашек Петри (диаметр 100 мм x глубина 15 мм). Дайте агару затвердеть при комнатной температуре (22 °C) с крышкой в течение ~2 ч и отложите для последующего использования.
- Приготовьте 500 мл среды Gamborg B-5 (GA), содержащей 3,2 г/л базальной среды GA с минимальной органикой, 20 г/л сахарозы, 15 г/л агара и дистиллированной воды (см. Таблицу материалов). Используя стерильную технику, налейте 50 мл автоклавной среды GA в 10 одноразовых чашек Петри (диаметр 100 мм x глубина 25 мм). Дайте агару затвердеть при комнатной температуре (22 °C) с крышкой в течение ~5 ч и храните в вертикальном положении при комнатной температуре в стерильном пакете до переноса ростков.
ПРИМЕЧАНИЕ: Избыточные пластины среды изготавливаются в случае загрязнения.
- Выполняют стерилизацию семян по методу, модифицированному по сравнению с предыдущей работой15.
- Автоклав один стакан на 2 л с перемешивателем, 2 щипцами, стеклянной чашкой Петри и 1 л дистиллированной воды. Приготовьте 200 мл 95% раствора EtOH и 200 мл 15% раствора коммерческого отбеливателя.
- Используйте семена гороха (см. Таблицу материалов). Вылейте 150 семян в стерильный 2-литровый стакан с перемешивателем рядом с пламенем горелки Бунзена на лабораторной скамье.
- Добавьте 200 мл 95% EtOH к семенам в стакане, энергично перемешайте на перемешиваемой пластине в течение 5 минут, а затем вылейте EtOH в контейнер для отходов.
- Налейте отбеливающий раствор в стакан, чтобы полностью погрузить семена. Энергично перемешайте на тарелке для перемешивания в течение 20 минут, затем вылейте отбеливатель в контейнер для отходов.
- Налейте дистиллированную воду в стакан для погружения семян и энергично перемешайте на тарелке для перемешивания в течение 20 минут. Повторите промывку водой три раза, выливая дистиллированную воду после каждой стирки. После окончательного промывания водой вылейте стерилизованные семена в стеклянную чашку Петри.
- Чтобы проверить наличие загрязнений, переложите 6 семян на каждую пластину NA размером 10 см (подготовленную на этапе 1.1.1) в ламинарный капюшон с использованием стерилизованных щипцов. Расположите семена по окружности тарелки (лучше всего подходят семена пухлости). Оберните пластины по отдельности в лабораторную пленку и инкубируйте в темноте в течение 3 дней при 26 °C.
ПРИМЕЧАНИЕ: Покрытие большего количества семян, чем необходимо, позволит выборочно использовать незагрязненные семена.
- Выполните перенос ростков, следуя приведенному ниже шагу.
- В ламинарной проточной вытяжке используйте стерилизованные щипцы для нанесения 2 незагрязненных семян на каждую пластину GA (подготовленную на этапе 1.1.2). Оберните пластины по отдельности в лабораторную пленку и инкубируйте при комнатной температуре в течение 7-10 дней, чтобы семена проросли.
- Выполняют выращивание in vitro по методу, модифицированному по сравнению с предыдущей работой15.
- Приготовить 50 мл 20 г/л раствора сахарозы. Фильтр стерилизуют раствором сахарозы и откладывают в сторону.
- В ламинарной вытяжке вырежьте кусок агара, содержащий корневую ткань (~ 2см3), из существующей культуральной пластины. Пипетка 500 мкл раствора сахарозы на новую пластину ГА с рассадой гороха и поместите кубик агара поверх сахарозы. Оберните пластины по отдельности в лабораторную пленку и храните культуру в коробке, выстланной алюминиевой фольгой, при комнатной температуре (~22 °C).
- Субкультура нематод на свежих пластинах ГА каждые 8-9 недель для поддержания культуры. Нематоды готовы к извлечению через ~8 недель.
2. Добыча и сбор D. dipsaci
- Выполните извлечение D. dipsaci , выполнив следующие действия.
- Автоклав - стакан 50 мл, воронка 80 мм, дистиллированная вода 150 мл и фильтры для кофе. Поместите воронку в стакан и выровняйте воронку стерильным кофейным фильтром.
- В ламинарном проточном капюшоне разрежьте агар и корневую ткань на 1см3 с помощью стерильного скальпеля. Переложите кубики агара в воронку с фильтром для кофе и медленно налейте дистиллированную воду на агар, чтобы смочить кофейный фильтр.
- Извлеките воронку с фильтром кофе из стакана и наполните стакан дистиллированной водой до тех пор, пока уровень воды не коснется нижней части фильтра после замены воронки с фильтром для кофе.
- Накройте воронку с фильтром для кофе и стакан алюминиевой фольгой. Оставьте на ночь (16 ч) на столешнице, чтобы черви могли перемещаться через кофейный фильтр в стакан для сбора.
ПРИМЕЧАНИЕ: Пластина культуры нематоды готова к экстракции, когда черви заползли в агар при осмотре с помощью рассеченного микроскопа. Как правило, пластина готова к экстракции через 6-8 недель после ее первоначальной прививки.
- Выполните сбор D. dipsaci.
ПРИМЕЧАНИЕ: На следующий день черви D. dipsaci осядут на дно стакана.- Снимите воронку с фильтром для кофе и аспирируйте верхние 40 мл воды из стакана для сбора; следите за тем, чтобы не нарушить работу осевших червей. Используя пластиковую серологическую пипетку объемом 10 мл, соберите оставшуюся жидкость в коническую центрифужную трубку объемом 15 мл.
ПРИМЕЧАНИЕ: Эта коллекция может быть использована непосредственно в анализах. Поместите при температуре 4 °C, если они не будут использоваться в течение 24 часов. Червей можно оставить на 3 дня при 4 °C без видимого влияния на подвижность. Удаление воронки может потревожить червей в стакане сбора. Дайте им осесть на дно перед сбором.
- Снимите воронку с фильтром для кофе и аспирируйте верхние 40 мл воды из стакана для сбора; следите за тем, чтобы не нарушить работу осевших червей. Используя пластиковую серологическую пипетку объемом 10 мл, соберите оставшуюся жидкость в коническую центрифужную трубку объемом 15 мл.
3. In vitro низкомолекулярный экран
- Подготовьте пробирные пластины, выполнив следующие действия.
- Налейте автоклавную дистиллированную воду в стерильный желоб и, используя многоканальную пипетку, дозируйте 40 мкл дистиллированной воды из корыта в каждую лунку плоскодонной 96-луночной пластины.
- Подготовьте инструмент для закрепления и добавьте химикаты
- Установите лотки для пиннера (см. Таблицу материалов) рядом с пламенем горелки Бунзена на лабораторном стенде. Добавьте в последовательные лотки для пиннера следующее: 25 мл раствора для очистки контактов, 35 мл 50% DMSO (в воде), 45 мл дистиллированной воды, 55 мл 70% EtOH и 65 мл 95% EtOH. Поместите один лист промокательной бумаги перед каждым лотком
- Очистите инструмент для закрепления, вставив штифты в чистящий раствор и переместив штифты вверх и вниз три раза (3x) в растворе. В этом протоколе «3x» и «10x» определяются как перемещение пиннера вверх и вниз в растворе три или десять раз соответственно. Промокните булавки на промокательной бумаге. Повторите эту процедуру еще раз.
- Затем промойте штифты 3x в дистиллированной воде, а затем промокайте штифты. Повторите процедуру еще раз.
- Наконец, промойте штифты 3x в 95% EtOH, а затем промокайте штифты. Повторите еще раз. Зажгите пиннер и дайте этанолу испариться.
- Добавьте химические вещества из 96-луночных химических пластин в пробирные пластины, прикрепив 3x к химической пластине, а затем переместив штифты 10X в пробирную пластину. Промокните на бумаге перед чистящим раствором.
- Очистите инструмент для закрепления между пластинами путем промывки в следующем порядке, промокнув между ними на промокательной бумаге: 3x в 50% DMSO (один раз), 3x в дистиллированной воде (один раз), 3x в 75% EtOH (один раз), 3x в 95% EtOH (дважды). Зажгите пиннер и дайте этанолу испариться.
- Повторите шаг 3.2.2 после завершения закрепления.
ПРИМЕЧАНИЕ: Скрининг проводили при конечной концентрации 60 мкМ.
- Добавление червей
- Подсчитайте количество нематод из коллекции, сначала повторно используя, а затем пипетировав 5 мкл, используя наконечники с низким уровнем удержания на слайде для наблюдения. Подсчитайте количество нематод в 5 мкл с помощью рассеченного микроскопа.
- Отрегулируйте концентрацию до 2 червей/мкл с помощью стерильной дистиллированной воды. Используя многоканальную пипетку и желоб, добавьте 10 мкл (~ 20 червей) к каждой скважине из 96-луночных плит.
ПРИМЕЧАНИЕ: Приблизительно 15 000 нематод D. dipsaci будут собраны на культуральную пластину с использованием описанного метода культивирования и сбора. На скважину используется двадцать червей, так как небольшое количество облегчает четкую визуализацию и учет подвижных и неподвижных.
- Отрегулируйте концентрацию до 2 червей/мкл с помощью стерильной дистиллированной воды. Используя многоканальную пипетку и желоб, добавьте 10 мкл (~ 20 червей) к каждой скважине из 96-луночных плит.
- Запечатайте пластины в лабораторную пленку и оберните влажным бумажным полотенцем. Поместите в коробку и прикрепите к липкой прокладке при 20 °C встряхивающий инкубатор, установленный при 200 об/мин. Убедитесь, что пластины стабилизированы в коробке, добавив дополнительное влажное бумажное полотенце, чтобы обеспечить минимальное движение пластин.
- Подсчитайте количество нематод из коллекции, сначала повторно используя, а затем пипетировав 5 мкл, используя наконечники с низким уровнем удержания на слайде для наблюдения. Подсчитайте количество нематод в 5 мкл с помощью рассеченного микроскопа.
4. Сбор и анализ данных
- Наблюдайте за пластинами на 5-й день под рассекающим микроскопом. Подсчитайте количество мобильных и общее количество D. dipsaci в системах контроля растворителей ДМСО и обработанных лекарственными средствами скважинах.
- Если черви относительно неподвижны, добавьте 2 мкл 1 М NaOH к конечной концентрации 40 мМ в лунку, чтобы стимулировать движение19,20.
ПРИМЕЧАНИЕ: После добавления NaOH черви будут перемещаться мгновенно и должны быть просмотрены в течение 5 минут. Количество мобильных червей и общее количество червей будет использоваться для расчета доли мобильных червей. Длина анализа может меняться в зависимости от цели экрана.
- Если черви относительно неподвижны, добавьте 2 мкл 1 М NaOH к конечной концентрации 40 мМ в лунку, чтобы стимулировать движение19,20.
- Рассчитайте долю мобильных червей. В экранах D. dipsaci скважины, которые воспроизводимо давали 0% мобильных червей, классифицируются как сильные попадания.
ПРИМЕЧАНИЕ: Длительное воздействие пластин на стадии рассеченных микроскопов избегается, поскольку источник света может нагревать пластины и вызывать переменное воздействие на биоанализ.
Результаты
Независимые реплики показывают воспроизводимые хиты
Чтобы проиллюстрировать ожидаемые различия между реплицированными экранами, средства и вариации подвижности образца строятся из трех репрезентативных пластин с недавнего экрана (рисунок 1). Три реплики экрана были выполнены в три разных дня. Все три пластины имеют отрицательные (только растворители) контрольные элементы (более темные полосы), а образцы в наборе содержали установленные нематициды. Остальные соединения взяты из пользовательской библиотеки, которая в настоящее время характеризуется в лаборатории Роя. По сравнению с аналогичными экранами, сделанными с C. elegans с теми же молекулами (SC, JK, PJR, неопубликованные результаты), частота попадания с D. dipsaci значительно ниже, и многие лекарственные пластины не проявляют активности (рисунок 1A). Некоторые пластины имеют полностью воспроизводимые попадания (рисунок 1B,C), в то время как другие различаются по активности (рисунок 1C). По сравнению с другими видами, прошедшими скрининг (не показанными), D. dipsaci показывает меньшую изменчивость в своей реакции на соединения. Несмотря на это, реплики считаются необходимыми для идентификации воспроизводимых хитов.
Nematicides различаются по своей способности обездвиживать Ditylenchus dipsaci
Из семи охарактеризованных нематицидов, протестированных против D. dipsaci, только Флуопирам проявляет устойчивую активность в анализе, описанном в настоящем описании (рисунок 1С). Это согласуется с предыдущей работой, показывающей, что D. dipsaci терпим к nematicides13,14. Флуопирам ингибирует комплекс II цепи переноса электронов нематодным селективным образом и является коммерческим нематицидом, используемым для управления различными PPN, включая Rotylenchulus reniformis и Meloidogyne incognita 4,21,22. Флуопирам и один из нематицидов, которые не проявляли активности при тестируемой концентрации (Oxamyl)23, были исследованы более подробно с помощью анализа «доза-реакция» с D. dipsaci. Флуопирам индуцирует кажущееся дозозависимое влияние на подвижность D. dipsaci при EC50 9,3 мкМ (с 95% доверительным интервалом от 8,2 до 10,5 мкМ) (рисунок 2A,B). Этот результат ожидается на основе опубликованных in vitro результатов Storelli et al., 202013. Оксамил не оказывает существенного влияния на подвижность до концентрации 120 мкМ (p = 0,3632, непарный t-тест) (рисунок 2C,D).
Гидроксид натрия улучшает чувствительность к анализу
В отличие от почти непрерывной плавательной активности C. elegans в жидкой культуре18, животные D. dipsaci значительно менее подвижны. Это не редкость среди паразитических нематод в культуре16. Чтобы помочь отличить «покоящихся» червей от больных червей, 40 мМ NaOH используется в конечной точке анализа для стимуляции движения у тех людей, которые способны (рисунок 3)19,20. Этот метод позволяет четко идентифицировать малые молекулы, которые обездвиживают червей, учитывая, что все черви в отрицательных контрольных скважинах движутся и дают исключительно низкий фон ложных срабатываний на экране.
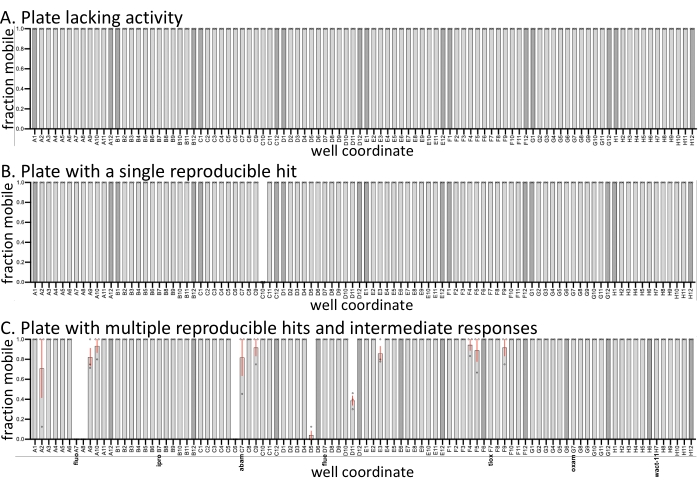
Рисунок 1: Примеры вывода на экран. Три биологические реплики (открытые круги) с D. dipsaci были выполнены против малых молекул (60 мкМ) в каждой из трех показанных пластин. Все три пластины имеют 0,6% dmso только растворителей (более темные полосы). Если не отмечено иное с помощью контроля растворителей или известных нематицидов, колодцы трех пластин содержат относительно нехарактеризованные лекарственно-подобные соединения, приобретенные у поставщиков (см. Burns et al., 2015)18. (A) В 96-луночной пластине из библиотеки малых молекул отсутствует какая-либо молекула с наблюдаемой биологической активностью против D. dipsaci. (B) Пластина из 96 лунок из библиотеки малых молекул имеет одну молекулу, которая воспроизводимо нарушает подвижность D. dipsaci . (C) 96-луночная лекарственная пластина, содержащая характерные нематициды флуопирам (флуо), ипродион (ипро), абамектин (абам), флуэнсульфон (дым), тиоксазафен (тиокс), оксамил (оксам) и вакт-11. Полосы погрешностей представляют стандартную погрешность среднего значения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
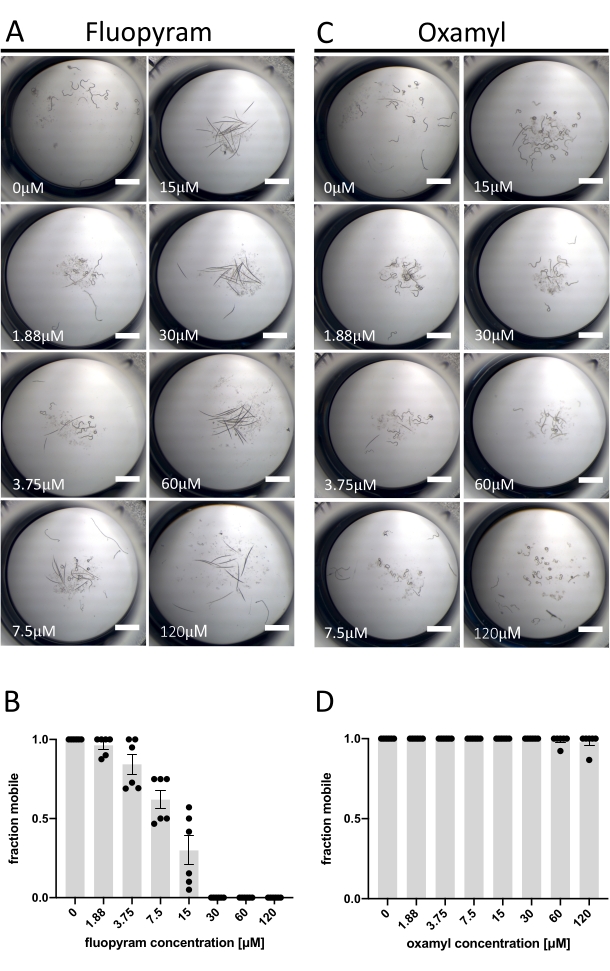
Рисунок 2: Пример положительных и отрицательных результатов с использованием анализа подвижности. (А) Примеры терминальных фенотипов после воздействия D. dipsaci на повышение концентрации флуопирама за 5 дней до добавления NaOH. (B) Анализ "доза-реакция" движения D. dipsaci после 5 дней воздействия указанных концентраций флуопирама. (С,Г) То же самое, что и А,В, за исключением оксамила. На каждом графике показаны испытания, проведенные в два отдельных дня с тремя репликами каждый день. Ось Y каждого графика показывает долю подвижности червей в каждой скважине, рассчитанную как количество движущихся животных относительно общего числа животных в скважине. Полосы погрешностей на обоих графиках представляют стандартную погрешность среднего значения. Шкала представляет собой 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
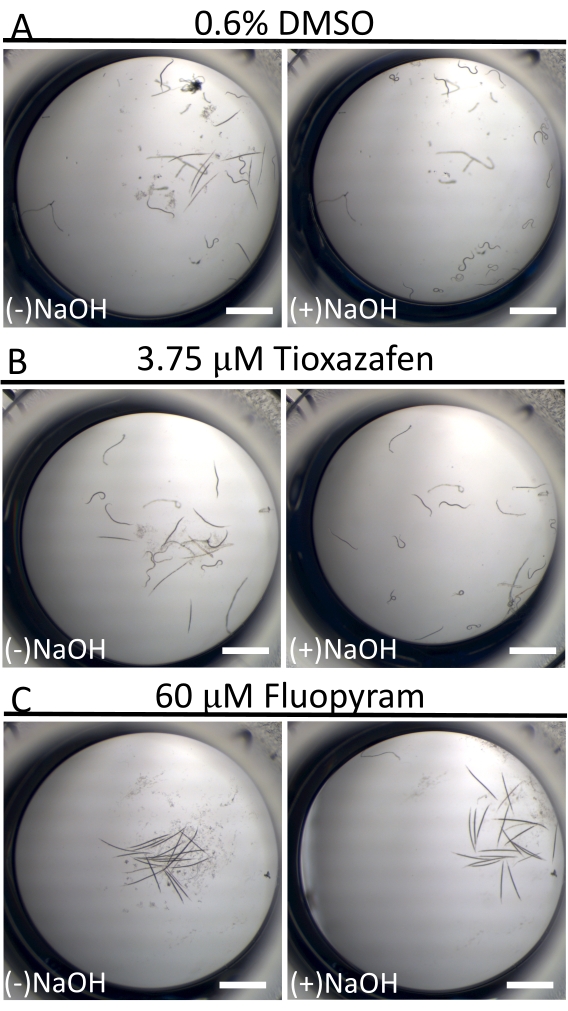
Рисунок 3: Подвижность D. dipsaci после добавления 40 мМ NaOH. Эффект добавления NaOH к образцам D. dipsaci в присутствии контроля только растворителя (A), тиоксазафена (B) или флуопирама (C) после 5 дней совместной инкубации. Шкала представляет собой 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Критические шаги
Несмотря на простоту протокола, в протоколе есть критические шаги, которые заслуживают дополнительного внимания, чтобы максимизировать вероятность успеха. Во-первых, перебеливание семян может нарушить их рост. Поэтому ограничение времени семян в отбеливающем растворе до 20 минут или менее имеет важное значение. Во-вторых, как ранее отмечали Storelli et al., кажущееся здоровье нематод со временем уменьшается при хранении при 4 ° C16. Использование нематод вскоре после их сбора дает дополнительную уверенность в том, что оптимальные условия скрининга могут быть достигнуты. Если требуется более длительное хранение, убедитесь, что крышка трубки не герметична, чтобы обеспечить кислородный обмен. В-третьих, обеспечение того, чтобы горох рос на пластинах NA в течение предполагаемого времени, позволяет экспериментатору судить, какие семена загрязнены. В-четвертых, разрастание гороха на пластинах GA перед добавлением нематод ослабит инфекцию и уменьшит выход нематод. Наконец, многие факторы, которые трудно контролировать, могут повлиять на результаты скрининга. Поэтому важно выполнять несколько независимых реплицированных экранов в разные дни и в идеале с PPN, собранными с разных культуральных пластин, чтобы обеспечить воспроизводимость результатов.
Ограничения метода
Ограничением протокола является то, что он не может синхронизировать стадию развития собранных червей, которые варьируются от молодых до взрослых. Следовательно, сильные удары, выявленные любым экраном, вероятно, эффективны на нескольких этапах. Тем не менее, протокол увеличивает риск пропустить эффективные удары по конкретным этапам. Второе соображение заключается в том, что скрининг in vitro следует рассматривать как первый шаг в конвейере обнаружения нематицидов; Анализы на основе почвы являются отличным дополнением к трубопроводу для проверки переводимости попаданий.
Значение и применение протокола
Протоколы, описанные в настоящем документе, просты и легко воспроизводятся. Кроме того, этот протокол был успешно применен к другим PPN в лаборатории, включая Pratylenchus penetrans, внеся лишь незначительные изменения. Разработка новых и безопасных мер контроля над PPN имеет важное значение для обеспечения глобальной продовольственной безопасности. Это особенно верно для таких видов, как D. dipsaci, которые, как правило, устойчивы к широкому спектру приемлемых в настоящее время химических нематицидов13,14. Таким образом, протоколы, изложенные здесь, могут внести важный вклад в здоровье человека в глобальном масштабе.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы выражают признательность д-ру Цин Ю (Сельское хозяйство и агропродовольственная Канада) за предоставление культуры Ditylenchus dipsaci и за консультации по методам культуры; д-р Бенджамин Мими (Сельское хозяйство и агропродовольственная Канада) и Натали Дофине (Сельское хозяйство и агропродовольственная Канада) за консультации по культуре in vitro растительно-паразитических нематод; Доктор Эндрю Бернс и Шон Харрингтон за полезные предложения по проекту и рукописи. JK является аспирантом NSERC Alexander Graham Bell Canada Graduate Scholar. PJR поддерживается грантом проекта CIHR (313296). PJR является канадской исследовательской кафедрой (Tier 1) в области химической генетики.
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL tube | Sarstedt | 62.554.205 | |
| 2 forceps | Almedic | 7747-A10-108 | |
| 2L beaker | Pyrex | CLS10002L | |
| 50mL beaker | Pyrex | CLS100050 | |
| 96 well plate | Sarstedt | 83.3924 | |
| aluminium foil | Alcan Plus | ||
| bacteriological agar | BioShop | AGR001.5 | |
| coffee filter | No name brand | 716 | |
| commercial bleach 6% | Lavo Pro 6 | DIN102358107 | |
| disposable petri dishes (10cm x 1.5cm) | Fisherbrand | FB0875712 | |
| disposable petri dishes (10cm x 2.5cm) | Sigma-Aldrich | Z358762 | |
| dissecting scope | Leica | Leica MZ75 | |
| DMSO | Sigma-Aldrich | 472301-500ML | |
| Funnel | VWR | 414004-270 | |
| Gamborg B5 | Sigma-Aldrich | G5893-10L | |
| glass petri dish | VWR | 75845-546 | |
| glass slide | MAGNA | 60-1200 | |
| Lint-Free Blotting Paper | V&P Scientific | VP 522-100 | |
| Low retention pipette tips (200uL) | LABFORCE | 1159M44 | |
| mutlichannel pipette | Eppendorf research plus | 3125000036 | |
| NaOH | Sigma-Aldrich | S8045-500G | |
| nutrient agar | Sigma-Aldrich | 70148-100G | |
| parafilm | Bemis | PM-996 | |
| pea seeds | Ontario Seed Company | D-1995-250G | |
| pin cleaning solutions | V&P Scientific | VP110A | |
| pinner | V&P Scientific | VP381N | |
| pinner rinse trays | V&P Scientific | VP 421 | |
| reagent reservoir with lid for multichannel pipettes | Sigma-Aldrich | BR703459 | |
| shaking incubator | New Brunswick Scientific | I26 | |
| sterile surgical blade | MAGNA | sb21-100-a | |
| stir bar | Fisherbrand | 2109 - 1451359 | |
| sucrose | BioShop | SUC507.1 |
Ссылки
- Sasser, J. N., Freckman, D. W. A. world perspective on nematology: the role of the society. Vistas on nematology. , 7-14 (1987).
- Abad, P., et al. Genome sequence of the metazoan plant parasitic nematode Meloidogyne incognita. Nature Biotechnology. 26 (8), 909-915 (2008).
- Auwal, M., Hassan, T. H. P., Hongli, S., Jingwu, Z. Nematodes threats to global food security. Acta Agriculturae Scandinavica, Section B - Soil & Plant Science. 63 (5), 420-425 (2013).
- Chen, Z. X., Chen, S. Y., Dickson, D. W. Nematicides: Past and present uses. Nematology Vol 2, Nematode Management and Utilization. , 1179-1200 (2004).
- Desaeger, J., Wram, C., Zasada, I. New reduced-risk agricultural nematicides - and review. Journal of nematology. 52, (2020).
- Donely, N. The USA lags behind other agricultural nations in banning harmful pesticides. Environmental Health. 18 (1), 44 (2019).
- Polansek, T. Monsanto halts launch of chemical after users complain of rashes. Reuters. , (2017).
- Sturhan, D., Brzeski, M. W. Stem and bulb nematodes, Ditylenchus spp. Manual of agricultural nematology. , 423-464 (1991).
- The European and Mediterranean Plant Protection Organization (EPPO). Data Sheets on Quarantine Pests; Ditylenchus dipsaci. Prepared by CABI and EPPO for the EU under Contract 90/399003. The European and Mediterranean Plant Protection Organization (EPPO). , (2021).
- Quebec (Canada), Agriculture, Pêcherie et Alimentation Quebec. Réseau d'avertissements phytosanitaires (RAP). Avertissement Carotte, Céleri, Laitue, Oignon, Poireau [Warning carrot celery, lettuce, onion, leek]. Quebec (Canada), Agriculture, Pêcherie et Alimentation Quebec. , (2011).
- Abawi, G. S., Moktan, K. Bloat nematode problem on garlic: symptoms, distribution, and management guidelines. Department of Plant Pathology and Plant-microbe Biology, Geneva. , (2010).
- Taylor, R. Chapter 7. Nematodes and other worms. , 143-234 (2019).
- Storelli, A., Keiser, A., Eder, R., Jenni, S., Kiewnick, S. Evaluation of fluopyram for the control of Ditylenchus dipsaci in sugar beet. Journal of nematology. 52, 1-10 (2020).
- Oka, Y. Nematicidal activity of fluensulfone against some migratory nematodes under laboratory conditions. Pest Management Science. 70, 1850 (2014).
- Poirier, S., Dauphinais, N., Van Der Heyden, H., Véronneau, P. Y., Bélair, G., Gravel, V., Mimee, B. Host Range and Genetic Characterization of Ditylenchus dipsaci Populations from Eastern Canada. Plant disease. 103, 456-460 (2019).
- Storelli, A., Kiewnick, S., Daub, M., et al. Virulence and pathogenicity of four Ditylenchus dipsaci populations on sugar beet. Eur J Plant Pathol. 161, 63-71 (2021).
- Kühnhold, V., Kiewnick, S., Sikora, R. A. Development of an in vivo bioassay to identify sugar beet resistance to the stem nematode Ditylenchus dipsaci. Nematology. 8 (5), 641-645 (2006).
- Burns, A., Luciani, G., Musso, G. Caenorhabditis elegans is a useful model for anthelmintic discovery. Nat Communications. 6, (2015).
- Chen, S. Y., Dickson, D. W. A Technique for Determining Live Second-stage Juveniles of Heterodera glycines. Journal of nematology. 32, 117-121 (2000).
- Xiang, N., Lawrence, K. S. Optimization of In Vitro Techniques for Distinguishing between Live and Dead Second Stage Juveniles of Heterodera glycinesand Meloidogyne incognita. PLoS ONE. 11 (5), (2016).
- US EPA. Fluopyram. US EPA. , (2016).
- US EPA. Fluopyram. US EPA. , (2020).
- US EPA. Oxamyl Facts. Prevention, Pesticides and Toxic Substances. US EPA. , (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены