Method Article
Culturing e Triagem da Planta Parasitic Nematode Ditylenchus dipsaci
Neste Artigo
Resumo
O presente protocolo descreve um método confiável e direto para a colheita, coleta e triagem de ditylenchus dipsaci.
Resumo
Os nematoides parasiticos vegetais (PPNs) destroem mais de 12% das culturas alimentares globais a cada ano, o que equivale a cerca de 157 bilhões de dólares (USD) perdidos anualmente. Com uma população global crescente e terras aráveis limitadas, controlar a infestação de PPN é fundamental para a produção de alimentos. O desafio de maximizar a produção agrícola são as restrições crescentes a pesticidas eficazes devido à falta de seletividade de nematoides. Por isso, desenvolver nematicides químicos novos e seguros é vital para a segurança alimentar. Neste protocolo, demonstram-se a cultura e a coleta da espécie PPN Ditylenchus dipsaci . D. dipsaci é economicamente prejudicial e relativamente resistente à maioria dos nematicídeos modernos. O trabalho atual também explica como usar esses nematoides em telas para nematicides de pequenas moléculas e relatórios sobre metodologias de coleta e análise de dados. O gasoduto demonstrado oferece um rendimento de milhares de compostos por semana e pode ser facilmente adaptado para uso com outras espécies de PPN, como penetrantes de Pratylenchus. As técnicas aqui descritas podem ser usadas para descobrir novos nematicides, que, por sua vez, podem ser desenvolvidos em produtos comerciais altamente seletivos que combatem com segurança as PPNs para ajudar a alimentar um mundo cada vez mais faminto.
Introdução
Estima-se que os nematoides parasiticos vegetais (PPNs) sejam responsáveis pela perda de 12,3% da produção global de alimentos e causem cerca de 157 bilhões de dólares em danos anualmente 1,2,3. Infelizmente, a capacidade de controlar as PPNs está diminuindo porque nematicides químicos eficazes foram banidos ou estão enfrentando restrições crescentes devido à segurança humana e preocupações ambientais. Isso se deve principalmente à pouca seletividade nematoide das gerações anteriores de pesticidas4. Nos últimos 25 anos, seis novos nematicides químicos foram pilotados ou introduzidos no mercado5. Um deles já foi banido na Europa, e outro foi descontinuado enquanto era investigado por seu impacto no calor humano 6,7. Portanto, há uma necessidade premente de novos nematicides que são altamente seletivos para PPNs.
O nematoide de caule e bulbo, Ditylenchus dipsaci (D. dipsaci) é um PPN4. D. Dipsaci, que infecta cerca de 500 espécies de plantas em 30 raças biológicas e tem como alvo algumas das culturas mais importantes agrícolas, como centeio, aveia, alho, cebola e alho-poró 8,9. Por exemplo, d. dipsaci recentemente esbanjou campos de alho em Ontário e Quebec, resultando em perdas de até 90%10,11. Sua distribuição geográfica é quase onipresente e inclui as Américas (incluindo Califórnia e Flórida), Europa, grande parte da Ásia (incluindo a China) e Oceania9. D. dipsaci é um endoparasita migratório que entra na etomata em folhas ou feridas e lenticels onde liberam enzimas para quebrar a paredecelular 12. Compondo o impacto do D. dipsaci nas culturas, os danos causados pela PPN tornam a planta suscetível à infecção secundária11. Infelizmente, d. dipsaci mostra altos níveis de tolerância aos nematicides atuais em comparação com outras cepas de nematoides13,14.
Este protocolo descreve a cultura de D. dipsaci, e seu uso em telas de grande escala para nematicides candidatos a pequenas moléculas. Resumidamente, as populações de D. dipsaci são mantidas e expandidas em plantas de ervilha cultivadas na mídia Gamborg B-5 (GA)estéril 15. Antes de cultivar brotos de sementes em meio GA, as sementes devem ser esterilizadas através de uma série de lavagens e banhadas em ágar nutriente (NA) para verificar se há contaminação. A esterilização de sementes é essencial para detectar contaminantes bacterianos e fúngicos que possam estar presentes. As sementes não contaminadas são então transferidas para placas de GA, onde brotos de sementes crescerão em preparação para a infecção. As placas de GA contendo brotos de sementes são infectadas com nematoides de uma placa de cultura anterior, transferindo um pedaço de ágar contendo tecido radicular para as placas frescas. Após 6-8 semanas, os nematoides são extraídos da mídia GA e são filtrados através de um funil revestido de filtro de café em um béquer de coleção. Os nematoides podem ser usados em vários bioensadores uma vez que um número adequado tenha sido coletado. A técnica descrita neste protocolo gera aproximadamente 15.000 D. dipsaci por placa de cultura. Protocolos alternativos para cultivar D. dipsaci foram publicados 16,17.
Um ensaio de triagem de pequenas moléculas in vitro baseado no trabalho anterior18 também é descrito aqui. Como um proxy da saúde dos vermes, a mobilidade de 20 nematoides por poço é examinada após 5 dias de exposição a pequenas moléculas. Para melhor visualizar a mobilidade dos vermes, o NaOH é adicionado para aumentar o movimento de vermes vivos19,20. Este protocolo permite a triagem de rendimento médio e fornece dados valiosos para avaliar o potencial nematicida de pequenas moléculas. Se uma técnica diferente de coleta de nematoide for utilizada16,17, a metodologia de triagem de pequenas moléculas descrita aqui pode, no entanto, ser implementada.
Protocolo
A cepa D. dipsaci G-137 usada para o presente trabalho foi coletada do Fish Lake 4 Variety alho no Condado de Prince Edward e foi fornecida pela Agricultura e Agro-alimentos do Canadá. Se iniciar uma nova cultura, consulte Poirier et al. para a metodologia de inoculação15.
1. Cultivo de D. dipsaci
- Prepare a mídia e as placas seguindo o trabalho relatado anteriormente15.
- Prepare 500 mL de mídia de ágar nutriente (NA) com 23 g/L de NA (ver Tabela de Materiais) e água ultrauso. Utilizando técnica estéril, despeje 25 mL de mídia NA autoclaved em 20 placas descartáveis de Petri (100 mm de diâmetro x 15 mm de profundidade). Deixe o ágar solidificar à temperatura ambiente (22 °C) com a tampa ligada por ~2 h e reserve para uso posterior.
- Prepare 500 mL de mídia Gamborg B-5 (GA) contendo 3,2 g/L de meio basal GA com orgânicos mínimos, 20 g/L de sacarose, 15 g/L de ágar e água destilada (ver Tabela de Materiais). Utilizando técnica estéril, despeje 50 mL de mídia GA autoclaved em 10 placas descartáveis de Petri (100 mm de diâmetro x 25 mm de profundidade). Deixe o ágar solidificar à temperatura ambiente (22 °C) com a tampa ligada por ~5 h e armazenar em pé a temperatura ambiente em um saco estéril até a transferência do broto.
NOTA: O excesso de placas de mídia é feito no caso de contaminação ocorrer.
- Realizar esterilização de sementes seguindo um método modificado de um trabalho anterior15.
- Autoclave um béquer 2 L com uma barra de rebuliço, 2 fórceps, uma placa de petri de vidro, e 1 L de água destilada. Prepare 200 mL de solução etoh de 95% e 200 mL de uma solução de alvejante comercial de 15%.
- Use sementes de ervilha (ver Tabela de Materiais). Despeje 150 sementes em um béquer 2 L estéril com uma barra de agitação perto de uma chama de bico de Bunsen em um banco de laboratório.
- Adicione 200 mL de 95% de EtOH às sementes dentro do béquer, mexa vigorosamente na placa de agitação por 5 minutos e, em seguida, despeje o EtOH em um recipiente de resíduos.
- Despeje a solução de alvejante no béquer para imergir completamente as sementes. Mexa vigorosamente em uma placa de mexida por 20 minutos e despeje alvejante em um recipiente de resíduos.
- Despeje água destilada no béquer para mergulhar as sementes e mexa vigorosamente em um prato de mexida por 20 minutos. Repita as lavagens de água três vezes, derramando água destilada após cada lavagem. Após a lavagem final da água, despeje sementes esterilizadas na placa de vidro Petri.
- Para verificar se há contaminação, transfira 6 sementes para cada placa NA de 10 cm (preparada na etapa 1.1.1) no capô de inundação laminar usando fórceps esterilizados. Disponha as sementes ao redor da circunferência da placa (as sementes de plumper funcionam melhor). Enrole as placas individualmente em filme de embalagem de laboratório e incubar no escuro por 3 dias a 26 °C.
NOTA: O revestimento de mais sementes do que o necessário permitirá o uso seletivo de sementes não contaminadas.
- Realize a transferência de broto seguindo o passo abaixo.
- Em uma coifa de fluxo laminar, use fórceps esterilizados para emplacar 2 sementes não contaminadas em cada placa de GA (preparada na etapa 1.1.2). Enrole as placas individualmente em filme de embalagem de laboratório e incubar à temperatura ambiente por 7-10 dias para permitir que as sementes brotem.
- Realize a criação in vitro seguindo um método modificado de um trabalho anterior15.
- Prepare 50 mL de solução de sacarose de 20 g/L. Filtrar esterilizar a solução de sacarose e reserve.
- Em uma capa de fluxo laminar, corte um pedaço de ágar contendo tecido radicular (~2 cm3) de uma placa de cultura existente. Pipeta 500 μL de solução de sacarose na nova placa GA com mudas de ervilha e coloque cubo de ágar em cima de sacarose. Enrole as placas individualmente em filme de embalagem de laboratório e mantenha a cultura em uma caixa forrada com papel alumínio à temperatura ambiente (~22 °C).
- Nematoides de subcultura em placas de GA frescas a cada 8-9 semanas para manter a cultura. Nematoides estão prontos para serem extraídos após ~8 semanas.
2. Extração e coleta de D. dipsaci
- Realize a extração de D. dipsaci seguindo as etapas abaixo.
- Autoclave um béquer de 50 mL, um funil de 80 mm, 150 mL de água destilada e filtros de café. Coloque o funil no béquer e forque o funil com filtro de café estéril.
- Em uma capa de fluxo laminar, corte o ágar e o tecido radicular em 1 cm3 usando um bisturi estéril. Transfira os cubos de ágar para o funil revestido de filtro de café e despeje lentamente água destilada no ágar para umedecer o filtro de café.
- Remova o funil forrado de filtro de café do béquer e encha o béquer com água destilada até que o nível da água esteja apenas tocando o fundo do filtro assim que o funil forrado pelo filtro de café for substituído.
- Cubra o funil forrado de filtro de café e o béquer com papel alumínio. Deixe durante a noite (16 h) no banco para permitir que os vermes se movam através do filtro de café para o béquer de coleta.
NOTA: Uma placa de cultura nematode está pronta para extração quando os vermes rastejaram para dentro do ágar quando examinados com um microscópio de dissecção. Normalmente, uma placa está pronta para extração 6-8 semanas após sua inoculação inicial.
- Realize a coleção de D. dipsaci.
NOTA: No dia seguinte, os vermes D. dipsaci terão se estabelecido no fundo do béquer.- Remova o funil forrado do filtro de café e aspire os 40 mL de água superiores do béquer de coleta; garantir não interromper os vermes resolvidos. Usando uma pipeta sorológica de plástico de 10 mL, colete o líquido restante em um tubo de centrífuga cônica de 15 mL.
NOTA: Esta coleção pode ser usada diretamente em ensaios. Coloque a 4 °C se não forem utilizados dentro de 24 horas. Os vermes podem ser deixados por 3 dias a 4 °C sem impacto visível na mobilidade. Remover o funil pode perturbar os vermes no béquer de coleta. Deixe-os se acomodarem até o fundo antes de coletar.
- Remova o funil forrado do filtro de café e aspire os 40 mL de água superiores do béquer de coleta; garantir não interromper os vermes resolvidos. Usando uma pipeta sorológica de plástico de 10 mL, colete o líquido restante em um tubo de centrífuga cônica de 15 mL.
3. Tela de molécula pequena in vitro
- Prepare as placas de ensaio seguindo os passos abaixo.
- Despeje água destilada autoclavada em um cocho estéril e, usando uma pipeta multicanal, dispense 40 μL de água destilada do cocho em cada poço de uma placa de fundo plano de 96 poços.
- Prepare a ferramenta de fixação e adicione os produtos químicos
- Configure bandejas de pinner (ver Tabela de Materiais) perto de uma chama de queimador Bunsen em um banco de laboratório. Adicione o seguinte às sucessivas bandejas de pinner: 25 mL de solução de limpeza de pinos, 35 mL de 50% DMSO (em água), 45 mL de água destilada, 55 mL de 70% EtOH e 65 mL de 95% EtOH. Coloque um pedaço de papel manchado na frente de cada bandeja
- Limpe a ferramenta de fixação, emersing os pinos na solução de limpeza e movendo os pinos para cima e para baixo três vezes (3x) na solução. Neste protocolo, '3x' e '10x' são definidos como mover o pinner para cima e para baixo em uma solução três ou dez vezes, respectivamente. Borriete os pinos no papel de mancha. Repita este procedimento mais uma vez.
- Em seguida, enxágue os pinos 3x em água destilada, seguido de manchas nos pinos. Repita o procedimento mais uma vez.
- Por fim, enxágue os pinos 3x em 95% EtOH, seguido de manchas nos pinos. Repita mais uma vez. Pegue o pinner e deixe o etanol evaporar.
- Adicione produtos químicos das placas químicas de 96 poços para assar placas, fixando 3x na placa química e, em seguida, transferindo os pinos 10X para a placa de ensaio. Borrida no papel em frente à solução de limpeza.
- Ferramenta de fixação limpa entre as placas lavando na seguinte ordem, manchando no meio no papel de mancha: 3x em 50% DMSO (uma vez), 3x em água destilada (uma vez), 3x em 75% EtOH (uma vez), 3x em 95% EtOH (duas vezes). Inflama o pinner e permite que o etanol evapore.
- Repita o passo 3.2.2 quando toda a fixação estiver concluída.
NOTA: A triagem foi realizada em uma concentração final de 60 μM.
- Adição de vermes
- Conte o número de nematoides da coleção primeiro resususundo e, em seguida, pipetting 5 μL usando dicas de baixa retenção em um slide para observação. Conte o número de nematoides em 5 μL usando um microscópio de dissecção.
- Ajuste a concentração para 2 vermes/μL usando água destilada estéril. Usando uma pipeta multicanal e um cocho, adicione 10 μL (~20 worms) a cada poço das placas de 96 poços.
NOTA: Aproximadamente 15.000 nematoides d. dipsaci serão coletados por placa de cultura usando o método de cultura e coleta descrito. Vinte worms são usados por poço porque o pequeno número facilita a visualização clara e a contabilidade dos móveis e imóveis.
- Ajuste a concentração para 2 vermes/μL usando água destilada estéril. Usando uma pipeta multicanal e um cocho, adicione 10 μL (~20 worms) a cada poço das placas de 96 poços.
- Sele as placas em filme de embalagem de laboratório e enrole com uma toalha de papel úmida. Coloque na caixa e afixe em uma almofada pegajosa em 20 °C de incubadora de agitação a 200 rpm. Certifique-se de que as placas estejam estabilizadas na caixa adicionando uma toalha de papel umedecido extra para garantir o mínimo de movimento das placas.
- Conte o número de nematoides da coleção primeiro resususundo e, em seguida, pipetting 5 μL usando dicas de baixa retenção em um slide para observação. Conte o número de nematoides em 5 μL usando um microscópio de dissecção.
4. Coleta e análise de dados
- Observe as placas no dia 5 sob um microscópio dissecando. Conte o número de móveis e número total de D. dipsaci em controles de solventes DMSO e poços tratados com drogas.
- Se os vermes estiverem relativamente imóveis, adicione 2 μL de 1 M NaOH a uma concentração final de 40 mM ao poço para estimular o movimento19,20.
NOTA: Depois de adicionar NaOH, os worms se moverão instantaneamente e precisarão ser vistos dentro de 5 minutos. O número de worms móveis e o número total de worms serão usados para calcular a proporção de worms móveis. O comprimento do ensaio pode mudar dependendo da pontaria da tela.
- Se os vermes estiverem relativamente imóveis, adicione 2 μL de 1 M NaOH a uma concentração final de 40 mM ao poço para estimular o movimento19,20.
- Calcule a proporção de vermes móveis. Nas telas D. dipsaci , poços que reproduzivelmente renderam 0% de vermes móveis são categorizados como fortes hits.
NOTA: A exposição prolongada de placas no estágio dos microscópios de dissecção é evitada porque a fonte de luz pode aquecer as placas e induzir efeitos variáveis no bioensaio.
Resultados
Réplicas independentes revelam hits reprodutíveis
Para ilustrar a variação esperada entre as telas de replicação, os meios e a variação na mobilidade amostral são plotados a partir de três placas representativas de uma tela recente (Figura 1). Três réplicas da tela foram realizadas em três dias diferentes. Todas as três placas possuem controles negativos (somente solventes) (barras mais escuras) e as amostras dentro do conjunto continham nematicides estabelecidos. Os compostos restantes são de uma biblioteca personalizada que está sendo caracterizada no laboratório Roy. Em comparação com telas similares feitas com C. elegans com as mesmas moléculas (SC, JK, PJR, resultados inéditos), a taxa de acerto com D. dipsaci é significativamente menor, e muitas placas de drogas não apresentam atividade (Figura 1A). Algumas placas têm acertos totalmente reprodutíveis (Figura 1B,C), enquanto outras variam em atividade (Figura 1C). Em relação a outras espécies examinadas (não mostradas), d. dipsaci mostra menor variabilidade em sua resposta aos compostos. Independentemente disso, as réplicas são consideradas necessárias na identificação de hits reprodutíveis.
Os nematicides variam em sua capacidade de imobilizar ditylenchus dipsaci
Dos sete nematicides caracterizados testados contra D. dipsaci, apenas Fluopyram apresenta atividade robusta no ensaio descrito aqui (Figura 1C). Isso é consistente com trabalhos anteriores mostrando que d. dipsaci é tolerante com nematicides13,14. Fluopyram inibe o complexo II da cadeia de transporte de elétrons de forma nematoide-seletiva e é um nematicida comercial usado para controlar uma variedade de PPNs, incluindo Rotylenchulus reniformis e Meloidogyne incognita 4,21,22. Fluopyram e um dos nematicides que não tinham atividade na concentração testada (Oxamyl)23 foram investigados com mais detalhes através de uma análise dose-resposta com D. dipsaci. O fluopyram induz um efeito aparente dependente de dose na mobilidade D. dipsaci com um EC50 de 9,3 μM (com um intervalo de confiança de 95% entre 8,2 e 10,5 μM) (Figura 2A,B). Este resultado é esperado com base nos resultados in vitro publicados da Storelli et al., 202013. Oxamyl não tem efeito significativo na mobilidade até uma concentração de 120 μM (p = 0,3632, t-test não remunerado) (Figura 2C,D).
Hidróxido de sódio melhora sensibilidade ao ensaio
Em contraste com a atividade de natação quase contínua de C. elegans na cultura líquida18, os animais D. dipsaci são dramaticamente menos móveis. Isso não é incomum entre nematoides parasitas na cultura16. Para ajudar a distinguir vermes "descansando" de vermes doentes, 40 mM de NaOH é usado no ponto final do ensaio para estimular o movimento naqueles indivíduos capazes (Figura 3)19,20. Esta técnica permite a identificação clara de pequenas moléculas que imobilizam vermes, dado que todos os vermes em poços de controle negativo se movem e produzem um fundo excepcionalmente baixo de falsos positivos na tela.
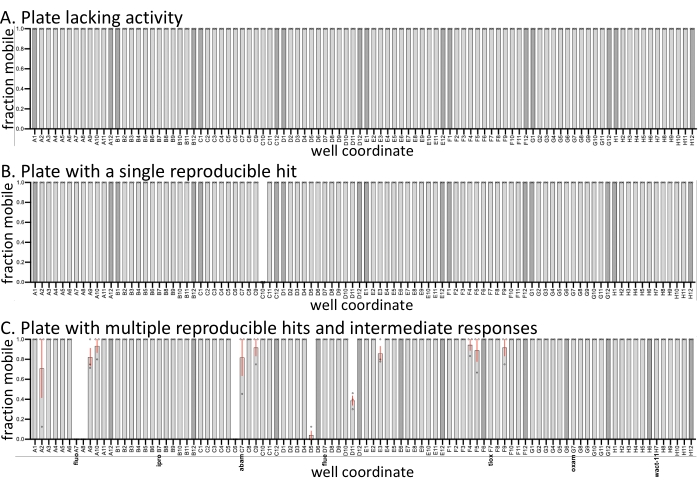
Figura 1: Exemplos de saída da tela. Três réplicas biológicas (círculos abertos) com D. dipsaci foram realizadas contra as pequenas moléculas (60 μM) em cada uma das três placas mostradas. Todas as três placas têm 0,6% dos controles somente de solventes DMSO (barras mais escuras). Exceto quando observados de outra forma com controles de solventes ou nematicides conhecidos, os poços das três placas contêm compostos relativamente não característicos de drogas comprados de fornecedores (ver Burns et al., 2015)18. (A) Uma placa de 96 poços da biblioteca de moléculas pequenas não tem qualquer molécula com bioatividade observável contra D. dipsaci. (B) Uma placa de poço 96 da pequena biblioteca de moléculas tem uma única molécula que interrompe a mobilidade de D. dipsaci . (C) Uma placa de 96 poços contendo os nematicides caracterizados fluopyram (fluo), iprodiona (ipro), abamectina (abam), fluensulfone (flue), tioxazafen (tiox), oxamyl (oxam) e wact-11. As barras de erro representam o erro padrão da média. Clique aqui para ver uma versão maior desta figura.
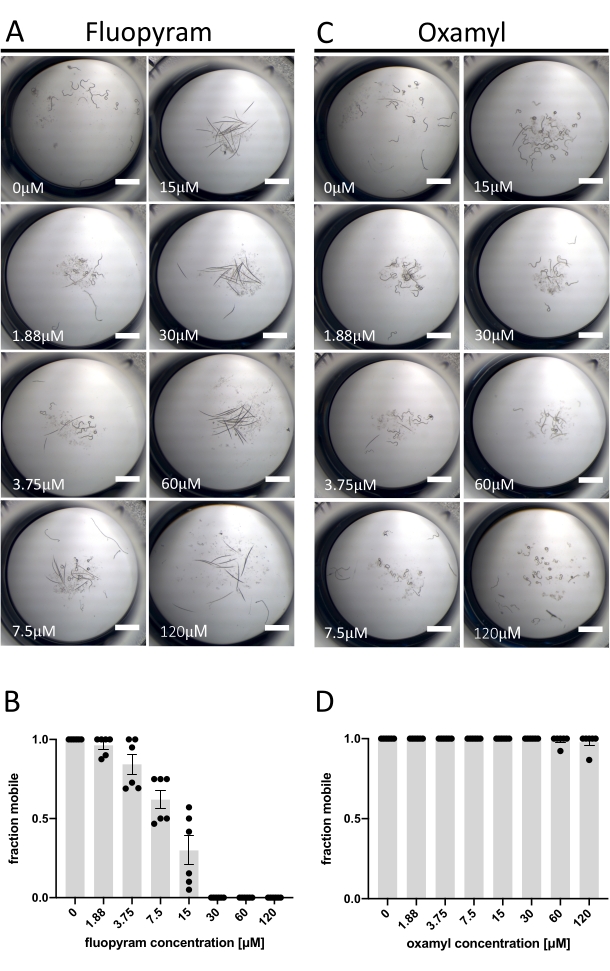
Figura 2: Exemplo de resultados positivos e negativos utilizando ensaio de mobilidade. (A) Exemplos dos fenótipos terminais após a exposição de D. dipsaci ao aumento das concentrações de fluopíram após 5 dias antes da adição de NaOH. (B) Uma análise dose-resposta do movimento de D. dipsaci após 5 dias de exposição às concentrações indicadas de fluopíramo. (C,D) O mesmo que A,B, exceto oxamyl. Cada gráfico mostra ensaios feitos em dois dias separados com três réplicas por dia. O eixo y de cada gráfico indica a fração móvel dos vermes em cada bem calculado como o número de animais se movendo em relação ao número total de animais no poço. As barras de erro em ambos os gráficos representam o erro padrão da média. A barra de escala representa 1 mm. Clique aqui para ver uma versão maior desta figura.
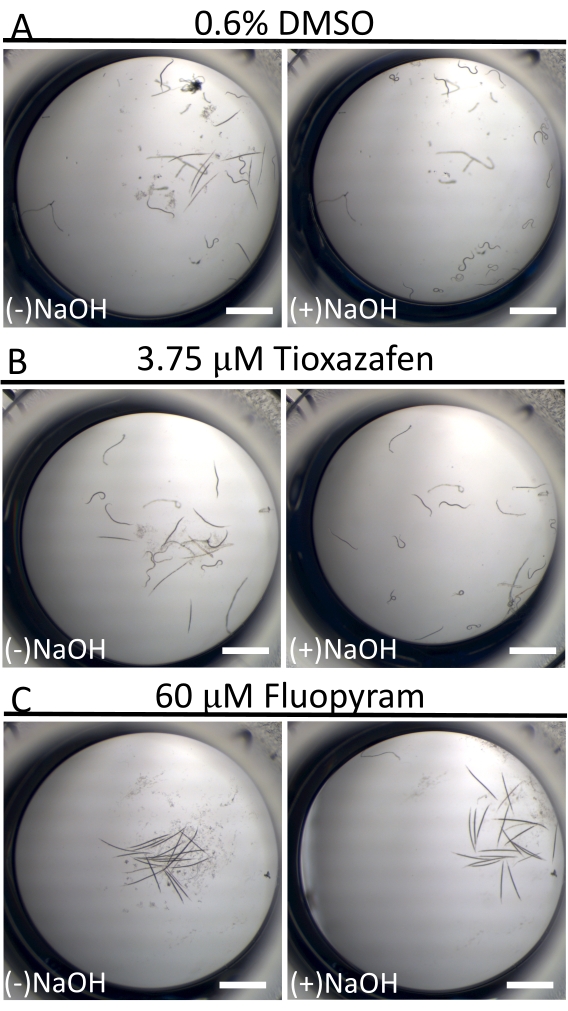
Figura 3: Mobilidade de D. dipsaci depois de adicionar 40 mM de NaOH. O efeito da adição de NaOH às amostras de D. dipsaci na presença de controle somente de solvente (A), tioxazafen (B) ou fluopyram (C) após 5 dias de co-incubação. A barra de escala representa 1 mm. Clique aqui para ver uma versão maior desta figura.
Discussão
Passos críticos
Apesar da simplicidade do protocolo, existem passos críticos no protocolo que merecem atenção adicional para maximizar a probabilidade de sucesso. Primeiro, exagerar as sementes pode interromper seu crescimento. Portanto, é essencial limitar o tempo das sementes na solução de branqueamento para 20 minutos ou menos. Em segundo lugar, como observado anteriormente por Storelli et al., a saúde aparente dos nematoides diminui ao longo do tempo quando armazenada a 4 °C16. O uso dos nematoides logo após sua coleta fornece confiança adicional de que condições ideais de triagem podem ser alcançadas. Se for necessário um armazenamento a longo prazo, certifique-se de que a tampa do tubo não esteja apertada para permitir a troca de oxigênio. Em terceiro lugar, garantir que as ervilhas cresçam nas placas de NA pelo tempo sugerido permite que o experimentador julgue quais sementes estão contaminadas. Em quarto lugar, sobrevar as ervilhas nas placas de GA antes de adicionar os nematoides enfraquecerá a infecção e reduzirá o rendimento do nematoide. Finalmente, muitos fatores difíceis de controlar podem impactar os resultados de triagem. Portanto, é essencial realizar múltiplas telas independentes de replicação em dias diferentes e, idealmente, com PPNs coletados de diferentes placas de cultura para garantir a reprodutibilidade dos resultados.
Limitações do método
Uma limitação ao protocolo é que ele não consegue sincronizar o estágio de desenvolvimento dos vermes coletados, que variam de jovens a adultos. Assim, os fortes hits revelados por qualquer tela são provavelmente eficazes em vários estágios. No entanto, o protocolo aumenta o risco de ignorar hits eficazes específicos do estágio. Uma segunda consideração é que a triagem in vitro deve ser considerada o primeiro passo em um gasoduto de descoberta de nematicida; Ensaios baseados no solo são uma excelente adição a um pipeline para testar a tradução dos hits.
Significância e aplicação do protocolo
Os protocolos aqui descritos são simples e facilmente replicados. Além disso, este protocolo foi aplicado com sucesso a outras PPNs no laboratório, incluindo penetrantes de Pratylenchus, fazendo apenas pequenas modificações. O desenvolvimento de novas e seguras medidas de controle de PPN é essencial para garantir a segurança alimentar global. Isso é especialmente verdadeiro para espécies como d. dipsaci que são geralmente tolerantes a uma grande variedade de nematicides químicos atualmente aceitáveis13,14. Assim, os protocolos aqui descritos têm o potencial de contribuir de forma importante para a saúde humana em escala global.
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Os autores reconhecem o Dr. Qing Yu (Agricultura e Agro-Alimentos do Canadá) por fornecer a cultura ditylenchus dipsaci e por conselhos sobre métodos culturais; Dr. Benjamin Mimee (Agricultura e Agro-Alimentos do Canadá) e Nathalie Dauphinais (Agricultura e Agro-Alimentos Canadá) para aconselhamento sobre cultura in vitro de nematoides vegetais-parasitas; Dr. Andrew Burns e Sean Harrington para sugestões úteis sobre o projeto e o manuscrito. JK é um NSERC Alexander Graham Bell Canada Graduate Scholar. A PJR é apoiada por uma concessão de projeto cihr (313296). PJR é uma Cadeira de Pesquisa do Canadá (Nível 1) em Genética Química.
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL tube | Sarstedt | 62.554.205 | |
| 2 forceps | Almedic | 7747-A10-108 | |
| 2L beaker | Pyrex | CLS10002L | |
| 50mL beaker | Pyrex | CLS100050 | |
| 96 well plate | Sarstedt | 83.3924 | |
| aluminium foil | Alcan Plus | ||
| bacteriological agar | BioShop | AGR001.5 | |
| coffee filter | No name brand | 716 | |
| commercial bleach 6% | Lavo Pro 6 | DIN102358107 | |
| disposable petri dishes (10cm x 1.5cm) | Fisherbrand | FB0875712 | |
| disposable petri dishes (10cm x 2.5cm) | Sigma-Aldrich | Z358762 | |
| dissecting scope | Leica | Leica MZ75 | |
| DMSO | Sigma-Aldrich | 472301-500ML | |
| Funnel | VWR | 414004-270 | |
| Gamborg B5 | Sigma-Aldrich | G5893-10L | |
| glass petri dish | VWR | 75845-546 | |
| glass slide | MAGNA | 60-1200 | |
| Lint-Free Blotting Paper | V&P Scientific | VP 522-100 | |
| Low retention pipette tips (200uL) | LABFORCE | 1159M44 | |
| mutlichannel pipette | Eppendorf research plus | 3125000036 | |
| NaOH | Sigma-Aldrich | S8045-500G | |
| nutrient agar | Sigma-Aldrich | 70148-100G | |
| parafilm | Bemis | PM-996 | |
| pea seeds | Ontario Seed Company | D-1995-250G | |
| pin cleaning solutions | V&P Scientific | VP110A | |
| pinner | V&P Scientific | VP381N | |
| pinner rinse trays | V&P Scientific | VP 421 | |
| reagent reservoir with lid for multichannel pipettes | Sigma-Aldrich | BR703459 | |
| shaking incubator | New Brunswick Scientific | I26 | |
| sterile surgical blade | MAGNA | sb21-100-a | |
| stir bar | Fisherbrand | 2109 - 1451359 | |
| sucrose | BioShop | SUC507.1 |
Referências
- Sasser, J. N., Freckman, D. W. A. world perspective on nematology: the role of the society. Vistas on nematology. , 7-14 (1987).
- Abad, P., et al. Genome sequence of the metazoan plant parasitic nematode Meloidogyne incognita. Nature Biotechnology. 26 (8), 909-915 (2008).
- Auwal, M., Hassan, T. H. P., Hongli, S., Jingwu, Z. Nematodes threats to global food security. Acta Agriculturae Scandinavica, Section B - Soil & Plant Science. 63 (5), 420-425 (2013).
- Chen, Z. X., Chen, S. Y., Dickson, D. W. Nematicides: Past and present uses. Nematology Vol 2, Nematode Management and Utilization. , 1179-1200 (2004).
- Desaeger, J., Wram, C., Zasada, I. New reduced-risk agricultural nematicides - and review. Journal of nematology. 52, (2020).
- Donely, N. The USA lags behind other agricultural nations in banning harmful pesticides. Environmental Health. 18 (1), 44 (2019).
- Polansek, T. Monsanto halts launch of chemical after users complain of rashes. Reuters. , (2017).
- Sturhan, D., Brzeski, M. W. Stem and bulb nematodes, Ditylenchus spp. Manual of agricultural nematology. , 423-464 (1991).
- The European and Mediterranean Plant Protection Organization (EPPO). Data Sheets on Quarantine Pests; Ditylenchus dipsaci. Prepared by CABI and EPPO for the EU under Contract 90/399003. The European and Mediterranean Plant Protection Organization (EPPO). , (2021).
- Quebec (Canada), Agriculture, Pêcherie et Alimentation Quebec. Réseau d'avertissements phytosanitaires (RAP). Avertissement Carotte, Céleri, Laitue, Oignon, Poireau [Warning carrot celery, lettuce, onion, leek]. Quebec (Canada), Agriculture, Pêcherie et Alimentation Quebec. , (2011).
- Abawi, G. S., Moktan, K. Bloat nematode problem on garlic: symptoms, distribution, and management guidelines. Department of Plant Pathology and Plant-microbe Biology, Geneva. , (2010).
- Taylor, R. Chapter 7. Nematodes and other worms. , 143-234 (2019).
- Storelli, A., Keiser, A., Eder, R., Jenni, S., Kiewnick, S. Evaluation of fluopyram for the control of Ditylenchus dipsaci in sugar beet. Journal of nematology. 52, 1-10 (2020).
- Oka, Y. Nematicidal activity of fluensulfone against some migratory nematodes under laboratory conditions. Pest Management Science. 70, 1850 (2014).
- Poirier, S., Dauphinais, N., Van Der Heyden, H., Véronneau, P. Y., Bélair, G., Gravel, V., Mimee, B. Host Range and Genetic Characterization of Ditylenchus dipsaci Populations from Eastern Canada. Plant disease. 103, 456-460 (2019).
- Storelli, A., Kiewnick, S., Daub, M., et al. Virulence and pathogenicity of four Ditylenchus dipsaci populations on sugar beet. Eur J Plant Pathol. 161, 63-71 (2021).
- Kühnhold, V., Kiewnick, S., Sikora, R. A. Development of an in vivo bioassay to identify sugar beet resistance to the stem nematode Ditylenchus dipsaci. Nematology. 8 (5), 641-645 (2006).
- Burns, A., Luciani, G., Musso, G. Caenorhabditis elegans is a useful model for anthelmintic discovery. Nat Communications. 6, (2015).
- Chen, S. Y., Dickson, D. W. A Technique for Determining Live Second-stage Juveniles of Heterodera glycines. Journal of nematology. 32, 117-121 (2000).
- Xiang, N., Lawrence, K. S. Optimization of In Vitro Techniques for Distinguishing between Live and Dead Second Stage Juveniles of Heterodera glycinesand Meloidogyne incognita. PLoS ONE. 11 (5), (2016).
- US EPA. Fluopyram. US EPA. , (2016).
- US EPA. Fluopyram. US EPA. , (2020).
- US EPA. Oxamyl Facts. Prevention, Pesticides and Toxic Substances. US EPA. , (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados