Method Article
نهج فحص المذنب عالي الإنتاجية لتقييم تلف الحمض النووي الخلوي
* These authors contributed equally
In This Article
Summary
فحص المذنب هو وسيلة شائعة للكشف عن تلف الحمض النووي. تصف هذه الدراسة نهجا لتشغيل الشرائح في المتغيرات التمثيلية لفحص المذنب. أدى هذا النهج إلى زيادة كبيرة في عدد العينات مع تقليل وقت تشغيل الفحص ، وعدد التلاعب بالشرائح ، وخطر تلف المواد الهلامية.
Abstract
تتعرض الخلايا باستمرار للعوامل الناشئة عن البيئات الداخلية والخارجية ، والتي قد تلحق الضرر بالحمض النووي. يمكن أن يسبب هذا الضرر وظيفة خلوية شاذة ، وبالتالي قد يلعب تلف الحمض النووي دورا حاسما في تطور جميع الأمراض البشرية الرئيسية ، مثل السرطان والأمراض العصبية التنكسية وأمراض القلب والأوعية الدموية والشيخوخة. يعد الرحلان الكهربائي الهلامي أحادي الخلية (أي فحص المذنب) أحد أكثر الطرق شيوعا وحساسية لدراسة تكوين وإصلاح مجموعة واسعة من أنواع تلف الحمض النووي (على سبيل المثال ، الفواصل أحادية ومزدوجة الخيط ، والمواقع القلوية ، والروابط المتقاطعة بين الحمض النووي والحمض النووي ، وبالاقتران مع بعض إنزيمات الإصلاح ، والبيورينات المؤكسدة ، والبيريميدين) ، في كل من المختبر وفي الجسم الحي نظم. ومع ذلك ، فإن إنتاجية العينة المنخفضة للفحص التقليدي وعمل العينة الشاق يحدان من العوامل إلى أوسع تطبيق ممكن. مع "تسجيل" المذنبات بشكل متزايد الآلي ، فإن القيد هو الآن القدرة على معالجة أعداد كبيرة من شرائح المذنبات. هنا ، تم تطوير متغير عالي الإنتاجية (HTP) لفحص المذنب (HTP comit) ، مما يزيد بشكل كبير من عدد العينات التي تم تحليلها ، ويقلل من وقت تشغيل الفحص ، وعدد التلاعب الفردي بالشرائح ، ومتطلبات الكاشف ، وخطر حدوث أضرار مادية للمواد الهلامية. علاوة على ذلك ، يتم تقليل بصمة خزان الرحلان الكهربائي بشكل كبير بسبب الاتجاه الرأسي للشرائح والتبريد المتكامل. كما تم الإبلاغ هنا عن نهج جديد لشرائح فحص المذنبات المرعبة ، والتي تسهل بسهولة وكفاءة تصلب المواد الهلامية للمذنبات. هنا ، تم وصف تطبيق هذه الأجهزة على طرق فحص المذنبات التمثيلية. تدعم هذه الابتكارات البسيطة إلى حد كبير استخدام فحص المذنب وتطبيقه على مجالات الدراسة مثل بيولوجيا التعرض ، وعلم السموم البيئية ، والرصد البيولوجي ، وفحص / اختبار السمية ، إلى جانب فهم الإمراض.
Introduction
تتعرض الخلايا باستمرار للعوامل الناشئة عن البيئات الداخلية والخارجية ، والتي يمكن أن تلحق الضرر بالحمض النووي 1,2. يمكن أن يسبب هذا الضرر وظيفة الخلية الشاذة3 ، وبالتالي قد يلعب تلف الحمض النووي دورا حاسما في تطور العديد من الأمراض البشرية الرئيسية ، مثل السرطان والأمراض العصبية التنكسية وأمراض القلب والأوعية الدموية والشيخوخة4. يعد فحص المذنب (ويسمى أيضا الرحلان الكهربائي الهلامي أحادي الخلية) طريقة شائعة بشكل متزايد للكشف عن تلف الحمض النووي الخلوي وقياسه كميا.
في أبسط صوره ، يكتشف فحص المذنب القلوي (ACA) فواصل الخيوط (SB ؛ مفردة ومزدوجة على حد سواء) ، جنبا إلى جنب مع المواقع apurinic / apyrimidinic والمواقع القلوية (ALS) وكلاهما يصبح فواصل أحادية الخيط في ظل الظروف القلوية5. يمكن لفحص مذنب الأس الهيدروجيني المحايد تقييم الفواصل الصريحة أحادية ومزدوجةالخيط 6. وعلاوة على ذلك، يمكن ل ACA، بالاشتراك مع عدد من إنزيمات إصلاح الحمض النووي، الكشف عن مجموعة كبيرة من أنواع تلف الحمض النووي، على سبيل المثال، البيورينات المؤكسدة (التي تم تحديدها باستخدام الحمض النووي البشري 8-oxoguanine glycosylase 1؛ hOGG17)؛ البيريميدين المؤكسد (باستخدام Endonuclease III; EndoIII) و سيكلوبوتان بيريميدين ديمرز (باستخدام T4 endonuclease V ؛ T4endoV)8. يمكن أيضا استخدام فحص المذنب لتقييم آفات الحمض النووي الناجمة عن عوامل الربط المتبادلة ، مثل سيسبلاتين9،10،11. وكما هو مبين في الاسم الرسمي للفحص، أي الرحلان الكهربائي الهلامي أحادي الخلية، يعتمد الفحص على الخلايا قيد التحليل كونها معلقة خلية واحدة؛ الأكثر شيوعا ، هذه هي الخلايا المستزرعة ولكن يمكن عزلها من الدم الكامل 12,13 ، أو يمكن استخدام الدم الكامل نفسه 14,15. بدلا من ذلك ، يمكن إنشاء تعليق خلية واحدة من الأنسجة الصلبة.
وبصرف النظر عن بعض الاستثناءات، وأبرزها تقارير CometChip من مختبر Engleward 16، لم يتغير بروتوكول فحص المذنب بشكل كبير عن ذلك الذي وصفه مخترعو الفحص في الأصل (Östling و Johansson17 و Singh etal.18). يتضمن فحص المذنب العديد من الخطوات (الشكل 1). تتضمن العديد من هذه الخطوات نقل جل الأغاروز الرقيق المحتوي على الخلايا ، شريحة واحدة في كل مرة ، وبالتالي ، تشكل خطر تلف أو فقدان الجل ، مما يعرض نجاح التجربة للخطر. وبالتالي ، يمكن أن يستغرق فحص المذنب وقتا طويلا ، خاصة إذا كان يتم تشغيل عدد كبير من الشرائح. عادة ، يتم تشغيل 40 شريحة كحد أقصى في خزان كبير (33 سم × 59 سم × 9 سم) ، والذي يقع داخل صينية أكبر تحتوي على ثلج رطب للتبريد. وقد أفيد مؤخرا أنه يمكن تقصير وقت تشغيل الفحص إلى يوم واحد عن طريق تقليل مدة خطوة التحلل وعدم تجفيف الشرائح قبل تلطيخ19.
أبلغ المؤلفون الحاليون سابقا عن نهج جديد لفحص المذنب القلوي عالي الإنتاجية (HTP ACA) ، حيث يمكن التلاعب بشرائح مجهر فحص المذنب المتعددة (دفعات من 25) في وقت واحد طوال عملية فحص المذنب 20،21،22. يقلل هذا النهج الحاصل على براءة اختراع من خطر تلف أو فقدان المواد الهلامية المحتوية على العينات عن طريق إزالة الحاجة إلى التعامل مع شرائح المجهر بشكل فردي ويمكن تطبيقه على جميع متغيرات فحص المذنب ، والتي تستخدم شرائح المجهر. تحمي الرفوف المحتوية على الشرائح المواد الهلامية أثناء التلاعب ، وبالتالي ، تكون معالجة العينات أسرع وأكثر كفاءة. يمكن أن تخضع الشرائح أيضا للرحلان الكهربائي في الرفوف ، التي يتم الاحتفاظ بها في الاتجاه الرأسي ، بدلا من الاتجاه الأفقي. هذا ، والتبريد المتكامل ، يقلل بشكل كبير من بصمة خزان الرحلان الكهربائي ويزيل الحاجة إلى الثلج الرطب. وهذا يمثل تحسنا كبيرا مقارنة بالإجراء التقليدي. ويوضح الشكل 2 المعدات المستخدمة. توضح البروتوكولات الموصوفة هنا ، باستخدام هذا النهج الجديد ، التطبيق التمثيلي للخلايا المستزرعة والدم الكامل14 للكشف عن المواقع القلوية الشفهية (ALS) ، والروابط المتقاطعة بين الخيوط (ICL) ، وركائز إنزيمات إصلاح الحمض النووي المختلفة.
Protocol
تم استخدام عينات الدم المتاحة تجاريا في هذه الدراسة. في مؤسستنا ، ليست هناك حاجة إلى موافقة مجلس المراجعة المؤسسية لاستخدام الدم المتاح تجاريا.
1. إعداد المواد اللازمة لفحص المذنب
- إعداد شرائح المجهر
- صب 1٪ (ث / v) درجة الانصهار العادية agarose [المذاب في الماء المقطر المزدوج (ddH 2 O)] في أنبوب 50 مل وميكروويف لإذابة الأغاروز في ddH2O. يخزن في 37 درجة مئوية لمنع التصلب قبل شرائح الطلاء. في حالة حدوث تصلب ، تخلص منه وقم بإعداده طازجا.
- ينزلق المجهر قبل المعطف عن طريق غمس الشرائح في أنبوب 50 مل يحتوي على 1٪ (ث / v) درجة الانصهار الطبيعية الأغاروز.
- امسح الجزء الخلفي من الشرائح بسرعة بعد غمس الشرائح.
ملاحظة: سيؤدي الفشل في مسح الجزء الخلفي من الشرائح بشكل صحيح إلى زيادة ضوضاء الخلفية للشرائح أثناء التحليل خطوة بالمجهر. - قم بتسمية الشريحة المطلية بعلامة دائمة في الزاوية السفلية اليمنى من القسم المتجمد (الشكل 3A). يوضح هذا أي جانب من الشريحة مطلي مسبقا.
- اترك الأغاروز ليجف طوال الليل في درجة حرارة الغرفة.
- لف الشرائح المجففة في المناديل الورقية وتخزينها في صندوق.
2. إعداد العينات
- الخلايا المستزرعة
ملاحظة: أولا ، عالج الخلايا بالعامل (العوامل) الضارة قبل بدء فحص المذنب. ثم قم بتنفيذ ما يلي.- إذا كانت الخلايا ملتصقة ، فقم بالتربسين في الخلايا لتحريرها من قارورة زراعة الخلايا أو أطباق بتري ثقافة الخلية ، عند الالتقاء الخلايا المناسب. تحييد التربسين عن طريق إضافة وسائط تحتوي على المصل.
- انقل الخلايا إلى أنبوب 50 مل ، وأجهزة طرد مركزي (على سبيل المثال ، ل HaCaTs ، جهاز طرد مركزي عند 300 × g لمدة 5 دقائق في درجة حرارة الغرفة) ، قم بإزالة supernatant بلطف ، وأضف 1 مل من PBS إلى حبيبة الخلية.
- إجراء عد الخلايا.
- انقل 30,000 خلية إلى أنبوب طرد مركزي دقيق سعة 1.5 مل وأجهزة طرد مركزي بسرعة 7,607 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- قم بإزالة المذنب برفق وتخزين حبيبات الخلية على الجليد في الظلام قبل إجراء فحص المذنب.
ملاحظة: يجب اختبار الخلايا بانتظام للكشف عن تلوث الميكوبلازما قبل إجراء فحص المذنب لمنع ، من بين آثار أخرى ، من تكوين تلف الحمض النووي الاصطناعي واستجابة تلف الحمض النووي المتغيرة ، كما ورد في مكان آخر23. يمكن تغيير ظروف الطرد المركزي ، حسب الحاجة ، اعتمادا على نوع الخلية المستخدمة.
- إعداد الخلايا المستزرعة لفحص الإصلاح
- خلايا الثقافة في زارعة زراعة الخلايا أو أطباق بتري.
- اغسل الخلايا ب 1 مل من PBS مرتين قبل معالجة الخلايا بعوامل ضارة (على سبيل المثال ، بالنسبة لخلايا BE-M17 ، عالج 50 ميكرومتر من H 2 O2لمدة 20 دقيقة) على الجليد لمنع حدوث الإصلاح أثناء العلاج.
- اغسل الخلايا بلطف مع 1 مل من PBS مرتين لإزالة أي عوامل ضارة متبقية.
- أعد إدخال وسط زراعة الخلايا واسمح للخلايا بالإصلاح لفترات متفاوتة (على سبيل المثال ، 0 دقيقة ، 30 دقيقة ، 2 ساعة ، 6 ساعات ، 24 ساعة ، و 30 ساعة) في حاضنة رطبة (37 درجة مئوية ، 5٪ CO2).
- في كل نقطة زمنية ، اجمع 30000 خلية في وسط زراعة الخلايا المحتوي على 10٪ من ثنائي ميثيل سلفوكسيد (DMSO) وتخزينها عند -80 درجة مئوية.
- قبل إجراء فحص المذنب ، قم بإذابة الخلايا بسرعة عند 37 درجة مئوية في حمام مائي وقم بطردها مركزيا عند 7,607 × g لمدة 5 دقائق عند 4 درجات مئوية.
- قم بإزالة السوبرناتانت وتخزين حبيبات الخلية على الجليد قبل إجراء الفحص (أي من الخطوة 3).
- تحضير الدم الكامل
ملاحظة: تستفيد الطريقة التالية من (i) كونها نهجا طفيف التوغل للحصول على عينة دم ، (ii) لا تتطلب عزل PBMC قبل فحص المذنب ، و (iii) السماح بتخزين عينات الدم (بحجم < 250 ميكرولتر) عند -80 درجة مئوية ، لمدة تصل إلى 1 شهر (على الرغم من أن الأدلة الحديثة تشير إلى أن التخزين لفترة أطول ممكن) ، دون الحاجة إلى مواد احتياطية مبردة ، وبدون أي خطر أو تكوين ضرر فني14. قد تكون هناك حاجة إلى موافقة أخلاقية ، أو ما يعادلها ، قبل الحصول على عينات دم من المرضى أو الحيوانات. بدلا من ذلك ، يمكن استخدام عينات الدم المتاحة تجاريا كما هو الحال في هذه الدراسة. في مؤسستنا ، ليست هناك حاجة إلى موافقة مجلس المراجعة المؤسسية لاستخدام الدم المتاح تجاريا.- باستخدام ماصة ، قم بنقل عينات الدم الكاملة (<250 ميكرولتر) (جدول المواد) إلى أنبوب تجميع يحتوي على الحد الأدنى من الحجم الذي يحتوي على 0.4 ملغ من EDTA (لكل 250 ميكرولتر من الدم).
- قم بتجميد عينات الدم عند -80 درجة مئوية قبل إجراء فحص المذنب HTP.
- إذابة عينات الدم المخزنة (<250 ميكرولتر) في درجة حرارة الغرفة ، دون تسخين.
- نقل 5 ميكرولتر من الدم كله إلى أنابيب أجهزة الطرد المركزي الدقيقة قبل إجراء فحص المذنب (انظر الخطوة 3).
3. تحلل الخلايا
ملاحظة: تنفيذ جميع الإجراءات على الجليد.
- استخدم 12000 خلية أو 2.5 ميكرولتر من الدم الكامل لكل هلام.
- تحضير 0.6٪ (ث / v) درجة انصهار منخفضة الأغاروز المذاب في PBS باستخدام الميكروويف ، ووضعها في حمام مائي على درجة حرارة 37 درجة مئوية لمنعها من التصلب.
- قم بتسمية النهاية المتجمدة للشرائح المطلية مسبقا باسم المحقق وتاريخه ومعلومات العلاج باستخدام علامة دائمة أو قلم رصاص.
- ضع صفيحة تبريد على مقعد مسطح وأدخل حزمتي التبريد المجمدتين في الدرج المنزلق أسفل السطح المعدني (كما هو موضح في الشكل 4)21.
- ضع الشرائح على لوحة التبريد واترك الشرائح لتبرد مسبقا لمدة 1-2 دقيقة قبل إضافة الخلايا المحتوية على الأغاروز منخفضة درجة الانصهار بنسبة 0.6٪ (w/v) (الخطوة 3.7).
ملاحظة: قد يؤدي ترك الشرائح على لوحة التبريد لأكثر من 1-2 دقيقة إلى تكوين تكاثف على سطح الشريحة بسبب الرطوبة المحيطة. هذا قد يجعل المواد الهلامية الأغاروز منخفضة درجة الانصهار أقل استقرارا على الشرائح. - قم بتفريق الكريات (الخطوة 2.2.7) عن طريق الدوامة. تأكد من إزالة جميع المواد الفائقة من الكريات. ضع أنابيب العينة (التي تحتوي على الخلايا الحبيبية) على الفور مرة أخرى على الجليد.
ملاحظة: عند وضع الأنابيب المحتوية على عينة في جهاز الطرد المركزي، ضعها مع المفصلة المواجهة للخارج بحيث يتم جمع الكريات على هذا الجانب من الأنبوب. في بعض الأحيان يكون من الصعب رؤية الكريات ، ومن السهل إزاحتها أثناء إزالة السوبرناتانت. سيمكن الطرد المركزي باستخدام غطاء الأنبوب في هذا الاتجاه المرء من معرفة مكان بيليه الخلية. - أعد تعليق حبيبة الخلية مع 200 ميكرولتر من الأغاروز منخفض درجة الانصهار بنسبة 0.6٪ (LMP agarose) واخلطها عن طريق السحب لأعلى ولأسفل دون إنشاء فقاعات. بعد ذلك ، انقل بسرعة 80 ميكرولتر من الخلايا المحتوية على الأغاروز LMP إلى شريحة مبردة وضع غطاء بسرعة على الجل.
- اترك الجل يوضع على طبق التبريد لمدة 1-2 دقيقة.
- وفي الوقت نفسه ، قم بإعداد محلول عمل 500 مل من المخزن المؤقت للتحلل (الجدول 1) وصبه في طبق التحلل (الشكل 2).
- بمجرد ضبط المواد الهلامية ، قم بإزالة الغطاء بسرعة عن طريق إمساك الشريحة برفق بين الإبهام والسبابة وتحريك الغطاء عن الجل.
- ضع الشرائح التي تحتوي على عينات داخل حامل الشرائح (يجب أن تكون جميع علامات "النقاط" السوداء على الشرائح متجهة في نفس الاتجاه عند وضعها في حامل) (الشكل 3B)، ثم ضع حامل الشرائح داخل طبق التحلل (الشكل 2).
- أغلق غطاء طبق التحلل واحتفظ بطبق التحلل في الثلاجة طوال الليل عند 4 درجات مئوية أو 30 دقيقة في درجة حرارة الغرفة، أيهما يناسب الجدول الزمني19 للمشغل.
4. الكهربائي
- قم بإزالة حامل الشريحة بعناية من طبق التحلل. احرص على عدم إزعاج المواد الهلامية.
- ضع حامل الشريحة برفق في طبق غسيل محمل مسبقا بالثلج البارد ddH 2 O واتركه لمدة 30دقيقة لضمان تغطية الشرائح بالكامل ب ddH2O.
- أدخل حزمة تبريد مجمدة داخل الدرج المنزلق أسفل خزان الرحلان الكهربائي للحفاظ على درجة حرارة التخزين المؤقت المثلى.
- أضف بعناية محلول عمل الرحلان الكهربائي البارد (الجدول 1) إلى خزان الرحلان الكهربائي وانقل حامل الانزلاق إلى خزان الرحلان الكهربائي. قم بتوجيه الشرائح بحيث تشير أجزاؤها الواضحة مع المواد الهلامية المحتوية على الخلايا (أي ، وليس نهايات المتجمد / وضع العلامات) نحو الكاثود (القطب الأحمر).
- اسمح للشرائح بالجلوس في خزان الرحلان الكهربائي لمدة 20 دقيقة حتى يرتاح الحمض النووي ويسترخي. حافظ على إيقاف تشغيل موفر الطاقة أثناء هذه الخطوة.
- إذا لزم الأمر، أدخل حزمة تبريد مجمدة جديدة لزيادة التبريد إلى أقصى حد.
- قم بإجراء الرحلان الكهربائي لمدة 20 دقيقة عند 1.19 فولت / سم ، أو أي ظروف تم تحسينها.
ملاحظة: يوصى بتحسين ظروف تشغيل الرحلان الكهربائي وحجم المخزن المؤقت لكل مختبر24. إن استخدام حامل شريحة واحد فقط أثناء الرحلان الكهربائي لا يسبب أي تأثير للشرائح على مقاومة المخزن المؤقت للرحلان الكهربائي ، ولم ير المؤلفون تأثيرا كبيرا في الجهد أو التيار عندما تغير عدد الشرائح. - قم بإيقاف تشغيل مصدر الطاقة ، وقم بإزالة حامل الشريحة بعناية من خزان الرحلان الكهربائي ، واتركه يستنزف على ورق المناديل الورقية لمدة 30 ثانية.
- ضع حامل الشريحة في الطبق الذي يحتوي على مخزن مؤقت للتحييد (الجدول 1). اتركيه لمدة 20 دقيقة.
- قم بإزالة حامل الشريحة من طبق التحييد ، وضعه في طبق الغسيل الذي يحتوي على dDH2O البارد ، واتركه لمدة 20 دقيقة.
- قم بإزالة حامل الشريحة من الماء واترك الشرائح تجف في حاضنة عند 37 درجة مئوية لمدة 1 ساعة ، أو في درجة حرارة الغرفة طوال الليل ، أو لا تجف ، اعتمادا على جدول المشغل19.
ملاحظة: إذا لم يكن هناك تجفيف في الخطوة 4.11، فقم بتنفيذ خطوة التلطيخ من 5.2.
5. يوديد البروبيديوم (PI) تلطيخ
- انقل حامل الشريحة إلى طبق غسيل يحتوي على الثلج البارد ddH2O لإعادة ترطيب الشرائح واتركها لمدة 30 دقيقة.
- ضع حامل الشريحة في طبق تلطيخ يحتوي على محلول يوديد البروبيديوم 2.5 ميكروغرام / مل.
ملاحظة: يوديد البروبيديوم حساس للضوء، لذا تعامل معه في منطقة مظلمة. كما أنها سامة. - أغلق غطاء طبق التلطيخ واحتضنه لمدة 20 دقيقة في الظلام في درجة حرارة الغرفة.
- انقل حامل الانزلاق إلى طبق منفصل ، واغسله بالثلج البارد ddH2O لمدة 20 دقيقة.
- قم بإزالة حامل الانزلاق من الطبق وجففه تماما في الظلام ، إما في حاضنة 37 درجة مئوية أو في درجة حرارة الغرفة ، اعتمادا على جدول المشغل أو تفضيله.
- بمجرد تجفيف الشرائح بالكامل، قم بإزالتها من حامل الشرائح وتخزينها في مربع شرائح في الظلام حتى تصبح جاهزة لتحليل الصور.
ملاحظة: ستظل الشرائح قابلة للقراءة إلى أجل غير مسمى ويمكن إعادة تلوينها إذا لزم الأمر.
6. فحص المذنب القلوي المعدل بالإنزيم
ملاحظة: يستخدم فحص المذنب القلوي المعدل بالإنزيم خطوة علاج إنزيم بعد التحلل ولكن قبل الرحلان الكهربائي. يسبب نشاط الإنزيم فواصل في الحمض النووي في المواقع التي هي ركائز للإنزيم. قبل إجراء هذا الفحص ، يجب تحسين تركيز الإنزيم ومدة حضانة الإنزيم.
- بعد تحلل الخلايا (الخطوة 3) ، اغسل الشرائح مرتين باستخدام ddH2O البارد لمدة 20 دقيقة لكل منهما.
- قم بإزالة حامل الشريحة من الماء وانقل الشرائح إلى صينية مبطنة بمناشف ورقية.
- أضف 80 ميكرولتر من الإنزيم بالتركيز الأمثل (على سبيل المثال ، 3.2 U / mL من hOGG1 لخلايا BE-M17 ، المخففة في مخزن تفاعل الإنزيم) وقم بتغطيتها بغطاء لنشر الإنزيم على العينة المحتوية على الهلام.
- احتضن الشرائح عند 37 درجة مئوية للمدة المحسنة (على سبيل المثال، 45 دقيقة ل hOGG1).
- بعد الحضانة ، قم بإزالة الأغطية بلطف ونقل الشرائح إلى الناقل.
ملاحظة: لا تغسل الشرائح بعد علاج الإنزيم. أداء الكهربائي مباشرة من الخطوة 4.3.
7. الحمض النووي بين الخيوط المتقاطعة (ICL) - فحص المذنبات القلوية المعدلة
ملاحظة: مفهوم هذا البديل من ICL-ACA هو أن وجود ICL في الحمض النووي سوف يؤخر الهجرة الكهربية للحمض النووي التالف ، الناجم عن التعرض لإهانة ناتجة عن الأكسدة. في هذه الحالة ، كلما كان ذيل المذنب أقصر ، زاد عدد ICL25,26,27,28.
- عالج الخلايا بكاشف يحفز ICL (على سبيل المثال ، سيسبلاتين ؛ انظر الملف التكميلي).
- قم بتعريض الخلايا المعالجة بأحد العوامل التالية للحث على فواصل حبلا كافية لإنشاء ذيل مذنب بحجم مناسب (~ 20٪ من الحمض النووي للذيل): بيروكسيد الهيدروجين (50 ميكرومتر H 2 O2 لمدة 30 دقيقة) ، أو الإشعاع المؤين (2-5 Gy) ، أو الأشعة فوق البنفسجية B (UVB) (0.5 J / cm2).
- بالإضافة إلى ذلك ، قم بإنتاج شريط كسر التحكم الإيجابي عن طريق معالجة مجموعة من الخلايا بنفس العامل والجرعة ، كما هو مستخدم في الخطوة 7.2 (أي ، لا يوجد علاج بعامل محفز ل ICL).
- قم بالطرد المركزي للخلايا عند 7,607 × g لمدة 5 دقائق ، وتخلص من supernatant ، واغسل حبيبة الخلية ثلاث مرات مع 1 مل من PBS ، وقم بمعالجة فحص المذنب القلوي (الخطوات 3-5).
- احسب مستويات الربط المتبادل بين خيوط الحمض النووي باستخدام الصيغة أدناه.
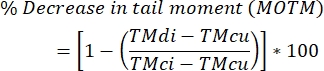
ملاحظة: MOTM (متوسط لحظة ذيل الزيتون) هي نقطة نهاية لفحص المذنب تستخدم على نطاق واسع عند وصف فحص المذنب المعدل بواسطة ICL ، ويتم تعريفه على أنه نتاج طول الذيل وجزء من إجمالي الحمض النووي في الذيل (أي ، عزم الذيل = طول الذيل × ٪ من الحمض النووي في الذيل)29 ؛ TMdi: لحظة ذيل العينات المعالجة بكل من عامل الربط المتقاطع و H2 O2 (أو محفز قاطع الخيوط الآخر) ؛ TMcu: لحظة ذيل العينات التي لا تعامل بعامل ربط متقاطع ولا تعالج ب H 2 O 2(بدون علاج) ، و TMci: لحظة ذيل العينات التي لا تعامل بعامل ربط متقاطع ولكنها تعامل مع H 2 O 2.
8. تسجيل المذنبات وتحليل البيانات
ملاحظة: مصطلح "مذنب" مشتق من صور الخلايا التالفة عند النظر إليها تحت المجهر بعد إجراء الفحص (الشكل 5). في ظل ظروف الرحلان الكهربائي ، لا يهاجر الحمض النووي في الخلايا غير التالفة إلى حد كبير ، ولكنه يبقى في كروي يسمى "رأس" المذنب. ومع ذلك ، فإن وجود فواصل حبلا يسمح للحمض النووي للخلية بالهجرة من الرأس ، وتشكيل "ذيل" ، مما يؤدي إلى ظهور مثل المذنب (الشكل 5). كلما زاد الحمض النووي في الذيل ، زاد الضرر.
- قم بتشغيل المجهر الفلوري باستخدام مرشح PI (الأحمر) (λ = 536/617 نانومتر) وبرنامج تسجيل فحص المذنبات.
- أضف قطرة ماء باستخدام ماصة باستور إلى الجل وقم بتغطيتها بغطاء.
- ضع الشرائح في المجهر الفلوري و "سجل" المذنبات.
ملاحظة: التسجيل هو وسيلة يتم من خلالها تقييم المذنبات، لتحديد مقدار الضرر الموجود في كل مذنب. على نطاق واسع ، يمكن تحقيق ذلك باستخدام نهجين ، وفقا لتفضيل المستخدم المختار ، إما عن طريق العين (قياس حجم المذنبات على مقياس من صفر إلى أربعة) أو باستخدام بحرية ، أو البرمجيات المتاحة تجاريا30. بشكل عام ، يقوم كلا النهجين بتقييم حجم ذيل المذنب ، على الرغم من أنه يمكن تحديد مجموعة متنوعة من نقاط النهاية المتعلقة بالمذنبات. في حالة استخدام البرنامج ، انقر فوق منتصف رأس المذنب وانتظر حتى يكتشف البرنامج المذنب تلقائيا ، ثم يقيم نقطة النهاية المختارة (الشكل 5). - سجل 50 مذنبا لكل هلام و 100 مذنب لكل عينة (أي كل عينة تتوافق مع علاجات مختلفة لإتلاف الحمض النووي ، أو تكراراتها).
- تكرار التجارب (n = 2) أو مضاعفة التجارب ثلاث مرات (n = 3).
ملاحظة: إذا تم إجراء تجارب النسخ المتماثل n = 2 فقط ، فلا يمكن إجراء التحليل الإحصائي ، ولكن إذا كان n = 3 ، فقم بإجراء اختبار D'agostino الطبيعي. معظم بيانات فحص المذنبات لا تجتاز اختبار الوضع الطبيعي. في هذه الحالة ، استخدم اختبارا غير بارامتري (اختبار Kruskal-Wallis مع اختبار المقارنات المتعددة ل Dunn ، واختبارات Mann-Whitney ذات الأهمية المحددة عند p < 0.05).
النتائج
تحسين جهد الرحلان الكهربائي ل HTP ACA
الخلايا الكيراتينية البشرية (HaCaTs; جدول المواد) تم تشعيعها بجرعات مختلفة من الأشعة فوق البنفسجية A (UVA) (5 أو 10 J/cm2; الشكل 6A)، الأشعة فوق البنفسجية (ب) (0.5 أو 1 J/cm2; الشكل 6B)، أو تعامل مع 50 ميكرومتر H 2 O2(الشكل 6C) للحث على الضرر. تم اختبار ثلاثة فولتية مختلفة من الرحلان الكهربائي لتحديد الجهد الأمثل للرحلان الكهربائي. كشفت نتائج جميع العلاجات الثلاثة الضارة بالحمض النووي أنه في حين أن جميع الفولتية ولدت استجابات جرعة خطية ، فقد تم الحصول على الاستجابة الأكثر حساسية مع 1.19 فولت / سم. أظهر HaCaTs أعلى تلف أساسي للحمض النووي باستخدام 1.19 فولت / سم أثناء الرحلان الكهربائي مقارنة ب 1 فولت / سم و 1.09 فولت / سم (الشكل 6A-C). بالإضافة إلى ذلك ، باستخدام 1.19 فولت / سم ، ينظر إلى أكبر نسبة من الحمض النووي للذيل ، بعد جميع العلاجات الضارة (الشكل 6)31.
الكشف عن تلف الحمض النووي في الدم البشري الكامل باستخدام Fpg المعدل HTP ACA
تم تشعيع دم الإنسان (جدول المواد) بجرعات مختلفة من 10 J / cm2 UVA للحث على الضرر. تم استخدام أربعة تركيزات مختلفة من Fpg (1 أو 2 أو 4 أو 8 U / mL) لتحديد التركيز الأمثل لعلاج الإنزيم في HTP ACA. أظهرت النتائج أنه تم الكشف عن المستويات المثلى لتلف الحمض النووي باستخدام 4 U / mL Fpg (الشكل 7A). صور المذنبات التمثيلية من عينات الدم المشععة UVA (الشكل 7B).
الكشف عن الحمض النووي ICL في خط خلايا سرطان المبيض التمثيلي باستخدام HTP ACA المعدل بواسطة ICL
خط خلايا سرطان المبيض (SKOV-3; جدول المواد) عولج بمجموعات من سيسبلاتين 200 ميكرومتر و / أو معالجة لاحقة مع 50 ميكرومتر H 2 O2لمدة 30 دقيقة على الجليد. ولم يلاحظ أي ضرر ملموس في الخلايا غير المكشوفة (الشكل 8 ألف). أدى التعرض ل H 2O2 وحده إلى توليد MOTM كبير (الشكل 8B). في المقابل ، أظهرت الخلايا التي تم فيها تحفيز ICL انخفاضا في MOTM (الشكل 8C)28.
تشكيل وإصلاح الحمض النووي ICL الناجم عن سيسبلاتين في خط خلايا سرطان المبيض التمثيلي
تم استخدام HTP ACA المعدل بواسطة ICL لتحديد المسار الزمني لتشكيل الحمض النووي ICL وإصلاحه الناجم عن سيسبلاتين في خط خلايا سرطان المبيض (A2780; جدول المواد). عولجت الخلايا ب 100 ميكرومتر سيسبلاتين لمدة 1 ساعة ، ثم تم احتضانها في وسائط خالية من سيسبلاتين (RPMI 1640 متوسطة مكملة بمصل بقري جنيني بنسبة 10٪ (v / v)) لدورة زمنية لاحقة. وفي نقاط زمنية مختلفة، أجري اختبار HTP ACA المعدل بواسطة ICL لتحديد مستويات ICL (الشكل 9)28. لم يتم الكشف عن ICL قبل علاج سيسبلاتين. ومع ذلك ، بعد علاج واحد مع سيسبلاتين 100 ميكرومتر ، زادت مستويات ICL بشكل كبير ، وبلغت ذروتها عند 12 ساعة ، وبعد ذلك انخفضت المستويات مرة أخرى إلى الصفر بعد 30 ساعة.
العلاقة بين الحمض النووي ICL ومستويات الحمض النووي البلاتينية
تم علاج ثلاث خلايا سرطانية المبيض باستخدام سيسبلاتين 100 ميكرومتر للحث على مستويات مختلفة من الحمض النووي-ICL ، قبل التحليل بواسطة HTP ACA المعدل بواسطة ICL وقياس الطيف الكتلي المقترن بالحث (ICP-MS ؛ انظر الملف التكميلي للحصول على التفاصيل). وكما هو مبين في الشكل 10، تم تحفيز مستويات مختلفة من الحمض النووي-ICL في خطوط الخلايا الثلاثة، جنبا إلى جنب مع مستويات مختلفة من Pt في الحمض النووي. ولوحظت علاقة إيجابية (R2 = 0.9235) بين مستويات الحمض النووي ICL وتركيزات البلاتين، مما يشير إلى الارتباط بين مستويات البلاتين الحمض النووي و ICL28 المقابلة.
إصلاح استئصال القاعدة في خلايا BE-M17 المصابة وغير المصابة بالميكوبلازما
عولجت خلايا BE-M17 المصابة وغير المصابة بالميكوبلازما ب 50 ميكرومتر H 2 O 2 لمدة 30 دقيقة وتم احتضانها بوسط كامل (وسط النسر المعدل من دولبيكو مكمل بنسبة 10٪ (v / v) FBS) لفترات مختلفة (0 دقيقة ، 30 دقيقة ، 1 ساعة ،2ساعة ، 6 ساعات ، 24 ساعة ، أو 30 ساعة) سمح خلالها للخلايا بالإصلاح. في كل نقطة زمنية ، تم جمع الخلايا وتجميدها عند -80 درجة مئوية ، في وسط يحتوي على 10٪ من DMSO ، قبل إجراء HTP ACA المعدل من hOGG1 (الخطوة 6). بعد 30 دقيقة ، انخفضت مستويات SB / ALS إلى 21٪ TD (النسبة المئوية للحمض النووي الذيل) في الخلايا غير المصابة ، في حين أظهرت الخلايا المصابة 49٪ TD (الشكل 11A). بعد حوالي 15 ساعة ، عادت مستويات SB / ALS إلى خط الأساس في كل من الخلايا المصابة وغير المصابة. بالنسبة للبيورينات المؤكسدة ، أظهر BE-M17 غير المصاب في البداية زيادة طفيفة في الضرر ، قبل العودة إلى خط الأساس في غضون 30 ساعة (الشكل 11B). وعلى النقيض من ذلك، أظهرت الخلايا المصابة زيادة مستدامة وكبيرة في البيورينات المؤكسدة، التي ظلت مرتفعة، ولم تعد إلى مستويات خط الأساس حتى بعد 30 ساعة (الشكل 11 ب)23.
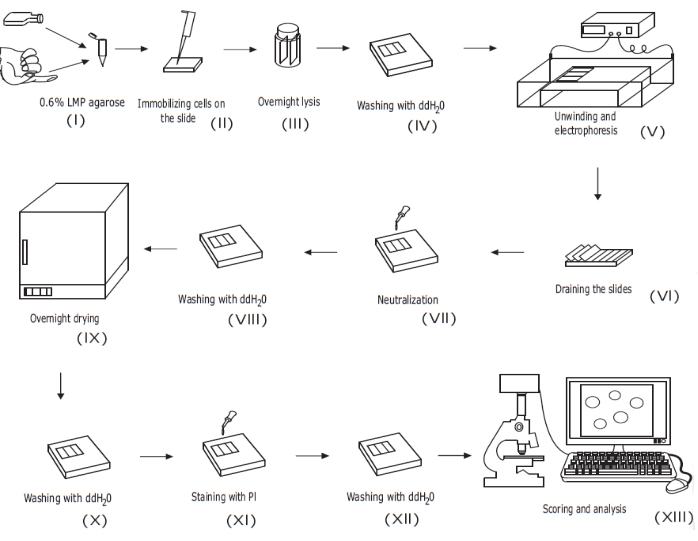
الشكل 1: نظرة عامة على إجراء فحص المذنبات القلوية التقليدية . (i) يتم خلط تعليق خلية واحدة للخلايا المستزرعة أو عينة من الدم الكامل مع 0.6٪ (ث / v) LMP agarose. '2' يطبق خليط الخلية/الأغاروز على شرائح المجهر المطلية مسبقا ويغطى بغطاء حتى يتصلب. (iii) يتم تحليل الخلايا باستخدام مخزن مؤقت لتحلل الأس الهيدروجيني عالي بين عشية وضحاها ، لتشكيل أجسام نووية ، قبل (iv) الغسيل باستخدام ddH2O. (v) يتفكك الحمض النووي الخلوي في المخزن المؤقت للرحلان الكهربائي عالي الأس الهيدروجيني. يسمح وجود فواصل حبلا للحمض النووي بالاسترخاء والاسترخاء ، وتحت الرحلان الكهربائي ، يتم سحب الحمض النووي من الجسم النووي ، مما يشكل ذيلا. ثم يتم تصريف الشرائح (vi) وتجفيفها وتحييدها (vii) وغسلها (viii) باستخدام ddH2O قبل (ix) تجفيفها بين عشية وضحاها. ثم يتم إعادة ترطيب الشرائح (x) باستخدام ddH2O ، (xi) ملطخة ، (xii) مغسولة ، وأخيرا (xiii) يتم تسجيلها وتحليلها ، عادة باستخدام المجهر الفلوري وبرنامج تحليل الصور. وهذا الرقم مستنسخ من منشور سابقرقم 20. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: المواد التي يتألف منها نظام الرحلان الكهربائي للمذنبات عالي الإنتاجية. يتم عرض خزان الرحلان الكهربائي HTP ورفوف HTP وأطباق التحلل والغسيل والتحييد والتلطيخ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
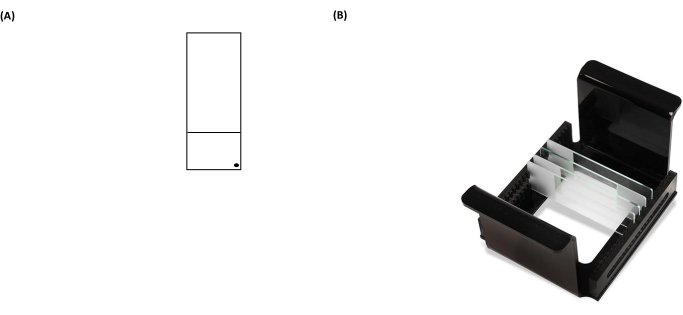
الشكل 3: صور تمثيلية لشريحة فحص مذنب ورف HTP (حامل شريحة المجهر). (أ) للتوجيه الصحيح ، يتم التعرف على الوجه المطلي مسبقا لشريحة المجهر بواسطة نقطة سوداء في الزاوية اليمنى من شريحة المجهر. (ب) توضح صورة حامل HTP كيفية الاحتفاظ بالشرائح في اتجاه رأسي ضيق ، مع علامات تبويب على الناقل لإصلاح اتجاهه داخل خزان الرحلان الكهربائي. يمكن لكل شركة نقل استيعاب ما يصل إلى 25 منزلقا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تمثيل لوحة التبريد مع شرائح العينات وعبوات التجميد في مكانها.

الشكل 5: لقطة شاشة للمذنبات التمثيلية التي تم التقاطها أثناء التسجيل. HaCaTs (A) بدون علاج و (B) تعامل مع 1 J / cm2 UVB قبل إجراء HTP ACA. يمكن لمعظم حزم البرامج حساب مجموعة متنوعة من نقاط نهاية المذنب ، ولكن أكثرها شيوعا هي النسبة المئوية للحمض النووي للذيل (المفضل) أو لحظة الذيل بناء على هذه الصور (الأزرق: بداية الرأس ، الأخضر: منتصف الرأس ، والأرجواني: نهاية الذيل). شريط المقياس هو 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
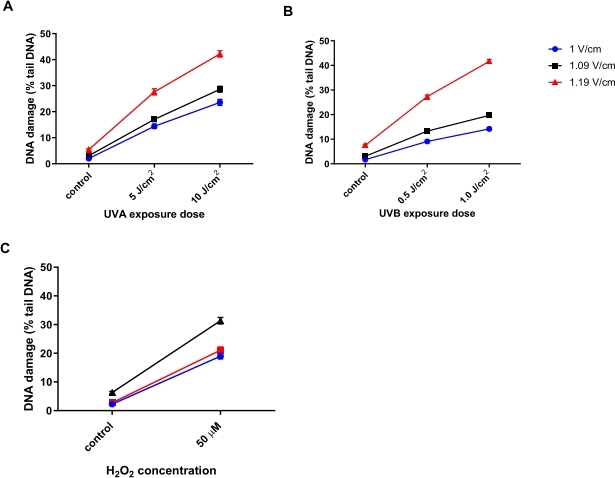
الشكل 6: رسوم بيانية تمثيلية توضح تأثير جهد الرحلان الكهربائي على النسبة المئوية للحمض النووي للذيل ، يتم تحديدها باستخدام HTP ACA. تعرضت الخلايا ل (A) 5 أو 10 J / cm 2 UVA ، (B) 0.5 أو 1.0 J / cm 2 UVB ، أو (C) 50 μM H 2 O 2 قبل HTP ACA ، مع جهد الكهربائي إما عند 1 أو 1.09 أو 1.19 فولت / سم. تمثل البيانات متوسط 200 تحديد من n = 2 تجارب مكررة31. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
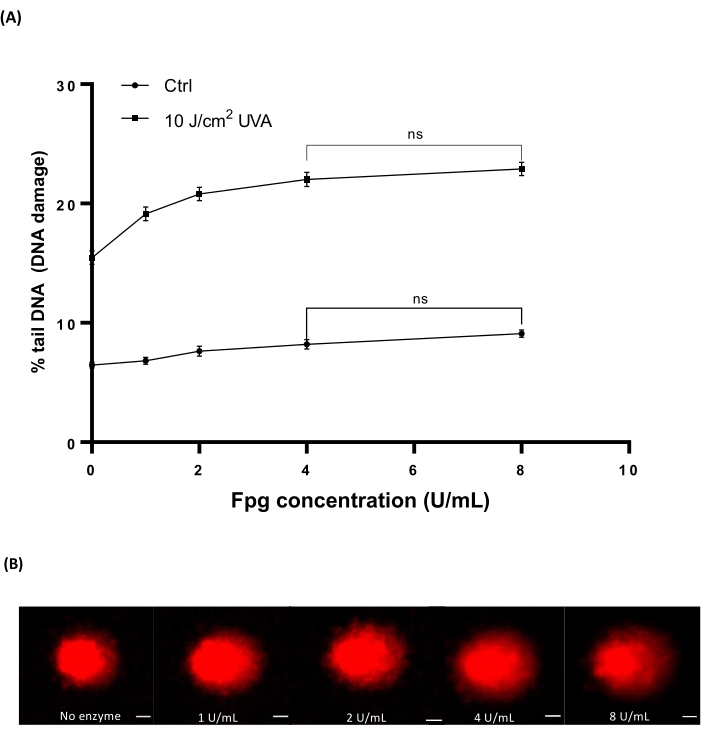
الشكل 7: الرسم البياني التمثيلي وصور المذنبات للدم البشري التي تم تحليلها بواسطة HTP ACA المعدل من Fpg. تم تشعيع عينات الدم البشري باستخدام 10 J / cm2 UVA أو التشعيع الصوري ("ctrl") على الجليد قبل خطوة التحلل. تم استخدام تركيزات مختلفة من Fpg (1 أو 2 أو 4 أو 8 U / mL) لعلاج الإنزيم قبل الرحلان الكهربائي. (أ) تمثل البيانات متوسط ± SEM البالغ 300 تحديد من تجارب n = 3. (ب) صور تمثيلية للمذنبات لكل تركيز من Fpg في عينات الدم المشععة 10 J/cm2 UVA. شريط المقياس هو 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
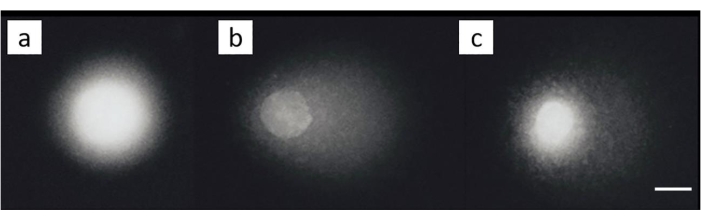
الشكل 8: صور المذنبات التمثيلية التي توضح اكتشاف ICL بعد معالجة سيسبلاتين. (A) خلايا التحكم دون أي علاج، (B) الخلايا التي عولجت ب H 2 O 2 (50 μM) فقط، (C) الخلايا التي عولجت ب H2O2 (50 μM) و cisplatin (200 μM)، مما يوضح أن الذيل أقصر مما كان عليه في (B)، بسبب وجود ICL28. شريط المقياس هو 10 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
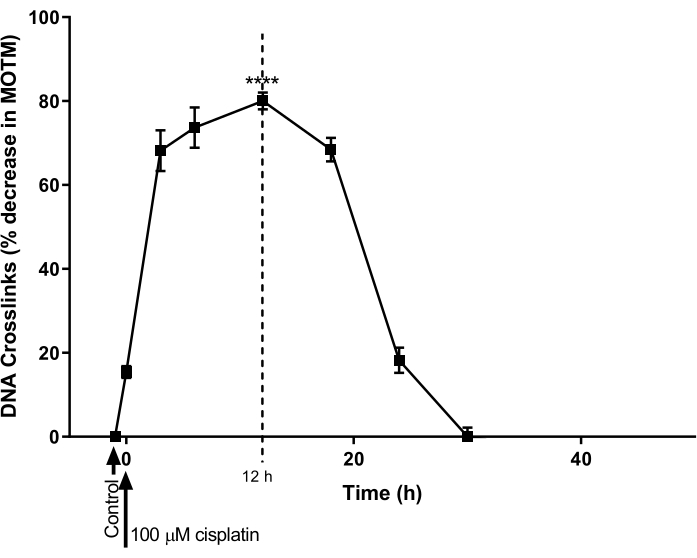
الشكل 9: عرض حركية تكوين ICL الناجم عن سيسبلاتين وإصلاحه. عولجت خلايا A2780 ب 100 ميكرومتر من سيسبلاتين في وسط الثقافة لمدة 1 ساعة. ثم تمت إزالة الوسط المحتوي على سيسبلاتين ، وتم استزراع الخلايا لنقاط زمنية مختلفة ، قبل التحليل بواسطة HTP ACA المعدل بواسطة ICL. تمثل البيانات متوسط ± SEM من n = 3 تجارب28. P < 0.0001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 10: العلاقة بين ICL الحمض النووي وتركيز البلاتين. تم تحديد ICL الحمض النووي بواسطة HTP ACA المعدل بواسطة ICL وتم قياس مستويات البلاتين بواسطة ICP-MS (مع تمييز الطاقة الرباعية الحركية المفردة ، SQ-KED) ، في ثلاثة خطوط خلايا سرطان المبيض. R2 = 0.9235. انظر الملف التكميلي لمنهجية ICP-MS لتحديد مستويات البلاتين في الحمض النووي28. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
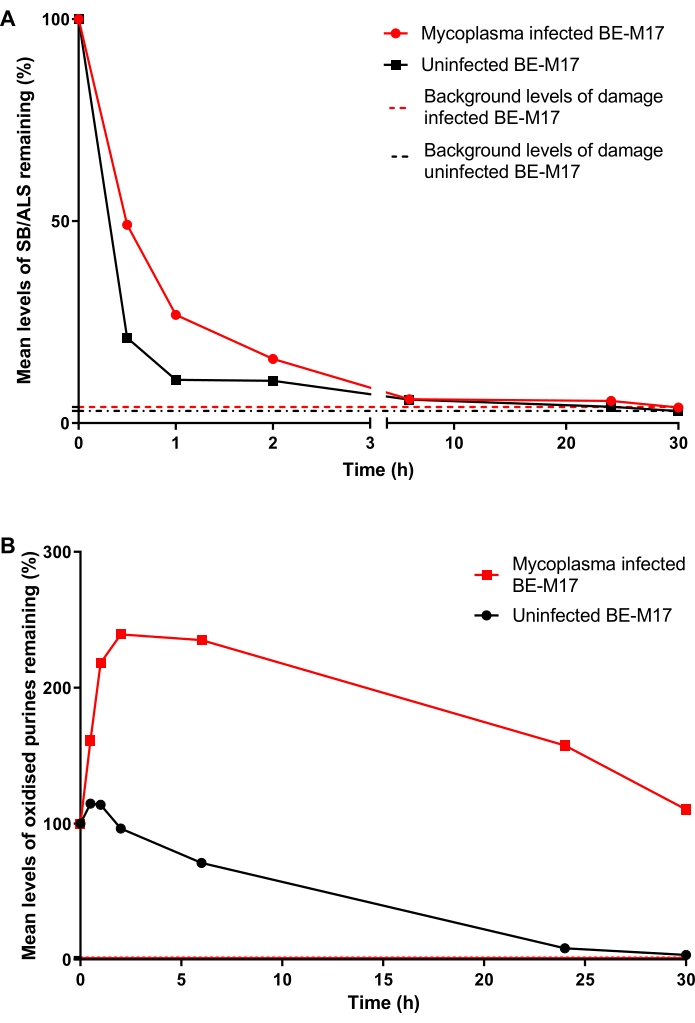
الشكل 11: رسم بياني تمثيلي يوضح تلف الحمض النووي وإصلاحه ، يحدده فحص المذنب المعدل من hOGG1 ، في خلايا الميكوبلازما المصابة مقابل خلايا BE-M17 غير المصابة. بعد العلاج ب 50 ميكرومتر H 2 O 2 لمدة 30 دقيقة ، سمح للخلايا بالإصلاح لفترات مختلفة (0 ، 30 دقيقة ، 1 ساعة ،2ساعة ، 6 ساعات ، 24 ساعة ، أو 30 ساعة). تم استخدام HTP ACA المعدل من hOGG1 لقياس (A) SB / ALS و (B) البيورينات المؤكسدة في خلايا BE-M17 المصابة (نقاط البيانات الحمراء) وغير المصابة (نقاط البيانات السوداء). تمثل البيانات متوسط 200 تحديد من n = 2 تجارب مكررة. وهذا الرقم مستنسخ بإذن من منشور سابق23. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الكاشف | حلول الأسهم | حل عملي | |
| المخزن المؤقت للتحلل | 100 mM Na 2 EDTA و 2.5 M NaCl و 10 mM Tris Base في ddH2O ؛ ضبط الرقم الهيدروجيني إلى 10 مع 10 M NaOH | 1٪ تريتون X-100 في حل مخزون التحلل | |
| المخزن المؤقت الكهربائي | 10 M NaOH و 200 mM Na 2 EDTA فيddH2O | 300 mM NaOH و 1 mM Na2EDTA ؛ الرقم الهيدروجيني > 13 | |
| المخزن المؤقت للتحييد | 0.4 M قاعدة تريس في ddH2O ؛ ضبط الرقم الهيدروجيني إلى 7.5 مع HCl | ||
| عازل تلطيخ | 1 ملغم/مل يوديد البروبيديوم | 2.5 ميكروغرام / مل يوديد البروبيديوم في ddH2O | |
الجدول 1: تكوين الكواشف المستخدمة في HTP ACA. يتم عرض المخزون وتركيزات العمل من التحلل ، والرحلان الكهربائي ، والتحييد ، والمخازن المؤقتة تلطيخ.
ملف تكميلي. يرجى النقر هنا لتنزيل هذا الملف.
Discussion
توضح هذه الدراسة التنوع الذي توفره المعدات الحالية ، والتي يمكن استخدامها لتحقيق إنتاجية عالية مع مجموعة متنوعة من المتغيرات التمثيلية الشائعة لفحص المذنب (أي القلوية ، المعدلة بالإنزيم ، الدم ، و ICL ، وغيرها من المتغيرات ستكون مناسبة أيضا). وبالإضافة إلى ذلك، فإن النهج الحالي يجلب معه عدة فوائد20،21: (أ) انخفاض وقت تشغيل الفحص بسبب التلاعب بشرائح متعددة بالتوازي (ينخفض وقت المعالجة بنسبة 60 في المائة)؛ (ب) انخفاض وقت إجراء الفحص بسبب التلاعب بشرائح متعددة بالتوازي (ينخفض وقت المعالجة بنسبة 60 في المائة)؛ (ب) انخفاض وقت إجراء الفحص بسبب التلاعب بشرائح متعددة بالتوازي (ينخفض وقت المعالجة بنسبة 60 في المائة)؛ (ب) انخفاض وقت إجراء الفحص بسبب التلاعب بشرائح متعددة بالتوازي (ينخفض وقت المعالجة بنسبة 60 في المائة)؛ (ب) انخفاض وقت إجراء الفحص بسبب التلاعب بشرائح متعددة بالتوازي (ينخفض وقت (ب) خطر تلف المواد الهلامية، وبالتالي تقليل المخاطر التي تتعرض لها التجربة؛ (ج) انخفاض الاحتياجات من الكواشف (على سبيل المثال، يكون حجم خزان الرحلان الكهربائي أصغر من الخزان التقليدي)؛ (د) زيادة عدد الشرائح التي يتم تشغيلها. يمكن أن يوفر خزان واحد زيادة بنسبة 20٪ في عدد الشرائح التي يتم تشغيلها مقارنة بخزان تقليدي واحد ؛ ومع ذلك ، يمكن تشغيل أو استعباد خزانات متعددة للرحلان الكهربائي (أي خزانات متعددة يتم التحكم فيها بواسطة مصدر طاقة واحد) ، بالتوازي مع نفس مصدر الطاقة ، ولا تزال تتطلب بصمة على الطاولة أصغر من خزان تقليدي واحد مع صينية ثلج ؛ و (ه) انخفاض بصمة الخزان بسبب الاتجاه الرأسي للشرائح والتبريد المتكامل (يوفر مساحة المختبر) ؛ يتكون خزان HTP من قاعدة تبريد سيراميك عالية الأداء مع درج منزلق يمكن أن يتسع لحزمة تبريد مجمدة واحدة للحفاظ على درجة حرارة التخزين المؤقت المثلى دون الحاجة إلى إجراء العملية في غرفة باردة.
علاوة على ذلك ، فإن لوحة التبريد التي طورناها تستوعب 26 شريحة مذنب ، وتمكن من التصلب السريع للأغاروز منخفض درجة الانصهار على شرائح فحص المذنب وتسهل استرجاع الشرائح بسهولة بعد تصلب هلام الأغاروز. الابتكارات المذكورة أعلاه تجعل عملية فحص المذنب أبسط وأسهل.
وفي حين تم تطوير نهج أخرى عالية الإنتاجية (على سبيل المثال، فحص المذنبات المكونة من 12 هلام، أو CometChip، أو 96 شكلا من أشكال الهلام الصغير)25، يفضل العديد من العلماء استخدام شرائح المجهر التقليدية (التي تشمل الشرائح المغلفة مسبقا المتاحة تجاريا، أو غيرها من الشرائح المتخصصة). يمكن أن يستوعب النهج الحالي جميع أنواع شرائح المجهر ، مما يسمح بتوسيع نطاق التجارب التي تستخدم هذه الشرائح من خلال معالجة الشرائح ومعالجتها بشكل أسرع. كما ذكر أعلاه ، فإن نظام المذنب HTP يجلب العديد من المزايا ، ولكن هناك قيد واحد ملحوظ: النهج الحالي يوفر زيادة بنسبة 20٪ فقط في عدد العينات التي يتم تشغيلها ، مقارنة بالخزان الأفقي التقليدي (على الرغم من أن معالجة الشرائح أسرع بكثير). تعمل تنسيقات CometChip و 96 mini-gel على تشغيل عدد أكبر من العينات. حتى الآن ، لا نعرف ما إذا كان النهج الحالي يمكن أن يستوعب CometChip أو 96 تنسيقات هلام صغير ، على الرغم من أننا نتوقع أنه سيكون. كما ذكر أعلاه ، يمكن زيادة عدد العينات عن طريق استعباد الخزانات إلى مصدر طاقة واحد. كما هو الحال مع جميع الأساليب ، لا تزال هناك فرصة لفقدان أو إتلاف المواد الهلامية أثناء تحميل العينات وتحليلها تحت المجهر ، ولكن هذا يرجع أكثر إلى خطأ المشغل ، ويتم تقليل فرص ذلك مع النهج الحالي.
يمكن أن يساعد استخدام نظام المذنب HTP بشكل كبير في تحليل تلف الحمض النووي ، مما يسهل استخدام فحص المذنب في مجموعة واسعة من التطبيقات ، مثل علم الأوبئة الجزيئي ، والعلوم الإنجابية للذكور ، ودراسات السموم الوراثية ، وعلم السموم البيئية. وينطبق هذا بشكل خاص على المستخدمين الذين يرغبون في الحصول على جميع فوائد تحسين الإنتاجية وسهولة الاستخدام ، دون الابتعاد عن شرائح المجهر التقليدية المألوفة والفعالة من حيث التكلفة.
Disclosures
الدكتور كوك والدكتور كارباشي مخترعان في ثلاث براءات اختراع ممنوحة تتعلق بالتقنيات الموضحة هنا.
Acknowledgements
تم دعم العمل المبلغ عنه في هذا المنشور ، جزئيا ، من قبل المعهد الوطني لعلوم الصحة البيئية التابع للمعاهد الوطنية للصحة تحت رقم الجائزة: 1R41ES030274. المحتوى هو مسؤولية المؤلفين فقط ولا يمثل بالضرورة وجهة النظر الرسمية للمعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| 22 x 22 mm glass coverslips | Fisher Scientific, Hampton, NH, USA | 631-0124 | |
| A2780 | ECACC, Louis, MO, USA | 93112519 | |
| Concentrated nitric acid (OptimaTM grade) | Fisher Scientific Fair Lawn, NJ, USA | A467-250 | |
| Fluorescence microscope equipped with a camera | Zeiss, Jena, Germany | ||
| Fresh human whole blood | Zen Bio Inc | SER-WB10ML | Commercial human whole blood sample |
| GraphPad Prism | GraphPad Software, San Diego, California | Data analysis software | |
| HTP Comet Assay system | Cleaver Scientific | COMPAC- 50 | |
| Human Keratinocyte (HaCaTs) | American Type Culture Collection (ATCC), Manassas, VA, USA | Discontinued | Can be purchased from another company ADDEXBIO TECHNOLOGIES Cat# T0020001 |
| Hydrogen peroxide (H2O2) 30% in water | Fisher Scientific, Hampton, NH, USA | BP2633-500 | |
| ICP-MS iCAP RQ ICP-MS system | Thermo Scientific, Waltham, MA, USA | IQLAAGGAAQFAQKMBIT | |
| Image and Data Analysis software | Perceptive Instrument, Bury St Edmunds, England, UK | 125525 | Free image analysis softwared is available e.g., ImageJ |
| Internal Standard Mix | SPEX Certiprep, Metuchen, NJ, USA | CL-ISM1-500 | Bismuch (isotope monitored 209 Bi)-concnetration of 10 µg/mL in 5% HNO3 |
| Low melting point Agarose | Invitrogen Waltham, MA, USA | P4864 | |
| Na2EDTA (disodium ethylenediaminetetraacetic acid) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| NaCl (Sodium chloride) | Sigma Aldrich, St. Louis, MO, USA | S7653 | |
| NanoDrop One | Thermo Scientific, Waltham, MA, USA | 701-058108 | Nanodrop for measuring DNA concentration |
| Nanopure Infinity Ultrapure Water System (Barnstead Nanopure) | Thermo Scientific, Waltham, MA, USA | D11901 | Ultrapure water (16 MΩ cm-1) |
| NaOH (sodium Hydroxide) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| Normal melting point Agarose | Fisher Scientific, Hampton, NH, USA | 16520100 | For pre-coating slides |
| OCI-P5X | University of Miami, Miami, FL, USA | N/A | Live Tumor Culture Core facility provided the cells |
| Platinum (Pt) reference standard | SPEX Certiprep, Metuchen, NJ, USA | PLPT3-2Y | (1000 µg/mL in 10% HCl) containing Bismuch |
| Propidium Iodide (1.0 mg/mL in water) | Sigma Aldrich, St. Louis, MO, USA | 12-541BP486410ML | |
| QIAamp DNA Mini Kit | Qiagen Valencia, CA, USA | 51304 | DNA extraction Kit |
| Single-frosted glass microscope slides | Fisher Scientific, Hampton, NH, USA | 12-541B | |
| SKOV3 | ECACC, Louis, MO, USA | 91091004 | |
| Slide box | Fisher Scientific, Hampton, NH, USA | 03-448-2 | Light proof, to protect cells from the formation adventitious damage (according to the widely held view) and prevent fading of the fluorescent dye |
| Slide Chilling plate | Cleaver Scientific, Rugby, England, UK | CSL-CHILLPLATE | |
| Treatment dish | Cleaver Scientific, Rugby, England, UK | STAINDISH4X | |
| Tris-base | Sigma Aldrich, St. Louis, MO, USA | 93362 | |
| Triton X-100 | Fisher Scientific, Hampton, NH, USA | BP151-500 | |
| Trypsin EDTA (0.5%) | Invitrogen Gibco, Waltham, MA, USA | 15400054 | |
| Vertical Slide Carrier | Cleaver Scientific, Rugby, England, UK | COMPAC-25 |
References
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46 (5), 1213-1224 (2018).
- Evans, M. D., Cooke, M. S. Factors contributing to the outcome of oxidative damage to nucleic acids. Bioessays. 26 (5), 533-542 (2004).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutatation Research. 567 (1), 1-61 (2004).
- Miyamae, Y., et al. Detection of DNA lesions induced by chemical mutagens using the single-cell gel electrophoresis (comet) assay. 2. Relationship between DNA migration and alkaline condition. Mutatation Research. 393 (1-2), 107-113 (1997).
- Angelis, K. J., Dusinská, M., Collins, A. R. Single cell gel electrophoresis: detection of DNA damage at different levels of sensitivity. Electrophoresis. 20 (10), 2133-2138 (1999).
- Duarte, T. L., Cooke, M. S., Jones, G. D. Gene expression profiling reveals new protective roles for vitamin C in human skin cells. Free Radical Biology & Medicine. 46 (1), 78-87 (2009).
- Karbaschi, M., et al. Rescue of cells from apoptosis increases DNA repair in UVB exposed cells: implications for the DNA damage response. Toxicology Research. 4 (3), 725-738 (2015).
- Wu, J. H., Jones, N. J. Assessment of DNA interstrand crosslinks using the modified alkaline comet assay. Methods in Molecular Biology. 817, 165-181 (2012).
- Merk, O., Speit, G. Detection of crosslinks with the comet assay in relationship to genotoxicity and cytotoxicity. Environmental and Molecular Mutagenesis. 33 (2), 167-172 (1999).
- Spanswick, V. J., Hartley, J. M., Hartley, J. A. Measurement of DNA interstrand crosslinking in individual cells using the Single Cell Gel Electrophoresis (Comet) assay. Methods in Molecular Biology. 613, 267-282 (2010).
- Saha, D. T., et al. Quantification of DNA repair capacity in whole blood of patients with head and neck cancer and healthy donors by comet assay. Mutation Research. 650 (1), 55-62 (2008).
- Giovannelli, L., Pitozzi, V., Riolo, S., Dolara, P. Measurement of DNA breaks and oxidative damage in polymorphonuclear and mononuclear white blood cells: a novel approach using the comet assay. Mutatation Research. 538 (1-2), 71-80 (2003).
- Al-Salmani, K., et al. Simplified method for the collection, storage, and comet assay analysis of DNA damage in whole blood. Free Radical Biology & Medicine. 51 (3), 719-725 (2011).
- Akor-Dewu, M. B., et al. Leucocytes isolated from simply frozen whole blood can be used in human biomonitoring for DNA damage measurement with the comet assay. Cell Biochemistry and Function. 32 (3), 299-302 (2014).
- Ge, J., et al. CometChip: a high-throughput 96-well platform for measuring DNA damage in microarrayed human cells. Journal of Visualized Experiments: JoVE. (92), e50607 (2014).
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochemical and Biophysical Reseach Communications. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Experimental Cell Research. 175 (1), 184-191 (1988).
- Karbaschi, M., et al. Evaluation of the major steps in the conventional protocol for the alkaline comet assay. International Journal of Molecular Sciences. 20 (23), 6072 (2019).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Scientific Reports. 4 (1), 7200 (2014).
- Karbaschi, M., Cooke, M. S. Chilling apparatus. USA patent. , (2020).
- Cooke, M. S., Karbaschi, M. Method and apparatus for performing electrophoresis. USA patent. , (2019).
- Ji, Y., Karbaschi, M., Cooke, M. S. Mycoplasma infection of cultured cells induces oxidative stress and attenuates cellular base excision repair activity. Mutatation Research. 845, 403054 (2019).
- Møller, P., et al. Minimum Information for Reporting on the Comet Assay (MIRCA): recommendations for describing comet assay procedures and results. Nature Protocols. 15 (12), 3817-3826 (2020).
- Almeida, G. M., Duarte, T. L., Steward, W. P., Jones, G. D. Detection of oxaliplatin-induced DNA crosslinks in vitro and in cancer patients using the alkaline comet assay. DNA Repair (Amst). 5 (2), 219-225 (2006).
- Moneef, M. A., et al. Measurements using the alkaline comet assay predict bladder cancer cell radiosensitivity. British Journal of Cancer. 89 (12), 2271-2276 (2003).
- Bowman, K. J., et al. Comet assay measures of DNA damage are predictive of bladder cancer cell treatment sensitivity in vitro and outcome in vivo. International Journal of Cancer. 134 (5), 1102-1111 (2014).
- Abdulwahed, A. M. S. . Investigation of DNA Damage and Genomic Organization in the Cellular Response to Platinum Chemotherapy. , (2020).
- Olive, P. L., Banáth, J. P., Durand, R. E. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the "comet" assay. Radiation Research. 122 (1), 86-94 (1990).
- Kumaravel, T. S., Vilhar, B., Faux, S. P., Jha, A. N. Comet Assay measurements: a perspective. Cell Biology and Toxicology. 25 (1), 53-64 (2009).
- Ji, Y. . Formation and Repair of Environmetally-induced damage to Mitochondrial and Nuclear Genomess. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved