Method Article
Ein Hochdurchsatz-Comet-Assay-Ansatz zur Beurteilung zellulärer DNA-Schäden
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Der Kometentest ist ein beliebtes Mittel zum Nachweis von DNA-Schäden. Diese Studie beschreibt einen Ansatz zum Ausführen von Objektträgern in repräsentativen Varianten des Kometenassays. Dieser Ansatz erhöhte die Anzahl der Proben signifikant und verringerte gleichzeitig die Assay-Laufzeit, die Anzahl der Objektträgermanipulationen und das Risiko einer Beschädigung von Gelen.
Zusammenfassung
Zellen sind ständig Agenzien aus der inneren und äußeren Umgebung ausgesetzt, die die DNA schädigen können. Dieser Schaden kann eine aberrante Zellfunktion verursachen, und daher können DNA-Schäden eine entscheidende Rolle bei der Entwicklung aller wichtigen menschlichen Krankheiten spielen, z. B. Krebs, neurodegenerative und kardiovaskuläre Erkrankungen und Alterung. Die Einzelzell-Gelelektrophorese (d. h. der Kometen-Assay) ist eine der gebräuchlichsten und empfindlichsten Methoden, um die Bildung und Reparatur einer Vielzahl von Arten von DNA-Schäden (z. B. Einzel- und Doppelstrangbrüche, alkalilabile Stellen, DNA-DNA-Vernetzungen und, in Kombination mit bestimmten Reparaturenzymen, oxidierte Purine und Pyrimidine), sowohl in vitro als auch in vivo zu untersuchen. Systeme. Der geringe Probendurchsatz des konventionellen Assays und die aufwändige Probenaufarbeitung sind jedoch limitierende Faktoren für eine möglichst breite Anwendung. Da das "Scoring" von Kometen zunehmend automatisiert wird, besteht die Einschränkung nun in der Fähigkeit, eine beträchtliche Anzahl von Kometenrutschen zu verarbeiten. Hier wurde eine Hochdurchsatzvariante (HTP) des Comet-Assays (HTP Comet Assay) entwickelt, die die Anzahl der analysierten Proben, die Assay-Laufzeit, die Anzahl der einzelnen Objektträgermanipulationen, den Reagenzienbedarf und das Risiko einer physikalischen Beschädigung der Gele deutlich erhöht. Darüber hinaus wird der Platzbedarf des Elektrophoresebehälters durch die vertikale Ausrichtung der Objektträger und die integrierte Kühlung deutlich verringert. Hier wird auch ein neuartiger Ansatz zum Abkühlen von Kometen-Assay-Objektträgern beschrieben, der die Verfestigung der Kometengele bequem und effizient erleichtert. Hier wurde die Anwendung dieser Geräte auf repräsentative Kometen-Assay-Methoden beschrieben. Diese einfachen Innovationen unterstützen die Verwendung des Comet-Assays und seine Anwendung in Studienbereichen wie Expositionsbiologie, Ökotoxikologie, Biomonitoring, Toxizitätsscreening / -test sowie das Verständnis der Pathogenese erheblich.
Einleitung
Zellen sind ständig Agenzien aus der inneren und äußeren Umgebung ausgesetzt, die DNA schädigen können 1,2. Dieser Schaden kann eine aberrante Zellfunktion verursachen3, und daher können DNA-Schäden eine entscheidende Rolle bei der Entwicklung vieler schwerer menschlicher Krankheiten spielen, z. B. Krebs, neurodegenerative und kardiovaskuläre Erkrankungen und Alterung4. Der Comet-Assay (auch Einzelzell-Gelelektrophorese genannt) ist eine immer beliebter werdende Methode zum Nachweis und zur Quantifizierung zellulärer DNA-Schäden.
Im einfachsten Fall erkennt der alkalische Kometentest (ACA) Strangbrüche (SB; sowohl einfach als auch doppelt), zusammen mit apurinischen/apyrimidinischen Stellen und alkalilabilen Stellen (ALS), die beide unter alkalischen Bedingungen zu Einzelstrangbrüchen werden5. Der pH-neutrale Kometen-Assay kann offene Einzel- und Doppelstrangbrüche bewerten6. Darüber hinaus kann der ACA in Kombination mit einer Reihe von DNA-Reparaturenzymen eine beträchtliche Anzahl von Arten von DNA-Schäden nachweisen, z. B. oxidierte Purine (identifiziert durch die Verwendung der humanen 8-Oxoguanin-DNA-Glykosylase 1; hOGG17); oxidierte Pyrimidine (unter Verwendung von Endonuklease III; EndoIII) und Cyclobutanpyrimidin-Dimere (unter Verwendung der T4-Endonuklease V; T4endoV)8. Der Comet-Assay kann auch verwendet werden, um DNA-Läsionen zu bewerten, die durch Vernetzer wie Cisplatin 9,10,11 induziert werden. Wie aus dem formalen Namen des Assays hervorgeht, d. h. Einzelzell-Gelelektrophorese, beruht der Assay darauf, dass die zu analysierenden Zellen eine Einzelzellsuspension sind; Am häufigsten sind dies kultivierte Zellen, können aber aus Vollblut12,13 isoliert werden, oder Vollblut selbst kann verwendet werden14,15. Alternativ kann eine einzellige Suspension aus festem Gewebe erzeugt werden.
Abgesehen von wenigen Ausnahmen, vor allem den CometChip-Berichten aus dem Engleward-Labor 16, hat sich das gesamte Kometen-Assay-Protokoll gegenüber dem ursprünglich von den Erfindern des Assays beschriebenen (Östling und Johansson17 und Singh etal.18) nicht dramatisch verändert. Der Kometen-Assay umfasst zahlreiche Schritte (Abbildung 1). Viele dieser Schritte beinhalten die Übertragung der dünnen, zellhaltigen Agarosegele, einen Objektträger nach dem anderen, und stellen daher ein Risiko der Beschädigung oder des Verlusts des Gels dar, was den Erfolg des Experiments gefährdet. Folglich kann der Kometentest zeitaufwendig sein, insbesondere wenn eine signifikante Anzahl von Objektträgern durchgeführt wird. Typischerweise werden maximal 40 Objektträger in einem großen (33 cm x 59 cm x 9 cm) Elektrophoresetank betrieben, der sich in einer noch größeren Wanne mit nassem Eis zur Kühlung befindet. Es wurde kürzlich berichtet, dass die Assay-Laufzeit auf 1 Tag verkürzt werden kann, indem die Dauer des Lyseschritts verringert wird und die Objektträger nicht vor dem Färbengetrocknet werden 19.
Die vorliegenden Autoren haben zuvor einen neuartigen Ansatz für den Hochdurchsatz-Alkali-Comet-Assay (HTP ACA) berichtet, bei dem mehrere (Chargen von 25) Kometen-Assay-Objektträger während des gesamten Kometen-Assay-Prozesses gleichzeitig manipuliert werden können20,21,22. Dieser patentierte Ansatz minimiert das Risiko einer Beschädigung oder eines Verlusts der probenhaltigen Gele, indem die Notwendigkeit entfällt, die Objektträger einzeln zu manipulieren, und kann auf alle Varianten des Kometentests angewendet werden, die Objektträger verwenden. Die Objektträger-Racks schützen die Gele während der Manipulationen, so dass die Probenverarbeitung schneller und effizienter ist. Die Objektträger können auch einer Elektrophorese in den Racks unterzogen werden, die in vertikaler und nicht in horizontaler Ausrichtung gehalten wird. Dies und die integrierte Kühlung verringern den Platzbedarf des Elektrophoresetanks erheblich und machen nasses Eis überflüssig. Zusammengenommen stellt dies eine deutliche Verbesserung gegenüber dem herkömmlichen Verfahren dar. Die verwendete Ausrüstung ist in Abbildung 2 dargestellt. Die hier beschriebenen Protokolle, die diesen neuartigen Ansatz verwenden, demonstrieren die repräsentative Anwendung auf kultivierte Zellen und Vollblut14 zum Nachweis von alkalilabilen Stellen (ALS), DNA-Interstrang-Crosslinks (ICL) und den Substraten verschiedener DNA-Reparaturenzyme.
Protokoll
In der vorliegenden Studie wurden kommerziell verfügbare Blutproben verwendet. An unserer Institution ist für die Verwendung von kommerziell erhältlichem Blut keine Genehmigung des Institutional Review Board erforderlich.
1. Vorbereitung der Materialien für den Kometentest
- Vorbereitung der Objektträger
- Gießen Sie 1% (w/v) normale Schmelzpunktagarose [gelöst in doppelt destilliertem Wasser (ddH2O)] in ein 50-ml-Röhrchen und eine Mikrowelle, um die Agarose in derddH2O aufzulösen. Sollte eine Erstarrung auftreten, entsorgen und frisch zubereiten.
- Vorbeschichtung von Objektträgern durch Eintauchen der Objektträger in das 50-ml-Röhrchen mit 1% (w/v) normalem Schmelzpunktagarose.
- Wischen Sie die Rückseite der Dias nach dem Eintauchen der Dias schnell ab.
HINWEIS: Wenn die Rückseite der Objektträger nicht richtig abgewischt wird, erhöht sich das Hintergrundrauschen der Objektträger während des Analyseschritts mit dem Mikroskop. - Beschriften Sie den beschichteten Objektträger mit einem permanenten Marker in der unteren rechten Ecke des mattierten Abschnitts (Abbildung 3A). Dies zeigt, welche Seite des Objektträgers vorbeschichtet ist.
- Die Agarose aushärten lassen und über Nacht bei Raumtemperatur trocknen.
- Die getrockneten Dias in Seidenpapier einwickeln und in einer Schachtel aufbewahren.
2. Vorbereitung der Proben
- Kultivierte Zellen
HINWEIS: Behandeln Sie zunächst die Zellen mit dem/den schädigenden Wirkstoff(en), bevor Sie mit dem Kometentest beginnen. Führen Sie dann die folgenden Schritte aus.- Wenn die Zellen anhaften, trypsinisieren Sie die Zellen, um sie aus dem Zellkulturkolben oder der Zellkultur-Petrischalen bei entsprechendem Zusammenfluss der Zellen zu befreien. Neutralisieren Sie Trypsin durch Zugabe von serumhaltigen Medien.
- Die Zellen in ein 50-ml-Röhrchen geben, zentrifugieren (z. B. für HaCaTs, Zentrifuge bei 300 x g für 5 min bei Raumtemperatur), den Überstand vorsichtig entfernen und 1 ml PBS in das Zellpellet geben.
- Führen Sie eine Zellzählung durch.
- 30.000 Zellen werden in ein 1,5-ml-Mikrozentrifugenröhrchen überführt und bei 7.607 x g für 5 min bei 4 °C zentrifugiert.
- Entfernen Sie vorsichtig den Überstand und lagern Sie das Zellpellet im Dunkeln auf Eis, bevor Sie den Kometentest durchführen.
HINWEIS: Zellen sollten vor der Durchführung des Kometentests regelmäßig auf Mykoplasmenkontamination getestet werden, um unter anderem die Bildung von artefaktischen DNA-Schäden und eine veränderte DNA-Schadensreaktion zu verhindern, wie an anderer Stelle berichtet23. Die Zentrifugationsbedingungen können je nach verwendetem Zelltyp bei Bedarf geändert werden.
- Vorbereitung kultivierter Zellen für den Reparaturtest
- Kulturzellen in der Zellkulturflasche oder Petrischale.
- Waschen Sie die Zellen zweimal mit 1 ml PBS, bevor Sie die Zellen mit schädlichen Mitteln behandeln (z. B. bei BE-M17-Zellen mit 50 μMH2O2für 20 min) auf Eis, um die Reparatur während der Behandlung zu verhindern.
- Waschen Sie die Zellen zweimal vorsichtig mit 1 ml PBS, um Schadstoffrückstände zu entfernen.
- Führen Sie das Zellkulturmedium wieder ein und lassen Sie die Zellen für unterschiedliche Zeiträume (z. B. 0 min, 30 min, 2 h, 6 h, 24 h und 30 h) in einem befeuchteten Inkubator (37 °C, 5% CO2) reparieren.
- Sammeln Sie zu jedem Zeitpunkt 30.000 Zellen in 10% Dimethylsulfoxid (DMSO)-haltigem Zellkulturmedium und lagern Sie sie bei -80 °C.
- Vor dem Comet-Assay die Zellen bei 37 °C im Wasserbad schnell auftauen und bei 7.607 x g für 5 min bei 4 °C zentrifugieren.
- Entfernen Sie den Überstand und lagern Sie das Zellpellet auf Eis, bevor Sie den Test durchführen (d. h. aus Schritt 3).
- Zubereitung von Vollblut
HINWEIS: Die folgende Methode profitiert davon, dass (i) es sich um einen minimalinvasiven Ansatz zur Entnahme einer Blutprobe handelt, (ii) keine Isolierung von PBMC vor dem Kometentest erforderlich ist und (iii) die Blutproben (mit einem Volumen < 250 μL) bei -80 °C bis zu 1 Monat gelagert werden können (obwohl neuere Erkenntnisse darauf hindeuten, dass eine längere Lagerung möglich ist). ohne Kryokonservierungsmittel und ohne Risiko oder artefaktische Schadensentstehung14. Eine ethische Genehmigung oder eine gleichwertige Genehmigung kann erforderlich sein, bevor Blutproben von Patienten oder Tieren entnommen werden. Alternativ können kommerziell erhältliche Blutproben wie in der vorliegenden Studie verwendet werden. An unserer Institution ist für die Verwendung von kommerziell erhältlichem Blut keine Genehmigung des Institutional Review Board erforderlich.- Mit einer Pipette werden Vollblutproben (<250 μL) (Table of Materials) in ein Entnahmeröhrchen überführt, das ein Mindestvolumen von 0,4 mg EDTA (pro 250 μl Blut) enthält.
- Die Blutproben werden vor dem HTP-Kometentest bei -80 °C eingefroren.
- Auftauen gelagerte Blutproben (<250 μL) bei Raumtemperatur, ohne zu erhitzen.
- Vor der Durchführung des Comet-Tests werden 5 μL Vollblut in Mikrozentrifugenröhrchen überführt (siehe Schritt 3).
3. Zelllyse
HINWEIS: Führen Sie alle Verfahren auf Eis durch.
- Verwenden Sie 12.000 Zellen oder 2,5 μL Vollblut pro Gel.
- 0,6% (w/v) in PBS gelöste Agarose mit niedrigem Schmelzpunkt mit einer Mikrowelle herstellen und in ein Wasserbad bei 37 °C geben, um ein Erstarren zu verhindern.
- Beschriften Sie das mattierte Ende der vorbeschichteten Objektträger mit dem Namen, dem Datum und den Behandlungsinformationen des Prüfers mit einem Permanentmarker oder Bleistift.
- Stellen Sie eine Kühlplatte auf eine flache Bank, und setzen Sie die beiden gefrorenen Kühlpakete in die verschiebbare Schublade unter der Metalloberfläche ein (siehe Abbildung 4)21.
- Legen Sie die Objektträger auf die Kühlplatte und lassen Sie die Objektträger 1-2 min vorkühlen, bevor Sie die 0,6% (w/v) Agarose-haltigen Zellen mit niedrigem Schmelzpunkt hinzufügen (Schritt 3.7).
HINWEIS: Wenn Sie die Objektträger länger als 1-2 Minuten auf der Kühlplatte belassen, kann sich aufgrund der Umgebungsfeuchtigkeit Kondenswasser auf der Objektträgeroberfläche bilden. Dies kann dazu führen, dass die Agarosegele mit niedrigem Schmelzpunkt auf den Objektträgern weniger stabil sind. - Das Pellet wird durch Wirbeln dispergiert (Schritt 2.2.7). Stellen Sie sicher, dass der gesamte Überstand aus dem Pellet entfernt wurde. Legen Sie die Probenröhrchen (mit den pelletierten Zellen) sofort wieder auf Eis.
HINWEIS: Wenn Sie die probenhaltigen Röhrchen in die Zentrifuge legen, legen Sie sie mit dem Scharnier nach außen, so dass das Pellet auf dieser Seite des Röhrchens gesammelt wird. Manchmal ist es schwierig, das Pellet zu sehen, und es ist leicht, es zu entfernen, während der Überstand entfernt wird. Durch Zentrifugieren mit dem Tubendeckel in dieser Ausrichtung weiß man, wo sich das Zellpellet befindet. - Resuspendieren Sie das Zellpellet mit 200 μL 0,6% Agarose mit niedrigem Schmelzpunkt (LMP-Agarose) und mischen Sie durch Pipettieren auf und ab, ohne Blasen zu erzeugen. Als nächstes schnell 80 μL LMP-agarosehaltige Zellen auf einen gekühlten Objektträger übertragen und schnell ein Deckglas auf das Gel legen.
- Lassen Sie das Gel 1-2 min auf der Kühlplatte aushärten.
- In der Zwischenzeit wird eine 500-ml-Arbeitslösung des Lysepuffers (Tabelle 1) vorbereitet und in die Lyseschale gegossen (Abbildung 2).
- Sobald die Gele fixiert sind, entfernen Sie die Deckgläser schnell, indem Sie den Schieber vorsichtig zwischen Daumen und Zeigefinger halten und das Deckglas vom Gel schieben.
- Legen Sie die Objektträger mit den Proben in den Objektträgerträger (alle schwarzen "Punkt"-Markierungen auf Objektträgern sollten in die gleiche Richtung zeigen, wenn sie in einen Träger gelegt werden) (Abbildung 3B), und platzieren Sie dann den Objektträgerträger in der Lyseschale (Abbildung 2).
- Schließen Sie den Deckel der Lyseschale und bewahren Sie die Lyseschale über Nacht bei 4 °C oder 30 min bei Raumtemperatur im Kühlschrank auf, je nachdem, was dem Zeitplan des Bedieners am besten entspricht19.
4. Elektrophorese
- Entfernen Sie vorsichtig den Objektträgerträger aus der Lyseschale. Achten Sie darauf, die Gele nicht zu stören.
- Legen Sie den Objektträger vorsichtig in eine mit eiskaltem ddH2O vorgeladene Waschschale und lassen Sie ihn 30 min stehen, damit die Objektträger vollständig mit ddH2O bedecktsind.
- Führen Sie ein gefrorenes Kühlpaket in die Schiebeschublade unter dem Elektrophoresetank ein, um die optimale Puffertemperatur aufrechtzuerhalten.
- Eiskalte Elektrophorese-Arbeitslösung (Tabelle 1) vorsichtig in den Elektrophoresebehälter geben und den Objektträgerträger in den Elektrophoresebehälter überführen. Richten Sie die Objektträger so aus, dass ihre klaren Teile mit den zellhaltigen Gelen (d.h. NICHT die mattierten / Markierungsenden) zur Kathode (rote Elektrode) zeigen.
- Lassen Sie die Objektträger 20 Minuten im Elektrophoresetank ruhen, damit sich die DNA entspannt und entspannt. Lassen Sie das Netzteil während dieses Schritts ausgeschaltet.
- Setzen Sie bei Bedarf ein neues gefrorenes Kühlpaket ein, um die Kühlung zu maximieren.
- Führen Sie eine Elektrophorese für 20 Minuten bei 1,19 V/cm oder unter den optimierten Bedingungen durch.
ANMERKUNG: Die Optimierung der Elektrophorese-Betriebsbedingungen und des Puffervolumens wird für jedes Laborempfohlen 24. Die Verwendung nur eines einzigen Objektträgers während der Elektrophorese verursacht keinen Einfluss von Objektträgern auf den Widerstand des Elektrophoresepuffers, und die Autoren sahen keinen signifikanten Effekt in der Spannung oder dem Strom, wenn sich die Anzahl der Objektträger änderte. - Schalten Sie die Stromversorgung aus, nehmen Sie den Objektträger vorsichtig aus dem Elektrophoresetank und lassen Sie ihn 30 s auf Seidenpapier abtropfen.
- Legen Sie den Objektträger in die Schale, die den Neutralisationspuffer enthält (Tabelle 1). Lassen Sie es für 20 min.
- Nehmen Sie den Objektträger aus der Neutralisationsschale, legen Sie ihn in die Waschschale, die eiskaltes ddH2O enthält, und lassen Sie ihn 20 min stehen.
- Nehmen Sie den Objektträger aus dem Wasser und lassen Sie die Objektträger in einem Inkubator bei 37 °C für 1 h oder bei Raumtemperatur über Nacht trocknen oder trocknen, je nach Zeitplan19 des Bedieners.
HINWEIS: Wenn in Schritt 4.11 nicht getrocknet wird, führen Sie den Färbeschritt ab 5.2 durch.
5. Propidiumiodid (PI) Färbung
- Den Objektträger zur Rehydrierung der Objektträger in eine Waschschale mit eiskaltemddH2Ogeben und 30 min stehen lassen.
- Legen Sie den Objektträger in eine Beibeschale mit 2,5 μg/ml Propidiumiodidlösung.
HINWEIS: Propidiumiodid ist lichtempfindlich, also behandeln Sie es in einem dunklen Bereich. Es ist auch giftig. - Schließen Sie den Deckel der Beizschale und brüten Sie ihn 20 min im Dunkeln bei Raumtemperatur aus.
- Den Objektträger in eine separate Schale geben und mit eiskaltemddH2O20 min waschen.
- Nehmen Sie den Objektträger aus der Schale und trocknen Sie ihn vollständig im Dunkeln, entweder in einem 37 °C Inkubator oder bei Raumtemperatur, je nach Zeitplan oder Wunsch des Bedieners.
- Sobald die Dias vollständig getrocknet sind, nehmen Sie sie vom Diaträger und lagern Sie sie in einer Diabox im Dunkeln, bis sie für die Bildanalyse bereit sind.
HINWEIS: Die Objektträger bleiben unbegrenzt lesbar und können bei Bedarf erneut gefärbt werden.
6. Enzymmodifizierter alkalischer Kometentest
HINWEIS: Der enzymmodifizierte alkalische Comet-Assay verwendet einen Enzymbehandlungsschritt nach der Lyse, aber vor der Elektrophorese. Die Aktivität des Enzyms verursacht Brüche in der DNA an Stellen, die Substrate für das Enzym sind. Vor der Durchführung dieses Assays müssen die Enzymkonzentration und die Dauer der Enzyminkubation optimiert werden.
- Nach der Zelllyse (Schritt 3) werden Objektträger zweimal mit eiskaltemddH2Ofür jeweils 20 min gewaschen.
- Nehmen Sie den Objektträgerträger aus dem Wasser und legen Sie die Dias in ein mit Papiertüchern ausgelegtes Fach.
- Fügen Sie 80 μL des Enzyms in der optimierten Konzentration hinzu (z. B. 3,2 U/ml hOGG1 für BE-M17-Zellen, verdünnt in Enzymreaktionspuffer) und bedecken Sie es mit einem Deckglas, um das Enzym über die gelhaltige Probe zu verteilen.
- Inkubieren Sie die Objektträger bei 37 °C für die optimierte Dauer (z. B. 45 min für hOGG1).
- Nach der Inkubation die Deckgläser vorsichtig entfernen und die Objektträger auf den Träger übertragen.
HINWEIS: Waschen Sie die Objektträger nach der Enzymbehandlung nicht; Führen Sie die Elektrophorese ab Schritt 4.3 direkt durch.
7. DNA-Interstrang-Crosslinks (ICL)-modifizierter alkalischer Kometentest
HINWEIS: Das Konzept dieser Variante des ICL-ACA ist, dass das Vorhandensein von ICL in der DNA die elektrophoretische Migration beschädigter DNA verzögert, die nach Exposition gegenüber einer oxidativ erzeugten Beleidigung induziert wird. In diesem Fall gilt: Je kürzer der Kometenschweif, desto größer ist die Zahl der ICL25,26,27,28.
- Behandeln Sie Zellen mit einem Reagenz, das ICL induziert (z. B. Cisplatin; siehe Zusatzdossier).
- Besetzen Sie die behandelten Zellen mit einem der folgenden Wirkstoffe, um genügend Strangbrüche zu induzieren, um einen entsprechend großen Kometenschweif (~20% Schweif-DNA) zu erzeugen: Wasserstoffperoxid (50 μMH2O2für 30 min), ionisierende Strahlung (2-5 Gy) oder Ultraviolett B (UVB) (0,5 J / cm 2).
- Zusätzlich wird eine Strangbruch-Positivkontrolle hergestellt, indem eine Charge von Zellen mit dem gleichen Wirkstoff und der gleichen Dosis behandelt wird, wie in Schritt 7.2 verwendet (d. h. keine Behandlung mit ICL-induzierendem Wirkstoff).
- Zentrifugieren Sie die Zellen bei 7.607 x g für 5 min, verwerfen Sie den Überstand, waschen Sie das Zellpellet dreimal mit 1 ml PBS und verarbeiten Sie es wie beim alkalischen Kometentest (Schritte 3-5).
- Berechnen Sie den Grad der DNA-Interstrangvernetzung mit der folgenden Formel.
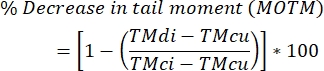
HINWEIS: MOTM (Mean Olive Tail Moment) ist ein Kometen-Assay-Endpunkt, der bei der Beschreibung des ICL-modifizierten Kometen-Assays weit verbreitet ist und definiert ist als das Produkt aus der Schweiflänge und dem Anteil der Gesamt-DNA im Schweif (d. h. Schweifmoment = Schweiflänge x % der DNA im Schweif)29; TMdi: Schwanzmoment von Proben, die sowohl mit Vernetzer als auch mitH2O2(oder einem anderen Strangbrecherinduktor) behandelt wurden; TMcu: Schwanzmoment von Proben, die nicht mit einem Vernetzer behandelt und nicht mit H2O2 behandelt wurden (keine Behandlung), und TMci: Schwanzmoment von Proben, die nicht mit einem Vernetzer, aber mitH2O2behandelt wurden.
8. Comet Scoring und Datenanalyse
HINWEIS: Der Begriff "Komet" leitet sich von den Bildern beschädigter Zellen ab, wenn sie nach der Durchführung des Assays unter einem Mikroskop betrachtet werden (Abbildung 5). Unter Elektrophoresebedingungen wandert die DNA in den unbeschädigten Zellen weitgehend nicht, sondern verbleibt in einem Sphäroid, das als Kometenkopf bezeichnet wird. Das Vorhandensein von Strangbrüchen ermöglicht es der DNA der Zelle jedoch, aus dem Kopf zu wandern und einen "Schweif" zu bilden, was zu einem Aussehen wie ein Komet führt (Abbildung 5). Je mehr DNA im Schwanz, desto mehr Schaden ist vorhanden.
- Schalten Sie das Fluoreszenzmikroskop mit dem PI-Filter (rot) (λ = 536/617 nm) und der Kometen-Assay-Scoring-Software ein.
- Fügen Sie einen Tropfen Wasser mit einer Pasteur-Pipette zum Gel hinzu und bedecken Sie es mit einem Deckglas.
- Legen Sie die Objektträger in das Fluoreszenzmikroskop und "ritzen" Sie die Kometen.
HINWEIS: Scoring ist ein Mittel, mit dem die Kometen bewertet werden, um die Höhe des Schadens zu bestimmen, der in jedem Kometen vorhanden ist. Im Großen und Ganzen kann dies durch die Verwendung von zwei Ansätzen erreicht werden, je nach der vom Benutzer gewählten Präferenz, entweder durch das Auge (Messung der Größe der Kometen auf einer Skala von null bis vier) oder durch die Verwendung frei oder kommerziell erhältlicher Software30. Im Allgemeinen bewerten beide Ansätze die Größe des Kometenschweifs, obwohl eine Vielzahl von kometenbezogenen Endpunkten bestimmt werden können. Wenn Sie die Software verwenden, klicken Sie auf die Mitte des Kometenkopfes und warten Sie, bis die Software den Kometen automatisch erkennt und dann den ausgewählten Endpunkt bewertet (Abbildung 5). - Erzielen Sie 50 Kometen pro Gel und 100 Kometen pro Probe (d.h. jede Probe entspricht verschiedenen DNA-schädigenden Behandlungen oder deren Replikaten).
- Replizieren Sie die Experimente (n = 2) oder verdreifachen Sie die Experimente (n = 3).
HINWEIS: Wenn nur n=2 Wiederholungsexperimente durchgeführt werden, kann keine statistische Analyse durchgeführt werden, aber wenn n=3, führen Sie den D'agostino-Normalitätstest durch. Die meisten Comet-Assay-Daten bestehen keinen Normalitätstest. Verwenden Sie in diesem Fall einen nichtparametrischen Test (Kruskal-Wallis-Test mit Dunns Multiple-Comparisons-Test und Mann-Whitney-Tests Signifikanz, der auf p < 0,05 festgelegt ist).
Ergebnisse
Optimierung der Elektrophoresespannung für den HTP ACA
Humane Keratinozyten (HaCaTs; Materialtabelle) wurden mit unterschiedlichen Dosen ultravioletter A-Strahlung (UVA) bestrahlt (5 oder 10 J/cm2; Abbildung 6A), UVB (0,5 oder 1 J/cm2; Abbildung 6B) oder mit 50 μMH2O2(Abbildung 6C) behandelt, um Schäden herbeizuführen. Drei verschiedene Spannungen der Elektrophorese wurden getestet, um die optimale Spannung für die Elektrophorese zu bestimmen. Die Ergebnisse aller drei DNA-schädigenden Behandlungen zeigten, dass, während alle Spannungen lineare Dosis-Reaktionen erzeugten, die empfindlichste Reaktion mit 1,19 V/cm erreicht wurde. HaCaTs zeigten den höchsten DNA-Grundschaden bei 1,19 V/cm während der Elektrophorese im Vergleich zu 1 V/cm und 1,09 V/cm (Abbildung 6A-C). Darüber hinaus wird bei Verwendung von 1,19 V/cm der größte Prozentsatz der Schwanz-DNA nach allen schädlichen Behandlungen gesehen (Abbildung 6)31.
Nachweis von DNA-Schäden im menschlichen Vollblut mit FPG-modifiziertem HTP ACA
Menschliches Windelblut (Table of Materials) wurde mit verschiedenen Dosen von 10 J/cm2 UVA bestrahlt, um Schäden zu induzieren. Vier verschiedene Konzentrationen von Fpg (1, 2, 4 oder 8 U/ml) wurden verwendet, um die optimale Konzentration für die Enzymbehandlung in HTP ACA zu bestimmen. Die Ergebnisse zeigten, dass die optimalen Niveaus der DNA-Schäden mit 4 U/ml Fpg aufgedeckt wurden (Abbildung 7A). Repräsentative Kometenbilder aus UVA-bestrahlten Blutproben (Abbildung 7B).
Nachweis von DNA-ICL in einer repräsentativen Eierstockkrebs-Zelllinie mit dem ICL-modifizierten HTP ACA
Eine Eierstockkrebs-Zelllinie (SKOV-3; Materialtabelle) wurde mit Kombinationen von 200 μM Cisplatin und/oder anschließender Behandlung mit 50 μMH2O2für 30 min auf Eis behandelt. In den nicht exponierten Zellen wurden keine nennenswerten Schäden festgestellt (Abbildung 8A). Die Exposition gegenüberH2O2allein erzeugte ein signifikantes MOTM (Abbildung 8B). Im Gegensatz dazu zeigten die Zellen, in denen ICL induziert wurden, eine verminderte MOTM (Abbildung 8C)28.
Bildung und Reparatur von Cisplatin-induzierter DNA-ICL in einer repräsentativen Eierstockkrebs-Zelllinie
Das ICL-modifizierte HTP ACA wurde verwendet, um den zeitlichen Verlauf für die DNA-ICL-Bildung und -Reparatur zu bestimmen, die durch Cisplatin in einer Eierstockkrebszelllinie induziert wurde (A2780; Materialtabelle). Die Zellen wurden 1 h lang mit 100 μM Cisplatin behandelt und dann in cisplatinfreien Medien (RPMI 1640 Medium, ergänzt mit 10% (v/v) fetalem Rinderserum (FBS)) für einen nachfolgenden Zeitverlauf inkubiert. Zu verschiedenen Zeitpunkten wurde der ICL-modifizierte HTP-ACA durchgeführt, um die ICL-Werte zu bestimmen (Abbildung 9)28. Vor der Behandlung mit Cisplatin wurden keine ICL nachgewiesen. Nach einer einzigen Behandlung mit 100 μM Cisplatin stiegen die ICL-Spiegel jedoch signifikant an und erreichten ihren Höhepunkt bei 12 h, woraufhin die Spiegel nach 30 h wieder auf Null sanken.
Korrelation zwischen DNA-ICL und DNA-Platinspiegeln
Drei Eierstockkrebszellen wurden mit 100 μM Cisplatin behandelt, um unterschiedliche DNA-ICL-Spiegel zu induzieren, bevor sie mit dem ICL-modifizierten HTP ACA und der induktiv gekoppelten Massenspektrometrie (ICP-MS; siehe Supplementary File für Details) analysiert wurden. Wie in Abbildung 10 gezeigt, wurden in den drei Zelllinien unterschiedliche DNA-ICL-Konzentrationen induziert, zusammen mit unterschiedlichen Pt-Konzentrationen in der DNA. Es wurde eine positive Korrelation (R2 = 0,9235) zwischen DNA-ICL-Spiegeln und Platinkonzentrationen beobachtet, was auf den Zusammenhang zwischen DNA-Platinspiegeln und der entsprechenden ICL28 hinweist.
Reparatur der Basenexzision in Mykoplasmen-infizierten und nicht infizierten BE-M17-Zellen
Mykoplasmen-infizierte und nicht infizierte BE-M17-Zellen wurden mit 50 μMH2O2 für 30 min behandelt und mit vollständigem Medium (Dulbeccos modifiziertes Eagle-Medium, ergänzt mit 10% (v/v) FBS) für verschiedene Zeiträume (0 min, 30 min, 1 h, 2 h, 6 h, 24 h oder 30 h) inkubiert, während der die Zellen repariert werden konnten. Zu jedem Zeitpunkt wurden die Zellen gesammelt und bei -80 °C in einem 10% DMSO-haltigen Medium eingefroren, bevor der hOGG1-modifizierte HTP-ACA durchgeführt wurde (Schritt 6). Nach 30 Minuten waren die SB/ALS-Spiegel in den nicht infizierten Zellen auf 21% TD (prozentuale Schwanz-DNA) gesunken, während die infizierten Zellen 49% TD zeigten (Abbildung 11A). Nach ~15 h waren die SB/ALS-Spiegel sowohl in infizierten als auch in nicht infizierten Zellen wieder auf den Ausgangswert zurückgekehrt. Bei den oxidierten Purinen zeigte das nicht infizierte BE-M17 zunächst einen leichten Anstieg der Schädigung, bevor es innerhalb von 30 h zum Ausgangswert zurückkehrte (Abbildung 11B). Im Gegensatz dazu zeigten die infizierten Zellen einen anhaltenden, signifikanten Anstieg der oxidierten Purine, die erhöht blieben und auch nach 30 h nicht auf das Ausgangsniveau zurückkehrten (Abbildung 11B)23.
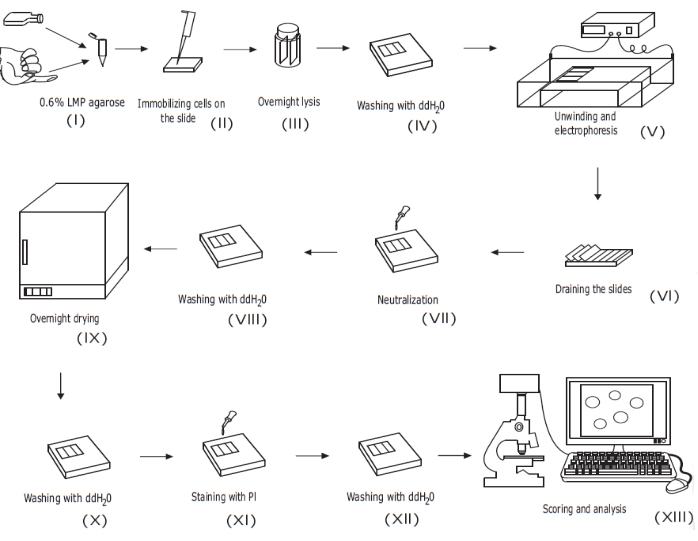
Abbildung 1: Überblick über das konventionelle alkalische Kometen-Assay-Verfahren . (i) Eine einzellige Suspension aus kultivierten Zellen oder eine Vollblutprobe wird mit 0,6% (w/v) LMP-Agarose gemischt. (ii) Das Zell-Agarose-Gemisch wird auf vorbeschichtete Objektträger aufgetragen und mit Deckglas bedeckt, bis es erstarrt ist. (iii) Die Zellen werden über Nacht mit einem Lysepuffer mit hohem pH-Wert lysiert und bilden Nukleoidkörper, bevor (iv) mitddH2Ogewaschen wird. (v) Die zelluläre DNA wird im Elektrophoresepuffer mit hohem pH-Wert abgewickelt. Das Vorhandensein von Strangbrüchen ermöglicht es der DNA, sich zu entspannen und zu entspannen, und unter Elektrophorese wird die DNA aus dem Nukleoidkörper gezogen und bildet einen Schwanz. Die Objektträger werden dann (vi) abgetropft, getrocknet, (vii) neutralisiert und (viii) mitddH2Ogewaschen, bevor (ix) über Nacht getrocknet wird. Objektträger werden dann (x) mit ddH2O rehydriert, (xi) gefärbt, (xii) gewaschen und schließlich (xiii) bewertet und analysiert, typischerweise mit Fluoreszenzmikroskopie und Bildanalysesoftware. Diese Abbildung ist aus einer früheren Veröffentlichungwiedergegeben 20. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Die Materialien des Hochdurchsatz-Kometenelektrophoresesystems. HTP-Elektrophoresetank, HTP-Racks und das Geschirr für Lyse, Waschen, Neutralisieren und Färben werden gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
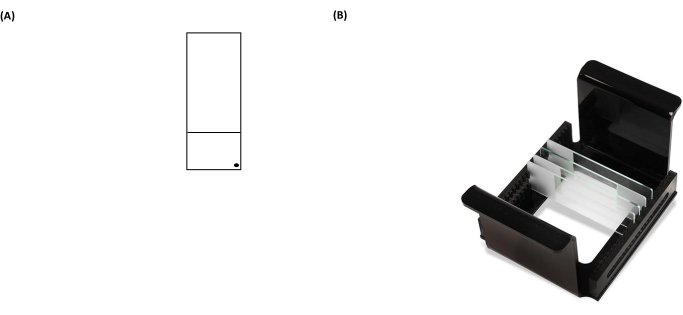
Abbildung 3: Repräsentative Bilder eines Kometen-Assay-Objektträgers und eines HTP-Racks (Mikroskopträger). (A) Zur korrekten Orientierung wird die vorbeschichtete Fläche des Objektträgers durch einen schwarzen Punkt in der rechten Ecke eines Objektträgers erkannt. (B) Das Bild des HTP-Racks zeigt, wie die Objektträger in einer engen vertikalen Ausrichtung gehalten werden, mit Laschen auf dem Träger, um seine Ausrichtung innerhalb des Elektrophoresetanks zu fixieren. Jeder Träger kann bis zu 25 Dias aufnehmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Darstellung der Kühlplatte mit Probenobjektträgern und Gefrierpackungen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Screenshot der repräsentativen Kometen, die während des Scorings aufgenommen wurden. HaCaTs (A) ohne Behandlung und (B) behandelt mit 1 J/cm2 UVB vor der Durchführung von HTP ACA. Die meisten Softwarepakete können eine Vielzahl von Kometenendpunkten berechnen, aber die gebräuchlichsten sind die % Schweif-DNA (bevorzugt) oder das Schweifmoment basierend auf diesen Bildern (blau: Beginn des Kopfes, grün: Mitte des Kopfes und lila: Ende des Schweifs). Der Maßstabsbalken beträgt 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
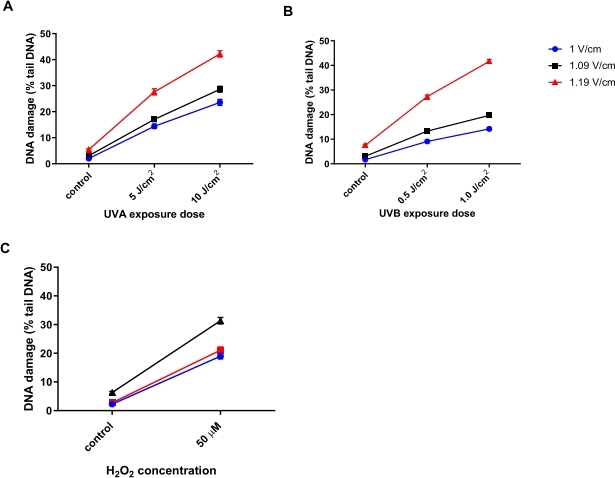
Abbildung 6: Repräsentative Grafiken, die den Effekt der Elektrophoresespannung auf die prozentuale Schwanz-DNA veranschaulichen, bestimmt mit dem HTP ACA. Die Zellen wurden vor dem HTP ACA bei (A) 5 oder 10 J/cm2 UVA, (B) 0,5 oder 1,0 J/cm2 UVB oder (C) 50 μMH2O2exponiert, wobei die Elektrophoresespannung entweder bei 1, 1,09 oder 1,19 V/cm lag. Die Daten stellen den Mittelwert von 200 Bestimmungen aus n = 2 doppelten Experimentendar 31. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
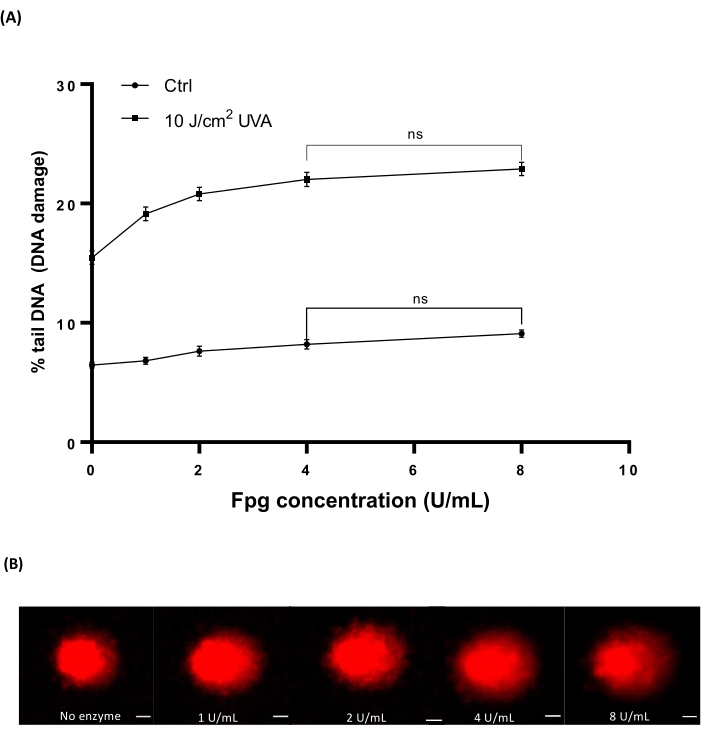
Abbildung 7: Repräsentative Grafik und Kometenbilder von menschlichem Blut, analysiert mit dem FPG-modifizierten HTP ACA. Menschliche Blutproben wurden vor dem Lyseschritt mit 10 J/cm2 UVA oder scheinbestrahlt ("ctrl") auf Eis bestrahlt. Für die Enzymbehandlung vor der Elektrophorese wurden unterschiedliche Konzentrationen von Fpg (1, 2, 4 oder 8 U/ml) verwendet. (A) Die Daten stellen den Mittelwert ± REM von 300 Bestimmungen aus n=3 Experimenten dar. (B) Repräsentative Bilder von Kometen für jede Konzentration von Fpg in 10 J/cm2 UVA-bestrahlten Blutproben. Der Maßstabsbalken beträgt 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
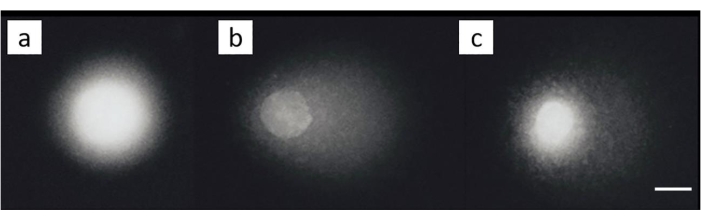
Abbildung 8: Repräsentative Kometenbilder zum Nachweis von ICL nach Cisplatin-Behandlung. (A) Kontrollzellen ohne jegliche Behandlung, (B) Zellen, die nur mit H2O2 (50 μM) behandelt wurden, (C) Zellen, die mitH2O2(50 μM) und Cisplatin (200 μM) behandelt wurden, wobei der Schweif aufgrund des Vorhandenseins von ICL28 kürzer als in (B) dargestellt wird. Der Maßstabsbalken beträgt 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
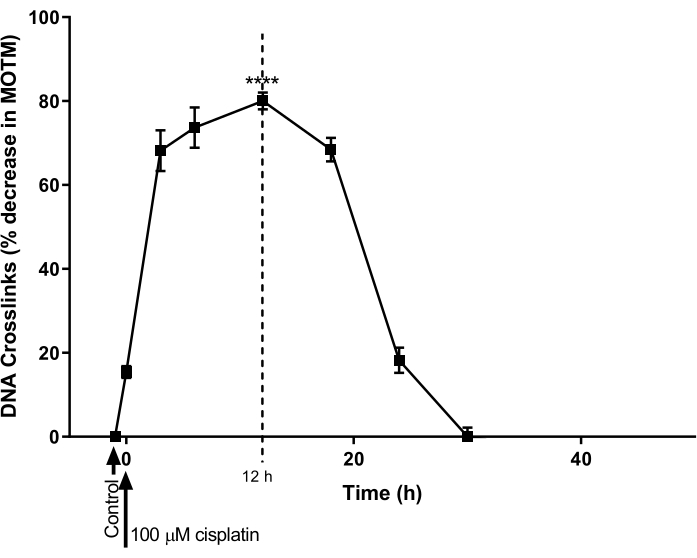
Abbildung 9: Demonstration der Kinetik der Cisplatin-induzierten ICL-Bildung und -Reparatur. A2780-Zellen wurden mit 100 μM Cisplatin im Kulturmedium für 1 h behandelt. Das Cisplatin-haltige Medium wurde dann entfernt, und die Zellen wurden für verschiedene Zeitpunkte kultiviert, bevor sie durch ICL-modifiziertes HTP ACA analysiert wurden. Die Daten stellen den Mittelwert ± REM aus n = 3 Experimentendar 28. P < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 10: Korrelation zwischen DNA-ICL und Platinkonzentration. DNA-ICL wurden durch den ICL-modifizierten HTP ACA bestimmt und Platinspiegel wurden mittels ICP-MS (mit Single Quad-Kinetic Energy Discrimination, SQ-KED) in drei Eierstockkrebszelllinien gemessen. R2 = 0,9235. Siehe Supplementary File for ICP-MS methodology to quantifying platinum levels in DNA28. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
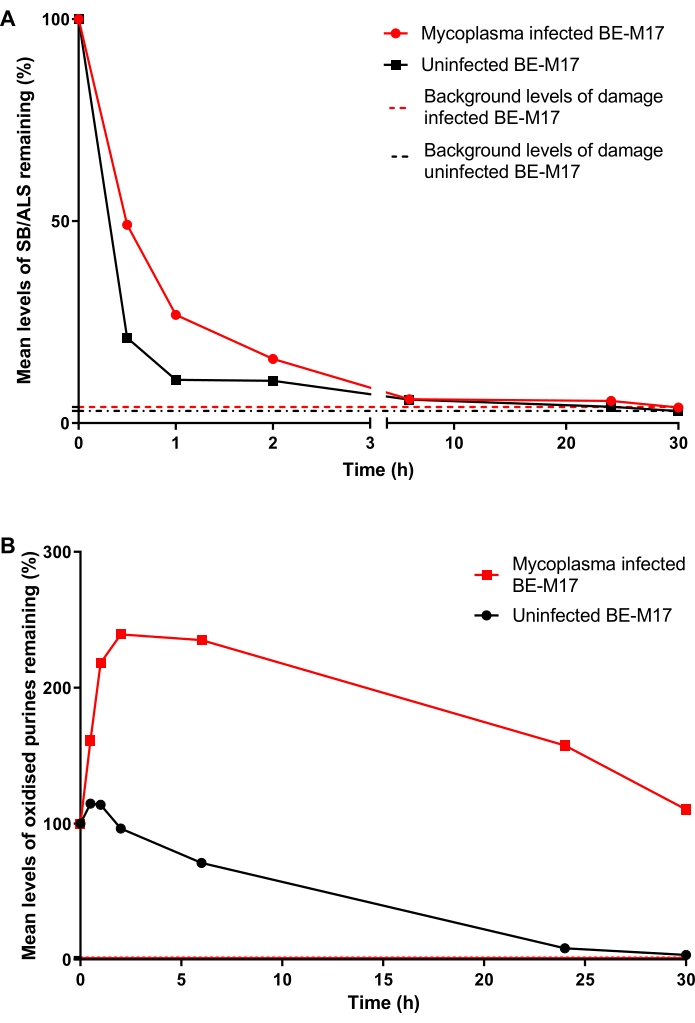
Abbildung 11: Eine repräsentative Grafik, die DNA-Schäden und -Reparaturen, bestimmt durch den hOGG1-modifizierten Kometen-Assay, in Mykoplasmen-infizierten versus nicht infizierten BE-M17-Zellen veranschaulicht. Nach der Behandlung mit 50 μMH2O2für 30 min konnten sich die Zellen für unterschiedliche Zeiträume (0, 30 min, 1 h, 2 h, 6 h, 24 h oder 30 h) reparieren. Der hOGG1-modifizierte HTP ACA wurde verwendet, um (A) SB/ALS und (B) oxidierte Purine in infizierten (rote Datenpunkte) und nicht infizierten (schwarze Datenpunkte) BE-M17-Zellen zu messen. Die Daten stellen den Mittelwert von 200 Bestimmungen aus n = 2 doppelten Experimenten dar. Diese Abbildung ist mit Genehmigung einer früheren Veröffentlichungwiedergegeben 23. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Reagenz | Standardlösung | Funktionierende Lösung | |
| Lyse-Puffer | 100 mM Na 2 EDTA, 2,5 M NaCl und 10 mM Tris Base in ddH2O; pH-Wert auf 10 mit 10 M NaOH einstellen | 1% Triton X-100 in Lyse-Stammlösung | |
| Elektrophorese-Puffer | 10 M NaOH und 200 mM Na2EDTAinddH2O | 300 mM NaOH und 1 mM Na2EDTA; pH-Wert > 13 | |
| Neutralisationspuffer | 0,4 m Tris-Basis in ddH2O; pH-Wert mit HCl auf 7,5 einstellen | ||
| Färbepuffer | 1 mg/ml Propidiumiodid | 2,5 μg/ml Propidiumiodid inddH2O | |
Tabelle 1: Zusammensetzung der in HTP ACA verwendeten Reagenzien. Die Stamm- und Arbeitskonzentrationen von Lyse, Elektrophorese, Neutralisation und Färbepuffern sind dargestellt.
Ergänzende Datei. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Diese Studie zeigt die Vielseitigkeit der aktuellen Ausrüstung, die verwendet werden kann, um einen hohen Durchsatz mit einer Vielzahl von repräsentativen, gängigen Varianten des Kometen-Assays zu erreichen (d.h. alkalische, enzymmodifizierte, Blut und ICL und andere Varianten werden ebenfalls geeignet sein). Darüber hinaus bringt der vorliegende Ansatz mehrere Vorteile mit sich 20,21: (a) Die Assay-Laufzeit wird durch parallele Manipulation mehrerer Objektträger verkürzt (die Bearbeitungszeit verringertsich um 60%); b) das Risiko einer Beschädigung der Gele und damit das Risiko für den Versuch verringert wird; (c) der Reagenzienbedarf verringert wird (z. B. ist das Volumen des Elektrophoresebehälters kleiner als der herkömmliche Tank); (d) die Anzahl der Lauffolien wird erhöht. Ein Tank kann die Anzahl der Schlitten im Vergleich zu einem herkömmlichen Tank um 20 % erhöhen. Mehrere Elektrophoresetanks können jedoch parallel von derselben Stromversorgung betrieben oder sklaviert werden (d. h. mehrere Tanks, die von einer einzigen Stromversorgung gesteuert werden) und erfordern immer noch eine Tischfläche, die kleiner ist als ein einzelner herkömmlicher Tank mit Eistanne. und (e) der Tank-Footprint wird aufgrund der vertikalen Ausrichtung der Objektträger und der integrierten Kühlung verringert (spart Platz im Labor); Der HTP-Tank besteht aus einer Hochleistungs-Keramik-Kühlbasis mit einer verschiebbaren Schublade, die in ein gefrorenes Kühlpaket passt, um eine optimale Puffertemperatur aufrechtzuerhalten, ohne den Prozess in einem Kühlraum durchführen zu müssen.
Darüber hinaus nimmt die von uns entwickelte Kühlplatte 26 Kometenobjektträger auf, ermöglicht eine schnelle Erstarrung der Agarose mit niedrigem Schmelzpunkt auf den Kometenassay-Objektträgern und ermöglicht ein einfaches Wiederfinden der Objektträger nach dem Erstarren des Agarosegels. Die oben genannten Innovationen machen den Kometen-Assay-Prozess einfacher und einfacher.
Während andere Hochdurchsatzansätze entwickelt wurden (z. B. 12-Gel-Comet-Assay, CometChip oder 96 Mini-Gel-Formate)25, bevorzugen viele Wissenschaftler die Verwendung der herkömmlichen Objektträger (einschließlich der kommerziell erhältlichen vorbeschichteten Objektträger oder anderer spezialisierter Objektträger). Der vorliegende Ansatz kann alle Arten von Objektträgern aufnehmen, so dass Experimente mit diesen Objektträgern durch schnellere Objektträgerverarbeitung und -handhabung skaliert werden können. Wie bereits erwähnt, bringt das HTP-Kometensystem viele Vorteile, aber es gibt eine bemerkenswerte Einschränkung: Der aktuelle Ansatz bietet nur eine 20%ige Steigerung der Anzahl der durchgeführten Proben im Vergleich zu einem herkömmlichen horizontalen Tank (obwohl die Verarbeitung von Objektträgern viel schneller ist). Die Formate CometChip und 96 Mini-Gel führen eine größere Anzahl von Proben aus. Bis heute wissen wir nicht, ob der derzeitige Ansatz den CometChip oder 96 Mini-Gel-Formate aufnehmen kann, obwohl wir vorhersagen, dass dies der Fall sein wird. Wie oben erwähnt, kann die Anzahl der Proben weiter erhöht werden, indem Tanks an eine einzige Stromversorgung angeschlossen werden. Wie bei allen Ansätzen besteht immer noch die Möglichkeit, die Gele beim Laden von Proben und ihrer Analyse unter dem Mikroskop zu verlieren oder zu beschädigen, aber dies ist eher auf Bedienfehler zurückzuführen, und die Wahrscheinlichkeit dafür wird mit dem aktuellen Ansatz minimiert.
Die Verwendung des HTP-Kometensystems kann die Analyse von DNA-Schäden erheblich erleichtern und den Einsatz des Kometentests in einer Vielzahl von Anwendungen wie molekularer Epidemiologie, männlicher Reproduktionswissenschaft, genotoxikologischen Studien und Umwelttoxikologie erleichtern. Dies gilt insbesondere für diejenigen Anwender, die alle Vorteile eines verbesserten Durchsatzes und einer einfachen Handhabung nutzen möchten, ohne sich von den bekannten, kostengünstigen und herkömmlichen Objektträgern zu entfernen.
Offenlegungen
Dr. Cooke und Dr. Karbaschi sind Erfinder von drei erteilten Patenten, die sich auf die hier beschriebenen Technologien beziehen.
Danksagungen
Die in dieser Veröffentlichung berichtete Arbeit wurde teilweise vom National Institute of Environmental Health Sciences der National Institutes of Health unter der Vergabenummer: 1R41ES030274 unterstützt. Der Inhalt liegt in der alleinigen Verantwortung der Autoren und stellt nicht unbedingt die offizielle Meinung der National Institutes of Health dar.
Materialien
| Name | Company | Catalog Number | Comments |
| 22 x 22 mm glass coverslips | Fisher Scientific, Hampton, NH, USA | 631-0124 | |
| A2780 | ECACC, Louis, MO, USA | 93112519 | |
| Concentrated nitric acid (OptimaTM grade) | Fisher Scientific Fair Lawn, NJ, USA | A467-250 | |
| Fluorescence microscope equipped with a camera | Zeiss, Jena, Germany | ||
| Fresh human whole blood | Zen Bio Inc | SER-WB10ML | Commercial human whole blood sample |
| GraphPad Prism | GraphPad Software, San Diego, California | Data analysis software | |
| HTP Comet Assay system | Cleaver Scientific | COMPAC- 50 | |
| Human Keratinocyte (HaCaTs) | American Type Culture Collection (ATCC), Manassas, VA, USA | Discontinued | Can be purchased from another company ADDEXBIO TECHNOLOGIES Cat# T0020001 |
| Hydrogen peroxide (H2O2) 30% in water | Fisher Scientific, Hampton, NH, USA | BP2633-500 | |
| ICP-MS iCAP RQ ICP-MS system | Thermo Scientific, Waltham, MA, USA | IQLAAGGAAQFAQKMBIT | |
| Image and Data Analysis software | Perceptive Instrument, Bury St Edmunds, England, UK | 125525 | Free image analysis softwared is available e.g., ImageJ |
| Internal Standard Mix | SPEX Certiprep, Metuchen, NJ, USA | CL-ISM1-500 | Bismuch (isotope monitored 209 Bi)-concnetration of 10 µg/mL in 5% HNO3 |
| Low melting point Agarose | Invitrogen Waltham, MA, USA | P4864 | |
| Na2EDTA (disodium ethylenediaminetetraacetic acid) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| NaCl (Sodium chloride) | Sigma Aldrich, St. Louis, MO, USA | S7653 | |
| NanoDrop One | Thermo Scientific, Waltham, MA, USA | 701-058108 | Nanodrop for measuring DNA concentration |
| Nanopure Infinity Ultrapure Water System (Barnstead Nanopure) | Thermo Scientific, Waltham, MA, USA | D11901 | Ultrapure water (16 MΩ cm-1) |
| NaOH (sodium Hydroxide) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| Normal melting point Agarose | Fisher Scientific, Hampton, NH, USA | 16520100 | For pre-coating slides |
| OCI-P5X | University of Miami, Miami, FL, USA | N/A | Live Tumor Culture Core facility provided the cells |
| Platinum (Pt) reference standard | SPEX Certiprep, Metuchen, NJ, USA | PLPT3-2Y | (1000 µg/mL in 10% HCl) containing Bismuch |
| Propidium Iodide (1.0 mg/mL in water) | Sigma Aldrich, St. Louis, MO, USA | 12-541BP486410ML | |
| QIAamp DNA Mini Kit | Qiagen Valencia, CA, USA | 51304 | DNA extraction Kit |
| Single-frosted glass microscope slides | Fisher Scientific, Hampton, NH, USA | 12-541B | |
| SKOV3 | ECACC, Louis, MO, USA | 91091004 | |
| Slide box | Fisher Scientific, Hampton, NH, USA | 03-448-2 | Light proof, to protect cells from the formation adventitious damage (according to the widely held view) and prevent fading of the fluorescent dye |
| Slide Chilling plate | Cleaver Scientific, Rugby, England, UK | CSL-CHILLPLATE | |
| Treatment dish | Cleaver Scientific, Rugby, England, UK | STAINDISH4X | |
| Tris-base | Sigma Aldrich, St. Louis, MO, USA | 93362 | |
| Triton X-100 | Fisher Scientific, Hampton, NH, USA | BP151-500 | |
| Trypsin EDTA (0.5%) | Invitrogen Gibco, Waltham, MA, USA | 15400054 | |
| Vertical Slide Carrier | Cleaver Scientific, Rugby, England, UK | COMPAC-25 |
Referenzen
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46 (5), 1213-1224 (2018).
- Evans, M. D., Cooke, M. S. Factors contributing to the outcome of oxidative damage to nucleic acids. Bioessays. 26 (5), 533-542 (2004).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutatation Research. 567 (1), 1-61 (2004).
- Miyamae, Y., et al. Detection of DNA lesions induced by chemical mutagens using the single-cell gel electrophoresis (comet) assay. 2. Relationship between DNA migration and alkaline condition. Mutatation Research. 393 (1-2), 107-113 (1997).
- Angelis, K. J., Dusinská, M., Collins, A. R. Single cell gel electrophoresis: detection of DNA damage at different levels of sensitivity. Electrophoresis. 20 (10), 2133-2138 (1999).
- Duarte, T. L., Cooke, M. S., Jones, G. D. Gene expression profiling reveals new protective roles for vitamin C in human skin cells. Free Radical Biology & Medicine. 46 (1), 78-87 (2009).
- Karbaschi, M., et al. Rescue of cells from apoptosis increases DNA repair in UVB exposed cells: implications for the DNA damage response. Toxicology Research. 4 (3), 725-738 (2015).
- Wu, J. H., Jones, N. J. Assessment of DNA interstrand crosslinks using the modified alkaline comet assay. Methods in Molecular Biology. 817, 165-181 (2012).
- Merk, O., Speit, G. Detection of crosslinks with the comet assay in relationship to genotoxicity and cytotoxicity. Environmental and Molecular Mutagenesis. 33 (2), 167-172 (1999).
- Spanswick, V. J., Hartley, J. M., Hartley, J. A. Measurement of DNA interstrand crosslinking in individual cells using the Single Cell Gel Electrophoresis (Comet) assay. Methods in Molecular Biology. 613, 267-282 (2010).
- Saha, D. T., et al. Quantification of DNA repair capacity in whole blood of patients with head and neck cancer and healthy donors by comet assay. Mutation Research. 650 (1), 55-62 (2008).
- Giovannelli, L., Pitozzi, V., Riolo, S., Dolara, P. Measurement of DNA breaks and oxidative damage in polymorphonuclear and mononuclear white blood cells: a novel approach using the comet assay. Mutatation Research. 538 (1-2), 71-80 (2003).
- Al-Salmani, K., et al. Simplified method for the collection, storage, and comet assay analysis of DNA damage in whole blood. Free Radical Biology & Medicine. 51 (3), 719-725 (2011).
- Akor-Dewu, M. B., et al. Leucocytes isolated from simply frozen whole blood can be used in human biomonitoring for DNA damage measurement with the comet assay. Cell Biochemistry and Function. 32 (3), 299-302 (2014).
- Ge, J., et al. CometChip: a high-throughput 96-well platform for measuring DNA damage in microarrayed human cells. Journal of Visualized Experiments: JoVE. (92), e50607 (2014).
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochemical and Biophysical Reseach Communications. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Experimental Cell Research. 175 (1), 184-191 (1988).
- Karbaschi, M., et al. Evaluation of the major steps in the conventional protocol for the alkaline comet assay. International Journal of Molecular Sciences. 20 (23), 6072 (2019).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Scientific Reports. 4 (1), 7200 (2014).
- Karbaschi, M., Cooke, M. S. Chilling apparatus. USA patent. , (2020).
- Cooke, M. S., Karbaschi, M. Method and apparatus for performing electrophoresis. USA patent. , (2019).
- Ji, Y., Karbaschi, M., Cooke, M. S. Mycoplasma infection of cultured cells induces oxidative stress and attenuates cellular base excision repair activity. Mutatation Research. 845, 403054 (2019).
- Møller, P., et al. Minimum Information for Reporting on the Comet Assay (MIRCA): recommendations for describing comet assay procedures and results. Nature Protocols. 15 (12), 3817-3826 (2020).
- Almeida, G. M., Duarte, T. L., Steward, W. P., Jones, G. D. Detection of oxaliplatin-induced DNA crosslinks in vitro and in cancer patients using the alkaline comet assay. DNA Repair (Amst). 5 (2), 219-225 (2006).
- Moneef, M. A., et al. Measurements using the alkaline comet assay predict bladder cancer cell radiosensitivity. British Journal of Cancer. 89 (12), 2271-2276 (2003).
- Bowman, K. J., et al. Comet assay measures of DNA damage are predictive of bladder cancer cell treatment sensitivity in vitro and outcome in vivo. International Journal of Cancer. 134 (5), 1102-1111 (2014).
- Abdulwahed, A. M. S. . Investigation of DNA Damage and Genomic Organization in the Cellular Response to Platinum Chemotherapy. , (2020).
- Olive, P. L., Banáth, J. P., Durand, R. E. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the "comet" assay. Radiation Research. 122 (1), 86-94 (1990).
- Kumaravel, T. S., Vilhar, B., Faux, S. P., Jha, A. N. Comet Assay measurements: a perspective. Cell Biology and Toxicology. 25 (1), 53-64 (2009).
- Ji, Y. . Formation and Repair of Environmetally-induced damage to Mitochondrial and Nuclear Genomess. , (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten