Method Article
Высокопроизводительный подход к кометному анализу для оценки повреждения клеточной ДНК
* Эти авторы внесли равный вклад
В этой статье
Резюме
Кометный анализ является популярным средством обнаружения повреждений ДНК. Это исследование описывает подход к запуску слайдов в репрезентативных вариантах анализа кометы. Такой подход значительно увеличил количество образцов при одновременном сокращении времени выполнения анализа, количества манипуляций с скольжением и риска повреждения гелей.
Аннотация
Клетки постоянно подвергаются воздействию агентов, возникающих из внутренней и внешней среды, которые могут повредить ДНК. Это повреждение может вызвать аберрантную функцию клеток, и поэтому повреждение ДНК может играть решающую роль в развитии, возможно, всех основных заболеваний человека, например, рака, нейродегенеративных и сердечно-сосудистых заболеваний и старения. Одноклеточный гель-электрофорез (т.е. кометный анализ) является одним из наиболее распространенных и чувствительных методов изучения образования и восстановления широкого спектра типов повреждений ДНК (например, одно- и двухцепочечных разрывов, щелочно-лабильных участков, сшивок ДНК-ДНК и, в сочетании с определенными ферментами репарации, окисленных пуринов и пиримидинов), как in vitro , так и in vivo Системы. Тем не менее, низкая пропускная способность обычного анализа образца и трудоемкая обработка образца являются ограничивающими факторами для его максимально широкого применения. Поскольку «подсчет очков» комет становится все более автоматизированным, ограничением теперь является способность обрабатывать значительное количество кометных слайдов. Здесь разработан высокопроизводительный (HTP) вариант кометного анализа (HTP comet assay), который значительно увеличивает количество анализируемых образцов, уменьшает время выполнения анализа, количество индивидуальных манипуляций с скольжением, требования к реагентам и риск физического повреждения гелей. Кроме того, площадь бака электрофореза значительно уменьшается за счет вертикальной ориентации слайдов и интегрального охлаждения. Также здесь сообщается о новом подходе к охлаждению слайдов кометного анализа, который удобно и эффективно облегчает затвердевание кометных гелей. Здесь описано применение этих устройств к репрезентативным методам анализа комет. Эти простые инновации в значительной степени поддерживают использование анализа кометы и его применение в таких областях исследований, как биология воздействия, экотоксикология, биомониторинг, скрининг / тестирование токсичности, а также понимание патогенеза.
Введение
Клетки постоянно подвергаются воздействию агентов, возникающих из внутренней и внешней среды, которые могут повредить ДНК 1,2. Это повреждение может вызвать аберрантную функцию клеток3, и поэтому повреждение ДНК может играть решающую роль в развитии многих основных заболеваний человека, например, рака, нейродегенеративных и сердечно-сосудистых заболеваний и старения4. Кометный анализ (также называемый одноклеточным гелевым электрофорезом) становится все более популярным методом обнаружения и количественной оценки повреждения клеточной ДНК.
В простейшем случае щелочной кометный анализ (ACA) обнаруживает разрывы нитей (SB; как одинарные, так и двойные) вместе с апуриновыми / апиримидиновыми участками и щелочно-лабильными участками (ALS), оба из которых становятся одноцепочечными разрывами в щелочных условиях5. Анализ нейтральной рН кометы может оценить откровенные одно- и двухцепочечные разрывы6. Кроме того, ACA в сочетании с рядом ферментов репарации ДНК может обнаруживать значительный спектр типов повреждений ДНК, например, окисленные пурины (идентифицированные с помощью человеческой 8-оксогуанин ДНК-гликозилазы 1; hOGG17); окисленные пиримидины (с использованием эндонуклеазы III; EndoIII) и циклобутановые пиримидиновые димеры (с использованием эндонуклеазы T4 V; T4endoV)8. Кометный анализ также может быть использован для оценки поражений ДНК, индуцированных сшивающими агентами, такими как цисплатин 9,10,11. Как указано в официальном названии анализа, т.е. электрофорез одноклеточного геля, анализ опирается на то, что анализируемые клетки являются одноклеточной суспензией; чаще всего это культивируемые клетки, но могут быть выделены из цельной крови12,13, или из самой цельной крови можно использовать14,15. Альтернативно, одноклеточная суспензия может быть получена из твердых тканей.
За исключением нескольких исключений, в первую очередь отчетов CometChip из лаборатории Энглварда16, общий протокол анализа кометы не изменился кардинально по сравнению с тем, что первоначально описано изобретателями анализа (Östling and Johansson17 и Singh et al.18). Анализ кометы включает в себя многочисленные этапы (рисунок 1). Многие из этих этапов включают перенос тонких, содержащих клетки агарозных гелей, по одному слайду за раз, и, следовательно, представляют риск повреждения или потери геля, ставя под угрозу успех эксперимента. Следовательно, анализ кометы может занять много времени, особенно если выполняется значительное количество слайдов. Как правило, максимум 40 слайдов запускаются в большом (33 см х 59 см х 9 см) резервуаре для электрофореза, который находится в еще большем лотке, содержащем влажный лед для охлаждения. Недавно сообщалось, что время выполнения анализа может быть сокращено до 1 дня за счет уменьшения продолжительности стадии лизиса и отказа от высыхания слайдов перед окрашиванием19.
Настоящие авторы ранее сообщали о новом подходе к высокопроизводительному щелочному кометному анализу (HTP ACA), в котором несколькими (партиями по 25) слайдами микроскопа кометного анализа можно манипулировать одновременно на протяжении всего процесса анализа кометы 20,21,22. Этот запатентованный подход сводит к минимуму риск повреждения или потери гелей, содержащих образец, устраняя необходимость манипулирования предметными стеклами микроскопа по отдельности и может быть применен ко всем вариантам анализа кометы, в которых используются слайды микроскопа. Скользящие стойки защищают гели во время манипуляций, и, следовательно, обработка образцов происходит быстрее и эффективнее. Слайды также могут подвергаться электрофорезу в стойках, удерживаемых в вертикальной, а не горизонтальной ориентации. Это, а также интегральное охлаждение значительно уменьшают площадь резервуара электрофореза и устраняют необходимость во влажном льде. В совокупности это представляет собой значительное улучшение по сравнению с обычной процедурой. Используемое оборудование проиллюстрировано на рисунке 2. Протоколы, описанные здесь, используя этот новый подход, демонстрируют репрезентативное применение к культивируемым клеткам и цельной крови14 для обнаружения щелочно-лабильных участков (ALS), межцепочечных сшивающих связей ДНК (ICL) и субстратов различных ферментов репарации ДНК.
протокол
В настоящем исследовании использовались коммерчески доступные образцы крови. В нашем учреждении одобрение Институционального наблюдательного совета не требуется для использования коммерчески доступной крови.
1. Подготовка материалов для кометного анализа
- Подготовка слайдов микроскопа
- Залить 1% (мас./об.) нормальной температурой плавления агарозы [растворенной в дважды дистиллированной воде (ddH2O)] в трубку объемом 50 мл и микроволновую печь для растворения агарозы в ddH2O. Хранить при 37 °C для предотвращения затвердевания перед скольжением покрытия. При затвердевании выбрасывают и готовят свежим.
- Предварительное покрытие микроскопа скользит, погружая слайды в трубку объемом 50 мл, содержащую 1% (мас./об.) нормальной агарозы температуры плавления.
- Быстро протрите заднюю часть слайдов после погружения слайдов.
ПРИМЕЧАНИЕ: Неспособность правильно протереть заднюю часть слайдов увеличит фоновый шум слайдов во время анализа с помощью микроскопа. - Пометьте слайд с покрытием постоянным маркером в правом нижнем углу матового участка (рисунок 3A). Это показывает, какая сторона слайда предварительно покрыта.
- Дайте агарозе схватиться и высохнуть ночью при комнатной температуре.
- Заверните высушенные слайды в папиросную бумагу и храните их в коробке.
2. Подготовка образцов
- Культивируемые клетки
ПРИМЕЧАНИЕ: Во-первых, обработайте клетки повреждающим агентом (агентами) перед началом анализа кометы. Затем выполните следующие действия.- Если клетки адгезивные, трипсинизируют клетки, чтобы освободить их из колбы клеточной культуры или клеточной культуры чашки Петри, при соответствующем слиянии клеток. Нейтрализуют трипсин путем добавления сывороточных сред.
- Переместите ячейки в трубку объемом 50 мл, центрифугу (например, для HaCaTs, центрифугу при 300 х г в течение 5 мин при комнатной температуре), осторожно удалите супернатант и добавьте 1 мл PBS в гранулу ячейки.
- Выполните подсчет ячеек.
- Переложите 30 000 клеток в микроцентрифужную трубку объемом 1,5 мл и центрифугу при 7 607 х г в течение 5 мин при 4 °C.
- Осторожно удалите супернатант и храните гранулу ячейки на льду в темноте перед выполнением кометного анализа.
ПРИМЕЧАНИЕ: Клетки должны регулярно проверяться на загрязнение микоплазмой перед выполнением анализа кометы, чтобы предотвратить, среди прочего, образование артефактного повреждения ДНК и измененного ответа на повреждение ДНК, как сообщается в другом месте23. Условия центрифугирования могут быть изменены по мере необходимости в зависимости от типа используемой ячейки.
- Подготовка культивируемых клеток к репарационному анализу
- Культивируйте клетки в колбе для клеточной культуры или чашке Петри.
- Промыть клетки 1 мл PBS дважды перед обработкой клеток повреждающими агентами (например, для клеток BE-M17 обработать 50 мкМ H2O2 в течение 20 мин) на льду, чтобы предотвратить восстановление во время лечения.
- Тщательно вымойте клетки 1 мл PBS дважды, чтобы удалить любые остаточные повреждающие агенты.
- Повторно вводят среду для культивирования клеток и позволяют клеткам восстанавливаться в течение различной продолжительности (например, 0 мин, 30 мин, 2 ч, 6 ч, 24 ч и 30 ч) в увлажненном инкубаторе (37 °C, 5% CO2).
- В каждый момент времени соберите 30 000 клеток в 10% диметилсульфоксид (ДМСО), содержащую культурную среду клеток, и храните их при -80 °C.
- Перед выполнением кометного анализа быстро разморозьте клетки при 37 °C на водяной бане и центрифугируйте их при 7,607 x g в течение 5 мин при 4 °C.
- Удалите супернатант и сохраните гранулу ячейки на льду перед выполнением анализа (т.е. с этапа 3).
- Подготовка цельной крови
ПРИМЕЧАНИЕ: Следующий метод выигрывает от того, что (i) является минимально инвазивным подходом к получению образца крови, (ii) не требует выделения PBMC перед анализом кометы и (iii) позволяет хранить образцы крови (с объемом < 250 мкл) при -80 °C в течение 1 месяца (хотя более поздние данные свидетельствуют о том, что возможно более длительное хранение), без необходимости в криоконсерваторах и без риска или артефактного повреждения образования14. Этическое одобрение или эквивалент может потребоваться перед получением образцов крови от пациентов или животных. Альтернативно, коммерчески доступные образцы крови могут быть использованы, как в настоящем исследовании. В нашем учреждении одобрение Институционального наблюдательного совета не требуется для использования коммерчески доступной крови.- Используя пипетку, перенесите образцы цельной крови (<250 мкл) (Таблица материалов) в сборную пробирку, содержащую минимальный объем, содержащий 0,4 мг ЭДТА (на 250 мкл крови).
- Заморозьте образцы крови при -80 °C перед выполнением анализа кометы HTP.
- Размораживать хранящиеся образцы крови (<250 мкл) при комнатной температуре, без нагрева.
- Перенос 5 мкл цельной крови в микроцентрифужные трубки перед выполнением кометного анализа (см. шаг 3).
3. Лизис клеток
ПРИМЕЧАНИЕ: Проводите все процедуры на льду.
- Используйте 12 000 клеток или 2,5 мкл цельной крови на гель.
- Приготовьте 0,6% (мас./об.) агарозу с низкой температурой плавления, растворенную в PBS с помощью микроволновой печи, и поместите на водяную баню при температуре 37 °C, чтобы предотвратить ее затвердевание.
- Пометьте матовый конец предварительно покрытых слайдов именем, датой и информацией о лечении исследователя с помощью постоянного маркера или карандаша.
- Поместите охлаждающую пластину на плоскую скамью и вставьте два замороженных охлаждающих пакета в скользящий ящик под металлической поверхностью (как показано на рисунке 4)21.
- Поместите слайды на охлаждающую пластину и дайте слайдам предварительно охладиться в течение 1-2 мин, прежде чем добавлять 0,6% (мас./об.) клеток с низкой температурой плавления, содержащих агарозу (этап 3.7).
ПРИМЕЧАНИЕ: Оставление слайдов на охлаждающей пластине более чем на 1-2 мин может привести к образованию конденсата на поверхности слайда из-за влажности окружающей среды. Это может сделать агарозные гели с низкой температурой плавления менее стабильными на слайдах. - Гранулу рассеивают (стадия 2.2.7) путем вихря. Убедитесь, что все супернатанты удалены из гранулы. Поместите пробирки для образцов (содержащие гранулированные клетки) немедленно вернитесь на лед.
ПРИМЕЧАНИЕ: При помещении пробосодержащих пробирок в центрифугу поместите их шарниром, обращенным наружу, чтобы гранула была собрана на этой стороне трубки. Иногда трудно увидеть гранулу, и легко выбить ее при удалении супернатанта. Центрифугирование с крышкой трубки в этой ориентации позволит узнать, где будет находиться гранула ячейки. - Повторно суспендируют ячейку гранулы с 200 мкл 0,6% агарозы с низкой температурой плавления (агароза LMP) и смешивают путем пипетирования вверх и вниз без образования пузырьков. Затем быстро перенесите 80 мкл клеток, содержащих агарозу LMP, на охлажденный слайд и быстро поместите на гель обложку.
- Дайте гелю закрепиться на охлаждающей пластине в течение 1-2 мин.
- Тем временем приготовьте рабочий раствор лизисного буфера объемом 500 мл (табл. 1) и вылейте его в лизисную посуду (рисунок 2).
- После того, как гели будут установлены, быстро удалите обтекатели, осторожно удерживая зажим между большим и указательным пальцами и сдвинув обтекатель с геля.
- Поместите слайды, содержащие образцы, внутрь держателя слайда (все черные «точечные» метки на слайдах должны быть обращены в том же направлении, когда они помещены в носитель) (рисунок 3B), а затем поместите держатель слайда внутрь лизисной тарелки (рисунок 2).
- Закройте крышку лизисной посуды и храните ее в холодильнике на ночь при температуре 4 °C или 30 мин при комнатной температуре, в зависимости от того, что лучше всего соответствует графикувремени оператора 19.
4. Электрофорез
- Осторожно снимите держатель слайда с лизисной посуды. Следите за тем, чтобы не потревожить гели.
- Осторожно поместите держатель слайда в посудомоечную машину, предварительно загруженную ледяным ddH2O, и оставьте ее на 30 минут, гарантируя, что слайды полностью покрыты ddH2O.
- Вставьте замороженный охлаждающий пакет в раздвижной ящик под резервуаром для электрофореза для поддержания оптимальной буферной температуры.
- Осторожно добавьте в резервуар электрофореза ледяной электрофорез рабочий раствор (табл. 1) и перенесите скользящий носитель в резервуар электрофореза. Ориентируйте слайды таким образом, чтобы их прозрачные части с помощью клеток, содержащих гели (т. Е. НЕ матовые / маркировочные концы) указывали на катод (красный электрод).
- Дайте слайдам посидеть в резервуаре электрофореза в течение 20 минут, чтобы ДНК расслабилась и расслабилась. На этом этапе держите блок питания выключенным.
- При необходимости вставьте новый замороженный охлаждающий пакет, чтобы максимизировать охлаждение.
- Выполняйте электрофорез в течение 20 мин при 1,19 В/см или в любых условиях, которые были оптимизированы.
ПРИМЕЧАНИЕ: Оптимизация условий работы электрофореза и объема буфера рекомендуется для каждой лаборатории24. Использование только одного скользящего носителя во время электрофореза не вызывает какого-либо влияния слайдов на сопротивление буфера электрофореза, и авторы не увидели существенного эффекта в напряжении или токе при изменении количества слайдов. - Выключите блок питания, осторожно извлеките держатель слайда из бака электрофореза и дайте ему стечь на папиросной бумаге в течение 30 с.
- Поместите держатель слайда в тарелку, содержащую буфер нейтрализации (таблица 1). Оставьте на 20 минут.
- Снимите держатель слайда с посуды для нейтрализации, поместите его в посудомоечную машину, содержащую ледяной ddH2O, и оставьте на 20 минут.
- Извлеките держатель для горок из воды и дайте горкам высохнуть в инкубаторе при 37 °C в течение 1 часа, или при комнатной температуре в течение ночи, или не высохнуть, в зависимости от графика19 оператора.
ПРИМЕЧАНИЕ: Если на этапе 4.11 нет сушки, выполните этап окрашивания, начиная с 5.2.
5. Окрашивание йодида пропидия (PI)
- Переложите держатель слайда на посудомоечную машину, содержащую ледяной ddH2O для регидратации слайдов и оставьте на 30 минут.
- Поместите скользящий носитель в окрашивающую посуду, содержащую 2,5 мкг/мл раствора йодида пропидия.
ПРИМЕЧАНИЕ: Йодид пропидия светонепроницаем, поэтому обрабатывайте его в затемненной области. Он также токсичен. - Закройте крышкой окрашивающей посуды и высиживайте ее в течение 20 мин в темноте при комнатной температуре.
- Переложите держатель слайда в отдельную посуду и вымойте его ледяным ddH2Oв течение 20 мин.
- Снимите держатель слайда с тарелки и полностью высушите его в темноте, либо в инкубаторе при температуре 37 °C, либо при комнатной температуре, в зависимости от графика или предпочтений оператора.
- Как только слайды полностью высохнут, извлеките их из держателя слайдов и храните их в коробке для слайдов в темноте до готовности к анализу изображения.
ПРИМЕЧАНИЕ: Слайды будут оставаться читаемыми неограниченное время и могут быть повторно окрашены при необходимости.
6. Фермент-модифицированный анализ щелочных комет
ПРИМЕЧАНИЕ: Ферментно-модифицированный анализ щелочной кометы использует стадию ферментной обработки после лизиса, но до электрофореза. Активность фермента вызывает разрывы в ДНК на участках, которые являются субстратами для фермента. Перед выполнением этого анализа необходимо оптимизировать концентрацию ферментов и продолжительность инкубации ферментов.
- После лизиса клеток (шаг 3) дважды промывайте слайды ледяным ddH2Oв течение 20 мин каждая.
- Извлеките держатель для горок из воды и переложите горки в лоток, выстланный бумажными полотенцами.
- Добавьте 80 мкл фермента в оптимизированной концентрации (например, 3,2 ЕД/мл hOGG1 для клеток BE-M17, разбавленных в буфере реакции ферментов) и покройте крышкой для распространения фермента по гелесодержащему образцу.
- Инкубируйте слайды при 37 °C для оптимизированной продолжительности (например, 45 мин для hOGG1).
- После инкубации аккуратно снимите обшивки и перенесите слайды в переноску.
ПРИМЕЧАНИЕ: Не мойте горки после ферментной обработки; непосредственно выполнить электрофорез с шага 4.3.
7. ДНК межцепочечные сшивки (ICL) - модифицированный щелочной кометный анализ
ПРИМЕЧАНИЕ: Концепция этого варианта ICL-ACA заключается в том, что присутствие ICL в ДНК замедлит электрофоретическую миграцию поврежденной ДНК, вызванную воздействием окислительно генерируемого оскорбления. В этом случае, чем короче хвост кометы, тем больше число ICL 25,26,27,28.
- Обработайте клетки реагентом, который индуцирует ICL (например, цисплатин; см. Дополнительный файл).
- Подвергайте обработанные клетки воздействию одного из следующих агентов, чтобы вызвать достаточные разрывы нитей для создания хвоста кометы подходящего размера (~ 20% хвостовой ДНК): перекись водорода (50 мкМ H2O2 в течение 30 мин), ионизирующее излучение (2-5 Гр) или ультрафиолетовое B (UVB) (0,5 Дж / см2).
- Кроме того, производят положительный контроль разрыва нити путем обработки партии клеток тем же агентом и дозой, что и на этапе 7.2 (т.е. без лечения ICL-индуцирующим агентом).
- Центрифугируют клетки при 7,607 х г в течение 5 мин, выбрасывают надосадочный агент, трижды промывают гранулу клетки 1 мл PBS и обрабатывают анализ щелочной кометы (этапы 3-5).
- Рассчитайте уровни межцепочечных сшивок ДНК, используя приведенную ниже формулу.
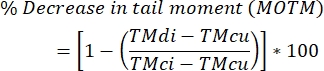
ПРИМЕЧАНИЕ: MOTM (Mean Olive Tail Moment) является конечной точкой кометного анализа, широко используемой при описании ICL-модифицированного кометного анализа, и определяется как произведение длины хвоста и доли общей ДНК в хвосте (т.е. хвостовой момент = длина хвоста x % ДНК в хвосте)29; TMdi: хвостовой момент образцов, обработанных как сшивающим агентом, так иH2O2 (или другим индуктором разрыва нитей); TMcu: хвостовой момент образцов, не обработанных сшивающим агентом и не обработанныхH2O 2 (безобработки ), и TMci: хвостовой момент образцов, не обработанных сшивающим агентом, но обработанныхH2O2.
8. Оценка комет и анализ данных
ПРИМЕЧАНИЕ: Термин «комета» происходит от изображений поврежденных клеток при просмотре под микроскопом после проведения анализа (рисунок 5). В условиях электрофореза ДНК в неповрежденных клетках в значительной степени не мигрирует, а остается в сфероиде, называемом кометной «головой». Однако наличие разрывов нитей позволяет ДНК клетки мигрировать из головы и образовывать «хвост», что приводит к появлению кометы (рисунок 5). Чем больше ДНК в хвосте, тем больше повреждений присутствует.
- Включите флуоресцентный микроскоп с фильтром PI (красный) (λ = 536/617 нм) и программным обеспечением для оценки кометного анализа.
- Добавьте каплю воды с помощью пипетки Пастера в гель и накройте крышкой.
- Поместите слайды в флуоресцентный микроскоп и «забивайте» кометы.
ПРИМЕЧАНИЕ: Оценка - это средство, с помощью которого кометы оцениваются, чтобы определить величину ущерба, присутствующего в каждой комете. В широком смысле это может быть достигнуто путем использования двух подходов, в соответствии с выбранными пользователем предпочтениями, либо на глаз (измерение размера комет по шкале от нуля до четырех), либо путем свободного или коммерчески доступного программного обеспечения30. Как правило, оба подхода оценивают размер хвоста кометы, хотя можно определить различные конечные точки, связанные с кометой. При использовании программного обеспечения нажмите на середину головки кометы и подождите, пока программное обеспечение не обнаружит комету автоматически, а затем оценит выбранную конечную точку (рисунок 5). - Наберите 50 комет на гель и 100 комет на образец (то есть каждый образец соответствует различным методам повреждения ДНК или их репликатам).
- Воспроизведите эксперименты (n = 2) или утроите эксперименты (n = 3).
ПРИМЕЧАНИЕ: Если проводятся только n=2 реплицированные эксперименты, статистический анализ не может быть выполнен, но если n=3, выполните тест на нормальность D'agostino. Большинство данных анализа комет не проходят тест на нормальность. В этом случае используйте непараметрический тест (тест Крускала-Уоллиса с тестом множественных сравнений Данна и тесты Манна-Уитни, установленные на уровне p < 0,05).
Результаты
Оптимизация напряжения электрофореза для ПВТ ACA
Кератиноциты человека (HaCaTs; Таблица материалов) облучали различными дозами ультрафиолетового излучения А (UVA) (5 или 10 Дж/см2); Рисунок 6A), UVB (0,5 или 1 Дж/см2; Рисунок 6В), или обработанный 50 мкМH2O2 (Рисунок 6C) для индуцирования повреждения. Три различных напряжения электрофореза были протестированы для определения оптимального напряжения для электрофореза. Результаты всех трех методов лечения, повреждающих ДНК, показали, что, хотя все напряжения генерировали линейные дозовые ответы, наиболее чувствительный ответ был получен с 1,19 В / см. HaCaTs показал самое высокое исходное повреждение ДНК с использованием 1,19 В / см во время электрофореза по сравнению с 1 В / см и 1,09 В / см (рисунок 6A-C). Кроме того, при использовании 1,19 В/см наблюдается наибольший процент хвостовой ДНК после всех повреждающих методов лечения (рисунок 6)31.
Обнаружение повреждений ДНК в цельной крови человека с использованием Fpg модифицированного HTP ACA
Кровь человека (Таблица материалов) облучали различными дозами 10 Дж/см2 UVA, чтобы вызвать повреждение. Четыре различные концентрации Fpg (1, 2, 4 или 8 Ед/мл) были использованы для определения оптимальной концентрации для ферментной обработки в HTP ACA. Результаты показали, что оптимальные уровни повреждения ДНК были выявлены при 4 ЕД/мл Fpg (Рисунок 7А). Репрезентативные изображения комет из облучаемых UVA образцов крови (рисунок 7B).
Обнаружение ДНК ICL в репрезентативной клеточной линии рака яичников с использованием ICL-модифицированного HTP ACA
Клеточная линия рака яичников (SKOV-3; Таблица материалов) лечили комбинациями 200 мкМ цисплатина и/или последующее лечение 50 мкМH2O2 в течение 30 мин на льду. В неэкспонированных ячейках не было отмечено заметного повреждения (рисунок 8А). ВоздействиеH2O2 само по себе привело к значительному MOTM (рисунок 8B). Напротив, клетки, в которых были индуцированы ICL, показали снижение MOTM (рисунок 8C)28.
Формирование и репарация цисплатин-индуцированной ДНК ICL в репрезентативной клеточной линии рака яичников
ICL-модифицированный HTP ACA использовался для определения временного хода формирования и репарации ДНК ICL, индуцированного цисплатином в клеточной линии рака яичников (A2780; Таблица материалов). Клетки обрабатывали 100 мкМ цисплатина в течение 1 ч, а затем инкубировали в среде, свободной от цисплатина (среда RPMI 1640, дополненная 10% (v/v) фетальной бычьей сывороткой (FBS)) в течение последующего временного курса. В различные моменты времени ICL-модифицированный HTP ACA был выполнен для установления уровней ICL (рисунок 9)28. ICL не было обнаружено до лечения цисплатином. Однако после однократного лечения 100 мкМ цисплатина уровни ICL значительно увеличились, достигнув пика через 12 ч, после чего уровни снизились до нуля через 30 ч.
Корреляция между ДНК ICL и уровнями ДНК платины
Три клетки рака яичников обрабатывали 100 мкМ цисплатина для индуцирования различных уровней ДНК-ICL, прежде чем проводить анализ ICL-модифицированным HTP ACA и индуктивно связанной масс-спектрометрией (ICP-MS; см. Дополнительный файл для получения подробной информации). Как показано на рисунке 10, различные уровни ДНК-ICL были индуцированы в трех клеточных линиях вместе с различными уровнями Pt в ДНК. Наблюдалась положительная корреляция (R2 = 0,9235) между уровнями ICL ДНК и концентрациями платины, что указывает на связь между уровнями платины ДНК и соответствующей ICL28.
Восстановление основания эксцизии в инфицированных микоплазмой и неинфицированных клетках BE-M17
Инфицированные микоплазмой и неинфицированные клетки BE-M17 обрабатывали 50 мкМH2O2 в течение 30 мин и инкубировали с полной средой (модифицированная среда Dulbecco Eagle, дополненная 10% (v/v) FBS) в течение различных длительностей (0 мин, 30 мин, 1 ч, 2 ч, 6 ч, 24 ч или 30 ч), в течение которых клеткам давали восстановиться. В каждый момент времени клетки собирали и замораживали при -80 °C в 10% DMSO-содержащей среде, прежде чем выполнять hOGG1-модифицированный HTP ACA (этап 6). Через 30 мин уровни SB/ALS снизились до 21% TD (процент хвостовой ДНК) в неинфицированных клетках, тогда как инфицированные клетки показали 49% TD (рисунок 11A). Через ~ 15 ч уровни SB / ALS вернулись к исходному уровню как в инфицированных, так и в неинфицированных клетках. Для окисленных пуринов неинфицированный BE-M17 первоначально показал небольшое увеличение повреждений, прежде чем вернуться к исходному уровню в течение 30 ч (рисунок 11B). Напротив, инфицированные клетки показали устойчивое, значительное увеличение окисленных пуринов, которые оставались повышенными и не возвращались к исходным уровням даже через 30 ч (рисунок 11B)23.
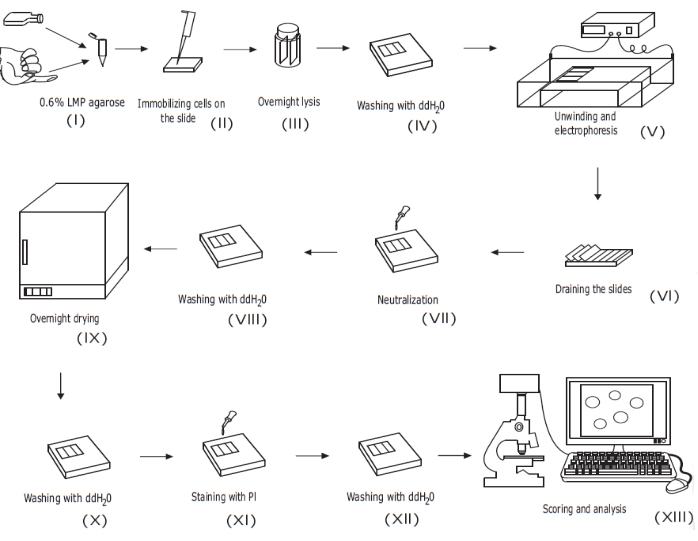
Рисунок 1: Обзор обычной процедуры анализа щелочных комет. (i) Одноклеточная суспензия культивируемых клеток или образец цельной крови смешивают с 0,6% (мас./об.) агарозой LMP. ii) Смесь клетка/агароза наносится на предварительно покрытые микроскопом предметные стекла и покрывается крышкой до затвердевания. (iii) Клетки лизируют с использованием буфера лизиса с высоким рН в течение ночи, образуя нуклеоидные тела, прежде чем (iv) промыться ddH2O. (v) Клеточная ДНК раскручивается в буфере электрофореза с высоким рН. Наличие разрывов нитей позволяет ДНК расслабляться и расслабляться, а под электрофорезом ДНК вытягивается из нуклеоидного тела, образуя хвост. Затем горки (vi) осушают, сушат, (vii) нейтрализуют и (viii) промывают ddH2O перед (ix) сушкой в течение ночи. Затем слайды (x) регидратируются с помощью ddH2O, (xi) окрашиваются, (xii) моются и, наконец, (xiii) оцениваются и анализируются, как правило, с использованием флуоресцентной микроскопии и программного обеспечения для анализа изображений. Эта цифра воспроизводится из предыдущей публикации20. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Материалы, составляющие высокопроизводительную систему кометного электрофореза. Показан резервуар для электрофореза HTP, стойки HTP и посуда для лизиса, мытья, нейтрализации и окрашивания. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
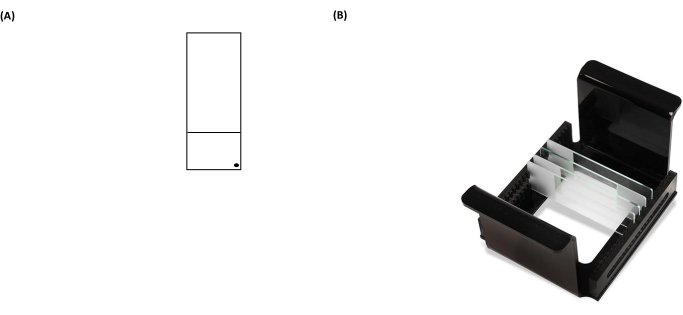
Рисунок 3: Репрезентативные изображения слайда для анализа кометы и стойки HTP (носитель слайдов микроскопа). (A) Для правильной ориентации предварительно покрытая поверхность слайда микроскопа распознается черной точкой в правом углу слайда микроскопа. (B) Изображение стойки HTP иллюстрирует, как слайды удерживаются в плотной вертикальной ориентации с вкладками на носителе для фиксации его ориентации в резервуаре электрофореза. Каждый носитель может вместить до 25 горок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Изображение охлаждающей пластины с образцами слайдов и морозильной камеры на месте. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Скриншот репрезентативных комет, сделанных во время подсчета очков. HaCaTs (A) без лечения и (B) обрабатывают 1 Дж/см2 UVB перед выполнением HTP ACA. Большинство программных пакетов могут вычислять различные конечные точки кометы, но наиболее распространенными из них являются % хвостовой ДНК (предпочтительно) или хвостовой момент на основе этих изображений (синий: начало головы, зеленый: середина головы и фиолетовый: конец хвоста). Шкала составляет 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
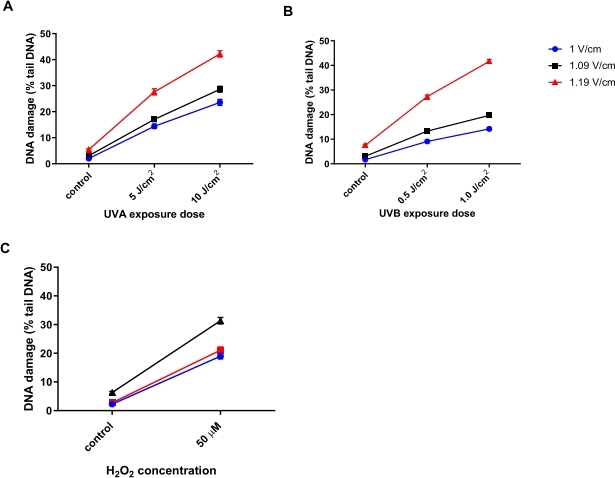
Рисунок 6: Репрезентативные графики, иллюстрирующие влияние напряжения электрофореза на процентное содержание хвостовой ДНК, определяемое с помощью ПВТ ACA. Клетки подвергались воздействию (A) 5 или 10 Дж/см2 UVA, (B) 0,5 или 1,0 Дж/см2 UVB или (C) 50 мкМ H2O2 до HTP ACA, с напряжением электрофореза на уровне 1, 1,09 или 1,19 В/см. Данные представляют собой среднее значение 200 определений из n = 2 дублирующих экспериментов31. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
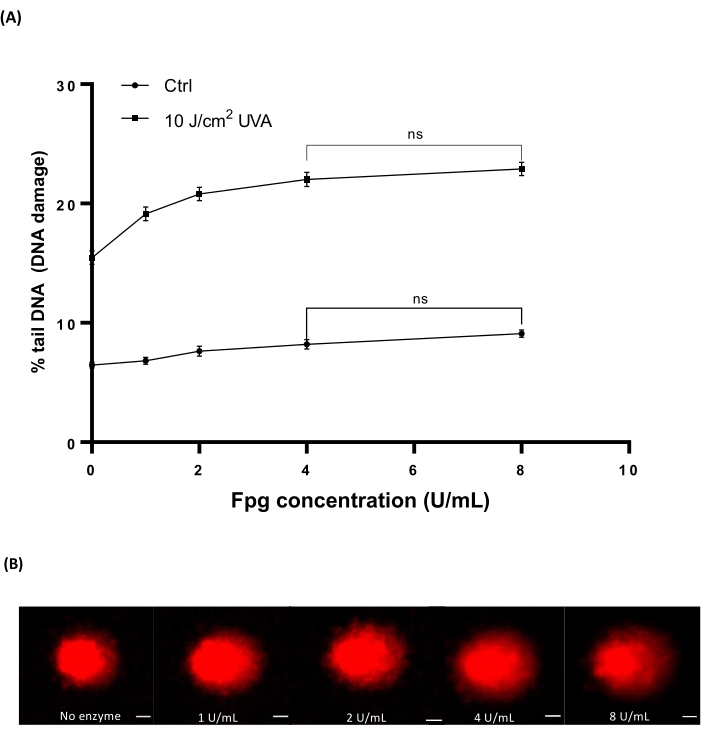
Рисунок 7: Репрезентативные изображения графика и комет человеческой крови, проанализированные Fpg модифицированным HTP ACA. Образцы крови человека облучали 10 Дж/см2 UVA или фиктивно облучали («ctrl») на льду до стадии лизиса. Различные концентрации Fpg (1, 2, 4 или 8 Ед/мл) использовали для ферментной обработки до электрофореза. (A) Данные представляют собой среднее ± SEM 300 определений из n=3 экспериментов. (B) Репрезентативные изображения комет для каждой концентрации Fpg в образцах крови, облученных 10 Дж/см2 UVA. Шкала составляет 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
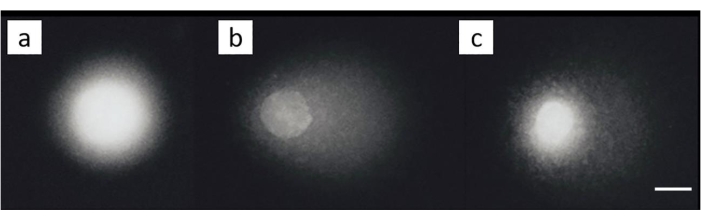
Рисунок 8: Репрезентативные изображения комет, иллюстрирующие обнаружение ICL после лечения цисплатином. (A) Контрольные клетки без какого-либо лечения, (B) клетки, которые были обработаны толькоH2O2 (50 мкМ), (C) клетки, которые были обработаныH2O2 (50 мкМ) и цисплатином (200 мкМ), иллюстрируя, что хвост короче, чем в (B), из-за присутствия ICL28. Шкала составляет 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
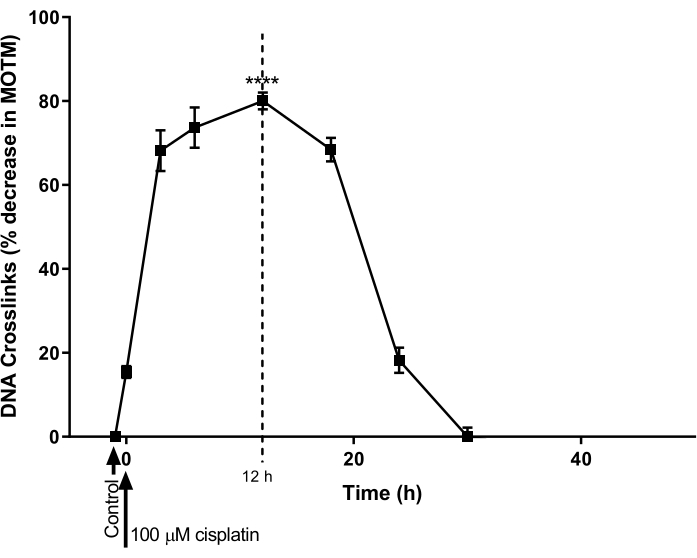
Рисунок 9: Демонстрация кинетики образования и восстановления ICL, индуцированного цисплатином. Клетки A2780 обрабатывали 100 мкМ цисплатина в культуральной среде в течение 1 ч. Затем цисплатинсодержащую среду удаляли, и клетки культивировали в течение различных временных точек перед анализом ICL-модифицированным HTP ACA. Данные представляют собой среднее ± SEM из n = 3 эксперимента28. P < 0,0001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 10: Корреляция между ДНК ICL и концентрацией платины. ДНК ICL определяли ICL-модифицированным HTP ACA, а уровни платины измеряли ICP-MS (с single Quad-Kinetic Energy Discrimination, SQ-KED) в трех клеточных линиях рака яичников. R2 = 0,9235. См. Дополнительный файл методологии ICP-MS для количественной оценки уровней платины в ДНК28. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
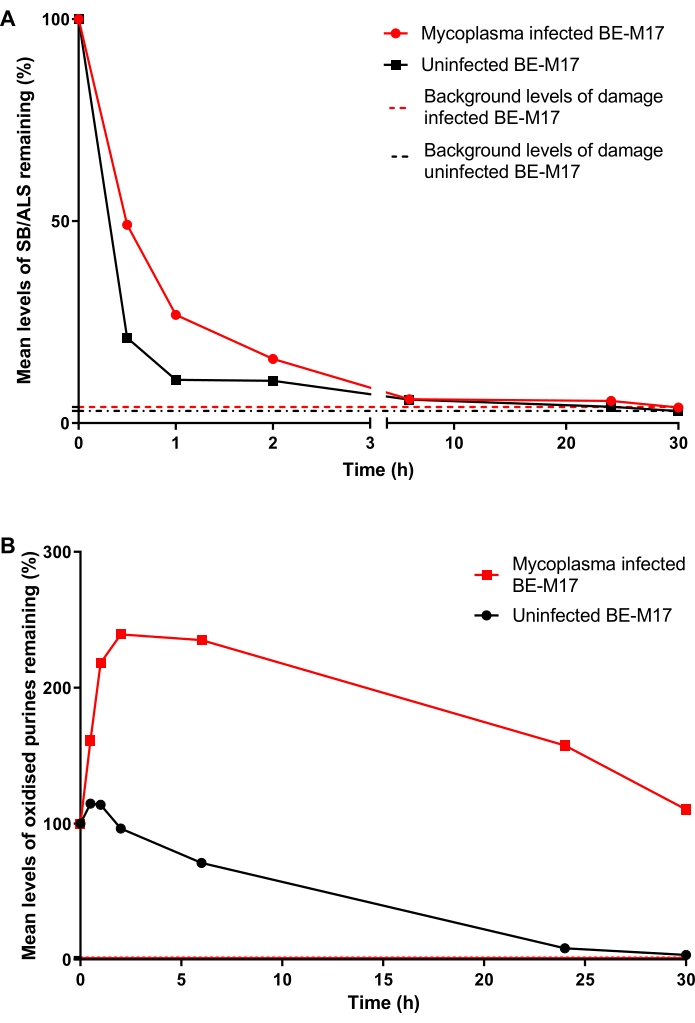
Рисунок 11: Репрезентативный график, иллюстрирующий повреждение и восстановление ДНК, определяемое с помощью модифицированного hOGG1 кометного анализа, в инфицированных микоплазмами и неинфицированных клетках BE-M17. После лечения 50 мкМ Н2О2 в течение 30 мин клеткам давали восстановиться в течение различной продолжительности (0, 30 мин, 1 ч, 2 ч, 6 ч, 24 ч или 30 ч). HOGG1-модифицированный HTP ACA использовался для измерения (A) SB/ALS и (B) окисленных пуринов в инфицированных (красные точки данных) и неинфицированных (черные точки данных) клетках BE-M17. Данные представляют собой среднее значение 200 определений из n = 2 дублирующих экспериментов. Эта цифра воспроизводится с разрешения предыдущей публикации23. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Реагент | Складское решение | Рабочее решение | |
| Буфер лизиса | 100 мМ Na2ЭДТА, 2,5 М NaCl и 10 мМ Tris Base в ddH2O; отрегулируйте pH до 10 с 10 M NaOH | 1% Тритон Х-100 в растворе лизиса | |
| Буфер электрофореза | 10 М NaOH и 200 мМ Na2ЭДТА в ddH2O | 300 мМ NaOH и 1 мМ Na2ЭДТА; pH > 13 | |
| Буфер нейтрализации | 0,4 М ТрисОвое основание в ddH2O; отрегулируйте pH до 7,5 с помощью HCl | ||
| Буфер окрашивания | 1 мг/мл йодида пропидия | 2,5 мкг/мл йодида пропидия в ddH2O | |
Таблица 1: Состав реагентов, используемых в ПВТ АСА. Показаны запас и рабочие концентрации буферов лизиса, электрофореза, нейтрализации и окрашивания.
Дополнительный файл. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Это исследование демонстрирует универсальность, обеспечиваемую современным оборудованием, которое может быть использовано для достижения высокой пропускной способности с различными репрезентативными, распространенными вариантами анализа кометы (т. Е. Щелочной, фермент-модифицированный, кровь и ICL, и другие варианты также будут подходящими). Кроме того, нынешний подход приносит с собой ряд преимуществ20,21: а) время выполнения анализа сокращается за счет параллельного манипулирования несколькими слайдами (время обработки сокращается на 60%); b) снижается риск повреждения гелей и, следовательно, риск для эксперимента; c) требования к реагентам уменьшаются (например, объем резервуара для электрофореза меньше, чем в обычном резервуаре); d) увеличивается количество прогонов горок. Один резервуар может обеспечить 20%-ное увеличение количества слайдов по сравнению с одним обычным резервуаром; однако несколько резервуаров для электрофореза могут работать или работать в рабстве (т.е. несколько резервуаров, управляемых одним источником питания), параллельно от одного и того же источника питания и по-прежнему требуют настольной площади, меньшей, чем один обычный резервуар с лотком для льда; и e) уменьшение занимаемой емкости бака за счет вертикальной ориентации слайдов и встроенного охлаждения (экономия лабораторного пространства); резервуар HTP содержит высокопроизводительную керамическую охлаждающую базу со скользящим ящиком, который может вместить один замороженный охлаждающий пакет для поддержания оптимальной буферной температуры без необходимости выполнения процесса в холодном помещении.
Кроме того, разработанная нами охлаждающая пластина вмещает 26 кометных слайдов, позволяет быстро затвердевать агарозу с низкой температурой плавления на слайдах анализа кометы и облегчает извлечение слайдов после затвердевания агарозного геля. Вышеперечисленные нововведения делают процесс анализа кометы проще и проще.
В то время как были разработаны другие высокопроизводительные подходы (например, 12-гель-кометный анализ, CometChip или 96 мини-гелевых форматов)25, многие ученые предпочитают использовать обычные слайды микроскопа (которые включают коммерчески доступные предварительно покрытые слайды или другие специализированные слайды). Настоящий подход может охватывать все типы слайдов микроскопа, что позволяет масштабировать эксперименты с использованием этих слайдов за счет более быстрой обработки и обработки слайдов. Как отмечалось выше, кометная система ПВТ приносит много преимуществ, но есть одно заметное ограничение: нынешний подход обеспечивает лишь 20%-ное увеличение количества прогонов проб, по сравнению с обычным горизонтальным резервуаром (хотя обработка слайдов происходит гораздо быстрее). Форматы CometChip и 96 мини-гелей содержат большее количество образцов. На сегодняшний день мы не знаем, может ли нынешний подход приспособиться к форматам CometChip или 96 мини-геля, хотя мы прогнозируем, что это произойдет. Как отмечалось выше, количество образцов может быть дополнительно увеличено путем приручения резервуаров к одному источнику питания. Как и во всех подходах, все еще существует вероятность потери или повреждения гелей при загрузке образцов и анализе их под микроскопом, но это больше связано с ошибкой оператора, и шансы на это сводятся к минимуму при нынешнем подходе.
Использование кометной системы HTP может значительно помочь проанализировать повреждение ДНК, облегчая использование анализа кометы в широком спектре применений, таких как молекулярная эпидемиология, мужская репродуктивная наука, генотоксикологические исследования и экологическая токсикология. Это особенно верно для тех пользователей, которые хотят иметь все преимущества улучшенной пропускной способности и простоты использования, не отходя от привычных, экономически эффективных, обычных слайдов микроскопа.
Раскрытие информации
Д-р Кук и д-р Карбаски являются изобретателями трех выданных патентов, относящихся к описанным здесь технологиям.
Благодарности
Работа, о которой сообщается в этой публикации, была частично поддержана Национальным институтом наук о гигиене окружающей среды Национальных институтов здравоохранения под номером награды: 1R41ES030274. Содержание является исключительной ответственностью авторов и не обязательно представляет официальную точку зрения Национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| 22 x 22 mm glass coverslips | Fisher Scientific, Hampton, NH, USA | 631-0124 | |
| A2780 | ECACC, Louis, MO, USA | 93112519 | |
| Concentrated nitric acid (OptimaTM grade) | Fisher Scientific Fair Lawn, NJ, USA | A467-250 | |
| Fluorescence microscope equipped with a camera | Zeiss, Jena, Germany | ||
| Fresh human whole blood | Zen Bio Inc | SER-WB10ML | Commercial human whole blood sample |
| GraphPad Prism | GraphPad Software, San Diego, California | Data analysis software | |
| HTP Comet Assay system | Cleaver Scientific | COMPAC- 50 | |
| Human Keratinocyte (HaCaTs) | American Type Culture Collection (ATCC), Manassas, VA, USA | Discontinued | Can be purchased from another company ADDEXBIO TECHNOLOGIES Cat# T0020001 |
| Hydrogen peroxide (H2O2) 30% in water | Fisher Scientific, Hampton, NH, USA | BP2633-500 | |
| ICP-MS iCAP RQ ICP-MS system | Thermo Scientific, Waltham, MA, USA | IQLAAGGAAQFAQKMBIT | |
| Image and Data Analysis software | Perceptive Instrument, Bury St Edmunds, England, UK | 125525 | Free image analysis softwared is available e.g., ImageJ |
| Internal Standard Mix | SPEX Certiprep, Metuchen, NJ, USA | CL-ISM1-500 | Bismuch (isotope monitored 209 Bi)-concnetration of 10 µg/mL in 5% HNO3 |
| Low melting point Agarose | Invitrogen Waltham, MA, USA | P4864 | |
| Na2EDTA (disodium ethylenediaminetetraacetic acid) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| NaCl (Sodium chloride) | Sigma Aldrich, St. Louis, MO, USA | S7653 | |
| NanoDrop One | Thermo Scientific, Waltham, MA, USA | 701-058108 | Nanodrop for measuring DNA concentration |
| Nanopure Infinity Ultrapure Water System (Barnstead Nanopure) | Thermo Scientific, Waltham, MA, USA | D11901 | Ultrapure water (16 MΩ cm-1) |
| NaOH (sodium Hydroxide) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| Normal melting point Agarose | Fisher Scientific, Hampton, NH, USA | 16520100 | For pre-coating slides |
| OCI-P5X | University of Miami, Miami, FL, USA | N/A | Live Tumor Culture Core facility provided the cells |
| Platinum (Pt) reference standard | SPEX Certiprep, Metuchen, NJ, USA | PLPT3-2Y | (1000 µg/mL in 10% HCl) containing Bismuch |
| Propidium Iodide (1.0 mg/mL in water) | Sigma Aldrich, St. Louis, MO, USA | 12-541BP486410ML | |
| QIAamp DNA Mini Kit | Qiagen Valencia, CA, USA | 51304 | DNA extraction Kit |
| Single-frosted glass microscope slides | Fisher Scientific, Hampton, NH, USA | 12-541B | |
| SKOV3 | ECACC, Louis, MO, USA | 91091004 | |
| Slide box | Fisher Scientific, Hampton, NH, USA | 03-448-2 | Light proof, to protect cells from the formation adventitious damage (according to the widely held view) and prevent fading of the fluorescent dye |
| Slide Chilling plate | Cleaver Scientific, Rugby, England, UK | CSL-CHILLPLATE | |
| Treatment dish | Cleaver Scientific, Rugby, England, UK | STAINDISH4X | |
| Tris-base | Sigma Aldrich, St. Louis, MO, USA | 93362 | |
| Triton X-100 | Fisher Scientific, Hampton, NH, USA | BP151-500 | |
| Trypsin EDTA (0.5%) | Invitrogen Gibco, Waltham, MA, USA | 15400054 | |
| Vertical Slide Carrier | Cleaver Scientific, Rugby, England, UK | COMPAC-25 |
Ссылки
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46 (5), 1213-1224 (2018).
- Evans, M. D., Cooke, M. S. Factors contributing to the outcome of oxidative damage to nucleic acids. Bioessays. 26 (5), 533-542 (2004).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutatation Research. 567 (1), 1-61 (2004).
- Miyamae, Y., et al. Detection of DNA lesions induced by chemical mutagens using the single-cell gel electrophoresis (comet) assay. 2. Relationship between DNA migration and alkaline condition. Mutatation Research. 393 (1-2), 107-113 (1997).
- Angelis, K. J., Dusinská, M., Collins, A. R. Single cell gel electrophoresis: detection of DNA damage at different levels of sensitivity. Electrophoresis. 20 (10), 2133-2138 (1999).
- Duarte, T. L., Cooke, M. S., Jones, G. D. Gene expression profiling reveals new protective roles for vitamin C in human skin cells. Free Radical Biology & Medicine. 46 (1), 78-87 (2009).
- Karbaschi, M., et al. Rescue of cells from apoptosis increases DNA repair in UVB exposed cells: implications for the DNA damage response. Toxicology Research. 4 (3), 725-738 (2015).
- Wu, J. H., Jones, N. J. Assessment of DNA interstrand crosslinks using the modified alkaline comet assay. Methods in Molecular Biology. 817, 165-181 (2012).
- Merk, O., Speit, G. Detection of crosslinks with the comet assay in relationship to genotoxicity and cytotoxicity. Environmental and Molecular Mutagenesis. 33 (2), 167-172 (1999).
- Spanswick, V. J., Hartley, J. M., Hartley, J. A. Measurement of DNA interstrand crosslinking in individual cells using the Single Cell Gel Electrophoresis (Comet) assay. Methods in Molecular Biology. 613, 267-282 (2010).
- Saha, D. T., et al. Quantification of DNA repair capacity in whole blood of patients with head and neck cancer and healthy donors by comet assay. Mutation Research. 650 (1), 55-62 (2008).
- Giovannelli, L., Pitozzi, V., Riolo, S., Dolara, P. Measurement of DNA breaks and oxidative damage in polymorphonuclear and mononuclear white blood cells: a novel approach using the comet assay. Mutatation Research. 538 (1-2), 71-80 (2003).
- Al-Salmani, K., et al. Simplified method for the collection, storage, and comet assay analysis of DNA damage in whole blood. Free Radical Biology & Medicine. 51 (3), 719-725 (2011).
- Akor-Dewu, M. B., et al. Leucocytes isolated from simply frozen whole blood can be used in human biomonitoring for DNA damage measurement with the comet assay. Cell Biochemistry and Function. 32 (3), 299-302 (2014).
- Ge, J., et al. CometChip: a high-throughput 96-well platform for measuring DNA damage in microarrayed human cells. Journal of Visualized Experiments: JoVE. (92), e50607 (2014).
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochemical and Biophysical Reseach Communications. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Experimental Cell Research. 175 (1), 184-191 (1988).
- Karbaschi, M., et al. Evaluation of the major steps in the conventional protocol for the alkaline comet assay. International Journal of Molecular Sciences. 20 (23), 6072 (2019).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Scientific Reports. 4 (1), 7200 (2014).
- Karbaschi, M., Cooke, M. S. Chilling apparatus. USA patent. , (2020).
- Cooke, M. S., Karbaschi, M. Method and apparatus for performing electrophoresis. USA patent. , (2019).
- Ji, Y., Karbaschi, M., Cooke, M. S. Mycoplasma infection of cultured cells induces oxidative stress and attenuates cellular base excision repair activity. Mutatation Research. 845, 403054 (2019).
- Møller, P., et al. Minimum Information for Reporting on the Comet Assay (MIRCA): recommendations for describing comet assay procedures and results. Nature Protocols. 15 (12), 3817-3826 (2020).
- Almeida, G. M., Duarte, T. L., Steward, W. P., Jones, G. D. Detection of oxaliplatin-induced DNA crosslinks in vitro and in cancer patients using the alkaline comet assay. DNA Repair (Amst). 5 (2), 219-225 (2006).
- Moneef, M. A., et al. Measurements using the alkaline comet assay predict bladder cancer cell radiosensitivity. British Journal of Cancer. 89 (12), 2271-2276 (2003).
- Bowman, K. J., et al. Comet assay measures of DNA damage are predictive of bladder cancer cell treatment sensitivity in vitro and outcome in vivo. International Journal of Cancer. 134 (5), 1102-1111 (2014).
- Abdulwahed, A. M. S. . Investigation of DNA Damage and Genomic Organization in the Cellular Response to Platinum Chemotherapy. , (2020).
- Olive, P. L., Banáth, J. P., Durand, R. E. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the "comet" assay. Radiation Research. 122 (1), 86-94 (1990).
- Kumaravel, T. S., Vilhar, B., Faux, S. P., Jha, A. N. Comet Assay measurements: a perspective. Cell Biology and Toxicology. 25 (1), 53-64 (2009).
- Ji, Y. . Formation and Repair of Environmetally-induced damage to Mitochondrial and Nuclear Genomess. , (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены