Method Article
細胞DNA損傷を評価するためのハイスループットコメットアッセイアプローチ
* これらの著者は同等に貢献しました
要約
コメットアッセイは、DNA損傷を検出するための一般的な手段です。この研究では、コメットアッセイの代表的なバリアントでスライドを実行するためのアプローチについて説明します。このアプローチにより、サンプル数が大幅に増加し、アッセイの実行時間、スライド操作の回数、およびゲルの損傷のリスクが軽減されました。
要約
細胞は、内部および外部環境から生じる薬剤に絶えずさらされており、DNAに損傷を与える可能性があります。この損傷は異常な細胞機能を引き起こす可能性があるため、DNA損傷は、おそらく、癌、神経変性疾患、心血管疾患、老化など、すべての主要なヒト疾患の発症に重要な役割を果たす可能性があります。シングルセルゲル電気泳動(すなわち、コメットアッセイ)は、in vitro および in vivo の両方で、広範囲のタイプのDNA損傷(例えば、一本鎖および二本鎖切断、アルカリ不安定部位、DNA-DNA架橋、および特定の修復酵素、酸化プリン、およびピリミジンと組み合わせて)の形成および修復を研究するための最も一般的で高感度な方法の1つです。 システムズ。ただし、従来のアッセイのサンプルスループットが低く、サンプル後処理が面倒なため、可能な限り幅広いアプリケーションが制限されています。彗星の「スコアリング」がますます自動化されるにつれて、制限は現在、かなりの数の彗星スライドを処理する能力です。ここでは、コメットアッセイ(HTPコメットアッセイ)のハイスループット(HTP)バリアントが開発されており、分析されるサンプルの数が大幅に増加し、アッセイの実行時間、個々のスライド操作の数、試薬の要件、およびゲルへの物理的損傷のリスクが減少します。さらに、電気泳動タンクの設置面積は、スライドの垂直方向と一体型冷却により大幅に減少します。また、ここで報告されているのは、コメットアッセイスライドを冷却するための新しいアプローチであり、コメットゲルの固化を便利かつ効率的に促進します。ここでは、代表的なコメットアッセイ法へのこれらの装置の適用について説明した。これらの単純な革新は、コメットアッセイの使用と、曝露生物学、生態毒性学、バイオモニタリング、毒性スクリーニング/試験などの研究分野への応用、および病因の理解を大いにサポートします。
概要
細胞は、DNAを損傷する可能性のある内部および外部環境から生じる薬剤に継続的にさらされています1,2。この損傷は細胞機能の異常を引き起こす可能性があるため3、DNA損傷は、癌、神経変性疾患、心血管疾患、老化など、多くの主要なヒト疾患の発症に重要な役割を果たす可能性があります4。コメットアッセイ(シングルセルゲル電気泳動とも呼ばれます)は、細胞のDNA損傷を検出および定量するためのますます普及している方法です。
最も単純なアルカリコメットアッセイ(ACA)は、アルカリ条件下で一本鎖切断になるアプリン/アピリミジン部位およびアルカリ不安定部位(ALS)とともに、鎖切断(SB、シングルおよびダブルの両方)を検出します5。中性pHコメットアッセイは、率直な一本鎖および二本鎖の切断を評価することができます6。さらに、ACAは、多数のDNA修復酵素と組み合わせて、かなりの範囲のタイプのDNA損傷、例えば酸化プリン(ヒト8-オキソグアニンDNAグリコシラーゼ1;hOGG17の使用によって同定される)を検出することができる。酸化ピリミジン(エンドヌクレアーゼIIIを使用;EndoIII)およびシクロブタンピリミジン二量体(T4エンドヌクレアーゼVを使用;T4endoV)8.コメットアッセイは、シスプラチン9,10,11などの架橋剤によって誘発されるDNA病変を評価するためにも使用できます。アッセイの正式名称、すなわちシングルセルゲル電気泳動によって示されるように、アッセイは分析中の細胞が単一細胞懸濁液であることに依存しています。最も一般的には、これらは培養細胞であるが全血から単離され得るが12、13、または全血自体を使用することができる14、15。あるいは、固体組織から単一細胞懸濁液を生成してもよい。
いくつかの例外、特にEnglewardラボ16からのCometChipレポートを除いて、全体的なコメットアッセイプロトコルは、アッセイの発明者によって最初に記述されたものから劇的に変更されていません(Östling and Johansson 17およびSingh etal.18)。コメットアッセイには多くのステップが含まれます(図1)。これらのステップの多くは、細胞を含む薄いアガロースゲルを一度に1スライドずつ移動させるため、ゲルの損傷または損失のリスクをもたらし、実験の成功を危うくします。その結果、コメットアッセイは、特にかなりの数のスライドが実行されている場合、時間がかかる可能性があります。通常、最大40枚のスライドが大きな(33 cm x 59 cm x 9 cm)電気泳動タンクで実行され、冷却用のウェットアイスが入ったさらに大きなトレイ内に配置されます。最近、溶解ステップの期間を短縮し、染色前にスライドを乾燥させないことで、アッセイの実行時間を1日に短縮できることが報告されています19。
本著者らは、高スループットアルカリコメットアッセイ(HTP ACA)への新規アプローチを以前に報告しており、そこでは、複数の(25のバッチ)コメットアッセイ顕微鏡スライドを、コメットアッセイプロセス全体を通して同時に操作することができる20、21、22。この特許取得済みのアプローチは、顕微鏡スライドを個別に操作する必要がなくなるため、サンプル含有ゲルの損傷や損失のリスクを最小限に抑え、顕微鏡スライドを使用するコメットアッセイのすべてのバリエーションに適用できます。スライド入りラックは、操作中にゲルを保護し、その結果、サンプル処理がより迅速かつ効率的になります。スライドは、水平方向ではなく垂直方向に保持されたラック内で電気泳動を受けることもできます。これと一体型の冷却により、電気泳動槽の設置面積が大幅に削減され、ウェットアイスが不要になります。まとめると、これは従来の手順よりも大幅に改善されています。使用した機器を図2に示します。ここで説明するプロトコルは、この新しいアプローチを使用して、アルカリ不安定部位(ALS)、DNA鎖間架橋(ICL)、およびさまざまなDNA修復酵素の基質の検出のための培養細胞および全血14への代表的なアプリケーションを実証します。
プロトコル
本研究では市販の血液サンプルを使用した。当院では、市販の血液の使用に治験審査委員会の承認は必要ありません。
1. コメットアッセイ用材料の準備
- 顕微鏡スライドの準備
- 1%(w/v)の標準融点アガロース[二重蒸留水(ddH 2 O)に溶解]を50 mLチューブに注ぎ、マイクロ波でアガロースをddH2Oに溶解します。 コーティングスライドの前に固化を防ぐために37°Cで保存してください。固化が発生した場合は、廃棄して新鮮なものを準備してください。
- プレコート顕微鏡は、1%(w/v)の標準融点アガロースを含む50 mLチューブにスライドを浸漬してスライドさせます。
- スライドを浸した後、スライドの背面をすばやく拭きます。
注意: スライドの背面を適切に拭かないと、顕微鏡による分析ステップ中にスライドのバックグラウンドノイズが増加します。 - つや消しセクションの右下隅にある油性マーカーでコーティングされたスライドにラベルを付けます(図3A)。これは、スライドのどちら側が事前にコーティングされているかを示しています。
- アガロースを固め、室温で一晩乾燥させます。
- 乾燥したスライドをティッシュペーパーで包み、箱に保管します。
2. サンプルの調製
- 培養細胞
注:まず、コメットアッセイを開始する前に、細胞を損傷剤で処理します。次に、以下を実行します。- 細胞が接着している場合は、細胞をトリプシン処理して、細胞の適切なコンフルエントで細胞培養フラスコまたは細胞培養ペトリ皿からそれらを放出します。血清含有培地を添加してトリプシンを中和します。
- 細胞を50 mLチューブに移し、遠心分離機(HaCaTの場合は、室温で5分間300 x g で遠心分離機)、上清を穏やかに取り除き、1 mLのPBSを細胞ペレットに加えます。
- 細胞カウントを実行します。
- 30,000個の細胞を1.5 mLの微量遠心チューブに移し、7,607 x g で4°Cで5分間遠心分離します。
- 上清を静かに取り除き、コメットアッセイを実行する前に、暗所で氷上に細胞ペレットを保存します。
注:他の場所で報告されているように、コメットアッセイを実行する前に、細胞を定期的にマイコプラズマ汚染についてテストして、他の影響の中でも、人工的なDNA損傷の形成とDNA損傷応答の変化を防ぐ必要があります23。遠心分離条件は、使用する細胞の種類に応じて、必要に応じて変更することができる。
- 修復アッセイのための培養細胞の調製
- 細胞培養フラスコまたはシャーレで細胞を培養する。
- 細胞を損傷剤で処理する前に、1 mLのPBSで細胞を2回洗浄します(例:BE-M17細胞の場合は、50 μMのH2O2 で20分間処理します)処理中に修復が起こらないようにします。
- 細胞を1 mLのPBSで2回穏やかに洗浄し、残留損傷剤を取り除きます。
- 細胞培養培地を再導入し、加湿インキュベーター(37°C、5%CO2)でさまざまな期間(0分、30分、2時間、6時間、24時間、30時間など)細胞を修復します。
- 各時点で、10%ジメチルスルホキシド(DMSO)含有細胞培養培地で30,000個の細胞を収集し、-80°Cで保存します。
- コメットアッセイを実行する前に、細胞を水浴中で37°Cで素早く解凍し、7,607 x g で4°Cで5分間遠心分離します。
- アッセイを実行する前に(すなわち、ステップ3から)上清を除去し、細胞ペレットを氷上に保管する。
- 全血の調製
注:以下の方法は、(i)血液サンプルを取得するための低侵襲アプローチであること、(ii)コメットアッセイの前にPBMCを分離する必要がないこと、および(iii)血液サンプル(容量<250μL)を-80°Cで最大1か月間保存できることから恩恵を受けます(ただし、最近の証拠では、より長い保存が可能であることが示唆されています)。 凍結保存剤を必要とせず、リスクや人工的な損傷の形成もありません14。患者または動物から血液サンプルを採取する前に、倫理的承認または同等の承認が必要になる場合があります。あるいは、市販の血液試料を本試験のように使用することができる。当院では、市販の血液の使用に治験審査委員会の承認は必要ありません。- ピペットを使用して、全血サンプル(<250 μL)(材料表)を、0.4 mgのEDTA(血液250 μLあたり)を含む最小容量の収集チューブに移します。
- HTPコメットアッセイを実行する前に、血液サンプルを-80°Cで凍結してください。
- 保存した血液サンプル(<250μL)を室温で加熱せずに解凍した。
- コメットアッセイを実行する前に、5 μLの全血をマイクロ遠心チューブに移します(ステップ3を参照)。
3.細胞溶解
注意: すべての手順を氷上で実行してください。
- ゲルあたり12,000細胞または2.5μLの全血を使用します。
- マイクロ波を用いてPBSに溶解した0.6%(w/v)低融点アガロースを調製し、固化しないように37°Cの水浴に入れます。
- プレコートされたスライドのつや消しの端に、パーマネントマーカーまたは鉛筆を使用して、治験責任医師の名前、日付、および治療情報のラベルを付けます。
- 冷却プレートを平らなベンチに置き、2つの冷凍冷却パックを金属表面の下のスライド式引き出しに挿入します( 図4を参照)21。
- スライドを冷却プレートに置き、スライドを1〜2分間プレチルしてから、0.6%(w / v)の低融点アガロース含有セルを追加します(ステップ3.7)。
注意: スライドを冷却プレートに1〜2分以上置いておくと、周囲の湿度によりスライド面に結露が発生する可能性があります。これにより、低融点アガロースゲルがスライド上での安定性を低下させる可能性があります。 - ボルテックスによってペレットを分散させる(ステップ2.2.7)。すべての上清がペレットから除去されていることを確認してください。サンプルチューブ(ペレットセルを含む)をすぐに氷上に戻します。
注意: サンプル含有チューブを遠心分離機に入れるときは、ペレットがチューブのこちら側に集められるように、ヒンジを外側に向けて配置します。ペレットが見えにくい場合があり、上澄み液を取り除きながらペレットを取り除くのは簡単です。チューブの蓋をこの向きにして遠心分離すると、細胞ペレットがどこにあるかを知ることができます。 - 細胞ペレットを200 μLの0.6%低融点アガロース(LMPアガロース)で再懸濁し、気泡を発生させずに上下にピペッティングして混合します。次に、80 μLのLMPアガロース含有細胞を冷やしたスライドにすばやく移し、カバーガラスをゲルにすばやく置きます。
- ゲルを冷却プレートに1〜2分間セットします。
- その間、溶解バッファーの500 mL作業溶液を調製し(表1)、それを溶解皿に注ぎます(図2)。
- ゲルをセットしたら、スライドを親指と人差し指でそっと持ち、カバーガラスをゲルからスライドさせて、カバーガラスをすばやく取り外します。
- サンプルを含むスライドをスライドキャリア内に置き(スライドの黒い「ドット」マークはすべて、キャリアに配置するときに同じ方向を向いている必要があります)、次にスライドキャリアを溶解皿内に置きます(図2)。
- 溶解皿の蓋を閉め、溶解皿を冷蔵庫に4°Cまたは室温で30分、オペレーターのタイムスケジュール19に最も適した方で一晩保管します。
4. 電気泳動
- スライドキャリアを溶解皿から慎重に取り外します。ゲルを乱さないように注意してください。
- スライドキャリアを氷冷したddH2Oをあらかじめロードした洗浄皿にそっと置き、スライドがddH2Oで完全に覆われるように30分間放置します。
- 電気泳動タンクの下のスライド式引き出し内に凍結冷却パックを挿入して、最適なバッファー温度を維持します。
- 氷冷電気泳動作業溶液(表1)を電気泳動タンクに注意深く加え、スライドキャリアを電気泳動槽に移します。セル含有ゲルのある透明な部分(つまり、つや消し/ラベリングの端ではない)がカソード(赤い電極)に向くようにスライドを向けます。
- スライドを電気泳動タンクに20分間置いて、DNAがリラックスしてほどけるようにします。この手順の間、電源装置をオフのままにします。
- 必要に応じて、冷却を最大化するために新しい冷凍冷却パックを挿入します。
- 1.19 V/cm、または最適化された条件で20分間電気泳動を実行します。
注:電気泳動の実行条件とバッファーの量の最適化は、すべての実験室24に推奨されます。電気泳動中に単一のスライドキャリアのみを使用しても、電気泳動バッファーの抵抗に対するスライドの影響は発生せず、スライドの数が変化した場合の電圧または電流に有意な影響は見られませんでした。 - 電源を切り、スライドキャリアを電気泳動タンクから慎重に取り外し、ティッシュペーパーに30秒間排出させます。
- 中和バッファーを含むディッシュにスライドキャリアを置きます(表1)。20分間放置します。
- 中和皿からスライドキャリアを取り出し、氷冷ddH2Oを含む洗浄皿に入れ、20分間放置します。
- スライドキャリアを水から取り出し、オペレーターのスケジュールに応じて、スライドを37°Cのインキュベーターで1時間、または室温で一晩乾燥させるか、乾燥させないでください19。
注意: ステップ4.11で乾燥がない場合は、5.2から染色ステップを実行します。
5.ヨウ化プロピジウム(PI)染色
- スライドキャリアを氷冷ddH2Oを含む洗浄皿に移してスライドを再水和し、30分間放置します。
- スライドキャリアを、2.5 μg/mLのヨウ化プロピジウム溶液を含む染色皿に入れます。
注意: ヨウ化プロピジウムは光に敏感なので、暗い場所で取り扱ってください。それはまた有毒です。 - 染色皿の蓋を閉め、室温で暗所で20分間インキュベートします。
- スライドキャリアを別の皿に移し、氷冷したddH2Oで20分間洗浄します。
- スライドキャリアをディッシュから取り出し、オペレーターのスケジュールや好みに応じて、37°Cのインキュベーター内または室温で暗所で完全に乾燥させます。
- スライドが完全に乾いたら、スライドキャリアから取り出し、画像分析の準備ができるまで暗所のスライドボックスに保管します。
注意: スライドは無期限に読み取り可能なままであり、必要に応じて再染色することができます。
6. 酵素修飾アルカリ彗星アッセイ
注:酵素修飾アルカリコメットアッセイは、溶解後、電気泳動前の酵素処理ステップを使用します。酵素の活性は、酵素の基質である部位でDNAの切断を引き起こします。このアッセイを実行する前に、酵素濃度と酵素インキュベーションの期間を最適化する必要があります。
- 細胞溶解(ステップ3)後、スライドを氷冷ddH 2 Oで2回ずつ20分間洗浄する。
- スライドキャリアを水から取り出し、ペーパータオルで裏打ちされたトレイにスライドを移します。
- 最適な濃度で80 μLの酵素を加え(例:酵素反応バッファーで希釈したBE-M17細胞用のhOGG13.2 U/mL)、カバーガラスで覆い、ゲル含有サンプル上に酵素を広げます。
- スライドを37°Cで最適化された持続時間(hOGG1の場合は45分など)インキュベートします。
- インキュベーション後、カバーガラスをそっと取り外し、スライドをキャリアに移します。
注:酵素処理後にスライドを洗わないでください。ステップ4.3の電気泳動を直接行います。
7. DNA鎖間架橋(ICL)修飾アルカリコメットアッセイ
注:ICL-ACAのこの変異体の概念は、DNA中のICLの存在が、酸化的に生成された侮辱にさらされた後に誘発される損傷したDNAの電気泳動移動を遅らせるというものです。この場合、彗星の尾が短いほど、ICL25,26,27,28の数が多くなります。
- ICLを誘導する試薬(シスプラチンなど; 補足ファイルを参照)で細胞を処理します。
- 処理した細胞を次のいずれかの薬剤でさらして、適切なサイズの彗星の尾(~20%の尾DNA)を作成するのに十分な鎖切断を誘発します:過酸化水素(50 μM H 2O 2で30分間)、電離放射線(2-5 Gy)、または紫外線B(UVB)(0.5 J / cm2)。
- さらに、ステップ7.2で使用したのと同じ薬剤および用量で細胞のバッチを処理することによって、ストランドブレークポジティブコントロールを生成する(すなわち、ICL誘導剤による処理なし)。
- 細胞を7,607 x g で5分間遠心分離し、上清を捨て、細胞ペレットを1 mLのPBSで3回洗浄し、アルカリコメットアッセイと同様に処理します(ステップ3〜5)。
- 以下の式を使用して、DNA鎖間架橋のレベルを計算します。
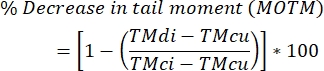
注:MOTM(平均オリーブテールモーメント)は、ICL修飾コメットアッセイを記述するときに広く使用されているコメットアッセイエンドポイントであり、テールの長さとテールの全DNAの割合の積として定義されます(つまり、テールモーメント=テールの長さxテールのDNAの%)29;TMdi:架橋剤およびH2O2(または他のストランドブレーカー誘導剤)の両方で処理した試料のテールモーメント;TMcu:架橋剤で処理されておらず、H2O2で処理されていない(処理されていない)サンプルのテールモーメント、およびTMci:架橋剤で処理されていないがH2O2で処理されたサンプルのテールモーメント。
8. 彗星のスコアリングとデータ分析
注:「彗星」という用語は、アッセイの実行後に顕微鏡で見たときの損傷細胞の画像に由来します(図5)。電気泳動条件下では、損傷を受けていない細胞のDNAはほとんど移動しませんが、彗星「頭」と呼ばれる回転楕円体に残ります。しかし、鎖切れの存在により、細胞のDNAが頭から移動して「尾」を形成し、彗星のような外観になります(図5)。尾のDNAが多いほど、より多くの損傷が存在します。
- PI(赤)フィルター(λ = 536/617 nm)とコメットアッセイスコアリングソフトウェアを使用して蛍光顕微鏡の電源を入れます。
- パスツールピペットを使用して一滴の水をゲルに加え、カバーガラスで覆います。
- スライドを蛍光顕微鏡に入れ、彗星を「スコアリング」します。
注:スコアリングは、各彗星に存在する損傷の量を決定するために、彗星を評価する手段です。大まかに言えば、これは、ユーザの選択した好みに応じて、目で(彗星のサイズを0〜4のスケールで測定する)か、または自由に、または市販のソフトウェア30を使用することによって、2つのアプローチを使用することによって達成することができる。一般に、どちらのアプローチも彗星の尾のサイズを評価しますが、さまざまな彗星関連のエンドポイントを決定することができます。ソフトウェアを使用する場合は、彗星の頭の中央をクリックし、ソフトウェアが彗星を自動的に検出するまで待ってから、選択したエンドポイントを評価します(図5)。 - ゲルあたり50個の彗星、サンプルあたり100個の彗星をスコアリングします(つまり、各サンプルは異なるDNA損傷処理またはそれらの反復に対応します)。
- 実験を複製する(n = 2)か、実験を3回繰り返す(n = 3)。
注:n=2回の反復実験のみを行う場合、統計分析は実行できませんが、n=3の場合はダゴスティーノ正規性検定を実行します。ほとんどの彗星アッセイデータは正規性検定に合格しません。この場合、ノンパラメトリック検定を使用します(クラスカル-ウォリス検定とダンの多重比較検定、およびマン-ホイットニー検定の有意性は p < 0.05に設定されています)。
結果
HTP ACAの電気泳動電圧の最適化
ヒトケラチノサイト(HaCaTs;資料表)異なる線量の紫外線A放射線(UVA)を照射した(5または10J / cm2;図6A)、UVB(0.5または1 J / cm2;図6B)、または50μMH2O2で処理して損傷を誘発する(図6C)。電気泳動の3つの異なる電圧をテストして、電気泳動に最適な電圧を決定しました。3つのDNA損傷処理すべての結果から、すべての電圧が線形の線量反応を生成する一方で、最も感度の高い応答は1.19 V / cmで得られたことが明らかになりました。HaCaTは、電気泳動中に1.19 V / cmを使用した場合、1 V / cmおよび1.09 V / cmと比較して最も高いベースラインDNA損傷を示しました(図6A-C)。さらに、1.19 V / cmを使用すると、すべての損傷処理に続いて、最大の%テールDNAが見られます(図6)31。
Fpg修飾HTP ACAを用いたヒト全血中のDNA損傷の検出
ヒトホールド血液(材料表)に異なる用量の10J / cm2 UVAを照射して損傷を誘発した。4つの異なる濃度のFpg(1、2、4または8 U / mL)を使用して、HTP ACAでの酵素処理に最適な濃度を決定しました。結果は、4 U / mL Fpgで最適なレベルのDNA損傷が明らかになったことを示しました(図7A)。UVA照射血液サンプルからの代表的な彗星画像(図7B)。
ICL修飾HTP ACAを用いた代表的な卵巣癌細胞株におけるDNA ICLの検出
卵巣癌細胞株(SKOV-3;資料表)200μMシスプラチンの組み合わせおよび/またはその後の50μM H 2 O2による処理を氷上で30分間処理した。未ばく露細胞には顕著な損傷は認められなかった(図8A)。H2O2単独への曝露は、有意なMOTMを生成した(図8B)。対照的に、ICLが誘導された細胞はMOTMの減少を示した(図8C)28。
代表的な卵巣癌細胞株におけるシスプラチン誘導性DNA ICLの形成と修復
ICL修飾HTP ACAを使用して、卵巣癌細胞株におけるシスプラチンによって誘導されるDNA ICL形成および修復の時間経過を決定しました(A2780; 資料表)。細胞を100 μMシスプラチンで1時間処理した後、シスプラチンフリー培地(10%(v/v)ウシ胎児血清(FBS)を添加したRPMI 1640培地)でその後の経時変化のためにインキュベートしました。さまざまな時点で、ICLのレベルを確立するためにICL修飾HTP ACAが実行されました(図9)28。シスプラチン処理前にICLは検出されなかった。しかし、100 μMシスプラチンによる1回の治療後、ICLレベルは有意に増加し、12時間でピークに達し、その後、レベルは30時間後にゼロに戻りました。
DNA ICLとDNAプラチナレベルの相関
3つの卵巣癌細胞を100 μMシスプラチンで処理して、異なるレベルのDNA-ICLを誘導した後、ICL修飾HTP ACAおよび誘導結合質量分析(ICP-MS;詳細については 補足ファイル を参照)による分析を行いました。 図10に示すように、3つの細胞株では異なるレベルのDNA-ICLが誘導され、DNAでは異なるレベルのPtが誘導されました。DNA ICLレベルとプラチナ濃度との間に正の相関(R2 = 0.9235)が観察され、DNAプラチナレベルと対応するICL28との関連が示された。
マイコプラズマ感染および非感染BE-M17細胞における塩基切除修復
マイコプラズマ感染および非感染BE-M17細胞を50μM H 2 O 2で30分間処理し、完全な培地(10%(v/v)FBSを添加したダルベッコ改変イーグル培地)とともに異なる期間(0分、30分、1時間、2時間、6時間、24時間、または30時間)インキュベートし、その間に細胞を修復させた。各時点で、細胞を回収し、-80°Cで凍結し、10%DMSO含有培地中で、hOGG1修飾HTP ACAを行う前に(ステップ6)。30分後、SB/ALSのレベルは非感染細胞で21%TD(パーセンテージテールDNA)に減少しましたが、感染細胞は49%TDを示しました(図11A)。~15時間後、SB/ALSのレベルは、感染細胞と非感染細胞の両方でベースラインに戻りました。酸化プリン体の場合、感染していないBE-M17は、30時間以内にベースラインに戻る前に、最初は損傷のわずかな増加を示しました(図11B)。対照的に、感染細胞は酸化プリンの持続的で有意な増加を示し、それは上昇したままであり、30時間後もベースラインレベルに戻りませんでした(図11B)23。
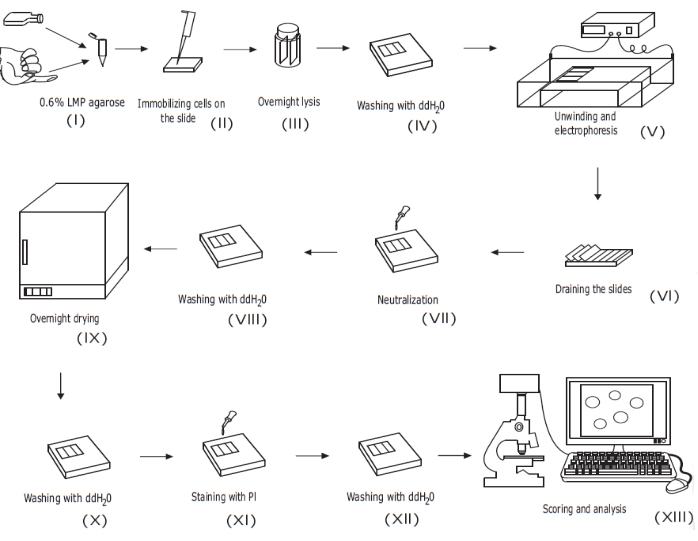
図1:従来のアルカリコメットアッセイ手順の概要 。 (i)培養細胞の単一細胞懸濁液または全血サンプルを0.6%(w / v)LMPアガロースと混合します。(ii)セル/アガロース混合物をプレコート顕微鏡スライドに塗布し、固まるまでカバーガラスで覆います。(iii)細胞を高pH溶解バッファーを使用して一晩溶解し、核様体を形成してから、(iv)ddH2Oで洗浄する。 (v)細胞DNAを高pH電気泳動バッファーで巻き戻します。鎖切断の存在は、DNAが弛緩してほどけることを可能にし、そして電気泳動下で、DNAは核様体から引き出されて尾を形成する。次いで、スライドを(vi)排水し、乾燥させ、(vii)中和し、(viii)ddH2Oで洗浄してから(ix)一晩乾燥する。次に、スライドを(x)ddH2Oで再水和し、(xi)染色し、(xii)洗浄し、最後に(xiii)典型的には蛍光顕微鏡および画像解析ソフトウェアを用いてスコアリングおよび分析する。この図は、以前の出版物20から複製されています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:ハイスループットコメット電気泳動システムを構成する材料。 HTP電気泳動タンク、HTPラック、および溶解、洗浄、中和、および染色のための皿が示されています。 この図の拡大版を表示するには、ここをクリックしてください。
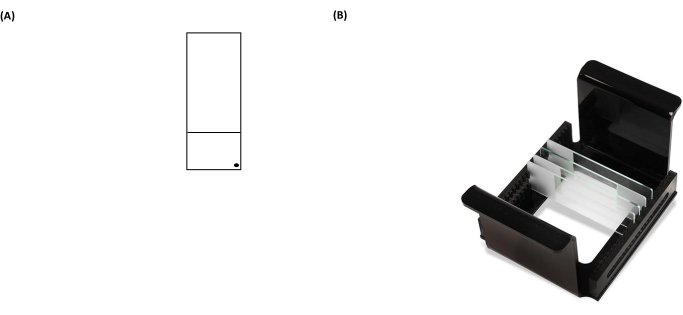
図3:コメットアッセイスライドとHTPラック(顕微鏡スライドキャリア)の代表的な画像 。 (A)正しい向きのために、顕微鏡スライドのプレコート面は、顕微鏡スライドの右隅にある黒い点で認識されます。(B)HTPラックの画像は、スライドが垂直方向にしっかりと保たれ、キャリアにタブを付けて電気泳動タンク内でその向きを固定する方法を示しています。各キャリアは最大25枚のスライドを収容できます。 この図の拡大版を表示するには、ここをクリックしてください。

図4:サンプルスライドとフリーザーパックを所定の位置に置いた冷却プレートの表現。 この図の拡大版を表示するには、ここをクリックしてください。

図5:スコアリング中に撮影された代表的な彗星のスクリーンショット。 HaCaTs(A)は処理せず、(B)HTP ACAを実施する前に1J / cm2UVB で処理します。ほとんどのソフトウェアパッケージはさまざまな彗星のエンドポイントを計算できますが、最も一般的なものは、これらの画像に基づく%テールDNA(推奨)またはテールモーメントです(青:頭の始まり、緑:頭の中央、紫:尾の終わり)。スケールバーは10μmです。 この図の拡大版を表示するには、ここをクリックしてください。
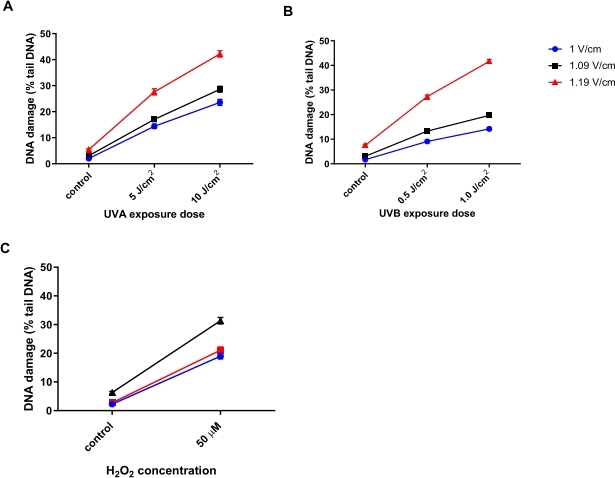
図6:HTP ACAを用いて決定された、テールDNA百分率に対する電気泳動電圧の影響を示す代表的なグラフ。細胞を、HTP ACAの前に(A)5または10 J/cm 2 UVA、(B)0.5または1.0 J/cm 2 UVB、または(C)50 μM H 2 O 2に、電気泳動電圧を1、1.09、または1.19 V / cmのいずれかで曝露しました。データは、n=2重複実験31からの200回の決定の平均を表す。この図の拡大版を表示するには、ここをクリックしてください。
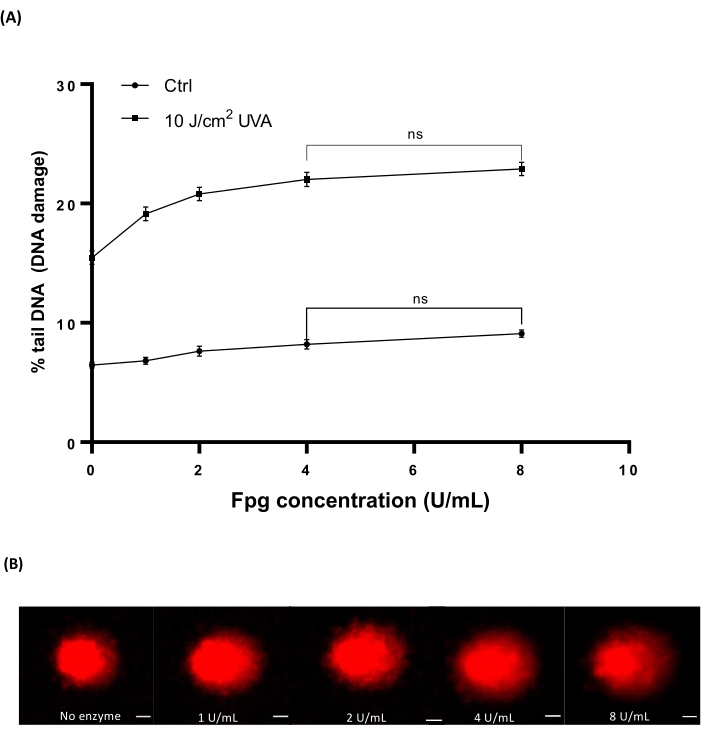
図7:Fpg修飾HTP ACAによって分析されたヒト血液の代表的なグラフおよび彗星画像。 ヒト血液サンプルは、溶解ステップの前に氷上に10 J / cm2 UVAまたは偽照射(「ctrl」)を照射しました。電気泳動前の酵素処理には、異なる濃度のFpg(1、2、4、または8 U / mL)を使用しました。 (A) データは、n = 3回の実験からの300回の決定の平均±SEMを表します。 (B) 10J/cm2UVA 照射血液試料中のFpg濃度ごとの彗星の代表的な画像。スケールバーは10μmです。 この図の拡大版を表示するには、ここをクリックしてください。
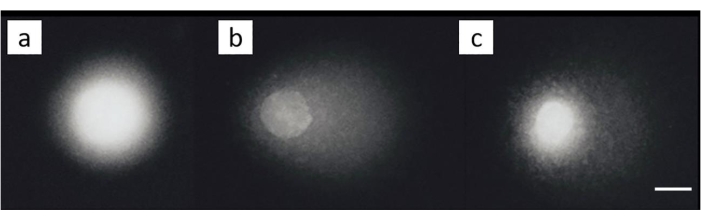
図8:シスプラチン処理後のICL検出を示す代表的な彗星画像。 (A)何も処理せずにコントロール細胞、(B)H2O2(50μM)のみで処理した細胞、(C)H2O2(50μM)およびシスプラチン(200μM)で処理した細胞、(B)よりも短い尾部、ICL28の存在による。スケールバーは10μmです。 この図の拡大版を表示するには、ここをクリックしてください。
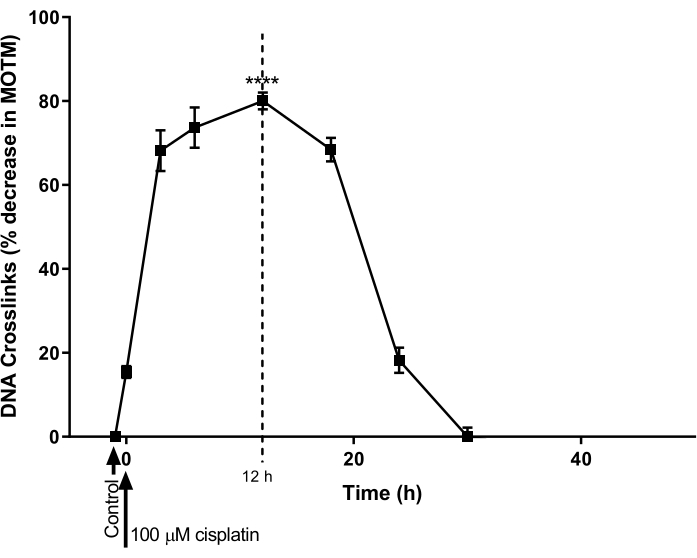
図9:シスプラチン誘発性ICL形成と修復の速度論の実証。 A2780細胞を培養液中の100 μMのシスプラチンで1時間処理した。次いで、シスプラチン含有培地を除去し、ICL修飾HTP ACAによる分析の前に、細胞を様々な時点にわたって培養した。データは、n=3実験28からのSEMの平均±を表す。 P < 0.0001 この図の拡大版を表示するには、ここをクリックしてください。

図10:DNA ICLと白金濃度の相関。 DNA ICLはICL修飾HTP ACAによって決定され、プラチナレベルは3つの卵巣癌細胞株においてICP-MS(単一四角形運動エネルギー識別、SQ-KED)によって測定された。R2 = 0.9235。DNA28のプラチナレベルを定量するためのICP-MS方法論の補足ファイルを参照してください。この図の拡大版を表示するには、ここをクリックしてください。
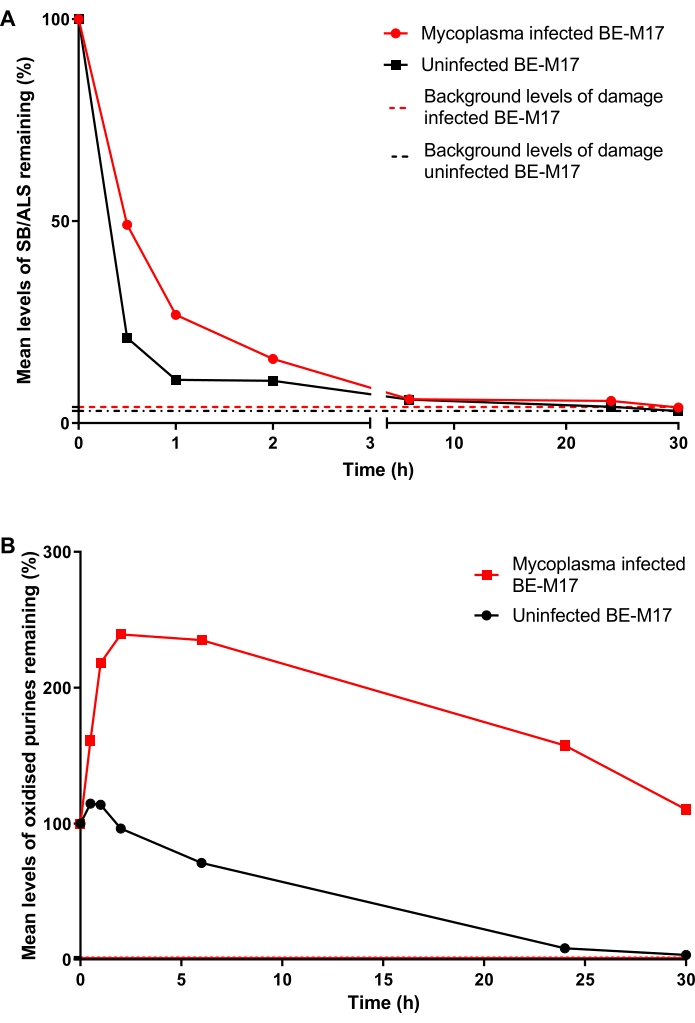
図11:マイコプラズマ感染細胞と非感染BE-M17細胞におけるhOGG1修飾コメットアッセイによって決定されたDNA損傷と修復を示す代表的なグラフ。50μMH2O2で30分間処理した後、細胞を異なる期間(0、30分、1時間、2時間、6時間、24時間、または30時間)修復させた。hOGG1修飾HTP ACAは、感染した(赤いデータポイント)および感染していない(黒いデータポイント)BE-M17細胞における(A)SB / ALSおよび(B)酸化プリンを測定するために使用されました。データは、n = 2回の重複実験からの200回の決定の平均を表す。この図は、以前の出版物23からの許可を得て複製されています。この図の拡大版を表示するには、ここをクリックしてください。
| 試薬 | ストックソリューション | 実用的なソリューション | |
| 溶解バッファー | 100 mM Na 2 EDTA、2.5 M NaCl、および ddH2O 中の 10 mM トリス塩基;10 M NaOHでpHを10に調整します | 溶解ストック溶液中の1%トリトンX-100 | |
| 電気泳動バッファー | ddH 2 O 中の 10 M NaOH および 200 mMNa2EDTA | 300 mM NaOHおよび1 mM Na2EDTA;pH > 13 | |
| 中和バッファー | 0.4 m トリス ベース in ddH2O;塩酸でpHを7.5に調整する | ||
| 染色バッファー | 1 mg/mL ヨウ化プロピジウム | 2.5 μg/mL ヨウ化プロピジウム ddH2O | |
表1:HTP ACAに使用される試薬の組成。 溶解、電気泳動、中和、および染色バッファーのストック濃度と使用濃度を示します。
ディスカッション
この研究は、現在の装置によって提供される汎用性を実証しており、コメットアッセイのさまざまな代表的な一般的なバリアント(すなわち、アルカリ、酵素修飾、血液、およびICL、およびその他のバリアントも適しています)でハイスループットを達成するために使用できます。さらに、本アプローチはいくつかの利点をもたらす20,21:(a)複数のスライドを並行して操作することによりアッセイの実行時間が短縮される(処理時間が60%減少する)。(b)ゲルの損傷のリスク、したがって実験のリスクが減少します。(c)試薬要件が減少している(例えば、電気泳動タンクの容積が従来のタンクよりも小さい)。(d)スライドの実行数が増えます。1つのタンクは、単一の従来のタンクと比較して、実行されるスライドの数を20%増加させることができます。ただし、複数の電気泳動タンクを同じ電源から並列に実行またはスレーブ化(つまり、単一の電源によって制御される複数のタンク)することができ、製氷皿を備えた単一の従来のタンクよりも小さいベンチトップフットプリントが必要です。(e)スライドの垂直方向と一体型冷却により、タンクの設置面積が減少します(ラボスペースを節約)。HTPタンクは、冷蔵室でプロセスを実行することなく最適なバッファ温度を維持するために1つの凍結冷却パックを収めることができるスライド式引き出しを備えた高性能セラミック冷却ベースで構成されています。
さらに、当社が開発した冷却プレートは、26枚のコメットスライドを収容し、コメットアッセイスライド上の低融点アガロースの迅速な凝固を可能にし、アガロースゲルが固化した後のスライドの取り出しを容易にします。上記の革新により、コメットアッセイプロセスがより簡単かつ簡単になります。
他のハイスループットアプローチ(12ゲルコメットアッセイ、CometChip、96ミニゲルフォーマットなど)が開発されていますが25、多くの科学者は従来の顕微鏡スライド(市販のプレコートスライド、またはその他の特殊なスライドを含む)の使用を好みます。現在のアプローチは、あらゆる種類の顕微鏡スライドに対応できるため、これらのスライドを使用した実験は、スライドの処理と処理を高速化してスケールアップできます。上記のように、HTPコメットシステムは多くの利点をもたらしますが、1つの注目すべき制限があります:現在のアプローチは、従来の水平タンクと比較して、実行されるサンプルの数の20%の増加しか提供しません(スライドの処理ははるかに高速ですが)。コメットチップと96ミニゲルフォーマットは、より多くのサンプルを実行します。これまでのところ、現在のアプローチがCometChipまたは96ミニゲルフォーマットに対応できるかどうかはわかりませんが、対応できると予測しています。上記のように、タンクを単一の電源に奴隷化することで、サンプルの数をさらに増やすことができます。すべてのアプローチと同様に、サンプルをロードして顕微鏡で分析している間にゲルが失われたり損傷したりする可能性がありますが、これはオペレーターのエラーによるものであり、現在のアプローチではこの可能性は最小限に抑えられています。
HTPコメットシステムの使用は、DNA損傷の分析に大いに役立ち、分子疫学、男性生殖科学、遺伝毒性学研究、環境毒性学などの幅広いアプリケーションでのコメットアッセイの使用を容易にします。これは、使い慣れた費用対効果の高い従来の顕微鏡スライドから離れることなく、スループットの向上と使いやすさのすべての利点を享受したいユーザーに特に当てはまります。
開示事項
クック博士とカルバスキ博士は、ここに記載されている技術に関連する3つの特許の発明者です。
謝辞
この出版物で報告された研究は、部分的に、国立衛生研究所の国立環境衛生科学研究所によって賞番号1R41ES030274でサポートされました。内容は著者の責任であり、必ずしも国立衛生研究所の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| 22 x 22 mm glass coverslips | Fisher Scientific, Hampton, NH, USA | 631-0124 | |
| A2780 | ECACC, Louis, MO, USA | 93112519 | |
| Concentrated nitric acid (OptimaTM grade) | Fisher Scientific Fair Lawn, NJ, USA | A467-250 | |
| Fluorescence microscope equipped with a camera | Zeiss, Jena, Germany | ||
| Fresh human whole blood | Zen Bio Inc | SER-WB10ML | Commercial human whole blood sample |
| GraphPad Prism | GraphPad Software, San Diego, California | Data analysis software | |
| HTP Comet Assay system | Cleaver Scientific | COMPAC- 50 | |
| Human Keratinocyte (HaCaTs) | American Type Culture Collection (ATCC), Manassas, VA, USA | Discontinued | Can be purchased from another company ADDEXBIO TECHNOLOGIES Cat# T0020001 |
| Hydrogen peroxide (H2O2) 30% in water | Fisher Scientific, Hampton, NH, USA | BP2633-500 | |
| ICP-MS iCAP RQ ICP-MS system | Thermo Scientific, Waltham, MA, USA | IQLAAGGAAQFAQKMBIT | |
| Image and Data Analysis software | Perceptive Instrument, Bury St Edmunds, England, UK | 125525 | Free image analysis softwared is available e.g., ImageJ |
| Internal Standard Mix | SPEX Certiprep, Metuchen, NJ, USA | CL-ISM1-500 | Bismuch (isotope monitored 209 Bi)-concnetration of 10 µg/mL in 5% HNO3 |
| Low melting point Agarose | Invitrogen Waltham, MA, USA | P4864 | |
| Na2EDTA (disodium ethylenediaminetetraacetic acid) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| NaCl (Sodium chloride) | Sigma Aldrich, St. Louis, MO, USA | S7653 | |
| NanoDrop One | Thermo Scientific, Waltham, MA, USA | 701-058108 | Nanodrop for measuring DNA concentration |
| Nanopure Infinity Ultrapure Water System (Barnstead Nanopure) | Thermo Scientific, Waltham, MA, USA | D11901 | Ultrapure water (16 MΩ cm-1) |
| NaOH (sodium Hydroxide) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| Normal melting point Agarose | Fisher Scientific, Hampton, NH, USA | 16520100 | For pre-coating slides |
| OCI-P5X | University of Miami, Miami, FL, USA | N/A | Live Tumor Culture Core facility provided the cells |
| Platinum (Pt) reference standard | SPEX Certiprep, Metuchen, NJ, USA | PLPT3-2Y | (1000 µg/mL in 10% HCl) containing Bismuch |
| Propidium Iodide (1.0 mg/mL in water) | Sigma Aldrich, St. Louis, MO, USA | 12-541BP486410ML | |
| QIAamp DNA Mini Kit | Qiagen Valencia, CA, USA | 51304 | DNA extraction Kit |
| Single-frosted glass microscope slides | Fisher Scientific, Hampton, NH, USA | 12-541B | |
| SKOV3 | ECACC, Louis, MO, USA | 91091004 | |
| Slide box | Fisher Scientific, Hampton, NH, USA | 03-448-2 | Light proof, to protect cells from the formation adventitious damage (according to the widely held view) and prevent fading of the fluorescent dye |
| Slide Chilling plate | Cleaver Scientific, Rugby, England, UK | CSL-CHILLPLATE | |
| Treatment dish | Cleaver Scientific, Rugby, England, UK | STAINDISH4X | |
| Tris-base | Sigma Aldrich, St. Louis, MO, USA | 93362 | |
| Triton X-100 | Fisher Scientific, Hampton, NH, USA | BP151-500 | |
| Trypsin EDTA (0.5%) | Invitrogen Gibco, Waltham, MA, USA | 15400054 | |
| Vertical Slide Carrier | Cleaver Scientific, Rugby, England, UK | COMPAC-25 |
参考文献
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46 (5), 1213-1224 (2018).
- Evans, M. D., Cooke, M. S. Factors contributing to the outcome of oxidative damage to nucleic acids. Bioessays. 26 (5), 533-542 (2004).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutatation Research. 567 (1), 1-61 (2004).
- Miyamae, Y., et al. Detection of DNA lesions induced by chemical mutagens using the single-cell gel electrophoresis (comet) assay. 2. Relationship between DNA migration and alkaline condition. Mutatation Research. 393 (1-2), 107-113 (1997).
- Angelis, K. J., Dusinská, M., Collins, A. R. Single cell gel electrophoresis: detection of DNA damage at different levels of sensitivity. Electrophoresis. 20 (10), 2133-2138 (1999).
- Duarte, T. L., Cooke, M. S., Jones, G. D. Gene expression profiling reveals new protective roles for vitamin C in human skin cells. Free Radical Biology & Medicine. 46 (1), 78-87 (2009).
- Karbaschi, M., et al. Rescue of cells from apoptosis increases DNA repair in UVB exposed cells: implications for the DNA damage response. Toxicology Research. 4 (3), 725-738 (2015).
- Wu, J. H., Jones, N. J. Assessment of DNA interstrand crosslinks using the modified alkaline comet assay. Methods in Molecular Biology. 817, 165-181 (2012).
- Merk, O., Speit, G. Detection of crosslinks with the comet assay in relationship to genotoxicity and cytotoxicity. Environmental and Molecular Mutagenesis. 33 (2), 167-172 (1999).
- Spanswick, V. J., Hartley, J. M., Hartley, J. A. Measurement of DNA interstrand crosslinking in individual cells using the Single Cell Gel Electrophoresis (Comet) assay. Methods in Molecular Biology. 613, 267-282 (2010).
- Saha, D. T., et al. Quantification of DNA repair capacity in whole blood of patients with head and neck cancer and healthy donors by comet assay. Mutation Research. 650 (1), 55-62 (2008).
- Giovannelli, L., Pitozzi, V., Riolo, S., Dolara, P. Measurement of DNA breaks and oxidative damage in polymorphonuclear and mononuclear white blood cells: a novel approach using the comet assay. Mutatation Research. 538 (1-2), 71-80 (2003).
- Al-Salmani, K., et al. Simplified method for the collection, storage, and comet assay analysis of DNA damage in whole blood. Free Radical Biology & Medicine. 51 (3), 719-725 (2011).
- Akor-Dewu, M. B., et al. Leucocytes isolated from simply frozen whole blood can be used in human biomonitoring for DNA damage measurement with the comet assay. Cell Biochemistry and Function. 32 (3), 299-302 (2014).
- Ge, J., et al. CometChip: a high-throughput 96-well platform for measuring DNA damage in microarrayed human cells. Journal of Visualized Experiments: JoVE. (92), e50607 (2014).
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochemical and Biophysical Reseach Communications. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Experimental Cell Research. 175 (1), 184-191 (1988).
- Karbaschi, M., et al. Evaluation of the major steps in the conventional protocol for the alkaline comet assay. International Journal of Molecular Sciences. 20 (23), 6072 (2019).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Scientific Reports. 4 (1), 7200 (2014).
- Karbaschi, M., Cooke, M. S. Chilling apparatus. USA patent. , (2020).
- Cooke, M. S., Karbaschi, M. Method and apparatus for performing electrophoresis. USA patent. , (2019).
- Ji, Y., Karbaschi, M., Cooke, M. S. Mycoplasma infection of cultured cells induces oxidative stress and attenuates cellular base excision repair activity. Mutatation Research. 845, 403054 (2019).
- Møller, P., et al. Minimum Information for Reporting on the Comet Assay (MIRCA): recommendations for describing comet assay procedures and results. Nature Protocols. 15 (12), 3817-3826 (2020).
- Almeida, G. M., Duarte, T. L., Steward, W. P., Jones, G. D. Detection of oxaliplatin-induced DNA crosslinks in vitro and in cancer patients using the alkaline comet assay. DNA Repair (Amst). 5 (2), 219-225 (2006).
- Moneef, M. A., et al. Measurements using the alkaline comet assay predict bladder cancer cell radiosensitivity. British Journal of Cancer. 89 (12), 2271-2276 (2003).
- Bowman, K. J., et al. Comet assay measures of DNA damage are predictive of bladder cancer cell treatment sensitivity in vitro and outcome in vivo. International Journal of Cancer. 134 (5), 1102-1111 (2014).
- Abdulwahed, A. M. S. . Investigation of DNA Damage and Genomic Organization in the Cellular Response to Platinum Chemotherapy. , (2020).
- Olive, P. L., Banáth, J. P., Durand, R. E. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the "comet" assay. Radiation Research. 122 (1), 86-94 (1990).
- Kumaravel, T. S., Vilhar, B., Faux, S. P., Jha, A. N. Comet Assay measurements: a perspective. Cell Biology and Toxicology. 25 (1), 53-64 (2009).
- Ji, Y. . Formation and Repair of Environmetally-induced damage to Mitochondrial and Nuclear Genomess. , (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved