Method Article
גישת בדיקת שביט בתפוקה גבוהה להערכת נזק לדנ"א תאי
* These authors contributed equally
In This Article
Summary
בדיקת השביט היא אמצעי פופולרי לאיתור נזק לדנ"א. מחקר זה מתאר גישה להפעלת שקופיות בגרסאות מייצגות של בדיקת השביט. גישה זו הגדילה משמעותית את מספר הדגימות תוך הפחתת זמן הריצה של הבדיקה, מספר מניפולציות השקופיות והסיכון לפגיעה בג'לים.
Abstract
התאים נחשפים ללא הרף לחומרים הנובעים מהסביבה הפנימית והחיצונית, מה שעלול לפגוע בדנ"א. נזק זה עלול לגרום לתפקוד לקוי של התאים, ולכן נזק לדנ"א עשוי למלא תפקיד קריטי בהתפתחותן של, באופן מתקבל על הדעת, כל המחלות האנושיות הגדולות, כגון סרטן, מחלות נוירודגנרטיביות ומחלות לב וכלי דם, והזדקנות. אלקטרופורזה בג'ל חד-תאי (כלומר, בדיקת השביט) היא אחת השיטות הנפוצות והרגישות ביותר לחקר היווצרות ותיקון של מגוון רחב של סוגים של נזק לדנ"א (למשל, שברים חד-גדיליים ודו-גדיליים, אתרים אלקליים-לביליים, קישורים צולבים של DNA-DNA, ובשילוב עם אנזימי תיקון מסוימים, פורינים מחומצנים ופירימידינים), הן במבחנה והן ב-in vivo מערכות. עם זאת, תפוקת המדגם הנמוכה של הבדיקה הקונבנציונלית ועבודת המדגם המייגעת מגבילים את הגורמים ליישום הרחב ביותר האפשרי שלה. כאשר "הניקוד" של כוכבי שביט הופך לאוטומטי יותר ויותר, המגבלה היא כעת היכולת לעבד מספר משמעותי של שקופיות שביט. כאן פותחה גרסה בעלת תפוקה גבוהה (HTP) של בדיקת השביט (HTP comt assay), מה שמגדיל משמעותית את מספר הדגימות שנותחו, מקטין את זמן הריצה של הבדיקה, את מספר מניפולציות השקופיות הבודדות, את דרישות הריאגנטים ואת הסיכון לנזק פיזי לג'לים. יתר על כן, טביעת הרגל של מיכל האלקטרופורזה מצטמצמת באופן משמעותי בשל הכיוון האנכי של השקופיות והקירור האינטגרלי. כמו כן, דווח כאן על גישה חדשנית לשקופיות בדיקה מצמררות של שביט, המאפשרת בנוחות וביעילות את התמצקות ג'ל השביט. כאן תוארה היישום של מכשירים אלה לשיטות בדיקה מייצגות של שביט. חידושים פשוטים אלה תומכים מאוד בשימוש במבחן השביט ויישומו בתחומי מחקר כגון ביולוגיה של חשיפה, אקוטוקסיקולוגיה, ניטור ביולוגי, סינון / בדיקת רעילות, יחד עם הבנת פתוגנזה.
Introduction
התאים נחשפים ללא הרף לחומרים הנובעים מהסביבה הפנימית והחיצונית, מה שעלול לפגוע בדנ"א 1,2. נזק זה עלול לגרום לתפקוד לקוי של התאים3, ולכן נזק לדנ"א עשוי למלא תפקיד קריטי בהתפתחותן של מחלות אנושיות מרכזיות רבות, כגון סרטן, מחלות נוירודגנרטיביות ומחלות לב וכלי דם, והזדקנות4. בדיקת השביט (הנקראת גם אלקטרופורזה בג'ל חד-תאי) היא שיטה פופולרית יותר ויותר לאיתור וכימות נזק לדנ"א תאי.
באופן הפשוט ביותר, בדיקת השביט האלקליין (ACA) מזהה שברי גדיל (SB; יחידים וכפולים), יחד עם אתרים אפוריניים/אפירימידיים ואתרים אלקליים-לביליים (ALS) ששניהם הופכים לשברים חד-גדיליים בתנאים אלקליים5. מבחן שביט pH נייטרלי יכול להעריך הפסקות חד-גדיליות ודו-גדיליות גלויות6. יתר על כן, ה-ACA, בשילוב עם מספר אנזימי תיקון DNA, יכול לזהות מגוון ניכר של סוגים של נזק לדנ"א, למשל, פורינים מחומצנים (מזוהים על ידי שימוש ב-8-אוקסוגואנין DNA גליקוזילאז 1; hOGG17); פירמידינים מחומצנים (באמצעות אנדונוקלאז III; EndoIII) וציקלובוטאן פירימידין דימרים (באמצעות אנדונוקלאז V4 T4; T4endoV)8. בדיקת השביט יכולה לשמש גם להערכת נגעים בדנ"א המושרים על ידי סוכני crosslinking, כגון ציספלטין 9,10,11. כפי שעולה משמה הרשמי של הבדיקה, כלומר אלקטרופורזה בג'ל חד-תאי, הבדיקה מסתמכת על כך שהתאים הנבדקים הם תרחיף של תא בודד; בדרך כלל, אלה הם תאים בתרבית אבל ניתן לבודד מדם שלם 12,13, או דם שלם עצמו ניתן להשתמש14,15. לחלופין, תרחיף של תא בודד עשוי להיווצר מרקמות מוצקות.
מלבד כמה יוצאים מן הכלל, ובראשם דיווחי CometChip ממעבדת אנגלוורד 16, פרוטוקול בדיקת השביט הכולל לא השתנה באופן דרמטי מזה שתואר במקור על ידי ממציאי הבדיקה (Östling and Johansson17 ו- Singh etal.18). בדיקת השביט כוללת שלבים רבים (איור 1). רבים מהצעדים הללו כרוכים בהעברת ג'ל האגרוז הדק, המכיל תאים, שקופית אחת בכל פעם, ולכן מהווים סיכון לנזק או אובדן של הג'ל, מה שמסכן את הצלחת הניסוי. כתוצאה מכך, בדיקת השביט עלולה לגזול זמן רב, במיוחד אם מספר משמעותי של שקופיות מופעלות. בדרך כלל, עד 40 שקופיות מופעלות במיכל אלקטרופורזה גדול (33 ס"מ x 59 ס"מ x 9 ס"מ), היושב בתוך מגש גדול עוד יותר המכיל קרח רטוב לקירור. לאחרונה דווח כי ניתן לקצר את זמן הריצה של הבדיקה ליום אחד על ידי הקטנת משך שלב הליזיס ולא ייבוש השקופיות לפני צביעת19.
המחברים הנוכחיים דיווחו בעבר על גישה חדשנית למבחן השביט אלקליין בתפוקה גבוהה (HTP ACA), שבו ניתן לתמרן מספר (קבוצות של 25) שקופיות מיקרוסקופ שביט בו-זמנית לאורך כל תהליך בדיקת השביט20,21,22. גישה זו המוגנת בפטנט ממזערת את הסיכון לפגיעה בג'לים המכילים דגימה או לאובדן שלהם על ידי הסרת הצורך לתפעל את שקופיות המיקרוסקופ בנפרד, וניתן ליישם אותה על כל הגרסאות של בדיקת השביט, המשתמשות בשקופיות מיקרוסקופ. המדפים המכילים שקופיות מגנים על הג'לים במהלך המניפולציות, וכתוצאה מכך, עיבוד הדגימה מהיר ויעיל יותר. המגלשות יכולות גם לעבור אלקטרופורזה במדפים, המוחזקים בכיוון האנכי, ולא האופקי. זה, וקירור אינטגרלי, מפחיתים באופן משמעותי את טביעת הרגל של מיכל האלקטרופורזה ומבטלים את הצורך בקרח רטוב. יחד, מדובר בשיפור משמעותי לעומת ההליך הקונבנציונלי. הציוד שבו נעשה שימוש מתואר באיור 2. הפרוטוקולים המתוארים כאן, תוך שימוש בגישה חדשנית זו, מדגימים את היישום המייצג של תאים בתרבית ודם שלם14 לזיהוי אתרי אלקלי-לבילי (ALS), קישורים צולבים בין גדילי DNA (ICL), ומצעים של אנזימי תיקון DNA שונים.
Protocol
במחקר הנוכחי נעשה שימוש בדגימות דם מסחריות. במוסד שלנו, אין צורך באישור מועצת הביקורת המוסדית לשימוש בדם זמין מסחרית.
1. הכנת חומרים לניסוי השביט
- הכנת שקופיות המיקרוסקופ
- יוצקים 1% (w/v) נקודת התכה רגילה [מומסת במים מזוקקים כפולים (ddH 2 O)] בצינור של 50 מ"ל ובמיקרוגל כדי להמיס את האגרוז ב-ddH2O. יש לאחסן בטמפרטורה של 37°C כדי למנוע התמצקות לפני שקופיות הציפוי. אם מתרחשת התמצקות, יש להשליך ולהכין טרי.
- מיקרוסקופ טרום ציפוי מחליק על ידי טבילת השקופיות לתוך צינור 50 מ"ל המכיל 1% (w / v) נקודת התכה רגילה agarose.
- נגב את החלק האחורי של השקופיות במהירות לאחר טבילת השקופיות.
הערה: אי מחיקה תקינה של גב השקופיות תגביר את רעשי הרקע של השקופיות במהלך שלב הניתוח באמצעות מיקרוסקופ. - סמן את השקופית המצופה עם סמן קבוע בפינה הימנית התחתונה של החלק הקפוא (איור 3A). פעולה זו מראה איזה צד של השקופית מצופה מראש.
- אפשרו לאגרוז להתייצב ולהתייבש למשך הלילה בטמפרטורת החדר.
- עטפו את השקופיות המיובשות בנייר טישו ואחסנו אותן בקופסה.
2. הכנת דוגמאות
- תאים בתרבית
הערה: ראשית, יש לטפל בתאים עם החומרים המזיקים לפני תחילת בדיקת השביט. לאחר מכן, בצע את הפעולות הבאות.- אם התאים דבקים, נסו את התאים כדי לשחרר אותם מבקבוק תרבית התאים או מתרבית התאים צלחות פטרי, במפגש התאים המתאים. נטרול טריפסין על ידי הוספת מדיה המכילה סרום.
- מעבירים את התאים לצינור של 50 מ"ל, צנטריפוגה (למשל, עבור HaCaTs, צנטריפוגה בגודל 300 x גרם למשך 5 דקות בטמפרטורת החדר), מסירים בעדינות את הסופרנטנט, ומוסיפים 1 מ"ל של PBS לכדור התא.
- ביצוע ספירת תאים.
- העבר 30,000 תאים לצינור מיקרוצנטריפוגה של 1.5 מ"ל וצנטריפוגה בגודל 7,607 x g למשך 5 דקות ב-4 מעלות צלזיוס.
- הסירו בעדינות את הסופרנטנט ואחסנו את כדור התא על קרח בחושך לפני ביצוע בדיקת השביט.
הערה: תאים צריכים להיבדק באופן קבוע לזיהום מיקופלסמה לפני ביצוע בדיקת השביט כדי למנוע, בין היתר, היווצרות של נזק לדנ"א artefactual ושינוי תגובת נזק לדנ"א, כפי שדווח במקום אחר23. תנאי הצנטרפוגציה עשויים להשתנות, לפי הצורך, בהתאם לסוג התא שבו נעשה שימוש.
- הכנת תאים בתרבית לבדיקת תיקון
- תאי תרבית בבקבוק תרבית התאים או צלחות פטרי.
- שטפו את התאים עם 1 מ"ל של PBS פעמיים לפני הטיפול בתאים עם חומרים מזיקים (למשל, עבור תאי BE-M17, טפלו עם 50 μM של H 2 O2למשך 20 דקות) על קרח כדי למנוע את התרחשות התיקון במהלך הטיפול.
- שטפו את התאים בעדינות עם 1 מ"ל של PBS פעמיים כדי להסיר שאריות של חומרים מזיקים.
- הציגו מחדש את מדיום תרבית התאים ואפשרו לתאים לתקן לפרקי זמן משתנים (למשל, 0 דקות, 30 דקות, 2 שעות, 6 שעות, 24 שעות ו-30 שעות) באינקובטור לח (37 מעלות צלזיוס, 5% CO2).
- בכל נקודת זמן, לאסוף 30,000 תאים ב 10% דימתיל סולפוקסיד (DMSO) המכיל תרבית תאים בינוני ולאחסן אותם ב -80 מעלות צלזיוס.
- לפני ביצוע בדיקת השביט, הפשירו את התאים במהירות בטמפרטורה של 37 מעלות צלזיוס באמבט מים וצנטריפוגות בטמפרטורה של 7,607 x g למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- הסר את הסופר-נטנט ואחסן את כדור התא על קרח לפני ביצוע הבדיקה (כלומר, משלב 3).
- הכנת דם שלם
הערה: השיטה הבאה נהנית מכך ש-(i) היא גישה זעיר פולשנית לקבלת דגימת דם, (ii) אי-דרישה לבידוד של PBMC לפני בדיקת השביט, ו-(iii) המאפשרת לאחסן את דגימות הדם (בנפח <-250 μL) בטמפרטורה של -80 מעלות צלזיוס, למשך עד חודש אחד (אם כי עדויות עדכניות יותר מצביעות על כך שאחסון ארוך יותר אפשרי), ללא צורך בחומרים משמרים קריופריים, וללא סיכון או היווצרות נזק artefactual14. ייתכן שיהיה צורך באישור אתי, או שווה ערך, לפני קבלת דגימות דם מחולים או מבעלי חיים. לחלופין, ניתן להשתמש בדגימות דם זמינות מסחרית כמו במחקר הנוכחי. במוסד שלנו, אין צורך באישור מועצת הביקורת המוסדית לשימוש בדם זמין מסחרית.- באמצעות פיפטה, מעבירים דגימות דם שלמות (<250 μL) (טבלת חומרים) לצינור איסוף המכיל נפח מינימלי המכיל 0.4 מ"ג EDTA (לכל 250 μL של דם).
- הקפיאו את דגימות הדם בטמפרטורה של -80 מעלות צלזיוס לפני ביצוע בדיקת שביט HTP.
- הפשרה אחסנו דגימות דם (<250 μL) בטמפרטורת החדר, ללא חימום.
- העבר 5 μL מכל הדם לצינורות מיקרוצנטריפוגה לפני ביצוע בדיקת השביט (ראה שלב 3).
3. תזה תאית
הערה: בצע את כל ההליכים על קרח.
- יש להשתמש ב-12,000 תאים או 2.5 מיקרו-ליטר של דם מלא לכל ג'ל.
- מכינים 0.6% (w/v) נקודת התכה נמוכה של אגרוז מומס ב-PBS באמצעות מיקרוגל, ומניחים באמבט מים בטמפרטורה של 37°C כדי למנוע את התמצקותו.
- סמן את הקצה הקפוא של השקופיות המצופות מראש עם שם החוקר, תאריך ופרטי הטיפול באמצעות טוש או עיפרון קבוע.
- הניחו צלחת צינון על ספסל שטוח והכניסו את שתי חבילות הקירור הקפואות למגירת ההזזה שמתחת למשטח המתכת (כפי שמוצג באיור 4)21.
- הניחו את המגלשות על צלחת הקירור ואפשרו לשקופיות להצטנן מראש למשך 1-2 דקות לפני הוספת 0.6% (w/v) של תאים המכילים אגרוז בנקודת התכה נמוכה (שלב 3.7).
הערה: השארת השקופיות על לוח הקירור למשך יותר מ-1-2 דקות עלולה לגרום להיווצרות עיבוי על משטח ההחלקה עקב לחות הסביבה. זה עשוי להפוך את נקודת ההיתוך הנמוכה של ג'ל אגרוז לפחות יציב בשקופיות. - פזרו את הכדור (שלב 2.2.7) על ידי מערבולת. יש לוודא שכל הסופר-נטנט הוסר מהכדור. מניחים את צינורות הדגימה (המכילים את התאים הכדוריים) מיד בחזרה על הקרח.
הערה: בעת הצבת הצינורות המכילים דגימה בצנטריפוגה, שים אותם עם הציר הפונה החוצה, כך שהכדור ייאסף בצד זה של הצינור. לפעמים קשה לראות את הכדור, וקל לעקור אותו תוך כדי הסרת הסופרנטנט. צנטריפוגה עם מכסה הצינור בכיוון זה תאפשר לדעת היכן יהיה כדור התא. - יש לתלות את כדור התא ב-200 μL של 0.6% נקודת התכה נמוכה של אגרוז (LMP agarose) ולערבב על ידי ניפוח למעלה ולמטה מבלי ליצור בועות. לאחר מכן, העבר במהירות 80 μL של תאים המכילים אגרוז LMP למגלשה צוננת והנח במהירות כיסוי על הג'ל.
- מניחים לג'ל להתייצב על צלחת הקירור למשך 1-2 דקות.
- בינתיים, הכינו תמיסת עבודה של 500 מ"ל של חיץ ליזה (טבלה 1) ושפכו אותה לתוך צלחת הליזיס (איור 2).
- לאחר הגדרת הג'לים, הסירו את הכיסויים במהירות על ידי החזקה עדינה של המגלשה בין האגודל לאצבע והחלקת הכיסוי מהג'ל.
- מקם את השקופיות המכילות דוגמאות בתוך נושא השקופיות (כל סימני ה"נקודה" השחורים בשקופיות צריכים להיות פונים באותו כיוון כאשר הם ממוקמים במנשא) (איור 3B), ולאחר מכן מקם את נושא השקופיות בתוך צלחת הליזיס (איור 2).
- סוגרים את המכסה של צלחת הליזיס ושומרים את צלחת הליזיס במקרר למשך הלילה בטמפרטורה של 4 מעלות צלזיוס או 30 דקות בטמפרטורת החדר, מה שהכי מתאים ללוח הזמנים של המפעיל19.
4. אלקטרופורזה
- הסר בזהירות את מנשא השקופיות מצלחת התזה. היזהר לא להפריע לג'לים.
- הניחו בעדינות את נושאת ההחלקה בכלי כביסה טעון מראש ב-ddH 2 O קר כקרח והשאירו אותו למשך 30 דקות כדי להבטיח שהמגלשות מכוסות לחלוטין ב-ddH2O.
- הכנס חבילת קירור קפואה לתוך מגירת ההזזה מתחת למיכל האלקטרופורזה כדי לשמור על טמפרטורת חיץ אופטימלית.
- הוסיפו בזהירות תמיסת עבודה של אלקטרופורזה קרה כקרח (טבלה 1) למיכל האלקטרופורזה והעבירו את נושא ההחלקה למיכל האלקטרופורזה. כוון את השקופיות כך שהחלקים הברורים שלהן עם הג'לים המכילים תאים (כלומר, לא קצוות חלביים/מסומנים) מצביעים לכיוון הקתודה (אלקטרודה אדומה).
- אפשרו למגלשות לשבת במיכל האלקטרופורזה למשך 20 דקות, כך שהדנ"א יירגע ויירגע. שמור על אספקת החשמל כבויה במהלך שלב זה.
- במידת הצורך, הכנס חבילת קירור קפואה חדשה כדי למקסם את הקירור.
- בצע אלקטרופורזה במשך 20 דקות ב-1.19 וולט לס"מ, או כל תנאי אחר שעבר.
הערה: אופטימיזציה של תנאי הריצה של אלקטרופורזה ונפח המאגר מומלצת לכל מעבדה24. שימוש במנשא שקופיות יחיד בלבד במהלך אלקטרופורזה אינו גורם להשפעה כלשהי של שקופיות על ההתנגדות של מאגר האלקטרופורזה, והמחברים לא ראו השפעה משמעותית במתח או בזרם כאשר מספר השקופיות השתנה. - כבה את אספקת החשמל, הסר בזהירות את נושאת השקופיות ממיכל האלקטרופורזה, ואפשר לה להתנקז על נייר טישו במשך 30 שניות.
- הנח את נושאת השקופיות בצלחת המכילה מאגר נטרול (טבלה 1). השאירו אותו למשך 20 דקות.
- הסר את מנשא השקופיות מצלחת הנטרול, הנח אותו בכלי הכביסה המכיל ddH2O קר כקרח, והשאר אותו למשך 20 דקות.
- הסר את נושאת המגלשות מהמים ואפשר למגלשות להתייבש באינקובטור בטמפרטורה של 37 מעלות צלזיוס למשך שעה, או בטמפרטורת החדר לילה, או לא להתייבש, בהתאם ללוח הזמנים של המפעיל19.
הערה: אם אין ייבוש בשלב 4.11, בצע את שלב הצביעה מ-5.2.
5. מכתים פרופידיום יודיד (PI)
- מעבירים את מנשא המגלשות לכלי כביסה המכיל ddH2O קר כקרח כדי לייבש את המגלשות ולהשאיר למשך 30 דקות.
- הכניסו את נושא ההחלקה לתוך צלחת מכתים המכילה תמיסת פרופידיום יודיד של 2.5 מיקרוגרם/מ"ל.
הערה: פרופידיום יודיד רגיש לאור, לכן טפל בו באזור חשוך. זה גם רעיל. - סוגרים את המכסה של צלחת הכתמים ודוגרים אותה למשך 20 דקות בחושך בטמפרטורת החדר.
- מעבירים את מנשא ההחלקה לצלחת נפרדת, ושוטפים אותו ב-ddH2O קר כקרח למשך 20 דקות.
- מוציאים את מנשא ההחלקה מהכלים ומייבשים אותו לחלוטין בחושך, באינקובטור של 37 מעלות צלזיוס או בטמפרטורת החדר, בהתאם ללוח הזמנים או להעדפה של המפעיל.
- לאחר ייבוש מלא של השקופיות, הסר אותן מנשא השקופיות ואחסן אותן בקופסת שקופיות בחושך עד שיהיו מוכנות לניתוח התמונה.
הערה: השקופיות יישארו קריאות ללא הגבלת זמן וניתן יהיה להכתים אותן מחדש במידת הצורך.
6. בדיקת שביט אלקליין שעברה שינוי על ידי אנזים
הערה: בדיקת השביט אלקליין שעברה שינוי באנזים משתמשת בשלב טיפול באנזים לאחר התזה אך לפני האלקטרופורזה. פעילות האנזים גורמת להפסקות בדנ"א באתרים שהם סובסטרטים לאנזים. לפני ביצוע בדיקה זו, יש למטב את ריכוז האנזים ואת משך הדגירה של האנזים.
- לאחר תזה של התאים (שלב 3), יש לשטוף פעמיים עם ddH2O קר כקרח למשך 20 דקות כל אחד.
- הסר את נושאת המגלשות מהמים והעבר את המגלשות למגש מרופד במגבות נייר.
- הוסיפו 80 μL של האנזים בריכוז הממוטב (לדוגמה, 3.2 U/mL של hOGG1 עבור תאי BE-M17, מדולל במאגר תגובת אנזים) וכסו בכיסוי כדי להפיץ את האנזים על הדגימה המכילה ג'ל.
- דגרו את השקופיות ב-37 מעלות צלזיוס למשך הזמן הממוטב (למשל, 45 דקות ל-hOGG1).
- לאחר הדגירה, הסר את הכיסויים בעדינות והעבר את השקופיות למנשא.
הערה: אין לשטוף את השקופיות לאחר טיפול באנזים; לבצע ישירות אלקטרופורזה משלב 4.3.
7. בדיקת שביט אלקליין בין גדילי דנ"א (ICL) ששונתה
הערה: הרעיון של גרסה זו של ICL-ACA הוא שנוכחות של כיל בדנ"א תעכב את ההגירה האלקטרופורטית של דנ"א פגום, המושרה בעקבות חשיפה לעלבון שנוצר באופן חמצוני. במקרה זה, ככל שזנב השביט קצר יותר, כך גדל מספרה-ICL 25,26,27,28.
- טפלו בתאים באמצעות מגיב הגורם ל-ICL (למשל, ציספלטין; ראו קובץ משלים).
- חשוף את התאים המטופלים עם אחד מהחומרים הבאים כדי לגרום להפסקות גדיל מספיקות כדי ליצור זנב שביט בגודל מתאים (~ 20% DNA זנב): מי חמצן (50 μM H 2 O 2 למשך 30 דקות), קרינה מייננת (2-5 Gy), או אולטרה סגול B (UVB) (0.5 J/cm2).
- בנוסף, לייצר שליטה חיובית על שבירת גדיל על ידי טיפול באצווה של תאים עם אותו סוכן ומינון, כפי שנעשה בשלב 7.2 (כלומר, אין טיפול עם סוכן משרה ICL).
- צנטריפוגה של התאים ב 7,607 x g במשך 5 דקות, להשליך את supernatant, לשטוף את כדור התא עם 1 מ"ל של PBS, ולעבד כמו עבור שביט אלקליין (שלבים 3-5).
- חשב רמות של קישור צולב בין גדילי DNA באמצעות הנוסחה שלהלן.
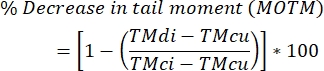
הערה: MOTM (Mean Olive Tail Moment) היא נקודת קצה של בדיקת שביט הנמצאת בשימוש נרחב כאשר מתארים את בדיקת השביט ששונתה על ידי ICL, והיא מוגדרת כמכפלה של אורך הזנב והחלק של סך הדנ"א בזנב (כלומר, מומנט זנב = אורך זנב x % מהדנ"א בזנב)29; TMdi: רגע זנב של דגימות שטופלו הן בסוכן crosslinking והן ב- H 2 O2 (או משרה אחרת של מפסק גדילים); TMcu: רגע זנב של דגימות שלא טופלו בסוכן crosslinking ולא טופלו ב- H 2 O 2 (ללא טיפול), ו- TMci: רגע זנב של דגימות שלא טופלו בסוכן crosslinking אך טופלו ב- H 2 O2.
8. ניקוד שביט וניתוח נתונים
הערה: המונח "שביט" נגזר מתמונות של תאים פגומים כאשר מסתכלים עליהם תחת מיקרוסקופ לאחר ביצוע הבדיקה (איור 5). בתנאי אלקטרופורזה, הדנ"א בתאים שלא ניזוקו לרוב אינו נודד, אלא נשאר בספרואיד המכונה "ראש" שביט. עם זאת, נוכחות של שברי גדיל מאפשרת לדנ"א של התא לנדוד אל מחוץ לראש, וליצור "זנב", ובכך להוביל למראה כמו כוכב שביט (איור 5). ככל שיש יותר דנ"א בזנב, כך יש יותר נזק.
- הפעל את המיקרוסקופ הפלואורסצנטי באמצעות מסנן PI (אדום) (λ = 536/617 ננומטר) ואת תוכנת הניקוד של בדיקת השביט.
- מוסיפים טיפת מים באמצעות פיפטה פסטר לג'ל ומכסים בכיסוי.
- מקם את השקופיות במיקרוסקופ הפלואורסצנטי ו"ניקוד" את השביטים.
הערה: ניקוד הוא אמצעי שבאמצעותו מעריכים את כוכבי השביט, כדי לקבוע את מידת הנזק הקיימת בכל כוכב שביט. באופן כללי, ניתן להשיג זאת על ידי שימוש בשתי גישות, על פי ההעדפה שנבחרה על ידי המשתמש, או על ידי עין (מדידת גודל השביטים בסולם של אפס עד ארבע) או על ידי שימוש חופשי, או זמין מסחרית תוכנה30. באופן כללי, שתי הגישות מעריכות את גודלו של זנב השביט, אם כי ניתן לקבוע מגוון נקודות קצה הקשורות לשביט. אם אתם משתמשים בתוכנה, לחצו על אמצע ראש השביט והמתינו עד שהתוכנה תזהה את השביט באופן אוטומטי, ואז תעריך את נקודת הקצה שנבחרה (איור 5). - ציון של 50 שביטים לכל ג'ל ו-100 שביטים לכל דגימה (כלומר, כל דגימה מתאימה לטיפולים שונים בפגיעה בדנ"א, או לשכפולים שלהם).
- שכפלו את הניסויים (n = 2) או שלשו את הניסויים (n = 3).
הערה: אם רק n=2 ניסויי שכפול מתבצעים, לא ניתן לבצע ניתוח סטטיסטי, אך אם n=3, בצע את מבחן הנורמליות של ד'אגוסטינו. רוב נתוני בדיקת השביט אינם עוברים מבחן נורמליות. במקרה זה, השתמש במבחן לא-פאראמטרי (מבחן קרוסקל-וואליס עם מבחן ההשוואות המרובות של דאן, ומבחן מאן-וויטני מובהקות שנקבע ב-p < 0.05).
תוצאות
אופטימיזציה של מתח האלקטרופורזה עבור HTP ACA
קרטינוציטים אנושיים (HaCaTs; טבלת חומרים) הוקרנו במינונים שונים של קרינה אולטרה סגולה A (UVA) (5 או 10 J/cm2; איור 6A), UVB (0.5 או 1 J/cm2; איור 6B), או טופל ב-50 μMH 2 O2 (איור 6C) כדי לגרום נזק. שלושה מתחים שונים של האלקטרופורזה נבדקו כדי לקבוע את המתח האופטימלי לאלקטרופורזה. התוצאות של כל שלושת הטיפולים המזיקים לדנ"א גילו כי בעוד שכל המתחים יצרו תגובות מינון ליניאריות, התגובה הרגישה ביותר התקבלה עם 1.19 וולט לס"מ. HaCaTs הראה את הנזק הגבוה ביותר לדנ"א בסיסי באמצעות 1.19 V/cm במהלך אלקטרופורזה, בהשוואה ל-1 V/cm ו-1.09 V/cm (איור 6A-C). בנוסף, באמצעות 1.19 V/cm, נראה ה-% הגדול ביותר של דנ"א זנב, לאחר כל הטיפולים המזיקים (איור 6)31.
זיהוי נזק לדנ"א בדם שלם אנושי באמצעות Fpg שונה HTP ACA
דם רחם אנושי (טבלת חומרים) הוקרן במינונים שונים של 10 J/cm2 UVA כדי לגרום נזק. ארבעה ריכוזים שונים של Fpg (1, 2, 4 או 8 U/mL) שימשו לקביעת הריכוז האופטימלי לטיפול באנזים ב-HTP ACA. התוצאות הראו שהרמות האופטימליות של נזק לדנ"א נחשפו עם 4 U/mL Fpg (איור 7A). תמונות שביט מייצגות מדגימות דם מוקרנות UVA (איור 7B).
איתור דנ"א כיל בקו תאים מייצג של סרטן השחלות באמצעות HTP ACA שעבר שינוי ב-ICL
קו תאים סרטניים בשחלות (SKOV-3; טבלת חומרים) טופל עם שילובים של 200 μM ציספלטין ו / או טיפול לאחר מכן עם 50 μM H 2O2 במשך 30 דקות על קרח. לא נצפה נזק ניכר בתאים שלא נחשפו (איור 8A). חשיפה ל-H2 O2 לבדה יצרה MOTM משמעותי (איור 8B). לעומת זאת, התאים שבהם הושרה כיל הראו ירידה ב-MOTM (איור 8C)28.
היווצרות ותיקון של דנ"א המושרה על ידי ציספלטין ICL בקו תאים מייצג של סרטן השחלות
ה-HTP ACA ששונה על-ידי ICL שימש לקביעת מהלך הזמן להיווצרות ותיקון DNA ICL המושרה על-ידי ציספלטין בקו תאים סרטניים בשחלות (A2780; טבלת חומרים). התאים טופלו ב-100 μM ציספלטין במשך שעה אחת, ולאחר מכן דוגרו במדיה נטולת ציספלטין (RPMI 1640 בינוני בתוספת 10% (v/v) סרום בקר עוברי (FBS)) למשך קורס זמן מאוחר יותר. בנקודות זמן שונות, ה-HTP ACA ששונה על-ידי כיל בוצע כדי לקבוע את הרמות של כיל (איור 9)28. לא אותרה כיל לפני הטיפול בציספלטין. עם זאת, לאחר טיפול יחיד עם ציספלטין 100 μM, רמות כיל עלו באופן משמעותי, והגיעו לשיא של 12 שעות, ולאחר מכן הרמות ירדו בחזרה לאפס לאחר 30 שעות.
מתאם בין דנ"א כיל לדנ"א פלטינה
שלושה תאים סרטניים בשחלות טופלו בציספלטין של 100 μM כדי לגרום לרמות שונות של DNA-ICL, לפני ניתוח על ידי HTP ACA שעבר שינוי של ICL וספקטרומטריית מסה מצומדת אינדוקטיבית (ICP-MS; ראה קובץ משלים לפרטים). כפי שניתן לראות באיור 10, רמות שונות של דנ"א-כיל הושרו בשלושת קווי התאים, יחד עם רמות שונות של Pt בדנ"א. נצפה מתאם חיובי (R2 = 0.9235) בין רמות ה- DNA ICL לריכוזי הפלטינה, מה שמצביע על הקשר בין רמות הפלטינה של ה- DNA לבין ה- ICL28 המתאים.
תיקון כריתת בסיס בתאי BE-M17 נגועים במיקופלזמה ולא נגועים
תאי BE-M17 נגועים ולא נגועים טופלו בתאי BE-M17 של 50 μM H 2 O 2 במשך 30 דקות והודגרו במדיום שלם (המדיום של Dulbecco Modified Eagle בתוספת 10% (v/v) FBS) לפרקי זמן שונים (0 דקות, 30 דקות, 1 שעות,2שעות, 6 שעות, 24 שעות או 30 שעות) שבמהלכם התאים הורשו לתקן. בכל נקודת זמן, התאים נאספו והוקפאו בטמפרטורה של -80 מעלות צלזיוס, בתווך המכיל 10% DMSO, לפני ביצוע HTP ACA ששונה ב-hOGG1 (שלב 6). לאחר 30 דקות, רמות ה-SB/ALS ירדו ל-21% TD (אחוז דנ"א זנב) בתאים הלא נגועים, בעוד שהתאים הנגועים הראו 49% TD (איור 11A). לאחר ~15 שעות, רמות ה-SB/ALS חזרו לנקודת ההתחלה הן בתאים נגועים והן בתאים לא נגועים. עבור הפורינים המחומצנים, ה-BE-M17 הלא נגוע הראה בתחילה עלייה קטנה בנזק, לפני שחזר לנקודת ההתחלה תוך 30 שעות (איור 11B). לעומת זאת, התאים הנגועים הראו עלייה מתמשכת ומשמעותית בפורינים מחומצנים, שנשארו גבוהים, ולא חזרו לרמות הבסיס גם לאחר 30 שעות (איור 11B)23.
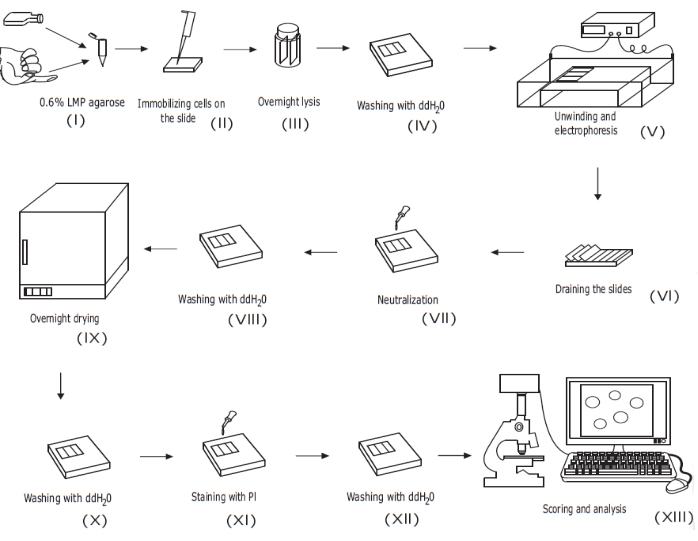
איור 1: סקירה כללית של הליך הבדיקה הקונבנציונלי של שביט אלקליין . (i) תרחיף חד-תאי של תאים בתרבית או דגימה של דם שלם מעורבב עם 0.6% (w/v) LMP agarose. (ii) תערובת התא/אגרוז מוחלת על מגלשות מיקרוסקופ מצופות מראש ומכוסה בכיסוי עד להתמצקות. (iii) התאים שוכבים באמצעות חיץ ליזיס בעל pH גבוה במשך הלילה, ויוצרים גופי נוקלואידים, לפני (iv) שטיפה עם ddH2O. (v) הדנ"א התאי משתחרר במאגר האלקטרופורזה בעל ה-pH הגבוה. הנוכחות של שברי גדילים מאפשרת לדנ"א להירגע ולהירגע, ותחת אלקטרופורזה, הדנ"א נשאב החוצה מגוף הנוקלואיד, ויוצר זנב. לאחר מכן מגלשות (vi) מנוקזות, מיובשות, (vii) מנוטרלות, ו- (viii) נשטפות עם ddH2O לפני (ix) מיובשות במהלך הלילה. לאחר מכן (x) מיובשות מחדש עם ddH2O, (xi) מוכתמות, (xii) שטופות, ולבסוף (xiii) מקבלות ניקוד ומנותחות, בדרך כלל באמצעות מיקרוסקופיה פלואורסצנטית ותוכנת ניתוח תמונה. נתון זה מועתק מפרסום קודם20. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: החומרים המרכיבים את מערכת האלקטרופורזה של השביט בעל התפוקה הגבוהה. מיכל אלקטרופורזה HTP, מתלי HTP, ואת הכלים עבור תזה, לשטוף, נטרול, והכתמה מוצגים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
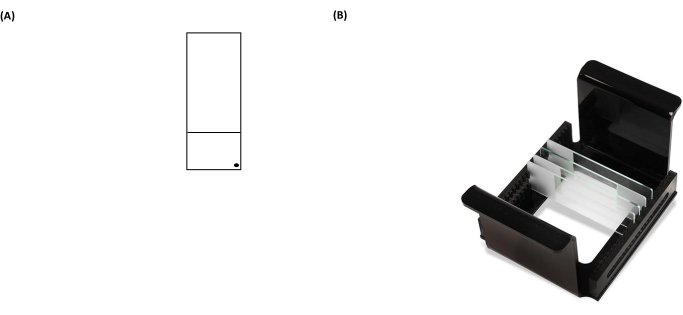
איור 3: תמונות מייצגות של שקופית בדיקת שביט וארון תקשורת HTP (נושאת שקופיות מיקרוסקופ). (A) לצורך כיוון נכון, הפנים המצופות מראש של שקופית המיקרוסקופ מזוהות על ידי נקודה שחורה בפינה הימנית של שקופית מיקרוסקופ. (B) התמונה של ארון התקשורת HTP מדגימה כיצד השקופיות נשמרות בכיוון אנכי הדוק, עם לשוניות על המוביל כדי לתקן את הכיוון שלו בתוך מיכל האלקטרופורזה. כל ספק יכול להכיל עד 25 מגלשות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: ייצוג של צלחת הקירור עם שקופיות לדוגמה וחבילות מקפיא במקום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: צילום מסך של כוכבי שביט מייצגים שצולמו במהלך הניקוד. HaCaTs (A) ללא טיפול ו-(B) טופלו ב-1 J/cm2 UVB לפני ביצוע HTP ACA. רוב חבילות התוכנה יכולות לחשב מגוון נקודות קצה של שביט, אך הנפוצות ביותר הן % דנ"א זנב (מועדף) או מומנט זנב בהתבסס על תמונות אלה (כחול: תחילת הראש, ירוק: אמצע הראש, וסגול: קצה הזנב). סרגל קנה המידה הוא 10 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
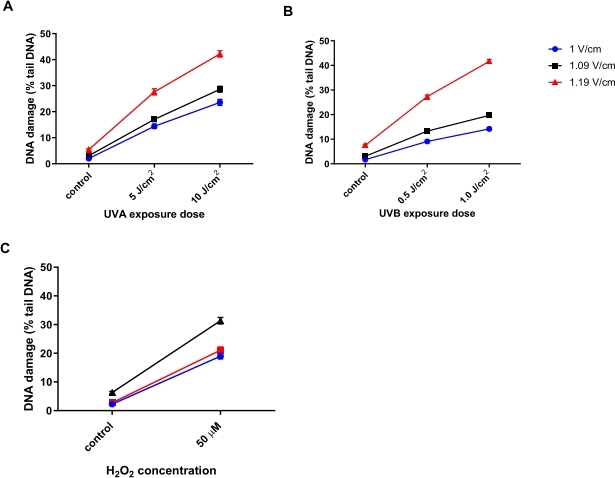
איור 6: גרפים מייצגים הממחישים את ההשפעה של מתח אלקטרופורזה על דנ"א זנב באחוזים, שנקבע באמצעות HTP ACA. התאים נחשפו ל-(A) 5 או 10 J/cm 2 UVA, (B) 0.5 או 1.0 J/cm 2 UVB, או (C) 50 μM H 2 O 2 לפני HTP ACA, כאשר מתח האלקטרופורזה היה 1, 1.09 או 1.19 V/cm. הנתונים מייצגים את הממוצע של 200 קביעות מתוך n = 2 ניסויים כפולים31. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
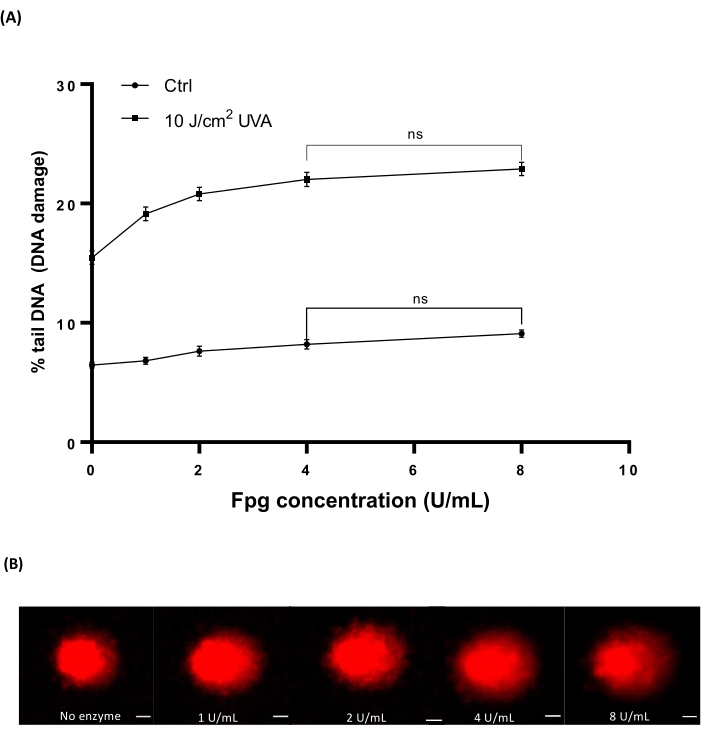
איור 7: גרף מייצג ותמונות שביט של דם אנושי שנותחו על-ידי ה-HTP ACA שעבר שינוי ב-Fpg. דגימות דם אנושיות הוקרנו ב-10 J/cm2 UVA או ב-sham מוקרן ('ctrl') על קרח לפני שלב התזה. ריכוזים שונים של Fpg (1, 2, 4 או 8 U/mL) שימשו לטיפול באנזים לפני האלקטרופורזה. (A) הנתונים מייצגים את הממוצע ± SEM של 300 קביעות מניסויי n=3. (B) תמונות מייצגות של כוכבי שביט עבור כל ריכוז של Fpg ב-10 J/cm2 דגימות דם מוקרנות UVA. סרגל קנה המידה הוא 10 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
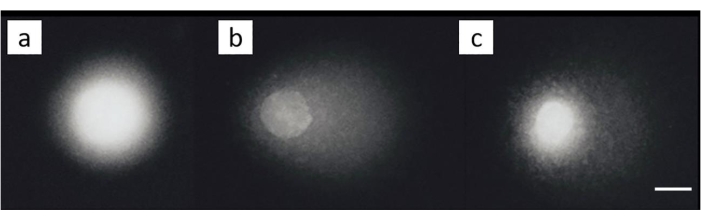
איור 8: תמונות שביט מייצגות הממחישות את גילוי כיל לאחר טיפול בציספלטין. (A) תאי בקרה ללא כל טיפול, (B) תאים שטופלו בתאי H 2 O 2 (50 μM) בלבד, (C) שטופלו בתאי H 2 O 2(50 μM) וציספלטין (200 μM), הממחישים את הזנב כקצר יותר מאשר ב-(B), בשל נוכחותה של כיל28. סרגל קנה המידה הוא 10 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
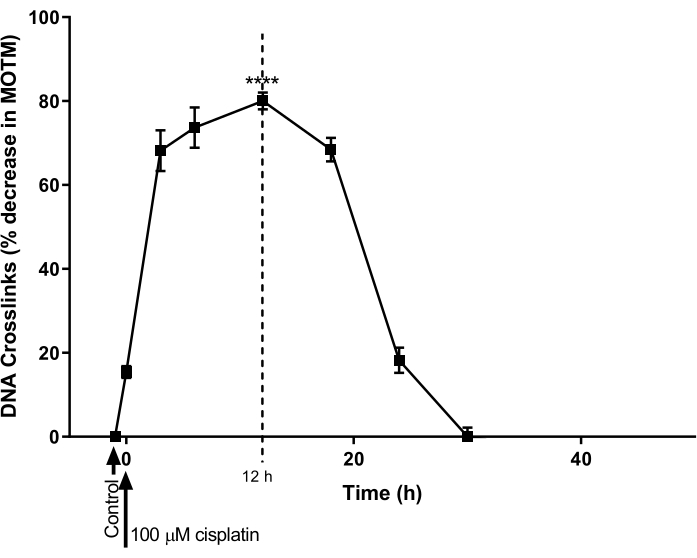
איור 9: הדגמה של הקינטיקה של היווצרות ותיקון ICL המושרה על-ידי ציספלטין. תאי A2780 טופלו ב-100 μM של ציספלטין בתרבית במשך שעה אחת. לאחר מכן הוסר התווך המכיל ציספלטין, והתאים עברו תרבית לנקודות זמן שונות, לפני ניתוח על ידי HTP ACA שעבר שינוי של ICL. הנתונים מייצגים ממוצע ± SEM מ n = 3 ניסויים28. P < 0.0001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 10: מתאם בין דנ"א כיל לריכוז פלטינה. דנ"א כיל נקבעו על ידי HTP ACA ששונה על ידי ICL ורמות הפלטינה נמדדו על ידי ICP-MS (עם אפליה של אנרגיה קינטית מרובעת יחידה, SQ-KED), בשלושה קווי תאים סרטניים בשחלות. R2 = 0.9235. ראה קובץ משלים עבור מתודולוגיית ICP-MS לכימות רמות פלטינה ב- DNA28. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
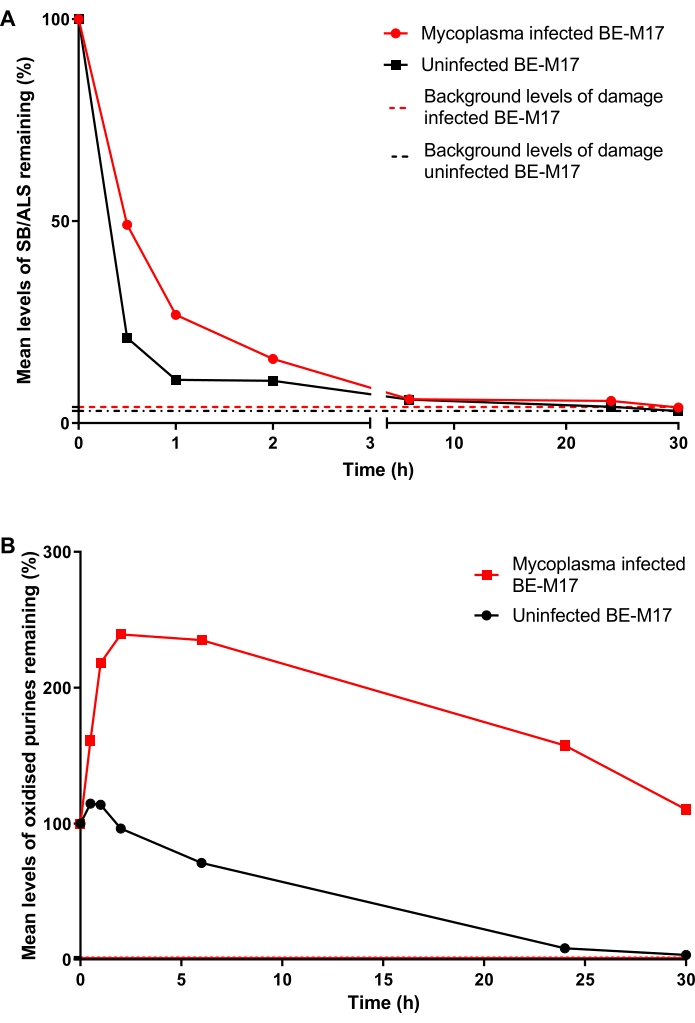
איור 11: גרף מייצג הממחיש נזק לדנ"א ותיקון, שנקבע על-ידי בדיקת השביט ששונה על-ידי hOGG1, בתאי מיקופלסמה נגועים לעומת תאי BE-M17 לא נגועים. לאחר טיפול עם 50 μM H 2O 2 במשך 30 דקות, תאים הורשו לתקן במשך משכי זמן שונים (0, 30 דקות, 1 שעות,2 שעות, 6 שעות, 24 שעות, או 30 שעות). ה-HTP ACA שעבר שינוי ב-hOGG1 שימש למדידת (A) SB/ALS ו-(B) פורינים מחומצנים בתאי BE-M17 נגועים (נקודות נתונים אדומות) ולא נגועים (נקודות נתונים שחורות). הנתונים מייצגים את הממוצע של 200 קביעות מ n = 2 ניסויים כפולים. נתון זה מועתק באישור מפרסום קודם23. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| מגיב | פתרון מלאי | פתרון עבודה | |
| חיץ ליסיס | 100 mM Na 2 EDTA, 2.5 M NaCl, ו 10 mM Tris בסיס ב ddH2O; כוונן את ה-pH ל-10 עם 10 M NaOH | 1% טריטון X-100 בפתרון מלאי ליזיס | |
| חיץ אלקטרופורזה | 10 M NaOH ו 200 mM Na 2 EDTAב ddH2O | 300 mM NaOH ו 1 mM Na2EDTA; pH > 13 | |
| מאגר נטרול | 0.4 M Tris בסיס ב ddH2O; כוונן את ה-pH ל-7.5 באמצעות HCl | ||
| חיץ צביעה | 1 מ"ג/מ"ל פרופידיום יודיד | 2.5 מיקרוגרם/מ"ל פרופידיום יודיד ב-ddH2O | |
טבלה 1: הרכב הריאגנטים המשמשים ב- HTP ACA. המלאי וריכוזי העבודה של תזה, אלקטרופורזה, נטרול ומאגרי צביעה מוצגים.
קובץ משלים. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
מחקר זה מדגים את הרבגוניות שמספק הציוד הנוכחי, אשר ניתן להשתמש בו כדי להשיג תפוקה גבוהה עם מגוון של גרסאות מייצגות ונפוצות של בדיקת השביט (כלומר, אלקליין, אנזים שונה, דם, ו- ICL, וגם גרסאות אחרות יהיו מתאימות). בנוסף, הגישה הנוכחית מביאה איתה מספר יתרונות 20,21: (א) זמן ריצת הבדיקה מצטמצם עקב מניפולציה של מספר שקופיות במקביל (זמן הטיפול מתקצר ב-60%); (ב) הסיכון לפגיעה בג'לים, ומכאן שהסיכון לניסוי פוחת; (ג) דרישות הריאגנטים מופחתות (למשל, נפח מיכל האלקטרופורזה קטן מהמיכל הרגיל); (ד) מספר השקופיות המופעלות גדל. טנק אחד יכול לספק עלייה של 20% במספר השקופיות בהשוואה למיכל קונבנציונלי יחיד; עם זאת, ניתן להפעיל או לעבד מיכלי אלקטרופורזה מרובים (כלומר, מיכלים מרובים הנשלטים על ידי ספק כוח יחיד), במקביל מאותו ספק כוח, ועדיין דורשים טביעת רגל קטנה יותר ממיכל קונבנציונלי יחיד עם מגש קרח; ו-(ה) טביעת הרגל של המיכל מצטמצמת עקב כיוון אנכי של שקופיות וקירור אינטגרלי (חוסך מקום במעבדה); מיכל ה-HTP כולל בסיס קירור קרמי בעל ביצועים גבוהים עם מגירת הזזה שיכולה להתאים לחבילת קירור קפואה אחת כדי לשמור על טמפרטורת חיץ אופטימלית מבלי לבצע את התהליך בחדר קר.
יתר על כן, לוח הקירור שפותח על ידינו מכיל 26 שקופיות שביט, מאפשר התמצקות מהירה של נקודת ההיתוך הנמוכה על שקופיות הבדיקה של השביט ומאפשר שליפה קלה של השקופיות לאחר מיצוק ג'ל האגרוז. החידושים הנ"ל הופכים את תהליך בדיקת השביט לפשוט וקל יותר.
בעוד שפותחו גישות אחרות בעלות תפוקה גבוהה (לדוגמה, בדיקת שביט 12-ג'ל, CometChip או 96 פורמטים של מיני-ג'ל)25, מדענים רבים מעדיפים להשתמש בשקופיות המיקרוסקופ הקונבנציונליות (הכוללות את השקופיות המצופות מראש הזמינות מסחרית, או שקופיות מיוחדות אחרות). הגישה הנוכחית יכולה להתאים לכל סוגי השקופיות במיקרוסקופ, ומאפשרת להגדיל את הניסויים המשתמשים בשקופיות אלה באמצעות עיבוד וטיפול מהירים יותר בשקופיות. כפי שצוין לעיל, מערכת שביט HTP מביאה יתרונות רבים, אבל יש מגבלה אחת בולטת: הגישה הנוכחית מספקת רק עלייה של 20% במספר הדגימות לרוץ, לעומת טנק אופקי קונבנציונאלי (אם כי עיבוד של שקופיות הוא הרבה יותר מהר). הפורמטים CometChip ו-96 מיני-ג'ל מריצים מספר רב יותר של דוגמאות. נכון להיום, איננו יודעים אם הגישה הנוכחית יכולה להתאים לפורמטים של CometChip או 96 מיני-ג'ל, אם כי אנו צופים שכן. כפי שצוין לעיל, מספר הדגימות ניתן להגדיל עוד יותר על ידי slaving טנקים לאספקת חשמל אחת. כמו בכל הגישות, עדיין יש סיכוי לאבד או לפגוע בג'לים תוך כדי טעינת דגימות וניתוחן תחת המיקרוסקופ, אך הדבר נובע יותר מטעות מפעיל, והסיכויים לכך מצטמצמים עם הגישה הנוכחית.
השימוש במערכת השביט HTP יכול לסייע רבות בניתוח נזק לדנ"א, להקל על השימוש בבדיקת השביט במגוון רחב של יישומים, כגון אפידמיולוגיה מולקולרית, מדעי הרבייה הגברית, מחקרי גנוטוקסיקולוגיה וטוקסיקולוגיה סביבתית. זה נכון במיוחד עבור אותם משתמשים המעוניינים לקבל את כל היתרונות של תפוקה משופרת, וקלות שימוש, מבלי להתרחק משקופיות המיקרוסקופ הקונבנציונליות המוכרות, החסכוניות.
Disclosures
ד"ר קוק וד"ר קרבשי הם ממציאים של שלושה פטנטים שהוענקו להם הנוגעים לטכנולוגיות המתוארות כאן.
Acknowledgements
העבודה שדווחה בפרסום זה נתמכה בחלקה על ידי המכון הלאומי למדעי בריאות הסביבה של המכונים הלאומיים לבריאות תחת מספר הפרס: 1R41ES030274. התוכן הוא באחריות המחברים בלבד ואינו מייצג בהכרח את ההשקפה הרשמית של המכונים הלאומיים לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| 22 x 22 mm glass coverslips | Fisher Scientific, Hampton, NH, USA | 631-0124 | |
| A2780 | ECACC, Louis, MO, USA | 93112519 | |
| Concentrated nitric acid (OptimaTM grade) | Fisher Scientific Fair Lawn, NJ, USA | A467-250 | |
| Fluorescence microscope equipped with a camera | Zeiss, Jena, Germany | ||
| Fresh human whole blood | Zen Bio Inc | SER-WB10ML | Commercial human whole blood sample |
| GraphPad Prism | GraphPad Software, San Diego, California | Data analysis software | |
| HTP Comet Assay system | Cleaver Scientific | COMPAC- 50 | |
| Human Keratinocyte (HaCaTs) | American Type Culture Collection (ATCC), Manassas, VA, USA | Discontinued | Can be purchased from another company ADDEXBIO TECHNOLOGIES Cat# T0020001 |
| Hydrogen peroxide (H2O2) 30% in water | Fisher Scientific, Hampton, NH, USA | BP2633-500 | |
| ICP-MS iCAP RQ ICP-MS system | Thermo Scientific, Waltham, MA, USA | IQLAAGGAAQFAQKMBIT | |
| Image and Data Analysis software | Perceptive Instrument, Bury St Edmunds, England, UK | 125525 | Free image analysis softwared is available e.g., ImageJ |
| Internal Standard Mix | SPEX Certiprep, Metuchen, NJ, USA | CL-ISM1-500 | Bismuch (isotope monitored 209 Bi)-concnetration of 10 µg/mL in 5% HNO3 |
| Low melting point Agarose | Invitrogen Waltham, MA, USA | P4864 | |
| Na2EDTA (disodium ethylenediaminetetraacetic acid) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| NaCl (Sodium chloride) | Sigma Aldrich, St. Louis, MO, USA | S7653 | |
| NanoDrop One | Thermo Scientific, Waltham, MA, USA | 701-058108 | Nanodrop for measuring DNA concentration |
| Nanopure Infinity Ultrapure Water System (Barnstead Nanopure) | Thermo Scientific, Waltham, MA, USA | D11901 | Ultrapure water (16 MΩ cm-1) |
| NaOH (sodium Hydroxide) | Sigma Aldrich, St. Louis, MO, USA | E5134 | |
| Normal melting point Agarose | Fisher Scientific, Hampton, NH, USA | 16520100 | For pre-coating slides |
| OCI-P5X | University of Miami, Miami, FL, USA | N/A | Live Tumor Culture Core facility provided the cells |
| Platinum (Pt) reference standard | SPEX Certiprep, Metuchen, NJ, USA | PLPT3-2Y | (1000 µg/mL in 10% HCl) containing Bismuch |
| Propidium Iodide (1.0 mg/mL in water) | Sigma Aldrich, St. Louis, MO, USA | 12-541BP486410ML | |
| QIAamp DNA Mini Kit | Qiagen Valencia, CA, USA | 51304 | DNA extraction Kit |
| Single-frosted glass microscope slides | Fisher Scientific, Hampton, NH, USA | 12-541B | |
| SKOV3 | ECACC, Louis, MO, USA | 91091004 | |
| Slide box | Fisher Scientific, Hampton, NH, USA | 03-448-2 | Light proof, to protect cells from the formation adventitious damage (according to the widely held view) and prevent fading of the fluorescent dye |
| Slide Chilling plate | Cleaver Scientific, Rugby, England, UK | CSL-CHILLPLATE | |
| Treatment dish | Cleaver Scientific, Rugby, England, UK | STAINDISH4X | |
| Tris-base | Sigma Aldrich, St. Louis, MO, USA | 93362 | |
| Triton X-100 | Fisher Scientific, Hampton, NH, USA | BP151-500 | |
| Trypsin EDTA (0.5%) | Invitrogen Gibco, Waltham, MA, USA | 15400054 | |
| Vertical Slide Carrier | Cleaver Scientific, Rugby, England, UK | COMPAC-25 |
References
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46 (5), 1213-1224 (2018).
- Evans, M. D., Cooke, M. S. Factors contributing to the outcome of oxidative damage to nucleic acids. Bioessays. 26 (5), 533-542 (2004).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutatation Research. 567 (1), 1-61 (2004).
- Miyamae, Y., et al. Detection of DNA lesions induced by chemical mutagens using the single-cell gel electrophoresis (comet) assay. 2. Relationship between DNA migration and alkaline condition. Mutatation Research. 393 (1-2), 107-113 (1997).
- Angelis, K. J., Dusinská, M., Collins, A. R. Single cell gel electrophoresis: detection of DNA damage at different levels of sensitivity. Electrophoresis. 20 (10), 2133-2138 (1999).
- Duarte, T. L., Cooke, M. S., Jones, G. D. Gene expression profiling reveals new protective roles for vitamin C in human skin cells. Free Radical Biology & Medicine. 46 (1), 78-87 (2009).
- Karbaschi, M., et al. Rescue of cells from apoptosis increases DNA repair in UVB exposed cells: implications for the DNA damage response. Toxicology Research. 4 (3), 725-738 (2015).
- Wu, J. H., Jones, N. J. Assessment of DNA interstrand crosslinks using the modified alkaline comet assay. Methods in Molecular Biology. 817, 165-181 (2012).
- Merk, O., Speit, G. Detection of crosslinks with the comet assay in relationship to genotoxicity and cytotoxicity. Environmental and Molecular Mutagenesis. 33 (2), 167-172 (1999).
- Spanswick, V. J., Hartley, J. M., Hartley, J. A. Measurement of DNA interstrand crosslinking in individual cells using the Single Cell Gel Electrophoresis (Comet) assay. Methods in Molecular Biology. 613, 267-282 (2010).
- Saha, D. T., et al. Quantification of DNA repair capacity in whole blood of patients with head and neck cancer and healthy donors by comet assay. Mutation Research. 650 (1), 55-62 (2008).
- Giovannelli, L., Pitozzi, V., Riolo, S., Dolara, P. Measurement of DNA breaks and oxidative damage in polymorphonuclear and mononuclear white blood cells: a novel approach using the comet assay. Mutatation Research. 538 (1-2), 71-80 (2003).
- Al-Salmani, K., et al. Simplified method for the collection, storage, and comet assay analysis of DNA damage in whole blood. Free Radical Biology & Medicine. 51 (3), 719-725 (2011).
- Akor-Dewu, M. B., et al. Leucocytes isolated from simply frozen whole blood can be used in human biomonitoring for DNA damage measurement with the comet assay. Cell Biochemistry and Function. 32 (3), 299-302 (2014).
- Ge, J., et al. CometChip: a high-throughput 96-well platform for measuring DNA damage in microarrayed human cells. Journal of Visualized Experiments: JoVE. (92), e50607 (2014).
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochemical and Biophysical Reseach Communications. 123 (1), 291-298 (1984).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Experimental Cell Research. 175 (1), 184-191 (1988).
- Karbaschi, M., et al. Evaluation of the major steps in the conventional protocol for the alkaline comet assay. International Journal of Molecular Sciences. 20 (23), 6072 (2019).
- Karbaschi, M., Cooke, M. S. Novel method for the high-throughput processing of slides for the comet assay. Scientific Reports. 4 (1), 7200 (2014).
- Karbaschi, M., Cooke, M. S. Chilling apparatus. USA patent. , (2020).
- Cooke, M. S., Karbaschi, M. Method and apparatus for performing electrophoresis. USA patent. , (2019).
- Ji, Y., Karbaschi, M., Cooke, M. S. Mycoplasma infection of cultured cells induces oxidative stress and attenuates cellular base excision repair activity. Mutatation Research. 845, 403054 (2019).
- Møller, P., et al. Minimum Information for Reporting on the Comet Assay (MIRCA): recommendations for describing comet assay procedures and results. Nature Protocols. 15 (12), 3817-3826 (2020).
- Almeida, G. M., Duarte, T. L., Steward, W. P., Jones, G. D. Detection of oxaliplatin-induced DNA crosslinks in vitro and in cancer patients using the alkaline comet assay. DNA Repair (Amst). 5 (2), 219-225 (2006).
- Moneef, M. A., et al. Measurements using the alkaline comet assay predict bladder cancer cell radiosensitivity. British Journal of Cancer. 89 (12), 2271-2276 (2003).
- Bowman, K. J., et al. Comet assay measures of DNA damage are predictive of bladder cancer cell treatment sensitivity in vitro and outcome in vivo. International Journal of Cancer. 134 (5), 1102-1111 (2014).
- Abdulwahed, A. M. S. . Investigation of DNA Damage and Genomic Organization in the Cellular Response to Platinum Chemotherapy. , (2020).
- Olive, P. L., Banáth, J. P., Durand, R. E. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the "comet" assay. Radiation Research. 122 (1), 86-94 (1990).
- Kumaravel, T. S., Vilhar, B., Faux, S. P., Jha, A. N. Comet Assay measurements: a perspective. Cell Biology and Toxicology. 25 (1), 53-64 (2009).
- Ji, Y. . Formation and Repair of Environmetally-induced damage to Mitochondrial and Nuclear Genomess. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved