A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعداد وتوصيف الحبر الحيوي الهجين الحيوي 3D القائم على الجرافين للهندسة العصبية الطرفية
In This Article
Summary
في هذه المخطوطة ، نوضح تحضير حبر حيوي هيدروجيل حيوي يحتوي على الجرافين للاستخدام في هندسة الأنسجة المحيطية. باستخدام هذه المادة biohybrid 3D ، يتم تنفيذ بروتوكول التمايز العصبي للخلايا الجذعية. يمكن أن تكون هذه خطوة مهمة في جلب مواد حيوية مماثلة إلى العيادة.
Abstract
يمكن أن تحدث اعتلالات الأعصاب الطرفية نتيجة لتلف المحور العصبي ، وأحيانا بسبب أمراض إزالة الميالين. تلف الأعصاب الطرفية هو مشكلة عالمية تحدث في 1.5٪ -5٪ من مرضى الطوارئ وقد تؤدي إلى فقدان كبير للوظائف. اليوم ، أصبحت الأساليب القائمة على هندسة الأنسجة ، والتي تتكون من السقالات وخطوط الخلايا المناسبة والإشارات الحيوية ، أكثر قابلية للتطبيق مع تطوير تقنيات الطباعة الحيوية ثلاثية الأبعاد (3D). كثيرا ما تتم دراسة مزيج من المواد الحيوية الهيدروجيل المختلفة مع الخلايا الجذعية أو الإكسوسومات أو جزيئات الإشارات الحيوية للتغلب على المشاكل الحالية في تجديد الأعصاب الطرفية. وبناء على ذلك ، اكتسب إنتاج الأنظمة القابلة للحقن ، مثل الهلاميات المائية ، أو هياكل القنوات القابلة للزرع التي شكلتها طرق الطباعة الحيوية المختلفة أهمية في الهندسة العصبية الطرفية. في ظل الظروف العادية ، الخلايا الجذعية هي الخلايا المتجددة للجسم ، ولا يتناقص عددها ووظائفها بمرور الوقت لحماية سكانها. هذه ليست خلايا متخصصة ولكن يمكن أن تتمايز عند التحفيز المناسب استجابة للإصابة. يقع نظام الخلايا الجذعية تحت تأثير بيئته المكروية ، والتي تسمى مكانة الخلايا الجذعية. في إصابات الأعصاب الطرفية ، وخاصة في المزيج العصبي ، لا يمكن إنقاذ هذه البيئة الدقيقة بالكامل حتى بعد ربط النهايات العصبية المقطوعة جراحيا معا. تزيد المواد الحيوية المركبة ونهج العلاجات الخلوية المدمجة من وظائف المواد وقابليتها للتطبيق من حيث الخصائص المختلفة مثل التحلل البيولوجي والتوافق الحيوي وقابلية المعالجة. وفقا لذلك ، تهدف هذه الدراسة إلى إظهار إعداد واستخدام نمط هيدروجيل حيوي هجين قائم على الجرافين وفحص كفاءة تمايز الخلايا الجذعية إلى خلايا عصبية ، والتي يمكن أن تكون حلا فعالا في تجديد الأعصاب.
Introduction
ينقسم الجهاز العصبي ، وهو الآلية التي تربط البنية الداخلية للكائن الحي والبيئة ، إلى قسمين: الجهاز العصبي المركزي والمحيطي. تلف الأعصاب الطرفية هو مشكلة عالمية تشكل 1.5٪ -5٪ من المرضى الذين يحضرون إلى قسم الطوارئ ويتطورون بسبب الصدمات المختلفة ، مما يؤدي إلى فقدان كبير للوظيفة1،2،3.
اليوم ، الأساليب الخلوية للهندسة العصبية الطرفية ذات أهمية كبيرة. تأتي الخلايا الجذعية أولا بين الخلايا المستخدمة في هذه الأساليب. في ظل الظروف العادية ، الخلايا الجذعية هي الخلايا المتجددة للجسم ، ولا يتناقص عددها ووظائفها بمرور الوقت لحماية سكانها. هذه الخلايا متخصصة ولكن يمكن أن تتمايز عند التحفيز المناسب استجابة للإصابة 4,5. وفقا لفرضية الخلايا الجذعية ، فإن نظام الخلايا الجذعية يقع تحت تأثير بيئته المكروية ، والتي تسمى مكانة الخلايا الجذعية. إن الحفاظ على الخلايا الجذعية وتمييزها أمر مستحيل دون وجود بيئتها المكروية6 ، والتي يمكن إعادة تشكيلها عن طريق هندسة الأنسجة باستخدام الخلايا والسقالات7. هندسة الأنسجة هي مجال متعدد التخصصات يشمل مبادئ الهندسة والبيولوجيا. توفر هندسة الأنسجة أدوات لإنشاء الأنسجة الاصطناعية التي يمكن أن تحل محل الأنسجة الحية ويمكن استخدامها في تجديد هذه الأنسجة عن طريق إزالة الأنسجة التالفة وتوفير الأنسجة الوظيفية8. يتم إنتاج سقالات الأنسجة ، وهي واحدة من الركائز الأساسية الثلاثة لهندسة الأنسجة ، باستخدام طرق مختلفة من المواد الطبيعية والاصطناعية9. الطباعة ثلاثية الأبعاد (3D) هي تقنية تصنيع مضافة ناشئة تستخدم على نطاق واسع لاستبدال أو استعادة الأنسجة المعيبة من خلال إنتاجها البسيط ولكن متعدد الاستخدامات للأشكال المعقدة باستخدام طرق مختلفة. الطباعة الحيوية هي طريقة تصنيع مضافة تتيح التعايش بين الخلايا والمواد الحيوية ، تسمى bioinks10. بالنظر إلى تفاعل الخلايا العصبية مع بعضها البعض ، تحولت الدراسات إلى المواد الحيوية الموصلة المرشحة مثل الجرافين. تعتبر ألواح الجرافين النانوية ، التي لها خصائص مثل الإلكترونيات المرنة ، والمكثفات الفائقة ، والبطاريات ، والبصريات ، وأجهزة الاستشعار الكهروكيميائية ، وتخزين الطاقة ، مادة حيوية مفضلة في مجال هندسة الأنسجة11. تم استخدام الجرافين في الدراسات التي تم فيها إجراء تكاثر وتجديد الأنسجة والأعضاء التالفة12,13.
تتكون هندسة الأنسجة من ثلاث لبنات أساسية: السقالة والخلايا وجزيئات الإشارات الحيوية. هناك أوجه قصور في الدراسات حول تلف الأعصاب الطرفية من حيث توفير هذه الهياكل الثلاثة بالكامل. تمت مواجهة مشاكل مختلفة في المواد الحيوية المنتجة والمستخدمة في الدراسات ، مثل احتوائها على الخلايا الجذعية أو جزيئات الإشارات الحيوية فقط ، وعدم وجود جزيء نشط بيولوجيا يمكن من تمايز الخلايا الجذعية ، وعدم التوافق الحيوي للمادة الحيوية المستخدمة ، والتأثير المنخفض على تكاثر الخلايا في مكانة الأنسجة ، وبالتالي ، لا يتم تحقيق التوصيل العصبي بالكامل2،13،14،15،16. وهذا يتطلب تحسين تجديد الأعصاب ، والحد من ضمور العضلات17،18 ، وخلق صاروخ موجهضروري 19 مع عوامل النمو ضد مثل هذه المشاكل. في هذه المرحلة ، يعد توصيف وتحليل النشاط العصبي لنموذج أولي للمادة الحيوية الجراحية ، ليتم نقله إلى العيادة ، أمرا مهما للغاية.
وفقا لذلك ، تبحث دراسة الطرق هذه في نمط هيدروجيل الحبر الحيوي باستخدام ألواح الجرافين النانوية التي شكلتها طابعة حيوية 3D وفعاليتها على التمايز العصبي للخلايا الجذعية التي تحتوي عليها. أيضا ، يتم التحقيق في آثار الجرافين على تشكيل الغلاف العصبي والتمايز.
Protocol
1. زراعة الخلايا الجذعية الوسيطة الهلامية في وارتون
- أخرج الخلايا الجذعية الهلامية الوسيطة من وارتون (WJ-MSCs ، من ATCC) من الفريزر -80 درجة مئوية. استزراع WJ-MSCs في وسط DMEM-F12 يحتوي على 10٪ مصل عجل الجنين (FBS) ، و 1٪ Pen-Strep ، و 1٪ L-glutamine في تدفق رقائقي معقم في درجة حرارة الغرفة ، كما هو موضح في Yurie et al.20.
- حفظ بعض الخلايا بالتبريد عند 1 × 106 خلايا / مل مع وسط تجميد يحتوي على 35٪ FBS و 55٪ DMEMF-12 و 10٪ ثنائي ميثيل سلفوكسيد (DMSO). لهذا ، عد 1 × 106 خلايا على شريحة عد خلايا Thoma وأضف محلول التجميد بالتنقيط. انقل الشريحة بسرعة إلى حاوية النيتروجين السائل.
- عندما تكون الخلايا المستزرعة متقاربة بنسبة 80٪ في القارورة ، اسكب الوسط واغسله ب 5 مل من برنامج تلفزيوني. أضف 5 مل من 0.25٪ تربسين و 2.21 مللي مول EDTA-4Na. احتضان في حاضنة على حرارة 37 درجة مئوية لمدة 5 دقائق.
- أضف 10 مل من وسط DMEM-F12 مع 10٪ FBS إلى الخلايا التي تمت إزالتها من الحاضنة. قم بتعليقه جيدا ، وجمع الوسط ، ونقل الوسيط إلى أنبوب طرد مركزي.
- أجهزة الطرد المركزي بسرعة دوران 101 × جم لمدة 5 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية وأعد زرع الخلايا في قوارير جديدة بوسط مغذي طازج يحتوي على 10٪ FBS.
ملاحظة: يمكن استخدام WJ-MSCs التجارية الموسومة بجين GFP بطريقة النقل لتصور تفاعلات الخلايا الحيوية التي سيتم إنتاجهابشكل أفضل 21. يمكن إنشاء المجموعات التي سيتم استخدامها في هذه الطريقة كما هو موضح في الجدول 1.
| المجموعات التي تم إنشاؤها | أسباب الإنشاء | عدد الممثلين | ||
| 2D WJ-MSCs (2D-C) | التحكم 2D | × 5 | ||
| 2D WJ-MSCs والجرافين (2D-G) | تحديد جرعة الجرافين السامة في 2D | × 5 ممثلين لكل من التركيزات المختلفة | ||
| يتم تضمين WJ-MSCs في الأحبار الحيوية (3D-B) | التحكم 3D | × 3 | ||
| يتم تضمين WJ-MSCs و 0.1٪ الجرافين في الأحبار الحيوية (3D-G) | 3D الجرافين Bioink Biohybrid المجموعة | × 3 | ||
| WJ-MSCs في شكل كروي على الأحبار الحيوية (3D-BS) | 3D السيطرة على شكل كروي | × 3 | ||
| WJ-MSCs و 0.1٪ الجرافين شكل كروي على الأحبار الحيوية (مجموعة 3D-GS) | 3D الجرافين Bioink مجموعة Biohybrid من شكل كروي | x3 | ||
| قطرة الحبر الحيوي 3D | يتم إنتاجه لتحليل توصيف SEM و FTIR. | x5 | ||
| 3D قطرة الجرافين | يتم إنتاجه لتحليل توصيف SEM و FTIR. | x5 | ||
| 3D Bioink مع GFP المسمى WJ-MSCs و 0.1٪ | مراقبة تحركات WJ-MsCs في الحبر الحيوي الذي يحتوي على الجرعة المناسبة من الجرافين. | x3 | ||
الجدول 1. المجموعات في الطريقة. يتم تضمين جميع مجموعات 2D و 3D في الطريقة.
2. سمية الجرافين والتصوير ثنائي الأبعاد
- تحضير تركيزات الجرافين وتطبيقها على الخلايا
ملاحظة: تم شراء جسيمات الجرافين النانوية الخام تجاريا (نوع ألواح الجرافين النانوية الصناعية) وتم التبرع بها أيضا. كانت أبعاد الجسيمات 5-8 نانومتر في السمك ، 5 ميكرومتر في القطر ، و 120-150 م2 / غرام في مساحة السطح.- قم بوزن الجرافين لإنشاء محلول 1٪ (مجم / مل). اصنع محلول مخزون عن طريق إضافة 10 مل من وسط DMEMF-12 مع 10٪ FBS إلى 100 ميكروغرام من جسيمات الجرافين النانوية وتسمية هذا المحلول على أنه محلول مخزون. تعقيم في الأوتوكلاف عند 121 درجة مئوية تحت ضغط 1.5 ضغط جوي لمدة 20 دقيقة.
ملاحظة: يتم تخزين خليط الجرافين المعقم في الثلاجة على حرارة 4 درجات مئوية حتى الاستخدام. قد لا تكون مناسبة للاستخدام على المدى الطويل (بحد أقصى 1 شهر). في هذه الحالات ، يجب إعادة تشكيل الخليط وتعقيمه. - تحضير خليط من الجرافين المتوسط بتركيزات مختلفة لتحديد الجرعات غير السامة. اضبط التخفيفات الأولية على أنها 1٪ و 0.1٪ و 0.01٪ و 0.001٪ جرافين / وسائط.
- بدءا من محلول المخزون 1٪ ، خذ 1 مل على التوالي من كل تركيز وانقله إلى أنبوب جديد. أضف 9 مل من وسط DMEMF-12 مع 10٪ FBS إلى كل أنبوب ، مما يجعل خمس عينات مخففة تدريجيا ، ويهز ودوامة الحلول للحصول على توزيع متساو. استخدم 10 مل فقط من وسط DMEMF-12 مع 10٪ FBS كعنصر تحكم.
ملاحظة: تترسب رقائق الجرافين الثقيلة ، وبالتالي تحتاج إلى إعادة توزيعها. - قم بزرع WJ-MSCs في ألواح ذات 6 آبار مع 2 مل من الوسط الطازج الذي يحتوي على 10٪ FBS عند 5 × 105 خلايا لكل بئر. احتضان لمدة 1 يوم في 37 درجة مئوية. ثم قسم الألواح إلى مجموعات من الآبار المتساوية والمتكررة. هل خمسة التكرار لكل تركيز.
- تخلص من الوسط ثم استبدل الوسط بتركيزات متوسطة من الجرافين عند 2 مل لكل بئر. استخدم الوسيط فقط للمجموعة الضابطة. احتضان الألواح عند 37 درجة مئوية لمدة 24 ساعة.
- قم بوزن الجرافين لإنشاء محلول 1٪ (مجم / مل). اصنع محلول مخزون عن طريق إضافة 10 مل من وسط DMEMF-12 مع 10٪ FBS إلى 100 ميكروغرام من جسيمات الجرافين النانوية وتسمية هذا المحلول على أنه محلول مخزون. تعقيم في الأوتوكلاف عند 121 درجة مئوية تحت ضغط 1.5 ضغط جوي لمدة 20 دقيقة.
- تحديد تركيزات غير سامة من الجرافين مع MTT
- تخلص من الوسائط التي تحتوي على الجرافين بعد 24 ساعة. اغسل كل بئر باستخدام برنامج تلفزيوني. أضف وسط DMEMF-12 طازجا مع 10٪ FBS بمعدل 2 مل لكل بئر.
ملاحظة: من المهم أن تغسل مع برنامج تلفزيوني بعد تطبيق تركيزات الجرافين على الخلية لأن جسيمات الجرافين النانوية ، التي لا تؤخذ إلى الخلية عن طريق التداخل الخلوي ، تتم إزالتها من البيئة. هذا يجعل اختبار MTT أكثر كفاءة. - استخدم بروتوكول MTT (3- (4،5-ثنائي ميثيل ثيازول-2-يل) -2،5-ثنائي فينيل - بروميد تيترازوليوم) لتحديد قيمة IC50 التي تشير إلى صلاحية الخلية بنسبة 50٪ ، كما هو موضح في Kose et al.22 وفي الخطوات 2.2.3.-2.2.6.
- أولا ، قم بوزن 5 مجم / مل من ملح MTT وتذوب في برنامج تلفزيوني. تعقيم باستخدام مرشح 0.45 ميكرومتر. لف محلول MTT ، المصنوع في أنبوب طرد مركزي سعة 15 مل ، بورق الألمنيوم واحفظه عند 4 درجات مئوية.
- أضف 10 ميكرولتر من MTT إلى جميع الآبار واحتضان اللوحة لمدة 4 ساعات عند 37 درجة مئوية. مراقبة تشكيل بلورات الفورمازان عند تكبير 10x تحت المجهر بعد الحضانة.
- لإذابة البلورات المتكونة في الخلايا ، أضف 100 ميكرولتر من DMSO إلى كل بئر واخلطها عن طريق الماصة. احتفظ بالطبق في الظلام في درجة حرارة الغرفة لمدة 30 دقيقة. أدخل اللوحة في قارئ لوحات ELISA. اضبط طولا موجيا قدره 570 نانومتر من البرنامج لقياس الامتصاص واجعله يقرأ اللوحة22.
ملاحظة: بالإضافة إلى ذلك ، بينما تتم قراءة جزيئات الجرافين وحدها عند 270 نانومتر23 ، فإن نطاق القراءة البالغ 570 نانومتر24 هنا سيكون لقراءة صلاحية الخلية فقط. - إجراء تحليل إحصائي على النتائج التي تم الحصول عليها باستخدام ANOVA أحادي الاتجاه مع اختبار Tukey في برنامج التحليل الإحصائي.
- تخلص من الوسائط التي تحتوي على الجرافين بعد 24 ساعة. اغسل كل بئر باستخدام برنامج تلفزيوني. أضف وسط DMEMF-12 طازجا مع 10٪ FBS بمعدل 2 مل لكل بئر.
- التصوير بالغرز
- لفحص تفاعل تركيزات الجرافين المختلفة مع الخلايا ، قم بإجراء فاصل زمني للخلايا باستخدام طريقة تسمى التصوير بالغرز. تنشئ هذه الطريقة صورة بفاصل زمني باستخدام عينات الصور المأخوذة على فترات منتظمة تحت المجهر.
- للقيام بذلك ، قم بتشغيل الكمبيوتر أولا. قم بتشغيل حاضنة التصوير بفاصل زمني واضبطها على 37 درجة مئوية. ضع لوحة MTT في فتحة حاضنة الفاصل الزمني.
- افتح برنامج Stitch على الكمبيوتر. حدد الآبار المراد قراءتها في النظام. أحضر القارئ إلى البئر الأول وحدد موقع المنطقة وركزها بتكبير 10x في الضوء الأبيض. بدء تشغيل البرنامج.
ملاحظة: إنه برنامج لإنشاء صور مجمعة متعددة عالية الجودة 4 صفوف × 5 أعمدة. يجمع البرنامج بين الصور التي تم التقاطها واحدة تلو الأخرى بجودة HD. عند الضغط على زر بدء النظام ، تتم قراءة الآبار تلقائيا ، ويأخذ ويخيط 4 صفوف × 5 أعمدة صور متعددة.
3. الجرافين - إنتاج هيدروجيل Bioink الحيوي وتمايز WJ-MSCs
- إنتاج الأحبار الحيوية
ملاحظة: تستخدم مساحيق الجينات الجيلاتين (3: 5) المجففة تجاريا كأساس للأحبار الحيوية. يتم تحضير مجموعة الحبر الحيوي للجرافين (3D-G ؛ 3D-GS) ومجموعة الحبر الحيوي الخالي من الجرافين (3D-B ؛ 3D-BS) بنفس الطريقة (الجدول 1).- استخدم أنابيب مخروطية سعة 50 مل للتحضير. أولا ، تزن 4.5 ملغ من الجينات و 1.5 ملغ من الجيلاتين ونقلها إلى أنبوب الطرد المركزي. أضف وسط DMEMF-12 الذي يحتوي على 10٪ FBS إلى الخليط إلى حجم إجمالي 50 مل. هذه هي مجموعة التحكم (C) بدون جرافين.
- كرر وزن 4.5 ملغ من الجينات و 1.5 ملغ من الجيلاتين ونقل إلى أنبوب الطرد المركزي. ثم ، خذ 50 ميكرولتر من الجرافين المحضر بنسبة 0.1٪ من الخطوة 2.1.3. وإضافته إلى الأنبوب. أضف DMEMF-12 مع 10٪ FBS إلى حجم إجمالي قدره 50 مل.
- امزج الأحبار الحيوية أولا عن طريق السحب ثم الدوامة. تعقيم في الأوتوكلاف عند 121 درجة مئوية تحت ضغط 1.5 ضغط جوي لمدة 20 دقيقة. بدلا من ذلك ، قم بإجراء التعقيم عن طريق الميكروويف حتى نقطة الغليان.
- بعد تعقيم الخلائط ، قم باستخدام أجهزة الطرد المركزي عند 280 × جم لمدة 2 دقيقة في درجة حرارة الغرفة لإزالة الفقاعات المشكلة. احتفظ بالأحبار الحيوية عند 37 درجة مئوية حتى يتم تحضير الخلايا.
- إضافة WJ-MSCs والطباعة الحيوية 3D
- للعد ، اغسل الخلايا عندما يكون هناك التقاء بنسبة 80٪ مع حوالي 5 مل من PBS ، وأضف 5 مل من 0.25٪ تربسين و 2.21 مللي متر EDTA 4Na. اتركيه لمدة 5 دقائق على حرارة 37 درجة مئوية.
- أضف 10 مل من وسط DMEM-F12 مع 10٪ FBS إلى الخلايا بعد إزالتها من الحاضنة. جيدا ، واجمع الوسط ، وانقله إلى أنبوب طرد مركزي. أجهزة الطرد المركزي عند 101 × جم لمدة 5 دقائق في درجة حرارة الغرفة ثم تخلص من المادة الطافية.
- اترك حوالي 250 ميكرولتر من الوسط مع الحبيبات. أعد إذابة الحبيبات في 1 مل من الوسط الطازج. إلى 48 ميكرولتر من الوسط ، أضف 2 ميكرولتر من معلق الخلية و 50 ميكرولتر من التريبان الأزرق (0.4 جم تريبان أزرق / 100 مل) في أنبوب مخروطي (1.5 مل) لحساب4. ماصة بشكل جيد.
- أضف ما يقرب من 10 مل من معلق الخلايا الملطخة المحضر إلى غرفة عد خلايا توما. احسب متوسط عدد الخلايا التي تسقط في المربعات على جانبي المجهر الضوئي.
احسب النسبة المئوية للحيوية (٪) = (عدد الخلايا القابلة للحياة / إجمالي الخلايا المحسوبة) × 100
ملاحظة: تتم دراسة التفاعل بين الخلية والحبر الحيوي بطريقتين: (1) يمكن طباعته عن طريق إضافته إلى الأحبار الحيوية (3D-B ؛ 3D-G) ؛ (2) يتم زرع الخلايا على الأحبار الحيوية بعد الضغط عليها ، وتشكل الخلايا كروية (3D-BS ؛ 3D-GS). - بالنسبة للتفاعل بين الخلية والحبر الحيوي ، قم أولا بإنشاء مجموعات الحبر الحيوي (الجدول 1). تتضمن المجموعة 1 3D-B و 3D-G مطبوعة بالحبر الحيوي للطباعة الحيوية. تتضمن المجموعة 2 أحبار حيوية 3D-BS و 3D-GS تشكلت عليها كرويات بعد الطباعة الحيوية.
- عد خلايا المجموعة 1 بحيث يكون هناك ما يقرب من 1 × 107 خلايا في 0.5 مل من الوسط. أضف 4.5 مل من الحبر الحيوي ليصل الحجم الإجمالي إلى 5 مل. نقل هذا إلى الخراطيش في خزانة معقمة بمساعدة المحاقن. قم بتثبيت الخراطيش في قسم الطارد المقابل في الطابعة الحيوية.
- بالنسبة للمجموعة الثانية ، خذ 5 مل من كل مجموعة من مجموعات bioink وانقلها إلى خراطيش معقمة بمساعدة حاقن.
- استخدم الطابعة الحيوية مع رأسي طباعة متحدي المحور وتقنية البثق التي تعمل بالهواء المضغوط. اضبط دقة X / Y / Z لكل خطوة صغيرة على 1.25 ميكرومتر ، وعرض البثق على 400 ميكرومتر ، وارتفاع البثق على 200 ميكرومتر. تعد الشبكة مقاس 20 مم × 20 مم × 5 مم واحدة من أكثر النماذج ثلاثية الأبعاد استخداما لأعمال الطباعة الحيوية ثلاثية الأبعاد.
- إنشاء نماذج 3D باستخدام برامج CAD مفتوحة المصدر على شبكة الإنترنت. قبل الطباعة الحيوية ، قم بإنشاء نماذج 3D بسيطة باستخدام أحد المنصات مفتوحة المصدر (على سبيل المثال ، الحشو). يمكن أن يكون النموذج خطيا (مثل النموذج المستخدم هنا) أو قرص العسل أو على شكل شبكة. تصدير وتنزيل بتنسيق .stl بعد إنشاء مربع 5 مم × 20 مم × 20 مم.
- يستخدم برنامج الطابعة الحيوية ملفات .stl ويحولها إلى تنسيق .gcode قابل للطباعة باستخدام وحدات مقسم طريقة العرض. للحصول على شكل شبكة قابل للطباعة، قم بتعطيل الغلاف الخارجي في وحدة مقسم طريقة العرض. امسح الجهاز بالإيثانول بنسبة 70٪ قبل التشغيل ثم قم بتعقيمه بالتعقيم بالأشعة فوق البنفسجية.
- بالنسبة لعملية الطباعة الحيوية ، انقل مجموعات الحبر الحيوي إلى الخراطيش بمساعدة حاقن. قم بتثبيت الخراطيش في قسم الطارد المقابل في الطابعة الحيوية.
- اضبط متوسط ضغط الطابعة ثلاثية الأبعاد على 7.5 رطل لكل بوصة مربعة ودرجة حرارة الخرطوشة والسرير على 37 درجة مئوية. اضبط السرعة على 60٪ وقم بإجراء عملية طباعة 3D قياسية.
ملاحظة: يسمح تخطيط النماذج المعدة بمسافات (مثل النموذج الخطي) بإجراء زراعة الخلايا في المساحات بعد الطباعة الحيوية. - ضع النظام في وضع المنزل أثناء مرحلة الكتابة. ضع المحاور (X ، Y ، Z) تلقائيا ، وحدد الطارد ، واضبط. ابدأ عملية الطباعة. بعد عملية الطباعة الحيوية ، خذ العينة وضعها تحت خزانة التدفق الصفحي.
- رش الأحبار الحيوية بمحلول 0.1 N CaCl2 بعد الطباعة أو أضف 1 مل من المحلول باستخدام ماصة في درجة حرارة الغرفة. انتظر حوالي 10-20 ثانية واغسل الأنماط المطبوعة 2x باستخدام PBS الذي يحتوي على Ca 2+ و Mg2+.
- أضف 2 مل من DMEMF-12 مع وسيط FBS بنسبة 10٪ فوق كل مجموعة من مجموعات الحبر الحيوي المحتوية على الخلية. احتضان الألواح عند 37 درجة مئوية مع 5٪ CO2. بعد ذلك ، أضف 2 مل من وسط التعليق الذي يحتوي على 1 × 106 خلايا لكل مجموعة لتشكيل كروي.
- احتضان الألواح عند 37 درجة مئوية مع 5٪ CO2. بعد حضانة 24 ساعة ، لاحظ تكوين كروي تحت المجهر المقلوب.
- تمايز WJ-MSCs إلى الخلايا الشبيهة بالخلايا العصبية
- مراقبة وتصوير جميع دفعات الحبر الحيوي بعد 24 ساعة من الحضانة. أضف 2 مل من وسط التمايز العصبي لكل بئر (باستثناء المجموعة الضابطة) وقم بالتحديث كل يومين. اتبع لمدة 7 أيام لمراقبة التمايز العصبي.
4. توصيف هيدروجيل الجرافين الحيوي الحيوي
ملاحظة: يتم إجراء تحليلات التصوير بفاصل زمني ، والتحليل الطيفي بالأشعة تحت الحمراء لتحويل فورييه (FT / IR) ، والمجهر الإلكتروني الماسح (SEM) لتوصيف هيدروجيل الجرافين الحيوي الحيوي. يتم إنشاء العينات من مجموعات الحبر الحيوي 3D-B و 3D-G بطريقة التنقيط لتحليل FT / IR و SEM.
- تحليل FT / IR
ملاحظة: FT / IR هي طريقة تحليلية كيميائية تعتمد على تحويل فورييه الرياضي ، ولا غنى عنه لتوصيف المواد. استخدم جهاز FT/IR استنادا إلى مبادئ مقياس التداخل Michelson عند 28 درجة مئوية، مع مصباح هالوجين، ومصدر ضوء زئبقي مبرد بالماء، ونسبة عرض إلى ارتفاع للإشارة تبلغ 4 سم−1، تقاس لمدة دقيقة واحدة، عند 2200 سم−1.- قم بإعداد مجهر FT / IR وتأكد من محاذاة بصريات الجهاز. معايرة الجهاز.
- نظرا لأن العينة في قطرة ، خذ قطعة من هيدروجيل بسمك 1-2 مم وضعها بالملقط على جزء العينة. ركز على العينة وارفعها حتى يتم الاتصال الوثيق. اجمع طيف العينة عن طريق بدء العملية من النظام.
- تحليل المجهر الإلكتروني الماسح (SEM)
ملاحظة: يمكن فحص مورفولوجيا السطح والبنية الداخلية وتوزيع الخلايا وتفاعلات خلايا الحبر الحيوي من خلال تحليل SEM بأبعاد مختلفة.- قم بإسقاط الهيدروجيل في ألواح ذات 6 آبار تحتوي على 1 مل من CaCl2 crosslinker باستخدام طريقة قطرات طرف الماصة (انظر الشكل 1).
- اغسل الألواح 2x بحوالي 1 مل من PBS لتحرير محلول الأملاح. ثم ضع هذه القطرات في أنبوب الصقر الذي يحتوي على 5 مل من 5٪ بارافورمالدهيد بمساعدة ملقط.
- اصنع مقاطع رقيقة من الأحبار الحيوية المتساقطة بمساعدة مشرط. عصا العينات على الجانب لزجة على اللوحة المعدنية. أدخل في جهاز الطلاء حيث يغطي البلاديوم الذهبي ، الذي يمر إلى مرحلة البلازما عن طريق استبدال الهواء بغاز الأرجون ، العينة.
- ضعه في المجهر الإلكتروني (SEM). افتح برنامج المجهر الذي يتصل به SEM. قم بإجراء القياس والتقاط صور لأجزاء مختلفة من العينة. بالنسبة لهذا البروتوكول ، تم استخدام مقاييس 5 ميكرومتر و 10 ميكرومتر و 200 ميكرومتر. تم التقاط ما مجموعه 40 صورة لمجموعات 3D-B و 3D-G.
- التصوير بفاصل زمني
ملاحظة: أثناء التصوير بفاصل زمني ، لم يتم استخدام عينات الحبر الحيوي التي تحتوي على خلايا محولة جينية GFP فحسب ، بل تم أيضا تصوير الأحبار الحيوية ذات الكرات الكروية لمدة 16 ساعة. يتم إجراء التصوير بفاصل زمني لفحص آثار الجرافين على الخلايا الجذعية ومراقبة تفاعلات الخلايا داخل الحبر الحيوي.- أضف 1 × 107 MSCs المصنفة على GFP المتاحة تجاريا إلى 5 مل من الحبر الحيوي والطباعة الحيوية كما في الخطوة 3.2.11. أضف 1 مل من crosslinker ، واستمر لمدة 20-30 ثانية ، واغسل 2x باستخدام PBS.
- قم بتشغيل شاشة الفاصل الزمني وافتح البرنامج على الكمبيوتر. اضبط حوالي 16 ساعة في وضع الفاصل الزمني واضبط درجة الحرارة على 37 درجة مئوية. اضغط على زر البدء . يتم تسجيل مقاطع الفيديو في شكل عينات فيديو بفاصل زمني 40 ثانية بواسطة النظام.
- ركز المجهر عند تكبير 10x كل 2 ساعة. أيضا ، تصور الأجسام الكروية التي تم إنشاؤها باتباع نفس الخطوات.
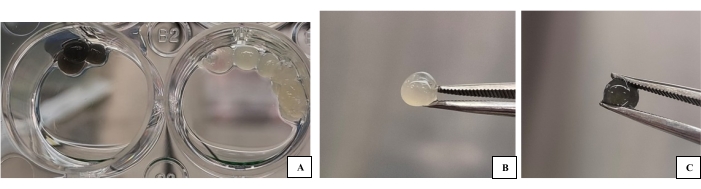
الشكل 1: مجموعات الحبر الحيوي 3D-B و 3D-G المنتجة كقطرات لاستخدامها في التوصيف. (أ) عينات الحبر الحيوي (صورة ما قبل التوصيف) على لوحة ذات رابط متشابك. (B) صورة قطرة 3D-B للحبر الحيوي. (C) صورة قطرة الحبر الحيوي 3D-G. يمكن للمادة الحيوية التي سيتم توصيفها والخلايا التي تحتوي عليها أن تمر بسهولة أكبر بعمليات مثل طلاء الذهب وأخذ العينات وما إلى ذلك. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تحديد التمايز العصبي عن طريق طريقة التلوين المناعي
- اجمع الكرات ، دون مقاطعة أشكال الكرة ، وأعد زرعها في أطباق جديدة لإعادة تشكيلها بطريقة أسهل ، بدلا من تضمينها في البارافين لتقسيم الأنسجة.
- قم بتغطية الألواح المكونة من 48 بئرا بحوالي 20 مل من محلول الجيلاتين المعقم مسبقا بنسبة 0.1٪ واحتفظ بها في حاضنة لمدة ساعة على الأقل. ماصة حوالي 500 ميكرولتر من الجيلاتين المحضر 0.1٪ في 48 لوحة بئر. اترك الألواح الجيلاتينية في الحاضنة لمدة 10 دقائق.
ملاحظة: سيسمح ذلك للجيلاتين بالانتفاخ قليلا ، ويغطي السطح ويخلق بيئة أفضل للكرويات المجمعة للالتصاق. - جمع الكرويات عن طريق ماصة ، وتوزيع الكرويات التي تم جمعها من الحاضنة في آبار لوحة 48 بئر ، وإضافة وسط جديد. ثم احتضان لمدة 12-24 ساعة.
ملاحظة: من الصعب جدا توزيع الكرويات عن طريق العد. جمع كروية في أنبوب واحد وتوزيع الحجم الكلي بالتساوي على الآبار. لهذه الدراسة ، احتوى كل بئر على ما يقرب من 4-6 كرويات.
ملاحظة: بالنسبة لعينات 2D ، يكون الغسيل المسبق للبقع كافيا ، ولا يلزم استبدال الوسائط. - قم بإزالة الوسط واغسل الخلايا ببطء باستخدام برنامج تلفزيوني لأن الأجسام الكروية ستكون في الأعلى. إصلاح في 4 ٪ بارافورمالدهيد لمدة 2 ساعة.
- اغسل العينات باستخدام برنامج تلفزيوني مرة أخرى وكتلها بحوالي 10 مل من 2٪ BSA و 0.1٪ TritonX لمدة 30 دقيقة. ثم اغسل باستخدام برنامج تلفزيوني 3x.
- تمييع الأجسام المضادة التمهيدي المختارة (N-cadherin-rabbit و β-III tubulin-mouse) بنسبة 1: 100 مع محلول كاشف مخفف للأجسام المضادة. أضف 100 ميكرولتر من محلول الأجسام المضادة إلى كل عينة واحتضانها طوال الليل عند 4 درجات مئوية.
- اغسل العينات 3x باستخدام برنامج تلفزيوني. احتضان مع الأرنب IgG-FTIC-المضاد للفأر لتوبولين β-III والجسم المضاد الثانوي IgG-SC2781-goat المضاد للفأر ل N-Cad المخفف إلى 1: 200 في درجة حرارة الغرفة لمدة 30 دقيقة. أداء جميع العمليات في الظلام.
ملاحظة: مهما كانت السلالة المستخدمة كجسم مضاد أساسي (على سبيل المثال ، الفأر) في التلوين المزدوج ، يجب استخدام سلالة مختلفة (على سبيل المثال ، الماعز أو الأرنب) للجسم المضاد الثانوي. - اغسل الجسم المضاد الثانوي باستخدام PBS 3x ثم قم بتقطير محلول DAPI (1: 1) في كل عينة. انتظر لمدة 15-20 دقيقة. إجراء التصوير المناعي.
النتائج
سمية الجرافين والتصوير 2D
تم إجراء التحليل الإحصائي لنتائج MTT التي تم الحصول عليها باستخدام ANOVA أحادي الاتجاه مع اختبار Tukey في برنامج التحليل الإحصائي ، ويظهر الرسم البياني الذي تم الحصول عليه في الشكل 2. أظهرت نسبة الجرافين مقارنة بالسيطرة انخفاضا معنويا فقط لتر?...
Discussion
أصبحت مزايا العلاجات المطبقة مع سقالات 3D الهندسية على طرق 2D التقليدية أكثر وضوحا كل يوم. عادة ما تكون الخلايا الجذعية المستخدمة بمفردها في هذه العلاجات أو جنبا إلى جنب مع السقالات المنتجة من مواد حيوية مختلفة ذات توافق حيوي منخفض وقابلية للتحلل البيولوجي غير كافية في تجديد الأعصاب الطرفي...
Disclosures
يعلن المؤلفون أنه لا يوجد تضارب في المصالح. تم تنفيذ المشروع بالتعاون مع HD Bioink ، مطور تقنية الطباعة الحيوية 3D.
Acknowledgements
تم تطوير الجرافين المستخدم في هذه الدراسة في جامعة كيركلاريلي ، قسم الهندسة الميكانيكية. تم التبرع بها من قبل الدكتور كارابي أوغلو. تم تمويل اختبار سمية الجرافين من قبل مشروع بعنوان "طباعة وتمايز الخلايا الجذعية الوسيطة على طابعات حيوية ثلاثية الأبعاد مع أحبار حيوية مخدرة بالجرافين" (رقم الطلب: 1139B411802273) تم إكماله في نطاق برنامج دعم أطروحة البكالوريوس TÜBİTAK 2209-B-Industry-Oriented Description. تم دعم الجزء الآخر من الدراسة من خلال صندوق الأبحاث المقدم من مشاريع البحث العلمي بجامعة يلدز التقنية (TSA-2021-4713). تم التبرع بالخلايا الجذعية الوسيطة مع GFP المستخدمة في مرحلة التصوير بفاصل زمني بواسطة Virostem Biotechnology. يشكر المؤلفون فريق Darıcı LAB و YTU The Cell Culture and Tissue Engineering LAB على المناقشات المثمرة.
Materials
| Name | Company | Catalog Number | Comments |
Centrifugal | Hitachi | Used in cell culture and biomaterial step | |
| 0.1N CaCl2 | HD Bioink | Used for crosslinker | |
| 0.22 µm membrane filter | Aιsιmo | Used for sterilization | |
| 0.45 µm syringe filter | Aιsιmo | Used for sterilization | |
| 1.5mL conic tube | Eppendorfa | Used for bioink drop | |
| 15mL Falcon tube | Nest | Used in cell culture step | |
| 25 cm2 cell culture flasks (Falcon, TPP tissue culture flasks | Nest | Used for cell culture | |
| 3D Bioprinting | Axolotl Biosystems Bio A2 (Turkey) | Bioprinting Step | |
| 50 mL Falcon tube | Nest | Used in cell culture step | |
| 6/24/48/96 well plates (Falcon, TPP microplates) | Merck Millipore | Used in cell culture step | |
| 75 cm2 cell culture flasks (Falcon, TPP tissue culture flasks | Nest | Used for cell culture | |
| Anti mouse IgG-FTIC-rabbit | Santa Cruz Biotechnology | J1514 | Seconder antibody, used for dye |
| Anti mouse IgG-SC2781-goat | Santa Cruz Biotechnology | C3109 | Seconder antibody, used for dye |
| Au coating device EM ACE600 | Leica | for gold plating of biomaterial section before SEM imaging | |
| Autoclave | NUVE-OT 90L | Used for the sterilization process. | |
| Autoclave | NUVE-OT 90L | Used for the sterilization process. | |
| Cell Cultre Cabine | Hera Safe KS | Used for the cell culture process | |
| Dulbecco's Modified Eagle's Medium/Nutrient Mixture-F12 | Sigma | RNBJ7249 | Used as cell culture medium |
| FEI QUANTA 450 FEG ESEM SEM | Quanta | FEG 450 | for SEM |
| Fetal Bovine Serum-FBS | Capricorn | FBS-16A | It was used by adding to the cell culture medium. |
| Freezer -80°C | Panasonic | MDF-U5386S-PE | We were used to store cells and the resulting exosomes |
| Gelatine-Alginate bioink powder | HD Bioink | Used for produced bioink step | |
| GFP labelled-WJ-MSCs | Virostem | Used for imaging to cell-bioink interaction | |
| Graphene nanoplatelets (Graphene-IGP2) | Grafen Chemical Industries Co. | Used for production 3D-G bioink | |
| Immunofluorescence antibodies (N-CAD; β-III Tubulin) | Cell Signalling and Santa Cruz | Used for dye | |
| JASCO 6600 | Tetra | for FTIR | |
| MTT Assay | Sigma | Viability testing | |
| Penicilin/Streptomycin Solution | Capricorn | PB-S | It was added to the medium to prevent contamination in cell culture. |
| Thoma slide | Isolab | Used for counting the cell | |
| Time-Lapse Imaging System | Zeiss Axio.Observer.Z1 | Imaging | |
| Tripsin-EDTA | Multicell | The flask was used to remove the cells covering the surface. | |
| Vorteks | Biobase | For produced bioink step | |
| WJ-MSCs | ATCC | Used for the cell culture process |
References
- Kamasak, B., et al. Peripheral Nerve Injuries and Physiotherapy. Clinical Physiotherapy. 19, (2019).
- Yegiyants, S., Dayicioglu, D., Kardashian, G., Panthaki, Z. J. Traumatic peripheral nerve injury: A wartime review. Journal of Craniofacial Surgery. 21 (4), 998-1001 (2010).
- Mushtaq, S., et al. Frequency of peripheral nerve injury in trauma in emergency settings. Cureus. 13 (3), 14195 (2021).
- Allahverdiyev, A. . Basic Principles of Somatic and Stem Cell Culture Systems, 1st Edition. , (2018).
- Allahverdiyev, A. M., et al. Adipose tissue-derived mesenchymal stem cells as a new host cell in latent leishmaniasis. The American Journal of Tropical Medicine and Hygiene. 85 (3), 535-539 (2011).
- Schofield, R. The relationship between the spleen colony-forming cell and the hemopoietic stem cell. Blood Cells. 4 (1-2), 7-25 (1978).
- Goodman, S. R. Stem Cells and Regenerative Medicine (Chapter 13). Goodman's Medical Cell Biology, Fourth Edition. , 361-380 (2021).
- Kaya, T. I. Tissue engineering. International Journal of Medical Sciences. 1 (48), 165-169 (2018).
- Sensharma, P., Madhumathi, R. G., Jayant, R. D., Jaiswal, A. K. Biomaterials and cells for neural tissue engineering: Current choices. Materials Science and Engineering: C. 7, 1302-1315 (2017).
- Hölzl, K., et al. Bioink properties before, during, and after 3D bioprinting. Biofabrication. 8 (3), 032002 (2016).
- Zheng, Y., et al. 2D nanomaterials for tissue engineering and regenerative nanomedicines: Recent advances and future challenges. Advanced Healthcare Materials. 10 (7), 2001743 (2021).
- Shin, S. R. Graphene-based materials for tissue engineering. Advanced Drug Delivery Reviews. 105, 255-274 (2016).
- Chen, M., Qin, X., Zeng, G. Biodegradation of carbon nanotubes, graphene, and their derivatives. Trends in Biotechnology. 35 (9), 836-846 (2017).
- Chen, S., et al. PAM/GO/Gel/SA composite hydrogel conduit with bioactivity for repairing peripheral nerve injury. Journal of Biomedical Materials Research Part A. 107, 1273-1283 (2019).
- Chiriac, S., Facca, S., Diaconu, M., Gouzou, S., Liverneaux, P. Experience of using the bioresorbable copolyester poly(DL-lactide-ε-caprolactone) nerve conduit guide Neurolac™ for nerve repair in peripheral nerve defects: Report on a series of 28 lesions. Journal of Hand Surgery (European Volume). 37 (4), 342-349 (2011).
- Karaaltin, A. B., et al. Human olfactory stem cells for injured facial nerve reconstruction in a rat model). Head & Neck. 38, 2011-2020 (2016).
- Bingham, J. R., et al. Stem cell therapy to promote limb function recovery in peripheral nerve damage in a rat model. Annals of Medicine and Surgery. 41, 20-28 (2019).
- Zhuang, H., et al. Gelatin-methacrylamide gel loaded with microspheres to deliver GDNF in bilayer collagen conduit promoting sciatic nerve growth. International Journal of Nanomedicine. 11, 1383-1394 (2016).
- Scheib, J., Hoke, A. Advances in peripheral nerve regeneration. Nature Reviews: Neurology. 9 (12), 668-676 (2013).
- Yurie, H., et al. The efficacy of a scaffold-free bio 3D conduit developed from human fibroblasts on peripheral nerve regeneration in a rat sciatic nerve model. PLOS ONE. 12 (2), 0171448 (2017).
- Guo, Y., et al. Assessment of the green florescence protein labeling method for tracking implanted mesenchymal stem cells. Cytotechnology. 64 (4), 391-401 (2012).
- Kose, C., Kacar, R., Zorba, A. P., Bagirova, M., Allahverdiyev, A. The effect of CO2 laser beam welded AISI 316L austenitic stainless steel on the viability of fibroblast cells, in vitro. Materials Science and Engineering: C. 60, 211-218 (2016).
- Liu, Y., et al. Bio-adenine-bridged molecular design approach toward non-covalent functionalized graphene by liquid-phase exfoliation. Journal of Materials Science. 55, 140-150 (2020).
- Rehman, S. Reduced graphene oxide incorporated GelMA hydrogel promotes angiogenesis for wound healing applications. International Journal of Nanomedicine. 14, 9603-9617 (2019).
- Bei, H. P., et al. Graphene-based nanocomposites for neural tissue engineering. Molecules. 24 (4), 658 (2019).
- Othman, S. A., et al. Alginate-gelatin bioink for bioprinting of HeLa spheroids in alginate-gelatin hexagon-shaped scaffolds. Polymer Bulletin. 78, 6115-6135 (2021).
- Peng, X. L., Li, Y., Zhang, G., Zhang, F., Fan, X. Functionalization of graphene with nitrile groups by cycloaddition of tetracyanoethylene oxide. Journal of Nanomaterials. 2013, 841789 (2013).
- Zorba Yildiz, A. P., et al. 3D therapeutic approaches for peripheral nerve damage. 9th International Molecular Biology and Biotechnology Congress Abstract Book. , (2020).
- Liau, L. L., Ruszymah, B. H. I., Ng, M. H., Law, J. X. Characteristics and clinical applications of Wharton's jelly-derived mesenchymal stromal cells. Current Research in Translational Medicine. 68 (1), 5-16 (2020).
- Yoo, J., et al. Augmented peripheral nerve regeneration through elastic nerve guidance conduits prepared using a porous PLCL membrane with a 3D printed collagen hydrogel. Biomaterials Science. 22, 1-12 (2020).
- Jansen, K., Meek, M. F., vander Werff, J. F. A., van Wachem, P. B., van Luyn, M. J. A. Long-term regeneration of the rat sciatic nerve through a biodegradable poly (DL-lactide-Ɛ-caprolactone) nerve guide: Tissue reactions with a focus on collagen III/IV reformation. Journal of Biomedical Materials Research. 69 (2), 334-341 (2016).
- Pathre, P., et al. PTP1B regulates neurite extension mediated by cell-cell and cell-matrix adhesion molecules. Journal of Neuroscience Research. 15, 143-150 (2001).
- Qing, L., Chen, H., Tang, J., Jia, X. Exosomes and their microRNA cargo: New players in peripheral nerve regeneration. Neurorehabilitation and Neural Repair. 32 (9), 765-776 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved