A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנה ואפיון של ביו-דיו הידרוג'ל ביו-היברידי תלת-ממדי מבוסס גרפן לנוירו-הנדסה היקפית
In This Article
Summary
בכתב יד זה, אנו מדגימים את ההכנה של ביודיו הידרוג'ל ביו-היברידי המכיל גרפן לשימוש בהנדסת רקמות היקפיות. באמצעות חומר ביו-היברידי תלת-ממדי זה, מבוצע פרוטוקול ההתמיינות העצבית של תאי גזע. זה יכול להיות צעד חשוב בהבאת ביו-חומרים דומים למרפאה.
Abstract
נוירופתיות היקפיות יכולות להתרחש כתוצאה מנזק אקסונלי, ולעיתים עקב מחלות דה-מיאלינטינג. נזק עצבי היקפי הוא בעיה גלובלית המתרחשת אצל 1.5%-5% ממטופלי החירום ועלולה להוביל לאובדן משמעותי של מקומות עבודה. כיום, גישות מבוססות הנדסת רקמות, המורכבות מפיגומים, קווי תאים מתאימים ואותות ביולוגיים, הפכו ישימות יותר עם פיתוח טכנולוגיות הדפסה ביולוגית תלת-ממדית (תלת-ממדית). השילוב של ביו-חומרים שונים של הידרוג'ל עם תאי גזע, אקסוזומים או מולקולות איתות ביולוגי נחקר לעתים קרובות כדי להתגבר על הבעיות הקיימות בהתחדשות עצבית היקפית. בהתאם לכך, הייצור של מערכות הזרקה, כגון הידרוג'לים, או מבני צינור מושתלים שנוצרו בשיטות הדפסה ביולוגית שונות זכה לחשיבות בנוירו-הנדסה היקפית. בתנאים רגילים, תאי גזע הם התאים המחדשים של הגוף, ומספרם ותפקודם אינם פוחתים עם הזמן כדי להגן על אוכלוסיותיהם; אלה אינם תאים מתמחים אך יכולים להתמיין עם גירוי מתאים בתגובה לפציעה. מערכת תאי הגזע נמצאת תחת השפעת המיקרו-סביבה שלה, הנקראת נישת תאי גזע. בפגיעות עצביות היקפיות, במיוחד בנוירוטמזיס, לא ניתן להציל את המיקרו-סביבה הזו במלואה גם לאחר קשירת קצות עצבים קטועים יחד בניתוח. גישת הביו-חומרים המרוכבים והטיפולים התאיים המשולבים מגבירה את הפונקציונליות והישימות של חומרים במונחים של תכונות שונות כגון מתכלה, תאימות ביולוגית ויכולת עיבוד. בהתאם לכך, מחקר זה נועד להדגים הכנה ושימוש בתבניות הידרוג'ל ביו-היברידיות מבוססות גרפן ולבחון את יעילות ההתמיינות של תאי גזע לתאי עצב, אשר יכולה להוות פתרון יעיל בהתחדשות עצבית.
Introduction
מערכת העצבים, שהיא המנגנון המגשר בין המבנה הפנימי של האורגניזם והסביבה, מחולקת לשני חלקים: מערכת העצבים המרכזית וההיקפית. פגיעה עצבית היקפית היא בעיה גלובלית המהווה 1.5%-5% מהמטופלים המגיעים למחלקה לרפואה דחופה ומתפתחת עקב טראומות שונות, המובילות לאובדן עבודה משמעותי 1,2,3.
כיום, גישות תאיות לנוירו-הנדסה היקפית מעוררות עניין רב. תאי גזע נמצאים במקום הראשון בין התאים המשמשים בגישות אלה. בתנאים רגילים, תאי גזע הם התאים המחדשים של הגוף, ומספרם ותפקודם אינם פוחתים עם הזמן כדי להגן על אוכלוסיותיהם; תאים אלה מתמחים אך יכולים להתמיין עם גירוי מתאים בתגובה לפציעה 4,5. על פי השערת תאי הגזע, מערכת תאי הגזע נמצאת תחת השפעת המיקרו-סביבה שלה, הנקראת נישת תאי הגזע. שימור והתמיינות של תאי גזע אינם אפשריים ללא נוכחות של מיקרו-סביבה6 שלהם, אשר ניתן לבנות מחדש באמצעות הנדסת רקמות באמצעות תאים ופיגומים7. הנדסת רקמות היא תחום רב תחומי הכולל עקרונות הנדסיים וביולוגיים כאחד. הנדסת רקמות מספקת כלים ליצירת רקמות מלאכותיות שיכולות להחליף רקמות חיות וניתן להשתמש בהן בהתחדשות רקמות אלה על ידי הסרת הרקמות הפגועות ומתן רקמות תפקודיות8. פיגומי רקמות, אחת משלוש אבני היסוד של הנדסת רקמות, מיוצרים בשיטות שונות מחומרים טבעיים וסינתטיים9. הדפסה תלת מימדית (3D) היא טכנולוגיית ייצור תוספים מתפתחת הנמצאת בשימוש נרחב להחלפה או שחזור של רקמות פגומות באמצעות הייצור הפשוט אך הרב-תכליתי של צורות מורכבות בשיטות שונות. הדפסה ביולוגית היא שיטת ייצור תוספתית המאפשרת דו-קיום של תאים וביו-חומרים, הנקראת ביו-דיו10. בהתחשב באינטראקציה של תאי עצב זה עם זה, מחקרים עברו למועמדים ביו-חומריים מוליכים כגון גרפן. ננו-לוחות גרפן, בעלי תכונות כגון אלקטרוניקה גמישה, קבלי-על, סוללות, אופטיקה, חיישנים אלקטרוכימיים ואגירת אנרגיה, הם חומר ביולוגי מועדף בתחום הנדסת רקמות11. גרפן שימש במחקרים שבהם התפשטות והתחדשות של רקמות ואיברים פגומים בוצעו12,13.
הנדסת רקמות מורכבת משלוש אבני בניין בסיסיות: פיגומים, תאים ומולקולות אות ביולוגי. ישנם ליקויים במחקרים על נזק עצבי היקפי במונחים של מתן שלושת המבנים הללו לחלוטין. בעיות שונות נתקלו בביו-חומרים המיוצרים ומשמשים במחקרים, כגון הם מכילים רק תאי גזע או מולקולות אות ביולוגי, היעדר מולקולה ביו-אקטיבית שתאפשר התמיינות תאי גזע, חוסר תאימות ביולוגית של החומר הביולוגי בו נעשה שימוש, וההשפעה הנמוכה על התפשטות התאים בנישת הרקמות, ולכן, הולכה עצבית לא ממומשת במלואה 2,13,14,15,16. זה דורש אופטימיזציה של התחדשות עצבית, הפחתת ניוון שרירים17,18, ויצירת ביותהכרחי 19 עם גורמי גדילה נגד בעיות כאלה. בשלב זה, האפיון והניתוח של הפעילות העצבית של אב טיפוס ביו-חומרי כירורגי, שיועבר למרפאה, חשובים מאוד.
בהתאם לכך, מחקר שיטות זה חוקר את דפוס ביו-דיו הידרוג'ל עם ננו-לוחות גרפן שנוצרו על ידי מדפסת ביולוגית תלת-ממדית ואת יעילותה על התמיינות נוירוגנית של תאי הגזע שהיא מכילה. כמו כן, ההשפעות של גרפן על היווצרות נוירוספרה והבחנה נחקרים.
Protocol
1. גידול תאי גזע מזנכימליים ג'לי של וורטון
- הוציאו את תאי הגזע המזנכימליים הג'לי של וורטון (WJ-MSCs, מ-ATCC) ממקפיא של -80°C. תרבית WJ-MSCs בתווך DMEM-F12 המכיל 10% סרום עגל עוברי (FBS), 1% Pen-Strep ו-1% L-גלוטמין בזרימה למינרית סטרילית בטמפרטורת החדר, כמתואר ב- Yurie et al.20.
- Cryopreserve חלק מהתאים ב 1 x 106 תאים / מ"ל עם מדיום הקפאה המכיל 35% FBS, 55% DMEMF-12, ו 10% dimethyl sulfoxide (DMSO). לשם כך, ספרו 1 x 106 תאים בשקופית ספירת תאי תומא והוסיפו את תמיסת ההקפאה כלפי מטה. העבר במהירות את השקופית למיכל חנקן נוזלי.
- כאשר תאים בתרבית הם 80% במפגש בצלוחית, לשפוך את המדיום ולשטוף עם 5 מ"ל של PBS. הוסף 5 מ"ל של 0.25% טריפסין ו- 2.21 מ"ל EDTA-4Na. יש לדגור באינקובטור בטמפרטורה של 37 מעלות צלזיוס למשך 5 דקות.
- הוסף 10 מ"ל של מדיום DMEM-F12 עם 10% FBS לתאים שהוסרו מהאינקובטור. תלו אותו היטב, אספו את התווך והעבירו את התווך לצינור צנטריפוגה.
- צנטריפוגה במהירות סיבוב של 101 x גרם למשך 5 דקות בטמפרטורת החדר. השליכו את הסופרנאטנט וזרעו מחדש את התאים בצלוחיות חדשות עם חומר מזין טרי המכיל 10% FBS.
הערה: ניתן להשתמש ב- WJ-MSCs מסחריים המסומנים בגן GFP בשיטת הטרנסדוקציה כדי להמחיש טוב יותר את האינטראקציות בין ביו-חומר לתאים שיוצרו21. ניתן ליצור את הקבוצות שישמשו בשיטה זו כמוצג בטבלה 1.
| קבוצות שנוצרו | סיבות ליצור | מספר חזרות | ||
| WJ-MSCs דו-ממדיים (2D-C) | שליטה דו-ממדית | x 5 | ||
| WJ-MSCs דו-ממדיים וגרפן (2D-G) | קביעת מינון רעיל של גרפן בדו-ממד | x 5 חזרות לכל אחד מהריכוזים השונים | ||
| WJ-MSCs כלולים בדיו ביולוגי (3D-B ) | בקרת תלת מימד | x 3 | ||
| WJ-MSCs ו-0.1% גרפן כלולים בדיו ביולוגי (3D-G) | 3D גרפן-Bioink Biohybrid הקבוצה | x 3 | ||
| WJ-MSCs הם בצורת ספרואיד על bioinks (3D-BS) | בקרה תלת ממדית של צורה ספרואידית | x 3 | ||
| WJ-MSCs ו-0.1% גרפן הם בצורת ספרואיד על הביו-דיו (קבוצת 3D-GS) | 3D גרפן-Bioink Biohybrid קבוצה של צורה ספרואידית | x3 | ||
| טיפת ביודיו תלת-ממדית | הוא מיוצר עבור ניתוח אפיון SEM ו- FTIR. | x5 | ||
| טיפת גרפן תלת-ממדית | הוא מיוצר עבור ניתוח אפיון SEM ו- FTIR. | x5 | ||
| 3D Bioink עם תווית GFP WJ-MSCs &; 0.1% | תצפית על תנועות WJ-MsCs בביודיו המכיל את המינון המתאים של גרפן. | x3 | ||
טבלה 1. קבוצות בשיטה. כל קבוצות הדו-ממד והתלת-ממד בשיטה כלולות.
2. רעילות גרפן והדמיה דו-ממדית
- הכנת ריכוזי גרפן ויישום בתאים
הערה: חלקיקי גרפן גולמי נרכשו באופן מסחרי (סוג ננו-לוחות גרפן תעשייתיים) ונתרמו גם הם. מידות החלקיקים היו 5-8 ננומטר עובי, 5 מיקרומטר קוטר, ו 120-150 מ '2/g בשטח הפנים.- שקלו את הגרפן ליצירת תמיסה של 1% (מ"ג/מ"ל). צור פתרון מלאי על ידי הוספת 10 מ"ל של מדיום DMEMF-12 עם 10% FBS למשקל של 100 מיקרוגרם של ננו-חלקיקי גרפן ותייג פתרון זה כתמיסת מלאי. יש לעקר באוטוקלאבה בטמפרטורה של 121°C תחת לחץ של 1.5 אטמ' למשך 20 דקות.
הערה: תערובת הגרפן הסטרילית מאוחסנת במקרר בטמפרטורה של 4°C עד לשימוש. זה לא יכול להיות מתאים לשימוש לטווח ארוך (מקסימום 1 חודש). במקרים אלה, יש לשחזר את התערובת ולעקר אותה. - הכינו תערובת של גרפן בינוני בריכוזים שונים כדי לקבוע מינונים לא רעילים. הגדר את הדילולים הראשוניים כ- 1%, 0.1%, 0.01%, 0.001% ו- 0.0001% גרפן/מדיה.
- החל מתמיסת מלאי 1%, קח 1 מ"ל ברציפות מכל ריכוז והעבר אותו לצינור חדש. הוסף 9 מ"ל של מדיום DMEMF-12 עם 10% FBS לכל צינור, ביצוע חמש דגימות בדילול הדרגתי, ולנער ולערבל את הפתרונות כדי לקבל חלוקה שווה. השתמש רק 10 מ"ל של DMEMF-12 בינוני עם 10% FBS כבקרה.
הערה: הפתיתים הכבדים של גרפן מזרזים, ולכן יש לפזר אותם מחדש. - זרעו את WJ-MSCs בצלחות 6 בארות עם 2 מ"ל של מדיום טרי המכיל 10% FBS ב 5 x 105 תאים לכל באר. לדגור במשך יום אחד ב 37 °C (77 °F). לאחר מכן, מחלקים את הצלחות לקבוצות של בארות שוות וחוזרות על עצמן. בצעו חמש חזרות על כל ריכוז.
- השליכו את התווך ולאחר מכן החליפו את המדיום בריכוזי גרפן בינוניים של 2 מ"ל לבאר. השתמש רק במדיום עבור קבוצת הביקורת. לדגור את הצלחות ב 37 ° C במשך 24 שעות.
- שקלו את הגרפן ליצירת תמיסה של 1% (מ"ג/מ"ל). צור פתרון מלאי על ידי הוספת 10 מ"ל של מדיום DMEMF-12 עם 10% FBS למשקל של 100 מיקרוגרם של ננו-חלקיקי גרפן ותייג פתרון זה כתמיסת מלאי. יש לעקר באוטוקלאבה בטמפרטורה של 121°C תחת לחץ של 1.5 אטמ' למשך 20 דקות.
- קביעת ריכוזים לא רעילים של גרפן עם MTT
- יש להשליך מדיה עם גרפן לאחר 24 שעות. לשטוף כל באר עם PBS. הוסף DMEMF-12 בינוני טרי עם FBS 10% ב 2mL לכל באר.
הערה: חשוב לשטוף עם PBS לאחר יישום ריכוזי גרפן על התא מכיוון שננו-חלקיקי גרפן, שאינם נלקחים לתא על ידי אנדוציטוזה, מוסרים מהסביבה. זה הופך את בדיקת MTT ליעילה יותר. - השתמש בפרוטוקול MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-tetrazolium bromide) כדי לקבוע את ערך IC50 המציין 50% כדאיות התא, כמתואר ב- Kose et al.22 ובשלבים 2.2.3.-2.2.6.
- ראשית, לשקול 5 מ"ג / מ"ל של מלח MTT ולהמיס PBS. יש לעקר באמצעות מסנן של 0.45 מיקרומטר. עטפו את תמיסת MTT, המיוצרת בצינור צנטריפוגה של 15 מ"ל, עם רדיד אלומיניום ואחסנו בטמפרטורה של 4°C.
- הוסף 10 μL של MTT לכל הבארות לדגור את הצלחת במשך 4 שעות ב 37 ° C. צפו בהיווצרות גבישי פורמזן בהגדלה של פי 10 מתחת למיקרוסקופ לאחר הדגירה.
- כדי להמיס את הגבישים שנוצרו בתאים, להוסיף 100 μL של DMSO לכל באר ולערבב על ידי pipetting. שומרים את הצלחת בחושך בטמפרטורת החדר למשך 30 דקות. הכנס את הצלחת לקורא הלוחות של ELISA. הגדר אורך גל של 570 ננומטר מהתוכנית למדידת בליעה ובקש ממנו לקרוא את הלוח22.
הערה: בנוסף, בעוד חלקיקי גרפן בלבד נקראים ב 270 ננומטר23, טווח הקריאה של 570 ננומטר24 כאן יהיה עבור כדאיות תא קריאה בלבד. - בצע ניתוח סטטיסטי על התוצאות שהתקבלו באמצעות ANOVA חד כיווני עם המבחן של Tukey בתוכנית ניתוח סטטיסטי.
- יש להשליך מדיה עם גרפן לאחר 24 שעות. לשטוף כל באר עם PBS. הוסף DMEMF-12 בינוני טרי עם FBS 10% ב 2mL לכל באר.
- הדמיית תפר
- כדי לבחון את האינטראקציה של ריכוזי גרפן שונים עם תאים, בצע קיטוע זמן של התאים בשיטה הנקראת דימות תפרים. שיטה זו יוצרת תמונה בהילוך מהיר באמצעות דגימות תמונה שצולמו במרווחי זמן קבועים מתחת למיקרוסקופ.
- לשם כך, הפעל תחילה את המחשב. הפעל את אינקובטור ההדמיה בהילוך מהיר והגדר אותו ל- 37 ° C. מקם את צלחת MTT בחריץ האינקובטור בהילוך מהיר.
- פתח את התוכנית Stitch במחשב. ציין את הבארות שיש לקרוא במערכת. הביאו את הקורא לבאר הראשונה ואתרו ומקדו את האזור בהגדלה של פי 10 באור לבן. הפעל את התוכנית.
הערה: זוהי תוכנית ליצירת באיכות גבוהה 4 שורות x 5 עמודות קולאז'ים מרובים תמונה. התוכנית משלבת תמונות שצולמו בזו אחר זו באיכות HD. כאשר אתה לוחץ על כפתור התחל המערכת, הבארות נקראות באופן אוטומטי, וזה לוקח ותופר 4 שורות x 5 עמודות תמונות מרובות.
3. גרפן - ייצור הידרוג'ל ביו-היברידי Bioink והתמיינות WJ-MSCs
- ייצור ביודיו
הערה: אבקות Alginate-Gelatin (3:5) הזמינות באופן מסחרי ליופיליות משמשות כבסיס לדיו ביולוגי. קבוצת ביו-דיו גרפן (3D-G; 3D-GS) וקבוצת ביו-דיו בקרה ללא גרפן (3D-B; 3D-BS) מוכנות באותה שיטה (טבלה 1).- השתמש 50 מ"ל צינורות חרוטי עבור ההכנה. ראשית, שוקלים 4.5 מ"ג אלגינט ו-1.5 מ"ג ג'לטין ומעבירים לצינור צנטריפוגה. הוסף מדיום DMEMF-12 המכיל 10% FBS לתערובת לנפח כולל של 50 מ"ל. זוהי קבוצת הבקרה (C) ללא גרפן.
- חוזרים על שקילה של 4.5 מ"ג אלגינט ו-1.5 מ"ג ג'לטין ומעבירים לצינור צנטריפוגה. לאחר מכן, קח 50 μL של גרפן 0.1% מוכן משלב 2.1.3. ולהוסיף אותו לצינור. הוסף DMEMF-12 עם 10% FBS לנפח כולל של 50 מ"ל.
- מערבבים את הביו-דיו תחילה על ידי פיפטינג ולאחר מכן מערבולת. יש לעקר באוטוקלאבה בטמפרטורה של 121°C תחת לחץ של 1.5 אטמ' למשך 20 דקות. לחילופין, בצעו עיקור על ידי גלי מיקרו עד לנקודת הרתיחה.
- לאחר התערובות הם autoclaved, צנטריפוגה ב 280 x גרם במשך 2 דקות בטמפרטורת החדר כדי להסיר בועות שנוצרו. שמור את הדיו הביולוגי בטמפרטורה של 37°C עד להכנת התאים.
- הוספת WJ-MSCs והדפסה ביולוגית תלת-ממדית
- לספירה, לשטוף את התאים כאשר יש מפגש 80% עם כ 5 מ"ל של PBS, ולהוסיף 5 מ"ל של 0.25% טריפסין ו 2.21 mM EDTA 4Na. להשאיר למשך 5 דקות ב 37 מעלות צלזיוס.
- הוסף 10 מ"ל של מדיום DMEM-F12 עם 10% FBS לתאים לאחר הסרת האינקובטור. להשהות היטב, לאסוף את המדיום, ולהעביר אותו צינור צנטריפוגה. צנטריפוגה ב 101 x גרם במשך 5 דקות בטמפרטורת החדר ולאחר מכן להשליך את supernatant.
- להשאיר כ 250 μL של בינוני עם הכדור. ממיסים מחדש את הגלולה ב 1 מ"ל של מדיום טרי. ל 48 μL של בינוני, להוסיף 2 μL של תרחיף התא ו 50 μL של כחול טריפאן (0.4 גרם טריפאן כחול / 100 מ"ל) בצינור חרוטי (1.5 מ"ל) לספירה4. פיפטה זה טוב.
- הוסיפו כ-10 מ"ל מתרחיף התאים המוכתם המוכן לתא ספירת תאי תומא. חשב את המספר הממוצע של תאים נופלים לתוך ריבועים משני הצדדים של מיקרוסקופ האור.
חישוב אחוז החיוניות (%) = (נספרים תאים בני קיימא/סך התאים שנספרו) x 100
הערה: האינטראקציה בין תא לביודיו נחקרת בשתי דרכים: (1) ניתן להדפיס אותה על-ידי הוספתה לדיו הביולוגי (3D-B; 3D-G); (2) התאים נזרעים על הביו-דיו לאחר לחיצה, והתאים יוצרים ספרואיד (3D-BS; 3D-GS). - לאינטראקציה בין תא לדיו ביולוגי, צור תחילה את קבוצות הדיו הביולוגי (טבלה 1). קבוצה 1 כוללת הדפסה בתלת-ממד-B ובתלת-ממד-G עם דיו ביולוגי לצורך הדפסה ביולוגית. קבוצה 2 כוללת ביודיו 3D-BS ו-3D-GS שעליהם נוצרו ספרואידים לאחר הדפסה ביולוגית.
- ספור את התאים עבור קבוצה 1 כך שיש בערך 1 x 107 תאים ב 0.5 מ"ל של בינוני. הוסף 4.5 מ"ל של דיו ביולוגי כדי להביא את הנפח הכולל ל -5 מ"ל. העבירו את זה למחסניות בארון הסטרילי בעזרת מזרקים. התקן את המחסניות באזור המכבש המתאים של המדפסת הביולוגית.
- עבור הקבוצה השנייה, לקחת 5 מ"ל מכל אחת מקבוצות bioink ולהעביר אותם מחסניות סטריליות בעזרת מזרק.
- השתמש במדפסת הביולוגית עם שני ראשי הדפסה קואקסיאליים וטכנולוגיית אקסטרוזיה פנאומטית. הגדר את רזולוציית X/Y/Z למיקרו-שלב ל- 1.25 מיקרומטר, את רוחב האקסטרוזיה ל- 400 מיקרומטר ואת גובה האקסטרוזיה ל- 200 מיקרומטר. רשת של 20 מ"מ x 20 מ"מ x 5 מ"מ היא אחד המודלים התלת-ממדיים הנפוצים ביותר לעבודה בהדפסה ביולוגית בתלת-ממד.
- צור את המודלים התלת-ממדיים באמצעות תוכניות CAD מבוססות אינטרנט בקוד פתוח. לפני הדפסה ביולוגית, צור מודלים תלת-ממדיים פשוטים עם אחת מפלטפורמות הקוד הפתוח (לדוגמה, מילוי). המודל יכול להיות ליניארי (כמו המודל המשמש כאן), חלת דבש או בצורת רשת. יצא והורד בפורמט .stl לאחר יצירת ריבוע של 5 מ"מ x 20 מ"מ x 20 מ"מ.
- תוכנת המדפסת הביולוגית משתמשת בקובצי .stl וממירה אותם לפורמט .gcode הניתן להדפסה באמצעות מודולים של כלי פריסה. כדי לקבל צורת רשת הניתנת להדפסה, הפוך את המעטפת החיצונית ללא זמינה במודול כלי הפריסה. נגב את המכשיר עם 70% אתנול לפני הפעולה ולאחר מכן עיקור על ידי עיקור UV.
- עבור תהליך ההדפסה הביולוגית, העבר את קבוצות הדיו הביולוגי למחסניות בעזרת מזרק. התקן את המחסניות באזור המכבש המתאים של המדפסת הביולוגית.
- הגדר את הלחץ הממוצע של מדפסת התלת-ממד ל- 7.5 psi ואת טמפרטורת המחסנית והמיטה ל- 37°C. הגדר את המהירות ל -60% ובצע תהליך הדפסה תלת מימדי סטנדרטי.
הערה: תכנון המודלים המוכנים עם רווחים (כמו מודל ליניארי) מאפשר לבצע תרבית תאים בחללים לאחר הדפסה ביולוגית. - שים את המערכת במצב ביתי בשלב הכתיבה. מקם את הצירים (X, Y, Z) באופן אוטומטי, בחר במכבש והגדר. התחל בתהליך ההדפסה. לאחר תהליך ההדפסה הביולוגית, קחו את הדגימה והניחו אותה מתחת לארון זרימה למינרי.
- רסס את הדיו הביולוגי בתמיסת CaCl2 0.1 N לאחר ההדפסה או הוסף 1 מ"ל של התמיסה עם פיפטה בטמפרטורת החדר. המתן כ- 10-20 שניות ושטוף את התבניות המודפסות 2x עם PBS המכיל Ca 2+ ו- Mg2+.
- הוסף 2 מ"ל של DMEMF-12 עם 10% FBS בינוני על גבי כל אחת מקבוצות הדיו הביולוגי המכילות תאים. לדגור על הצלחות ב 37 ° C עם 5% CO2. לאחר מכן, להוסיף 2 מ"ל של מדיום תרחיף המכיל 1 x 106 תאים לכל קבוצה עבור היווצרות spheroid .
- לדגור על הצלחות ב 37 ° C עם 5% CO2. לאחר דגירה של 24 שעות, צפו בהיווצרות הספרואידים תחת מיקרוסקופ הפוך.
- התמיינות WJ-MSCs לתאים דמויי נוירון
- התבונן וצלם את כל אצוות הדיו הביולוגי לאחר 24 שעות של דגירה. הוסף 2 מ"ל של מדיום התמיינות נוירוגני לכל באר (למעט קבוצת הביקורת) ורענן כל יומיים. עקוב במשך 7 ימים כדי לבחון התמיינות עצבית.
4. אפיון הידרוג'ל ביו-היברידי גרפן-ביואינק
הערה: הדמיית קיטועי זמן, ספקטרוסקופיית אינפרא אדום התמרת פורייה (FT/IR) ומיקרוסקופ אלקטרונים סורק (SEM) מבוצעים לאפיון הידרוג'ל ביו-היברידי גרפן-ביודיו. הדגימות נוצרות מקבוצות ביודיו 3D-B ו-3D-G בשיטת הטפטוף לניתוח FT/IR ו-SEM.
- ניתוח FT/IR
הערה: FT/IR היא שיטה אנליטית כימית המבוססת על התמרת פורייה המתמטית, הכרחית לאפיון חומרים. השתמש במכשיר FT/IR המבוסס על עקרונות אינטרפרומטר מייקלסון של 28°C, עם מנורת הלוגן, מקור אור כספית מקורר מים, יחס גובה-רוחב אות של 4 ס"מ−1, נמדד במשך דקה אחת, ב-2,200 ס"מ−1.- הכינו את המיקרוסקופ FT/IR וודאו שהאופטיקה של המכשיר מיושרת. כייל את ההתקן.
- מכיוון שהדגימה נמצאת בטיפה, לוקחים חתיכה של הידרוג'ל בעובי 1-2 מ"מ ומניחים אותה במלקחיים על חלק הדגימה. התמקדו בדגימה והעלו אותה עד ליצירת קשר קרוב. אסוף את ספקטרום הדגימה על ידי הפעלת התהליך מהמערכת.
- ניתוח מיקרוסקופ אלקטרונים סורק (SEM)
הערה: ניתן לבחון את המורפולוגיה של פני השטח, המבנה הפנימי, התפלגות התאים והאינטראקציות בין תאי ביו-דיו באמצעות ניתוח SEM בממדים שונים.- זרקו את ההידרוג'ל לתוך צלחות בנות 6 בארות המכילות 1 מ"ל של קרוסלינקר CaCl2 באמצעות שיטת טיפת קצה פיפטה (ראו איור 1).
- לשטוף את הצלחות 2x עם כ 1 מ"ל של PBS כדי לשחרר את הפתרון של מלחים. לאחר מכן, לשים טיפות אלה לתוך צינור בז המכיל 5 מ"ל של 5% paraformaldehyde בעזרת מלקחיים.
- צור מקטעים דקים מהדיו הביולוגי של הטיפה בעזרת אזמל. הדביקו את הדגימות בצד הדביק על לוח המתכת. הכניסו למכשיר הציפוי שבו פלדיום הזהב, העובר לשלב הפלזמה על ידי החלפת האוויר בגז ארגון, מכסה את הדגימה.
- שים אותו במיקרוסקופ אלקטרונים (SEM). פתח את תוכנית המיקרוסקופ שאליה מחובר ה- SEM. בצע את שינוי קנה המידה וצלם תמונות של חלקים שונים של הדגימה. עבור פרוטוקול זה נעשה שימוש בקשקשים של 5 מיקרומטר, 10 מיקרומטר ו-200 מיקרומטר. בסך הכל צולמו 40 תמונות עבור קבוצות 3D-B ו-3D-G.
- הדמיה עם קיטועי זמן
הערה: במהלך הדמיה בהילוך מהיר, לא רק דגימות ביו-דיו המכילות תאים מותמרים של גן GFP שימשו אלא גם ביו-דיו עם ספרואידים מצולמים במשך 16 שעות. הדמיה בהילוך מהיר מבוצעת כדי לבחון את ההשפעות של גרפן על תאי גזע ולנטר אינטראקציות תאים בתוך הביו-דיו.- הוסף MSCs זמינים מסחרית 1 x 107 GFP עם תווית 5 מ"ל של דיו ביולוגי והדפסה ביולוגית כמו בשלב 3.2.11. הוסף 1 מ"ל של crosslinker, להחזיק במשך 20-30 שניות, ולשטוף 2x עם PBS.
- הפעל את צג קיטועי הזמן ופתח את התוכנית במחשב. הגדר כ- 16 שעות במצב קיטועי זמן והגדר את הטמפרטורה ל- 37 ° C. לחץ על לחצן התחל . קטעי וידאו בצורה של 40 s time-lapse דגימות וידאו נרשמים על ידי המערכת.
- מקדו את המיקרוסקופ בהגדלה של פי 10 כל שעתיים. כמו כן, דמיינו את הספרואידים שנוצרו על ידי ביצוע אותם שלבים.
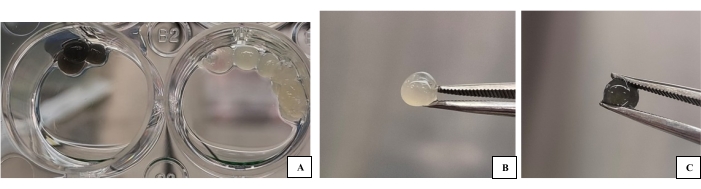
איור 1: קבוצות ביו-דיו 3D-B ו-3D-G שנוצרו כטיפות לשימוש באפיון . (A) דגימות ביו-דיו (תמונת טרום-אפיון) על לוח עם קרוסלינקר. (B) תמונת טיפה תלת-ממדית של ביו-דיו. (C) תמונת טיפת דיו ביו-דיו תלת-ממדית. החומר הביולוגי שיש לאפיין והתאים שהוא מכיל יכולים לעבור ביתר קלות תהליכים כגון ציפוי זהב, דגימה וכו '. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. קביעת התמיינות נוירוגנית בשיטת immunostaining
- אספו את הספרואידים, מבלי להפריע לצורות הכדוריות, וזרעו מחדש בצלחות חדשות כדי להכתים מחדש בשיטה קלה יותר, במקום להטמיע בפרפין לחיתוך רקמות.
- מכסים את צלחות 48 הבאר בכ -20 מ"ל של תמיסת ג'לטין 0.1% טרום אוטוקלאבד ושומרים באינקובטור לפחות שעה אחת. פיפטה כ 500 μL של מוכן 0.1% ג'לטין לתוך צלחות 48 באר. השאירו את הצלחות הג'לטיניות באינקובטור למשך 10 דקות.
הערה: זה יאפשר לג'לטין להתנפח מעט, לכסות את פני השטח וליצור סביבה טובה יותר עבור הספרואידים שנאספו להצמיד. - אוספים את הספרואידים על ידי פיפטינג, מפיצים את הספרואידים שנאספו מהאינקובטור לבארות של צלחת 48 הקידוחים, ומוסיפים מדיום טרי. לאחר מכן, לדגור במשך 12-24 שעות.
הערה: זה די קשה להפיץ את הספרואידים על ידי ספירה. לאסוף את הספרואידים בצינור אחד ולהפיץ באופן שווה את הנפח הכולל לבארות. עבור מחקר זה, כל באר הכילה כ 4-6 spheroids.
הערה: עבור דוגמיות דו-ממדיות, די בשטיפת כתמים מראש, ואין צורך בהחלפת מדיה. - הסר את המדיום ולשטוף לאט את התאים עם PBS כמו spheroids יהיה בחלק העליון. תקן ב 4% paraformaldehyde במשך 2 שעות.
- שטפו שוב את הדגימות עם PBS וחסמו עם כ-10 מ"ל של 2% BSA ו-0.1% TritonX למשך 30 דקות. לאחר מכן, שטפו עם PBS 3x.
- יש לדלל נוגדני פריימר נבחרים (N-cadherin-rabbit ו-β-III tubulin-mouse) ביחס של 1:100 עם תמיסת מגיב מדלל נוגדנים. הוסף 100 μL של תמיסת נוגדנים לכל אחת מהדגימות ודגור לילה ב 4 ° C.
- שטפו את הדגימות 3x עם PBS. יש לדגור עם ארנב IgG-FTIC-ארנב נגד עכבר עבור טובולין β-III ונוגדן משני נגד עכבר IgG-SC2781-עז עבור N-Cad מדולל ל-1:200 בטמפרטורת החדר למשך 30 דקות. בצע את כל הפעולות בחושך.
הערה: לא משנה איזה זן משמש כנוגדן העיקרי (למשל, עכבר) בכתמים כפולים, יש להשתמש בזן אחר (למשל, עז או ארנבת) עבור הנוגדן המשני. - שטפו את הנוגדן המשני עם PBS 3x ולאחר מכן טפטפו את תמיסת DAPI (1:1) לכל אחת מהדגימות. המתן 15-20 דקות. לבצע הדמיה immunofluorescence.
תוצאות
רעילות גרפן והדמיה דו-ממדית
ניתוח סטטיסטי של תוצאות MTT שהתקבלו נערך עם ANOVA חד-כיווני עם המבחן של Tukey בתוכנת ניתוח סטטיסטי, והגרף שהתקבל מוצג באיור 2. אחוז הגרפן בהשוואה לביקורת הראה ירידה משמעותית רק עבור ריכוז גרפן 0.001% (**p < 0.01).. לא נמצאו הבדלים משמעותיים בין הקבוצו...
Discussion
היתרונות של טיפולים המיושמים עם פיגומים תלת ממדיים מהונדסים על פני שיטות דו-ממדיות קונבנציונליות הופכים בולטים יותר ויותר מדי יום. תאי גזע המשמשים לבדם בטיפולים אלה או יחד עם פיגומים המיוצרים מביו-חומרים שונים בעלי תאימות ביולוגית נמוכה ומתכלות אינם מספיקים בדרך כלל בהתחדשות עצבית היקפ?...
Disclosures
המחברים מצהירים כי אין ניגוד עניינים. הפרויקט בוצע בשיתוף פעולה עם HD Bioink, מפתחת טכנולוגיית ההדפסה הביולוגית בתלת מימד.
Acknowledgements
הגרפן ששימש במחקר זה פותח באוניברסיטת קירקלרלי, המחלקה להנדסת מכונות. הוא נתרם על ידי ד"ר Karabeyoğlu. בדיקת רעילות הגרפן מומנה על ידי הפרויקט שכותרתו "הדפסה והתמיינות של תאי גזע מזנכימליים במדפסות ביולוגיות תלת-ממדיות עם ביו-דיו מסומם גרפן" (מספר יישום: 1139B411802273) שהושלם במסגרת תוכנית התמיכה בתזה לתואר ראשון TÜBİTAK 2209-B-Industry. החלק השני של המחקר נתמך על ידי קרן המחקר שסופקה על ידי Yildiz Technical University Scientific Research Projects (TSA-2021-4713). תאי גזע מזנכימליים עם GFP המשמשים בשלב ההדמיה בהילוך מהיר נתרמו על ידי Virostem Biotechnology. המחברים מודים ל-Darıcı LAB ולצוות YTU The Cell Culture and Tissue Engineering LAB על דיונים פרודוקטיביים.
Materials
| Name | Company | Catalog Number | Comments |
Centrifugal | Hitachi | Used in cell culture and biomaterial step | |
| 0.1N CaCl2 | HD Bioink | Used for crosslinker | |
| 0.22 µm membrane filter | Aιsιmo | Used for sterilization | |
| 0.45 µm syringe filter | Aιsιmo | Used for sterilization | |
| 1.5mL conic tube | Eppendorfa | Used for bioink drop | |
| 15mL Falcon tube | Nest | Used in cell culture step | |
| 25 cm2 cell culture flasks (Falcon, TPP tissue culture flasks | Nest | Used for cell culture | |
| 3D Bioprinting | Axolotl Biosystems Bio A2 (Turkey) | Bioprinting Step | |
| 50 mL Falcon tube | Nest | Used in cell culture step | |
| 6/24/48/96 well plates (Falcon, TPP microplates) | Merck Millipore | Used in cell culture step | |
| 75 cm2 cell culture flasks (Falcon, TPP tissue culture flasks | Nest | Used for cell culture | |
| Anti mouse IgG-FTIC-rabbit | Santa Cruz Biotechnology | J1514 | Seconder antibody, used for dye |
| Anti mouse IgG-SC2781-goat | Santa Cruz Biotechnology | C3109 | Seconder antibody, used for dye |
| Au coating device EM ACE600 | Leica | for gold plating of biomaterial section before SEM imaging | |
| Autoclave | NUVE-OT 90L | Used for the sterilization process. | |
| Autoclave | NUVE-OT 90L | Used for the sterilization process. | |
| Cell Cultre Cabine | Hera Safe KS | Used for the cell culture process | |
| Dulbecco's Modified Eagle's Medium/Nutrient Mixture-F12 | Sigma | RNBJ7249 | Used as cell culture medium |
| FEI QUANTA 450 FEG ESEM SEM | Quanta | FEG 450 | for SEM |
| Fetal Bovine Serum-FBS | Capricorn | FBS-16A | It was used by adding to the cell culture medium. |
| Freezer -80°C | Panasonic | MDF-U5386S-PE | We were used to store cells and the resulting exosomes |
| Gelatine-Alginate bioink powder | HD Bioink | Used for produced bioink step | |
| GFP labelled-WJ-MSCs | Virostem | Used for imaging to cell-bioink interaction | |
| Graphene nanoplatelets (Graphene-IGP2) | Grafen Chemical Industries Co. | Used for production 3D-G bioink | |
| Immunofluorescence antibodies (N-CAD; β-III Tubulin) | Cell Signalling and Santa Cruz | Used for dye | |
| JASCO 6600 | Tetra | for FTIR | |
| MTT Assay | Sigma | Viability testing | |
| Penicilin/Streptomycin Solution | Capricorn | PB-S | It was added to the medium to prevent contamination in cell culture. |
| Thoma slide | Isolab | Used for counting the cell | |
| Time-Lapse Imaging System | Zeiss Axio.Observer.Z1 | Imaging | |
| Tripsin-EDTA | Multicell | The flask was used to remove the cells covering the surface. | |
| Vorteks | Biobase | For produced bioink step | |
| WJ-MSCs | ATCC | Used for the cell culture process |
References
- Kamasak, B., et al. Peripheral Nerve Injuries and Physiotherapy. Clinical Physiotherapy. 19, (2019).
- Yegiyants, S., Dayicioglu, D., Kardashian, G., Panthaki, Z. J. Traumatic peripheral nerve injury: A wartime review. Journal of Craniofacial Surgery. 21 (4), 998-1001 (2010).
- Mushtaq, S., et al. Frequency of peripheral nerve injury in trauma in emergency settings. Cureus. 13 (3), 14195 (2021).
- Allahverdiyev, A. . Basic Principles of Somatic and Stem Cell Culture Systems, 1st Edition. , (2018).
- Allahverdiyev, A. M., et al. Adipose tissue-derived mesenchymal stem cells as a new host cell in latent leishmaniasis. The American Journal of Tropical Medicine and Hygiene. 85 (3), 535-539 (2011).
- Schofield, R. The relationship between the spleen colony-forming cell and the hemopoietic stem cell. Blood Cells. 4 (1-2), 7-25 (1978).
- Goodman, S. R. Stem Cells and Regenerative Medicine (Chapter 13). Goodman's Medical Cell Biology, Fourth Edition. , 361-380 (2021).
- Kaya, T. I. Tissue engineering. International Journal of Medical Sciences. 1 (48), 165-169 (2018).
- Sensharma, P., Madhumathi, R. G., Jayant, R. D., Jaiswal, A. K. Biomaterials and cells for neural tissue engineering: Current choices. Materials Science and Engineering: C. 7, 1302-1315 (2017).
- Hölzl, K., et al. Bioink properties before, during, and after 3D bioprinting. Biofabrication. 8 (3), 032002 (2016).
- Zheng, Y., et al. 2D nanomaterials for tissue engineering and regenerative nanomedicines: Recent advances and future challenges. Advanced Healthcare Materials. 10 (7), 2001743 (2021).
- Shin, S. R. Graphene-based materials for tissue engineering. Advanced Drug Delivery Reviews. 105, 255-274 (2016).
- Chen, M., Qin, X., Zeng, G. Biodegradation of carbon nanotubes, graphene, and their derivatives. Trends in Biotechnology. 35 (9), 836-846 (2017).
- Chen, S., et al. PAM/GO/Gel/SA composite hydrogel conduit with bioactivity for repairing peripheral nerve injury. Journal of Biomedical Materials Research Part A. 107, 1273-1283 (2019).
- Chiriac, S., Facca, S., Diaconu, M., Gouzou, S., Liverneaux, P. Experience of using the bioresorbable copolyester poly(DL-lactide-ε-caprolactone) nerve conduit guide Neurolac™ for nerve repair in peripheral nerve defects: Report on a series of 28 lesions. Journal of Hand Surgery (European Volume). 37 (4), 342-349 (2011).
- Karaaltin, A. B., et al. Human olfactory stem cells for injured facial nerve reconstruction in a rat model). Head & Neck. 38, 2011-2020 (2016).
- Bingham, J. R., et al. Stem cell therapy to promote limb function recovery in peripheral nerve damage in a rat model. Annals of Medicine and Surgery. 41, 20-28 (2019).
- Zhuang, H., et al. Gelatin-methacrylamide gel loaded with microspheres to deliver GDNF in bilayer collagen conduit promoting sciatic nerve growth. International Journal of Nanomedicine. 11, 1383-1394 (2016).
- Scheib, J., Hoke, A. Advances in peripheral nerve regeneration. Nature Reviews: Neurology. 9 (12), 668-676 (2013).
- Yurie, H., et al. The efficacy of a scaffold-free bio 3D conduit developed from human fibroblasts on peripheral nerve regeneration in a rat sciatic nerve model. PLOS ONE. 12 (2), 0171448 (2017).
- Guo, Y., et al. Assessment of the green florescence protein labeling method for tracking implanted mesenchymal stem cells. Cytotechnology. 64 (4), 391-401 (2012).
- Kose, C., Kacar, R., Zorba, A. P., Bagirova, M., Allahverdiyev, A. The effect of CO2 laser beam welded AISI 316L austenitic stainless steel on the viability of fibroblast cells, in vitro. Materials Science and Engineering: C. 60, 211-218 (2016).
- Liu, Y., et al. Bio-adenine-bridged molecular design approach toward non-covalent functionalized graphene by liquid-phase exfoliation. Journal of Materials Science. 55, 140-150 (2020).
- Rehman, S. Reduced graphene oxide incorporated GelMA hydrogel promotes angiogenesis for wound healing applications. International Journal of Nanomedicine. 14, 9603-9617 (2019).
- Bei, H. P., et al. Graphene-based nanocomposites for neural tissue engineering. Molecules. 24 (4), 658 (2019).
- Othman, S. A., et al. Alginate-gelatin bioink for bioprinting of HeLa spheroids in alginate-gelatin hexagon-shaped scaffolds. Polymer Bulletin. 78, 6115-6135 (2021).
- Peng, X. L., Li, Y., Zhang, G., Zhang, F., Fan, X. Functionalization of graphene with nitrile groups by cycloaddition of tetracyanoethylene oxide. Journal of Nanomaterials. 2013, 841789 (2013).
- Zorba Yildiz, A. P., et al. 3D therapeutic approaches for peripheral nerve damage. 9th International Molecular Biology and Biotechnology Congress Abstract Book. , (2020).
- Liau, L. L., Ruszymah, B. H. I., Ng, M. H., Law, J. X. Characteristics and clinical applications of Wharton's jelly-derived mesenchymal stromal cells. Current Research in Translational Medicine. 68 (1), 5-16 (2020).
- Yoo, J., et al. Augmented peripheral nerve regeneration through elastic nerve guidance conduits prepared using a porous PLCL membrane with a 3D printed collagen hydrogel. Biomaterials Science. 22, 1-12 (2020).
- Jansen, K., Meek, M. F., vander Werff, J. F. A., van Wachem, P. B., van Luyn, M. J. A. Long-term regeneration of the rat sciatic nerve through a biodegradable poly (DL-lactide-Ɛ-caprolactone) nerve guide: Tissue reactions with a focus on collagen III/IV reformation. Journal of Biomedical Materials Research. 69 (2), 334-341 (2016).
- Pathre, P., et al. PTP1B regulates neurite extension mediated by cell-cell and cell-matrix adhesion molecules. Journal of Neuroscience Research. 15, 143-150 (2001).
- Qing, L., Chen, H., Tang, J., Jia, X. Exosomes and their microRNA cargo: New players in peripheral nerve regeneration. Neurorehabilitation and Neural Repair. 32 (9), 765-776 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved