È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione e caratterizzazione di bioink idrogel bioibrido 3D a base di grafene per la neuroingegneria periferica
In questo articolo
Riepilogo
In questo manoscritto, dimostriamo la preparazione di un bioink idrogel bioibrido contenente grafene per l'uso nell'ingegneria dei tessuti periferici. Utilizzando questo materiale bioibrido 3D, viene eseguito il protocollo di differenziazione neurale delle cellule staminali. Questo può essere un passo importante per portare biomateriali simili alla clinica.
Abstract
Le neuropatie periferiche possono verificarsi a causa di danni assonali e, occasionalmente, a causa di malattie demielinizzanti. Il danno ai nervi periferici è un problema globale che si verifica nell'1,5% -5% dei pazienti di emergenza e può portare a significative perdite di posti di lavoro. Oggi, gli approcci basati sull'ingegneria tissutale, costituiti da scafffold, linee cellulari appropriate e biosegnali, sono diventati più applicabili con lo sviluppo di tecnologie di bioprinting tridimensionale (3D). La combinazione di vari biomateriali idrogel con cellule staminali, esosomi o molecole di bio-segnalazione è spesso studiata per superare i problemi esistenti nella rigenerazione dei nervi periferici. Di conseguenza, la produzione di sistemi iniettabili, come idrogel, o strutture di condotti impiantabili formate da vari metodi di bioprinting ha acquisito importanza nella neuroingegneria periferica. In condizioni normali, le cellule staminali sono le cellule rigenerative del corpo e il loro numero e le loro funzioni non diminuiscono con il tempo per proteggere le loro popolazioni; Queste non sono cellule specializzate, ma possono differenziarsi su stimolazione appropriata in risposta a lesioni. Il sistema delle cellule staminali è sotto l'influenza del suo microambiente, chiamato nicchia delle cellule staminali. Nelle lesioni dei nervi periferici, specialmente nella neurotmesi, questo microambiente non può essere completamente salvato anche dopo aver legato chirurgicamente le terminazioni nervose recise insieme. L'approccio dei biomateriali compositi e delle terapie cellulari combinate aumenta la funzionalità e l'applicabilità dei materiali in termini di varie proprietà come biodegradabilità, biocompatibilità e processabilità. Di conseguenza, questo studio mira a dimostrare la preparazione e l'uso di pattern idrogel bioibridi a base di grafene e ad esaminare l'efficienza di differenziazione delle cellule staminali in cellule nervose, che può essere una soluzione efficace nella rigenerazione nervosa.
Introduzione
Il sistema nervoso, che è il meccanismo che collega la struttura interna dell'organismo e l'ambiente, è diviso in due parti: il sistema nervoso centrale e periferico. Il danno ai nervi periferici è un problema globale che costituisce l'1,5%-5% dei pazienti che si presentano al pronto soccorso e si sviluppa a causa di vari traumi, portando a una significativa perdita del lavoro 1,2,3.
Oggi, gli approcci cellulari alla neuroingegneria periferica sono di grande interesse. Le cellule staminali sono al primo posto tra le cellule utilizzate in questi approcci. In condizioni normali, le cellule staminali sono le cellule rigenerative del corpo e il loro numero e le loro funzioni non diminuiscono con il tempo per proteggere le loro popolazioni; Queste cellule sono specializzate ma possono differenziarsi su stimolazione appropriata in risposta alla lesione 4,5. Secondo l'ipotesi delle cellule staminali, il sistema delle cellule staminali è sotto l'influenza del suo microambiente, chiamato nicchia delle cellule staminali. La conservazione e la differenziazione delle cellule staminali sono impossibili senza la presenza del loro microambiente6, che può essere ricostituito attraverso l'ingegneria tissutale utilizzando cellule e scaffold7. L'ingegneria tissutale è un campo multidisciplinare che include sia principi di ingegneria che di biologia. L'ingegneria tissutale fornisce strumenti per la creazione di tessuti artificiali che possono sostituire i tessuti viventi e possono essere utilizzati nella rigenerazione di questi tessuti rimuovendo i tessuti danneggiati e fornendo tessuti funzionali8. Gli scaffold tissutali, uno dei tre capisaldi dell'ingegneria tissutale, sono prodotti utilizzando metodi diversi da materiali naturali e sintetici9. La stampa tridimensionale (3D) è una tecnologia di produzione additiva emergente ampiamente utilizzata per sostituire o ripristinare i tessuti difettosi attraverso la sua produzione semplice ma versatile di forme complesse utilizzando vari metodi. Il bioprinting è un metodo di produzione additiva che consente la coesistenza di cellule e biomateriali, chiamato bioinks10. Considerando l'interazione delle cellule nervose tra loro, gli studi si sono spostati su candidati biomateriali conduttivi come il grafene. Le nanopiastre di grafene, che hanno proprietà quali elettronica flessibile, supercondensatori, batterie, ottica, sensori elettrochimici e accumulo di energia, sono un biomateriale preferito nel campo dell'ingegneria tissutale11. Il grafene è stato utilizzato in studi in cui sono state eseguite la proliferazione e la rigenerazione di tessuti e organi danneggiati12,13.
L'ingegneria tissutale è costituita da tre elementi costitutivi di base: impalcatura, cellule e molecole di biosegnale. Ci sono carenze negli studi sul danno ai nervi periferici in termini di fornitura completa di queste tre strutture. Sono stati riscontrati vari problemi nei biomateriali prodotti e utilizzati negli studi, come ad esempio contenenti solo cellule staminali o molecole di biosegnale, la mancanza di una molecola bioattiva che consenta la differenziazione delle cellule staminali, la mancanza di biocompatibilità del biomateriale utilizzato e il basso effetto sulla proliferazione delle cellule nella nicchia tissutale, e, quindi, la conduzione nervosa non è pienamente realizzata 2,13,14,15,16. Ciò richiede l'ottimizzazione della rigenerazione nervosa, riducendo l'atrofia muscolare 17,18 e creando il necessario homing19 con fattori di crescita contro tali problemi. A questo punto, la caratterizzazione e l'analisi della neuro-attività di un prototipo di biomateriale chirurgico, da trasferire in clinica, sono molto importanti.
Di conseguenza, questo studio sui metodi studia il pattern dell'idrogel bioink con nanopiastre di grafene formate da un bioprinter 3D e la sua efficacia sulla differenziazione neurogena delle cellule staminali che contiene. Inoltre, vengono studiati gli effetti del grafene sulla formazione e differenziazione della neurosfera.
Protocollo
1. Coltura delle cellule staminali mesenchimali gelatinose di Wharton
- Prelevare le cellule staminali mesenchimali gelatinose di Wharton (WJ-MSCs, da ATCC) da un congelatore a -80 °C. WJ-MSCs di coltura in terreno DMEM-F12 contenente il 10% di siero fetale di vitello (FBS), l'1% di Pen-strep e l'1% di L-glutammina in un flusso laminare sterile a temperatura ambiente, come descritto in Yurie et al.20.
- Crioconservare alcune cellule a 1 x 106 cellule/ml con mezzo di congelamento contenente il 35% di FBS, il 55% di DMEMF-12 e il 10% di dimetilsolfossido (DMSO). Per questo, contare 1 x 106 celle su un vetrino di conteggio delle cellule Thoma e aggiungere la soluzione di congelamento a goccia. Trasferire rapidamente il vetrino in un contenitore di azoto liquido.
- Quando le cellule in coltura sono confluenti all'80% nel pallone, versare il mezzo e lavare con 5 ml di PBS. Aggiungere 5 mL di tripsina allo 0,25% e 2,21 mM EDTA-4Na. Incubare in incubatrice a 37 °C per 5 min.
- Aggiungere 10 mL di terreno DMEM-F12 con il 10% di FBS alle cellule rimosse dall'incubatore. Sospenderlo bene, raccogliere il mezzo e trasferire il mezzo in un tubo da centrifuga.
- Centrifugare ad una velocità di rotazione di 101 x g per 5 minuti a temperatura ambiente. Scartare il surnatante e riseminare le cellule in nuovi palloni con un mezzo nutritivo fresco contenente il 10% di FBS.
NOTA: Le WJ-MSC commerciali marcate con il gene GFP con il metodo di trasduzione possono essere utilizzate per visualizzare meglio le interazioni biomateriale-cellula da produrre21. I gruppi da utilizzare in questo metodo possono essere creati come illustrato nella tabella 1.
| Gruppi creati | Motivi per creare | Numero di ripetizioni | ||
| 2D WJ-MSC (2D-C) | Controllo 2D | x 5 | ||
| 2D WJ-MSC e grafene (2D-G) | Determinazione della dose tossica del grafene in 2D | x 5 ripetizioni per ciascuna delle diverse concentrazioni | ||
| Le WJ-MSC sono incluse nei bioink (3D-B) | Controllo 3D | x 3 | ||
| WJ-MSC e 0,1% di grafene sono inclusi nei bioink (3D-G) | 3D Graphene-Bioink Biohybrid Group | x 3 | ||
| Le WJ-MSC sono in forma sferoidale sui bioink (3D-BS) | Controllo 3D della forma sferoidale | x 3 | ||
| WJ-MSC e 0,1% di grafene sono in forma sferoidale sui bioink (gruppo 3D-GS) | Gruppo bioibrido 3D Graphene-Bioink di forma sferoidale | x3 | ||
| Goccia 3D Bioink | Viene prodotto per l'analisi di caratterizzazione SEM e FTIR. | x5 | ||
| Goccia di grafene 3D | Viene prodotto per l'analisi di caratterizzazione SEM e FTIR. | x5 | ||
| Bioink 3D con WJ-MSC etichettati GFP e 0,1% | Osservazione dei movimenti di WJ-MsCs nel bioink contenente la dose appropriata di grafene. | x3 | ||
Tabella 1. Gruppi nel metodo. Sono inclusi tutti i gruppi 2D e 3D nel metodo.
2. Tossicità del grafene e imaging 2D
- Preparazione delle concentrazioni di grafene e applicazione alle cellule
NOTA: Le nanoparticelle di grafene grezzo sono state acquistate commercialmente (tipo nanopiastre di grafene industriale) e sono state anche donate. Le dimensioni delle particelle erano 5-8 nm di spessore, 5 μm di diametro e 120-150 m2 / g di superficie.- Pesare il grafene per creare una soluzione all'1% (mg/ml). Fare una soluzione madre aggiungendo 10 ml di terreno DMEMF-12 con il 10% di FBS ai 100 μg pesati di nanoparticelle di grafene ed etichettare questa soluzione come soluzione madre. Sterilizzare in autoclave a 121 °C sotto pressione di 1,5 atm per 20 minuti.
NOTA: La miscela sterile di grafene viene conservata in frigorifero a 4 °C fino all'uso. Potrebbe non essere adatto per l'uso a lungo termine (massimo 1 mese). In questi casi, la miscela deve essere ricostituita e sterilizzata. - Preparare una miscela di grafene medio a diverse concentrazioni per determinare le dosi non tossiche. Impostare le diluizioni iniziali come 1%, 0,1%, 0,01%, 0,001% e 0,0001% grafene/media.
- A partire dalla soluzione madre all'1%, prelevare successivamente 1 mL da ciascuna concentrazione e trasferirla in una nuova provetta. Aggiungere 9 ml di terreno DMEMF-12 con il 10% di FBS a ciascuna provetta, facendo cinque campioni gradualmente diluiti, e agitare e vortice le soluzioni per ottenere una distribuzione uniforme. Utilizzare solo 10 ml di terreno DMEMF-12 con FBS al 10% come controllo.
NOTA: Le pesanti scaglie di grafene precipitano e, quindi, devono essere ridistribuite. - Seminare le WJ-MSC in piastre da 6 pozzetti con 2 ml di terreno fresco contenente il 10% di FBS a 5 x 105 cellule per pozzetto. Incubare per 1 giorno a 37 °C. Quindi, dividere le piastre in gruppi di pozzi uguali e ripetuti. Fai cinque ripetizioni per ogni concentrazione.
- Scartare il mezzo e quindi sostituirlo con concentrazioni di terreno di grafene a 2 ml per pozzetto. Utilizzare solo il supporto per il gruppo di controllo. Incubare le piastre a 37 °C per 24 h.
- Pesare il grafene per creare una soluzione all'1% (mg/ml). Fare una soluzione madre aggiungendo 10 ml di terreno DMEMF-12 con il 10% di FBS ai 100 μg pesati di nanoparticelle di grafene ed etichettare questa soluzione come soluzione madre. Sterilizzare in autoclave a 121 °C sotto pressione di 1,5 atm per 20 minuti.
- Determinazione delle concentrazioni non tossiche di grafene con MTT
- Scartare i supporti con grafene dopo 24 ore. Lavare bene ogni pozzetto con PBS. Aggiungere DMEMF-12 fresco con 10% FBS a 2mL per pozzetto.
NOTA: È importante lavare con PBS dopo l'applicazione di concentrazioni di grafene sulla cellula perché le nanoparticelle di grafene, che non vengono introdotte nella cellula dall'endocitosi, vengono rimosse dall'ambiente. Questo rende il test MTT più efficiente. - Utilizzare il protocollo MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difenil-tetrazolium bromuro) per determinare il valore IC50 che indica il 50% di vitalità cellulare, come descritto in Kose et al.22 e nei passaggi 2.2.3.-2.2.6.
- In primo luogo, pesare 5 mg / ml di sale MTT e sciogliere in PBS. Sterilizzare con un filtro da 0,45 μm. Avvolgere la soluzione MTT, realizzata in una provetta da centrifuga da 15 ml, con un foglio di alluminio e conservare a 4 °C.
- Aggiungere 10 μL di MTT in tutti i pozzetti e incubare la piastra per 4 ore a 37 °C. Osservare la formazione di cristalli di formazan con ingrandimento 10x al microscopio dopo l'incubazione.
- Per sciogliere i cristalli formati nelle cellule, aggiungere 100 μL di DMSO a ciascun pozzetto e mescolare mediante pipettaggio. Tenere la piastra al buio a temperatura ambiente per 30 minuti. Inserire la piastra nel lettore di piastre ELISA. Impostare una lunghezza d'onda di 570 nm dal programma per la misura dell'assorbanza e fargli leggere la piastra22.
NOTA: Inoltre, mentre le particelle di grafene da sole vengono lette a 270 nm23, l'intervallo di lettura di 570 nm24 qui sarà solo per la lettura della vitalità cellulare. - Eseguire analisi statistiche sui risultati ottenuti utilizzando ANOVA unidirezionale con il test di Tukey in un programma di analisi statistica.
- Scartare i supporti con grafene dopo 24 ore. Lavare bene ogni pozzetto con PBS. Aggiungere DMEMF-12 fresco con 10% FBS a 2mL per pozzetto.
- Imaging dei punti
- Per esaminare l'interazione di diverse concentrazioni di grafene con le cellule, eseguire un time-lapse delle cellule con il metodo chiamato stitch imaging. Questo metodo crea un'immagine time-lapse utilizzando campioni di immagini prelevati a intervalli regolari al microscopio.
- A tale scopo, accendere prima il computer. Accendere l'incubatore di imaging time-lapse e impostarlo a 37 °C. Posizionare la piastra MTT nello slot dell'incubatore time-lapse.
- Aprire il programma Stitch sul computer. Specificare i pozzetti da leggere nel sistema. Porta il lettore al primo pozzo e individua e focalizza l'area con un ingrandimento 10x in luce bianca. Avviare il programma.
NOTA: È un programma per la creazione di collage fotografici multipli di 4 righe x 5 colonne di alta qualità. Il programma combina le foto scattate una dopo l'altra in qualità HD. Quando si preme il pulsante di avvio del sistema, i pozzetti vengono letti automaticamente, e prende e cuce 4 righe x 5 colonne più foto.
3. Grafene - Produzione di idrogel bioibrido Bioink e differenziazione WJ-MSCs
- Produzione di bioink
NOTA: Le polveri di Alginato-Gelatina (3:5) liofilizzate disponibili in commercio sono utilizzate come base dei bioink. Il gruppo bioink grafene (3D-G; 3D-GS) e il gruppo bioink di controllo privo di grafene (3D-B; 3D-BS) sono preparati con lo stesso metodo (Tabella 1).- Utilizzare tubi conici da 50 ml per la preparazione. In primo luogo, pesare 4,5 mg di alginato e 1,5 mg di gelatina e trasferire in una provetta da centrifuga. Aggiungere DMEMF-12 mezzo contenente il 10% di FBS alla miscela per un volume totale di 50 ml. Questo è il gruppo di controllo (C) senza grafene.
- Ripetere il peso di 4,5 mg di alginato e 1,5 mg di gelatina e trasferire in una provetta da centrifuga. Quindi, prendere 50 μL del grafene preparato allo 0,1% dal punto 2.1.3. e aggiungilo al tubo. Aggiungere DMEMF-12 con FBS al 10% per un volume totale di 50 ml.
- Mescolare i bioink prima mediante pipettaggio e poi vortice. Sterilizzare in autoclave a 121 °C sotto pressione di 1,5 atm per 20 minuti. In alternativa, eseguire la sterilizzazione mediante microonde fino al punto di ebollizione.
- Dopo l'autoclave delle miscele, centrifugare a 280 x g per 2 minuti a temperatura ambiente per rimuovere le bolle formate. Mantenere i bioink a 37 °C fino a quando le cellule non sono pronte.
- Aggiunta di WJ-MSC e bioprinting 3D
- Per il conteggio, lavare le cellule quando c'è una confluenza dell'80% con circa 5 ml di PBS e aggiungere 5 ml di tripsina allo 0,25% e 2,21 mM di EDTA 4Na. Lasciare agire per 5 min a 37 °C.
- Aggiungere 10 ml di terreno DMEM-F12 con il 10% di FBS alle cellule dopo aver rimosso dall'incubatore. Sospendi bene, raccogli il mezzo e trasferiscilo in un tubo da centrifuga. Centrifugare a 101 x g per 5 minuti a temperatura ambiente e poi scartare il surnatante.
- Lasciare circa 250 μL di terreno con il pellet. Risciogliere il pellet in 1 mL di terreno fresco. A 48 μL di terreno, aggiungere 2 μL di sospensione cellulare e 50 μL di blu tripano (0,4 g di blu tripano/100 ml) in un tubo conico (1,5 ml) per il conteggio4. Pipetta bene.
- Aggiungere circa 10 ml della sospensione di cellule colorate preparata in una camera di conteggio delle cellule Thoma. Calcola il numero medio di cellule che cadono nei quadrati su entrambi i lati del microscopio ottico.
Calcola la percentuale di vitalità (%) = (cellule vitali conteggiate/cellule totali contate) x 100
NOTA: L'interazione cellula-bioink è studiata in due modi: (1) Può essere stampata aggiungendola ai bioink (3D-B; 3D-G); (2) Le cellule vengono seminate sui bioink dopo essere state pressate e le cellule formano uno sferoide (3D-BS; 3D-GS). - Per l'interazione cellula-bioink, creare prima i gruppi bioink (Tabella 1). Il gruppo 1 include 3D-B e 3D-G stampati con bioink per bioprinting. Il gruppo 2 comprende bioink 3D-BS e 3D-GS su cui si sono formati sferoidi dopo il bioprinting.
- Contare le cellule per il gruppo 1 in modo che ci siano circa 1 x 107 cellule in 0,5 ml di terreno. Aggiungere 4,5 ml di bioink per portare il volume totale a 5 ml. Trasferirlo nelle cartucce nell'armadio sterile con l'aiuto di siringhe. Installare le cartucce nella sezione estrusore corrispondente del bioprinter.
- Per il secondo gruppo, prelevare 5 ml da ciascuno dei gruppi di bioink e trasferirli in cartucce sterili con l'aiuto di un iniettore.
- Utilizzare la bioprinter con due testine di stampa coassiali e la tecnologia di estrusione pneumatica. Impostare la risoluzione X/Y/Z per microstep su 1,25 μm, la larghezza di estrusione su 400 μm e l'altezza di estrusione su 200 μm. Una griglia di 20 mm x 20 mm x 5 mm è uno dei modelli 3D più utilizzati per il lavoro di bioprinting 3D.
- Creare i modelli 3D utilizzando programmi CAD open source basati sul Web. Prima del bioprinting, crea semplici modelli 3D con una delle piattaforme open source (ad esempio, infill). Il modello può essere lineare (come il modello utilizzato qui), a nido d'ape o a forma di griglia. Esporta e scarica in formato .stl dopo aver creato un quadrato di 5 mm x 20 mm x 20 mm.
- Il software bioprinter utilizza file .stl e li converte in formato .gcode stampabile utilizzando moduli affettatrice. Per ottenere una forma griglia stampabile, disattivate il guscio esterno nel modulo filtro dei dati. Pulire il dispositivo con etanolo al 70% prima dell'operazione e quindi sterilizzare mediante sterilizzazione UV.
- Per il processo di bioprinting, trasferire i gruppi bioink alle cartucce con l'aiuto di un iniettore. Installare le cartucce nella sezione estrusore corrispondente del bioprinter.
- Impostare la pressione media della stampante 3D su 7,5 psi e la temperatura della cartuccia e del letto su 37 °C. Imposta la velocità al 60% ed esegui un processo di stampa 3D standard.
NOTA: La pianificazione dei modelli preparati con spazi (come un modello lineare) consente di eseguire la coltura cellulare negli spazi dopo il bioprinting. - Mettere il sistema nella posizione iniziale durante la fase di scrittura. Posizionare automaticamente gli assi (X, Y, Z), selezionare l'estrusore e impostare. Avviare il processo di stampa. Dopo il processo di bioprinting, prelevare il campione e posizionarlo sotto una cabina a flusso laminare.
- Spruzzare i bioink con una soluzione di CaCl 2 0,1 N dopo la stampa o aggiungere 1 mLdella soluzione con una pipetta a temperatura ambiente. Attendere circa 10-20 secondi e lavare i modelli stampati 2x con PBS contenente Ca 2+ e Mg2+.
- Aggiungere 2 ml di DMEMF-12 con il 10% di terreno FBS sopra ciascuno dei gruppi bioink contenenti cellule. Incubare le piastre a 37 °C con il 5% di CO2. Successivamente, aggiungere 2 ml di terreno di sospensione contenente 1 x 106 cellule a ciascun gruppo per la formazione di sferoidi.
- Incubare le piastre a 37 °C con il 5% di CO2. Dopo 24 ore di incubazione, osservare la formazione sferoidale al microscopio invertito.
- Differenziazione delle WJ-MSCs in cellule simili ai neuroni
- Osservare e fotografare tutti i lotti di bioink dopo 24 ore di incubazione. Aggiungere 2 ml di terreno di differenziazione neurogena per pozzetto (ad eccezione del gruppo di controllo) e aggiornare ogni 2 giorni. Seguire per 7 giorni per osservare la differenziazione neurale.
4. Caratterizzazione dell'idrogel bioibrido Graphene-Bioink
NOTA: L'imaging time-lapse, la spettroscopia infrarossa a trasformata di Fourier (FT/IR) e la microscopia elettronica a scansione (SEM) vengono eseguite per la caratterizzazione dell'idrogel bioibrido grafene-bioink. I campioni vengono creati da gruppi di bioink 3D-B e 3D-G con il metodo a goccia per l'analisi FT / IR e SEM.
- Analisi FT/IR
NOTA: FT/IR è un metodo chimico analitico basato sulla trasformata matematica di Fourier, indispensabile per la caratterizzazione dei materiali. Utilizzare un dispositivo FT/IR basato sui principi dell'interferometro Michelson a 28 °C, con lampada alogena, sorgente luminosa al mercurio raffreddata ad acqua, rapporto di aspetto del segnale di 4 cm−1, misurato per 1 minuto, a 2.200 cm−1.- Preparare il microscopio FT/IR e assicurarsi che l'ottica dello strumento sia allineata. Calibrare il dispositivo.
- Poiché il campione è in una goccia, prendere un pezzo di idrogel spesso 1-2 mm e posizionarlo con una pinza sulla parte del campione. Concentrarsi sul campione e sollevarlo fino a quando non viene stabilito uno stretto contatto. Raccogliere lo spettro del campione avviando il processo dal sistema.
- Analisi al microscopio elettronico a scansione (SEM)
NOTA: La morfologia superficiale, la struttura interna, la distribuzione cellulare e le interazioni bioink-cellula possono essere esaminate mediante analisi SEM in diverse dimensioni.- Far cadere l'idrogel in piastre a 6 pozzetti contenenti 1 mL di reticolante CaCl2 utilizzando il metodo delle gocce della punta della pipetta (vedere Figura 1).
- Lavare le piastre 2x con circa 1 mL di PBS per liberare la soluzione dai sali. Quindi, mettere queste gocce in un tubo di falco contenente 5 ml di paraformaldeide al 5% con l'aiuto di una pinza.
- Crea sezioni sottili dai bioink a goccia con l'aiuto di un bisturi. Incollare i campioni sul lato adesivo sulla piastra metallica. Inserire nel dispositivo di rivestimento dove il palladio d'oro, che passa nella fase di plasma sostituendo l'aria con gas argon, copre il campione.
- Mettilo nel microscopio elettronico (SEM). Aprire il programma del microscopio a cui è collegato il SEM. Eseguire il ridimensionamento e acquisire immagini di diverse parti del campione. Per questo protocollo sono state utilizzate scale da 5 μm, 10 μm e 200 μm. Un totale di 40 immagini sono state scattate per i gruppi 3D-B e 3D-G.
- Imaging time-lapse
NOTA: Durante l'imaging time-lapse, non sono stati utilizzati solo campioni di bioink contenenti cellule trasformate del gene GFP, ma anche bioink con sferoidi vengono visualizzati per 16 ore. L'imaging time-lapse viene eseguito per esaminare gli effetti del grafene sulle cellule staminali e per monitorare le interazioni cellulari all'interno del bioink.- Aggiungere 1 x 10 7 MSC marcaticon GFP disponibili in commercio in 5 mL di bioink e bioprint come al punto 3.2.11. Aggiungere 1 mL di reticolante, tenere premuto per 20-30 s e lavare 2 volte con PBS.
- Accendi il monitor time-lapse e apri il programma sul computer. Impostare circa 16 h in modalità Time-Lapse e impostare la temperatura su 37 °C. Premere il pulsante Start . I video sotto forma di campioni video time-lapse di 40 s vengono registrati dal sistema.
- Mettere a fuoco il microscopio con un ingrandimento 10x ogni 2 ore. Inoltre, visualizza gli sferoidi creati seguendo gli stessi passaggi.
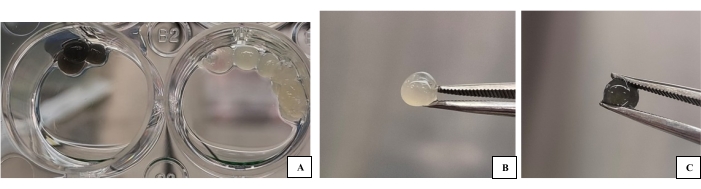
Figura 1: Gruppi di bioink 3D-B e 3D-G prodotti come gocce per l'uso nella caratterizzazione. (A) Campioni di bioink (immagine di pre-caratterizzazione) su una lastra con reticolante. (B) Immagine di goccia 3D-B di bioink. (C) Immagine della goccia del bioink 3D-G. Il biomateriale da caratterizzare e le cellule che contiene possono passare più facilmente attraverso processi come la doratura, il campionamento, ecc. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Determinazione della differenziazione neurogena mediante metodo immunocolorante
- Raccogli gli sferoidi, senza interrompere le forme di sfere, e riseminali in nuove piastre per ricolorarli con un metodo più semplice, invece di incorporarli in paraffina per il sezionamento dei tessuti.
- Coprire le piastre a 48 pozzetti con circa 20 ml di soluzione di gelatina allo 0,1% pre-autoclavata e conservare in un incubatore per almeno 1 ora. Pipettare circa 500 μL di gelatina preparata allo 0,1% in piastre da 48 pozzetti. Lasciare le piastre gelatinose nell'incubatore per 10 minuti.
NOTA: Ciò consentirà alla gelatina di gonfiarsi leggermente, coprendo la superficie e creando un ambiente migliore per gli sferoidi raccolti. - Raccogliere gli sferoidi mediante pipettaggio, distribuire gli sferoidi raccolti dall'incubatore nei pozzetti della piastra a 48 pozzetti e aggiungere terreno fresco. Quindi, incubare per 12-24 ore.
NOTA: È abbastanza difficile distribuire gli sferoidi contando. Raccogliere gli sferoidi in un singolo tubo e distribuire uniformemente il volume totale ai pozzetti. Per questo studio, ogni pozzo conteneva circa 4-6 sferoidi.
NOTA: Per i campioni 2D, è sufficiente il lavaggio pre-macchia e non è necessaria alcuna sostituzione del supporto. - Rimuovere il mezzo e lavare lentamente le cellule con PBS poiché gli sferoidi saranno in cima. Fissare in paraformaldeide al 4% per 2 ore.
- Lavare nuovamente i campioni con PBS e bloccare con circa 10 ml di BSA al 2% e TritonX allo 0,1% per 30 minuti. Quindi, lavare con PBS 3x.
- Diluire gli anticorpi primer selezionati (N-caderina-coniglio e β-III tubulina-topo) in rapporto 1:100 con soluzione di reagente diluente anticorpale. Aggiungere 100 μL di soluzione anticorpale a ciascuno dei campioni e incubare per una notte a 4 °C.
- Lavare i campioni 3 volte con PBS. Incubare con coniglio anti-topo IgG-FTIC-per tubulina β-III e anticorpo secondario anti-topo IgG-SC2781-capra per N-Cad diluito a 1:200 a temperatura ambiente per 30 min. Esegui tutte le operazioni al buio.
NOTA: Qualunque ceppo venga utilizzato come anticorpo primario (ad es. topo) nella doppia colorazione, un ceppo diverso (ad es. capra o coniglio) deve essere usato per l'anticorpo secondario. - Lavare l'anticorpo secondario con PBS 3x e quindi gocciolare la soluzione DAPI (1:1) in ciascuno dei campioni. Attendere 15-20 minuti. Eseguire l'imaging a immunofluorescenza.
Risultati
Tossicità del grafene e imaging 2D
L'analisi statistica dei risultati MTT ottenuti è stata condotta con un ANOVA unidirezionale con il test di Tukey nel software di analisi statistica e il grafico ottenuto è mostrato nella Figura 2. La percentuale di grafene rispetto al controllo ha mostrato una diminuzione significativa solo per la concentrazione di grafene dello 0,001% (**p < 0,01). Non ci sono state differenze significative tra gli altri gruppi e il controllo (p > 0...
Discussione
I vantaggi dei trattamenti applicati con scaffold 3D ingegnerizzati rispetto ai metodi 2D convenzionali stanno diventando sempre più evidenti ogni giorno. Le cellule staminali utilizzate da sole in queste terapie o insieme a scaffold prodotti da vari biomateriali con bassa biocompatibilità e biodegradabilità sono solitamente inadeguate nella rigenerazione dei nervi periferici. Le cellule staminali mesenchimali gelatinose di Wharton (WJ-MSCs) sembrano essere una linea cellulare candidata adatta, soprattutto considerand...
Divulgazioni
Gli autori dichiarano che non vi è conflitto di interessi. Il progetto è stato eseguito in collaborazione con HD Bioink, sviluppatore della tecnologia di bioprinting 3D.
Riconoscimenti
Il grafene utilizzato in questo studio è stato sviluppato presso l'Università di Kirklareli, Dipartimento di Ingegneria Meccanica. È stato donato dal Dr. Karabeyoğlu. Il test di tossicità del grafene è stato finanziato dal progetto intitolato "Printing and Differentiation of Mesenchymal Stem Cells on 3D Bioprinters with Graphene Doped Bioinks" (Domanda n.: 1139B411802273) completato nell'ambito del TÜBİTAK 2209-B-Industry-Oriented Undergraduate Thesis Support Program. L'altra parte dello studio è stata supportata dal fondo di ricerca fornito da Yildiz Technical University Scientific Research Projects (TSA-2021-4713). Le cellule staminali mesenchimali con GFP utilizzate nella fase di imaging time-lapse sono state donate da Virostem Biotechnology. Gli autori ringraziano Darıcı LAB e il team YTU The Cell Culture and Tissue Engineering LAB per le discussioni produttive.
Materiali
| Name | Company | Catalog Number | Comments |
Centrifugal | Hitachi | Used in cell culture and biomaterial step | |
| 0.1N CaCl2 | HD Bioink | Used for crosslinker | |
| 0.22 µm membrane filter | Aιsιmo | Used for sterilization | |
| 0.45 µm syringe filter | Aιsιmo | Used for sterilization | |
| 1.5mL conic tube | Eppendorfa | Used for bioink drop | |
| 15mL Falcon tube | Nest | Used in cell culture step | |
| 25 cm2 cell culture flasks (Falcon, TPP tissue culture flasks | Nest | Used for cell culture | |
| 3D Bioprinting | Axolotl Biosystems Bio A2 (Turkey) | Bioprinting Step | |
| 50 mL Falcon tube | Nest | Used in cell culture step | |
| 6/24/48/96 well plates (Falcon, TPP microplates) | Merck Millipore | Used in cell culture step | |
| 75 cm2 cell culture flasks (Falcon, TPP tissue culture flasks | Nest | Used for cell culture | |
| Anti mouse IgG-FTIC-rabbit | Santa Cruz Biotechnology | J1514 | Seconder antibody, used for dye |
| Anti mouse IgG-SC2781-goat | Santa Cruz Biotechnology | C3109 | Seconder antibody, used for dye |
| Au coating device EM ACE600 | Leica | for gold plating of biomaterial section before SEM imaging | |
| Autoclave | NUVE-OT 90L | Used for the sterilization process. | |
| Autoclave | NUVE-OT 90L | Used for the sterilization process. | |
| Cell Cultre Cabine | Hera Safe KS | Used for the cell culture process | |
| Dulbecco's Modified Eagle's Medium/Nutrient Mixture-F12 | Sigma | RNBJ7249 | Used as cell culture medium |
| FEI QUANTA 450 FEG ESEM SEM | Quanta | FEG 450 | for SEM |
| Fetal Bovine Serum-FBS | Capricorn | FBS-16A | It was used by adding to the cell culture medium. |
| Freezer -80°C | Panasonic | MDF-U5386S-PE | We were used to store cells and the resulting exosomes |
| Gelatine-Alginate bioink powder | HD Bioink | Used for produced bioink step | |
| GFP labelled-WJ-MSCs | Virostem | Used for imaging to cell-bioink interaction | |
| Graphene nanoplatelets (Graphene-IGP2) | Grafen Chemical Industries Co. | Used for production 3D-G bioink | |
| Immunofluorescence antibodies (N-CAD; β-III Tubulin) | Cell Signalling and Santa Cruz | Used for dye | |
| JASCO 6600 | Tetra | for FTIR | |
| MTT Assay | Sigma | Viability testing | |
| Penicilin/Streptomycin Solution | Capricorn | PB-S | It was added to the medium to prevent contamination in cell culture. |
| Thoma slide | Isolab | Used for counting the cell | |
| Time-Lapse Imaging System | Zeiss Axio.Observer.Z1 | Imaging | |
| Tripsin-EDTA | Multicell | The flask was used to remove the cells covering the surface. | |
| Vorteks | Biobase | For produced bioink step | |
| WJ-MSCs | ATCC | Used for the cell culture process |
Riferimenti
- Kamasak, B., et al. Peripheral Nerve Injuries and Physiotherapy. Clinical Physiotherapy. 19, (2019).
- Yegiyants, S., Dayicioglu, D., Kardashian, G., Panthaki, Z. J. Traumatic peripheral nerve injury: A wartime review. Journal of Craniofacial Surgery. 21 (4), 998-1001 (2010).
- Mushtaq, S., et al. Frequency of peripheral nerve injury in trauma in emergency settings. Cureus. 13 (3), 14195 (2021).
- Allahverdiyev, A. . Basic Principles of Somatic and Stem Cell Culture Systems, 1st Edition. , (2018).
- Allahverdiyev, A. M., et al. Adipose tissue-derived mesenchymal stem cells as a new host cell in latent leishmaniasis. The American Journal of Tropical Medicine and Hygiene. 85 (3), 535-539 (2011).
- Schofield, R. The relationship between the spleen colony-forming cell and the hemopoietic stem cell. Blood Cells. 4 (1-2), 7-25 (1978).
- Goodman, S. R. Stem Cells and Regenerative Medicine (Chapter 13). Goodman's Medical Cell Biology, Fourth Edition. , 361-380 (2021).
- Kaya, T. I. Tissue engineering. International Journal of Medical Sciences. 1 (48), 165-169 (2018).
- Sensharma, P., Madhumathi, R. G., Jayant, R. D., Jaiswal, A. K. Biomaterials and cells for neural tissue engineering: Current choices. Materials Science and Engineering: C. 7, 1302-1315 (2017).
- Hölzl, K., et al. Bioink properties before, during, and after 3D bioprinting. Biofabrication. 8 (3), 032002 (2016).
- Zheng, Y., et al. 2D nanomaterials for tissue engineering and regenerative nanomedicines: Recent advances and future challenges. Advanced Healthcare Materials. 10 (7), 2001743 (2021).
- Shin, S. R. Graphene-based materials for tissue engineering. Advanced Drug Delivery Reviews. 105, 255-274 (2016).
- Chen, M., Qin, X., Zeng, G. Biodegradation of carbon nanotubes, graphene, and their derivatives. Trends in Biotechnology. 35 (9), 836-846 (2017).
- Chen, S., et al. PAM/GO/Gel/SA composite hydrogel conduit with bioactivity for repairing peripheral nerve injury. Journal of Biomedical Materials Research Part A. 107, 1273-1283 (2019).
- Chiriac, S., Facca, S., Diaconu, M., Gouzou, S., Liverneaux, P. Experience of using the bioresorbable copolyester poly(DL-lactide-ε-caprolactone) nerve conduit guide Neurolac™ for nerve repair in peripheral nerve defects: Report on a series of 28 lesions. Journal of Hand Surgery (European Volume). 37 (4), 342-349 (2011).
- Karaaltin, A. B., et al. Human olfactory stem cells for injured facial nerve reconstruction in a rat model). Head & Neck. 38, 2011-2020 (2016).
- Bingham, J. R., et al. Stem cell therapy to promote limb function recovery in peripheral nerve damage in a rat model. Annals of Medicine and Surgery. 41, 20-28 (2019).
- Zhuang, H., et al. Gelatin-methacrylamide gel loaded with microspheres to deliver GDNF in bilayer collagen conduit promoting sciatic nerve growth. International Journal of Nanomedicine. 11, 1383-1394 (2016).
- Scheib, J., Hoke, A. Advances in peripheral nerve regeneration. Nature Reviews: Neurology. 9 (12), 668-676 (2013).
- Yurie, H., et al. The efficacy of a scaffold-free bio 3D conduit developed from human fibroblasts on peripheral nerve regeneration in a rat sciatic nerve model. PLOS ONE. 12 (2), 0171448 (2017).
- Guo, Y., et al. Assessment of the green florescence protein labeling method for tracking implanted mesenchymal stem cells. Cytotechnology. 64 (4), 391-401 (2012).
- Kose, C., Kacar, R., Zorba, A. P., Bagirova, M., Allahverdiyev, A. The effect of CO2 laser beam welded AISI 316L austenitic stainless steel on the viability of fibroblast cells, in vitro. Materials Science and Engineering: C. 60, 211-218 (2016).
- Liu, Y., et al. Bio-adenine-bridged molecular design approach toward non-covalent functionalized graphene by liquid-phase exfoliation. Journal of Materials Science. 55, 140-150 (2020).
- Rehman, S. Reduced graphene oxide incorporated GelMA hydrogel promotes angiogenesis for wound healing applications. International Journal of Nanomedicine. 14, 9603-9617 (2019).
- Bei, H. P., et al. Graphene-based nanocomposites for neural tissue engineering. Molecules. 24 (4), 658 (2019).
- Othman, S. A., et al. Alginate-gelatin bioink for bioprinting of HeLa spheroids in alginate-gelatin hexagon-shaped scaffolds. Polymer Bulletin. 78, 6115-6135 (2021).
- Peng, X. L., Li, Y., Zhang, G., Zhang, F., Fan, X. Functionalization of graphene with nitrile groups by cycloaddition of tetracyanoethylene oxide. Journal of Nanomaterials. 2013, 841789 (2013).
- Zorba Yildiz, A. P., et al. 3D therapeutic approaches for peripheral nerve damage. 9th International Molecular Biology and Biotechnology Congress Abstract Book. , (2020).
- Liau, L. L., Ruszymah, B. H. I., Ng, M. H., Law, J. X. Characteristics and clinical applications of Wharton's jelly-derived mesenchymal stromal cells. Current Research in Translational Medicine. 68 (1), 5-16 (2020).
- Yoo, J., et al. Augmented peripheral nerve regeneration through elastic nerve guidance conduits prepared using a porous PLCL membrane with a 3D printed collagen hydrogel. Biomaterials Science. 22, 1-12 (2020).
- Jansen, K., Meek, M. F., vander Werff, J. F. A., van Wachem, P. B., van Luyn, M. J. A. Long-term regeneration of the rat sciatic nerve through a biodegradable poly (DL-lactide-Ɛ-caprolactone) nerve guide: Tissue reactions with a focus on collagen III/IV reformation. Journal of Biomedical Materials Research. 69 (2), 334-341 (2016).
- Pathre, P., et al. PTP1B regulates neurite extension mediated by cell-cell and cell-matrix adhesion molecules. Journal of Neuroscience Research. 15, 143-150 (2001).
- Qing, L., Chen, H., Tang, J., Jia, X. Exosomes and their microRNA cargo: New players in peripheral nerve regeneration. Neurorehabilitation and Neural Repair. 32 (9), 765-776 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon