需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于外周神经工程的石墨烯基3D生物杂化水凝胶生物墨水的制备与表征
摘要
在本手稿中,我们演示了用于外周组织工程的含有石墨烯的生物杂化水凝胶生物墨水的制备方法。使用这种3D生物杂交材料,进行干细胞的神经分化方案。这可能是将类似生物材料带入临床的重要一步。
摘要
周围神经病可由轴索损伤引起,偶尔也可由脱髓鞘疾病引起。周围神经损伤是一个全球性问题,发生在1.5%-5%的急诊患者中,并可能导致大量失业。如今,随着三维(3D)生物打印技术的发展,基于组织工程的方法(包括支架,适当的细胞系和生物信号)变得更加适用。经常研究各种水凝胶生物材料与干细胞、外泌体或生物信号分子的组合,以克服周围神经再生中存在的问题。因此,可注射系统的生产,如水凝胶,或由各种生物打印方法形成的植入式导管结构,在周围神经工程中变得越来越重要。在正常情况下,干细胞是人体的再生细胞,它们的数量和功能不会随着时间的推移而减少,以保护其种群;这些不是特化的细胞,但可以在损伤反应的适当刺激下分化。干细胞系统受到其微环境的影响,称为干细胞生态位。在周围神经损伤中,特别是在神经病中,即使在手术将切断的神经末梢结合在一起后,也无法完全挽救这种微环境。复合生物材料和联合细胞疗法方法在生物降解性、生物相容性和可加工性等各种特性方面提高了材料的功能和适用性。因此,本研究旨在证明石墨烯基生物杂交水凝胶图案的制备和使用,并检验干细胞向神经细胞的分化效率,这可以成为神经再生的有效解决方案。
引言
神经系统是连接生物体内部结构和环境的机制,分为两部分:中枢神经系统和周围神经系统。周围神经损伤是一个全球性问题,占急诊科就诊患者的1.5%-5%,并因各种创伤而发展,导致大量失业1,2,3。
今天,用于外周神经工程的细胞方法引起了极大的兴趣。干细胞在这些方法中使用的细胞中排在第一位。在正常情况下,干细胞是人体的再生细胞,它们的数量和功能不会随着时间的推移而减少,以保护其种群;这些细胞是特化的,但可以根据损伤的适当刺激分化4,5。根据干细胞假说,干细胞系统受到其微环境的影响,称为干细胞生态位。如果没有干细胞的微环境6的存在,干细胞的保存和分化是不可能的,微环境可以使用细胞和支架7通过组织工程重建。组织工程是一个多学科领域,包括工程和生物学原理。组织工程提供了用于创建人造组织的工具,这些人造组织可以替代活组织,并且可以通过去除受损组织和提供功能性组织来用于这些组织的再生8。组织支架是组织工程的三大基石之一,采用天然和合成材料的不同方法生产9。三维(3D)打印是一种新兴的增材制造技术,通过使用各种方法简单但多功能地生产复杂形状,广泛用于替换或恢复有缺陷的组织。生物打印是一种增材制造方法,可实现细胞和生物材料的共存,称为生物墨水10。考虑到神经细胞之间的相互作用,研究已经转向导电生物材料候选物,如石墨烯。石墨烯纳米片具有柔性电子、超级电容器、电池、光学、电化学传感器和储能等特性,是组织工程领域的首选生物材料11。石墨烯已被用于对受损组织和器官进行增殖和再生的研究12,13。
组织工程由三个基本组成部分组成:支架、细胞和生物信号分子。关于周围神经损伤的研究在完全提供这三种结构方面存在不足。在研究中生产和使用的生物材料中遇到了各种问题,例如它们仅包含干细胞或生物信号分子,缺乏能够分化的生物活性分子,所用生物材料缺乏生物相容性,以及对组织生态位中细胞增殖的影响低, 因此,神经传导未完全实现2,13,14,15,16。这需要优化神经再生,减少肌肉萎缩17,18,并创造必要的归巢19与生长因子对抗这些问题。在这一点上,要转移到临床的手术生物材料原型的神经活性的表征和分析非常重要。
因此,该方法研究由3D生物打印机形成的石墨烯纳米板的生物墨水水凝胶图案及其对其所含干细胞神经分化的有效性。此外,还研究了石墨烯对神经球形成和分化的影响。
研究方案
1. 沃顿商学院果冻间充质干细胞的培养
- 将沃顿商学院的果冻间充质干细胞(WJ-MSCs,来自ATCC)从-80°C冰箱中取出。如Yurie等人20中所述,在含有10%胎牛血清(FBS),1%Pen-Strep和1%L-谷氨酰胺的DMEM-F12培养基中培养WJ-MSC,在室温下无菌层流中。
- 用含有 35% FBS、55% DMEMF-12 和 10% 二甲基亚砜 (DMSO) 的冷冻培养基以 1 x 106 个细胞 /mL 冷冻保存一些细胞。为此,在Thoma细胞计数载玻片上计数1 x 106 个细胞,并滴加冷冻溶液。快速将载玻片转移到液氮容器中。
- 当培养的细胞在烧瓶中汇合80%时,倒出培养基并用5mL PBS洗涤。加入 5 mL 的 0.25% 胰蛋白酶和 2.21 mM EDTA-4Na。在37°C的培养箱中孵育5分钟。
- 将 10 mL 含有 10% FBS 的 DMEM-F12 培养基加入从培养箱中取出的细胞中。将其悬浮良好,收集培养基,然后将培养基转移到离心管中。
- 在室温下以101× g 的转速离心5分钟。弃去上清液,并将细胞重新接种在新烧瓶中,加入含有10%FBS的新鲜营养培养基。
注意:通过转导方法用GFP基因标记的商业WJ-MSC可用于更好地可视化要产生的生物材料 - 细胞相互作用21。该方法中使用的组可以创建,如 表1所示。
| 创建的组 | 创作理由 | 代表次数 | ||
| 2D WJ-MSC (2D-C) | 2D 控制 | x 5 | ||
| 2D WJ-MSCs和石墨烯(2D-G) | 2D石墨烯毒性剂量测定 | x 5 次,每种不同浓度 | ||
| WJ-MSC包含在生物墨水(3D-B)中 | 3D 控制 | x 3 | ||
| WJ-MSCs和0.1%石墨烯包含在生物墨水(3D-G)中 | 3D石墨烯-生物墨水生物杂交组 | x 3 | ||
| WJ-MSC在生物墨水(3D-BS)上呈球状体 | 球体形式的 3D 控制 | x 3 | ||
| WJ-MSCs和0.1%石墨烯在生物墨水上的球状体形式(3D-GS组) | 球状体形式的3D石墨烯-生物墨水生物杂交组 | x3 | ||
| 3D生物墨水滴 | 它用于 SEM 和 FTIR 表征分析。 | x5 | ||
| 3D石墨烯滴 | 它用于 SEM 和 FTIR 表征分析。 | x5 | ||
| 3D Bioink,GFP标记WJ-MSCs&0.1% | 观察含有适当剂量石墨烯的生物墨水中WJ-MsCs的运动。 | x3 | ||
表 1. 方法中的组。包括方法中的所有 2D 和 3D 组。
2. 石墨烯毒性与二维成像
- 石墨烯浓度的制备及其在细胞中的应用
注意:原始石墨烯纳米颗粒是商业购买的(工业石墨烯纳米片类型)并捐赠的。颗粒的尺寸厚度为5-8 nm,直径为5 μm,表面积为120-150 m2 / g。- 称量石墨烯以产生1%溶液(mg / mL)。通过将 10 mL 含有 10% FBS 的 DMEMF-12 培养基添加到称量的 100 μg 石墨烯纳米颗粒中来制备储备溶液,并将该溶液标记为储备溶液。在121°C的高压釜中,在1.5个大气压下灭菌20分钟。
注意:无菌石墨烯混合物储存在4°C的冰箱中直至使用。它可能不适合长期使用(最多1个月)。在这些情况下,必须对混合物进行复溶和灭菌。 - 制备不同浓度的培养基石墨烯混合物以确定无毒剂量。将初始稀释度设置为 1%、0.1%、0.01%、0.001% 和 0.0001% 石墨烯/培养基。
- 从 1% 储备溶液开始,从每种浓度中依次取 1 mL 并将其转移到新管中。向每个试管中加入 9 mL 含有 10% FBS 的 DMEMF-12 培养基,制成五个逐渐稀释的样品,并摇动和涡旋溶液以获得均匀分布。仅使用 10 mL DMEMF-12 培养基和 10% FBS 作为对照。
注意:石墨烯的重片会沉淀,因此需要重新分布。 - 将WJ-MSCs接种在6孔板中,每孔5 x 105 个细胞,用2 mL含有10%FBS的新鲜培养基。在37°C孵育1天。 然后,将板分成相等和重复的孔组。每个浓度重复五次。
- 弃去培养基,然后用每孔2mL浓度的石墨烯培养基替换培养基。仅对对照组使用培养基。将板在37°C孵育24小时。
- 称量石墨烯以产生1%溶液(mg / mL)。通过将 10 mL 含有 10% FBS 的 DMEMF-12 培养基添加到称量的 100 μg 石墨烯纳米颗粒中来制备储备溶液,并将该溶液标记为储备溶液。在121°C的高压釜中,在1.5个大气压下灭菌20分钟。
- 用MTT测定石墨烯的无毒浓度
- 24小时后用石墨烯丢弃培养基。用PBS清洗每个井。加入含有 10% FBS 的新鲜 DMEMF-12 培养基,每孔 2mL。
注意:在细胞上应用石墨烯浓度后,用PBS洗涤很重要,因为石墨烯纳米颗粒不会通过内吞作用进入细胞,而是从环境中去除。这使得MTT测试更有效。 - 使用MTT(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物)方案确定指示50%细胞活力的IC50值,如Kose等人22 和步骤2.2.3.-2.2.6中所述。
- 首先,称取 5 mg/mL 的 MTT 盐并溶解在 PBS 中。使用0.45μm过滤器灭菌。用铝箔包裹在15mL离心管中制成的MTT溶液,并储存在4°C。
- 向所有孔中加入10μLMTT,并将板在37°C孵育4小时。 孵育后在显微镜下以10倍放大倍率观察甲臜晶体的形成。
- 为了溶解细胞中形成的晶体,向每个孔中加入 100 μL DMSO 并通过移液混合。将板在室温下在黑暗中保持30分钟。将板插入 ELISA 酶标仪。从程序设置570nm的波长以进行吸光度测量,并使其读取板22。
注意:此外,虽然单独读取石墨烯颗粒在270 nm23处,但此处的570 nm24 读取范围仅用于读取细胞活力。 - 在统计分析程序中使用单因素方差分析与Tukey检验对获得的结果进行统计分析。
- 24小时后用石墨烯丢弃培养基。用PBS清洗每个井。加入含有 10% FBS 的新鲜 DMEMF-12 培养基,每孔 2mL。
- 缝合成像
- 为了检查不同石墨烯浓度与细胞的相互作用,请使用称为缝合成像的方法对细胞进行延时。该方法使用在显微镜下定期拍摄的图像样本创建延时图像。
- 为此,请先打开计算机。打开延时成像培养箱并将其设置为37°C。 将MTT板放入延时培养箱槽中。
- 在计算机上打开Stitch程序。指定要在系统中读取的孔。将读者带到第一个孔,在白光下以 10 倍放大倍率定位和聚焦该区域。启动程序。
注意:这是一个用于创建高质量4行x 5列多照片拼贴的程序。该程序以高清质量组合了一个接一个拍摄的照片。当您按下系统启动按钮时,孔会自动读取,并拍摄并缝合 4 行 x 5 列多张照片。
3. 石墨烯-生物墨水生物杂化水凝胶生产与WJ-MSCs分化
- 生物油墨的生产
注意:冻干市售海藻酸盐 - 明胶(3:5)粉末用作生物墨水的基础。石墨烯生物墨水基团(3D-G;3D-GS)和无石墨烯对照生物墨水基团(3D-B;3D-BS)用相同的方法制备(表1)。- 使用 50 mL 锥形管进行制备。首先,称取4.5mg海藻酸盐和1.5mg明胶并转移到离心管中。将含有 10% FBS 的 DMEMF-12 培养基添加到混合物中,总体积为 50 mL。这是不含石墨烯的对照(C)组。
- 重复称量4.5mg海藻酸盐和1.5mg明胶,并转移到离心管中。然后,从步骤2.1.3中取50μL制备的0.1%石墨烯。并将其添加到管中。加入含有 10% FBS 的 DMEMF-12,总体积为 50 mL。
- 首先通过移液混合生物墨水,然后涡旋。在121°C的高压釜中,在1.5个大气压下灭菌20分钟。或者,通过微波进行灭菌直至沸点。
- 将混合物高压灭菌后,在室温下以280× g 离心2分钟以除去形成的气泡。将生物墨水保持在37°C,直到细胞制备完毕。
- 增加WJ-MSC和3D生物打印
- 为了计数,当与大约 5 mL PBS 汇合 80% 时洗涤细胞,并加入 5 mL 的 0.25% 胰蛋白酶和 2.21 mM EDTA 4Na。在37°C下放置5分钟。
- 从培养箱中取出后,向细胞中加入 10 mL 含有 10% FBS 的 DMEM-F12 培养基。悬浮良好,收集培养基,然后将其转移到离心管中。在室温下以101× g 离心5分钟,然后弃去上清液。
- 将约250μL培养基与沉淀一起留置。将沉淀重新溶解在 1 mL 新鲜培养基中。向 48 μL 培养基中加入 2 μL 细胞悬液和 50 μL 台盼蓝(0.4 g 台盼蓝/100 mL)在锥形管 (1.5 mL) 中计数4.好好移液。
- 将大约 10 mL 制备好的染色细胞悬液添加到 Thoma 细胞计数室中。计算落入光学显微镜两侧正方形的平均细胞数。
计算活力百分比(%)=(计数活细胞/计数总细胞)x 100
注意:细胞 - 生物墨水相互作用以两种方式研究:(1)可以通过将其添加到生物墨水(3D-B; 3D-G)中来打印;(2)细胞在按压后接种在生物墨水上,细胞形成球状体(3D-BS; 3D-GS)。 - 对于细胞-生物墨水相互作用,首先创建生物墨水组(表1)。第 1 组包括用生物墨水打印的 3D-B 和 3D-G 用于生物打印。第2组包括3D-BS和3D-GS生物墨水,生物打印后在其上形成球体。
- 计数第 1 组的细胞,使其在 0.5 mL 培养基中大约有 1 x 107 个 细胞。加入 4.5 mL 生物墨水,使总体积达到 5 mL。在注射器的帮助下将其转移到无菌柜中的墨盒中。将墨盒安装在生物打印机的相应挤出机部分。
- 对于第二组,从每个生物墨水组中取5 mL,并在注射器的帮助下将它们转移到无菌墨盒中。
- 使用带有两个同轴打印头和气动驱动挤出技术的生物打印机。将每微步的 X/Y/Z 分辨率设置为 1.25 μm,将挤出宽度设置为 400 μm,将挤出高度设置为 200 μm。20 mm x 20 mm x 5 mm网格是3D生物打印工作中最常用的3D模型之一。
- 使用基于 Web 的开源 CAD 程序创建 3D 模型。在生物打印之前,使用其中一个开源平台(例如填充)创建简单的3D模型。模型可以是线性的(如此处使用的模型)、蜂窝状或网格形。创建 5 mm x 20 mm x 20 mm 正方形后,以 .stl 格式导出和下载。
- 生物打印机软件使用.stl文件,并使用切片器模块将其转换为可打印的.gcode格式。若要获取可打印的网格形状,请在切片器模块中禁用外壳。操作前用70%乙醇擦拭设备,然后通过紫外线灭菌灭菌。
- 对于生物打印过程,在注射器的帮助下将生物墨水基团转移到墨盒上。将墨盒安装在生物打印机的相应挤出机部分。
- 将3D打印机的平均压力设置为7.5 psi,将墨盒和床温设置为37°C。 将速度设置为60%,然后执行标准的3D打印过程。
注意:使用空间(如线性模型)规划准备好的模型允许在生物打印后在空间中进行细胞培养。 - 在写入阶段将系统置于初始位置。自动定位轴(X,Y,Z),选择挤出机并设置。开始打印过程。生物打印过程完成后,取样并将其放置在层流柜下。
- 打印后用 0.1 N CaCl2 溶液喷洒生物墨水,或在室温下用移液管加入 1 mL 溶液。等待约10-20秒,用含有Ca2+和Mg2+的PBS清洗印刷图案2倍。
- 在每个含有细胞的生物墨水组的顶部加入 2 mL DMEMF-12 和 10% FBS 培养基。将板在37°C与5%CO2孵育。之后,向每组加入 2 mL 含有 1 x 106 个细胞的悬浮培养基以形成球状体。
- 将板在37°C与5%CO2孵育。孵育24小时后,在倒置显微镜下观察球体形成。
- WJ-MSCs分化为神经元样细胞
- 孵育24小时后观察并拍摄所有批次的生物墨水。每孔加入 2 mL 神经源性分化培养基(对照组除外),每 2 天刷新一次。随访 7 天以观察神经分化。
4. 石墨烯-生物墨水生物杂化水凝胶表征
注意:进行延时成像,傅里叶变换红外光谱(FT / IR)和扫描电子显微镜(SEM)分析以表征石墨烯 - 生物墨水生物杂化水凝胶。样品由3D-B和3D-G生物墨水组通过滴灌法制成,用于FT / IR和SEM分析。
- 傅立叶变换/红外分析
注意:FT/IR是一种基于数学傅里叶变换的化学分析方法,对于材料表征是必不可少的。使用基于28°C迈克尔逊干涉仪原理的FT / IR设备,带有卤素灯,水冷汞光源,信号长宽比为4 cm−1,测量1分钟,在2,200 cm−1。- 准备FT / IR显微镜并确保仪器的光学元件对齐。校准设备。
- 由于样品呈液滴状,因此取一块1-2毫米厚的水凝胶,并用镊子将其放在样品部分。专注于样品并将其升高,直到密切接触。通过从系统启动该过程来收集样本光谱。
- 扫描电子显微镜 (SEM) 分析
注意:表面形态,内部结构,细胞分布和生物墨水 - 细胞相互作用可以通过不同维度的SEM分析进行检查。- 使用移液器尖端液滴法将水凝胶放入含有 1 mL CaCl2 交联剂的 6 孔板中(见 图 1)。
- 用大约 1 mL PBS 清洗板 2 倍,以释放盐溶液。然后,在镊子的帮助下将这些滴剂放入含有 5 mL 5% 多聚甲醛的猎鹰管中。
- 在手术刀的帮助下,从滴生物墨水中制作薄片。将样品粘在金属板上的粘性一侧。插入涂层装置中,通过用氩气代替空气进入等离子体相的金钯覆盖样品。
- 将其放入电子显微镜(SEM)中。打开 SEM 连接到的显微镜程序。执行缩放并拍摄样品不同部分的图像。对于该协议,使用5μm,10μm和200μm刻度。共拍摄了3D-B和3D-G组的40张图像。
- 延时成像
注意:在延时成像期间,不仅使用含有GFP基因转化细胞的生物墨水样品,而且还使用具有球状体的生物墨水成像16小时。进行延时成像以检查石墨烯对干细胞的影响并监测生物墨水中的细胞相互作用。- 将市售的 1 x 107 GFP 标记的 MSC 加入 5 mL 生物墨水和生物打印中,如步骤 3.2.11 所示。加入 1 mL 交联剂,保持 20-30 秒,用 PBS 洗涤 2 次。
- 打开延时监视器并在计算机上打开程序。在延时模式下设置大约16小时,并将温度设置为37°C。 按 "开始" 按钮。系统记录40秒延时视频样本形式的视频。
- 每2小时以10倍放大倍率聚焦显微镜。此外,可视化按照相同步骤创建的椭球体。
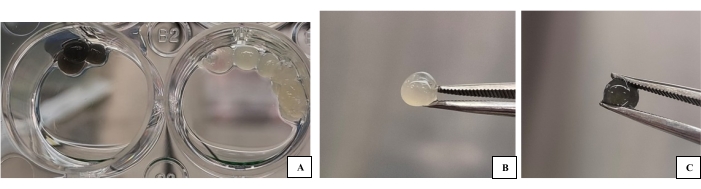
图 1:3D-B 和 3D-G 生物墨水基团以液滴形式生产,用于表征。 (A)带有交联剂的平板上的生物墨水样品(预表征图像)。(B)生物墨水的3D-B液滴图像。(C) 3D-G生物墨水滴图像。要表征的生物材料及其所含的细胞可以更容易地经历镀金、取样等过程。请点击此处查看此图的大图。
5.免疫染色法测定神经源性分化
- 在不中断球体形式的情况下收集球体,并重新播种到新板中以使用更简单的方法进行重新染色,而不是嵌入石蜡中进行组织切片。
- 用约20mL预高压灭菌的0.1%明胶溶液覆盖48孔板,并在培养箱中保持至少1小时。将约 500 μL 制备的 0.1% 明胶移液到 48 孔板中。将凝胶状板留在培养箱中10分钟。
注意:这将使明胶略微膨胀,覆盖表面并为收集的球体附着创造更好的环境。 - 通过移液收集球体,将收集的球体从培养箱分配到48孔板的孔中,并加入新鲜培养基。然后,孵育12-24小时。
注意:通过计数来分布球体是相当困难的。将球状体收集在单个管中,并将总体积均匀分配到孔中。在这项研究中,每个孔包含大约4-6个球状体。
注意:对于 2D 样品,预染色清洗就足够了,无需更换培养基。 - 取出培养基并用PBS缓慢洗涤细胞,因为球状体将位于顶部。在4%多聚甲醛中固定2小时。
- 再次用PBS洗涤样品,并用约10mL的2%BSA和0.1%TritonX封闭30分钟。然后,用PBS 3x清洗。
- 用抗体稀释剂试剂溶液以1:100的比例稀释选定的引物抗体(N-钙粘蛋白-兔和β-III微管蛋白-小鼠)。向每个样品中加入 100 μL 抗体溶液,并在 4 °C 下孵育过夜。
- 用PBS洗涤样品3次。与抗小鼠IgG-FTIC-兔孵育用于β-III微管蛋白和抗小鼠IgG-SC2781-山羊二抗,用于在室温下稀释至1:200的N-Cd30分钟。在黑暗中执行所有操作。
注意:无论在双重染色中使用哪种菌株作为一抗(例如小鼠),都应使用不同的菌株(例如山羊或兔)作为二抗。 - 用PBS 3x洗涤二抗,然后将DAPI溶液(1:1)滴入每个样品中。等待15-20分钟。进行免疫荧光成像。
结果
石墨烯毒性和2D成像
在统计分析软件中,使用Tukey检验的单因素方差分析对获得的MTT结果进行统计分析,得到的图形如图 2所示。与对照相比,石墨烯百分比仅在0.001%石墨烯浓度(**p <0.01)时显着降低。其他组与对照组比较差异无统计学意义(p > 0.05)。因此,最佳石墨烯浓度被确定为0.1%,因为根据MTT测试结果和拼接图像,暴露于该浓度后观察到最高的活性率?...
讨论
与传统的2D方法相比,使用工程3D支架应用的处理优势每天都变得越来越明显。在这些疗法中单独使用的干细胞或与由具有低生物相容性和生物降解性的各种生物材料产生的支架一起在周围神经再生中通常不足。沃顿商学院的果冻间充质干细胞(WJ-MSCs)似乎是一种合适的候选细胞系,特别是考虑到获取方案的优化,它们的增殖能力和分化能力29。在这项研究中,我们检查了干细胞...
披露声明
作者声明不存在利益冲突。该项目是与3D生物打印技术的开发商HD Bioink合作进行的。
致谢
本研究中使用的石墨烯是在Kirklareli大学机械工程系开发的。它是由卡拉贝约奥卢博士捐赠的。石墨烯毒性测试由名为"使用石墨烯掺杂生物墨水在3D生物打印机上打印和分化间充质干细胞"的项目资助(申请号:1139B411802273),该项目在TÜBİTAK 2209-B-面向行业的本科论文支持计划范围内完成。该研究的另一部分得到了Yildiz技术大学科学研究项目(TSA-2021-4713)提供的研究基金的支持。用于延时成像阶段的具有GFP的间充质干细胞由Virostem Biotechnology捐赠。作者感谢Darıcı LAB和YTU细胞培养和组织工程实验室团队富有成效的讨论。
材料
| Name | Company | Catalog Number | Comments |
Centrifugal | Hitachi | Used in cell culture and biomaterial step | |
| 0.1N CaCl2 | HD Bioink | Used for crosslinker | |
| 0.22 µm membrane filter | Aιsιmo | Used for sterilization | |
| 0.45 µm syringe filter | Aιsιmo | Used for sterilization | |
| 1.5mL conic tube | Eppendorfa | Used for bioink drop | |
| 15mL Falcon tube | Nest | Used in cell culture step | |
| 25 cm2 cell culture flasks (Falcon, TPP tissue culture flasks | Nest | Used for cell culture | |
| 3D Bioprinting | Axolotl Biosystems Bio A2 (Turkey) | Bioprinting Step | |
| 50 mL Falcon tube | Nest | Used in cell culture step | |
| 6/24/48/96 well plates (Falcon, TPP microplates) | Merck Millipore | Used in cell culture step | |
| 75 cm2 cell culture flasks (Falcon, TPP tissue culture flasks | Nest | Used for cell culture | |
| Anti mouse IgG-FTIC-rabbit | Santa Cruz Biotechnology | J1514 | Seconder antibody, used for dye |
| Anti mouse IgG-SC2781-goat | Santa Cruz Biotechnology | C3109 | Seconder antibody, used for dye |
| Au coating device EM ACE600 | Leica | for gold plating of biomaterial section before SEM imaging | |
| Autoclave | NUVE-OT 90L | Used for the sterilization process. | |
| Autoclave | NUVE-OT 90L | Used for the sterilization process. | |
| Cell Cultre Cabine | Hera Safe KS | Used for the cell culture process | |
| Dulbecco's Modified Eagle's Medium/Nutrient Mixture-F12 | Sigma | RNBJ7249 | Used as cell culture medium |
| FEI QUANTA 450 FEG ESEM SEM | Quanta | FEG 450 | for SEM |
| Fetal Bovine Serum-FBS | Capricorn | FBS-16A | It was used by adding to the cell culture medium. |
| Freezer -80°C | Panasonic | MDF-U5386S-PE | We were used to store cells and the resulting exosomes |
| Gelatine-Alginate bioink powder | HD Bioink | Used for produced bioink step | |
| GFP labelled-WJ-MSCs | Virostem | Used for imaging to cell-bioink interaction | |
| Graphene nanoplatelets (Graphene-IGP2) | Grafen Chemical Industries Co. | Used for production 3D-G bioink | |
| Immunofluorescence antibodies (N-CAD; β-III Tubulin) | Cell Signalling and Santa Cruz | Used for dye | |
| JASCO 6600 | Tetra | for FTIR | |
| MTT Assay | Sigma | Viability testing | |
| Penicilin/Streptomycin Solution | Capricorn | PB-S | It was added to the medium to prevent contamination in cell culture. |
| Thoma slide | Isolab | Used for counting the cell | |
| Time-Lapse Imaging System | Zeiss Axio.Observer.Z1 | Imaging | |
| Tripsin-EDTA | Multicell | The flask was used to remove the cells covering the surface. | |
| Vorteks | Biobase | For produced bioink step | |
| WJ-MSCs | ATCC | Used for the cell culture process |
参考文献
- Kamasak, B., et al. Peripheral Nerve Injuries and Physiotherapy. Clinical Physiotherapy. 19, (2019).
- Yegiyants, S., Dayicioglu, D., Kardashian, G., Panthaki, Z. J. Traumatic peripheral nerve injury: A wartime review. Journal of Craniofacial Surgery. 21 (4), 998-1001 (2010).
- Mushtaq, S., et al. Frequency of peripheral nerve injury in trauma in emergency settings. Cureus. 13 (3), 14195 (2021).
- Allahverdiyev, A. . Basic Principles of Somatic and Stem Cell Culture Systems, 1st Edition. , (2018).
- Allahverdiyev, A. M., et al. Adipose tissue-derived mesenchymal stem cells as a new host cell in latent leishmaniasis. The American Journal of Tropical Medicine and Hygiene. 85 (3), 535-539 (2011).
- Schofield, R. The relationship between the spleen colony-forming cell and the hemopoietic stem cell. Blood Cells. 4 (1-2), 7-25 (1978).
- Goodman, S. R. Stem Cells and Regenerative Medicine (Chapter 13). Goodman's Medical Cell Biology, Fourth Edition. , 361-380 (2021).
- Kaya, T. I. Tissue engineering. International Journal of Medical Sciences. 1 (48), 165-169 (2018).
- Sensharma, P., Madhumathi, R. G., Jayant, R. D., Jaiswal, A. K. Biomaterials and cells for neural tissue engineering: Current choices. Materials Science and Engineering: C. 7, 1302-1315 (2017).
- Hölzl, K., et al. Bioink properties before, during, and after 3D bioprinting. Biofabrication. 8 (3), 032002 (2016).
- Zheng, Y., et al. 2D nanomaterials for tissue engineering and regenerative nanomedicines: Recent advances and future challenges. Advanced Healthcare Materials. 10 (7), 2001743 (2021).
- Shin, S. R. Graphene-based materials for tissue engineering. Advanced Drug Delivery Reviews. 105, 255-274 (2016).
- Chen, M., Qin, X., Zeng, G. Biodegradation of carbon nanotubes, graphene, and their derivatives. Trends in Biotechnology. 35 (9), 836-846 (2017).
- Chen, S., et al. PAM/GO/Gel/SA composite hydrogel conduit with bioactivity for repairing peripheral nerve injury. Journal of Biomedical Materials Research Part A. 107, 1273-1283 (2019).
- Chiriac, S., Facca, S., Diaconu, M., Gouzou, S., Liverneaux, P. Experience of using the bioresorbable copolyester poly(DL-lactide-ε-caprolactone) nerve conduit guide Neurolac™ for nerve repair in peripheral nerve defects: Report on a series of 28 lesions. Journal of Hand Surgery (European Volume). 37 (4), 342-349 (2011).
- Karaaltin, A. B., et al. Human olfactory stem cells for injured facial nerve reconstruction in a rat model). Head & Neck. 38, 2011-2020 (2016).
- Bingham, J. R., et al. Stem cell therapy to promote limb function recovery in peripheral nerve damage in a rat model. Annals of Medicine and Surgery. 41, 20-28 (2019).
- Zhuang, H., et al. Gelatin-methacrylamide gel loaded with microspheres to deliver GDNF in bilayer collagen conduit promoting sciatic nerve growth. International Journal of Nanomedicine. 11, 1383-1394 (2016).
- Scheib, J., Hoke, A. Advances in peripheral nerve regeneration. Nature Reviews: Neurology. 9 (12), 668-676 (2013).
- Yurie, H., et al. The efficacy of a scaffold-free bio 3D conduit developed from human fibroblasts on peripheral nerve regeneration in a rat sciatic nerve model. PLOS ONE. 12 (2), 0171448 (2017).
- Guo, Y., et al. Assessment of the green florescence protein labeling method for tracking implanted mesenchymal stem cells. Cytotechnology. 64 (4), 391-401 (2012).
- Kose, C., Kacar, R., Zorba, A. P., Bagirova, M., Allahverdiyev, A. The effect of CO2 laser beam welded AISI 316L austenitic stainless steel on the viability of fibroblast cells, in vitro. Materials Science and Engineering: C. 60, 211-218 (2016).
- Liu, Y., et al. Bio-adenine-bridged molecular design approach toward non-covalent functionalized graphene by liquid-phase exfoliation. Journal of Materials Science. 55, 140-150 (2020).
- Rehman, S. Reduced graphene oxide incorporated GelMA hydrogel promotes angiogenesis for wound healing applications. International Journal of Nanomedicine. 14, 9603-9617 (2019).
- Bei, H. P., et al. Graphene-based nanocomposites for neural tissue engineering. Molecules. 24 (4), 658 (2019).
- Othman, S. A., et al. Alginate-gelatin bioink for bioprinting of HeLa spheroids in alginate-gelatin hexagon-shaped scaffolds. Polymer Bulletin. 78, 6115-6135 (2021).
- Peng, X. L., Li, Y., Zhang, G., Zhang, F., Fan, X. Functionalization of graphene with nitrile groups by cycloaddition of tetracyanoethylene oxide. Journal of Nanomaterials. 2013, 841789 (2013).
- Zorba Yildiz, A. P., et al. 3D therapeutic approaches for peripheral nerve damage. 9th International Molecular Biology and Biotechnology Congress Abstract Book. , (2020).
- Liau, L. L., Ruszymah, B. H. I., Ng, M. H., Law, J. X. Characteristics and clinical applications of Wharton's jelly-derived mesenchymal stromal cells. Current Research in Translational Medicine. 68 (1), 5-16 (2020).
- Yoo, J., et al. Augmented peripheral nerve regeneration through elastic nerve guidance conduits prepared using a porous PLCL membrane with a 3D printed collagen hydrogel. Biomaterials Science. 22, 1-12 (2020).
- Jansen, K., Meek, M. F., vander Werff, J. F. A., van Wachem, P. B., van Luyn, M. J. A. Long-term regeneration of the rat sciatic nerve through a biodegradable poly (DL-lactide-Ɛ-caprolactone) nerve guide: Tissue reactions with a focus on collagen III/IV reformation. Journal of Biomedical Materials Research. 69 (2), 334-341 (2016).
- Pathre, P., et al. PTP1B regulates neurite extension mediated by cell-cell and cell-matrix adhesion molecules. Journal of Neuroscience Research. 15, 143-150 (2001).
- Qing, L., Chen, H., Tang, J., Jia, X. Exosomes and their microRNA cargo: New players in peripheral nerve regeneration. Neurorehabilitation and Neural Repair. 32 (9), 765-776 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。