Method Article
القياس الكمي الكامل مقابل دون الإقليمي لحمل الأميلويد بيتا على أقسام دماغ الفأر
In This Article
Summary
يصف هذا البروتوكول ويقارن الإجراء الخاص بإجراء تحليل كامل للمنطقة أو المنطقة الفرعية ذات الأهمية لأقسام دماغ الفأر السهمي لتحديد حمل أميلويد بيتا في نموذج الفأر المعدل وراثيا APP / PS1 لمرض الزهايمر.
Abstract
يعد التراكم خارج الخلية للويحات أميلويد بيتا (Aβ) أحد السمات المميزة المرضية الرئيسية لمرض الزهايمر (AD) ، وهو هدف العلاج الوحيد المعدل للمرض المعتمد من إدارة الأغذية والعقاقير ل AD. وفقا لذلك ، فإن استخدام نماذج الفئران المعدلة وراثيا التي تبالغ في التعبير عن بروتين سلائف الأميلويد وبالتالي تراكم لويحات Aβ الدماغية تستخدم على نطاق واسع لنمذجة AD البشري في الفئران. لذلك ، فإن المقايسات المناعية ، بما في ذلك مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) والتلطيخ المناعي ، تقيس عادة حمل Aβ في أنسجة المخ المشتقة من الفئران المعدلة وراثيا AD. على الرغم من أن طرق الكشف عن Aβ وتحديدها كميا قد تم تأسيسها وتوثيقها بشكل جيد ، إلا أنه لم يتم الإبلاغ عن تأثير حجم المنطقة ذات الاهتمام المختارة في أنسجة المخ على قياسات الحمل Aβ بعد تلطيخ المناعة. لذلك ، يهدف البروتوكول الحالي إلى مقارنة قياسات حمل Aβ عبر المناطق الكاملة والفرعية ذات الأهمية باستخدام برنامج تحليل الصور. يتم وصف الخطوات التي ينطوي عليها إعداد أنسجة المخ ، والتلطيخ المناعي لقسم الدماغ العائم الحر ، والتصوير ، وتحديد كمية حمل Aβ بالكامل مقابل المناطق الفرعية ذات الأهمية باستخدام أقسام الدماغ المشتقة من الفئران الذكور المعدلة وراثيا المزدوجة APP / PS1 البالغة من العمر 13 شهرا. يوفر البروتوكول الحالي والنتائج معلومات قيمة حول تأثير حجم المنطقة ذات الاهتمام على القياس الكمي للمنطقة الإيجابية Aβ ، ويظهران علاقة قوية بين المنطقة الإيجابية Aβ التي تم الحصول عليها باستخدام تحليلات المناطق الكاملة والفرعية ذات الأهمية لأقسام الدماغ المستمدة من ذكور APP / PS1 البالغة من العمر 13 شهرا والتي تظهر ترسبا Aβ واسع النطاق.
Introduction
لا يزال مرض الزهايمر (AD) ، وهو السبب الرئيسي السادس للوفاة في الولايات المتحدة ، يشكل تهديدا للصحة العامة ، حيث يعيش ما يقدر بنحو 6.2 مليون أمريكي مصاب بمرض الزهايمر. ومن المتوقع أن يصل هذا إلى 13.8 مليون بحلول عام 20601. حتى الآن ، فإن إدارة الأعراض من خلال الأدوية مثل مثبطات الكولينستراز والميمانتين هي المسار الأساسي للعلاج2. يتميز AD بمظاهر عصبية مرضية مثل ترسب خارج الخلية من لويحات أميلويد بيتا (Aβ) وتراكم تاو فرط الفوسفوريلات داخل الخلايا في شكل تشابك عصبي ليفي 3,4. يتكون Aβ من انقسام انحلالي داخلي لبروتين سلائف الأميلويد (APP) عبر بيتا وغاما سكريتاز ، ويتجمع Aβ لتشكيل oligomers والألياف ، مما يؤدي إلى تأثيرات سمية عصبية5. تم افتراض Aβ لخدمة دور مرضي أساسي منذ 1980s ، وهو الهدف العلاجي للعلاج الوحيد المعدل للأمراض المعتمد من إدارة الأغذية والعقاقير ل AD6. ونتيجة لذلك ، تم استخدام نماذج الفئران المعدلة وراثيا AD التي تؤوي طفرات في الجينات مما أدى إلى تراكم Aβ دماغي قوي على نطاق واسع لأبحاث AD قبل السريرية منذ أوائل 1990s7.
يتم الكشف عن أنواع Aβ في أدمغة الفئران المعدلة وراثيا AD هذه بشكل عام باستخدام اثنين من المقايسات المناعية: مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) والتلطيخ المناعي. يتيح الفحص السابق التحديد الكمي لأنواع Aβ المختلفة وهو أقل استهلاكا للوقت مقارنة بالتلطيخ المناعي ، والذي يتطلب العديد من خطوات معالجة الأنسجة والتصوير المتسلسلة ، بما في ذلك تقسيم الأنسجة ، والتلطيخ المناعي ، والتصوير ، والقياس الكمي8. علاوة على ذلك ، فإن النتائج التي تم الحصول عليها بعد تلطيخ المناعة هي شبه كمية8. ومع ذلك ، فإن القدرة على توطين Aβ مكانيا تجعل التلطيخ المناعي نهجا جذابا للكشف عن Aβ في أنسجة المخ8.
أثناء استخدام Aβ immunostaining ، تم استخدام العديد من نماذج القياس الكمي المختلفة من قبل مجموعات بحثية مختلفة. على سبيل المثال ، تقوم بعض المجموعات البحثية بقياس حمل Aβ في المنطقة بأكملها ذات الأهمية (القشرة أو الحصين) ، بينما تقوم مجموعات أخرى بقياس حمل Aβ في منطقة فرعية محددة ذات أهمية (جزء من القشرة أو الحصين)9،10،11. على الرغم من أن طرق الكشف عن Aβ وتحديدها كميا قد تم تأسيسها وتوثيقها بشكل جيد ، إلا أنه لم يتم الإبلاغ عن تأثير حجم المنطقة ذات الاهتمام على قياسات الحمل Aβ بعد تلطيخ المناعة. لذلك ، يهدف البروتوكول الحالي إلى مقارنة قياسات حمل Aβ عبر المناطق الكاملة والفرعية ذات الأهمية باستخدام برنامج تحليل الصور ، ImageJ.
استخدمت الدراسة الحالية الفئران الذكور المعدلة وراثيا المزدوجة APP / PS1 البالغة من العمر 13 شهرا ، والتي تعبر عن فأر / إنسان وهمي و presenilin 1 متحور ، لنمذجة البداية المبكرة ل AD12. تبدأ رواسب Aβ في التطور بحلول عمر 6-7 أشهر ، ويلاحظ تراكم Aβ وفير في كل من القشرة والحصين لهذه الفئران بحلول 9-10 أشهر من العمر12. يمكن الكشف عن ببتيدات الأميلويد المعدلة وراثيا والبروتين المجسم بواسطة 6E10-immunostaining13 ، مما يجعله نموذجا حيوانيا مرغوبا فيه لهذا البروتوكول. يشمل الإجراء المغطى هنا إعداد أنسجة المخ ، والتلطيخ المناعي للأقسام العائمة الحرة ، والتصوير ، وتحديد كمية حمل Aβ بالكامل مقابل المناطق الفرعية ذات الاهتمام. يظهر التحليل وجود علاقة قوية بين القياس الكمي الكامل ودون الإقليمي ، مما يشير إلى وجود اتفاق قوي بين هاتين الطريقتين في أقسام أنسجة المخ المستمدة من الفئران الذكور APP / PS1 البالغة من العمر 13 شهرا والتي تظهر رواسب Aβ وفيرة.
Protocol
أجريت جميع التجارب على الحيوانات وفقا لمختبر الموارد الحيوانية في الجامعة بموجب بروتوكولات وافقت عليها جامعة كاليفورنيا ، إيرفين ، لجنة رعاية واستخدام الحيوانات المؤسسية. أجريت التجارب على ذكور B6C3-Tg (APPswe ، PSEN1dE9) 85Dbo / Mmjax (APP / PS1) الفئران (13 شهرا ، n = 35). تم الحصول على الفئران من مصادر تجارية (انظر جدول المواد).
1. إعداد أنسجة المخ
- تخدير الفئران باستخدام جرعة قاتلة من مخدر قائم على الفينيتوين / البنتوباربيتال (150 ملغم / كغ) يتم حقنه داخل الصفاق (انظر جدول المواد) وفقا للبروتوكولات الحيوانية المعتمدة. قم بإجراء تروية القلب باستخدام محلول ملحي مخزن بالفوسفات البارد (1x PBS) لمدة 5 دقائق بسرعة 5 مل / دقيقة لمسح الأوعية الدموية في الدماغ14.
- حصاد أنسجة المخ بعد التقرير المنشور سابقا 15 ، وفصلها إلى نصف الكرة المخية الأيسر والأيمن ووضع نصف الدماغ الأيمن لكل فأر في أنبوب مخروطي 15 مل يحتوي على 5 مل من محلول بارافورمالديهايد (PFA) الطازج بنسبة 4٪ في1x PBS لمدة 72 ساعة عند 4 درجات مئوية.
ملاحظة: قد تكون الأدمغة ثابتة الغمر من 24-72 ساعة اعتمادا على المستضد قيد الدراسة. يمكن تجميد الدماغ نصف الأيسر ، بدون المخيخ ، في النيتروجين السائل ثم تخزينه عند -80 درجة مئوية ، تليها معالجة المقايسات الكيميائية الحيوية مثل ELISA والكشف الكيميائي الحيوي Aβ16.
تحذير: PFA هو مادة مسرطنة محتملة، وملامسة الجلد مع PFA قد يؤدي إلى أعراض حساسية الجلد. استخدم قفازات النتريل أو البوتيل والأقنعة وحماية العين للتعامل معها ، واستحضر تحت غطاء دخان كيميائي. - بعد الحضانة في 4٪ PFA ، احتضن أدمغة نصف الأدمغة بالتتابع في 5 مل من 10٪ ، 20٪ ، و 30٪ من محاليل السكروز المحضرة في 1x PBS لمدة 24 ساعة ، كل منها عند 4 درجات مئوية حتى تغرق أنسجة المخ في الجزء السفلي من الأنبوب المخروطي.
- بعد الحضانة في محلول السكروز بنسبة 30٪ ، قم بإزالة دماغ الهيمي ، وربت الدماغ بلطف على ورقة تصفية لإزالة محلول السكروز الزائد ، وقم بتجميد دماغ الهيمي الثابت في مسحوق الثلج الجاف لمدة 30 دقيقة. قم بتخزين دماغ الهيمي المجمد في رقائق الألومنيوم ذات العلامات الجيدة عند -80 درجة مئوية حتى الاستئصال بالتبريد.
ملاحظة: في البروتوكول الحالي ، تم تخزين أدمغة الهيمي عند -80 درجة مئوية لمدة 6-8 أشهر. - قسم دماغ الهيمي المجمد إلى أقسام سميكة 20 ميكرومتر باستخدام cryostat (انظر جدول المواد).
ملاحظة: بالنسبة للبروتوكول الحالي ، تم تقسيم أدمغة الهيمي إلى أقسام سهمية ، وإذا لزم الأمر ، يمكن أيضا إعداد الأقسام الإكليلية17. الخطوة 2 هي تلطيخ Aβ المناعي الفلورسنت على عينات أنسجة المخ الثابتة والمحمية بالتبريد.
2. التألق المناعي
- ضع أقسام أنسجة المخ السهمية (الخطوة 1.5) في صفيحة من 24 بئرا (ما يصل إلى ستة أقسام من دماغ الفأر لكل 300 ميكرولتر لكل بئر). يغسل لمدة 5 دقائق باستخدام 1x PBS ثلاث مرات في درجة حرارة الغرفة (23 درجة مئوية) عن طريق وضع الطبق على شاكر مع دوامة لطيفة.
- احتضان أقسام أنسجة المخ مع 70٪ حمض الفورميك في dH20 في درجة حرارة الغرفة لمدة 10 دقائق.
تحذير: حمض الفورميك قابل للتآكل، لذلك تجنب الجلد والاتصال بالعين. - اغسل أقسام أنسجة المخ لمدة 5 دقائق باستخدام dH20 ثلاث مرات في درجة حرارة الغرفة.
- قم بحظر التجليد غير المحدد بنسبة 0.5٪ من ألبومين مصل البقر (BSA) و 0.3٪ TritonX 100 (انظر جدول المواد) في 1x PBS في درجة حرارة الغرفة لمدة 1 ساعة.
- احتضان أقسام أنسجة المخ بجسم مضاد أولي يحمل علامة الفلوروفور (6E10 ، انظر جدول المواد) مخفف (1: 1000) في 1x PBS يحتوي على 0.3٪ TritonX 100 عند 4 درجات مئوية لمدة 24 ساعة.
ملاحظة: نظرا لأن الجسم المضاد الأساسي مقترن بالفلوروفور ، يجب تغطية اللوحة من هذه الخطوة فصاعدا ، أو يجب القيام بجميع الأعمال في غرفة مظلمة للحفاظ على فعالية الفلوروفور. - اغسل أقسام أنسجة المخ لمدة 10 دقائق باستخدام 1x PBS ثلاث مرات في درجة حرارة الغرفة.
- قم بتركيب أقسام أنسجة المخ على شرائح زجاجية مشحونة بشكل إيجابي (انظر جدول المواد) التي تحمل علامات جيدة (تعتمد معلومات الملصق على الشريحة على التفضيل) ، بعد غسل قصير ب dH20 لإزالة الأملاح المتبقية. دع الشرائح تجف في الهواء في الظلام.
ملاحظة: يجب تركيب أقسام الدماغ بعناية لتجنب الطيات والتمزقات ، مما يؤثر على تحديد كمية البيانات. في حالة حدوث تمزقات و / أو طيات تقع في المنطقة محل الاهتمام ويمكن أن تتداخل مع تحديد كمية البيانات ، يوصى بإعادة التلطيخ وإعادة التركيب. - قم بتركيب أقسام أنسجة المخ باستخدام وسائط تركيب مائية (انظر جدول المواد) وضع الغطاء الزجاجي فوق الأنسجة. أغلق نهايات الغطاء بطلاء أظافر شفاف وخزن الشرائح في صندوق شرائح عند 4 درجات مئوية حتى التصوير.
ملاحظة: في البروتوكول الحالي ، تم تصوير الشرائح في غضون شهر 1 بعد التلطيخ.
3. التصوير
- قم بتصوير أقسام الدماغ الملطخة ب 6E10 باستخدام مجهر فلوري (epifluorescence أو confocal) (انظر جدول المواد) ، والذي يهدف إلى 2x لالتقاط قسم أنسجة المخ بالكامل في صورة واحدة وهو مجهز بالمرشح المناسب (GFP في هذا العمل).
ملاحظة: يجب أن تكون إعدادات التصوير متسقة عبر شرائح مختلفة. - احفظ الصور الملتقطة كملف TIFF أو كما هو مطلوب وافتحها في برنامج تحليل الصور (راجع جدول المواد) كما هو موضح في الخطوة 4.2 أدناه لتحديد كمية 6E10.
ملاحظة: قم بتضمين شريط مقياس قبل التقاط الصورة لتحديد كميتها في برنامج تحليل الصور، ImageJ.
4. تحليل المنطقة الكاملة للاهتمامات
ملاحظة: منطقتا الاهتمام في هذا العمل هما الحصين والقشرة الأيزو. يمثل تحليل المنطقة الكاملة ذات الاهتمام تحليل القشرة المتساوية بأكملها (يشار إليها باسم القشرة من الآن فصاعدا) أو الحصين في قسم أنسجة المخ المصورة.
- قم بتنزيل برنامج تحليل الصور (انظر جدول المواد) وابدأ تشغيل البرنامج بمجرد تثبيته.
- بمجرد تشغيل البرنامج ، انقر فوق ملف | فتح | اختر الصورة المراد تحليلها.
- انقر على تحليل | تعيين المقياس| انقر لإزالة المقياس. حدد الأداة مستقيمة من شريط أدوات البرنامج وارسم خطا مستقيما على طول شريط المقياس. انقر على تحليل | القياس. لاحظ طول أو مسافة شريط المقياس بالبكسل. انقر على تحليل | تعيين المقياس.
- في النافذة المنبثقة، أدخل المسافة بالبكسل، والمسافة المعروفة لشريط المقياس (بالميكرومتر في هذه الحالة)، ووحدة الطول بميكرومتر. تحقق من Global لتطبيق إعداد المقياس الجديد على جميع الصور التالية إذا تمت معالجة صور متعددة. انقر فوق موافق لتطبيق الإعدادات.
ملاحظة: يوصى دائما بالتحقق مما إذا كان يتم تطبيق المقياس الدقيق على الصورة قبل إجراء مزيد من التحليل.
- في النافذة المنبثقة، أدخل المسافة بالبكسل، والمسافة المعروفة لشريط المقياس (بالميكرومتر في هذه الحالة)، ووحدة الطول بميكرومتر. تحقق من Global لتطبيق إعداد المقياس الجديد على جميع الصور التالية إذا تمت معالجة صور متعددة. انقر فوق موافق لتطبيق الإعدادات.
- لتعيين القياس المطلوب إلى مساحة القسم، انتقل إلى تحليل | تعيين القياسات | حدد مربعي المنطقة وتسمية العرض. تحقق من تحديد الصورة التي يتم تحليلها ضمن إعادة التوجيه إلى.
- لسهولة تصور الحصين أو القشرة، انتقل إلى الصورة | ضبط | السطوع/التباين. اسحب شريط الشريحة الأقصى تدريجيا إلى اليسار لزيادة وضوح الأنسجة حتى يتم تحديد مناطق الدماغ ذات الاهتمام.
ملاحظة: لا تقم بتطبيق هذا الإعداد لتجنب القياسات الخاطئة أثناء التحليل، بل انتقل إلى الخطوة التالية. - استخدم أداة تحديد المضلع أو أداة التحديد اليدوي لتحديد منطقة الحصين. انقر فوق خيار إعادة الضبط لإعدادات السطوع / التباين بمجرد تحديد الحصين للعودة إلى السطوع الأصلي.
ملاحظة: يجب تكرار الخطوات بشكل منفصل للمنطقة القشرية . - لقياس إجمالي مساحة الأنسجة في المنطقة المحددة ، انقر فوق تحرير | واضح في الخارج. بمجرد أن تصبح المنطقة المحددة هي الصورة الوحيدة التي تظهر على الشاشة ، انقر فوق تحليل | قم بالقياس للحصول على إجمالي مساحة الأنسجة التي تم تحليلها في نافذة منبثقة. احفظ البيانات في ملف Excel لاستخدامها لاحقا.
- لقياس المنطقة الموجبة 6E10، انتقل إلى Image | ضبط | عتبة اللون. عادة ما يوفر المرشح المصنوع مسبقا بموجب طريقة العتبة النتائج المرجوة التي تسلط الضوء على أقوى الإشارات باللون الأحمر.
ملاحظة: يعتمد اختيار العتبة الأمثل على خلفية الصورة وكثافة التلطيخ. حدد إعداد عتبة يلتقط البقعة وليس الخلفية. - بعد تحديد العتبة المناسبة، تحقق من الخلفية الداكنة. سيؤدي ذلك إلى تسليط الضوء على بقع Aβ (وصمة الاهتمام) على خلفية سوداء. انقر على تحديد | | الأصلي حدد ، مع إعطاء الإشارات المظلمة (رواسب Aβ) على خلفية بيضاء. انقر على تحليل | قم بتحليل الجسيمات وانقر فوق موافق عند إنشاء النافذة المنبثقة.
- انسخ مخرجات الملخص التي تم إنشاؤها بواسطة البرنامج بالنقر فوق تحرير | نسخ. الصق في ملف Excel الذي تم تشغيله مسبقا باستخدام التسميات ذات الصلة. هذه هي المنطقة الإيجابية 6E10 في المناطق المحددة ذات الأهمية (إما الحصين أو القشرة).
ملاحظة: في Excel، سيكون هناك عمود لإجمالي المنطقة الموجبة 6E10 (الخطوة 4.10) وإجمالي مساحة الأنسجة (الخطوة 4.7). - احسب المساحة الموجبة 6E10 (٪) على النحو التالي16: (إجمالي المساحة الإيجابية 6E10 / إجمالي مساحة الأنسجة التي تم تحليلها) × 100.
5. تحليل المناطق دون الإقليمية ذات الأهمية
ملاحظة: يمثل تحليل المنطقة الفرعية ذات الاهتمام تحليل جزء من القشرة أو الحصين في قسم أنسجة المخ المصورة.
- قم بتنزيل برنامج تحليل الصور وابدأ تشغيل البرنامج بمجرد تثبيته.
- بمجرد تشغيل البرنامج ، انقر فوق ملف | فتح | اختر الصورة المراد تحليلها.
- انقر على تحليل | تعيين المقياس| انقر لإزالة المقياس. حدد الأداة مستقيمة من شريط أدوات البرنامج وارسم خطا مستقيما على طول شريط المقياس. انقر على تحليل | القياس. لاحظ طول أو مسافة شريط المقياس بالبكسل. انقر على تحليل | تعيين المقياس.
- في النافذة المنبثقة، أدخل المسافة بالبكسل، والمسافة المعروفة لشريط المقياس (بميكرومتر في هذه الحالة)، وأدخل وحدة الطول ك μm. تحقق من Global لتطبيق إعداد المقياس الجديد على جميع الصور التالية إذا تمت معالجة صور متعددة. انقر فوق موافق لتطبيق الإعدادات.
ملاحظة: يوصى دائما بالتحقق مما إذا كان يتم تطبيق المقياس الدقيق على الصورة قبل إجراء مزيد من التحليل.
- في النافذة المنبثقة، أدخل المسافة بالبكسل، والمسافة المعروفة لشريط المقياس (بميكرومتر في هذه الحالة)، وأدخل وحدة الطول ك μm. تحقق من Global لتطبيق إعداد المقياس الجديد على جميع الصور التالية إذا تمت معالجة صور متعددة. انقر فوق موافق لتطبيق الإعدادات.
- لتعيين القياس المطلوب إلى مساحة القسم، انتقل إلى تحليل | تعيين القياسات | حدد مربعي المنطقة وتسمية العرض. تحقق من تحديد الصورة التي يتم تحليلها ضمن إعادة التوجيه إلى.
- اضبط السطوع والتباين إذا كانت الصورة قاتمة للغاية ولا يمكن تحديد مناطق الدماغ (على سبيل المثال ، الحصين أو القشرة في هذه الحالة) بسهولة. استخدم شريط أدوات البرنامج وانقر على صورة | ضبط | السطوع/التباين واسحب أشرطة التمرير القصوى إلى اليسار حسب الحاجة لزيادة رؤية الأنسجة.
ملاحظة: لا تقم بتطبيق هذا الإعداد لتجنب القياسات الخاطئة أثناء التحليل، بل انتقل إلى الخطوة التالية. - باستخدام أداة المستطيل، حدد المنطقة ذات الأهمية في القشرة أو الحصين. استخدم شريط الأدوات وانقر على تحرير | | الاختيار حدد، وقم بتغيير الارتفاع والعرض إلى قيمة محددة مسبقا. اضبط الصندوق ، بحيث يتم تغطيته بالكامل بالأنسجة. أعد تعيين السطوع/التباين للعودة إلى السطوع الأصلي.
ملاحظة: يجب أن يكون حجم المربع المستخدم لتحديد مناطق الاهتمام متناسقا لجميع الصور. بالنسبة للتحليل الحالي ، كان حجم الصندوق إما 300 بكسل × 300 بكسل (أي ما يعادل 1177 ميكرومتر × 1177 ميكرومتر) أو 400 بكسل × 200 بكسل (أي ما يعادل 1569 ميكرومتر × 784 ميكرومتر). - قم بتكرار المنطقة المحددة ذات الأهمية عن طريق النقر بزر الماوس الأيمن فوق المربع والنقر فوق تكرار. سيتم فتح نافذة جديدة مع المنطقة المحددة. أعد تسمية الصورة المكررة لعرض المنطقة التي تقع فيها (على سبيل المثال، القشرة أو الحصين).
- اضبط نوع الصورة المكررة باستخدام شريط الأدوات والنقر فوق صورة | النوع | 8 بت لتحويل صورة RGB المكررة إلى 8 بت لتحليل اللويحات بشكل أفضل. عكس الصورة بالنقر فوق تحرير | عكس.
- لقياس المنطقة الموجبة 6E10، انتقل إلى Image | ضبط | العتبة. عادة ما يوفر المرشح المحدد مسبقا ضمن طريقة العتبة النتائج المرجوة من خلال تسليط الضوء على أقوى الإشارات باللون الأحمر.
ملاحظة: يعتمد اختيار العتبة الأمثل على خلفية الصورة وكثافة التلطيخ. حدد إعداد عتبة يلتقط البقعة وليس الخلفية. - بعد تحديد الحد الأدنى المناسب، حدد تطبيق.
- لتحليل المنطقة الإيجابية 6E10 ، استخدم شريط الأدوات وانقر فوق تحليل | تحليل الجسيمات، وضمان التحقق من "تلخيص النتائج".
- انسخ إخراج الملخص باستخدام النسبة المئوية للمنطقة التي تم إنشاؤها بواسطة البرنامج بالنقر فوق تحرير | نسخ. الصق في ملف Excel الذي تم تشغيله مسبقا باستخدام التسميات ذات الصلة.
- كرر الخطوات 5.3-5.12 للمناطق المختلفة في الأنسجة. تأكد من أن موضع كل مربع لتحديد منطقة الاهتمام متناسق بين كل صورة.
ملاحظة: يمكن استخدام أداة التدوير إذا كانت أبعاد صندوق أدوات المستطيل لا يمكن أن تتناسب مع المنطقة المحددة بسبب انحناء الأنسجة. - لتدوير المستطيل ، استخدم شريط الأدوات وانقر فوق تحرير | | الاختيار قم بتدوير درجة الدوران وضبطها حسب الحاجة. قم بتكرار الصورة كما هو مذكور في الخطوة 5.7 وامسح الخارج باستخدام شريط الأدوات والنقر فوق تحرير | واضح في الخارج ، مما يزيل بقع 6E10 خارج المستطيل المحدد. تابع الخطوة 5.8 الموضحة أعلاه.
النتائج
هنا ، تتم مقارنة طريقتين مختلفتين لتحديد المنطقة الإيجابية 6E10 في الحصين وقشرة أنسجة دماغ الفئران. والطريقتان هما تحليلات المنطقة الكاملة والمنطقة دون الإقليمية ذات الأهمية (الشكل 1). يتضمن تحليل المنطقة الكاملة ذات الاهتمام ، كما يوحي الاسم ، تحديد المنطقة بأكملها ذات الاهتمام (في هذه الحالة ، إما القشرة المتساوية أو الحصين) لتحديد المنطقة الموجبة 6E10 (الشكل 1A ، B). يتضمن تحليل المنطقة دون الإقليمية ذات الأهمية اختيار منطقة محددة مسبقا داخل المنطقة ذات الاهتمام لتحديد المنطقة الإيجابية 6E10 (الشكل 1C ، D). يظهر بروتوكول ImageJ التدريجي للطريقتين في الشكل 2 والشكل 3 والشكل 4.
استخدمت هذه الدراسة ثلاثة قراء. وأجرى قارئان مستقلان تحليلا لمنطقة الاهتمام الفرعية، وأجرى القارئ الثالث تحليلا لكامل منطقة الاهتمام. كما هو موضح في الشكل 5A و B ، كان هناك ارتباط إيجابي كبير قوي (p < 0.0001) بين المنطقة الإيجابية 6E10 التي أبلغ عنها القارئان اللذان أجريا تحليل المنطقة الفرعية ذات الاهتمام (معامل ارتباط بيرسون r = 0.97 للقشرة و r = 0.96 للحصين). وبلغ متوسط المناطق الإيجابية 6E10 التي أبلغ عنها القارئان لتحليل الاهتمام دون الإقليمي، وتقاسم متوسط المنطقة الفرعية ذات الأهمية 6E10 علاقة إيجابية كبيرة قوية (p < 0.0001) مع المنطقة الإيجابية 6E10 التي تم الحصول عليها باستخدام تحليل كامل منطقة الاهتمام لكل من القشرة (معامل ارتباط بيرسون r = 0.96; الشكل 5 جيم) والحصين (معامل ارتباط بيرسون r = 0.95; الشكل 5 دال). وكان متوسط المنطقة الإيجابية القشرية والحصين 6E10 التي حصلت عليها تحليلات المنطقة الكاملة والمنطقة الفرعية ذات الأهمية قابلا للمقارنة دون وجود فرق كبير، مما يؤكد الاتفاق بين الطريقتين (الشكل 5E). علاوة على ذلك ، تم قياس Aβ1-42 غير القابل للذوبان في متجانسات الدماغ بالكامل في مجموعة فرعية من الفئران وكانت المنطقة القشرية (الشكل 5F) والحصين (الشكل 5G) 6E10 الإيجابية التي حددها تحليل المنطقة الكاملة ذات الاهتمام مرتبطة بشكل كبير (p < 0.01) بحمل Aβ1-42 غير القابل للذوبان باستخدام ELISA (انظر جدول المواد).
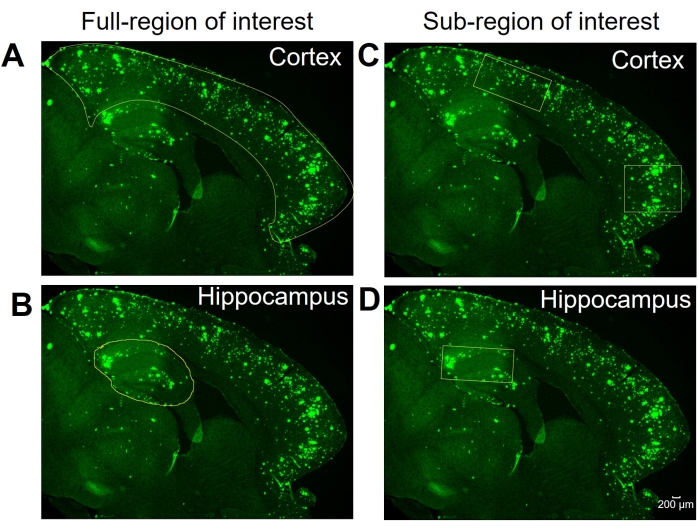
الشكل 1: اختيار المناطق ذات الاهتمام الكامل مقابل المناطق الفرعية. صور تمثيلية تظهر كامل القشرة المتساوية (القشرة) والحصين المحددة لتحليل المنطقة الكاملة ذات الأهمية في (A) و (B) ، على التوالي. تظهر الصور التمثيلية اختيار المنطقة الفرعية / المناطق الفرعية للقشرة والحصين لتحليل المنطقة الفرعية ذات الاهتمام في (C) و (D) ، على التوالي. شريط المقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
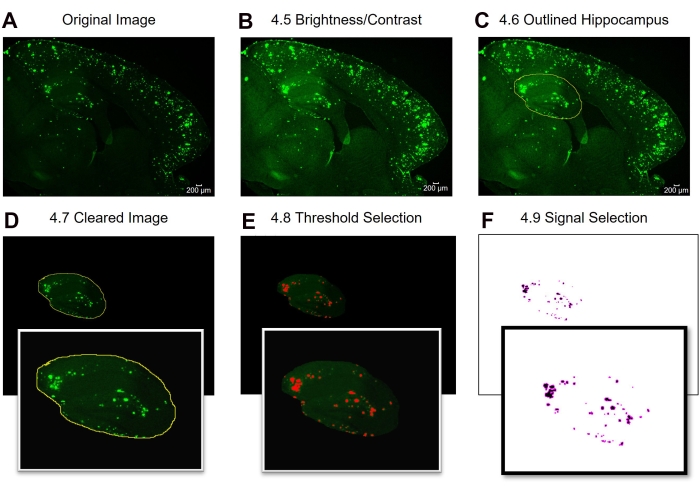
الشكل 2: بروتوكول للمنطقة الكاملة ذات الأهمية 6E10 - تحديد كمية المنطقة الإيجابية. خطوات تحليل الصورة التي تعرض الصورة الأصلية (A)، والصورة بعد ضبط السطوع/التباين (B)، وتحديد منطقة الاهتمام (C)، والمسح (D)، وضبط العتبة (E)، والصورة النهائية الجاهزة للتحليل (F). تشير الأرقام الموجودة في الشكل إلى أرقام الخطوات في البروتوكول. شريط المقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
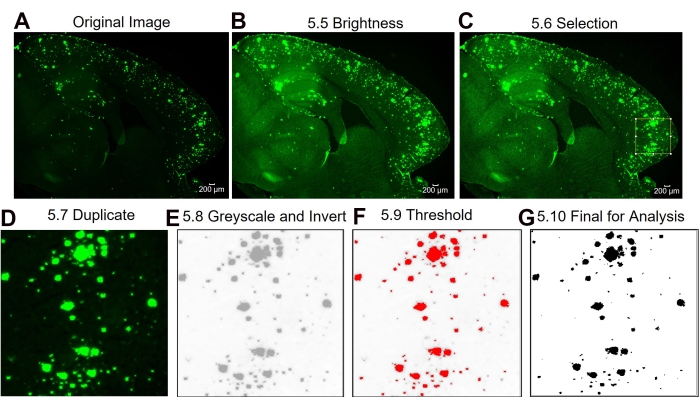
الشكل 3: بروتوكول المنطقة دون الإقليمية ذات الأهمية 6E10 - تحديد كمية المنطقة الإيجابية. خطوات تحليل الصورة التي تظهر الصورة الأصلية (A)، والصورة بعد ضبط السطوع/التباين (B)، واختيار منطقة الاهتمام (C)، وتكرار صورة المنطقة ذات الاهتمام (D)، وتغيير الصورة إلى 8 بت وعكس الصورة (E)، وضبط العتبة (F)، والصورة النهائية الجاهزة للتحليل (G). تشير الأرقام الموجودة في الشكل إلى أرقام الخطوات في البروتوكول. شريط المقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
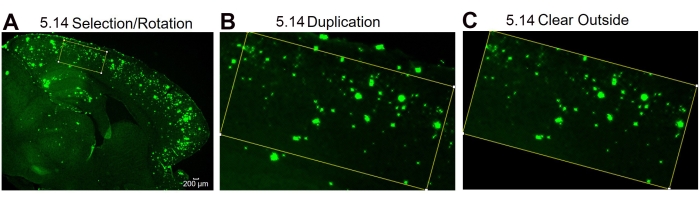
الشكل 4: بروتوكول لتناوب منطقة الاهتمام. خطوات تحليل الصور التي توضح اختيار منطقة الاهتمام ودوران مربع التحديد لتناسب انحناء الأنسجة (A) ، وصورة المنطقة ذات الاهتمام بعد الازدواجية (B) ، والصورة بعد مسح المنطقة الخارجية (غير منطقة الاهتمام) (C). تشير الأرقام الموجودة في الشكل إلى رقم الخطوة في البروتوكول. شريط المقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
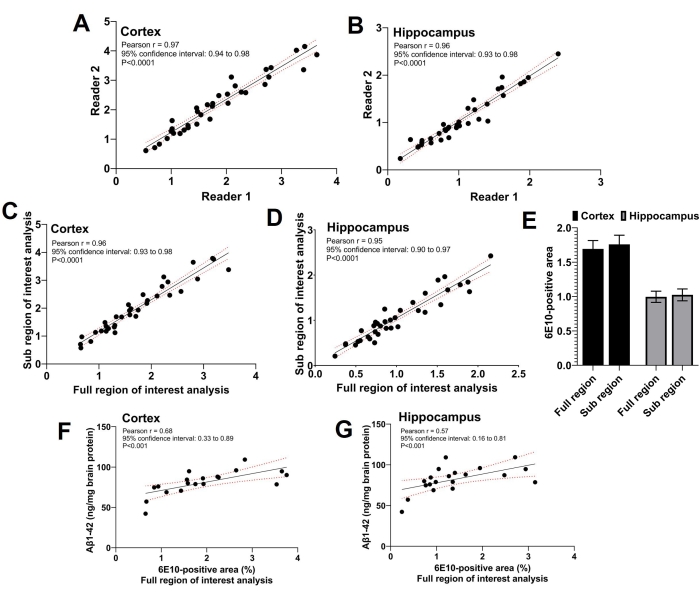
الشكل 5: العلاقة بين تحليلات المناطق الكاملة والمناطق الفرعية ذات الاهتمام. تظهر المخططات المبعثرة العلاقة بين المنطقة الموجبة 6E10 من قبل القارئين المستقلين اللذين يجريان تحليل المنطقة الفرعية ذات الأهمية للقشرة (A) والحصين (B). لوحظ وجود علاقة إيجابية قوية بين المنطقة الإيجابية 6E10 الناتجة عن تحليل المنطقة الفرعية ذات الاهتمام وتحليل المنطقة الكاملة ذات الاهتمام لكل من القشرة (C) والحصين (D). لا يوجد فرق ذو دلالة إحصائية في متوسط المنطقة الإيجابية 6E10 حسب المنطقة الكاملة ذات الاهتمام والمنطقة دون الإقليمية ذات الاهتمام في القشرة والحصين (E). لوحظ وجود علاقة معنوية بين قياسات Aβ1-42 المتجانسة غير القابلة للذوبان في الدماغ بالكامل باستخدام ELISA وتحليل المنطقة الكاملة ذات الأهمية لكل من القشرة (F) والحصين (G). تم تحليل البيانات باستخدام معامل ارتباط بيرسون ، r ، في (A-D) و (F-G) ، وباستخدام مقاييس متكررة ثنائية الاتجاه ANOVA في (E) باستخدام برنامج الرسوم البيانية والإحصاءات. يتم تقديم البيانات كمتوسط ± خطأ معياري للمتوسط (SEM) من n = 35 فئران في (E) ، واعتبر p ثنائي الذيل < 0.05 ذا دلالة إحصائية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يحدد البروتوكول الموصوف هنا الإجراء الخاص بإعداد نصف الدماغ للتقسيم السهمي ، والتلطيخ المناعي الفلوري لرواسب Aβ باستخدام الجسم المضاد 6E10 على أقسام عائمة حرة ، وتصوير أقسام الدماغ الملطخة ب Aβ متبوعا بقياس كمي لرواسب Aβ في القشرة الدماغية والحصين من أنسجة دماغ الفئران باستخدام برنامج تحليل الصور. في حين أن هناك بروتوكولات منشورة لتحديد كمية حمل Aβ في أقسام أنسجة المخ 8,10 ، يصف هذا البروتوكول الخطوات التي ينطوي عليها التحديد الكمي لحمل Aβ في كامل قشرة iso-cortex (المشار إليها باسم القشرة) والحصين بالمقارنة مع حمل Aβ في منطقة فرعية ذات أهمية في القشرة والحصين ، عندما يكون ذلك مطلوبا. ويرد أيضا الترابط بين تحليلات الاهتمام الكاملة مقابل المناطق دون الإقليمية.
هناك العديد من الخطوات الحاسمة في البروتوكول. أولا ، البروتوكول الموصوف هو لأقسام أنسجة المخ السميكة 20 ميكرومتر المعرضة للتلطيخ المناعي العائم الحر ، مما يؤدي إلى اختراق مثالي للأجسام المضادة داخل قسم الأنسجة18. قد تتطلب تقنية التعويم الحر نقل أقسام الأنسجة يدويا بين المحاليل المختلفة أثناء تلطيخ الفلورسنت المناعي ، والتعامل الدقيق مع أقسام الأنسجة طوال الإجراء. هذا أمر بالغ الأهمية بشكل خاص عندما يتم غمر أقسام الأنسجة في محلول حمض الفورميك بنسبة 70٪ لاسترجاع المستضد في البروتوكول الحالي ، مما يزيد من هشاشة الأنسجة للأقسام الرقيقة. تشمل النهج البديلة للبروتوكول الموصوف استخدام مقاطع أنسجة أكثر سمكا (على سبيل المثال ، 30-40 ميكرومتر) أو استخدام مقاطع الأنسجة التي يتم تثبيتها مباشرة على شرائح مشحونة إيجابيا قبل تلطيخ الفلورسنت المناعي. ثانيا ، يستخدم البروتوكول الموصوف هنا جسما مضادا 6E10 يحمل علامة الفلورسنت. إلى جانب استخدام الجسم المضاد 6E10 المسمى بالفلورسنت ، يمكن أيضا استخدام الأجسام المضادة 6E10 غير الفلورية (على سبيل المثال ، الأجسام المضادة 6E10 المترافقة مع بيروكسيديز الفجل) للكشف عن حمل Aβ في أقسام أنسجة المخ ، ويمكن تكييف البروتوكول الحالي لتحديد البقع الكيميائية المناعية الإيجابية Aβ في أقسام أنسجة المخ كما هو موضح سابقا8 . ثالثا ، تعتمد دقة نتائج تحديد كمية الحمل Aβ على اختيار العتبة المناسبة في برنامج التحليل ، والذي يعتمد على خلفية الأنسجة وكثافة الإشارة. يجب أن يتم اختيار العتبة من قبل المستخدم النهائي بحيث يتم اختيار البقع الإيجابية Aβ فقط للقياس الكمي. مطلوب تدخل المستخدم النهائي لتحسين العتبة المحددة التي يمكن تطبيقها على جميع الصور لضمان دقة إعداد العتبة. رابعا ، نظرا لأن تحليل المنطقة دون الإقليمية ذات الاهتمام يتطلب اختيار منطقة صغيرة ذات أهمية في قسم الأنسجة ، فقد تم استخدام قارئين مستقلين لهذا التحليل. للحفاظ على الاستقلالية والعمى أثناء جمع البيانات ، تم ترميز جميع الصور بالأرقام. تم تقسيم تسلسل تحليل الصور عشوائيا بين القراء بحيث قام القراء المختلفون بتحليل صور مختلفة في أي وقت من الأوقات ، وتم تقديم البيانات في نهاية كل أسبوع. نظرا لزيادة احتمال التباين بين القراء في اختيار المنطقة ذات الاهتمام في تحليل المنطقة دون الإقليمية ذات الاهتمام ، تم تدريب القراء باستخدام العديد من صور العينات لتحسين اختيار المنطقة في القشرة والحصين قبل البدء في جمع البيانات. هذا التدريب أمر بالغ الأهمية للحد من التباين بين القراء ، وكما يمكن رؤيته (الشكل 5A ، B) ، فإن المنطقة الإيجابية 6E10 التي أبلغ عنها كلا القراء تظهر اتفاقا نسبيا قويا في الدراسة الحالية.
يوفر البروتوكول الحالي والنتائج معلومات قيمة حول تأثير حجم المنطقة ذات الأهمية على تحديد كمي للمنطقة الإيجابية Aβ. ومن المتوقع أن تمثل منطقة الاهتمام الأكبر الأنسجة أكثر من منطقة اهتمام أصغر. لذلك ، من المستحسن أخذ عينات من نسيج أكبر لتحديد حمولة Aβ في الأنسجة بدقة. ومع ذلك ، في حالة توزيع الحمل Aβ المتجانس داخل الأنسجة ، تعتبر منطقة أخذ العينات الأصغر عموما تمثيلا جيدا للأنسجة الأكبر قيد التحليل. تؤكد نتائج الدراسة الحالية ذلك ، وكان حمل Aβ في القشرة بأكملها والحصين ارتباطا قويا بحمل Aβ في منطقة فرعية مختارة من القشرة والحصين (الشكل 5C ، D). ولزيادة تأكيد الاتفاق بين تحليلات المناطق الكاملة والمناطق الفرعية ذات الاهتمام، تمت مقارنة متوسط المنطقة الإيجابية 6E10 في القشرة الدماغية والحصين، ولم يتم العثور على فرق بين الطريقتين (الشكل 5E). وهذا يؤكد أن أيا من هاتين الطريقتين (تحليل المنطقة الكاملة أو الفرعية) تسفر عن قياسات حمل Aβ قابلة للمقارنة.
البروتوكول الحالي لديه بعض القيود. وقد لا تستخدم الطريقتان (تحليل المنطقة الكاملة مقابل تحليل المنطقة دون الإقليمية) دائما بالتبادل. يعتمد اختيار استخدام تحليل المنطقة الكاملة أو الفرعية على التوزيع الإقليمي ل Aβ داخل الأنسجة ، والذي يتأثر بعمر وجنس وسلالة نموذج الفأر AD. في 13 شهرا ، يتم توزيع حمل Aβ في جميع أنحاء القشرة والحصين من الفئران APP / PS1. ومع ذلك ، في 6 أشهر ، تقتصر رواسب Aβ على القشرة ، ويلاحظ الحد الأدنى من الرواسب في الحصين12. في ظل هذه الظروف ، قد يكون تحليل المنطقة الكاملة ذات الاهتمام هو النهج المرغوب فيه لزيادة منطقة أخذ عينات الأنسجة وبالتالي إشارة Aβ. من ناحية أخرى ، قد يكون تحليل المنطقة الفرعية هو الطريقة المفضلة عندما يكون حمل Aβ في منطقة معينة من الدماغ ذا أهمية ، (على سبيل المثال ، القشرة الحسية الجسدية). بالإضافة إلى ذلك ، في 13 شهرا ، تظهر الفئران الذكور APP / PS1 بقع شديدة إيجابية 6E10 ، ويؤدي تلطيخ الفلورسنت المناعي إلى إشارة ممتازة ذات خلفية منخفضة للغاية ، مما يجعل البروتوكول الحالي مناسبا جدا للقياس الكمي في ظل الظروف المحددة. من غير الواضح ما إذا كان يمكن تطبيق طريقة القياس الكمي هذه بنجاح على تلطيخ أقل كثافة ، وستكون هناك حاجة إلى عمل مستقبلي للإجابة على هذا السؤال. وتكشف طريقة الفلورسنت المناعي والقياس الكمي للصور المعروضة هنا عن جميع أشكال Aβ، بما في ذلك الشكل13 من السلائف. ونتيجة لذلك ، إذا كان هناك اهتمام بالكشف عن نوع معين من Aβ (على سبيل المثال ، Aβ1-40 أو Aβ1-42) ، يمكن استخدام الأجسام المضادة الخاصة بهذه الأشكال المتساوية Aβ. لذلك ، على الرغم من أن طريقة التلطيخ والكشف عن الفلورسنت المناعي 6E10 مرتبطة بقياسات قياسات Aβ1-42 في متجانسات الدماغ بالكامل باستخدام ELISA (الشكل 5F ، G) ، إلا أن الارتباط كان متواضعا فقط. يمكن أن يعزى ذلك إلى قياس Aβ1-42 فقط باستخدام ELISA والكشف عن جميع أنواع Aβ باستخدام تلطيخ المناعة 6E10. تستخدم الدراسة الحالية ثلاثة قراء لتقييم الاتفاق والعلاقة بين التحليلات الكاملة ودون الإقليمية. قد يؤدي وجود قراء إضافيين إلى تحسين متانة الدراسة ويمكن أن يزيد من التحقق من صحة الاتفاقات بين الطريقتين المعروضتين هنا. علاوة على ذلك ، نستخدم ارتباط بيرسون كمقياس للاتفاق ، والذي يستخدم على نطاق واسع من بين طرق أخرى لوصف الاتفاق بين المتغيرات المستمرة19. ومع ذلك ، فإن أحد القيود المفروضة على استخدام ارتباط بيرسون لتحديد الاتفاق هو أن الطريقتين المستخدمتين هنا قد تقدمان نتائج ذات صلة ، ولكن قد تؤدي إحدى الطريقتين إلى قيم أعلى بشكل عام من الأخرى بسبب التحيز المنهجي. لذلك ، فإن ارتباط بيرسون هو مقياس جيد للاتفاق النسبي19. ولزيادة متانة البروتوكول، يمكن استخدام طرق إضافية لتأكيد الاتفاق المطلق، مثل مقارنة متوسط المنطقة الموجبة 6E10 بالطريقتين (الشكل 5E)،19. يقارن البروتوكول الحالي معا حمل Aβ المكتشف بواسطة تلطيخ الفلورسنت المناعي ويحلل المناطق الكاملة والفرعية ذات الأهمية في أقسام أنسجة المخ. تظهر النتائج وجود علاقة قوية بين هاتين الطريقتين لأقسام أنسجة المخ المشتقة من الفئران الذكور APP / PS1 البالغة من العمر 13 شهرا والتي تظهر رواسب Aβ وفيرة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم الأبحاث الواردة في هذا المنشور من قبل المعهد الوطني للشيخوخة التابع للمعاهد الوطنية للصحة تحت أرقام الجوائز R01AG062840 (إلى RKS) و R01AG072896 (إلى RKS). المحتوى هو مسؤولية المؤلفين فقط ولا يمثل بالضرورة وجهات النظر الرسمية للمعاهد الوطنية للصحة. حوالي 200 ألف دولار (100٪) من الأموال الفيدرالية دعمت هذا المشروع. ونود أيضا أن نشكر الدكتور جوشوا يانغ على مساعدته في تحرير المخطوطات.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | ThermoFisher Scientific, MA, USA | 339650 | |
| 24-well plates | Fisher Scientific, NH, USA | FB012929 | |
| Amyloid beta 42 human ELISA kit | ThermoFisher Scientific, MA, USA | KHB3441 | |
| Aqueous mounting media | Vector laboratories, CA, USA | H-5501-60 | |
| Bovine serum albumin | Sigmaaldrich, MO, USA | A2153-50G | |
| BZ-X710 Keyence all-in-one fluorescence microscope | Keyence, IL, USA | BZ-X710 | |
| Clear nail poilsh | User preference | NA | |
| Cryostat | Leica Biosystems, IL, USA | Leica CM1860 Cryostat | |
| Formic acid | Sigmaaldrich, MO, USA | F0507-500ML | |
| Glass coverslips | VWR, PA, USA | 48393-081 | |
| GraphPad Prism | GraphPad Software, CA, USA | Version 8 | |
| ImageJ 1.51k | National Institutes of Health, MD, USA | Version 1.53e | |
| Mice | Jackson Laboratories, ME, USA | 034829-JAX | |
| Paraformaldehyde | Sigmaaldrich, MO, USA | P6148-500G | |
| Phenytoin/pentobarbital based anesthetic (Euthasol) | Patterson Veterinary, MA, USA | 07-805-9296 | |
| Phosphate-buffered saline | Fisher Scientific, NH, USA | BP661-50 | |
| Plus (+) microscope slides | Ted Pella, Inc., CA, USA | 260100 | |
| Primary antibody (6E10) | Biolegend, CA, USA | 803013 | |
| Sucrose | Sigmaaldrich, MO, USA | 47289 | |
| Triton X 100 | Sigmaaldrich, MO, USA | T8787-100ML |
References
- Alzheimer's Association. 2021 Alzheimer's disease facts and figures. Alzheimer's & Dementia. 17 (3), 327-406 (2021).
- Langa, K. M., Foster, N. L., Larson, E. B. Mixed dementia: emerging concepts and therapeutic implications. Journal of the American Medical Association. 292 (23), 2901-2908 (2004).
- Gandy, S., DeKosky, S. T. Toward the treatment and prevention of Alzheimer's disease: rational strategies and recent progress. Annual Review of Medicine. 64, 367-383 (2013).
- Bloom, G. S. Amyloid-beta and tau: the trigger and bullet in Alzheimer disease pathogenesis. JAMA Neurology. 71 (4), 505-508 (2014).
- Gremer, L., et al. Fibril structure of amyloid-beta(1-42) by cryo-electron microscopy. Science. 358 (6359), 116-119 (2017).
- Ferrero, J., et al. First-in-human, double-blind, placebo-controlled, single-dose escalation study of aducanumab (BIIB037) in mild-to-moderate Alzheimer's disease. Alzheimer's & Dementia Translational Research & Clinical Interventions. 2 (3), 169-176 (2016).
- Poon, C. H., Wang, Y., Fung, M. L., Zhang, C., Lim, L. W. Rodent models of amyloid-beta feature of Alzheimer's disease: development and potential treatment implications. Aging and Disease. 11 (5), 1235-1259 (2020).
- Christensen, A., Pike, C. J. Staining and quantification of beta-amyloid pathology in transgenic mouse models of Alzheimer's disease. Methods in Molecular Biology. 2144, 221(2020).
- Thakker, D. R., et al. Intracerebroventricular amyloid-beta antibodies reduce cerebral amyloid angiopathy and associated micro-hemorrhages in aged Tg2576 mice. Proceedings of the National Academy of Sciences of the United States of America. 106 (11), 4501-4506 (2009).
- Song, Z., et al. Detecting amyloid-beta accumulation via immunofluorescent staining in a mouse model of Alzheimer's disease. Journal of Visualized Experiments. (170), e62254(2021).
- Sun, J., et al. Hematologic safety of chronic brain-penetrating erythropoietin dosing in APP/PS1 mice. Alzheimer's & DementiaTranslational Research & Clinical Interventions. 5, 627-636 (2019).
- Jankowsky, J. L., et al. Mutant presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo: evidence for augmentation of a 42-specific gamma secretase. Human Molecular Genetics. 13 (2), 159-170 (2004).
- Grant, M. K. O., et al. Human cerebrospinal fluid 6E10-immunoreactive protein species contain amyloid precursor protein fragments. PloS One. 14 (2), 0212815(2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Eichenbaum, K. D., et al. Minimally invasive method for murine brain fixation. Biotechniques. 39 (4), 487-490 (2005).
- Chang, R., et al. Blood-brain barrier penetrating biologic tnf-alpha inhibitor for Alzheimer's disease. Molecular Pharmaceutics. 14 (7), 2340-2349 (2017).
- Pinskiy, V., et al. High-throughput method of whole-brain sectioning, using the tape-transfer technique. PloS One. 10 (7), 0102363(2015).
- Potts, E. M., Coppotelli, G., Ross, J. M. Histological-based stainings using free-floating tissue sections. Journal of Visualized Experiments. (162), e61622(2020).
- van Stralen, K. J., Dekker, F. W., Zoccali, C., Jager, K. J. Measuring agreement, more complicated than it seems. Nephron Clinical Practice. 120 (3), 162-167 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved