Method Article
Voll- versus subregionale Quantifizierung der Amyloid-Beta-Belastung von Hirnschnitten der Maus
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt und vergleicht das Verfahren zur Durchführung einer Analyse der gesamten Region oder Subregion von Interesse an sagittalen Hirnschnitten der Maus zur Quantifizierung der Amyloid-Beta-Belastung im transgenen APP/PS1-Mausmodell der Alzheimer-Krankheit.
Zusammenfassung
Die extrazelluläre Akkumulation von Amyloid-Beta (Aβ)-Plaques ist eines der wichtigsten pathologischen Merkmale der Alzheimer-Krankheit (AD) und das Ziel der einzigen von der FDA zugelassenen krankheitsmodifizierenden Behandlung von AD. Dementsprechend wird die Verwendung von transgenen Mausmodellen, die das Amyloid-Vorläuferprotein überexprimieren und dadurch zerebrale Aβ-Plaques akkumulieren, häufig verwendet, um die menschliche AD bei Mäusen zu modellieren. Daher messen Immunoassays, einschließlich enzymgebundener Immunsorbentien-Assays (ELISA) und Immunfärbung, üblicherweise die Aβ-Last in Hirngeweben, die von transgenen AD-Mäusen stammen. Obwohl die Methoden für den Aβ-Nachweis und die Quantifizierung gut etabliert und dokumentiert sind, wurde der Einfluss der Größe der im Hirngewebe ausgewählten Region von Interesse auf Aβ-Lastmessungen nach Immunfärbung nicht berichtet. Daher zielte das aktuelle Protokoll darauf ab, die Aβ-Lastmessungen über die von Interesse befindlichen Voll- und Teilregionen mit einer Bildanalysesoftware zu vergleichen. Die Schritte bei der Vorbereitung des Hirngewebes, der Immunfärbung des frei schwebenden Hirnabschnitts, der Bildgebung und der Quantifizierung der Aβ-Last in Voll- und Subregionen von Interesse werden anhand von Hirnschnitten beschrieben, die von 13 Monate alten APP / PS1-Doppeltransgenen männlichen Mäusen abgeleitet wurden. Das aktuelle Protokoll und die Ergebnisse liefern wertvolle Informationen über den Einfluss der Größe der interessierenden Region auf die Aβ-positive Flächenquantifizierung und zeigen eine starke Korrelation zwischen der Aβ-positiven Fläche, die unter Verwendung der Voll- und Subregionen von Interessenanalysen für Hirnschnitte erhalten wurde, die von 13 Monate alten männlichen APP / PS1-Mäusen abgeleitet wurden, die eine weit verbreitete Aβ-Ablagerung zeigen.
Einleitung
Die Alzheimer-Krankheit (AD), die sechsthäufigste Todesursache in den Vereinigten Staaten, ist nach wie vor eine Bedrohung für die öffentliche Gesundheit, wobei schätzungsweise 6,2 Millionen Amerikaner mit AD leben. Bis 2060 werden voraussichtlich 13,8 Millionen erreicht1. Bis heute ist die symptomatische Behandlung durch Medikamente wie Cholinesterasehemmer und Memantin der primäre Behandlungsverlauf2. AD ist gekennzeichnet durch neuropathologische Manifestationen wie extrazelluläre Ablagerung von Amyloid-beta (Aβ)-Plaques und intrazelluläre hyperphosphorylierte Tau-Akkumulation in Form von neurofibrillären Verwicklungen 3,4. Gebildet durch eine endoproteolytische Spaltung des Amyloid-Vorläuferproteins (APP) über Beta- und Gamma-Sekretase, aggregiert Aβ zu Oligomeren und Fibrillen, was zu neurotoxischen Wirkungenführt 5. Es wird angenommen, dass Aβ seit den 1980er Jahren eine primäre pathologische Rolle spielt und das therapeutische Ziel der einzigen von der FDA zugelassenen krankheitsmodifizierenden Therapie für AD6 ist. Infolgedessen werden transgene AD-Mausmodelle, die Mutationen in Genen beherbergen, die zu einer robusten zerebralen Aβ-Akkumulation führen, seit den frühen 1990er Jahren häufig für die präklinische AD-Forschung eingesetzt7.
Der Nachweis von Aβ-Spezies in diesen transgenen AD-Mausgehirnen erfolgt im Allgemeinen unter Verwendung von zwei Immunoassays: Enzym-linked Immunosorbent Assay (ELISA) und Immunfärbung. Der erste Assay ermöglicht die quantitative Bestimmung verschiedener Aβ-Spezies und ist im Vergleich zur Immunfärbung, die mehrere aufeinanderfolgende Gewebeverarbeitungs- und Bildgebungsschritte erfordert, einschließlich Gewebeschnitt, Immunfärbung, Bildgebung und Quantifizierung8. Darüber hinaus sind die Ergebnisse, die nach der Immunfärbung erzielt wurden, semi-quantitativ8. Die Fähigkeit, Aβ räumlich zu lokalisieren, macht die Immunfärbung jedoch zu einem attraktiven Ansatz für den Aβ-Nachweis im Hirngewebe8.
Bei der Verwendung der Aβ-Immunfärbung wurden verschiedene Quantifizierungsparadigmen von verschiedenen Forschungsgruppen eingesetzt. Zum Beispiel quantifizieren einige Forschungsgruppen die Aβ-Last in der gesamten interessierenden Region (Kortex oder Hippocampus), während andere die Aβ-Last in einer bestimmten Subregion von Interesse (einem Teil des Kortex oder des Hippocampus) quantifizieren9,10,11. Obwohl die Methoden für den Aβ-Nachweis und die Quantifizierung gut etabliert und dokumentiert sind, wurde der Einfluss der Größe der interessierenden Region auf Aβ-Belastungsmessungen nach Immunflecken nicht berichtet. Daher zielte das aktuelle Protokoll darauf ab, die Aβ-Lastmessungen über die Voll- und Unterregionen von Interesse mit einer Bildanalysesoftware, ImageJ, zu vergleichen.
Die aktuelle Studie verwendete 13 Monate alte APP / PS1-Doppeltransgene männliche Mäuse, die eine chimäre Maus / menschliche APP und ein mutiertes Presenilin 1 exprimieren, um den frühen Beginn von AD12 zu modellieren. Aβ-Ablagerungen beginnen sich im Alter von 6-7 Monaten zu entwickeln, und eine reichliche Aβ-Akkumulation wird sowohl im Kortex als auch im Hippocampus dieser Mäuse im Alter von 9-10 Monaten im Alter von12 Jahren beobachtet. Die transgenen Amyloidpeptide und das Holoprotein können durch 6E10-Immunfärbung13 nachgewiesen werden, was es zu einem wünschenswerten Tiermodell für das vorliegende Protokoll macht. Das hierin behandelte Verfahren umfasst die Vorbereitung des Hirngewebes, die Immunfärbung von frei schwebenden Abschnitten, die Bildgebung und die Quantifizierung der Aβ-Belastung in Voll- und Unterregionen von Interesse. Die Analyse zeigt eine starke Korrelation zwischen der voll- und subregionalen Quantifizierung, was auf eine robuste Übereinstimmung zwischen diesen beiden Methoden in den Hirngewebeabschnitten hinweist, die von 13 Monate alten männlichen APP / PS1-Mäusen stammen, die reichlich Aβ-Ablagerungen aufweisen.
Protokoll
Alle Tierversuche wurden in Übereinstimmung mit dem University Laboratory Animal Resources gemäß Protokollen durchgeführt, die vom Institutional Animal Care and Use Committee der University of California, Irvine, genehmigt wurden. Die Experimente wurden mit männlichen B6C3-Tg(APPswe, PSEN1dE9)85Dbo/Mmjax (APP/PS1) Mäusen (13 Monate alt, n = 35) durchgeführt. Die Mäuse wurden aus kommerziellen Quellen gewonnen (siehe Materialtabelle).
1. Vorbereitung des Hirngewebes
- Anästhesien der Mäuse mit einer tödlichen Dosis eines auf Phenytoin/Pentobarbital basierenden Anästhetikums (150 mg/kg), das intraperitoneal (siehe Materialtabelle) gemäß den genehmigten Tierprotokollen injiziert wird. Führen Sie eine Herzdurchblutung mit eiskalter phosphatgepufferter Kochsalzlösung (1x PBS) für 5 min mit einer Geschwindigkeit von 5 ml / min durch, um das Gefäßsystem des Gehirnszu reinigen 14.
- Entnehmen Sie Hirngewebe nach dem zuvor veröffentlichten Bericht 15, trennen Sie sich in die linke und rechte Gehirnhälfte und legen Sie das rechte Hemi-Gehirn jeder Maus in ein 15 ml konisches Röhrchen, das 5 ml frisch zubereitete 4% Paraformaldehyd (PFA) -Lösung in1x PBS für 72 h bei 4 ° C enthält.
HINWEIS: Das Gehirn kann je nach untersuchtem Antigen von 24-72 h eingetaucht sein. Das linke Gehirn, ohne Kleinhirn, kann in flüssigem Stickstoff schockgefroren und dann bei -80 °C gelagert werden, gefolgt von der Verarbeitung für biochemische Assays wie ELISA und biochemischen Aβ-Nachweis16.
VORSICHT: PFA ist ein wahrscheinliches Karzinogen, und Hautkontakt mit PFA kann zu allergischen Hautsymptomen führen. Verwenden Sie Nitril- oder Butylhandschuhe, Masken und Augenschutz für die Handhabung und bereiten Sie sie unter einem chemischen Abzug vor. - Nach der Inkubation in 4% PFA inkubieren Sie die Hemi-Gehirne nacheinander in 5 ml von 10%, 20% und 30% Saccharoselösungen, die in 1x PBS für 24 h bei jeweils 4 ° C hergestellt wurden, bis das Hirngewebe auf den Boden der konischen Röhre sinkt.
- Entfernen Sie nach der Inkubation in der 30% igen Saccharoselösung das Hemi-Gehirn, tupfen Sie das Gehirn vorsichtig auf ein Filterpapier, um die überschüssige Saccharoselösung zu entfernen, und frieren Sie das fixierte Halbhirn in pulverisiertem Trockeneis für 30 min ein. Lagern Sie das gefrorene Halbhirn in gut beschrifteten Aluminiumfolien bei -80 °C bis zur Kryosektion.
HINWEIS: Im aktuellen Protokoll wurden die Hemi-Gehirne bei -80 °C für 6-8 Monate gelagert. - Schneiden Sie das gefrorene Halbhirn mit einem Kryostaten in 20 μm dicke Abschnitte (siehe Materialtabelle).
HINWEIS: Für das aktuelle Protokoll wurden die Hemi-Gehirne in sagittale Abschnitte unterteilt, und bei Bedarf können auch koronale Abschnitte vorbereitetwerden 17. Schritt 2 ist die Aβ-Immunfluoreszenzfärbung auf fixierten und kryogeschützten Hirngewebeproben.
2. Immunfluoreszenz
- Legen Sie die sagittalen Hirngewebeabschnitte (Schritt 1.5) in eine 24-Well-Platte (bis zu sechs Maus-Hirnschnitte pro 300 μL pro Well). 5 min mit 1x PBS dreimal bei Raumtemperatur (23 °C) waschen, indem Sie die Platte mit sanftem Wirbeln auf einen Shaker legen.
- Inkubieren Sie die Hirngewebeschnitte mit 70% Ameisensäure in dH20 bei Raumtemperatur für 10 min.
ACHTUNG: Ameisensäure ist ätzend, vermeiden Sie daher Haut- und Augenkontakt. - Waschen Sie die Hirngewebeabschnitte für 5 min mit dH20 dreimal bei Raumtemperatur.
- Blockieren Sie unspezifische Bindung mit 0,5% Rinderserumalbumin (BSA) und 0,3% TritonX 100 (siehe Materialtabelle) in 1x PBS bei Raumtemperatur für 1 h.
- Inkubieren Sie die Hirngewebeabschnitte mit einem fluorophormarkierten Primärantikörper (6E10, siehe Materialverzeichnis), verdünnt (1:1000) in 1x PBS mit 0,3% TritonX 100 bei 4 °C für 24 h.
HINWEIS: Da der primäre Antikörper fluorophorkonjugiert ist, muss die Platte von diesem Schritt an abgedeckt werden, oder alle Arbeiten müssen in einem dunklen Raum durchgeführt werden, um die Wirksamkeit von Fluorophor aufrechtzuerhalten. - Waschen Sie die Hirngewebeabschnitte für 10 min dreimal mit 1x PBS bei Raumtemperatur.
- Montieren Sie die Hirngewebeabschnitte auf positiv geladene Glasobjektträger (siehe Materialtabelle), die gut beschriftet sind (die Etiketteninformationen auf dem Objektträger basieren auf der Präferenz), nach einer kurzen Wäsche mit dH20, um die verbleibenden Salze zu entfernen. Lassen Sie die Dias im Dunkeln an der Luft trocknen.
HINWEIS: Die Gehirnabschnitte müssen sorgfältig montiert werden, um Falten und Risse zu vermeiden, die sich auf die Datenquantifizierung auswirken. Bei Rissen und/oder Falten, die im interessierenden Bereich liegen und die Datenquantifizierung beeinträchtigen können, wird eine erneute Färbung und erneute Montage empfohlen. - Montieren Sie die Hirngewebeabschnitte mit einem wässrigen Befestigungsmedium (siehe Materialtabelle) und legen Sie das Glasdeckglas über das Gewebe. Verschließen Sie die Enden des Deckglases mit klarem Nagellack und lagern Sie die Objektträger bis zur Bildgebung in einem Objektträgerkasten bei 4 °C.
HINWEIS: Im aktuellen Protokoll wurden die Folien innerhalb von 1 Monat nach dem Färben abgebildet.
3. Bildgebung
- Stellen Sie die 6E10-gefärbten Hirnschnitte mit einem Fluoreszenzmikroskop (Epifluoreszenz oder Konfokal) auf (siehe Materialtabelle), das ein 2-faches Objektiv hat, um den gesamten Hirngewebeschnitt in einem Bild zu erfassen und mit dem entsprechenden Filter ausgestattet ist (GFP in dieser Arbeit).
HINWEIS: Die Bildeinstellungen müssen auf verschiedenen Folien konsistent sein. - Speichern Sie die aufgenommenen Bilder als TIFF-Datei oder nach Bedarf und öffnen Sie sie in der Bildanalysesoftware (siehe Materialtabelle), wie in Schritt 4.2 unten für die 6E10-Quantifizierung beschrieben.
HINWEIS: Fügen Sie eine Maßstabsleiste hinzu, bevor Sie das Bild aufnehmen, um es in der Bildanalysesoftware ImageJ zu quantifizieren.
4. Analyse der gesamten Interessenregion
HINWEIS: Die beiden interessierenden Regionen der vorliegenden Arbeit sind der Hippocampus und der Iso-Kortex. Die Full-Region-of-Interest-Analyse stellt die Analyse des gesamten Isokortex (in Zukunft als Kortex bezeichnet) oder des Hippocampus im abgebildeten Hirngewebeabschnitt dar.
- Laden Sie die Bildanalysesoftware herunter (siehe Materialverzeichnis) und starten Sie die Software nach der Installation.
- Sobald die Software läuft, klicken Sie auf Datei | | öffnen Wählen Sie das zu analysierende Bild aus .
- Klicken Sie auf | analysieren Maßstab festlegen| Klicken Sie hier, um die Skalierung zu entfernen. Wählen Sie in der Symbolleiste der Software das Werkzeug "Gerade" aus, und zeichnen Sie eine gerade Linie entlang der Länge der Maßstabsleiste. Klicken Sie auf | analysieren Messen. Notieren Sie sich die Länge oder den Abstand der Skalierungsleiste in Pixel. Klicken Sie auf | analysieren Skala einstellen.
- Geben Sie im Popup-Fenster den Abstand in Pixel, den bekannten Abstand der Skalierungsleiste (in diesem Fall in μm) und die Längeneinheit als μm ein. Aktivieren Sie das Kontrollkästchen Global, um die neue Skalierungseinstellung auf alle folgenden Bilder anzuwenden, wenn mehrere Bilder verarbeitet werden. Klicken Sie auf OK, um die Einstellungen zu übernehmen.
HINWEIS: Es wird immer empfohlen, vor der weiteren Analyse zu überprüfen, ob die genaue Skala auf das Bild angewendet wird.
- Geben Sie im Popup-Fenster den Abstand in Pixel, den bekannten Abstand der Skalierungsleiste (in diesem Fall in μm) und die Längeneinheit als μm ein. Aktivieren Sie das Kontrollkästchen Global, um die neue Skalierungseinstellung auf alle folgenden Bilder anzuwenden, wenn mehrere Bilder verarbeitet werden. Klicken Sie auf OK, um die Einstellungen zu übernehmen.
- Um die gewünschte Messung auf den Bereich des Abschnitts einzustellen, gehen Sie zu Analyze | Festlegen von Messungen | Wählen Sie die Felder Bereich und Bezeichnung anzeigen aus. Überprüfen Sie, ob das zu analysierende Bild unter Umleiten auf ausgewählt ist.
- Um die Visualisierung des Hippocampus oder des Kortex zu vereinfachen, gehen Sie zu Image | | anpassen Helligkeit/Kontrast. Ziehen Sie den Maximal-Schieberegler allmählich nach links, um die Gewebeklarheit zu erhöhen, bis die interessierenden Gehirnregionen identifizierbar sind.
HINWEIS: Wenden Sie diese Einstellung nicht an, um falsche Messungen während der Analyse zu vermeiden, sondern fahren Sie mit dem nächsten Schritt fort. - Verwenden Sie das Polygon-Auswahl - oder Freihand-Auswahlwerkzeug , um die Hippocampus-Region zu skizzieren. Klicken Sie auf die Option Zurücksetzen der Helligkeits-/Kontrasteinstellungen , sobald der Hippocampus umrissen ist, um zur ursprünglichen Helligkeit zurückzukehren.
HINWEIS: Die Schritte müssen separat für die kortikale Region wiederholt werden. - Um die gesamte Gewebefläche der ausgewählten Region zu messen, klicken Sie auf Bearbeiten | Außen klar. Sobald die ausgewählte Region das einzige Bild auf dem Bildschirm ist, klicken Sie auf | analysieren Messen Sie , um die gesamte Gewebefläche zu erhalten, die in einem Popup-Fenster analysiert wird. Speichern Sie die Daten in einer Excel-Datei zur späteren Verwendung.
- Um den 6E10-positiven Bereich zu messen, gehen Sie zu Bild | | anpassen Farbschwelle. Ein vorgefertigter Filter nach der Thresholding-Methode liefert in der Regel die gewünschten Ergebnisse, indem er die stärksten Signale rot hervorhebt.
HINWEIS: Die optimale Auswahl des Schwellenwerts hängt vom Hintergrund des Bildes und der Färbeintensität ab. Wählen Sie eine Schwellenwerteinstellung aus, die den Fleck und nicht den Hintergrund aufnimmt. - Nachdem Sie den entsprechenden Schwellenwert ausgewählt haben, aktivieren Sie das Kontrollkästchen Dunkler Hintergrund. Dadurch werden die Aβ-Flecken (der Fleck von Interesse) auf schwarzem Hintergrund hervorgehoben. Klicken Sie auf | auswählen Original | Wählen Sie, wobei Sie die dunklen Signale (die Aβ-Ablagerungen) auf weißem Hintergrund angeben. Klicken Sie auf | analysieren Analysieren Sie Partikel und klicken Sie auf OK, wenn das Popup-Fenster generiert wird.
- Kopieren Sie die von der Software generierte Zusammenfassungsausgabe, indem Sie auf Bearbeiten | klicken Kopieren. Einfügen in die zuvor gestartete Excel-Datei mit entsprechenden Beschriftungen. Dies ist der 6E10-positive Bereich in den ausgewählten Regionen von Interesse (entweder Hippocampus oder Kortex).
HINWEIS: In Excel gibt es eine Spalte für den gesamten 6E10-positiven Bereich (Schritt 4.10) und den gesamten Gewebebereich (Schritt 4.7). - Berechnen Sie die 6E10-positive Fläche (%) wie folgt16: (Gesamt 6E10-positive Fläche/Gesamtgewebefläche analysiert) x 100.
5. Analyse der Teilregion des Interesses
HINWEIS: Die Subregion of Interest-Analyse stellt die Analyse eines Teils des Kortex oder des Hippocampus im abgebildeten Hirngewebeschnitt dar.
- Laden Sie die Bildanalysesoftware herunter und starten Sie die Software nach der Installation.
- Sobald die Software ausgeführt wird, klicken Sie auf Datei | | öffnen Wählen Sie das zu analysierende Bild aus .
- Klicken Sie auf | analysieren Maßstab festlegen| Klicken Sie hier, um die Skalierung zu entfernen. Wählen Sie in der Symbolleiste der Software das Werkzeug "Gerade" aus und zeichnen Sie eine gerade Linie entlang der Länge der Maßstabsleiste. Klicken Sie auf | analysieren Messen. Notieren Sie sich die Länge oder den Abstand der Skalierungsleiste in Pixel. Klicken Sie auf | analysieren Skala einstellen.
- Geben Sie im Popup-Fenster den Abstand in Pixel, den bekannten Abstand der Skalierungsleiste (in diesem Fall in μm) und die Längeneinheit als μm ein. Aktivieren Sie das Kontrollkästchen Global, um die neue Skalierungseinstellung auf alle folgenden Bilder anzuwenden, wenn mehrere Bilder verarbeitet werden. Klicken Sie auf OK, um die Einstellungen zu übernehmen.
HINWEIS: Es wird immer empfohlen, vor der weiteren Analyse zu überprüfen, ob die genaue Skala auf das Bild angewendet wird.
- Geben Sie im Popup-Fenster den Abstand in Pixel, den bekannten Abstand der Skalierungsleiste (in diesem Fall in μm) und die Längeneinheit als μm ein. Aktivieren Sie das Kontrollkästchen Global, um die neue Skalierungseinstellung auf alle folgenden Bilder anzuwenden, wenn mehrere Bilder verarbeitet werden. Klicken Sie auf OK, um die Einstellungen zu übernehmen.
- Um die gewünschte Messung auf den Bereich des Abschnitts einzustellen, gehen Sie zu Analyze | Festlegen von Messungen | Wählen Sie die Felder Bereich und Anzeigebeschriftung aus. Überprüfen Sie, ob das zu analysierende Bild unter Umleiten auf ausgewählt ist.
- Passen Sie die Helligkeit und den Kontrast an, wenn das Bild zu schwach ist und die Hirnregionen (in diesem Fall der Hippocampus oder der Kortex) nicht leicht identifiziert werden können. Verwenden Sie die Software-Symbolleiste und klicken Sie auf Image | | anpassen Helligkeit/Kontrast und ziehen Sie die Maximal-Schieberegler nach Bedarf nach links, um die Sichtbarkeit des Gewebes zu erhöhen.
HINWEIS: Wenden Sie diese Einstellung nicht an, um falsche Messungen während der Analyse zu vermeiden, sondern fahren Sie mit dem nächsten Schritt fort. - Wählen Sie mit dem Rechteckwerkzeug die Region aus, die im Kortex oder im Hippocampus von Interesse ist. Verwenden Sie die Symbolleiste und klicken Sie auf Bearbeiten | Auswahl | Legen Sie fest, indem Sie die Höhe und Breite auf einen vordefinierten Wert ändern. Stellen Sie die Box so ein, dass sie vollständig von Gewebe bedeckt ist. Setzen Sie die Helligkeit/den Kontrast zurück, um die ursprüngliche Helligkeit wiederherzustellen.
HINWEIS: Die Größe des Felds, das zur Auswahl der gewünschten Regionen verwendet wird, muss für alle Bilder konsistent sein. Für die vorliegende Analyse betrug die Boxgröße entweder 300 Pixel x 300 Pixel (entspricht 1177 μm x 1177 μm) oder 400 Pixel x 200 Pixel (entspricht 1569 μm x 784 μm). - Duplizieren Sie den ausgewählten Interessenbereich, indem Sie mit der rechten Maustaste auf das Kästchen klicken und auf Duplizieren klicken. Es öffnet sich ein neues Fenster mit der ausgewählten Region. Benennen Sie das duplizierte Bild um, um die Region anzuzeigen, in der es sich befindet (z. B. Kortex oder Hippocampus).
- Passen Sie den duplizierten Bildtyp an, indem Sie die Symbolleiste verwenden und auf Bild | klicken Typ | 8-Bit , um das duplizierte RGB-Bild in 8-Bit zu konvertieren, um die Plaketten optimal zu analysieren. Kehren Sie das Bild um, indem Sie auf | bearbeiten klicken Invertieren.
- Um den 6E10-positiven Bereich zu messen, gehen Sie zu Bild | | anpassen Schwellenwert. Ein vordefinierter Filter unter der Thresholding-Methode liefert in der Regel die gewünschten Ergebnisse, indem er die stärksten Signale rot hervorhebt.
HINWEIS: Die optimale Auswahl des Schwellenwerts hängt vom Hintergrund des Bildes und der Färbeintensität ab. Wählen Sie eine Schwellenwerteinstellung aus, die den Fleck und nicht den Hintergrund aufnimmt. - Nachdem Sie den entsprechenden Schwellenwert ausgewählt haben, wählen Sie Übernehmen aus.
- Um den 6E10-positiven Bereich zu analysieren, verwenden Sie die Symbolleiste und klicken Sie auf | analysieren Analysieren Sie Partikel und stellen Sie sicher, dass die Option "Ergebnisse zusammenfassen" überprüft wird.
- Kopieren Sie die Zusammenfassungsausgabe mit dem von der Software generierten %Area, indem Sie auf Edit | klicken Kopieren. Einfügen in die zuvor gestartete Excel-Datei mit entsprechenden Beschriftungen.
- Wiederholen Sie die Schritte 5.3-5.12 für die verschiedenen Bereiche im Gewebe. Stellen Sie sicher, dass die Platzierung jeder Box, um den interessierenden Bereich zu skizzieren, zwischen den einzelnen Bildern konsistent ist.
HINWEIS: Das Rotationswerkzeug kann verwendet werden, wenn die Abmessungen der Rechteck-Toolbox aufgrund der Gewebekrümmung nicht in den angegebenen Bereich passen. - Um das Rechteck zu drehen, verwenden Sie die Symbolleiste und klicken Sie auf | bearbeiten Auswahl | Drehen und passen Sie den Rotationsgrad nach Bedarf an. Duplizieren Sie das Bild wie in Schritt 5.7 erwähnt und löschen Sie die Außenseite, indem Sie die Symbolleiste verwenden und auf | bearbeiten klicken Außen frei, wodurch die 6E10-Flecken außerhalb des angegebenen Rechtecks entfernt werden. Fahren Sie mit dem oben beschriebenen Schritt 5.8 fort.
Ergebnisse
Hier werden zwei verschiedene Methoden verglichen, um den 6E10-positiven Bereich im Hippocampus und den Kortex des Hirngewebes der Maus zu quantifizieren. Bei den beiden Methoden handelt es sich um die Analysen der Vollregion und der Subregion von Interesse (Abbildung 1). Die Analyse der gesamten Interessenregion beinhaltet, wie der Name schon sagt, die Umrissfassung der gesamten Region von Interesse (in diesem Fall entweder des Isokortex oder des Hippocampus), um den 6E10-positiven Bereich zu bestimmen (Abbildung 1A, B). Die Subregion of Interest-Analyse beinhaltet die Auswahl einer vordefinierten Region innerhalb der Region von Interesse, um die 6E10-positive Fläche zu bestimmen (Abbildung 1C, D). Das schrittweise ImageJ-Protokoll für die beiden Methoden ist in Abbildung 2, Abbildung 3 und Abbildung 4 dargestellt.
Diese Studie verwendete drei Leser; Zwei unabhängige Leser führten die Analyse der Subregion of Interest durch, und der dritte Leser führte die vollständige Analyse der Interessenregion durch. Wie in Abbildung 5A,B zu sehen ist, gab es eine starke signifikante positive Korrelation (p < 0,0001) zwischen dem 6E10-positiven Bereich, der von den beiden Lesern berichtet wurde, die die Subregion of Interest-Analyse durchführten (Pearson-Korrelationskoeffizient r = 0,97 für den Kortex und r = 0,96 für den Hippocampus). Die 6E10-positiven Bereiche, die von den beiden Lesern für die Subregion of Interest-Analyse gemeldet wurden, wurden gemittelt, und die gemittelte Subregion von Interesse 6E10-positive Fläche teilte eine starke signifikante positive Korrelation (p < 0,0001) mit der 6E10-positiven Fläche, die unter Verwendung der vollständigen Interessengebietsanalyse für den Kortex (Pearson-Korrelationskoeffizient r = 0,96; Abbildung 5C) und der Hippocampus (Pearson-Korrelationskoeffizient r = 0,95; Abbildung 5D). Die mittlere kortikal- und Hippocampus-6E10-positive Fläche, die durch die Analysen der Vollregion und der Subregion von Interesse erhalten wurde, war ohne signifikanten Unterschied vergleichbar, was die Übereinstimmung zwischen den beiden Methoden bestätigt (Abbildung 5E). Weiterhin wurde das unlösliche Aβ1-42 in Ganzhirnhomogenaten in einer Untergruppe von Mäusen gemessen und der kortikale (Abbildung 5F) und hippokampale (Abbildung 5G) 6E10-positive Bereich, der durch die Analyse der gesamten Interessenregion bestimmt wurde, signifikant (p < 0,01) mit der unlöslichen Aβ1-42-Belastung unter Verwendung von ELISA korreliert (siehe Materialtabelle).
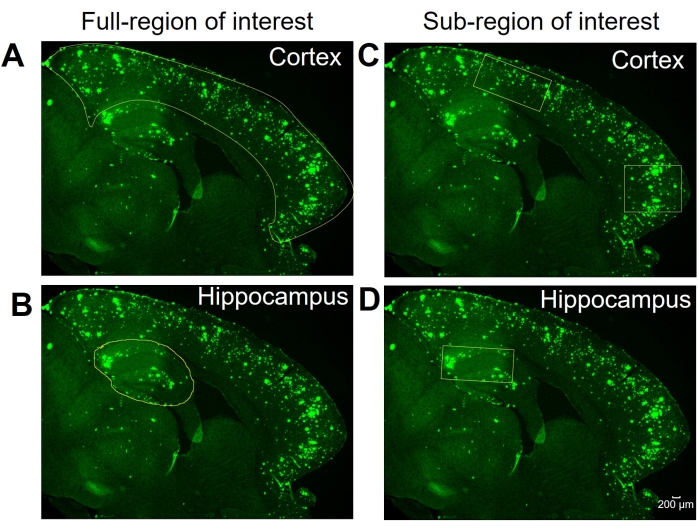
Abbildung 1: Voll- und Unterregionen der Interessenauswahl. Repräsentative Bilder, die den vollständigen Isokortex (Kortex) und den Hippocampus zeigen, die für die vollständige Interessengebietsanalyse in (A) bzw. (B) skizziert sind. Repräsentative Bilder zeigen die Auswahl der Subregion(en) des Kortex und des Hippocampus für die Subregionenanalyse in (C) bzw. (D). Maßstabsleiste = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
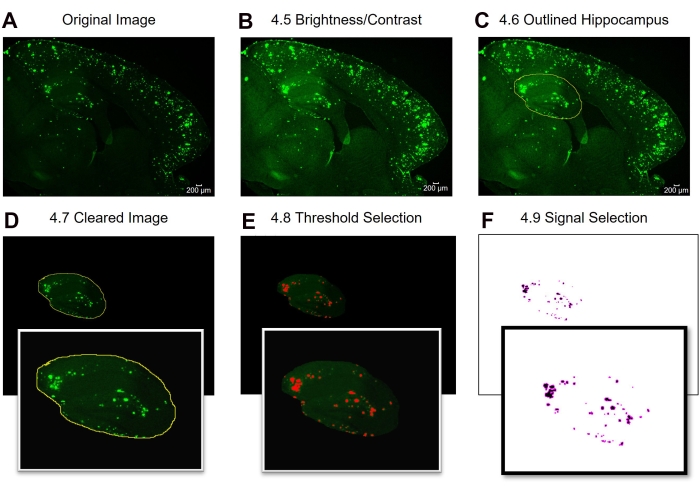
Abbildung 2: Protokoll für die gesamte Interessenregion 6E10-positive Flächenquantifizierung. Die Bildanalyseschritte zeigen das Originalbild (A), das Bild nach der Helligkeits- / Kontrastanpassung (B), die Auswahl des Interessenbereichs (C), das Löschen (D), die Schwellenwerteinstellung (E) und das endgültige Bild bereit für die Analyse (F). Die Zahlen in der Abbildung bezeichnen die Schrittnummern im Protokoll. Maßstabsleiste = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
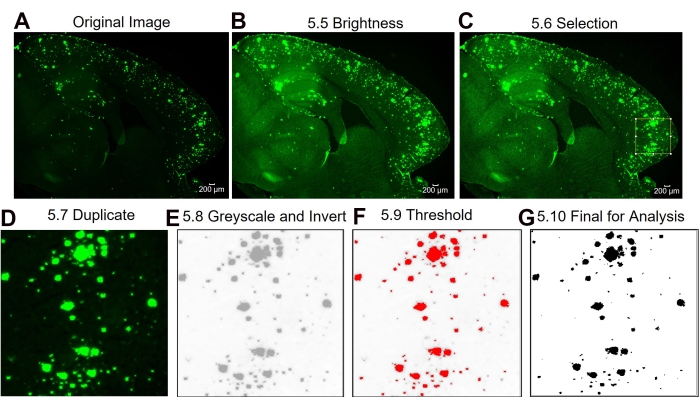
Abbildung 3: Protokoll für die Subregion von Interesse 6E10-positive Flächenquantifizierung. Die Schritte der Bildanalyse zeigen das Originalbild (A), das Bild nach der Helligkeits- / Kontrastanpassung (B), die Auswahl des interessierenden Bereichs (C), die Duplizierung des Bildes des interessierenden Bereichs (D), das Ändern des Bildes auf 8-Bit und das Invertieren des Bildes (E), die Schwelleneinstellung (F) und das endgültige Bild bereit für die Analyse (G). Die Zahlen in der Abbildung bezeichnen die Schrittnummern im Protokoll. Maßstabsleiste = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
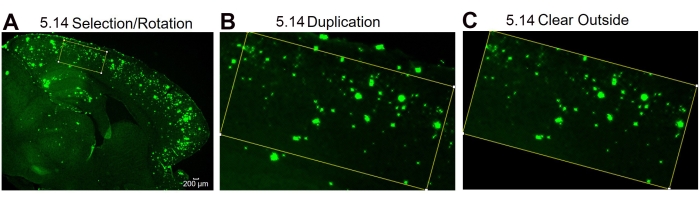
Abbildung 4: Protokoll für die Region of Interest Rotation. Bildanalyseschritte, die die Auswahl des interessierenden Bereichs und die Rotation der Auswahlbox zeigen, um der Gewebekrümmung (A), dem Bild der Region von Interesse nach der Duplizierung (B) und dem Bild nach dem Löschen des äußeren (nicht von Interesse betroffenen Bereichs) (C) zu entsprechen. Die Zahlen in der Abbildung bezeichnen die Schrittnummer im Protokoll. Maßstabsleiste = 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
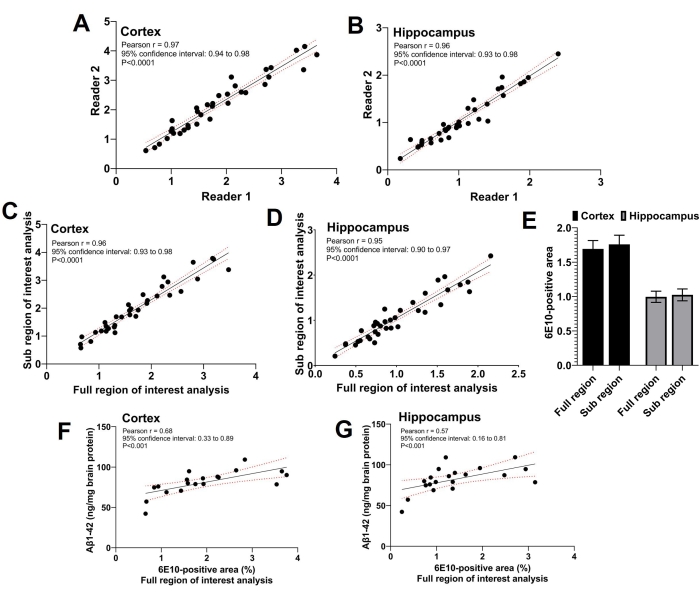
Abbildung 5: Korrelation zwischen den Voll- und Teilregionen der Interessenanalysen. Streudiagramme zeigen die Korrelation zwischen dem 6E10-positiven Bereich durch die beiden unabhängigen Leser, die die Subregion of Interest-Analyse für den Kortex (A) und den Hippocampus (B) durchführen. Es wird eine starke positive Korrelation zwischen dem 6E10-positiven Bereich, der sich aus der Subregion-of-Interest-Analyse ergibt, und der Full-Region-of-Interest-Analyse sowohl für den Kortex (C) als auch für den Hippocampus (D) beobachtet. Es gibt keinen statistisch signifikanten Unterschied in der mittleren 6E10-positiven Fläche durch die vollständige Interessenregion und die Subregion der Interessenanalysen im Kortex und im Hippocampus (E). Es wird eine signifikante Korrelation zwischen homogenen Aβ1-42-Messungen des ganzen Gehirns unter Verwendung von ELISA und der Analyse der gesamten Interessenregion sowohl für den Kortex (F) als auch für den Hippocampus (G) beobachtet. Die Daten wurden unter Verwendung des Pearson-Korrelationskoeffizienten r, in (A-D) und (F-G) und unter Verwendung von Zwei-Wege-ANOVA mit wiederholten Messungen in (E) unter Verwendung einer Grafik- und Statistiksoftware analysiert. Die Daten werden als Mittelwert ± Standardfehler des Mittelwerts (SEM) von n = 35 Mäusen in (E) dargestellt, und ein zweiseitiger p < 0,05 wurde als statistisch signifikant angesehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Das hierin beschriebene Protokoll beschreibt das Verfahren zur Hemi-Hirn-Vorbereitung für die sagittale Schnitte, die immunfluoreszierende Färbung von Aβ-Ablagerungen unter Verwendung des 6E10-Antikörpers auf frei schwebenden Abschnitten, die Bildgebung der Aβ-gefärbten Hirnabschnitte gefolgt von der Quantifizierung der Aβ-Ablagerungen im Kortex und im Hippocampus des Hirngewebes der Maus mit einer Bildanalysesoftware. Während es veröffentlichte Protokolle zur Quantifizierung der Aβ-Last in Hirngewebeabschnitten 8,10 gibt, beschreibt dieses Protokoll die Schritte zur Quantifizierung der Aβ-Last im gesamten Isokortex (als Kortex bezeichnet) und Hippocampus im Vergleich zur Aβ-Last in einer Subregion von Interesse im Kortex und im Hippocampus, wenn dies gewünscht werden kann. Die Korrelation zwischen den Full- und Sub-Regions of Interest-Analysen wird ebenfalls bereitgestellt.
Das Protokoll enthält mehrere kritische Schritte. Erstens gilt das beschriebene Protokoll für 20 μm dicke Hirngewebeabschnitte, die einer frei schwebenden Immunfärbung unterzogen werden, was zu einer optimalen Antikörperpenetration innerhalb desGewebeabschnitts 18 führt. Die frei schwebende Technik kann erfordern, dass die Gewebeabschnitte während der Immunfluoreszenzfärbung manuell zwischen den verschiedenen Lösungen übertragen werden und die Gewebeabschnitte während des gesamten Verfahrens sorgfältig gehandhabt werden. Dies ist besonders wichtig, wenn die Gewebeabschnitte in die 70% ige Ameisensäurelösung für die Antigengewinnung im aktuellen Protokoll eingetaucht werden, wodurch die Gewebebrechlichkeit für dünne Abschnitte erhöht wird. Alternative Ansätze zum beschriebenen Protokoll umfassen die Verwendung dickerer Gewebeabschnitte (z. B. 30-40 μm) oder die Verwendung von Gewebeschnitten, die direkt auf positiv geladene Objektträger vor der Immunfluoreszenzfärbung montiert werden. Zweitens verwendet das hierin beschriebene Protokoll einen fluoreszierend markierten 6E10-Antikörper. Neben der Verwendung des fluoreszenzmarkierten 6E10-Antikörpers können nicht-fluoreszierende 6E10-Antikörper (z. B. Meerrettichperoxidase-konjugierter 6E10-Antikörper) auch zum Nachweis der Aβ-Belastung in Hirngewebeabschnitten verwendet werden, und das aktuelle Protokoll kann angepasst werden, um Aβ-positive immunchemische Färbungen in den Hirngewebeabschnitten zu quantifizieren, wie zuvor beschrieben8 . Drittens hängt die Genauigkeit der Ergebnisse für die Aβ-Lastquantifizierung von der geeigneten Schwellenwertauswahl in der Analysesoftware ab, die vom Gewebehintergrund und der Signalintensität abhängt. Die Auswahl des Schwellenwerts muss vom Endbenutzer so durchgeführt werden, dass nur Aβ-positive Flecken für die Quantifizierung ausgewählt werden. Ein Eingreifen des Endbenutzers ist erforderlich, um den spezifischen Schwellenwert zu optimieren, der auf alle Bilder angewendet werden kann, um die Genauigkeit der Schwellenwerteinstellung sicherzustellen. Viertens, da die Subregion of Interest-Analyse die Auswahl einer kleinen Region von Interesse im Gewebeabschnitt erfordert, wurden zwei unabhängige Leser für diese Analyse verwendet. Um die Unabhängigkeit und Verblendung während der Datenerfassung zu wahren, wurden alle Bilder nummerncodiert; Die Bildanalysesequenz wurde zwischen den Lesern randomisiert, so dass die verschiedenen Leser zu einem bestimmten Zeitpunkt verschiedene Bilder analysierten, und die Daten wurden am Ende jeder Woche eingereicht. Aufgrund der erhöhten Wahrscheinlichkeit einer Inter-Reader-Variabilität in der Auswahl der Interessenregion in der Subregion of Interest-Analyse wurden die Leser anhand mehrerer Stichprobenbilder geschult, um die Regionsauswahl im Kortex und im Hippocampus zu optimieren, bevor mit der Datenerhebung begonnen wurde. Dieses Training ist entscheidend, um die Variabilität zwischen den Lesern zu reduzieren, und wie man sehen kann (Abbildung 5A, B), zeigt der 6E10-positive Bereich, der von beiden Lesern berichtet wird, eine starke relative Übereinstimmung in der aktuellen Studie.
Das aktuelle Protokoll und die Ergebnisse liefern wertvolle Informationen über den Einfluss der interessierenden Region auf die Aβ-positive Flächenquantifizierung. Es wird erwartet, dass eine größere Region von Interesse das Gewebe mehr repräsentiert als eine kleinere Region von Interesse. Daher ist die Probenahme eines größeren Gewebes wünschenswert, um die Aβ-Belastung in Geweben genau zu quantifizieren. Im Falle einer homogenen Aβ-Lastverteilung innerhalb des Gewebes wird jedoch ein kleinerer Probenahmebereich im Allgemeinen als eine gute Darstellung des zu analysierenden größeren Gewebes angesehen. Die aktuellen Studienergebnisse bestätigen dies, und die Aβ-Last im gesamten Kortex und im Hippocampus war ein starkes Korrelat der Aβ-Last in einer ausgewählten Subregion des Kortex und des Hippocampus (Abbildung 5C, D). Um die Übereinstimmung zwischen den Voll- und Subregionen der Interessenanalysen weiter zu bestätigen, wurden die mittlere 6E10-positive Fläche im Kortex und im Hippocampus verglichen und kein Unterschied zwischen den beiden Methoden (Abbildung 5E) gefunden. Dies bestätigt, dass jede dieser Methoden (Voll- oder Subregionenanalyse) vergleichbare Aβ-Lastmessungen liefert.
Das aktuelle Protokoll hat einige Einschränkungen. Die beiden Methoden (Vollregionen- versus Subregionenanalyse) werden möglicherweise nicht immer austauschbar verwendet. Die Wahl der Voll- oder Subregionenanalyse hängt von der regionalen Verteilung von Aβ innerhalb des Gewebes ab, die durch Alter, Geschlecht und Stamm des AD-Mausmodells beeinflusst wird. Nach 13 Monaten verteilt sich die Aβ-Last über den Kortex und Hippocampus der APP/PS1-Mäuse. Nach 6 Monaten sind die Aβ-Ablagerungen jedoch auf den Kortex beschränkt, und im Hippocampus12 werden minimale Ablagerungen beobachtet. Unter solchen Bedingungen kann die Analyse der gesamten interessierenden Region der gewünschte Ansatz sein, um die Gewebeentnahmefläche und damit das Aβ-Signal zu vergrößern. Auf der anderen Seite kann die Subregionenanalyse die Methode der Wahl sein, wenn die Aβ-Last in einer bestimmten Gehirnregion von Interesse ist (z. B. der somatosensorische Kortex). Darüber hinaus zeigen die männlichen APP/PS1-Mäuse nach 13 Monaten intensive 6E10-positive Flecken, und die immunfluoreszierende Färbung führt zu einem hervorragenden Signal mit einem sehr niedrigen Hintergrund, wodurch das aktuelle Protokoll für die Quantifizierung unter den gegebenen Bedingungen sehr geeignet ist. Es ist unklar, ob diese Quantifizierungsmethode erfolgreich auf weniger intensive Färbungen angewendet werden kann, und zukünftige Arbeiten werden erforderlich sein, um diese Frage zu beantworten. Das hierin vorgestellte Immunfluoreszenz- und Bildquantifizierungsverfahren detektiert alle Formen von Aβ, einschließlich der Vorläuferform13. Wenn also ein Interesse am Nachweis einer bestimmten Aβ-Spezies besteht (z. B. Aβ1-40 oder Aβ1-42), können Antikörper verwendet werden, die für diese Aβ-Isoformen spezifisch sind. Obwohl die 6E10-Immunfluoreszenzfärbungs- und Detektionsmethode mit den Messungen von Aβ1-42-Messungen in Ganzhirnhomogenaten unter Verwendung von ELISA korrelierte (Abbildung 5F, G), war die Korrelation daher nur bescheiden. Dies ist auf die Messung von nur Aβ1-42 mit dem ELISA und den Nachweis aller Aβ-Spezies mit der 6E10-Immunfärbung zurückzuführen. Die aktuelle Studie verwendet drei Leser, um die Übereinstimmung und Korrelation zwischen den voll- und subregionalen Analysen zu bewerten. Zusätzliche Leser können die Robustheit der Studie verbessern und die Vereinbarungen zwischen den beiden hier vorgestellten Methoden weiter validieren. Darüber hinaus verwenden wir die Pearson-Korrelation als Maß für die Übereinstimmung, die unter anderen Methoden häufig verwendet wird, um die Übereinstimmung zwischen kontinuierlichen Variablen19 zu beschreiben. Eine Einschränkung der Verwendung der Pearson-Korrelation zur Bestimmung der Übereinstimmung besteht jedoch darin, dass die beiden hierin verwendeten Methoden verwandte Ergebnisse liefern können, aber eine Methode kann aufgrund systematischer Verzerrung zu insgesamt höheren Werten führen als die andere. Daher ist die Pearson-Korrelation ein gutes Maß für die relative Übereinstimmung19. Um die Robustheit des Protokolls zu erhöhen, können zusätzliche Methoden zur Bestätigung der absoluten Übereinstimmung, wie der Vergleich der mittleren 6E10-positiven Fläche mit den beiden Methoden (Abbildung 5E), verwendetwerden 19. Zusammengenommen vergleicht das aktuelle Protokoll die durch Immunfluoreszenzfärbung nachgewiesene Aβ-Last und analysiert die Voll- und Subregionen, die in Hirngewebeschnitten von Interesse sind. Die Ergebnisse zeigen eine starke Korrelation zwischen diesen beiden Methoden für Hirngewebeschnitte, die von 13 Monate alten männlichen APP/PS1-Mäusen stammen, die reichlich Aβ-Ablagerungen aufweisen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die in dieser Veröffentlichung berichtete Forschung wurde vom National Institute of Aging der National Institutes of Health unter den Preisnummern R01AG062840 (zu RKS) und R01AG072896 (zu RKS) unterstützt. Der Inhalt liegt ausschließlich in der Verantwortung der Autoren und stellt nicht unbedingt die offiziellen Ansichten der National Institutes of Health dar. Ungefähr $ 200k (100%) der Bundesmittel unterstützten dieses Projekt. Wir möchten uns auch bei Dr. Joshua Yang für seine Unterstützung bei der Manuskriptbearbeitung bedanken.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | ThermoFisher Scientific, MA, USA | 339650 | |
| 24-well plates | Fisher Scientific, NH, USA | FB012929 | |
| Amyloid beta 42 human ELISA kit | ThermoFisher Scientific, MA, USA | KHB3441 | |
| Aqueous mounting media | Vector laboratories, CA, USA | H-5501-60 | |
| Bovine serum albumin | Sigmaaldrich, MO, USA | A2153-50G | |
| BZ-X710 Keyence all-in-one fluorescence microscope | Keyence, IL, USA | BZ-X710 | |
| Clear nail poilsh | User preference | NA | |
| Cryostat | Leica Biosystems, IL, USA | Leica CM1860 Cryostat | |
| Formic acid | Sigmaaldrich, MO, USA | F0507-500ML | |
| Glass coverslips | VWR, PA, USA | 48393-081 | |
| GraphPad Prism | GraphPad Software, CA, USA | Version 8 | |
| ImageJ 1.51k | National Institutes of Health, MD, USA | Version 1.53e | |
| Mice | Jackson Laboratories, ME, USA | 034829-JAX | |
| Paraformaldehyde | Sigmaaldrich, MO, USA | P6148-500G | |
| Phenytoin/pentobarbital based anesthetic (Euthasol) | Patterson Veterinary, MA, USA | 07-805-9296 | |
| Phosphate-buffered saline | Fisher Scientific, NH, USA | BP661-50 | |
| Plus (+) microscope slides | Ted Pella, Inc., CA, USA | 260100 | |
| Primary antibody (6E10) | Biolegend, CA, USA | 803013 | |
| Sucrose | Sigmaaldrich, MO, USA | 47289 | |
| Triton X 100 | Sigmaaldrich, MO, USA | T8787-100ML |
Referenzen
- Alzheimer's Association. 2021 Alzheimer's disease facts and figures. Alzheimer's & Dementia. 17 (3), 327-406 (2021).
- Langa, K. M., Foster, N. L., Larson, E. B. Mixed dementia: emerging concepts and therapeutic implications. Journal of the American Medical Association. 292 (23), 2901-2908 (2004).
- Gandy, S., DeKosky, S. T. Toward the treatment and prevention of Alzheimer's disease: rational strategies and recent progress. Annual Review of Medicine. 64, 367-383 (2013).
- Bloom, G. S. Amyloid-beta and tau: the trigger and bullet in Alzheimer disease pathogenesis. JAMA Neurology. 71 (4), 505-508 (2014).
- Gremer, L., et al. Fibril structure of amyloid-beta(1-42) by cryo-electron microscopy. Science. 358 (6359), 116-119 (2017).
- Ferrero, J., et al. First-in-human, double-blind, placebo-controlled, single-dose escalation study of aducanumab (BIIB037) in mild-to-moderate Alzheimer's disease. Alzheimer's & Dementia Translational Research & Clinical Interventions. 2 (3), 169-176 (2016).
- Poon, C. H., Wang, Y., Fung, M. L., Zhang, C., Lim, L. W. Rodent models of amyloid-beta feature of Alzheimer's disease: development and potential treatment implications. Aging and Disease. 11 (5), 1235-1259 (2020).
- Christensen, A., Pike, C. J. Staining and quantification of beta-amyloid pathology in transgenic mouse models of Alzheimer's disease. Methods in Molecular Biology. 2144, 221 (2020).
- Thakker, D. R., et al. Intracerebroventricular amyloid-beta antibodies reduce cerebral amyloid angiopathy and associated micro-hemorrhages in aged Tg2576 mice. Proceedings of the National Academy of Sciences of the United States of America. 106 (11), 4501-4506 (2009).
- Song, Z., et al. Detecting amyloid-beta accumulation via immunofluorescent staining in a mouse model of Alzheimer's disease. Journal of Visualized Experiments. (170), e62254 (2021).
- Sun, J., et al. Hematologic safety of chronic brain-penetrating erythropoietin dosing in APP/PS1 mice. Alzheimer's & DementiaTranslational Research & Clinical Interventions. 5, 627-636 (2019).
- Jankowsky, J. L., et al. Mutant presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo: evidence for augmentation of a 42-specific gamma secretase. Human Molecular Genetics. 13 (2), 159-170 (2004).
- Grant, M. K. O., et al. Human cerebrospinal fluid 6E10-immunoreactive protein species contain amyloid precursor protein fragments. PloS One. 14 (2), 0212815 (2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Eichenbaum, K. D., et al. Minimally invasive method for murine brain fixation. Biotechniques. 39 (4), 487-490 (2005).
- Chang, R., et al. Blood-brain barrier penetrating biologic tnf-alpha inhibitor for Alzheimer's disease. Molecular Pharmaceutics. 14 (7), 2340-2349 (2017).
- Pinskiy, V., et al. High-throughput method of whole-brain sectioning, using the tape-transfer technique. PloS One. 10 (7), 0102363 (2015).
- Potts, E. M., Coppotelli, G., Ross, J. M. Histological-based stainings using free-floating tissue sections. Journal of Visualized Experiments. (162), e61622 (2020).
- van Stralen, K. J., Dekker, F. W., Zoccali, C., Jager, K. J. Measuring agreement, more complicated than it seems. Nephron Clinical Practice. 120 (3), 162-167 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten