Method Article
Quantification complète ou sous-régionale de la charge bêta-amyloïde sur les sections cérébrales de souris
Dans cet article
Résumé
Le présent protocole décrit et compare la procédure permettant d’effectuer une analyse complète de région ou de sous-région d’intérêt de sections cérébrales de souris sagittales afin de quantifier la charge bêta-amyloïde dans le modèle murin transgénique APP/PS1 de la maladie d’Alzheimer.
Résumé
L’accumulation extracellulaire de plaques bêta-amyloïdes (Aβ) est l’une des principales caractéristiques pathologiques de la maladie d’Alzheimer (MA) et est la cible du seul traitement modificateur de la maladie approuvé par la FDA pour la MA. En conséquence, l’utilisation de modèles murins transgéniques qui surexpriment la protéine précurseur amyloïde et accumulent ainsi des plaques Aβ cérébrales est largement utilisée pour modéliser la MA humaine chez la souris. Par conséquent, les immunoessais, y compris le test immuno-enzymatique (ELISA) et l’immunocoloration, mesurent généralement la charge Aβ dans les tissus cérébraux dérivés de souris transgéniques AD. Bien que les méthodes de détection et de quantification de l’Aβ aient été bien établies et documentées, l’impact de la taille de la région d’intérêt sélectionnée dans le tissu cérébral sur les mesures de la charge Aβ après l’immunocoloration n’a pas été rapporté. Par conséquent, le protocole actuel visait à comparer les mesures de charge Aβ à travers les régions complètes et sous-régions d’intérêt à l’aide d’un logiciel d’analyse d’images. Les étapes impliquées dans la préparation des tissus cérébraux, l’immunocoloration de la section cérébrale flottante librement, l’imagerie et la quantification de la charge Aβ dans les régions d’intérêt complètes par rapport aux sous-régions d’intérêt sont décrites à l’aide de sections cérébrales dérivées de souris mâles app/PS1 double transgéniques âgées de 13 mois. Le protocole actuel et les résultats fournissent des informations précieuses sur l’impact de la taille de la région d’intérêt sur la quantification de l’aire Aβ-positive, et montrent une forte corrélation entre la zone Aβ-positive obtenue à l’aide des analyses des régions complètes et des sous-régions d’intérêt pour les coupes cérébrales dérivées de souris APP/PS1 mâles de 13 mois qui présentent un dépôt Aβ généralisé.
Introduction
La maladie d’Alzheimer (MA), la sixième cause de décès aux États-Unis, continue d’être une menace pour la santé publique, avec environ 6,2 millions d’Américains vivant avec la MA. Ce chiffre devrait atteindre 13,8 millions d’ici 20601. À ce jour, la prise en charge symptomatique par des médicaments tels que les inhibiteurs de la cholinestérase et la mémantine est le principal traitement2. La MA est caractérisée par des manifestations neuropathologiques telles que le dépôt extracellulaire de plaques bêta-amyloïdes (Aβ) et l’accumulation intracellulaire de tau hyperphosphorylé sous la forme d’enchevêtrements neurofibrillaires 3,4. Formé par un clivage endoprotéolytique de la protéine précurseur de l’amyloïde (APP) via la bêta- et la gamma-sécrétase, Aβ s’agrège pour former des oligomères et des fibrilles, entraînant des effets neurotoxiques5. Aβ a été supposé servir un rôle pathologique primaire depuis les années 1980, et est la cible thérapeutique de la seule thérapie modificateur de la maladie approuvée par la FDA pour AD6. En conséquence, les modèles murins transgéniques de la MA hébergeant des mutations dans les gènes entraînant une accumulation robuste d’Aβ cérébrale ont été largement utilisés pour la recherche préclinique sur la MA depuis le début des années 19907.
La détection des espèces Aβ dans ces cerveaux de souris transgéniques AD se fait généralement à l’aide de deux immunoessais: le test immuno-enzymatique (ELISA) et l’immunocoloration. Le premier essai permet la détermination quantitative de différentes espèces d’Aβ et prend moins de temps que l’immunocoloration, qui nécessite plusieurs étapes séquentielles de traitement et d’imagerie des tissus, y compris la section des tissus, l’immunocoloration, l’imagerie et la quantification8. De plus, les résultats obtenus après immunocoloration sont semi-quantitatifs8. Cependant, la capacité de localiser spatialement Aβ fait de l’immunocoloration une approche attrayante pour la détection de l’Aβ dans les tissus cérébraux8.
Lors de l’utilisation de l’immunocoloration Aβ, plusieurs paradigmes de quantification différents ont été utilisés par différents groupes de recherche. Par exemple, certains groupes de recherche quantifient la charge Aβ dans toute la région d’intérêt (cortex ou hippocampe), tandis que d’autres quantifient la charge Aβ dans une sous-région d’intérêt spécifiée (une partie du cortex ou de l’hippocampe)9,10,11. Bien que les méthodes de détection et de quantification de l’Aβ aient été bien établies et documentées, l’impact de la taille de la région d’intérêt sur les mesures de la charge Aβ après l’immunocoloration n’a pas été rapporté. Par conséquent, le protocole actuel visait à comparer les mesures de charge Aβ à travers les régions complètes et sous-régions d’intérêt à l’aide d’un logiciel d’analyse d’images, ImageJ.
L’étude actuelle a utilisé des souris mâles double transgéniques APP/PS1 âgées de 13 mois, qui expriment une souris chimérique / APP humaine et une préséniline 1 mutante, pour modéliser l’apparition précoce de la MA12. Les dépôts d’Aβ commencent à se développer à l’âge de 6-7 mois, et une accumulation abondante d’Aβ est observée à la fois dans le cortex et l’hippocampe de ces souris à l’âge de 9-10 mois de12 ans. Les peptides amyloïdes transgéniques et l’holoprotéine peuvent être détectés par 6E10-immunocolorant13, ce qui en fait un modèle animal souhaitable pour le présent protocole. La procédure couverte ici comprend la préparation du tissu cérébral, l’immunocoloration des sections flottantes, l’imagerie et la quantification de la charge Aβ dans les régions complètes par rapport aux sous-régions d’intérêt. L’analyse montre une forte corrélation entre la quantification complète et sous-régionale, indiquant un accord robuste entre ces deux méthodes dans les coupes de tissu cérébral dérivées de souris mâles APP/PS1 âgées de 13 mois qui présentent des dépôts abondants d’Aβ.
Protocole
Toutes les expériences sur les animaux ont été menées conformément aux ressources des animaux de laboratoire de l’Université en vertu de protocoles approuvés par le Comité institutionnel de soins et d’utilisation des animaux de l’Université de Californie à Irvine. Les expériences ont été réalisées avec des souris mâles B6C3-Tg(APPswe, PSEN1dE9)85Dbo/Mmjax (APP/PS1) mâles (13 mois, n = 35). Les souris ont été obtenues à partir de sources commerciales (voir tableau des matériaux).
1. Préparation des tissus cérébraux
- Anesthésier les souris à l’aide d’une dose létale d’un anesthésique à base de phénytoïne/pentobarbital (150 mg/kg) injecté par voie intrapéritonéale (voir tableau des matériaux) conformément aux protocoles animaux approuvés. Effectuer une perfusion cardiaque avec une solution saline tamponnée au phosphate glacée (1x PBS) pendant 5 min à une vitesse de 5 mL / min pour éliminer le système vasculaire cérébral14.
- Prélever du tissu cérébral conformément au rapport15 publié précédemment, séparer dans l’hémisphère cérébral gauche et droit et placer l’hémi-cerveau droit de chaque souris dans un tube conique de 15 mL contenant 5 mL de solution de paraformaldéhyde (PFA) à 4 % fraîchement préparée dans 1x PBS pendant 72 h à 4 °C.
REMARQUE: Le cerveau peut être fixé par immersion de 24 à 72 heures selon l’antigène étudié. L’hémi-cerveau gauche, sans cervelet, peut être congelé dans de l’azote liquide puis stocké à -80 °C, suivi d’un traitement pour des tests biochimiques tels que ELISA et la détection biochimique Aβ16.
ATTENTION: Pfa est un cancérogène probable, et le contact de la peau avec PFA peut entraîner des symptômes cutanés allergiques. Utilisez des gants en nitrile ou en butyle, des masques et une protection oculaire pour le manipuler, et préparez-vous sous une hotte à fumée chimique. - Après incubation dans du PFA à 4 %, incuber les hémi-cerveaux séquentiellement dans 5 mL de solutions de saccharose à 10 %, 20 % et 30 % préparées dans 1x PBS pendant 24 h, chacune à 4 °C jusqu’à ce que le tissu cérébral s’enfonce au fond du tube conique.
- Après incubation dans la solution de saccharose à 30%, retirez l’hémi-cerveau, tamponnez doucement le cerveau sur un papier filtre pour éliminer l’excès de solution de saccharose et congelez l’hémi-cerveau fixe dans de la glace sèche en poudre pendant 30 minutes. Conservez l’hémi-cerveau congelé dans des feuilles d’aluminium bien étiquetées à -80 °C jusqu’à la cryosection.
REMARQUE: Dans le protocole actuel, les hémi-cerveaux ont été stockés à -80 ° C pendant 6-8 mois. - Découper l’hémi-cerveau congelé en sections de 20 μm d’épaisseur à l’aide d’un cryostat (voir tableau des matériaux).
REMARQUE: Pour le protocole actuel, les hémi-cerveaux ont été sectionnés en sections sagittales, et si nécessaire, des sections coronales peuvent également être préparées17. L’étape 2 concerne la coloration immunofluorescente Aβ sur des échantillons de tissu cérébral fixes et cryoprotégés.
2. Immunofluorescence
- Placez les coupes de tissu cérébral sagittal (étape 1.5) dans une plaque de 24 puits (jusqu’à six sections de cerveau de souris par 300 μL par puits). Laver pendant 5 min avec 1x PBS trois fois à température ambiante (23 °C) en plaçant la plaque sur un agitateur avec un léger tourbillonnement.
- Incuber les coupes de tissu cérébral avec 70% d’acide formique dans dH20 à température ambiante pendant 10 min.
ATTENTION: L’acide formique est corrosif, alors évitez le contact avec la peau et les yeux. - Laver les coupes de tissu cérébral pendant 5 min avec dH20 trois fois à température ambiante.
- Bloquer la liaison non spécifique avec 0,5 % d’albumine sérique bovine (BSA) et 0,3 % de TritonX 100 (voir tableau des matériaux) dans 1x PBS à température ambiante pendant 1 h.
- Incuber les coupes de tissu cérébral avec un anticorps primaire marqué au fluorophore (6E10, voir Tableau des matériaux) dilué (1:1000) dans 1x PBS contenant 0,3% de TritonX 100 à 4 °C pendant 24 h.
REMARQUE: Étant donné que l’anticorps primaire est conjugué au fluorophore, la plaque doit être recouverte à partir de cette étape, ou tout le travail doit être effectué dans une pièce sombre pour maintenir l’efficacité du fluorophore. - Lavez les coupes de tissu cérébral pendant 10 minutes avec 1x PBS trois fois à température ambiante.
- Montez les coupes de tissu cérébral sur des lames de verre chargées positivement (voir tableau des matériaux) qui sont bien étiquetées (les informations sur l’étiquette sur la diapositive sont basées sur la préférence), après un bref lavage avec dH20 pour éliminer les sels restants. Laissez sécher les toboggans à l’air libre dans l’obscurité.
REMARQUE: Les sections du cerveau doivent être montées avec soin pour éviter les plis et les déchirures, ce qui a un impact sur la quantification des données. En cas de déchirures et/ou de plis qui se trouvent dans la région d’intérêt et peuvent interférer avec la quantification des données, il est recommandé de recolorer et de remonter. - Montez les sections de tissu cérébral avec un support de montage aqueux (voir Tableau des matériaux) et placez le couvercle en verre sur le tissu. Scellez les extrémités du couvercle avec du vernis à ongles transparent et rangez les lames dans une boîte à glissière à 4 °C jusqu’à l’imagerie.
REMARQUE: Dans le protocole actuel, les diapositives ont été imagées dans le mois 1 après la coloration.
3. Imagerie
- Imagez les sections cérébrales colorées au 6E10 à l’aide d’un microscope à fluorescence (épifluorescence ou confocale) (voir Tableau des matériaux), qui a un objectif 2x pour capturer toute la section du tissu cérébral en une seule image et est équipé du filtre approprié (GFP dans ce travail).
REMARQUE : Les paramètres d’imagerie doivent être cohérents entre les différentes diapositives. - Enregistrez les images capturées en tant que fichier TIFF ou selon les besoins et ouvrez-les dans le logiciel d’analyse d’images (voir Tableau des matériaux) comme décrit à l’étape 4.2 ci-dessous pour la quantification 6E10.
REMARQUE: Incluez une barre d’échelle avant de capturer l’image à quantifier dans le logiciel d’analyse d’image, ImageJ.
4. Analyse complète de la région d’intérêt
NOTE: Les deux régions d’intérêt du présent travail sont l’hippocampe et l’iso-cortex. L’analyse de la région d’intérêt complète représente l’analyse de l’ensemble de l’iso-cortex (appelé cortex à l’avenir) ou de l’hippocampe dans la section du tissu cérébral imagé.
- Téléchargez le logiciel d’analyse d’images (voir Tableau des matériaux) et démarrez le logiciel une fois installé.
- Une fois le logiciel exécuté, cliquez sur Fichier | Ouvrir | Choisissez l’image à analyser.
- Cliquez sur Analyser | Définir l’échelle| Cliquez pour supprimer l’échelle. Sélectionnez l’outil Droit dans la barre d’outils du logiciel et tracez une ligne droite le long de la barre d’échelle. Cliquez sur Analyser | Mesure. Notez la longueur ou la distance de la barre d’échelle en pixels. Cliquez sur Analyser | Définissez l’échelle.
- Dans la fenêtre contextuelle, entrez la distance en pixels, la distance connue de la barre d’échelle (en μm dans ce cas) et l’unité de longueur en μm. Cochez Global pour appliquer le nouveau paramètre d’échelle à toutes les images suivantes si plusieurs images sont traitées. Cliquez sur OK pour appliquer les paramètres.
REMARQUE: Il est toujours recommandé de vérifier si l’échelle précise est appliquée à l’image avant une analyse plus approfondie.
- Dans la fenêtre contextuelle, entrez la distance en pixels, la distance connue de la barre d’échelle (en μm dans ce cas) et l’unité de longueur en μm. Cochez Global pour appliquer le nouveau paramètre d’échelle à toutes les images suivantes si plusieurs images sont traitées. Cliquez sur OK pour appliquer les paramètres.
- Pour définir la mesure souhaitée sur la zone de la section, accédez à Analyser | Définir les | de mesures Sélectionnez les zones Zone et Étiquette d’affichage. Vérifiez que l’image analysée est sélectionnée sous Rediriger vers.
- Pour faciliter la visualisation de l’hippocampe ou du cortex, accédez à Image | Ajuster | Luminosité/Contraste. Faites glisser la barre de glissement Maximum progressivement vers la gauche pour augmenter la clarté des tissus jusqu’à ce que les régions du cerveau d’intérêt soient identifiables.
REMARQUE : n’appliquez pas ce paramètre pour éviter les fausses mesures pendant l’analyse, mais passez plutôt à l’étape suivante. - Utilisez l’outil sélection de polygones ou de sélection à main levée pour décrire la région de l’hippocampe. Cliquez sur l’option Réinitialiser des paramètres Luminosité/Contraste une fois que l’hippocampe est défini pour revenir à la luminosité d’origine.
REMARQUE: Les étapes doivent être répétées séparément pour la région corticale. - Pour mesurer la surface tissulaire totale de la région sélectionnée, cliquez sur Modifier | Clair à l’extérieur. Une fois que la région sélectionnée est la seule image à l’écran, cliquez sur Analyser | Mesurez pour obtenir la surface tissulaire totale analysée dans une fenêtre contextuelle. Enregistrez les données dans un fichier Excel pour une utilisation ultérieure.
- Pour mesurer la zone positive 6E10, accédez à Image | Ajuster | Seuil de couleur. Un filtre prédéfini sous la méthode de seuillage fournit généralement les résultats souhaités mettant en évidence les signaux les plus forts en rouge.
REMARQUE: La sélection optimale du seuil dépendra de l’arrière-plan de l’image et de l’intensité de la coloration. Sélectionnez un paramètre de seuil qui ramasse la tache et non l’arrière-plan. - Après avoir sélectionné le seuil approprié, cochez Arrière-plan sombre. Cela mettra en évidence les taches Aβ (la tache d’intérêt) sur un fond noir. Cliquez sur Sélectionner | | d’origine Sélectionnez, en donnant les signaux sombres (les dépôts Aβ) sur un fond blanc. Cliquez sur Analyser | Analysez les particules et cliquez sur OK lorsque la fenêtre contextuelle est générée.
- Copiez la sortie récapitulative générée par le logiciel en cliquant sur Modifier | Copier. Collez dans le fichier Excel précédemment démarré avec les étiquettes respectives. Il s’agit de la zone 6E10 positive dans les régions d’intérêt sélectionnées (hippocampe ou cortex).
REMARQUE: Dans Excel, il y aura une colonne pour la zone totale 6E10 positive (étape 4.10) et la zone tissulaire totale (étape 4.7). - Calculez la zone 6E10 positive (%) comme suit16 : (Surface totale 6E10 positive/Surface tissulaire totale analysée) x 100.
5. Analyse de la sous-région d’intérêt
REMARQUE: L’analyse de la sous-région d’intérêt représente l’analyse d’une partie du cortex ou de l’hippocampe dans la section du tissu cérébral imagé.
- Téléchargez le logiciel d’analyse d’images et démarrez le logiciel une fois installé.
- Une fois le logiciel exécuté, cliquez sur Fichier | Ouvrir | Choisissez l’image à analyser.
- Cliquez sur Analyser | Définir l’échelle| Cliquez pour supprimer l’échelle. Sélectionnez l’outil Droit dans la barre d’outils du logiciel et tracez une ligne droite le long de la barre d’échelle. Cliquez sur Analyser | Mesure. Notez la longueur ou la distance de la barre d’échelle en pixels. Cliquez sur Analyser | Définissez l’échelle.
- Dans la fenêtre contextuelle, entrez la distance en pixels, la distance connue de la barre d’échelle (en μm dans ce cas), et entrez l’unité de longueur en μm. Cochez Global pour appliquer le nouveau paramètre d’échelle à toutes les images suivantes si plusieurs images sont traitées. Cliquez sur OK pour appliquer les paramètres.
REMARQUE: Il est toujours recommandé de vérifier si l’échelle précise est appliquée à l’image avant une analyse plus approfondie.
- Dans la fenêtre contextuelle, entrez la distance en pixels, la distance connue de la barre d’échelle (en μm dans ce cas), et entrez l’unité de longueur en μm. Cochez Global pour appliquer le nouveau paramètre d’échelle à toutes les images suivantes si plusieurs images sont traitées. Cliquez sur OK pour appliquer les paramètres.
- Pour définir la mesure souhaitée sur la zone de la section, accédez à Analyser | Définir les | de mesures sélectionnez les zones Zone et Étiquette d’affichage. Vérifiez que l’image analysée est sélectionnée sous Rediriger vers.
- Ajustez la luminosité et le contraste si l’image est trop sombre et que les régions du cerveau (par exemple, l’hippocampe ou le cortex dans ce cas) ne peuvent pas être facilement identifiées. Utilisez la barre d’outils du logiciel et cliquez sur Image | Ajuster | Luminosité/Contraste et faites glisser les curseurs Maximum vers la gauche si nécessaire pour augmenter la visibilité des tissus.
REMARQUE : n’appliquez pas ce paramètre pour éviter les fausses mesures pendant l’analyse, mais passez plutôt à l’étape suivante. - À l’aide de l’outil Rectangle, sélectionnez la région d’intérêt dans le cortex ou l’hippocampe. Utilisez la barre d’outils et cliquez sur Modifier | Sélection | Spécifiez, en changeant la hauteur et la largeur à une valeur prédéfinie. Ajustez la boîte, de sorte qu’elle soit complètement recouverte de tissu. Réinitialisez la luminosité/le contraste pour revenir à la luminosité d’origine.
REMARQUE : La taille de la zone utilisée pour sélectionner les régions d’intérêt doit être cohérente pour toutes les images. Pour la présente analyse, la taille de la boîte était soit de 300 pixels x 300 pixels (équivalent à 1177 μm x 1177 μm) soit de 400 pixels x 200 pixels (équivalent à 1569 μm x 784 μm). - Dupliquez la région d’intérêt sélectionnée en cliquant avec le bouton droit de la souris sur la case et en cliquant sur Dupliquer. Une nouvelle fenêtre avec la région sélectionnée s’ouvrira. Renommez l’image dupliquée pour afficher la région dans laquelle elle se trouve (par exemple, cortex ou hippocampe).
- Ajustez le type d’image dupliquée en utilisant la barre d’outils et en cliquant sur Image | Type | 8 bits pour convertir l’image RVB dupliquée en 8 bits afin d’analyser au mieux les plaques. Inversez l’image en cliquant sur Modifier | Inverser.
- Pour mesurer la zone positive 6E10, accédez à Image | Ajuster | Seuil. Un filtre prédéfini sous la méthode de seuillage fournit généralement les résultats souhaités en mettant en évidence les signaux les plus forts en rouge.
REMARQUE: La sélection optimale du seuil dépendra de l’arrière-plan de l’image et de l’intensité de la coloration. Sélectionnez un paramètre de seuil qui ramasse la tache et non l’arrière-plan. - Après avoir sélectionné le seuil approprié, sélectionnez Appliquer.
- Pour analyser la zone 6E10-positive, utilisez la barre d’outils et cliquez sur Analyser | Analysez les particules en vous assurant que le « Résumer les résultats » est vérifié.
- Copiez la sortie Résumé avec le %Area généré par le logiciel en cliquant sur Modifier | Copier. Collez dans le fichier Excel précédemment démarré avec les étiquettes respectives.
- Répétez les étapes 5.3 à 5.12 pour les différentes régions du tissu. Assurez-vous que le placement de chaque case pour décrire la région d’intérêt est cohérent entre chaque image.
REMARQUE: L’outil de rotation peut être utilisé si les dimensions de la boîte à outils Rectangle ne peuvent pas s’adapter à la région spécifiée en raison de la courbure des tissus. - Pour faire pivoter le rectangle, utilisez la barre d’outils et cliquez sur Modifier | Sélection | Faites pivoter et ajustez le degré de rotation selon vos besoins. Dupliquez l’image comme mentionné à l’étape 5.7 et effacez l’extérieur en utilisant la barre d’outils et en cliquant sur Modifier | Clair à l’extérieur, ce qui efface les taches 6E10 à l’extérieur du rectangle spécifié. Passez à l’étape 5.8 décrite ci-dessus.
Résultats
Ici, deux méthodes différentes sont comparées pour quantifier la zone 6E10-positive dans l’hippocampe et le cortex des tissus cérébraux de souris. Les deux méthodes sont les analyses de la région complète et de la sous-région d’intérêt (figure 1). L’analyse de la région d’intérêt complète, comme son nom l’indique, consiste à décrire toute la région d’intérêt (dans ce cas, soit l’iso-cortex, soit l’hippocampe) pour déterminer la zone 6E10 positive (Figure 1A, B). L’analyse de la sous-région d’intérêt consiste à sélectionner une région prédéfinie dans la région d’intérêt pour déterminer la zone positive 6E10 (Figure 1C,D). Le protocole ImageJ par étapes pour les deux méthodes est illustré à la Figure 2, à la Figure 3 et à la Figure 4.
Cette étude a utilisé trois lecteurs; deux lecteurs indépendants ont effectué l’analyse de la sous-région d’intérêt, et le troisième lecteur a effectué l’analyse complète de la région d’intérêt. Comme le montre la figure 5A,B, il y avait une forte corrélation positive significative (p < 0,0001) entre la zone 6E10 positive rapportée par les deux lecteurs effectuant l’analyse de la sous-région d’intérêt (coefficient de corrélation de Pearson r = 0,97 pour le cortex et r = 0,96 pour l’hippocampe). Les zones 6E10 positives rapportées par les deux lecteurs pour l’analyse de la sous-région d’intérêt ont été moyennées, et la sous-région d’intérêt moyenne de la zone positive 6E10 partageait une forte corrélation positive significative (p < 0,0001) avec la zone 6E10 positive obtenue à l’aide de l’analyse de la région d’intérêt complète pour les deux cortex (coefficient de corrélation de Pearson r = 0,96; Figure 5C) et l’hippocampe (coefficient de corrélation de Pearson r = 0,95; Figure 5D). L’aire moyenne corticale et hippocampique-6E10-positive obtenue par les analyses de la région complète et de la sous-région d’intérêt était comparable sans différence significative, confirmant l’accord entre les deux méthodes (Figure 5E). De plus, l’insoluble Aβ1-42 a été mesuré dans des homogénats cérébraux entiers dans un sous-ensemble de souris et la zone corticale (Figure 5F) et hippocampique (Figure 5G) 6E10-positive déterminée par l’analyse de la région d’intérêt complète était significativement (p < 0,01) corrélée avec une charge insoluble d’Aβ1-42 à l’aide d’ELISA (voir tableau des matériaux).
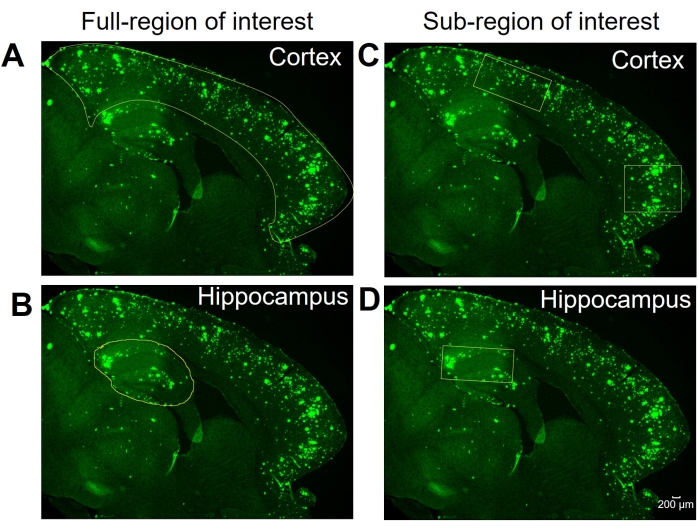
Figure 1 : Régions complètes ou sous-régions d’intérêt. Images représentatives montrant l’iso-cortex complet (cortex) et l’hippocampe décrits pour l’analyse de la région d’intérêt complète dans (A) et (B), respectivement. Des images représentatives montrent la sélection de sous-régions du cortex et de l’hippocampe pour l’analyse de la sous-région d’intérêt en (C) et (D), respectivement. Barre d’échelle = 200 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
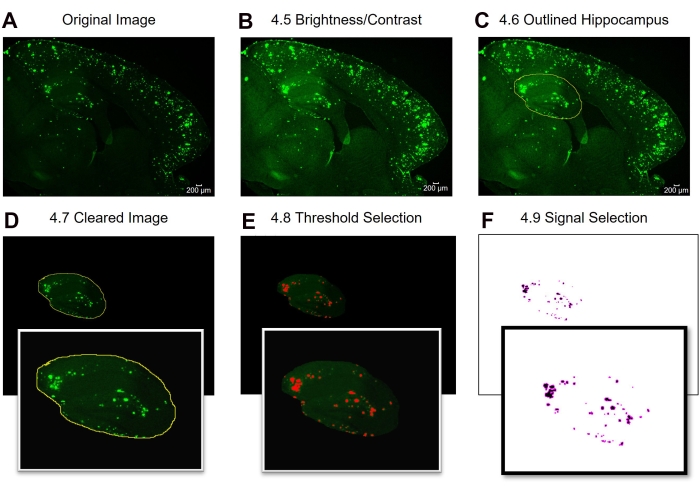
Figure 2 : Protocole pour la quantification de la zone positive de la région d’intérêt 6E10. Étapes d’analyse d’image montrant l’image d’origine (A), l’image après réglage de la luminosité / contraste (B), la sélection de la zone d’intérêt (C), l’effacement (D), le réglage du seuil (E) et l’image finale prête pour l’analyse (F). Les numéros de la figure désignent les numéros d’étape dans le protocole. Barre d’échelle = 200 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
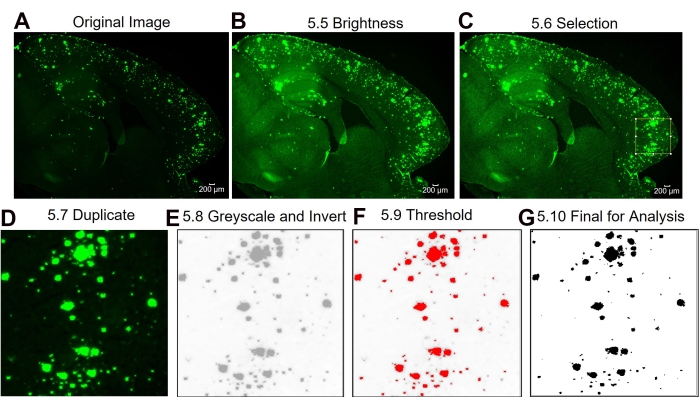
Figure 3 : Protocole pour la sous-région d’intérêt 6E10 -quantification de la zone positive. Étapes d’analyse d’image montrant l’image d’origine (A), l’image après réglage de la luminosité / contraste (B), la sélection de la zone d’intérêt (C), la duplication de l’image de la région d’intérêt (D), la modification de l’image en 8 bits et l’inversion de l’image (E), le réglage du seuil (F) et l’image finale prête à être analysée (G). Les numéros de la figure désignent les numéros d’étape dans le protocole. Barre d’échelle = 200 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
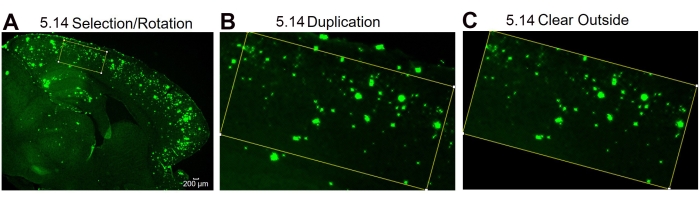
Figure 4 : Protocole pour la rotation de la région d’intérêt. Étapes d’analyse d’image montrant la sélection de la zone d’intérêt et la rotation de la boîte de sélection pour s’adapter à la courbure du tissu (A), l’image de la région d’intérêt après duplication (B) et l’image après avoir nettoyé la zone extérieure (non-région d’intérêt) (C). Les numéros de la figure désignent le numéro d’étape dans le protocole. Barre d’échelle = 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
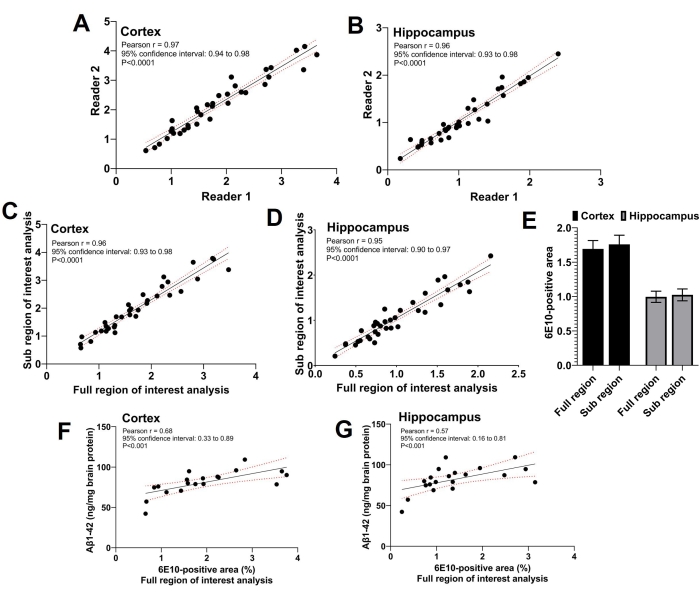
Figure 5 : Corrélation entre les analyses des régions complètes et des sous-régions d’intérêt. Les nuages de points montrent la corrélation entre la zone 6E10 positive par les deux lecteurs indépendants effectuant l’analyse de la sous-région d’intérêt pour le cortex (A) et l’hippocampe (B). Une forte corrélation positive est observée entre l’aire 6E10-positive résultant de l’analyse de la sous-région d’intérêt et l’analyse de la région d’intérêt complète pour le cortex (C) et l’hippocampe (D). Il n’y a pas de différence statistiquement significative dans l’aire moyenne 6E10-positive par la région complète d’intérêt et la sous-région d’intérêt analyses dans le cortex et l’hippocampe (E). Une corrélation significative est observée entre les mesures d’Aβ1-42 insolubles dans l’homogénat du cerveau entier à l’aide d’ELISA et l’analyse de la région d’intérêt complète pour le cortex (F) et l’hippocampe (G). Les données ont été analysées à l’aide du coefficient de corrélation de Pearson, r, in (A-D) et (F-G), et à l’aide de mesures répétées bidirectionnelles ANOVA in (E) à l’aide d’un logiciel de représentation graphique et de statistiques. Les données sont présentées comme moyennes ± erreur-type de la moyenne (MEB) de n = 35 souris en (E), et un p à deux queues < 0,05 a été considéré comme statistiquement significatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le protocole décrit ici décrit décrit la procédure de préparation hémi-cérébrale pour la section sagittale, la coloration immunofluorescente des dépôts Aβ à l’aide de l’anticorps 6E10 sur des sections flottantes librement, l’imagerie des sections cérébrales colorées Aβ suivie de la quantification des dépôts Aβ dans le cortex et l’hippocampe du tissu cérébral de souris à l’aide d’un logiciel d’analyse d’images. Bien qu’il existe des protocoles publiés pour quantifier la charge Aβ dans les sections de tissu cérébral 8,10, ce protocole décrit les étapes impliquées dans la quantification de la charge Aβ dans l’ensemble de l’iso-cortex (appelé cortex) et de l’hippocampe par rapport à la charge Aβ dans une sous-région d’intérêt dans le cortex et l’hippocampe, lorsque cela peut être souhaité. La corrélation entre les analyses complètes et les sous-régions d’intérêt est également fournie.
Il y a plusieurs étapes critiques dans le protocole. Tout d’abord, le protocole décrit concerne des coupes de tissu cérébral de 20 μm d’épaisseur soumises à une immunocoloration flottante, ce qui entraîne une pénétration optimale des anticorps dans la section tissulaire18. La technique de flottement libre peut nécessiter que les sections de tissus soient transférées manuellement entre les différentes solutions pendant la coloration immunofluorescente et qu’elles soient manipulées avec soin tout au long de la procédure. Ceci est particulièrement crucial lorsque les sections de tissus sont immergées dans la solution d’acide formique à 70% pour la récupération de l’antigène dans le protocole actuel, ce qui augmente la fragilité des tissus pour les sections minces. D’autres approches au protocole décrit comprennent l’utilisation de coupes de tissus plus épaisses (p. ex., 30 à 40 μm) ou de sections de tissus directement montées sur des lames chargées positivement avant la coloration immunofluorescente. Deuxièmement, le protocole décrit ici utilise un anticorps 6E10 marqué par fluorescence. Outre l’utilisation de l’anticorps 6E10 marqué par fluorescence, les anticorps 6E10 non fluorescents (par exemple, l’anticorps 6E10 conjugué à la peroxydase de raifort) peuvent également être utilisés pour détecter la charge Aβ dans les coupes de tissu cérébral, et le protocole actuel peut être adapté pour quantifier les taches immunochimiques Aβ positives dans les sections de tissu cérébral comme décrit précédemment8 . Troisièmement, l’exactitude des résultats pour la quantification de la charge Aβ dépendra de la sélection appropriée du seuil dans le logiciel d’analyse, qui dépend du fond tissulaire et de l’intensité du signal. La sélection du seuil doit être effectuée par l’utilisateur final de manière à ce que seules les taches Aβ positives soient sélectionnées pour la quantification. L’intervention de l’utilisateur final est nécessaire pour optimiser le seuil spécifique qui peut être appliqué à toutes les images afin d’assurer la précision du réglage du seuil. Quatrièmement, étant donné que l’analyse de la sous-région d’intérêt nécessite la sélection d’une petite région d’intérêt dans la section des tissus, deux lecteurs indépendants ont été utilisés pour cette analyse. Pour maintenir l’indépendance et l’aveuglement lors de la collecte des données, toutes les images ont été codées par numéro; la séquence d’analyse d’images a été randomisée entre les lecteurs de sorte que les différents lecteurs ont analysé différentes images à un moment donné, et les données ont été soumises à la fin de chaque semaine. En raison de la probabilité accrue de variabilité entre lecteurs dans la sélection de la région d’intérêt dans la sous-région d’analyse d’intérêt, les lecteurs ont été formés à l’aide de plusieurs images d’échantillon pour optimiser la sélection de la région dans le cortex et l’hippocampe avant de commencer la collecte de données. Cette formation est cruciale pour réduire la variabilité entre les lecteurs et, comme on peut le voir (Figure 5A, B), la zone 6E10 positive rapportée par les deux lecteurs montre un fort accord relatif dans la présente étude.
Le protocole actuel et les résultats fournissent des informations précieuses sur l’impact de la région de taille d’intérêt sur la quantification de la zone Aβ-positive. On s’attend à ce qu’une plus grande région d’intérêt représente le tissu plus qu’une région d’intérêt plus petite. Par conséquent, l’échantillonnage d’un tissu plus grand est souhaitable pour quantifier avec précision la charge Aβ dans les tissus. Cependant, dans le cas d’une distribution homogène de la charge Aβ dans le tissu, une région d’échantillonnage plus petite est généralement considérée comme une bonne représentation du plus grand tissu analysé. Les résultats de l’étude actuelle le confirment, et la charge Aβ dans l’ensemble du cortex et de l’hippocampe était un fort corrélat de la charge Aβ dans une sous-région sélectionnée du cortex et de l’hippocampe (Figure 5C,D). Pour confirmer davantage l’accord entre les analyses des régions complètes et des sous-régions d’intérêt, l’aire moyenne 6E10 positive dans le cortex et l’hippocampe a été comparée, et aucune différence entre les deux méthodes (Figure 5E) n’a été trouvée. Cela confirme que l’une ou l’autre de ces méthodes (analyse complète ou sous-région) donne des mesures de charge Aβ comparables.
Le protocole actuel comporte certaines limites. Les deux méthodes (analyse par région complète ou par sous-région) ne sont pas toujours utilisées de manière interchangeable. Le choix d’utiliser l’analyse complète ou sous-région dépendra de la distribution régionale d’Aβ dans le tissu, qui est influencée par l’âge, le sexe et la souche du modèle murin AD. À 13 mois, la charge Aβ est répartie dans tout le cortex et l’hippocampe des souris APP/PS1. Cependant, à 6 mois, les dépôts d’Aβ sont limités au cortex et des dépôts minimes sont observés dans l’hippocampe12. Dans de telles conditions, l’analyse de la région d’intérêt complète peut être l’approche souhaitée pour augmenter la zone d’échantillonnage tissulaire et donc le signal Aβ. D’autre part, l’analyse de sous-région peut être la méthode de choix lorsque la charge Aβ dans une région spécifique du cerveau est intéressante (par exemple, le cortex somatosensoriel). De plus, à 13 mois, les souris mâles APP/PS1 présentent des taches intenses 6E10 positives, et la coloration immunofluorescente donne un excellent signal avec un fond très faible, ce qui rend le protocole actuel très approprié pour la quantification dans les conditions données. Il n’est pas clair si cette méthode de quantification peut être appliquée avec succès à une coloration moins intense, et des travaux futurs seront nécessaires pour répondre à cette question. La méthode immunofluorescente et de quantification par image présentée ici détecte toutes les formes d’Aβ, y compris la forme précurseur13. Par conséquent, s’il y a un intérêt pour la détection d’une espèce Aβ spécifique (par exemple, Aβ1-40 ou Aβ1-42), des anticorps spécifiques à ces isoformes Aβ peuvent être utilisés. Par conséquent, bien que la méthode de coloration et de détection immunofluorescente 6E10 soit corrélée avec les mesures des mesures Aβ1-42 dans des homogénats cérébraux entiers à l’aide d’ELISA (Figure 5F, G), la corrélation n’était que modeste. Cela peut être attribué à la mesure de seulement Aβ1-42 à l’aide de l’ELISA et à la détection de toutes les espèces d’Aβ à l’aide de l’immunocoloration 6E10. La présente étude utilise trois lecteurs pour évaluer l’accord et la corrélation entre les analyses complètes et sous-régionales. Avoir des lecteurs supplémentaires peut améliorer la robustesse de l’étude et peut valider davantage les accords entre les deux méthodes présentées ici. De plus, nous utilisons la corrélation de Pearson comme mesure de l’accord, qui est largement utilisée parmi d’autres méthodes pour décrire l’accord entre les variables continues19. Cependant, l’une des limites de l’utilisation de la corrélation de Pearson pour déterminer l’accord est que les deux méthodes utilisées ici peuvent fournir des résultats connexes, mais une méthode peut entraîner des valeurs globalement plus élevées que l’autre en raison d’un biais systématique. Par conséquent, la corrélation de Pearson est une bonne mesure de l’accord relatif19. Pour accroître la robustesse du protocole, des méthodes supplémentaires pour confirmer l’accord absolu, telles que la comparaison de la zone moyenne positive de 6E10 par les deux méthodes (figure 5E), peuvent êtreutilisées 19. Pris ensemble, le protocole actuel compare la charge Aβ détectée par coloration immunofluorescente et analyse les régions complètes et sous-régions d’intérêt dans les sections de tissu cérébral. Les résultats montrent une forte corrélation entre ces deux méthodes pour les coupes de tissu cérébral dérivées de souris mâles APP/PS1 âgées de 13 mois qui présentent des dépôts abondants d’Aβ.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
La recherche rapportée dans cette publication a été soutenue par le National Institute of Aging des National Institutes of Health sous les numéros d’attribution R01AG062840 (à RKS) et R01AG072896 (à RKS). Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les points de vue officiels des National Institutes of Health. Environ 200 000 $ (100 %) de fonds fédéraux ont appuyé ce projet. Nous tenons également à remercier le Dr Joshua Yang pour son aide à l’édition de manuscrits.
matériels
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | ThermoFisher Scientific, MA, USA | 339650 | |
| 24-well plates | Fisher Scientific, NH, USA | FB012929 | |
| Amyloid beta 42 human ELISA kit | ThermoFisher Scientific, MA, USA | KHB3441 | |
| Aqueous mounting media | Vector laboratories, CA, USA | H-5501-60 | |
| Bovine serum albumin | Sigmaaldrich, MO, USA | A2153-50G | |
| BZ-X710 Keyence all-in-one fluorescence microscope | Keyence, IL, USA | BZ-X710 | |
| Clear nail poilsh | User preference | NA | |
| Cryostat | Leica Biosystems, IL, USA | Leica CM1860 Cryostat | |
| Formic acid | Sigmaaldrich, MO, USA | F0507-500ML | |
| Glass coverslips | VWR, PA, USA | 48393-081 | |
| GraphPad Prism | GraphPad Software, CA, USA | Version 8 | |
| ImageJ 1.51k | National Institutes of Health, MD, USA | Version 1.53e | |
| Mice | Jackson Laboratories, ME, USA | 034829-JAX | |
| Paraformaldehyde | Sigmaaldrich, MO, USA | P6148-500G | |
| Phenytoin/pentobarbital based anesthetic (Euthasol) | Patterson Veterinary, MA, USA | 07-805-9296 | |
| Phosphate-buffered saline | Fisher Scientific, NH, USA | BP661-50 | |
| Plus (+) microscope slides | Ted Pella, Inc., CA, USA | 260100 | |
| Primary antibody (6E10) | Biolegend, CA, USA | 803013 | |
| Sucrose | Sigmaaldrich, MO, USA | 47289 | |
| Triton X 100 | Sigmaaldrich, MO, USA | T8787-100ML |
Références
- Alzheimer's Association. 2021 Alzheimer's disease facts and figures. Alzheimer's & Dementia. 17 (3), 327-406 (2021).
- Langa, K. M., Foster, N. L., Larson, E. B. Mixed dementia: emerging concepts and therapeutic implications. Journal of the American Medical Association. 292 (23), 2901-2908 (2004).
- Gandy, S., DeKosky, S. T. Toward the treatment and prevention of Alzheimer's disease: rational strategies and recent progress. Annual Review of Medicine. 64, 367-383 (2013).
- Bloom, G. S. Amyloid-beta and tau: the trigger and bullet in Alzheimer disease pathogenesis. JAMA Neurology. 71 (4), 505-508 (2014).
- Gremer, L., et al. Fibril structure of amyloid-beta(1-42) by cryo-electron microscopy. Science. 358 (6359), 116-119 (2017).
- Ferrero, J., et al. First-in-human, double-blind, placebo-controlled, single-dose escalation study of aducanumab (BIIB037) in mild-to-moderate Alzheimer's disease. Alzheimer's & Dementia Translational Research & Clinical Interventions. 2 (3), 169-176 (2016).
- Poon, C. H., Wang, Y., Fung, M. L., Zhang, C., Lim, L. W. Rodent models of amyloid-beta feature of Alzheimer's disease: development and potential treatment implications. Aging and Disease. 11 (5), 1235-1259 (2020).
- Christensen, A., Pike, C. J. Staining and quantification of beta-amyloid pathology in transgenic mouse models of Alzheimer's disease. Methods in Molecular Biology. 2144, 221(2020).
- Thakker, D. R., et al. Intracerebroventricular amyloid-beta antibodies reduce cerebral amyloid angiopathy and associated micro-hemorrhages in aged Tg2576 mice. Proceedings of the National Academy of Sciences of the United States of America. 106 (11), 4501-4506 (2009).
- Song, Z., et al. Detecting amyloid-beta accumulation via immunofluorescent staining in a mouse model of Alzheimer's disease. Journal of Visualized Experiments. (170), e62254(2021).
- Sun, J., et al. Hematologic safety of chronic brain-penetrating erythropoietin dosing in APP/PS1 mice. Alzheimer's & DementiaTranslational Research & Clinical Interventions. 5, 627-636 (2019).
- Jankowsky, J. L., et al. Mutant presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo: evidence for augmentation of a 42-specific gamma secretase. Human Molecular Genetics. 13 (2), 159-170 (2004).
- Grant, M. K. O., et al. Human cerebrospinal fluid 6E10-immunoreactive protein species contain amyloid precursor protein fragments. PloS One. 14 (2), 0212815(2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Eichenbaum, K. D., et al. Minimally invasive method for murine brain fixation. Biotechniques. 39 (4), 487-490 (2005).
- Chang, R., et al. Blood-brain barrier penetrating biologic tnf-alpha inhibitor for Alzheimer's disease. Molecular Pharmaceutics. 14 (7), 2340-2349 (2017).
- Pinskiy, V., et al. High-throughput method of whole-brain sectioning, using the tape-transfer technique. PloS One. 10 (7), 0102363(2015).
- Potts, E. M., Coppotelli, G., Ross, J. M. Histological-based stainings using free-floating tissue sections. Journal of Visualized Experiments. (162), e61622(2020).
- van Stralen, K. J., Dekker, F. W., Zoccali, C., Jager, K. J. Measuring agreement, more complicated than it seems. Nephron Clinical Practice. 120 (3), 162-167 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon