Method Article
小鼠脑切片上淀粉样蛋白-β负荷的全区域与亚区域定量
摘要
本方案描述并比较了对矢状小鼠脑切片进行全区域或子区域感兴趣分析的程序,以量化阿尔茨海默病的APP / PS1转基因小鼠模型中的淀粉样蛋白-β负荷。
摘要
细胞外淀粉样蛋白β(Aβ)斑块的积累是阿尔茨海默病(AD)的主要病理标志之一,也是FDA批准的唯一AD疾病修饰治疗的目标。因此,免疫测定,包括酶联免疫吸附测定(ELISA)和免疫染色,通常测量来自AD转基因小鼠的脑组织中的Aβ负荷。虽然Aβ检测和定量的方法已经建立并记录在案,但在免疫染色后,脑组织中选择的感兴趣区域的大小对Aβ负荷测量的影响尚未报道。因此,目前的协议旨在使用图像分析软件比较感兴趣的全区域和子区域的Aβ负载测量值。使用来自13个月大的APP / PS1双转基因雄小鼠的脑切片来描述脑组织制备,自由浮动脑切片免疫染色,成像和全非感兴趣亚区域Aβ负荷定量所涉及的步骤。目前的方案和结果提供了有关感兴趣区域大小对Aβ阳性区域定量的影响的宝贵信息,并显示使用来自13个月大的雄性APP / PS1小鼠的大脑切片的全区域和子区域感兴趣的区域获得的Aβ阳性区域之间存在很强的相关性,这些区域显示出广泛的Aβ沉积。
引言
阿尔茨海默病(AD)是美国第六大死因,仍然是一种公共卫生威胁,估计有620万美国人患有AD。预计到2060年将达到1380万1。迄今为止,通过胆碱酯酶抑制剂和美金刚等药物进行对症治疗是治疗的主要疗程2。AD的特征在于神经病理学表现,例如细胞外β-淀粉样蛋白(Aβ)斑块的沉积和细胞内高磷酸化tau以神经原纤维缠结的形式积累3,4。由淀粉样蛋白前体蛋白(APP) 通过 β和γ-分泌酶的内旋溶解裂解形成,Aβ聚集形成低聚物和原纤维,导致神经毒性作用5。自 20 世纪 80 年代以来,Aβ 已被假设为具有主要病理作用,并且是 FDA 批准的唯一 AD6 疾病改善疗法的治疗靶点。因此,自20世纪90年代初以来,转基因AD小鼠模型在基因中携带突变,导致强大的大脑Aβ积累,已被广泛用于临床前AD研究7。
这些AD转基因小鼠大脑中Aβ物种的检测通常使用两种免疫测定法进行:酶联免疫吸附测定(ELISA)和免疫染色。前一种测定能够定量测定不同的Aβ物种,并且与免疫染色相比,它更省时,免疫染色需要几个顺序组织处理和成像步骤,包括组织切片,免疫染色,成像和定量8。此外,免疫染色后获得的结果是半定量的8。然而,空间定位Aβ的能力使得免疫染色成为脑组织中Aβ检测的一种有吸引力的方法8。
在使用Aβ免疫染色时,不同的研究小组已经采用了几种不同的定量范式。例如,一些研究小组量化整个感兴趣区域(皮层或海马体)中的Aβ负荷,而另一些研究小组则量化指定感兴趣子区域(皮层或海马体的一部分)中的Aβ负荷9,10,11。虽然Aβ检测和定量的方法已经建立并记录在案,但尚未报道免疫染色后感兴趣区域的大小对Aβ负载测量的影响。因此,目前的协议旨在使用图像分析软件ImageJ比较感兴趣的全区域和子区域的Aβ负载测量值。
目前的研究使用13个月大的APP / PS1双转基因雄性小鼠,其表达嵌合小鼠/人类APP和突变前enilin 1,以模拟AD12的早期发作。Aβ沉积物在6-7月龄时开始发育,并且在12岁9-10个月大时在这些小鼠的皮层和海马体中观察到丰富的Aβ积累。转基因淀粉样肽和全蛋白可以通过6E10-免疫染色13检测,使其成为本方案的理想动物模型。本文涵盖的程序包括脑组织制备,自由浮动切片的免疫染色,成像以及全孔与子区域中Aβ负荷的定量。该分析显示全区域和次区域定量之间存在很强的相关性,表明这两种方法在来自13个月大的APP / PS1雄性小鼠的脑组织切片中具有很强的一致性,这些雄性小鼠显示出丰富的Aβ沉积物。
研究方案
所有动物实验均按照加州大学欧文分校机构动物护理和使用委员会批准的协议,按照大学实验动物资源进行。实验用雄性B6C3-Tg(APPswe,PSEN1dE9)85Dbo / Mmjax(APP / PS1)小鼠(13个月大,n = 35)进行。小鼠是从商业来源获得的(见 材料表)。
1. 脑组织准备
- 按照批准的动物方案,使用致命剂量的苯妥英/戊巴比妥基麻醉剂(150mg / kg)腹膜内注射(见 材料表)麻醉小鼠。以 5 mL/min 的速度用冰冷的磷酸盐缓冲盐水 (1x PBS) 进行心脏灌注 5 分钟,以清除脑血管系统14.
- 根据先前发表的报告15收获脑组织,分离成左脑和右脑半球,并将每只小鼠的右半脑放入含有5mL新鲜制备的4%多聚甲醛(PFA)溶液的15mL锥形管中,在1x PBS中在4°C下72小时。
注意:大脑可能在24-72小时内浸泡固定,具体取决于所研究的抗原。没有小脑的左半脑可以在液氮中快速冷冻,然后储存在-80°C,然后处理生化测定,例如ELISA和生化Aβ检测16。
注意:PFA是一种可能的致癌物质,皮肤接触PFA可能会导致过敏性皮肤症状。使用丁腈或丁基手套,面罩和护目镜进行处理,并在化学通风橱下准备。 - 在4%PFA中孵育后,将半脑依次在5mL的10%,20%和30%蔗糖溶液中孵育1x PBS中24小时,每个溶液在4°C下直到脑组织沉入锥形管的底部。
- 在30%蔗糖溶液中孵育后,除去半脑,轻轻地将脑轻拍在滤纸上以除去多余的蔗糖溶液,并将固定的半脑在干冰粉中冷冻30分钟。将冷冻的半脑储存在-80°C下标记良好的铝箔中,直到冷冻切片。
注意:在目前的方案中,半脑在-80°C下储存6-8个月。 - 使用低温恒温器将冷冻的半脑切片成20μm厚的部分(参见 材料表)。
注意:对于目前的方案,半脑被切成矢状切片,如果需要,冠状切片也可以制备17。步骤2用于在固定和冷冻保护的脑组织样品上进行Aβ免疫荧光染色。
2. 免疫荧光
- 将矢状脑组织切片(步骤1.5)放入24孔板中(每孔每300μL最多6个小鼠脑切片)。通过将板放在具有温和旋转的振荡器上,在室温(23°C)下用1x PBS洗涤5分钟三次。
- 在室温下用70%甲酸在dH20中孵育脑组织切片10分钟。
注意:甲酸具有腐蚀性,因此请避免皮肤和眼睛接触。 - 在室温下用dH20洗涤脑组织切片5分钟三次。
- 在室温下阻断与0.5%牛血清白蛋白(BSA)和0.3%TritonX 100(参见 材料表)在1x PBS中的非特异性结合1小时。
- 将脑组织切片与荧光团标记的一抗(6E10,参见 材料表)在含有0.3%TritonX 100的1x PBS中稀释(1:1000)在4°C下孵育24小时。
注意:由于一抗是荧光团偶联的,因此从此步骤开始需要覆盖板,或者必须在暗室中完成所有工作以保持荧光团的有效性。 - 在室温下用1x PBS洗涤脑组织切片10分钟三次。
- 将脑组织切片安装在带正电 的载玻片上,这些载玻片标记良好(载玻片上的标签信息基于偏好),用dH20进行短暂洗涤以除去剩余的盐。让幻灯片在黑暗中风干。
注意:大脑切片必须仔细安装,以避免折叠和撕裂,从而影响数据量化。如果裂隙和/或褶皱位于感兴趣区域并可能干扰数据定量,建议重新染色并重新安装。 - 用水性安装介质安装脑组织切片(参见 材料表),并将玻璃盖玻片放在组织上。用透明指甲油密封盖玻片的末端,并将载玻片存放在4°C的载玻片盒中,直到成像。
注意:在目前的方案中,载玻片在染色后1个月内成像。
3. 成像
- 使用荧光(落射荧光或共聚焦)显微镜对6E10染色的大脑切片进行成像(参见 材料表),该显微镜具有2倍物镜,可在一张图像中捕获整个脑组织切片,并配备适当的过滤器(本作品中的GFP)。
注意:不同载玻片的成像设置必须一致。 - 将捕获的图像保存为TIFF文件或根据需要,并在图像分析软件中打开它们(参见 材料表),如下面的步骤4.2中所述,用于6E10定量。
注:在图像分析软件 ImageJ 中捕获要量化的图像之前,请先添加比例尺。
4. 全区域感兴趣分析
注意:本作品感兴趣的两个区域是海马体和等皮层。全感兴趣区域分析表示对整个等皮层(称为向前的皮层)或成像脑组织部分中的海马体的分析。
- 下载图像分析软件(参见 材料表),安装后启动软件。
- 软件运行后,单击 "文件|开放式|选择要分析的图像 。
- 单击" 分析|设置比例|单击此项可删除刻度。从软件工具栏中选择直线工具,然后沿比例尺的长度绘制一条直线。单击"分析|测量。请注意比例尺的长度或距离(以像素为单位)。单击"分析|设置比例。
- 在弹出窗口中,输入以像素为单位的距离、比例尺的已知距离(在本例中为 μm)以及长度单位(μm)。选中"全局"以将新比例设置应用于处理多个图像时的所有后续图像。单击"确定"以应用设置。
注意:始终建议在进一步分析之前检查是否将精确比例应用于图像。
- 在弹出窗口中,输入以像素为单位的距离、比例尺的已知距离(在本例中为 μm)以及长度单位(μm)。选中"全局"以将新比例设置应用于处理多个图像时的所有后续图像。单击"确定"以应用设置。
- 要将所需测量值设置为截面面积,请转到 分析|设置测量|选择"面积"和"显示标签"框。检查是否在" 重定向到"下选择了正在分析的图像。
- 为了便于海马体或皮层可视化,请转到 图像|调整|亮度/对比度。将" 最大" 滑动条逐渐向左拖动,以提高组织的清晰度,直到可以识别感兴趣的大脑区域。
注意:请勿应用此设置以避免在分析过程中出现错误测量,而是继续执行下一步。 - 使用多边形选择或手绘选择工具勾勒出海马体区域的轮廓。单击"亮度/对比度"设置的"重置"选项,一旦海马体轮廓化,即可恢复到原始亮度。
注意:对于皮质区域,必须单独重复这些步骤。 - 要测量所选区域的总组织面积,请单击 编辑|外面很清晰。一旦所选区域是屏幕上的唯一图像,请单击" 分析|测量 以获得在弹出窗口中分析 的总组织面积 。将数据保存在 Excel 文件中以供以后使用。
- 要测量 6E10 正区域,请转到 图像|调整|颜色阈值。 阈值方法 下的预制滤波器通常提供所需的结果,以红色突出显示最强的信号。
注意:最佳阈值选择将取决于图像的背景和染色强度。选择选取污渍而不是背景的阈值设置。 - 选择适当的阈值后,选中 深色背景。这将突出显示黑色背景上的Aβ斑点(感兴趣的污点)。点击 选择|原始|选择,在白色背景上给出暗信号(Aβ沉积物)。单击" 分析|分析粒子, 并在弹出窗口生成时单击 确定 。
- 通过单击"编辑|复制软件生成的摘要输出 复制。粘贴到以前启动的Excel文件中,并带有相应的标签。这是所选感兴趣区域(海马体或皮层)中的6E10阳性区域。
注意:在Excel中,将有一列用于总6E10阳性区域(步骤4.10)和总组织区域(步骤4.7)。 - 计算6E10阳性面积(%)如下16:(分析的总6E10阳性面积/总组织面积)x 100。
5. 兴趣子区域分析
注意:感兴趣的子区域分析表示对成像脑组织部分中皮层或海马体部分的分析。
- 下载图像分析软件,并在安装后启动软件。
- 软件运行后,单击 "文件|开放式|选择要分析的图像 。
- 单击"分析|设置比例|单击此项可删除刻度。从软件工具栏中选择直线工具,然后沿比例尺的长度绘制一条直线。单击"分析|测量。请注意比例尺的长度或距离(以像素为单位)。单击"分析|设置比例。
- 在弹出窗口中,输入以像素为单位的距离、比例尺的已知距离(在本例中以 μm 为单位),然后输入长度单位 μm。选中"全局"以将新比例设置应用于处理多个图像时的所有后续图像。单击"确定"以应用设置。
注意:始终建议在进一步分析之前检查是否将精确比例应用于图像。
- 在弹出窗口中,输入以像素为单位的距离、比例尺的已知距离(在本例中以 μm 为单位),然后输入长度单位 μm。选中"全局"以将新比例设置应用于处理多个图像时的所有后续图像。单击"确定"以应用设置。
- 要将所需测量值设置为截面面积,请转到 分析|设置测量|选择"区域"和"显示标签"框。检查是否在" 重定向到"下选择了正在分析的图像。
- 如果图像太暗,并且大脑区域(例如,在这种情况下是海马体或皮层)无法轻松识别,则调整亮度和对比度。使用软件工具栏,然后单击 图像|调整|亮度/对比度 ,然后根据需要向左拖动 "最大 "滑块以增加组织可见性。
注意:请勿应用此设置以避免在分析过程中出现错误测量,而是继续执行下一步。 - 使用 矩形工具,选择皮层或海马体中感兴趣的区域。使用工具栏,然后单击 编辑|选择|指定,将高度和宽度更改为预定义的值。调整盒子,使其完全被纸巾覆盖。重置亮度/对比度以恢复到原始亮度。
注: 用于选择感兴趣区域的框的大小对于所有图像必须保持一致。对于目前的分析,盒子尺寸为300像素x 300像素(相当于1177μm x 1177μm)或400像素x 200像素(相当于1569μm x 784μm)。 - 通过右键单击该框并单击"复制"来 复制选定的感兴趣区域。将打开一个包含所选区域的新窗口。重命名复制的图像以显示其所在的区域(例如,皮层或海马体)。
- 通过使用工具栏并单击"图像|来调整复制 的图像类型类型 |8 位 ,用于将复制的 RGB 图像转换为 8 位,以最好地分析斑块。通过单击 "编辑|来反转图像反转。
- 要测量 6E10 正区域,请转到 图像|调整|阈值。 阈值方法 下的预定义滤波器通常通过以红色突出显示最强的信号来提供所需的结果。
注意:最佳阈值选择将取决于图像的背景和染色强度。选择选取污渍而不是背景的阈值设置。 - 选择适当的阈值后,选择" 应用"。
- 要分析 6E10 阳性区域,请使用工具栏并单击" 分析|分析颗粒,确保选中"汇总结果"。
- 通过单击"编辑"复制摘要输出和软件生成的%面积|复制。粘贴到以前启动的Excel文件中,并带有相应的标签。
- 对组织中的不同区域重复步骤5.3-5.12。确保每个框的位置与每个图像之间的感兴趣区域的轮廓一致。
注: 如果 矩形工具箱 尺寸由于组织曲率而无法适应指定区域,则可以使用旋转工具。 - 要旋转矩形,请使用工具栏并单击 "编辑|选择|根据需要旋转 和调整旋转度。复制步骤 5.7 中提到的图像,并使用工具栏并单击" 编辑|清除外部清除外部,清除指定矩形外部的 6E10 污渍。继续执行上述步骤 5.8。
结果
在这里,比较两种不同的方法来量化海马体中的6E10阳性区域和小鼠脑组织的皮层。这两种方法是感兴趣的全区域和子区域分析(图1)。顾名思义,全感兴趣区域分析涉及概述整个感兴趣区域(在这种情况下,是等皮层或海马体)以确定6E10阳性区域(图1A,B)。感兴趣的子区域分析涉及在感兴趣区域内选择一个预定义的区域,以确定6E10正区域(图1C,D)。这两种方法的逐步 ImageJ 协议如图 2、 图 3 和 图 4 所示。
这项研究使用了三个读者;两个独立的阅读器执行感兴趣的子区域分析,第三个读取器执行感兴趣的全区域分析。如图 5A,B所示,进行兴趣子分析的两位读者报告的6E10阳性区域之间存在很强的显着正相关(p <0.0001)(皮质的Pearson相关系数 r = 0.97,海马体 的r = 0.96)。对两位读者报告的6E10阳性区域进行兴趣子区域分析,平均感兴趣的6E10正区域与使用全感兴趣区域分析获得的6E10阳性区域 <( Pearson相关系数 r = 0.96; 图 5C)和海马体(皮尔逊相关系数 r = 0.95; 图 5D)。通过感兴趣的全区域和亚区域分析获得的平均皮质和海马6E10阳性区域具有可比性,没有显着差异,证实了两种方法之间的一致性(图5E)。此外,在小鼠亚群中测定不溶性Aβ1-42的全脑匀浆,并且使用ELISA测定的皮质(图5F)和海马(图5G)6E10阳性区域的全区域感兴趣分析显着(p <0.01)与不溶性Aβ1-42负载相关(参见 材料表)。
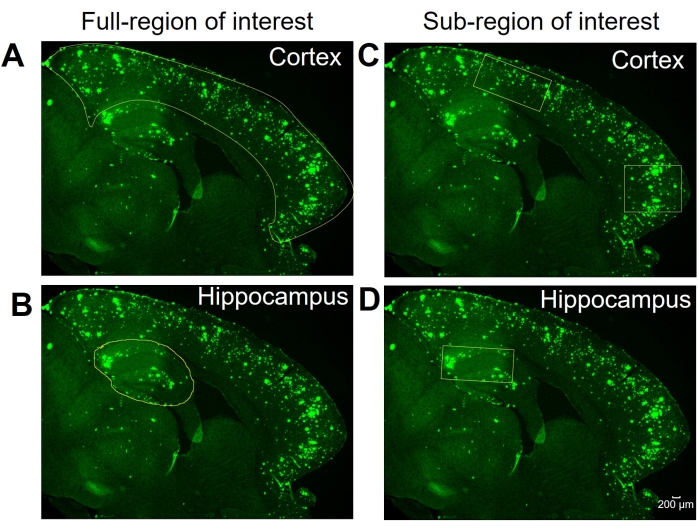
图 1:感兴趣的全区域与子区域选择。 代表性图像分别显示了(A)和(B)中用于全感兴趣区域分析的全等皮层(皮层)和海马体。代表性图像分别显示了皮层和海马体亚区域的选择,用于(C)和(D)中感兴趣的亚区域分析。比例尺 = 200 μm 。请点击此处查看此图的大图。
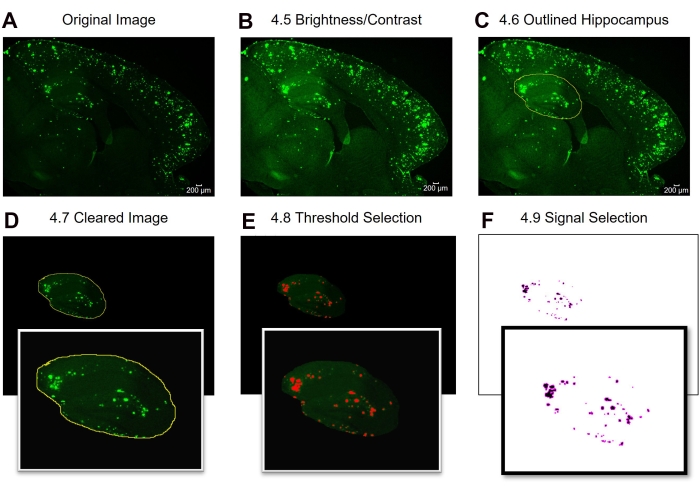
图2:全感兴趣区域6E10阳性区域定量的实验方案。 图像分析步骤显示原始图像(A),亮度/对比度调整后的图像(B),感兴趣区域的选择(C),清除(D),阈值调整(E),以及准备分析的最终图像(F)。图中的数字表示协议中的步骤号。比例尺 = 200 μm 。请点击此处查看此图的大图。
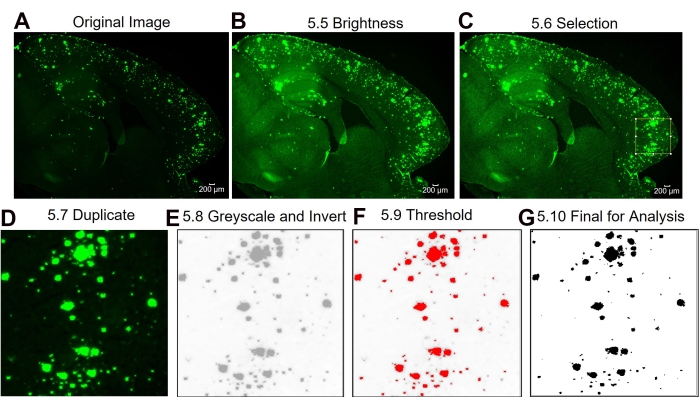
图3:感兴趣的子区域6E10阳性区域定量的实验方案。 显示原始图像(A),亮度/对比度调整后的图像(B),选择感兴趣区域(C),复制感兴趣区域的图像(D),将图像更改为8位并反转图像(E),阈值调整(F)和最终图像准备分析的图像(G)的图像分析步骤。图中的数字表示协议中的步骤号。比例尺 = 200 μm 。请点击此处查看此图的大图。
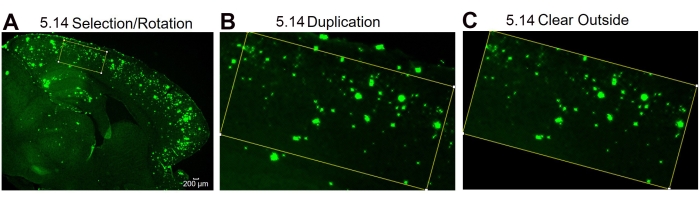
图 4:感兴趣区域旋转的协议。 图像分析步骤显示选择感兴趣区域和旋转选择框以拟合组织曲率(A),复制后感兴趣区域的图像(B),以及清除外部(非感兴趣区域)区域(C)后的图像。图中的数字表示协议中的步骤号。比例尺 = 200 μm。 请点击此处查看此图的大图。
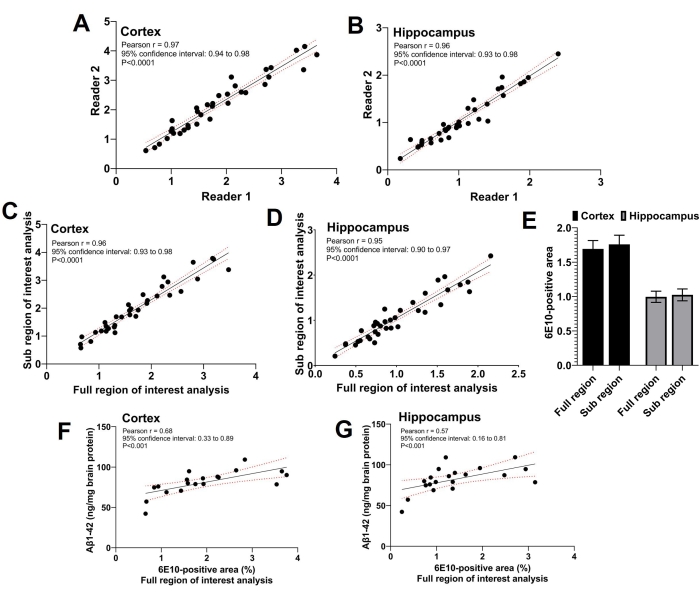
图 5:感兴趣分析的全区域和子区域之间的相关性。 散点图显示了两个独立的读取器对皮层(A)和海马体(B)进行兴趣子区域分析的6E10阳性区域之间的相关性。在由子感兴趣区域分析得出的6E10阳性区域与皮层(C)和海马体(D)的全感兴趣区域分析之间观察到很强的正相关关系。在皮层和海马体(E)中,通过全感兴趣区域和感兴趣的子区域分析,平均6E10阳性区域没有统计学上的显着差异。使用ELISA的全脑均质不溶性Aβ1-42测量与皮层(F)和海马体(G)的全感兴趣区域分析之间存在显着相关性。使用Pearson相关系数 r,in(A-D)和(F-G)分析数据,并使用图形和统计软件使用(E)中的双向重复测量方差分析数据。数据表示为平均±(E)中n = 35只小鼠的平均±标准误差(SEM),并且双尾 p <0.05被认为具有统计学意义。 请点击此处查看此图的大图。
讨论
这里描述的方案概述了半脑制备矢状截面的程序,在自由浮动切片上使用6E10抗体对Aβ沉积物进行免疫荧光染色,对Aβ染色的脑切片进行成像,然后使用图像分析软件对小鼠脑组织的皮层和海马体中的Aβ沉积物进行定量。虽然有已发表的方案可以量化脑组织切片8,10中的Aβ负荷,但该方案描述了在整个等皮层(称为皮层)和海马体中与皮层和海马体中感兴趣的子区域中的Aβ负荷进行定量所涉及的步骤,当可能需要这样做时。还提供了感兴趣分析的全区域与子区域之间的相关性。
该协议中有几个关键步骤。首先,所描述的方案是用于对20μm厚的脑组织切片进行自由浮动的免疫染色,这导致抗体在组织切片18内的最佳渗透。自由浮动技术可能需要在免疫荧光染色期间在不同溶液之间手动转移组织切片,并在整个过程中仔细处理组织切片。在当前方案中,当组织切片浸入70%甲酸溶液中以进行抗原检索时,这一点尤其重要,这增加了薄切片的组织脆性。所述方案的替代方法包括使用较厚的组织切片(例如,30-40μm)或使用在免疫荧光染色之前直接安装在带正电荷的载玻片上的组织切片。其次,本文描述的方案使用荧光标记的6E10抗体。除了使用荧光标记的6E10抗体外,非荧光6E10抗体(例如,辣根过氧化物酶偶联6E10抗体)也可用于检测脑组织切片中的Aβ负荷,并且当前的方案可以适应量化脑组织切片中的Aβ阳性免疫化学染色,如前所述8.第三,Aβ负荷定量结果的准确性将取决于分析软件中适当的阈值选择,这取决于组织背景和信号强度。阈值选择必须由最终用户执行,以便仅选择Aβ阳性染色进行定量。需要最终用户干预来优化可应用于所有图像的特定阈值,以确保阈值设置的准确性。第四,由于感兴趣的子区域分析需要在组织部分中选择一个小的感兴趣区域,因此使用两个独立的阅读器进行此分析。为了在数据收集过程中保持独立性和盲法,所有图像都进行了编号编码;图像分析序列在读者之间随机化,以便不同的读者在任何给定时间分析不同的图像,并在每周结束时提交数据。由于在感兴趣的子区域分析中,在感兴趣的区域选择中,读取器间变异的可能性增加,因此在开始数据收集之前,使用几个样本图像对读取器进行了训练,以优化皮层和海马体中的区域选择。这种训练对于减少读者之间的变异性至关重要,可以看出(图5A,B),两位读者报告的6E10阳性区域在当前研究中显示出很强的相对一致性。
目前的实验方案和结果提供了关于感兴趣区域大小对Aβ正区域定量的影响的宝贵信息。较大的感兴趣区域应比较小的感兴趣区域更能代表组织。因此,需要对较大的组织进行采样以准确量化组织中的Aβ负荷。然而,在组织内Aβ负荷分布均匀的情况下,较小的采样区域通常被认为是所分析的较大组织的良好代表。目前的研究结果证实了这一点,整个皮层和海马体中的Aβ负荷与皮层和海马体的选定亚区域中的Aβ负荷密切相关(图5C,D)。为了进一步确认感兴趣的全区域和子区域之间的一致性,比较了皮层和海马体中的平均6E10阳性区域,并且发现两种方法之间没有差异(图5E)。这证实了这两种方法中的任何一种(全区域或子区域分析)都能产生可比的Aβ负载测量结果。
当前的协议有一些限制。这两种方法(全区域分析与子区域分析)可能并不总是可以互换使用。使用全区域或亚区域分析的选择将取决于Aβ在组织内的区域分布,这受到AD小鼠模型的年龄,性别和菌株的影响。在13个月时,Aβ负荷分布在APP / PS1小鼠的整个皮质和海马体中。然而,在6个月时,Aβ沉积物仅限于皮层,并且在海马体12中观察到最小的沉积物。在这样的条件下,全感兴趣区域分析可能是增加组织采样面积并因而增加Aβ信号的所需方法。另一方面,亚区域分析可能是当感兴趣的特定大脑区域(例如,躯体感觉皮层)中的Aβ负荷时的首选方法。此外,在13个月时,APP / PS1雄性小鼠表现出强烈的6E10阳性染色,并且免疫荧光染色产生具有非常低背景的出色信号,使得当前的方案非常适合在给定条件下进行定量。目前尚不清楚这种定量方法是否可以成功地应用于强度较低的染色,未来的工作将需要回答这个问题。本文提出的免疫荧光和图像定量方法检测所有形式的Aβ,包括前体形式13。因此,如果对检测特定的Aβ物种(例如,Aβ1-40或Aβ1-42)感兴趣,则可以使用这些Aβ亚型的特异性抗体。因此,尽管6E10免疫荧光染色和检测方法与使用ELISA的全脑匀浆中Aβ1-42测量的测量结果相关(图5F,G),但相关性仅为适度。这可以归因于仅使用ELISA测量Aβ1-42,并使用6E10免疫染色检测所有Aβ物种。本研究使用三位读者来评估全区域分析与次区域分析之间的一致性和相关性。拥有额外的读者可能会提高研究的稳健性,并且可以进一步验证此处介绍的两种方法之间的一致性。此外,我们使用皮尔逊相关作为一致性的度量,这在其他方法中被广泛用于描述连续变量19之间的一致性。然而,使用Pearson相关性来确定一致性的一个限制是,本文使用的两种方法可以提供相关结果,但由于系统偏倚,一种方法可能导致总体值高于另一种方法。因此,皮尔逊相关是相对一致性19的良好衡量标准。为了增加协议的鲁棒性,可以使用其他方法来确认绝对一致性,例如通过两种方法比较平均6E10正区域(图5E),可以使用19。综上所述,目前的方案比较了免疫荧光染色检测到的Aβ负荷,并分析了脑组织切片中感兴趣的全区域和子区域。结果显示,这两种方法与13个月大的APP / PS1雄性小鼠的脑组织切片之间存在很强的相关性,这些小鼠显示出丰富的Aβ沉积物。
披露声明
作者没有什么可透露的。
致谢
本出版物中报告的研究得到了美国国立卫生研究院国家老龄化研究所的支持,奖励号为R01AG062840(RKS)和R01AG072896(RKS)。内容完全由作者负责,并不一定代表美国国立卫生研究院的官方观点。大约20万美元(100%)的联邦资金支持了这个项目。我们还要感谢杨约书亚博士在稿件编辑方面的协助。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | ThermoFisher Scientific, MA, USA | 339650 | |
| 24-well plates | Fisher Scientific, NH, USA | FB012929 | |
| Amyloid beta 42 human ELISA kit | ThermoFisher Scientific, MA, USA | KHB3441 | |
| Aqueous mounting media | Vector laboratories, CA, USA | H-5501-60 | |
| Bovine serum albumin | Sigmaaldrich, MO, USA | A2153-50G | |
| BZ-X710 Keyence all-in-one fluorescence microscope | Keyence, IL, USA | BZ-X710 | |
| Clear nail poilsh | User preference | NA | |
| Cryostat | Leica Biosystems, IL, USA | Leica CM1860 Cryostat | |
| Formic acid | Sigmaaldrich, MO, USA | F0507-500ML | |
| Glass coverslips | VWR, PA, USA | 48393-081 | |
| GraphPad Prism | GraphPad Software, CA, USA | Version 8 | |
| ImageJ 1.51k | National Institutes of Health, MD, USA | Version 1.53e | |
| Mice | Jackson Laboratories, ME, USA | 034829-JAX | |
| Paraformaldehyde | Sigmaaldrich, MO, USA | P6148-500G | |
| Phenytoin/pentobarbital based anesthetic (Euthasol) | Patterson Veterinary, MA, USA | 07-805-9296 | |
| Phosphate-buffered saline | Fisher Scientific, NH, USA | BP661-50 | |
| Plus (+) microscope slides | Ted Pella, Inc., CA, USA | 260100 | |
| Primary antibody (6E10) | Biolegend, CA, USA | 803013 | |
| Sucrose | Sigmaaldrich, MO, USA | 47289 | |
| Triton X 100 | Sigmaaldrich, MO, USA | T8787-100ML |
参考文献
- Alzheimer's Association. 2021 Alzheimer's disease facts and figures. Alzheimer's & Dementia. 17 (3), 327-406 (2021).
- Langa, K. M., Foster, N. L., Larson, E. B. Mixed dementia: emerging concepts and therapeutic implications. Journal of the American Medical Association. 292 (23), 2901-2908 (2004).
- Gandy, S., DeKosky, S. T. Toward the treatment and prevention of Alzheimer's disease: rational strategies and recent progress. Annual Review of Medicine. 64, 367-383 (2013).
- Bloom, G. S. Amyloid-beta and tau: the trigger and bullet in Alzheimer disease pathogenesis. JAMA Neurology. 71 (4), 505-508 (2014).
- Gremer, L., et al. Fibril structure of amyloid-beta(1-42) by cryo-electron microscopy. Science. 358 (6359), 116-119 (2017).
- Ferrero, J., et al. First-in-human, double-blind, placebo-controlled, single-dose escalation study of aducanumab (BIIB037) in mild-to-moderate Alzheimer's disease. Alzheimer's & Dementia Translational Research & Clinical Interventions. 2 (3), 169-176 (2016).
- Poon, C. H., Wang, Y., Fung, M. L., Zhang, C., Lim, L. W. Rodent models of amyloid-beta feature of Alzheimer's disease: development and potential treatment implications. Aging and Disease. 11 (5), 1235-1259 (2020).
- Christensen, A., Pike, C. J. Staining and quantification of beta-amyloid pathology in transgenic mouse models of Alzheimer's disease. Methods in Molecular Biology. 2144, 221(2020).
- Thakker, D. R., et al. Intracerebroventricular amyloid-beta antibodies reduce cerebral amyloid angiopathy and associated micro-hemorrhages in aged Tg2576 mice. Proceedings of the National Academy of Sciences of the United States of America. 106 (11), 4501-4506 (2009).
- Song, Z., et al. Detecting amyloid-beta accumulation via immunofluorescent staining in a mouse model of Alzheimer's disease. Journal of Visualized Experiments. (170), e62254(2021).
- Sun, J., et al. Hematologic safety of chronic brain-penetrating erythropoietin dosing in APP/PS1 mice. Alzheimer's & DementiaTranslational Research & Clinical Interventions. 5, 627-636 (2019).
- Jankowsky, J. L., et al. Mutant presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo: evidence for augmentation of a 42-specific gamma secretase. Human Molecular Genetics. 13 (2), 159-170 (2004).
- Grant, M. K. O., et al. Human cerebrospinal fluid 6E10-immunoreactive protein species contain amyloid precursor protein fragments. PloS One. 14 (2), 0212815(2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Eichenbaum, K. D., et al. Minimally invasive method for murine brain fixation. Biotechniques. 39 (4), 487-490 (2005).
- Chang, R., et al. Blood-brain barrier penetrating biologic tnf-alpha inhibitor for Alzheimer's disease. Molecular Pharmaceutics. 14 (7), 2340-2349 (2017).
- Pinskiy, V., et al. High-throughput method of whole-brain sectioning, using the tape-transfer technique. PloS One. 10 (7), 0102363(2015).
- Potts, E. M., Coppotelli, G., Ross, J. M. Histological-based stainings using free-floating tissue sections. Journal of Visualized Experiments. (162), e61622(2020).
- van Stralen, K. J., Dekker, F. W., Zoccali, C., Jager, K. J. Measuring agreement, more complicated than it seems. Nephron Clinical Practice. 120 (3), 162-167 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。