Method Article
Fare Beyin Bölümlerinde Amiloid-Beta Yükünün Tam ve Alt Bölgesel Nicelleştirilmesi
Bu Makalede
Özet
Mevcut protokol, Alzheimer hastalığının APP / PS1 transgenik fare modelinde amiloid-beta yükünü ölçmek için sagital fare beyin bölümlerinin tam bölge veya alt bölge analizini gerçekleştirme prosedürünü açıklar ve karşılaştırır.
Özet
Amiloid-beta (Aβ) plaklarının hücre dışı birikimi, Alzheimer hastalığının (AD) başlıca patolojik özelliklerinden biridir ve AD için FDA onaylı tek hastalık modifiye edici tedavinin hedefidir. Buna göre, amiloid öncü proteinini aşırı eksprese eden ve böylece serebral Aβ plaklarını biriktiren transgenik fare modellerinin kullanılması, farelerde insan AD'sini modellemek için yaygın olarak kullanılmaktadır. Bu nedenle, enzime bağlı immünosorbent testi (ELISA) ve immünoboyama dahil olmak üzere immünoassaylar, AD transgenik farelerden türetilen beyin dokularındaki Aβ yükünü yaygın olarak ölçer. Aβ tespiti ve nicelleştirme yöntemleri iyi kurulmuş ve belgelenmiş olmasına rağmen, beyin dokusunda seçilen ilgi bölgesinin büyüklüğünün immün boyama sonrası Aβ yük ölçümleri üzerindeki etkisi bildirilmemiştir. Bu nedenle, mevcut protokol, bir görüntü analiz yazılımı kullanarak ilgilenilen tam ve alt bölgelerdeki Aβ yük ölçümlerini karşılaştırmayı amaçlamıştır. Beyin dokusu hazırlama, serbest yüzen beyin bölümü immünoboyama, görüntüleme ve Aβ yükünün tam ve alt ilgi alanlarına karşı nicelleştirilmesinde yer alan adımlar, 13 aylık APP / PS1 çift transgenik erkek farelerden türetilen beyin bölümleri kullanılarak açıklanmaktadır. Mevcut protokol ve sonuçlar, ilgi alanının büyüklüğünün Aβ-pozitif alan nicelemesi üzerindeki etkisi hakkında değerli bilgiler sağlar ve yaygın Aβ birikimi gösteren 13 aylık erkek APP / PS1 farelerinden türetilen beyin bölümleri için ilgi analizlerinin tam ve alt bölgeleri kullanılarak elde edilen Aβ-pozitif alan arasında güçlü bir korelasyon olduğunu göstermektedir.
Giriş
Amerika Birleşik Devletleri'nde altıncı önde gelen ölüm nedeni olan Alzheimer hastalığı (AD), AD ile yaşayan tahmini 6,2 milyon Amerikalı ile halk sağlığı tehdidi olmaya devam etmektedir. Bunun 2060 yılına kadar 13,8 milyona ulaşması bekleniyor1. Bugüne kadar, kolinesteraz inhibitörleri ve memantin gibi ilaçlarla semptomatik yönetim tedavinin birincil seyridir2. AH, amiloid-beta (Aβ) plakların hücre dışı birikimi ve nörofibriler yumaklar şeklinde hücre içi hiperfosforile tau birikimi gibi nöropatolojik bulgularla karakterizedir 3,4. Amiloid öncü proteininin (APP) beta ve gama sekretaz yoluyla endoproteolitik bölünmesiyle oluşan Aβ, oligomerler ve fibriller oluşturmak için toplanır ve nörotoksik etkilere yol açar5. Aβ'nın 1980'lerden beri birincil patolojik bir role hizmet ettiği varsayılmıştır ve AD6 için FDA onaylı tek hastalık modifiye edici tedavinin terapötik hedefidir. Sonuç olarak, genlerdeki mutasyonları barındıran ve sağlam serebral Aβ birikimi ile sonuçlanan transgenik AD fare modelleri, 1990'ların başından beri klinik öncesi AD araştırmaları için yaygın olarak kullanılmaktadır7.
Bu AD transgenik fare beyinlerinde Aβ türlerinin tespiti genellikle iki immünoassay kullanılarak yapılır: enzime bağlı immünosorbent testi (ELISA) ve immünoboyama. Eski tahlil, farklı Aβ türlerinin kantitatif olarak belirlenmesini sağlar ve doku kesitleme, immün boyama, görüntüleme ve nicelleştirme8 dahil olmak üzere birkaç sıralı doku işleme ve görüntüleme adımı gerektiren immünoboyamaya kıyasla daha az zaman alıcıdır. Ayrıca, immün boyama sonrası elde edilen sonuçlar yarı kantitatif8'dir. Bununla birlikte, Aβ'yı mekansal olarak lokalize etme yeteneği, immün boyamayı beyin dokularında Aβ tespiti için çekici bir yaklaşım haline getirir8.
Aβ immün boyama kullanılırken, farklı araştırma grupları tarafından birkaç farklı niceleme paradigması kullanılmıştır. Örneğin, bazı araştırma grupları tüm ilgi bölgesindeki (korteks veya hipokampus) Aβ yükünü ölçerken, diğerleri Aβ yükünü belirli bir ilgi alanı alt bölgesinde (korteksin veya hipokampusun bir kısmı) ölçer9,10,11. Aβ tespiti ve nicelleştirme yöntemleri iyi kurulmuş ve belgelenmiştir, ancak ilgili bölgenin büyüklüğünün immün boyama sonrası Aβ yük ölçümleri üzerindeki etkisi bildirilmemiştir. Bu nedenle, mevcut protokol, bir görüntü analiz yazılımı olan ImageJ'yi kullanarak Aβ yük ölçümlerini ilgilenilen tam ve alt bölgeler arasında karşılaştırmayı amaçladı.
Mevcut çalışma, AD12'nin erken başlangıcını modellemek için kimerik fare / insan APP ve mutant bir presenilin 1'i ifade eden 13 aylık APP / PS1 çift transgenik erkek fareleri kullandı. Aβ birikintileri 6-7 aylıkken gelişmeye başlar ve bu farelerin korteksinde ve hipokampüsünde12 aylıkken 9-10 aylıkken bol miktarda Aβ birikimi gözlenir. Transgenik amiloid peptitler ve holoprotein, 6E10-immün boyama13 ile tespit edilebilir ve bu da onu mevcut protokol için arzu edilen bir hayvan modeli haline getirir. Burada ele alınan prosedür, beyin dokusunun hazırlanmasını, serbest yüzen bölümlerin immün boyamasını, görüntülemeyi ve Aβ yükünün ilgilenilen alt bölgelere karşı tam olarak ölçülmesini içerir. Analiz, tam ve alt bölgesel niceleme arasında güçlü bir korelasyon olduğunu göstererek, bol miktarda Aβ birikintisi gösteren 13 aylık APP / PS1 erkek farelerden türetilen beyin dokusu bölümlerinde bu iki yöntem arasında sağlam bir anlaşma olduğunu göstermektedir.
Protokol
Tüm hayvan deneyleri, Kaliforniya Üniversitesi, Irvine, Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanan protokoller kapsamında Üniversite Laboratuvarı Hayvan Kaynakları ile uyumlu olarak gerçekleştirilmiştir. Deneyler erkek B6C3-Tg(APPswe, PSEN1dE9)85Dbo/Mmjax (APP/PS1) farelerle (13 aylık, n=35) gerçekleştirildi. Fareler ticari kaynaklardan elde edilmiştir (bakınız Malzeme Tablosu).
1. Beyin dokusu hazırlığı
- Onaylanmış hayvan protokollerini takiben intraperitoneal olarak enjekte edilen bir fenitoin / pentobarbital bazlı anestezinin (150 mg / kg) ölümcül bir dozunu kullanarak fareleri anestezi altına alın (bakınız Malzeme Tablosu). Beyin vaskülatürünü temizlemek için buz gibi soğuk fosfat tamponlu salin (1x PBS) ile 5 dakika boyunca 5 mL / dak hızında kardiyak perfüzyon yapın14.
- Daha önce yayınlanan rapor 15'i takiben beyin dokusunu toplayın, sol ve sağ beyin yarımküresine ayırın ve her farenin sağ yarım-beynini, 4 ° C'de 72 saat boyunca 1x PBS'de 5 mL taze hazırlanmış% 4 paraformaldehit (PFA) çözeltisi içeren15 mL konik bir tüpe yerleştirin.
NOT: Beyinler, çalışılan antijene bağlı olarak 24-72 saat arasında daldırma ile sabitlenebilir. Sol hemi-beyin, beyincik olmadan, sıvı azotta dondurulabilir ve daha sonra -80 ° C'de saklanabilir, ardından ELISA ve biyokimyasal Aβ tespiti16 gibi biyokimyasal testler için işlenebilir.
DİKKAT: PFA olası bir kanserojendir ve PFA ile cilt teması alerjik cilt semptomlarına yol açabilir. Nitril veya bütil eldivenler, maskeler ve göz koruması kullanın ve kimyasal bir duman başlığı altında hazırlayın. - % 4 PFA'da inkübasyondan sonra, hemi-beyinleri, beyin dokusu konik tüpün dibine batana kadar her biri 4 ° C'de, 24 saat boyunca 1x PBS'de hazırlanan% 10,% 20 ve% 30 sakkaroz çözeltisinin 5 mL'sinde sırayla inkübe edin.
- % 30 sakkaroz çözeltisinde inkübasyondan sonra, hemi beyni çıkarın, fazla sakkaroz çözeltisini çıkarmak için beyni bir filtre kağıdına hafifçe sürün ve sabit hemi beyni toz kuru buzda 30 dakika boyunca dondurun. Dondurulmuş hemi-beyni, kriyoseksiyona kadar -80 ° C'de iyi etiketlenmiş alüminyum folyolarda saklayın.
NOT: Mevcut protokolde, hemi-beyinler 6-8 ay boyunca -80 ° C'de saklandı. - Dondurulmuş hemi-beyni bir kriyostat kullanarak 20 μm kalınlığında bölümlere ayırın (bkz.
NOT: Mevcut protokol için, hemi-beyinler sagital bölümlere ayrılmıştır ve gerekirse koronal bölümler de hazırlanabilir17. Adım 2, sabit ve kriyokorumalı beyin dokusu örneklerinde Aβ immünofloresan boyama içindir.
2. İmmünofloresan
- Sagital beyin dokusu bölümlerini (adım 1.5) 24 kuyucuklu bir plakaya yerleştirin (kuyucuk başına 300 μL başına altı adede kadar fare beyin bölümü). Plakayı hafifçe dönen bir çalkalayıcıya yerleştirerek oda sıcaklığında (23 ° C) üç kez 1x PBS ile 5 dakika yıkayın.
- Beyin dokusu kesitlerini oda sıcaklığında 10 dakika boyunca dH20'da% 70 formik asit ile inkübe edin.
DİKKAT: Formik asit aşındırıcıdır, bu nedenle cilt ve göz temasından kaçının. - Beyin dokusu bölümlerini oda sıcaklığında üç kez dH20 ile 5 dakika yıkayın.
- Spesifik olmayan bağlanmayı, oda sıcaklığında 1 saat boyunca oda sıcaklığında %0,5 sığır serum albümini (BSA) ve %0,3 TritonX 100 (bakınız Malzeme Tablosu) ile bloke edin.
- Beyin dokusu kesitlerini, 24 saat boyunca 4 °C'de %0,3 TritonX 100 içeren 1x PBS'de seyreltilmiş (1:1000) florofor etiketli birincil antikor (6E10, bakınız Malzeme Tablosu) ile inkübe edin.
NOT: Birincil antikor florofor konjuge olduğundan, plakanın bu adımdan itibaren örtülmesi veya florofor etkinliğini korumak için tüm çalışmaların karanlık bir odada yapılması gerekir. - Beyin dokusu bölümlerini oda sıcaklığında üç kez 1x PBS ile 10 dakika boyunca yıkayın.
- Beyin dokusu bölümlerini, kalan tuzları çıkarmak için dH20 ile kısa bir yıkamadan sonra, iyi etiketlenmiş pozitif yüklü cam slaytlara (bkz. Malzeme Tablosu) monte edin (slayttaki etiket bilgileri tercihe dayanmaktadır). Slaytların karanlıkta kurumasını bekleyin.
NOT: Beyin bölümleri, veri miktarını etkileyen kıvrımları ve yırtılmaları önlemek için dikkatlice monte edilmelidir. İlgilenilen bölgede bulunan ve veri ölçümünü engelleyebilecek yırtılmalar ve / veya kıvrımlar durumunda, yeniden boyama ve yeniden montaj önerilir. - Beyin dokusu bölümlerini sulu bir montaj ortamıyla monte edin (bakınız Malzeme Tablosu) ve cam kapak kaymasını dokunun üzerine yerleştirin. Kapak kapağının uçlarını şeffaf oje ile kapatın ve slaytları görüntülemeye kadar 4 ° C'de bir slayt kutusunda saklayın.
NOT: Mevcut protokolde, slaytlar boyandıktan sonraki 1 ay içinde görüntülenmiştir.
3. Görüntüleme
- 6E10 boyalı beyin bölümlerini, tüm beyin dokusu bölümünü tek bir görüntüde yakalamak için 2x hedefi olan ve uygun filtreyle (bu çalışmada GFP) donatılmış bir floresan (epifloresan veya konfokal) mikroskop kullanarak (bakınız Malzeme Tablosu) görüntüleyin.
NOT: Görüntüleme ayarları farklı slaytlar arasında tutarlı olmalıdır. - Yakalanan görüntüleri bir TIFF dosyası olarak veya gerektiği gibi kaydedin ve 6E10 ölçümü için aşağıdaki adım 4.2'de açıklandığı gibi görüntü analiz yazılımında (bkz. Malzeme Tablosu) açın.
NOT: Görüntü analiz yazılımı ImageJ'de ölçmek için görüntüyü yakalamadan önce bir ölçek çubuğu ekleyin.
4. Tam ilgi alanı analizi
NOT: Bu çalışmanın ilgi çekici iki bölgesi hipokampus ve izo-kortekstir. Tam ilgi alanı analizi, tüm izo-korteksin (ileriye dönük korteks olarak adlandırılır) veya görüntülenen beyin dokusu bölümündeki hipokampüsün analizini temsil eder.
- Görüntü analiz yazılımını indirin (bkz. Malzeme Tablosu) ve yüklendikten sonra yazılımı başlatın.
- Yazılım çalıştıktan sonra, Dosya | Açık | Analiz edilecek görüntüyü seçin .
- | Analiz Et'e tıklayın Ölçeği ayarlayın| Ölçeği kaldırmak için tıklatın. Yazılım araç çubuğundan Düz aracı seçin ve ölçek çubuğunun uzunluğu boyunca düz bir çizgi çizin. | Analiz Et'e tıklayın Ölçün. Ölçek çubuğunun uzunluğunu veya uzaklığını piksel cinsinden not alın. | Analiz Et'e tıklayın Ölçeği ayarlayın.
- Açılır pencerede, mesafeyi piksel cinsinden, ölçek çubuğunun bilinen mesafesini (bu durumda μm cinsinden) ve uzunluk birimini μm olarak girin. Birden fazla görüntü işleniyorsa yeni ölçek ayarını aşağıdaki tüm görüntülere uygulamak için Genel'i işaretleyin. Ayarları uygulamak için Tamam'ı tıklatın.
NOT: Daha fazla analizden önce görüntüye doğru ölçeğin uygulanıp uygulanmadığını kontrol etmeniz her zaman önerilir.
- Açılır pencerede, mesafeyi piksel cinsinden, ölçek çubuğunun bilinen mesafesini (bu durumda μm cinsinden) ve uzunluk birimini μm olarak girin. Birden fazla görüntü işleniyorsa yeni ölçek ayarını aşağıdaki tüm görüntülere uygulamak için Genel'i işaretleyin. Ayarları uygulamak için Tamam'ı tıklatın.
- İstenen ölçümü bölümün alanına ayarlamak için Analiz | Ölçümleri ayarlama | Alan ve Etiket Görüntüle kutularını seçin. Analiz edilen görüntünün Yönlendir altında seçili olup olmadığını kontrol edin.
- Hipokampus veya korteks görselleştirme kolaylığı için Resim | | ayarlama Parlaklık/Kontrast. İlgilenilen beyin bölgeleri tanımlanana kadar doku netliğini artırmak için Maksimum kaydırma çubuğunu kademeli olarak sola sürükleyin.
NOT: Analiz sırasında yanlış ölçümleri önlemek için bu ayarı uygulamayın, bunun yerine bir sonraki adıma geçin. - Hipokampus bölgesini özetlemek için Poligon seçimi veya Serbest el seçim aracını kullanın. Orijinal parlaklığa geri dönmek için hipokampus ana hatlarıyla belirtildikten sonra Parlaklık/Kontrast ayarlarının Sıfırla seçeneğine tıklayın.
NOT: Adımlar kortikal bölge için ayrı ayrı tekrarlanmalıdır. - Seçilen bölgenin toplam doku alanını ölçmek için, Düzenle | Dışarısı açık. Seçilen bölge ekrandaki tek görüntü olduğunda, Analiz Et'e tıklayın | Bir açılır pencerede analiz edilen toplam doku alanını elde etmek için ölçün. Verileri daha sonra kullanmak üzere bir Excel dosyasına kaydedin.
- 6E10 pozitif alanı ölçmek için Görüntü | | ayarlama Renk eşiği. Eşik yöntemi altında önceden hazırlanmış bir filtre genellikle en güçlü sinyalleri kırmızı renkte vurgulayarak istenen sonuçları sağlar.
NOT: En uygun eşik seçimi, görüntünün arka planına ve boyama yoğunluğuna bağlı olacaktır. Arka planı değil, lekeyi alan bir eşik ayarı seçin. - Uygun eşiği seçtikten sonra Koyu arka plan seçeneğini işaretleyin. Bu, siyah bir arka plan üzerindeki Aβ lekelerini (ilgi lekesi) vurgulayacaktır. | Seç'e tıklayın Orijinal | Beyaz bir arka plan üzerinde karanlık sinyaller (Aβ birikintileri) vererek seçin. | Analiz Et'e tıklayın Parçacıkları analiz edin ve açılır pencere oluşturulduğunda Tamam'ı tıklatın.
- Yazılım tarafından oluşturulan özet çıktıyı Düzenle'ye tıklayarak kopyalayın | Kopyala. Daha önce başlatılan Excel dosyasına ilgili etiketlerle yapıştırın. Bu, seçilen ilgi alanlarındaki (hipokampus veya korteks) 6E10-pozitif alandır.
NOT: Excel'de, toplam 6E10 pozitif alan (adım 4.10) ve toplam doku alanı (adım 4.7) için bir sütun olacaktır. - 6E10-pozitif alanı (%) aşağıdaki gibi hesaplayın16: (Toplam 6E10-pozitif alan/Analiz edilen toplam doku alanı) x 100.
5. İlgi alanı alt bölgesi analizi
NOT: İlgilenilen alt bölge analizi, korteksin veya hipokampusun bir kısmının görüntüdeki beyin dokusu bölümündeki analizini temsil eder.
- Görüntü analiz yazılımını indirin ve yüklendikten sonra yazılımı başlatın.
- Yazılım çalıştıktan sonra, Dosya | Açık | Analiz edilecek görüntüyü seçin .
- | Analiz Et'e tıklayın Ölçeği ayarlayın| Ölçeği kaldırmak için tıklatın. Yazılım araç çubuğundan Düz aracı seçin ve ölçek çubuğunun uzunluğu boyunca düz bir çizgi çizin. | Analiz Et'e tıklayın Ölçün. Ölçek çubuğunun uzunluğunu veya uzaklığını piksel cinsinden not alın. | Analiz Et'e tıklayın Ölçeği ayarlayın.
- Açılır pencerede, mesafeyi piksel cinsinden, ölçek çubuğunun bilinen mesafesini (bu durumda μm cinsinden) girin ve uzunluk birimini μm olarak girin. Birden fazla görüntü işleniyorsa yeni ölçek ayarını aşağıdaki tüm görüntülere uygulamak için Genel'i işaretleyin. Ayarları uygulamak için Tamam'ı tıklatın.
NOT: Daha fazla analizden önce görüntüye doğru ölçeğin uygulanıp uygulanmadığını kontrol etmeniz her zaman önerilir.
- Açılır pencerede, mesafeyi piksel cinsinden, ölçek çubuğunun bilinen mesafesini (bu durumda μm cinsinden) girin ve uzunluk birimini μm olarak girin. Birden fazla görüntü işleniyorsa yeni ölçek ayarını aşağıdaki tüm görüntülere uygulamak için Genel'i işaretleyin. Ayarları uygulamak için Tamam'ı tıklatın.
- İstenilen ölçümü bölümün alanına ayarlamak için Analiz | Ölçümleri ayarlama | Alan ve Etiket Görüntüle kutularını seçin. Analiz edilen görüntünün Yönlendir altında seçili olup olmadığını kontrol edin.
- Görüntü çok loşsa ve beyin bölgeleri (örneğin, bu durumda hipokampus veya korteks) kolayca tanımlanamıyorsa parlaklığı ve kontrastı ayarlayın. Yazılım araç çubuğunu kullanın ve Image | | ayarlama Parlaklık/Kontrast öğesine dokunun görünürlüğünü artırmak için Maksimum kaydırıcılarını gerektiği gibi sola sürükleyin.
NOT: Analiz sırasında yanlış ölçümleri önlemek için bu ayarı uygulamayın, bunun yerine bir sonraki adıma geçin. - Dikdörtgen aracını kullanarak, korteks veya hipokampustaki ilgi alanını seçin. Araç çubuğunu kullanın ve | Düzenle'ye tıklayın Seçim | Yükseklik ve genişliği önceden tanımlanmış bir değere değiştirerek belirtin. Kutuyu ayarlayın, böylece tamamen doku ile kaplanır. Orijinal parlaklığa geri dönmek için parlaklığı/kontrastı sıfırlayın.
NOT: İlgilenilen bölgeleri seçmek için kullanılan kutunun boyutu tüm görüntüler için tutarlı olmalıdır. Bu analiz için, kutu boyutu 300 piksel x 300 piksel (1177 μm x 1177 μm'ye eşdeğer) veya 400 piksel x 200 piksel (1569 μm x 784 μm'ye eşdeğer) idi. - Kutuyu sağ tıklayıp Çoğalt'a tıklayarak seçilen ilgi alanını çoğaltın. Seçilen bölgeyi içeren yeni bir pencere açılacaktır. Çoğaltılan görüntüyü, bulunduğu bölgeyi (ör. korteks veya hipokampus) görüntülemek için yeniden adlandırın.
- Araç çubuğunu kullanarak ve Resim | Tip | Plakları en iyi şekilde analiz etmek için çoğaltılan RGB görüntüsünü 8 bit'e dönüştürmek için 8-Bit. Düzenle'ye tıklayarak resmi ters | Ters çevir.
- 6E10 pozitif alanı ölçmek için Görüntü | | ayarlama Eşik. Eşik yöntemi altında önceden tanımlanmış bir filtre genellikle en güçlü sinyalleri kırmızı renkle vurgulayarak istenen sonuçları sağlar.
NOT: En uygun eşik seçimi, görüntünün arka planına ve boyama yoğunluğuna bağlı olacaktır. Arka planı değil, lekeyi alan bir eşik ayarı seçin. - Uygun eşiği seçtikten sonra Uygula'yı seçin.
- 6E10 pozitif alanını analiz etmek için araç çubuğunu kullanın ve Analiz Et | Parçacıkları analiz ederek "Sonuçları Özetle" nin kontrol edildiğinden emin olun.
- Özet çıktısını, Düzenle'ye tıklayarak yazılım tarafından oluşturulan %Area ile kopyalayın | Kopyala. Daha önce başlatılan Excel dosyasına ilgili etiketlerle yapıştırın.
- Dokudaki farklı bölgeler için 5.3-5.12 arasındaki adımları yineleyin. İlgilenilen bölgeyi özetlemek için her kutunun yerleşiminin her görüntü arasında tutarlı olduğundan emin olun.
NOT: Döndürme aracı, doku eğriliği nedeniyle Dikdörtgen takım kutusu boyutları belirtilen bölgeye sığamazsa kullanılabilir. - Dikdörtgeni döndürmek için araç çubuğunu kullanın ve Düzenle'ye tıklayın | Seçim | Döndürme derecesini gerektiği gibi döndürün ve ayarlayın. Görüntüyü adım 5.7'de belirtildiği gibi çoğaltın ve araç çubuğunu kullanarak ve Düzenle'ye tıklayarak dışını temizleyin | Belirtilen dikdörtgenin dışındaki 6E10 lekelerini temizleyen dışarıyı temizleyin. Yukarıda açıklanan adım 5.8 ile devam edin.
Sonuçlar
Burada, hipokampustaki 6E10-pozitif alanı ve fare beyin dokularının korteksi ölçmek için iki farklı yöntem karşılaştırılmıştır. İki yöntem, ilgilenilen alanın tam bölgesi ve alt bölgesi analizleridir (Şekil 1). Tam ilgi alanı analizi, adından da anlaşılacağı gibi, 6E10-pozitif alanı belirlemek için tüm ilgi bölgesini (bu durumda, izo-korteks veya hipokampus) özetlemeyi içerir (Şekil 1A, B). Faiz alt bölgesi analizi, 6E10-pozitif alanı belirlemek için ilgili bölge içinde önceden tanımlanmış bir bölgenin seçilmesini içerir (Şekil 1C, D). İki yöntem için aşamalı ImageJ protokolü Şekil 2, Şekil 3 ve Şekil 4'te gösterilmiştir.
Bu çalışmada üç okuyucu kullanılmıştır; iki bağımsız okuyucu ilgi alanı alt bölgesi analizini gerçekleştirdi ve üçüncü okuyucu tam ilgi bölgesi analizini gerçekleştirdi. Şekil 5A,B'de görüldüğü gibi, ilgi alanı alt bölgesi analizini yapan iki okuyucu tarafından bildirilen 6E10-pozitif alan arasında güçlü bir anlamlı pozitif korelasyon (p < 0.0001) vardı (Pearson korelasyon katsayısı r = korteks için 0.97 ve hipokampus için r = 0.96). İki okuyucu tarafından faiz alt bölgesi analizi için bildirilen 6E10-pozitif alanların ortalaması alındı ve ortalama ilgi alanı 6E10-pozitif alan alt bölgesi, her iki korteks için tam ilgi bölgesi analizi kullanılarak elde edilen 6E10-pozitif alan ile güçlü bir anlamlı pozitif korelasyon (p < 0.0001) paylaştı (Pearson korelasyon katsayısı r = 0.96; Şekil 5C) ve hipokampus (Pearson korelasyon katsayısı r = 0.95; Şekil 5D). İlgilenilen tam bölge ve alt bölge analizleri ile elde edilen ortalama kortikal ve hipokampal-6E10 pozitif alan, iki yöntem arasındaki anlaşmayı doğrulayan anlamlı bir fark olmaksızın karşılaştırılabilir (Şekil 5E). Ayrıca, çözünmeyen Aβ1-42, farelerin bir alt kümesindeki tüm beyin homojenatlarında ölçülmüştür ve tam ilgi alanı analizi ile belirlenen kortikal (Şekil 5F) ve hipokampal (Şekil 5G) 6E10-pozitif alan<, ELISA kullanılarak çözünmeyen Aβ1-42 yükü ile anlamlı olarak korelasyon göstermiştir (bkz.
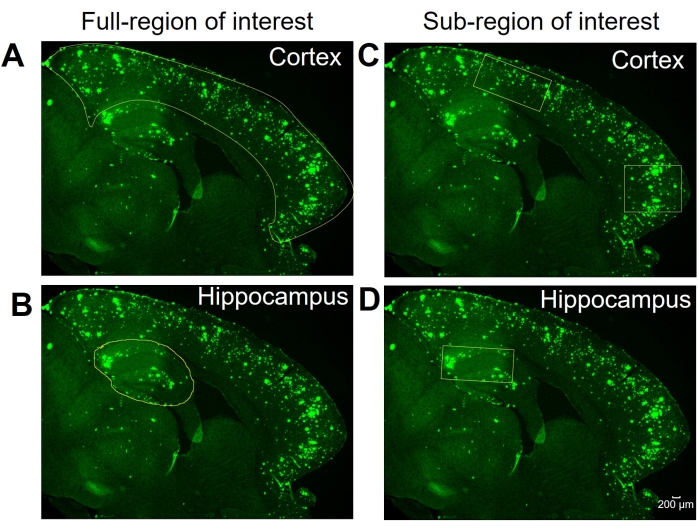
Şekil 1: İlgi alanı seçiminin tam ve alt bölgeleri. Tam izokorteksi (korteks) ve hipokampüsü gösteren temsili görüntüler, sırasıyla (A) ve (B) 'deki tam ilgi alanı analizi için özetlenmiştir. Temsili görüntüler, sırasıyla (C) ve (D) 'deki ilgi alanı analizi alt bölgesi için korteks ve hipokampusun alt bölgelerinin seçimini göstermektedir. Ölçek çubuğu = 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
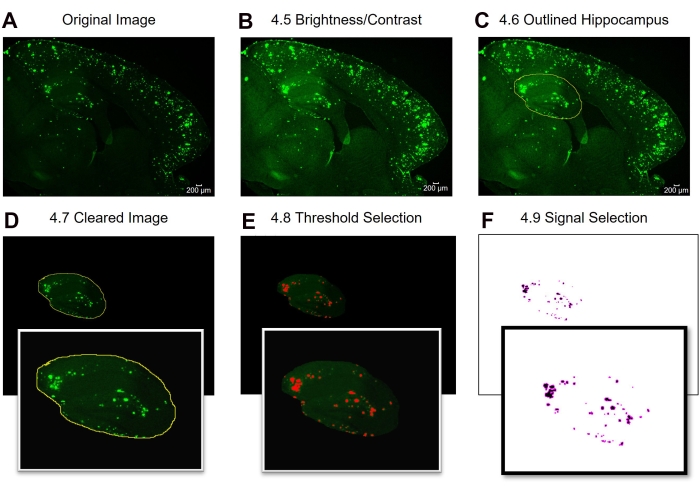
Şekil 2: İlgilenilen tam bölge 6E10-pozitif alan ölçümü için protokol. Orijinal görüntüyü (A), parlaklık/kontrast ayarından sonraki görüntüyü (B), ilgi alanı seçimini (C), temizleme (D), eşik ayarını (E) ve analize hazır son görüntüyü (F) gösteren görüntü analizi adımları. Şekildeki sayılar protokoldeki adım numaralarını belirtir. Ölçek çubuğu = 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
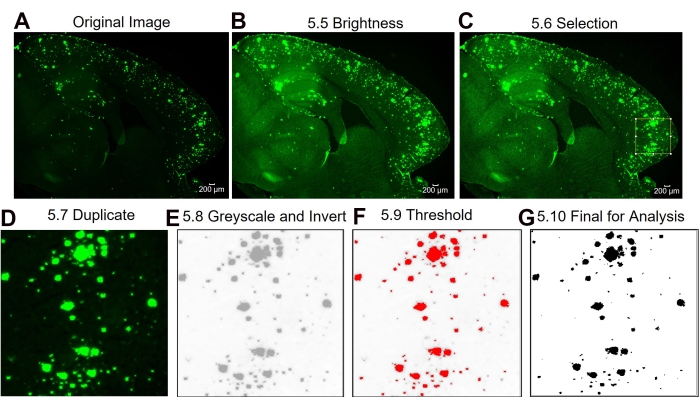
Şekil 3: İlgilenilen alt bölge 6E10-pozitif alan nicelemesi için protokol. Orijinal görüntüyü (A), parlaklık/kontrast ayarından sonraki görüntüyü (B), ilgi alanının seçimini (C), ilgilenilen bölgenin görüntüsünün çoğaltılmasını (D), görüntüyü 8 Bit olarak değiştirme ve görüntüyü ters çevirme (E), eşik ayarını (F) ve analize hazır son görüntüyü (G) gösteren görüntü analizi adımları. Şekildeki sayılar protokoldeki adım numaralarını belirtir. Ölçek çubuğu = 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
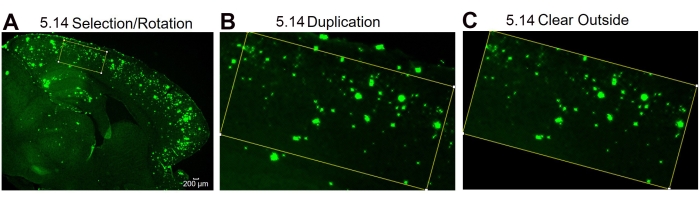
Şekil 4: İlgi alanı rotasyonu protokolü. İlgi alanının seçimini ve seçim kutusunun doku eğriliğine (A) uyacak şekilde döndürülmesini, çoğaltmadan sonra ilgilenilen bölgenin görüntüsünü (B) ve dış (ilgi alanı olmayan) alanı (C) temizledikten sonraki görüntüyü gösteren görüntü analizi adımları. Şekildeki sayılar protokoldeki adım numarasını belirtir. Ölçek çubuğu = 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
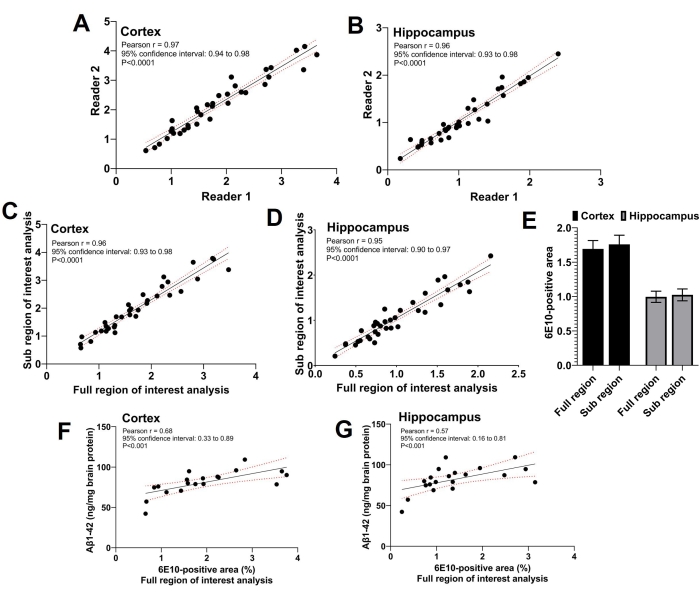
Şekil 5: İlgi analizlerinin tam ve alt bölgeleri arasındaki korelasyon. Dağılım grafikleri, korteks (A) ve hipokampus (B) için ilgi alanı alt bölgesi analizi yapan iki bağımsız okuyucu tarafından 6E10-pozitif alan arasındaki korelasyonu göstermektedir. İlgi alanı analizinin alt bölgesi ile hem korteks (C) hem de hipokampus (D) için tam ilgi bölgesi analizinden kaynaklanan 6E10-pozitif alan arasında güçlü bir pozitif korelasyon gözlenmiştir. Ortalama 6E10-pozitif alanda, korteks ve hipokampustaki (E) ilgi alanının tamamı ve ilgi alanı alt bölgesi ile istatistiksel olarak anlamlı bir fark yoktur. ELISA kullanılarak tüm beyin homojenatının çözünmeyen Aβ1-42 ölçümleri ile hem korteks (F) hem de hipokampus (G) için tam ilgi alanı analizi arasında anlamlı bir korelasyon gözlenmiştir. Veriler, Pearson korelasyon katsayısı, r, in (A-D) ve (F-G) kullanılarak ve bir grafik ve istatistik yazılımı kullanılarak (E) 'de iki yönlü tekrarlanan ölçümler ANOVA kullanılarak analiz edilmiştir. Veriler, (E) cinsinden n = 35 farenin ortalamasının (SEM) ortalama ± standart hatası olarak sunulmuş ve iki kuyruklu p < 0.05 istatistiksel olarak anlamlı kabul edilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan protokol, sagital kesitleme için hemi-beyin hazırlığı, serbest yüzen bölümlerde 6E10 antikoru kullanılarak Aβ birikintilerinin immünofloresan boyanması, Aβ lekeli beyin bölümlerinin görüntülenmesi ve ardından korteksteki Aβ birikintilerinin ve fare beyin dokusunun hipokampusunun bir görüntü analiz yazılımı kullanılarak nicelleştirilmesi prosedürünü özetlemektedir. Beyin dokusu bölüm 8,10'da Aβ yükünü ölçmek için yayınlanmış protokoller olsa da, bu protokol, istenilebileceği zaman, korteks ve hipokampustaki ilgi çekici bir alt bölgedeki Aβ yüküne kıyasla, tüm izo-kortekste (korteks olarak adlandırılır) ve hipokampusta Aβ yükünün ölçülmesinde yer alan adımları açıklar. İlgi analizlerinin tam ve alt bölgeleri arasındaki korelasyon da sağlanmaktadır.
Protokolde birkaç kritik adım vardır. İlk olarak, tarif edilen protokol, serbest yüzen immün boyamaya maruz kalan 20 μm kalınlığındaki beyin dokusu bölümleri içindir ve bu da doku bölümü18'de optimal antikor penetrasyonu ile sonuçlanır. Serbest yüzen teknik, immünofloresan boyama sırasında doku kesitlerinin farklı çözeltiler arasında manuel olarak aktarılmasını ve prosedür boyunca doku kesitlerinin dikkatli bir şekilde kullanılmasını gerektirebilir. Bu, özellikle doku kesitleri mevcut protokolde antijen alımı için% 70 formik asit çözeltisine daldırıldığında çok önemlidir ve ince kesitler için doku kırılganlığını arttırır. Tanımlanan protokole alternatif yaklaşımlar, daha kalın doku kesitlerinin (örneğin, 30-40 μm) kullanılmasını veya immünofloresan boyamadan önce pozitif yüklü slaytlara doğrudan monte edilen doku kesitlerinin kullanılmasını içerir. İkincisi, burada açıklanan protokol floresan etiketli bir 6E10 antikoru kullanır. Floresan etiketli 6E10 antikorunun kullanılmasının yanı sıra, floresan olmayan 6E10 antikorları (örneğin, yaban turpu peroksidaz konjuge 6E10 antikoru) beyin dokusu bölümlerinde Aβ yükünü tespit etmek için de kullanılabilir ve mevcut protokol, daha önce açıklandığı gibi beyin dokusu bölümlerindeki Aβ-pozitif immünokimyasal lekeleri ölçmek için uyarlanabilir8 . Üçüncüsü, Aβ yük ölçümü için sonuçların doğruluğu, doku arka planına ve sinyal yoğunluğuna bağlı olan analiz yazılımındaki uygun eşik seçimine bağlı olacaktır. Eşik seçimi son kullanıcı tarafından yapılmalıdır, böylece niceleme için sadece Aβ-pozitif lekeler seçilir. Eşik ayarının doğruluğunu sağlamak amacıyla tüm görüntülere uygulanabilecek belirli eşiği optimize etmek için son kullanıcı müdahalesi gerekir. Dördüncüsü, ilgi alanı alt bölgesi analizi, doku bölümünde küçük bir ilgi alanı seçmeyi gerektirdiğinden, bu analiz için iki bağımsız okuyucu kullanılmıştır. Veri toplama sırasında bağımsızlığı ve körlüğü korumak için, tüm görüntüler sayı kodludur; görüntü analizi dizisi okuyucular arasında rastgele hale getirildi, böylece farklı okuyucular herhangi bir zamanda farklı görüntüleri analiz etti ve veriler her haftanın sonunda gönderildi. İlgi alanı analizinin alt bölgesinde ilgi alanı seçiminde okuyucular arası değişkenlik olasılığının artması nedeniyle, okuyucular, veri toplamaya başlamadan önce korteks ve hipokampustaki bölge seçimini optimize etmek için birkaç örnek görüntü kullanılarak eğitilmiştir. Bu eğitim, okuyucular arası değişkenliği azaltmak için çok önemlidir ve görülebileceği gibi (Şekil 5A, B), her iki okuyucu tarafından bildirilen 6E10-pozitif alan, mevcut çalışmada güçlü bir göreceli anlaşma göstermektedir.
Mevcut protokol ve sonuçlar, ilgi alanı büyüklüğünün Aβ-pozitif alan nicelemesi üzerindeki etkisi hakkında değerli bilgiler sağlamaktadır. Daha büyük bir ilgi alanının, dokuyu daha küçük bir ilgi alanından daha fazla temsil etmesi beklenir. Bu nedenle, dokulardaki Aβ yükünü doğru bir şekilde ölçmek için daha büyük bir dokudan numune alınması arzu edilir. Bununla birlikte, doku içinde homojen Aβ yük dağılımı durumunda, daha küçük bir örnekleme bölgesi genellikle analiz edilen daha büyük dokunun iyi bir temsili olarak kabul edilir. Mevcut çalışma sonuçları bunu doğrulamaktadır ve tüm korteks ve hipokampustaki Aβ yükü, korteks ve hipokampusun seçilmiş bir alt bölgesindeki Aβ yükünün güçlü bir korelasyonuydu (Şekil 5C, D). İlgi analizlerinin tam ve alt bölgeleri arasındaki anlaşmayı daha da doğrulamak için, korteks ve hipokampustaki ortalama 6E10-pozitif alan karşılaştırıldı ve iki yöntem arasında bir fark bulunamadı (Şekil 5E). Bu, bu yöntemlerden herhangi birinin (tam veya alt bölge analizi) karşılaştırılabilir Aβ yük ölçümleri sağladığını doğrulamaktadır.
Mevcut protokolün bazı sınırlamaları vardır. İki yöntem (tam bölgeye karşı alt bölge analizi) her zaman birbirinin yerine kullanılamayabilir. Tam veya alt bölge analizini kullanma seçimi, AD fare modelinin yaşı, cinsiyeti ve suşundan etkilenen doku içindeki Aβ'nın bölgesel dağılımına bağlı olacaktır. 13 ayda, Aβ yükü APP / PS1 farelerinin korteksi ve hipokampüsü boyunca dağıtılır. Bununla birlikte, 6 ayda, Aβ birikintileri korteksle sınırlıdır ve hipokampus12'de minimum birikintiler gözlenir. Bu koşullar altında, tam ilgi alanı analizi, doku örnekleme alanını ve dolayısıyla Aβ sinyalini artırmak için istenen yaklaşım olabilir. Öte yandan, alt bölge analizi, belirli bir beyin bölgesindeki Aβ yükü ilgi çekici olduğunda (örneğin, somatosensoriyel korteks) tercih edilen yöntem olabilir. Ek olarak, 13 ayda, APP / PS1 erkek fareleri yoğun 6E10-pozitif lekeler gösterir ve immünofloresan boyama çok düşük bir arka plana sahip mükemmel bir sinyalle sonuçlanır ve mevcut protokolü verilen koşullar altında nicelleştirme için çok uygun hale getirir. Bu niceleme yönteminin daha az yoğun boyamaya başarılı bir şekilde uygulanıp uygulanamayacağı belirsizdir ve bu soruyu cevaplamak için gelecekteki çalışmalar gerekecektir. Burada sunulan immünofloresan ve görüntü nicelleştirme yöntemi, öncü form13 de dahil olmak üzere tüm Aβ formlarını tespit eder. Sonuç olarak, belirli bir Aβ türünün (örneğin, Aβ1-40 veya Aβ1-42) tespitinde bir ilgi varsa, bu Aβ izoformlarına özgü antikorlar kullanılabilir. Bu nedenle, 6E10 immünofloresan boyama ve tespit yöntemi, ELISA kullanılarak tüm beyin homojenatlarında Aβ1-42 ölçümlerinin ölçümleri ile ilişkili olmasına rağmen (Şekil 5F, G), korelasyon sadece mütevazıydı. Bu, ELISA kullanılarak sadece Aβ1-42'nin ölçülmesine ve 6E10 immün boyama kullanılarak tüm Aβ türlerinin tespitine bağlanabilir. Mevcut çalışma, tam ve alt bölgesel analizler arasındaki anlaşmayı ve korelasyonu değerlendirmek için üç okuyucu kullanmaktadır. Ek okuyuculara sahip olmak, çalışmanın sağlamlığını artırabilir ve burada sunulan iki yöntem arasındaki anlaşmaları daha da doğrulayabilir. Ayrıca, Pearson korelasyonunu, sürekli değişkenler19 arasındaki anlaşmayı tanımlamak için diğer yöntemlerin yanı sıra yaygın olarak kullanılan bir anlaşma ölçüsü olarak kullanıyoruz. Bununla birlikte, anlaşmayı belirlemek için Pearson korelasyonunu kullanmanın bir sınırlaması, burada kullanılan iki yöntemin ilgili sonuçları sağlayabilmesidir, ancak bir yöntem, sistematik önyargı nedeniyle diğerinden genel olarak daha yüksek değerlerle sonuçlanabilir. Bu nedenle, Pearson korelasyonu göreceli anlaşmanın iyi bir ölçüsüdür19. Protokolün sağlamlığını arttırmak için, ortalama 6E10-pozitif alanın iki yöntemle karşılaştırılması gibi mutlak anlaşmayı doğrulamak için ek yöntemler kullanılabilir (Şekil 5E),19. Birlikte ele alındığında, mevcut protokol, immünofloresan boyama ile tespit edilen Aβ yükünü karşılaştırır ve beyin dokusu bölümlerinde ilgilenilen tam ve alt bölgeleri analiz eder. Sonuçlar, bol miktarda Aβ birikintisi gösteren 13 aylık APP / PS1 erkek farelerden türetilen beyin dokusu bölümleri için bu iki yöntem arasında güçlü bir korelasyon olduğunu göstermektedir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu yayında bildirilen araştırmalar, Ulusal Sağlık Enstitüleri Ulusal Yaşlanma Enstitüsü tarafından R01AG062840 (RKS'ye) ve R01AG072896 (RKS'ye) ödül numaraları altında desteklenmiştir. İçerik yalnızca yazarların sorumluluğundadır ve Ulusal Sağlık Enstitüleri'nin resmi görüşlerini temsil etmek zorunda değildir. Federal fonların yaklaşık 200 bin doları (% 100) bu projeyi destekledi. Ayrıca Dr. Joshua Yang'a el yazması düzenleme konusundaki yardımları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | ThermoFisher Scientific, MA, USA | 339650 | |
| 24-well plates | Fisher Scientific, NH, USA | FB012929 | |
| Amyloid beta 42 human ELISA kit | ThermoFisher Scientific, MA, USA | KHB3441 | |
| Aqueous mounting media | Vector laboratories, CA, USA | H-5501-60 | |
| Bovine serum albumin | Sigmaaldrich, MO, USA | A2153-50G | |
| BZ-X710 Keyence all-in-one fluorescence microscope | Keyence, IL, USA | BZ-X710 | |
| Clear nail poilsh | User preference | NA | |
| Cryostat | Leica Biosystems, IL, USA | Leica CM1860 Cryostat | |
| Formic acid | Sigmaaldrich, MO, USA | F0507-500ML | |
| Glass coverslips | VWR, PA, USA | 48393-081 | |
| GraphPad Prism | GraphPad Software, CA, USA | Version 8 | |
| ImageJ 1.51k | National Institutes of Health, MD, USA | Version 1.53e | |
| Mice | Jackson Laboratories, ME, USA | 034829-JAX | |
| Paraformaldehyde | Sigmaaldrich, MO, USA | P6148-500G | |
| Phenytoin/pentobarbital based anesthetic (Euthasol) | Patterson Veterinary, MA, USA | 07-805-9296 | |
| Phosphate-buffered saline | Fisher Scientific, NH, USA | BP661-50 | |
| Plus (+) microscope slides | Ted Pella, Inc., CA, USA | 260100 | |
| Primary antibody (6E10) | Biolegend, CA, USA | 803013 | |
| Sucrose | Sigmaaldrich, MO, USA | 47289 | |
| Triton X 100 | Sigmaaldrich, MO, USA | T8787-100ML |
Referanslar
- Alzheimer's Association. 2021 Alzheimer's disease facts and figures. Alzheimer's & Dementia. 17 (3), 327-406 (2021).
- Langa, K. M., Foster, N. L., Larson, E. B. Mixed dementia: emerging concepts and therapeutic implications. Journal of the American Medical Association. 292 (23), 2901-2908 (2004).
- Gandy, S., DeKosky, S. T. Toward the treatment and prevention of Alzheimer's disease: rational strategies and recent progress. Annual Review of Medicine. 64, 367-383 (2013).
- Bloom, G. S. Amyloid-beta and tau: the trigger and bullet in Alzheimer disease pathogenesis. JAMA Neurology. 71 (4), 505-508 (2014).
- Gremer, L., et al. Fibril structure of amyloid-beta(1-42) by cryo-electron microscopy. Science. 358 (6359), 116-119 (2017).
- Ferrero, J., et al. First-in-human, double-blind, placebo-controlled, single-dose escalation study of aducanumab (BIIB037) in mild-to-moderate Alzheimer's disease. Alzheimer's & Dementia Translational Research & Clinical Interventions. 2 (3), 169-176 (2016).
- Poon, C. H., Wang, Y., Fung, M. L., Zhang, C., Lim, L. W. Rodent models of amyloid-beta feature of Alzheimer's disease: development and potential treatment implications. Aging and Disease. 11 (5), 1235-1259 (2020).
- Christensen, A., Pike, C. J. Staining and quantification of beta-amyloid pathology in transgenic mouse models of Alzheimer's disease. Methods in Molecular Biology. 2144, 221(2020).
- Thakker, D. R., et al. Intracerebroventricular amyloid-beta antibodies reduce cerebral amyloid angiopathy and associated micro-hemorrhages in aged Tg2576 mice. Proceedings of the National Academy of Sciences of the United States of America. 106 (11), 4501-4506 (2009).
- Song, Z., et al. Detecting amyloid-beta accumulation via immunofluorescent staining in a mouse model of Alzheimer's disease. Journal of Visualized Experiments. (170), e62254(2021).
- Sun, J., et al. Hematologic safety of chronic brain-penetrating erythropoietin dosing in APP/PS1 mice. Alzheimer's & DementiaTranslational Research & Clinical Interventions. 5, 627-636 (2019).
- Jankowsky, J. L., et al. Mutant presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo: evidence for augmentation of a 42-specific gamma secretase. Human Molecular Genetics. 13 (2), 159-170 (2004).
- Grant, M. K. O., et al. Human cerebrospinal fluid 6E10-immunoreactive protein species contain amyloid precursor protein fragments. PloS One. 14 (2), 0212815(2019).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Eichenbaum, K. D., et al. Minimally invasive method for murine brain fixation. Biotechniques. 39 (4), 487-490 (2005).
- Chang, R., et al. Blood-brain barrier penetrating biologic tnf-alpha inhibitor for Alzheimer's disease. Molecular Pharmaceutics. 14 (7), 2340-2349 (2017).
- Pinskiy, V., et al. High-throughput method of whole-brain sectioning, using the tape-transfer technique. PloS One. 10 (7), 0102363(2015).
- Potts, E. M., Coppotelli, G., Ross, J. M. Histological-based stainings using free-floating tissue sections. Journal of Visualized Experiments. (162), e61622(2020).
- van Stralen, K. J., Dekker, F. W., Zoccali, C., Jager, K. J. Measuring agreement, more complicated than it seems. Nephron Clinical Practice. 120 (3), 162-167 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır