A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
فحص عالي الإنتاجية للعزلات الميكروبية مع التأثير على صحة Caenorhabditis elegans
* These authors contributed equally
In This Article
Summary
قد تؤثر ميكروبات الأمعاء بشكل إيجابي أو سلبي على صحة مضيفها من خلال آليات محددة أو محفوظة. Caenorhabditis elegans هي منصة ملائمة لفحص مثل هذه الميكروبات. يصف البروتوكول الحالي الفحص عالي الإنتاجية ل 48 عزلة بكتيرية للتأثير على مقاومة إجهاد الديدان الخيطية ، ويستخدم كبديل لصحة الديدان.
Abstract
بفضل صغر حجمها وعمرها القصير وسهولة علم الوراثة ، توفر Caenorhabditis elegans منصة ملائمة لدراسة تأثير العزلات الميكروبية على فسيولوجيا المضيف. كما أنه يتألق باللون الأزرق عند الموت ، مما يوفر وسيلة ملائمة لتحديد الموت. تم استغلال هذه الخاصية لتطوير فحوصات بقاء C. elegans عالية الإنتاجية (LFASS). ويتضمن ذلك تسجيل مضان بفاصل زمني لمجموعات الديدان الموضوعة في صفائح متعددة الآبار ، والتي يمكن من خلالها اشتقاق متوسط وقت الوفاة. تعتمد الدراسة الحالية نهج LFASS لفحص عزلات ميكروبية متعددة في وقت واحد للتأثيرات على قابلية C. elegans للحرارة الشديدة والضغوط التأكسدية. يتم الإبلاغ هنا عن خط أنابيب الفحص الميكروبي هذا ، والذي يمكن استخدامه بشكل ملحوظ لفحص البروبيوتيك مسبقا ، باستخدام مقاومة الإجهاد الشديدة كبديل لصحة المضيف. يصف البروتوكول كيفية زراعة كل من مجموعات عزل ميكروبات الأمعاء C. elegans ومجموعات الديدان المتزامنة في صفائف متعددة الآبار قبل دمجها في المقايسات. يغطي المثال المقدم اختبار 47 عزلة بكتيرية وسلالة تحكم واحدة على سلالتين من الديدان ، في مقايستين للإجهاد بالتوازي. ومع ذلك ، فإن خط أنابيب النهج قابل للتطوير بسهولة وقابل للتطبيق على فحص العديد من الطرائق الأخرى. وبالتالي ، فإنه يوفر إعدادا متعدد الاستخدامات لإجراء مسح سريع للمناظر الطبيعية متعددة المعلمات للظروف البيولوجية والكيميائية الحيوية التي تؤثر على صحة C. elegans.
Introduction
يحتوي جسم الإنسان على ما يقدر بنحو 10-100 تريليون خلية ميكروبية حية (البكتيريا والفطريات القديمة) ، والتي توجد بشكل أساسي في الأمعاء والجلد والبيئات المخاطية1. في حالة صحية ، توفر هذه الفوائد لمضيفها ، بما في ذلك إنتاج الفيتامينات ، ونضج الجهاز المناعي ، وتحفيز الاستجابات المناعية الفطرية والتكيفية لمسببات الأمراض ، وتنظيم التمثيل الغذائي للدهون ، وتعديل استجابات الإجهاد ، وأكثر من ذلك ، مع التأثير على النمو والتطور ، وظهور المرض ، والشيخوخة2،3،4،5 . تتطور ميكروبات الأمعاء أيضا بشكل كبير طوال الحياة. يحدث التطور الأكثر جذرية خلال مرحلة الرضاعة والطفولة المبكرة6 ، ولكن تحدث تغييرات كبيرة أيضا مع تقدم العمر ، بما في ذلك انخفاض في وفرة Bifidobacterium وزيادة في Clostridium و Lactobacillus و Enterobacteriaceae و Enterococcus الأنواع 7. يمكن أن يؤدي نمط الحياة إلى تغيير تكوين ميكروبات الأمعاء مما يؤدي إلى dysbiosis (فقدان البكتيريا المفيدة ، فرط نمو البكتيريا الانتهازية) ، مما يؤدي إلى أمراض مختلفة مثل مرض التهاب الأمعاء والسكري والسمنة5 ، ولكن أيضا المساهمة في مرض الزهايمر وأمراض باركنسون8،9،10،11.
ساهم هذا الإدراك بشكل حاسم في تحسين مفهوم محور الأمعاء والدماغ (GBA) ، حيث تعتبر التفاعلات بين فسيولوجيا الأمعاء (بما في ذلك الآن الميكروبات الموجودة داخلها) والجهاز العصبي المنظم الرئيسي لعملية التمثيل الغذائي للحيوان والوظائف الفسيولوجية12. ومع ذلك ، فإن الدور الدقيق للميكروبات في إشارات الأمعاء والدماغ وآليات العمل المرتبطة بها بعيدة كل البعد عن الفهم الكامل13. مع كون ميكروبيوتا الأمعاء محددا رئيسيا للشيخوخة الصحية ، أصبحت كيفية تعديل البكتيريا لعملية الشيخوخة موضوعا للبحث المكثف والجدل6،14،15.
مع إثبات أن الدودة المستديرة Caenorhabditis elegans تستضيف ميكروبيوتا الأمعاء الصادقة التي تهيمن عليها - كما هو الحال في الأنواع الأخرى - من قبل Bacteroidetes و Firmicutes و Actinobacteria16،17،18،19،20 ، صعودها السريع كمنصة تجريبية لدراسة التفاعلات المشتركة بين المضيفوالأمعاء 21،22،23،24 ، 25،26 وسعت بشكل كبير ترسانة التحقيقلدينا 26،27،28،29. على وجه الخصوص ، يمكن تكييف الأساليب التجريبية عالية الإنتاجية المتاحة ل C. elegans لدراسة النظام الغذائي الجيني ، والتفاعلات الجينية الدوائية ، والممرض الجيني ، وما إلى ذلك ، لاستكشاف كيفية تأثير العزلات البكتيرية والكوكتيلات على صحة C. elegans وشيخوختها بسرعة.
يصف البروتوكول الحالي خط أنابيب تجريبي لفحص صفائف من العزلات البكتيرية أو المخاليط الموضوعة في ألواح متعددة الآبار للتأثيرات على مقاومة الإجهاد C. elegans كبديل للصحة ، والتي يمكن استخدامها لتحديد البروبيوتيك. يوضح بالتفصيل كيفية تنمية أعداد كبيرة من الديدان والتعامل مع المصفوفات البكتيرية في تنسيقات ألواح 96 و 384 بئرا قبل معالجة الديدان لتحليل مقاومة الإجهاد الآلي باستخدام قارئ لوحة مضان (الشكل 1). يعتمد هذا النهج على فحوصات البقاء الآلية الخالية من الملصقات (LFASS)30 التي تستغل ظاهرة مضان الموت31 ، حيث تنتج الديدان المحتضرة دفعة من التألق الأزرق الذي يمكن استخدامه لتحديد وقت الوفاة. ينبعث التألق الأزرق بواسطة استرات الجلوكوزيل لحمض الأنثرانيليك المخزن في حبيبات الأمعاء C. elegans (نوع من العضيات المرتبطة بالليزوزوم) ، والتي تنفجر عندما يتم تشغيل شلال في أمعاء الدودة عند الوفاة31.
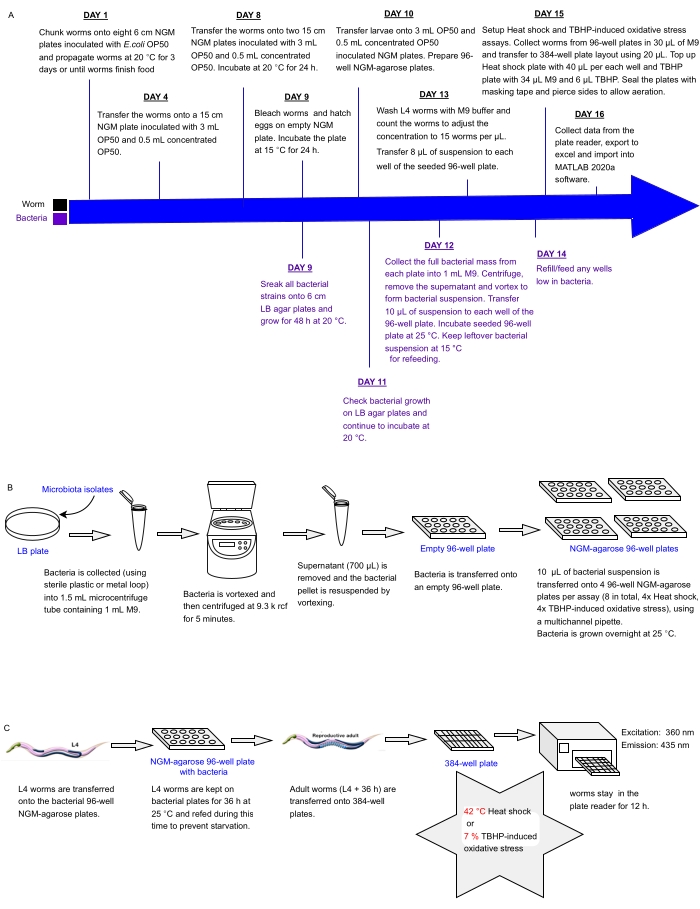
الشكل 1: سير العمل التجريبي للفحص عالي الإنتاجية للعزلات البكتيرية مع التأثير على مقاومة C. elegans للإجهاد . (أ) الجدول الزمني لصيانة الديدان والبكتيريا وإعداد المقايسة. (ب) إعداد صفيف صفيحة بكتيرية 96 بئرا والتعامل معها. (ج) إعداد لوحة دودة 384 بئرا. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Access restricted. Please log in or start a trial to view this content.
Protocol
السلالتان المستخدمتان بالتوازي في الدراسة الحالية هما Bristol N2 من النوع البري و HT1890: daf-16 (mgDf50) ، والتي تنمو بمعدلات مماثلة. ومع ذلك ، يمكن تكرار البروتوكول مع أي مزيج من سلالتين لهما معدلات نمو مماثلة. لاحظ أنه عند اختبار سلالات أخرى بالتوازي (على سبيل المثال ، النوع البري ومتحولات daf-2 بطيئة النمو) ، يجب مراعاة معدلات نمو مختلفة ، وبالتالي ، يجب تعديل البروتوكول. تم تحسين الجداول الزمنية وكميات الديدان والبكتيريا في البروتوكول التالي للاختبار المتوازي ل 48 عزلة بكتيرية على سلالتين دوديتين في مقايستين LFASS في رباعي الأضلاع. ستكون هناك حاجة إلى تعديلات إذا كان سيتم اختبار المزيد من الظروف بالتوازي. الإشريكية القولونية تم الحصول على سلالة بكتيريا OP50 من مركز علم الوراثة Caenorhabditis (CGC) ، جامعة مينيسوتا. تم الحصول على 48 عزلة بكتيرية من مختبر Schulenburg وصيانتها على أجار LB.
1. C. ايليجانس الاستزراع في OP50 (الأيام 1 - 8)
ملاحظة: يهدف النهج الحالي إلى زراعة خنثى C. elegans على وسط صلب في جميع المراحل وتجنب التغييرات الغذائية غير الضرورية (أي استخدام سلالات E. coli البديلة الأسرع نموا مثل NA22 أو وسائط النمو الأكثر ثراء مثل أطباق البيض) للبقاء أقرب ما يمكن إلى ظروف النمو القياسية32,33 التي لا تزال مستخدمة على نطاق واسع. تعتمد درجة حرارة نمو الدودة (المحددة هنا عند 15 درجة مئوية) على سلالة (سلالات) C. elegans المستخدمة وقد تحتاج إلى تعديل (على سبيل المثال ، لتجنب أو تحفيز التعبير عن النمط الظاهري أو العلامة الحيوية الحساسة لدرجة الحرارة). للحصول على معلومات حول تربية الديدان ، يرجى الاطلاع على المرجع33.
- قم بإعداد ثمانية ألواح NGM بقطر 6 سم (10 مل من أجار وسائط نمو الديدان الخيطية ، NGM ، الملف التكميلي 1) 32,33 لكل سلالة دودة واتركها تجف لمدة يوم واحد في درجة حرارة الغرفة.
- تحضير مزرعة سائلة مشبعة من بكتيريا E. coli OP50 عن طريق زرع استنساخ بكتيري واحد من صفيحة أجار مرق الليزوجيني المزروعة حديثا (LB agar ، الملف التكميلي 1) في 25 مل من وسط OP50 (الملف التكميلي 1) في أنبوب مخروطي سعة 50 مل. قم بتنمية الثقافة بين عشية وضحاها عند 37 درجة مئوية في حاضنة شاكر.
- قم بتلقيح ثمانية ألواح NGM مقاس 6 سم لكل سلالة ب 100 ميكرولتر من الاستزراع السائل المشبع من E. coli OP50 لكل لوحة واحتفظ بالألواح عند 20 درجة مئوية لمدة يومين قبل الاستخدام.
- باستخدام مشرط ، قم بقطع ونقل قطعة أجار مربعة بحجم 0.5 سم مع الديدان من صفيحة NGM التي تم تجويعها مؤخرا على كل من ألواح NGM الثمانية الملقحة مقاس 6 سم واحتضان هذه الأطباق عند 20 درجة مئوية لمدة 3 أيام (أو حتى تنتهي الديدان من الطعام).
- تحضير خمس صفائح NGM مقاس 15 سم لكل سلالة دودية (30 مل من وسط NGM لكل طبق) وتلقيحها ب 3 مل من OP50. اترك الأطباق تجف قبل التحضين عند 37 درجة مئوية طوال الليل. احتفظ بالأطباق عند 20 درجة مئوية حتى يتم استخدامها في خطوات لاحقة.
- باستخدام ماصة P-1000 ، أضف ما يصل إلى 3 مل من المخزن المؤقت M9 المعقم (الملف التكميلي 1) إلى ألواح NGM مقاس 6 سم (الخطوة 1.1.) لإعادة تعليق الديدان ، وجمع محلول الدودة من جميع الألواح الثمانية لكل سلالة في أنبوب مخروطي واحد سعة 15 مل.
- جهاز طرد مركزي عند 142 × جم لمدة 2 دقيقة عند 4 درجات مئوية. قم بإزالة المادة الطافية بعناية باستخدام ماصة P-5000 أو مضخة مياه مجهزة بماصة أو طرف باستور معقم. أضف 10 مل من المخزن المؤقت M9 المعقم لغسل حبيبات الدودة. كرر 2x.
- قم بإزالة المادة الطافية (قدر الإمكان) وانقل الديدان إلى لوحة NGM ملقحة OP50 مقاس 15 سم (الخطوة 1.5.) باستخدام ماصة. أضف 0.5 مل من ثقافة OP50 المركزة.
- لصنع OP50 المركز ، قم بتلقيح كل زجاجة من أربع زجاجات سعة 1 لتر من LB ب 2 مل من ثقافة بداية OP50 (محضرة في الخطوة 1.2.) ، وتنمو في حاضنة اهتزاز لمدة 6 ساعات عند 37 درجة مئوية و 160 × جم. حبيبات البكتيريا في 3057 × غرام و 20 درجة مئوية لمدة 15 دقيقة. تخلص من المادة الطافية ، وأعد تعليق الكريات البكتيرية ب 6 مل من وسط OP50 ، واجمعها في أنبوب مخروطي معقم سعة 50 مل.
ملاحظة: يمكن تخزين البكتيريا في 4 °C لمدة تصل إلى 1 أسبوع.
- تنمو كل سلالة دودة على صفيحة NGM قطرها 15 سم لمدة 3-4 أيام عند 15 درجة مئوية عن طريق إعادة تغذية الديدان ب 0.5 مل من OP50 المركز يوميا.
- بمجرد أن تنتهي الديدان من الطعام تقريبا ، قم بجمعها وغسلها في المخزن المؤقت M9 (الخطوة 1.6.1.) ، وانقل كل مزرعة من سلالات الديدان إلى لوحين NGM مقاس 15 سم (الخطوة 1.5) ، وانشر الديدان عند 20 درجة مئوية حتى ~ 95٪ من السكان بالغون جاذبون (سيستغرق الأمر حوالي 24 ساعة للنوع البري Bristol N2).
ملاحظة: تتميز الحشرات البالغة بوجود بيض داخل الدودة ، ويجب أن تحتوي اللوحة المثالية أيضا على وفرة من البيض غير المفقس الموضوعة على الطبق بدون الكثير من اليرقات33.
- بمجرد أن تنتهي الديدان من الطعام تقريبا ، قم بجمعها وغسلها في المخزن المؤقت M9 (الخطوة 1.6.1.) ، وانقل كل مزرعة من سلالات الديدان إلى لوحين NGM مقاس 15 سم (الخطوة 1.5) ، وانشر الديدان عند 20 درجة مئوية حتى ~ 95٪ من السكان بالغون جاذبون (سيستغرق الأمر حوالي 24 ساعة للنوع البري Bristol N2).
2. صيانة مجموعات عزل ميكروبيوتا الأمعاء (اليوم 9)
- قم بخط 48 عزلة بكتيرية على ألواح أجار فردية 6 سم رطل وتنمو لمدة 48 ساعة عند 20 درجة مئوية.
ملاحظة: يمكن زراعة البكتيريا عند 25 درجة مئوية لمدة 24-36 ساعة إذا لزم الأمر في وقت أقرب ، ولكن النمو الأطول 20 درجة مئوية يسمح باكتشاف الملوثات المحتملة. - مزامنة عدد كبير من C. elegans.
- يقوم المبيض بتجاذيف الديدان البالغة باتباع طريقة تحضير البيض القياسية33 ونقل البيض إلى لوحين NGM غير مصنفين مقاس 15 سم لمدة 24 ساعة عند 15 درجة مئوية للسماح لجميع يرقات L1 بالفقس والنمو بشكل متزامن في الخطوات اللاحقة.
تنبيه: كن حذرا أثناء التعامل مع محاليل التبييض.
- يقوم المبيض بتجاذيف الديدان البالغة باتباع طريقة تحضير البيض القياسية33 ونقل البيض إلى لوحين NGM غير مصنفين مقاس 15 سم لمدة 24 ساعة عند 15 درجة مئوية للسماح لجميع يرقات L1 بالفقس والنمو بشكل متزامن في الخطوات اللاحقة.
3. تزايد ثقافات C. elegans الكبيرة (اليوم 10)
- بمجرد الفقس ، اجمع يرقات L1 (من الخطوة 2.2.1.) في 3-4 مل من M9 في أنبوب مخروطي نظيف سعة 15 مل. ماصة أربع قطرات 10 ميكرولتر من محلول الدودة على شريحة أو لوحة وحساب عدد الديدان في كل قطرة تحت مجهر مجسم عند تكبير 16x. أوجد تركيز الدودة في المحلول عن طريق حساب متوسط عدد اليرقات من جميع قطرات محلول الديدان. اضرب هذه القيمة في الحجم المتبقي وقم بتقدير إجمالي عدد الديدان لكل سلالة.
ملاحظة: هناك حاجة إلى 46000-50000 يرقة L1 لكل سلالة في هذه المرحلة لملء صفيحة 384 بئرا أو صفيحتين نصفيتين لاحقا.- لكل سلالة ، انقل جميع يرقات L1 إلى لوحين NGM مقاس 15 سم (23000-25000 L1 لكل طبق) تم تلقيحهما مسبقا ب 3 مل من OP50 (الخطوة 1.5.) وإعادة بذرها ب 0.5 مل من OP50 المركز.
- احتضن عند 15 درجة مئوية ، مع إضافة 0.5 مل من OP50 المركز يوميا حسب الحاجة حتى تصل الديدان إلى المرحلة L4.
ملاحظة: تتميز المرحلة L4 بأمعاء أغمق قليلا وبقعة بيضاء نصف قرص أو هلال حيث سيتشكل الفرج في النهاية32,33. - قم بإعداد 96 بئرا من ألواح NGM-agarose باتباع الخطوات أدناه.
- قم بإعداد ثماني ألواح NGM-agarose سعة 96 بئرا عن طريق ملء كل بئر ب 125 ميكرولتر من NGM-agarose (أربع لوحات لكل فحص).
ملاحظة: يوصى بطلاء بعض الأطباق الإضافية إذا تلوث بعضها في الخطوات التالية. ستكون هناك حاجة إلى قارئين للألواح لتشغيل المقايسات بالتوازي ، ولكن يمكن أيضا تشغيلها على التوالي بدءا من فحص الإجهاد الحراري حيث يمكن تشغيلها لمدة 6 ساعات. بالنسبة لهذه الألواح ، يتم استبدال أجار الرماد بنسبة <4٪ بالأغاروز (انظر جدول المواد) ، مما يتيح تجفيفا أبطأ وأكثر توازنا عبر سدادات NGM وتقليل حفر الديدان من أجل استعادة أفضل. - تأكد من ملء الآبار بالتساوي وخالية من الفقاعات. استخدم كتلة حرارية مضبوطة على 70 درجة مئوية (مع نقل بطيء للحرارة من خلال بلاستيك اللوحة متعددة الآبار ، قد يسخن NGM-agarose فقط حتى حوالي 55-60 درجة مئوية) لمنع الخليط من التصلب أثناء العملية. لإزالة الفقاعات داخل الآبار ، استخدم إبرة معقمة ساخنة باللهب.
- اترك الألواح المكونة من 96 بئرا تثبت في درجة حرارة الغرفة في بيئة معقمة قبل قلبها (الغطاء لأسفل لمنع التكثيف) وتخزينها عند 4 درجات مئوية في صندوق نظيف لحين الحاجة.
- قم بإعداد ثماني ألواح NGM-agarose سعة 96 بئرا عن طريق ملء كل بئر ب 125 ميكرولتر من NGM-agarose (أربع لوحات لكل فحص).
- في اليوم 11 ، تحقق من الديدان من الخطوة 3.2 ، وتأكد من عدم ظهور أي تلوث وأن الديدان لا تزال ممتلئة.
- في اليوم 12 ، تحقق من الديدان من الخطوة 3.1 ، وتأكد من عدم ظهور أي تلوث وأن الديدان لا تزال ممتلئة. تحقق أيضا من مرحلة نمو الديدان.
ملاحظة: يعتمد الجنس / السلالة ومرحلة نمو الدودة ، مثل الديدان L4 أو L4 + 24 h المستخدمة ، على العلاجات التي تخضع لها الديدان. هنا ، تعرضت الخنثى من النوع البري لعزلات بكتيرية من L4 لمدة 36 ساعة.
4. تحضير مجموعات عزل ميكروبيوتا الأمعاء لإعادة تغذية الديدان
- راقب نمو البكتيريا على ألواح أجار LB من الخطوة 2.1. والاستمرار في الحضانة عند 20 درجة مئوية.
ملاحظة: على الرغم من أنها ليست مثالية ، في حالة عدم نمو بعض الحيوانات المستنسخة أو الكشف عن الملوثات ، يمكن إعادة ربط البكتيريا من المخزون النظيف على ألواح رطل 6 سم وتنمو عند 25-28 درجة مئوية لمدة 24 ساعة لتكون جاهزة للتجربة. - تحديد تخطيط صفيف مكون من 96 بئرا للجمع البكتيري الذي يتم اختباره ، مما يسهل البذر المنتظم للصفائح وتحليل البيانات في الخطوات اللاحقة (الجدول التكميلي 1).
- اجمع الكتلة البكتيرية من كل صفيحة بكتيرية 6 سم (الخطوة 4.1) ، وانقلها إلى أنبوب طرد مركزي دقيق سعة 1.5 مل يحتوي على 1 مل من المخزن المؤقت M9. قم بذلك باستخدام حلقة بلاستيكية معقمة بقطر 2 مم للاستخدام مرة واحدة أو حلقة معدنية قطرها 5 مم. تعقيم الحلقة المعدنية بين السلالات البكتيرية عن طريق غمس الإيثانول بنسبة 100٪ ، واللهب ، والتبريد لمدة 5 ثوان.
- دوامة أنابيب الطرد المركزي الدقيقة حتى يتم إعادة تعليق الكريات البكتيرية بالكامل (اعتمادا على السلالة البكتيرية, قد يستغرق هذا ~ 1-10 ثانية).
- قم بالدوران لأسفل عند 9,300 × جم لمدة 5 دقائق في درجة حرارة الغرفة ، وقم بإزالة 700 ميكرولتر من المادة الطافية ، وأعد تعليق الحبيبات البكتيرية عن طريق الدوامة.
- انقل 200 ميكرولتر من كل معلق بكتيري إلى بئر واحد من صفيحة 96 بئر معقمة فارغة وفقا للتخطيط المنصوص عليه في الخطوة 4.2.
- من هذه الصفيحة ، قم بتلقيح ثماني صفائح NGM-agarose 96 بئرا (محضرة في الخطوة 3.3.) ب 10 ميكرولتر من المحلول البكتيري باستخدام ماصة متعددة القنوات واحتضانها مع الغطاء عند 25 درجة مئوية لمدة 24 ساعة. لا تغلق الألواح للسماح بتجفيف الألواح والنمو الهوائي البكتيري وتجنب التكثيف الزائد.
- أغلق لوحة التعليق المكونة من 96 بئرا والتي تم إعدادها في الخطوة 4.6. مع فيلم مانع للتسرب لاصق نظيف (انظر جدول المواد) ، وتخزينها في درجة حرارة 15 درجة مئوية لمدة تصل إلى 5 أيام. سيتم استخدام هذا لإعادة تغذية الديدان حسب الحاجة.
5. الصدمة الحرارية LFASS وإعداد مقايسة الأكسدة (الأيام 13 - 14)
- بالنظر إلى اللوحات من الخطوة 3.5 ، قم بتقييم مرحلة نمو الديدان. بمجرد وصول >90٪ من الديدان إلى L434 ، اجمع الديدان في ما يصل إلى 10 مل من محلول M9 المعقم في أنابيب مخروطية سعة 15 مل.
- اغسل الديدان على نطاق واسع (على الأقل 4x) عن طريق الدوران لأسفل عند 142 × جم لمدة 2 دقيقة عند 4 درجات مئوية ، وإزالة المادة الطافية ، وإضافة 10 مل من M9 المعقم الطازج بين كل غسلة للتخلص من بكتيريا OP50. أعد تعليق حبيبات الدودة في 10 مل من M9.
- نقل 50 ميكرولتر من محلول الدودة إلى أنبوب ربط سطحي منخفض (انظر جدول المواد) يحتوي على 950 ميكرولتر من M9. بعد خلط محتويات الأنبوب برفق لتجنب ترسيب الديدان ، استخدم بسرعة طرف ماصة مبلل منخفض الارتباط لنقل 3-4 قطرات منفصلة سعة 10 ميكرولتر على شريحة زجاجية أو لوحة NGM ، وعد أرقام الديدان تحت مجهر مجسم (انظر جدول المواد) بتكبير 16x. متوسط العد من 3-4 قطرات وتحديد عدد الديدان لكل ميكرولتر في محلول الدودة (انظر الخطوة 3.1.).
- اضبط تركيز الدودة في أنبوب 10 مل للوصول إلى ~ 120 دودة في 8 ميكرولتر. إذا تم إعداد الحل في الخطوة 5.2. غير مركزة بما فيه الكفاية ، قم بتدوير الديدان لأسفل وإزالة M9 وفقا لذلك للوصول إلى 120 دودة لكل 8 ميكرولتر.
- نقل 8 ميكرولتر من محلول الدودة (~ 120 ديدان) إلى كل من آبار ألواح NGM-agarose الثمانية المكونة من 96 بئرا من الخطوة 4.7 ، باستخدام ماصة متعددة القنوات أو ماصة متكررة. تأكد من استخدام نصائح الاحتفاظ المنخفض للحد من فقدان الديدان. قد يكون من الضروري أيضا قطع أطراف الأطراف للسماح للديدان البالغة الكبيرة بالحد من الضغط الميكانيكي على الديدان البالغة.
ملاحظة: يتطلب الفحص ما لا يقل عن 30 دودة صحية حية للعمل بشكل موثوق ولكنه يعمل بشكل أفضل مع حوالي 100 دودة لكل بئر. - احتضان الدودة وألواح NGM-agarose المصنفة ببذور البكتيريا 96 بئرا عند 25 درجة مئوية لمدة 36 ساعة.
- افحص الألواح بين 12-24 ساعة ، وتأكد من بقاء الديدان ممتلئة طوال الوقت. إذا كانت إعادة التغذية مطلوبة ، فأعد تعليق البكتيريا داخل صفيحة الصفيف البكتيرية المكونة من 96 بئرا المخزنة عند 15 درجة مئوية في الخطوة 4.8 ، وأضف ما يصل إلى 10 ميكرولتر من المحلول البكتيري المقابل إلى صفائح NGM-agarose ذات 96 بئرا حيث تكون الديدان معرضة لخطر الجوع قبل نهاية فترة الحضانة البالغة 36 ساعة (ستؤدي الديدان الجائعة إلى نتائج مختلفة إلى حد كبير ، لذلك هذا مهم جدا).
ملاحظة: يجب تنفيذ الخطوات التالية في اليوم 15. قبل بدء الفحص ، قد يكون من الضروري تحسين ارتفاع القراءة. سيتم تحقيق القراءة المثلى 20-50 ميكرومتر فوق قاع البئر. سيعتمد هذا على طراز قارئ اللوحة. يوفر البعض إمكانية Z-scan ، بينما يسمح البعض الآخر بإدخال الارتفاع يدويا. اضبط الارتفاع الأمثل عند المستوى الذي يتم فيه اكتشاف أعلى إشارة مضان أزرق (365 نانومتر / 430 نانومتر). قد تعمل بعض قارئات الألواح على ارتفاع ثابت محسن لفحوصات الخلايا الملتصقة وقد لا تكون مثالية لمقايسات LFASS. - بعد 36 ساعة ، قم بتوزيع 30 ميكرولتر من M9 في كل بئر من لوحة 96 بئر.
ملاحظة: بالنسبة لفحوصات الإجهاد الحراري ، يجب أن يكون قارئ اللوحة قد وصل إلى درجة الحرارة المطلوبة لإجراء الفحص وقد يحتاج إلى تشغيله مسبقا. يستخدم البروتوكول الحالي 42 درجة مئوية لزيادة سرعة القتل إلى أقصى حد ، لكن النهج ينطبق على درجات الحرارة الأخرى فوق 30 درجة مئوية. - انقل الديدان (حوالي 20 ميكرولتر) إلى لوحة 384 بئرا وفقا للتخطيطات المحددة ، باستخدام نصائح منخفضة الاحتفاظ (ضع في اعتبارك قطع نهاية الأطراف للسماح للديدان الكبيرة بتقليل الضغط الميكانيكي للديدان البالغة).
ملاحظة: بالنسبة للدراسة الحالية ، تم استخدام إعدادين مختلفين لقارئ الألواح للفحصين الموصوفين هنا (الإجهاد الحراري والإجهاد التأكسدي) ، وبالتالي يجب عدم طلاء العينات المخصصة لهذين الفحصين في نفس اللوحة التي تحتوي على 384 بئرا. - تأكد من إعداد قارئات اللوحات بشكل صحيح (الجدول 1).
- قم بتعبئة ألواح البئر البالغ عددها 384 لوحة بمزيد من M9 ، بهدف الحصول على حجم نهائي يبلغ 60 ميكرولتر لكل بئر. لفحص الإجهاد الحراري ، أضف 40 ميكرولتر من M9 ، وبالنسبة للإجهاد التأكسدي الناجم عن t-BHP ، أضف 34 ميكرولتر من M9 في 6 ميكرولتر من t-BHP (انظر جدول المواد).
- ابدأ الفحص في غضون دقيقتين من إضافة t-BHP (من الناحية المثالية ، يجب أن تتعرض جميع الديدان ل t-BHP في وقت واحد ، ودقة وقت الفحص هي 2 دقيقة). إذا لم يكن ذلك ممكنا ، فاستخدم مؤقتا لتقدير الوقت المستغرق في سحب t-BHP قبل بدء الفحص للسماح بالتعديل اللاحق لمتوسط وقت الوفاة.
- أغلق الألواح بغطاءها الشفاف. أغلق حواف الألواح التي تضم 384 بئرا بشريط لاصق (شريط لاصق فوق اللوحة والغطاء) ، مما يضمن عدم مرور الشريط فوق الغطاء أو أسفل اللوحة. شق الشريط بين الغطاء واللوحة على فترات باستخدام مشرط للسماح بتبادل الهواء مع تقليل التبخر أثناء الفحص.
- أدخل اللوحة في قارئ اللوحة (انظر جدول المواد) وابدأ الجري. اهدف إلى الإثارة عند 365 نانومتر واكتشاف الانبعاثات عند 435 نانومتر كل دقيقتين لمدة 6-12 ساعة (الجدول 1).
ملاحظة: عادة ما تكون 6 ساعات كافية لمقايسات الإجهاد الحراري 42 درجة مئوية و 8 ساعات لمقايسات الإجهاد التأكسدي t-BHP بنسبة 7٪.
6. معالجة بيانات قارئ اللوحة
- احفظ بيانات التألق الأولية من قارئ اللوحة كتنسيقات .txt مفصولة بفواصل أو .csv أو .xls /.xlsx ، ثم قم بالتحويل إلى تنسيق xls /.xlsx. اعتمادا على تنسيق البيانات ، أعد تنظيمها لمطابقة تخطيط ورقة Excel المطلوب لتحليل LFASS. اتبع التعليمات التفصيلية الواردة في المرجع30.
ملاحظة: بينما يمكن تحليل البيانات يدويا ، وتطبيع كل سلسلة زمنية والبحث عن الوقت الذي يصل فيه مضان الموت إلى نصف الحد الأقصى ، يمكن إجراء التحليل الآلي في Matlab الذي يعمل على روتين LFASS30. - قم بتنزيل وتثبيت Matlab (الإصدار 2014a أو أعلى) وحزمة برامج LFASS من https://github.com/ABA80/LFASS. اتبع الإرشادات والتعليقات التوضيحية الواردة فيه.
ملاحظة: يقدم الشكل 1 جيم وصفا موجزا للنهج. مطلوب Matlab لتشغيل روتين LFASS. بدلا من ذلك ، يمكن ترجمة رمز Matlab إلى Oracle ، باستثناء وظيفة التركيب ، وهي ملكية خاصة. يمكن إعادة كتابة وظائف التنعيم والسيني الجديدة لتمكين الاستخدام في نظام أساسي مفتوح المصدر بالكامل. - بين تحليلات LFASS ، انقل البيانات والنتائج إلى موقع جديد حيث سيقوم تحليل LFASS بمعالجة جميع الملفات الموجودة في مجلد البيانات والكتابة فوق الملفات في مجلد النتائج.
7. فحص البيانات
- افتح ملف Excel وقم بتسمية الصفوف وفقا لموضع البئر على لوحة البئر 384. يعرض الملف التكميلي 2 مثالا على ملف Excel لبيانات التألق الخام التي تم إنشاؤها لفحص الصدمة الحرارية. استخدم موضع البئر على لوحة البئر 384 لتسمية الدودة والسلالات البكتيرية.
- قبل تحليل Matlab ، افحص البيانات بصريا في Excel ، مع رسم شدة التألق بمرور الوقت لبئر تمثيلي. اعتمادا على قارئ اللوحة المستخدم ، قد تكون البيانات صاخبة ولكن يجب أن تعرض ذروة واضحة. وعلى وجه الخصوص:
- حدد قيمة مضان دونها لن تختلف الذروة اختلافا كبيرا عن الضوضاء (سيؤدي تعيين مثل هذه العتبة في LFASS إلى تسريع التحليل عن طريق استبعاد الآبار الفارغة).
- لاحظ أقرب نقطة زمنية تضعف فيها تقلبات التألق قبل الارتفاع (قد تسحق الحيوانات بقوة لمدة تصل إلى 30 دقيقة ، مما يؤدي إلى تذبذب سريع لقراءات التألق الأزرق).
ملاحظة: يمكن تحسين تركيب الذروة عن طريق استبعاد هذه النقاط الزمنية المبكرة من نافذة تركيب المنحنى. - لاحظ النقاط الزمنية التي يتوقع أن تنخفض بينها قيم التألق الدنيا والقصوى (انظر إلى العديد من الآبار لتحديد هذه النطاقات) حيث سيتم استخدامها لتركيب المنحنى.
- تحقق مما إذا كانت سعة قمم التألق تختلف اختلافا كبيرا بين الآبار ، وقم بتطبيع البيانات قبل إجراء مزيد من التحليل باستخدام الصيغة التالية:
بئر مضان طبيعي n (t) = (بئر مضانn [t] - الحد الأدنى من التألق جيدا [Dt]) / (أقصى بئر مضان [Dt] - الحد الأدنى من التألق جيدا [Dt])
حيث "n" هو رقم البئر الحالي ، و "t" هي النقطة الزمنية ، و "Dt" هي سلسلة النقاط الزمنية للفحص.
8. معالجة بيانات LFASS
ملاحظة: ترد التفاصيل في https://github.com/ABA80/LFASS وفي المواد التكميلية للمرجع30.
- قم بإنشاء مجلدين فرعيين داخل مجلد LFASS ، أحدهما للبيانات المراد تحليلها والآخر للنتائج ، على سبيل المثال ، "بياناتي" و "النتائج".
- انسخ ملف بيانات Excel للفحص إلى المجلد الفرعي LFASS "بياناتي" بعد فحص البيانات.
- قم بتشغيل MATLAB ، وانتقل إلى مجلد LFASS ، واكتب ، وقم بتشغيل fitfolder في نافذة الأوامر (الملف التكميلي 3). ثم اتبع التعليمات التي تظهر على الشاشة.
- بعد كتابة "fitfolder" ، يطلب النظام اسم المجلد الذي يوجد به ملف Excel ، على سبيل المثال ، "بياناتي". اكتب اسم مجلد البيانات (في هذا المثال، "بياناتي").
- اتبع التعليمات التي تظهر على الشاشة ، مع توفير المعلمات المختلفة المطلوبة.
- أدخل "2" للفاصل الزمني بين القياسات المتتالية في البروتوكول الحالي (يسمح تحديد ذلك بالتعبير عن النتائج بالدقائق بدلا من وحدات النقطة الزمنية).
ملاحظة: يمكن تعديل الفاصل الزمني لإجراء قياسات مضان بشكل متكرر أو أقل (لتقليل أو زيادة دقة الوقت) وأيضا اعتمادا على قدرات قارئ اللوحة (على سبيل المثال ، قد يلزم زيادة الفاصل الزمني لقارئات الألواح التي لا يمكنها إجراء قياسات سريعة بما يكفي). تأكد دائما من مطابقة الفاصل الزمني التجريبي مع روتين LFASS. - قم بتعيين عتبة التسامح العليا عن طريق كتابة "0.95" (يمكن تغيير ذلك حسب الحاجة لتحسين الملاءمة) وعتبة التسامح الأدنى عن طريق كتابة "0.05" (يمكن تغيير هذا حسب الحاجة لتحسين الملاءمة) لتقييد الملاءمة السيني.
ملاحظة: تستند معلمات الوقت الأخرى إلى ملاحظات المستخدم من فحص البيانات (الخطوة 7.2.).
- أدخل "2" للفاصل الزمني بين القياسات المتتالية في البروتوكول الحالي (يسمح تحديد ذلك بالتعبير عن النتائج بالدقائق بدلا من وحدات النقطة الزمنية).
- اختر ما إذا كنت تريد عرض منحنيات ملائمة وسلسة أم لا عن طريق كتابة "y" ل YES أو "n" ل NO عند مطالبتك بذلك. لفحص النوبات المتقاربة بصريا ، حدد الأول.
ملاحظة: هذا الأخير مفيد لتصور جميع البيانات المتجانسة ولكن عادة لا يتم تحديده لأنه يولد الكثير من الرسوم البيانية المنبثقة. بعد ذلك ، سيقوم Matlab بتنفيذ روتين LFASS ، والذي قد يستغرق من 1 إلى 10 دقائق إذا تمت معالجة ملفات Excel متعددة دفعة واحدة. ستظهر النوافذ المنبثقة ذات المنحنيات وفقا للتحديد في الخطوة 8.6. يعرض الملف التكميلي 4A مثالا على منحنى مجهز. - اختر ما إذا كنت تريد (1) تحليل المنحنيات المحددة على أنها ضوضاء أو (2) تجديد المنحنيات غير الملائمة بشكل جيد باستخدام خيار [y / n]. اكتب y للموافقة و n للرفض.
ملاحظة: يوصى بالموافقة على إعادة التركيب ، خاصة إذا كان هناك العديد من المنحنيات غير الملائمة أو غير الملائمة. سيسمح ذلك للمستخدم بتوفير معلمات ملائمة للمنحنى مخصصة لكل منحنى عند ظهورها على الشاشة ويطلب فقط الحدود السابقة واللاحقة لتناسب السيني. يمكن تجربته عدة مرات حسب الحاجة. - بمجرد تحليل البيانات ، أغلق Matlab وافتح مجلد LFASS .
- انقر فوق المجلد الفرعي LFASS My Results ، حيث يتم حفظ ملفات النتائج تلقائيا في مجلد النتائج كما .txt.
ملاحظة: يقوم Matlab بإنشاء ثلاثة ملفات .txt: "Batch-fitted.txt" و "Batch and noise-fitted.txt" و "Refitted.txt". يتم حفظ الاثنين السابقين كإجراء احترازي في حالة تعطل الكمبيوتر أو خطأ المستخدم أثناء التجديد. الملف الذي يحتوي على التحليل الكامل الأكثر دقة هو "Refitted.txt". - افتح الملف Refitted.txt باستخدام Microsoft Excel واحفظه باسم .xls لمزيد من المعالجة. يعرض الملف التكميلي 4B مثالا على ملف النتيجة هذا.
ملاحظة: لكل بئر (منظمة في صفوف) ، يتم توفير ثلاث قيم في الأعمدة التي تعطي تقديرات لمتوسط وقت وفاة مجموعة الدودة: "الخام": يبلغ عن الوقت المتقاطع عند نصف الحد الأقصى لذروة البيانات التجريبية ؛ "الدفعة المركبة": تبلغ عن وقت التقاطع عند نصف الحد الأقصى لمنحنى الدفعة المجهزة ؛ "معاد تركيبه": يبلغ عن وقت التقاطع عند نصف الحد الأقصى للمنحنى المجدد. - احفظ الملف بتنسيق .xls كنسخة في مكان آمن. سيؤدي عدم القيام بذلك إلى المخاطرة بالكتابة فوق الملفات أثناء التشغيل التالي لروتين LFASS.
ملاحظة: يمكن بعد ذلك معالجة النتائج بشكل أكبر للرسوم البيانية أو التحليل الإحصائي.
Access restricted. Please log in or start a trial to view this content.
النتائج
توفر مقايسات LFASS فحصا قويا وعالي الإنتاجية وسريعا لظروف اختبار متعددة في وقت واحد ، مثل فحص العديد من المعلمات الجينية والميكروبات التي تساهم في مقاومة الإجهاد والشيخوخة. يستغرق الأمر من 2 إلى 3 أسابيع فقط حتى تحصل التجربة على مجموعة بيانات شاملة لظروف الاختبار المتعددة. تعرضت مجموعات الد?...
Access restricted. Please log in or start a trial to view this content.
Discussion
تقدم C. elegans العديد من المزايا للفحص السريع للمعلمات التجريبية المتعددة في وقت واحد ، نظرا لصغر حجمها وشفافيتها وتطورها السريع وعمرها القصير وعدم تكلفتها وسهولة التعامل معها. إن الجينوم الأبسط إلى حد كبير ، وخطة الجسم ، والجهاز العصبي ، والأمعاء ، والميكروبيوم ، ولكنه معقد ومشابه بما ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر CGC Minnesota (ماديسون ، الولايات المتحدة الأمريكية ، NIH - P40 OD010440) لتوفير سلالات دودة و OP50 و Pr. Hinrich Schulenburg (CAU ، كيل ، ألمانيا) لتوفير جميع العزلات الميكروبية البيئية الموضحة هنا. تم تمويل هذا العمل من خلال منحة UKRI-BBSRC إلى AB (BB / S017127 / 1). يتم تمويل JM من خلال منحة دكتوراه FHM بجامعة لانكستر.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 10 cm diameter plates (Non-vented) | Fisher Scientific | 10720052 | Venting is not necessary for bacterial cultures |
| 15 cm diameter plates (Vented) | Fisher Scientific | 168381 | |
| 384-well black, transparent flat bottom plates | Corning | 3712 or 3762 | Not essential to be sterile for fast stress assays |
| 6 cm diameter plates (Vented) | Fisher Scientific | 150288 | Venting is necessary for worm cultures to avoid hypoxia |
| 96-well transparent plates (Biolite) | Thermo | 130188 | |
| Agar (<4% ash) | Sigma-Aldrich | 102218041 | Good quality agar is important for the structural integrity of the culture media, to avoid worm burrowing |
| Agarose | Fisher Scientific | BP1356 | |
| Avanti Centrifuge J-26 XP | Beckman coulter | ||
| Bleach | Honeywell | 425044 | |
| Calcium chloride | Sigma-Aldrich | C5080 | |
| Centrifuge 5415 R | Eppendorf | ||
| Centrifuge 5810 R | Eppendorf | ||
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB agar | Difco | 240110 | |
| LB broth | Invitrogen | 12795084 | |
| LoBind tips | VWR | 732-1488 | Lo-bind reduce worm loss during transfers |
| LoBind tubes | Eppendorf | 22431081 | |
| Magnesium sulfate | Fisher Scientific | M/1100/53 | |
| Plate reader- infinite M nano+ | Tecan | Monochromator setup enables fluorescence tuning but adequate filter-based setups may be used | |
| Plate reader- Spark | Tecan | ||
| Potassium phosphate monobasic | Honeywell | P0662 | |
| Sodium chloride | Sigma-Aldrich | S/3160/63 | |
| Stereomicroscope setup with transillumination base | Leica | MZ6, or M80 | Magnification from 0.6-0.8x up to 40-60x is necessary, as is a good quality transillumination base with a deformable, titable or slidable mirror to adjust contrast |
| t-BHP (tert-Butyl hydroperoxide) | Sigma-Aldrich | 458139 | |
| Transparent adhesive seals Nunc | Fisher Scientific | 101706871 | It is important that it is transparent and that it can tolerate the temperatures involved in the assays. |
| Tryptophan | Sigma-Aldrich | 1278-7099 | |
| Yeast extract | Fisher Scientific | BP1422 |
References
- Krishna, S., et al. Integrating microbiome network: establishing linkages between plants, microbes and human health. The Open Microbiology Journal. 13, 330-342 (2019).
- Amon, P., Sanderson, I. What is the microbiome. Archives of Disease in Childhood - Education & Practice Edition. 102 (5), 257-260 (2017).
- Belkaid, Y., Harrison, O. J. Homeostatic immunity and the microbiota. Immunity. 46 (4), 562-576 (2017).
- Cabreiro, F., Gems, D. Worms need microbes too: microbiota, health and aging in Caenorhabditis elegans. EMBO Molecular Medicine. 5 (9), 1300-1310 (2013).
- Vaga, S., et al. Compositional and functional differences of the mucosal microbiota along the intestine of healthy individuals. Scientific Reports. 10 (1), 14977(2020).
- Nagpal, R., et al. Gut microbiome and aging: Physiological and mechanistic insights. Nutrition and Healthy Aging. 4 (4), 267-285 (2018).
- Mitsuoka, T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 33 (3), 99-116 (2014).
- Bonfili, L., et al. Microbiota modulation as preventative and therapeutic approach in Alzheimer's disease. The FEBS Journal. 288 (9), 2836-2855 (2021).
- Vendrik, K. E. W., et al. Fecal microbiota transplantation in neurological disorders. Frontiers in Cellular and Infection Microbiology. 10, 98(2020).
- Wang, Q., et al. The role of gut dysbiosis in Parkinson's disease: mechanistic insights and therapeutic options. Brain. 144 (9), 2571-2593 (2021).
- Zhu, X., et al. The relationship between the gut microbiome and neurodegenerative diseases. Neuroscience Bulletin. 37 (10), 1510-1522 (2021).
- Miller, I. The gut-brain axis: historical reflections. Microbial Ecology in Health and Disease. 29 (1), 1542921(2018).
- Foster, J. A., Rinaman, L., Cryan, J. F. Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress. 7, 124-136 (2017).
- Coman, V., Vodnar, D. C. Gut microbiota and old age: Modulating factors and interventions for healthy longevity. Experimental Gerontology. 141, 111095(2020).
- Conway, J., Duggal, N. A. Ageing of the gut microbiome: Potential influences on immune senescence and inflammageing. Ageing Research Reviews. 68, 101323(2021).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10 (8), 1998-2009 (2016).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans Microbiome Resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: gateway to a new host-microbiome model. BMC Biology. 14, 38(2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Felix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Zimmermann, J., et al. The functional repertoire contained within the native microbiota of the model nematode Caenorhabditis elegans. The ISME Journal. 14 (1), 26-38 (2020).
- Dinic, M., et al. Host-commensal interaction promotes health and lifespan in Caenorhabditis elegans through the activation of HLH-30/TFEB-mediated autophagy. Aging. 13 (6), 8040-8054 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against alpha-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Hacariz, O., Viau, C., Karimian, F., Xia, J. The symbiotic relationship between Caenorhabditis elegans and members of its microbiome contributes to worm fitness and lifespan extension. BMC Genomics. 22 (1), 364(2021).
- Shin, M. G., et al. Bacteria-derived metabolite, methylglyoxal, modulates the longevity of C. elegans through TORC2/SGK-1/DAF-16 signaling. Proceedings of the National Academy of Sciences of the United States of America. 117 (29), 17142-17150 (2020).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Zhang, F., et al. High-throughput assessment of changes in the Caenorhabditis elegans gut microbiome. Methods in Molecular Biology. 2144, 131-144 (2020).
- Chan, J. P., et al. Using bacterial transcriptomics to investigate targets of host-bacterial interactions in Caenorhabditis elegans. Scientific Reports. 9 (1), 5545(2019).
- Hartsough, L. A., et al. Optogenetic control of gut bacterial metabolism to promote longevity. Elife. 9, 56849(2020).
- Pryor, R., et al. Host-microbe-drug-nutrient screen identifies bacterial effectors of Metformin therapy. Cell. 178 (6), 1299-1312 (2019).
- Benedetto, A., et al. New label-free automated survival assays reveal unexpected stress resistance patterns during C. elegans aging. Aging Cell. 18 (5), 12998(2019).
- Coburn, C., et al. Anthranilate fluorescence marks a calcium-propagated necrotic wave that promotes organismal death in C. elegans. PLOS Biology. 11 (7), 1001613(2013).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Naomi, R., et al. Probiotics for Alzheimer's disease: a systematic review. Nutrients. 14 (1), 20(2021).
- Zheng, S. Y., et al. Potential roles of gut microbiota and microbial metabolites in Parkinson's disease. Ageing Research Reviews. 69, 101347(2021).
- Gill, M. S., Olsen, A., Sampayo, J. N., Lithgow, G. J. An automated high-throughput assay for survival of the nematode Caenorhabditis elegans. Free Radical Biology and Medicine. 35 (6), 558-565 (2003).
- Park, H. -E. H., Jung, Y., Lee, S. -J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Partridge, F. A., et al. An automated high-throughput system for phenotypic screening of chemical libraries on C. elegans and parasitic nematodes. International Journal for Parasitology: Drugs and Drug Resistance. 8 (1), 8-21 (2018).
- Rahman, M., et al. NemaLife chip: a micropillar-based microfluidic culture device optimized for aging studies in crawling C. elegans. Scientific Reports. 10 (1), 16190(2020).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: a quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Brown, A. E., Schafer, W. R. Unrestrained worms bridled by the light. Nature Methods. 8 (2), 129-130 (2011).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652(2017).
- Jushaj, A., et al. Optimized criteria for locomotion-based healthspan evaluation in C. elegans using the WorMotel system. PLoS One. 15 (3), 0229583(2020).
- Nambyiah, P., Brown, A. E. X. Quantitative behavioural phenotyping to investigate anaesthesia induced neurobehavioural impairment. Scientific Reports. 11 (1), 19398(2021).
- Squiban, B., Belougne, J., Ewbank, J., Zugasti, O. Quantitative and automated high-throughput genome-wide RNAi screens in C. elegans. Journal of Visualized Experiments. (60), e3448(2012).
- Zugasti, O., et al. Activation of a G protein-coupled receptor by its endogenous ligand triggers the innate immune response of Caenorhabditis elegans. Nature Immunology. 15 (9), 833-838 (2014).
- Zugasti, O., et al. A quantitative genome-wide RNAi screen in C. elegans for antifungal innate immunity genes. BMC Biology. 14, 35(2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved