Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Hochdurchsatz-Screening mikrobieller Isolate mit Auswirkungen auf die Gesundheit von Caenorhabditis elegans
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Darmmikroben können die Gesundheit ihres Wirts über spezifische oder konservierte Mechanismen positiv oder negativ beeinflussen. Caenorhabditis elegans ist eine bequeme Plattform, um nach solchen Mikroben zu suchen. Das vorliegende Protokoll beschreibt das Hochdurchsatz-Screening von 48 Bakterienisolaten auf Auswirkungen auf die Nematoden-Stressresistenz, die als Proxy für die Gesundheit von Würmern verwendet werden.
Zusammenfassung
Mit seiner geringen Größe, kurzen Lebensdauer und einfachen Genetik bietet Caenorhabditis elegans eine bequeme Plattform, um die Auswirkungen mikrobieller Isolate auf die Wirtsphysiologie zu untersuchen. Es fluoresziert auch blau, wenn es stirbt, was eine bequeme Möglichkeit bietet, den Tod zu lokalisieren. Diese Eigenschaft wurde genutzt, um markierungsfreie C. elegans-Überlebenstests (LFASS) mit hohem Durchsatz zu entwickeln. Dabei handelt es sich um die Zeitraffer-Fluoreszenzaufzeichnung von Wurmpopulationen in Multiwell-Platten, aus denen die mediane Todeszeit der Population abgeleitet werden kann. Die vorliegende Studie wendet den LFASS-Ansatz an, um mehrere mikrobielle Isolate gleichzeitig auf die Auswirkungen auf die Anfälligkeit von C. elegans gegenüber starker Hitze und oxidativem Stress zu untersuchen. Eine solche mikrobielle Screening-Pipeline, die insbesondere zum Vorscreening von Probiotika verwendet werden kann, wobei schwere Stressresistenz als Proxy für die Gesundheit des Wirts verwendet wird, wird hier berichtet. Das Protokoll beschreibt, wie sowohl C. elegans-Darmmikrobiota-Isolatsammlungen als auch synchrone Wurmpopulationen in Multiwell-Arrays gezüchtet werden, bevor sie für die Assays kombiniert werden. Das vorgelegte Beispiel umfasst die Prüfung von 47 Bakterienisolaten und einem Kontrollstamm auf zwei Wurmstämme in zwei parallelen Stressassays. Die Ansatzpipeline ist jedoch leicht skalierbar und auf das Screening vieler anderer Modalitäten anwendbar. Somit bietet es ein vielseitiges Setup, um schnell eine multiparametrische Landschaft biologischer und biochemischer Bedingungen zu untersuchen, die sich auf die Gesundheit von C. elegans auswirken.
Einleitung
Der menschliche Körper beherbergt schätzungsweise 10-100 Billionen lebende mikrobielle Zellen (Bakterien, Archaeenpilze), die hauptsächlich in der Darm-, Haut- und Schleimhautumgebung vorkommen1. In einem gesunden Zustand bieten diese ihrem Wirt Vorteile, einschließlich Vitaminproduktion, Reifung des Immunsystems, Stimulation angeborener und adaptiver Immunantworten auf Krankheitserreger, Regulierung des Fettstoffwechsels, Modulation von Stressreaktionen und mehr, mit Auswirkungen auf Wachstum und Entwicklung, Krankheitsbeginn und Alterung 2,3,4,5 . Die Darmmikrobiota entwickelt sich auch im Laufe des Lebens erheblich. Die drastischste Entwicklung findet im Säuglingsalter und in der frühen Kindheit statt6, aber auch mit zunehmendem Alter treten signifikante Veränderungen auf, einschließlich einer Abnahme der Bifidobacterium-Häufigkeit und einer Zunahme von Clostridium, Lactobacillus, Enterobacteriaceae und Enterococcus-Arten 7. Der Lebensstil kann die mikrobielle Zusammensetzung des Darms weiter verändern, was zu Dysbiose führt (Verlust nützlicher Bakterien, übermäßiges Wachstum opportunistischer Bakterien), was zu verschiedenen Pathologien wie entzündlichen Darmerkrankungen, Diabetes und Fettleibigkeit führt5, aber auch zu Alzheimer und Parkinson beiträgt 8,9,10,11.
Diese Erkenntnis hat entscheidend dazu beigetragen, das Konzept der Darm-Hirn-Achse (GBA) zu verfeinern, bei der Wechselwirkungen zwischen der Darmphysiologie (die jetzt die darin enthaltenen Mikroben einschließt) und dem Nervensystem als Hauptregulator des tierischen Stoffwechsels und der physiologischen Funktionen angesehen werden12. Die genaue Rolle der Mikrobiota bei der Darm-Hirn-Signalübertragung und die damit verbundenen Wirkmechanismen sind jedoch noch lange nicht vollständig verstanden13. Da die Darmmikrobiota eine Schlüsseldeterminante für gesundes Altern ist, ist die Art und Weise, wie Bakterien den Alterungsprozess modulieren, Gegenstand intensiver Forschung und Kontroversen geworden 6,14,15.
Mit dem Nachweis, dass der Spulwurm Caenorhabditis elegans eine bonafide Darmmikrobiota beherbergt, die - wie bei anderen Arten - von Bacteroidetes, Firmicutes und Actinobacteria dominiert wird 16,17,18,19,20, sein rasanter Aufstieg als experimentelle Plattform zur Untersuchung kommensaler Interaktionen zwischen Wirt und Darm21,22,23,24 ,25,26 hat unser Ermittlungsarsenal 26,27,28,29 erheblich erweitert. Insbesondere Hochdurchsatz-experimentelle Ansätze, die für C. elegans zur Verfügung stehen, um Gen-Diät-, Gen-Medikament-, Gen-Pathogen-Interaktionen usw. zu untersuchen, können angepasst werden, um schnell zu untersuchen, wie bakterielle Isolate und Cocktails die Gesundheit und das Altern von C. elegans beeinflussen.
Das vorliegende Protokoll beschreibt eine experimentelle Pipeline, um sofort Arrays von Bakterienisolaten oder Mischungen in Multiwell-Platten auf Auswirkungen auf die Stressresistenz von C. elegans als Proxy für die Gesundheit zu untersuchen, die zur Identifizierung von Probiotika verwendet werden können. Es wird detailliert beschrieben, wie große Wurmpopulationen gezüchtet und bakterielle Arrays in 96- und 384-Well-Plattenformaten gehandhabt werden, bevor Würmer für die automatisierte Stressresistenzanalyse mit einem Fluoreszenzplattenleser verarbeitet werden (Abbildung 1). Der Ansatz basiert auf markierungsfreien automatisierten Überlebensassays (LFASS)30, die das Phänomen der Todesfluoreszenz31 ausnutzen, wobei sterbende Würmer einen Ausbruch blauer Fluoreszenz erzeugen, mit dem der Zeitpunkt des Todes bestimmt werden kann. Blaue Fluoreszenz wird von Glucosylestern der Anthranilsäure emittiert, die in C. elegans-Darmgranulaten (einer Art Lysosomen-verwandter Organelle) gespeichert sind, die platzen, wenn eine nekrotische Kaskade im Wurmdarm nach dem Tod ausgelöstwird 31.
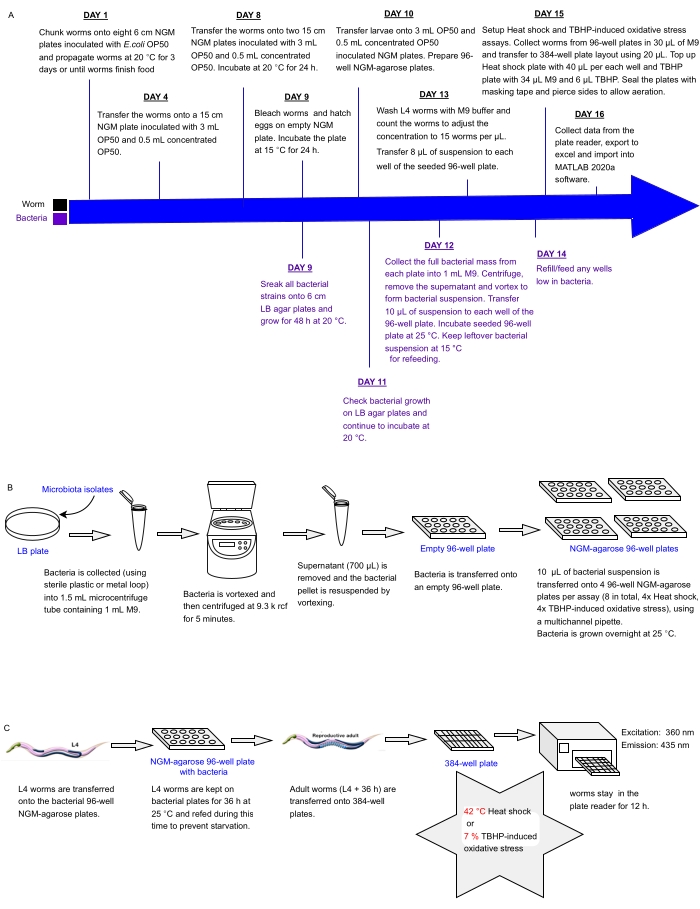
Abbildung 1: Experimenteller Workflow für das Hochdurchsatz-Screening von Bakterienisolaten mit Auswirkungen auf die Stressresistenz von C. elegans . (A) Zeitplan für die Erhaltung von Würmern und Bakterien und den Aufbau des Assays. (B) 96-Well-Aufbau und Handhabung bakterieller Plattenarrays. (C) 384-Well-Schneckenplatten-Setup. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Die beiden parallel für die vorliegende Studie verwendeten C. elegans-Stämme waren der Bristol N2-Wildtyp und HT1890: daf-16(mgDf50), die mit ähnlichen Raten wachsen. Das Protokoll kann jedoch mit einer beliebigen Kombination von zwei Stämmen repliziert werden, die ähnliche Wachstumsraten aufweisen. Beachten Sie, dass beim parallelen Testen anderer Stämme (z. B. Wildtyp- und langsam wachsende Daf-2-Mutanten) unterschiedliche Wachstumsraten berücksichtigt werden müssen und das Protokoll entsprechend angepasst werden muss. Die Zeitskalen und Mengen von Würmern und Bakterien im folgenden Protokoll sind für die parallele Prüfung von 48 Bakterienisolaten auf zwei Wurmstämme in zwei LFASS-Assays in Tetraplikaten optimiert. Anpassungen sind erforderlich, wenn mehrere Bedingungen parallel getestet werden sollen. Escherichia Coli Der OP50-Bakterienstamm wurde vom Caenorhabditis Genetics Center (CGC) der University of Minnesota bezogen. Die 48 Bakterienisolate wurden aus dem Labor Schulenburg gewonnen und auf LB-Agar gehalten.
1. C. elegans-Kultivierung auf OP50 (Tage 1 - 8)
ANMERKUNG: Der derzeitige Ansatz zielt darauf ab, C. elegans-Hermaphroditen in allen Stadien auf einem festen Medium zu züchten und unnötige Ernährungsumstellungen zu vermeiden (d. H. Verwendung alternativer, schneller wachsender E. coli-Stämme wie NA22 oder reicherer Wachstumsmedien wie Eierplatten), um so nah wie möglich an den Standardwachstumsbedingungen32,33 zu bleiben, die immer noch weit verbreitet sind. Die Wurmwachstumstemperatur (hier auf 15 °C festgelegt) hängt von dem/den verwendeten C. elegans-Stamm(en) ab und muss möglicherweise angepasst werden (z. B. um die Expression eines temperaturempfindlichen Phänotyps oder Biomarkers zu vermeiden oder auszulösen). Informationen zur Wurmhaltung finden Sie in Referenz33.
- Bereiten Sie acht NGM-Platten mit 6 cm Durchmesser vor (10 mL Nematoden-Wachstumsmedien-Agar, NGM, Ergänzungsdatei 1)32,33 pro Schneckenstamm und lassen Sie sie 1 Tag bei Raumtemperatur trocknen.
- Bereiten Sie eine gesättigte flüssige Kultur von E. coli OP50-Bakterien vor, indem Sie einen einzelnen Bakterienklon aus einer frisch gewachsenen Lysogeny-Brühe-Agarplatte (LB-Agar, Supplementary File 1) in 25 ml OP50-Medium (Supplementary File 1) in einem 50-ml-konischen Röhrchen aussäen. Die Kultur über Nacht bei 37 °C in einem Shaker-Inkubator anbauen.
- Die acht 6 cm NGM-Platten pro Stamm werden mit 100 μL gesättigter flüssiger Kultur von E. coli OP50 pro Platte beimpft und die Platten vor Gebrauch 2 Tage lang bei 20 °C aufbewahrt.
- Schneiden Sie mit einem Skalpell ein quadratisches Agarstück von 0,5 cm mit Würmern von einer kürzlich ausgehungerten NGM-Platte auf jede der acht geimpften 6 cm NGM-Platten und inkubieren Sie diese Platten bei 20 ° C für 3 Tage (oder bis die Würmer das Futter beendet haben).
- Bereiten Sie fünf 15-cm-NGM-Platten pro Schneckenstamm vor (30 mL NGM-Medium pro Platte) und impfen Sie mit 3 ml OP50. Lassen Sie die Platten trocknen, bevor sie über Nacht bei 37 °C inkubieren. Halten Sie die Platten bis zur späteren Verwendung bei 20 °C.
- Geben Sie mit einer P-1000-Pipette bis zu 3 ml sterilen M9-Puffer (Zusatzdatei 1) zu den 6 cm NGM-Platten (Schritt 1.1), um die Würmer zu resuspendieren, und sammeln Sie die Schneckenlösung von allen acht Platten pro Stamm in einem einzigen konischen 15-ml-Röhrchen.
- Zentrifugieren bei 142 x g für 2 min bei 4 °C. Entfernen Sie den Überstand vorsichtig mit einer P-5000-Pipette oder einer Wasserpumpe, die mit einer sterilen Pasteur-Pipette oder -Spitze ausgestattet ist. Fügen Sie 10 ml sterilen M9-Puffer hinzu, um das Schneckenpellet zu waschen. Wiederholen Sie 2x.
- Entfernen Sie den Überstand (so weit wie möglich) und übertragen Sie die Würmer mit einer Pipette auf eine 15 cm OP50 beimpfte NGM-Platte (Schritt 1.5). Fügen Sie 0,5 ml konzentrierte OP50-Kultur hinzu.
- Um konzentriertes OP50 herzustellen, beimpfen Sie jede der vier 1-Liter-Flaschen LB mit 2 ml OP50-Starterkultur (hergestellt in Schritt 1.2.) und wachsen Sie in einem Schüttelinkubator für 6 h bei 37 °C und 160 x g. Pelletieren Sie die Bakterien bei 3057 x g und 20 °C für 15 min. Verwerfen Sie den Überstand, resuspendieren Sie die Bakterienpellets mit 6 ml OP50-Medium und sammeln Sie sie in einem sterilen 50-ml-Konikuschen.
HINWEIS: Bakterien können bei 4 °C bis zu 1 Woche gelagert werden.
- Züchten Sie jeden Wurmstamm auf einer NGM-Platte mit 15 cm Durchmesser für 3-4 Tage bei 15 °C, indem Sie die Würmer täglich mit 0,5 ml konzentriertem OP50 erneut füttern.
- Sobald die Würmer das Futter fast aufgebraucht haben, sammeln und waschen Sie es im M9-Puffer (Schritt 1.6.1), übertragen Sie jede Wurmstammkultur auf zwei 15-cm-NGM-Platten (Schritt 1.5.) und vermehren Sie Würmer bei 20 ° C, bis ~95% der Population gravide Erwachsene sind (es dauert etwa 24 Stunden für Wildtyp Bristol N2).
HINWEIS: Gravide Erwachsene zeichnen sich durch das Vorhandensein von Eiern im Wurm aus, und die ideale Platte sollte auch eine Fülle von ungeschlüpften Eiern auf dem Teller ohne zu viele Larven haben33.
- Sobald die Würmer das Futter fast aufgebraucht haben, sammeln und waschen Sie es im M9-Puffer (Schritt 1.6.1), übertragen Sie jede Wurmstammkultur auf zwei 15-cm-NGM-Platten (Schritt 1.5.) und vermehren Sie Würmer bei 20 ° C, bis ~95% der Population gravide Erwachsene sind (es dauert etwa 24 Stunden für Wildtyp Bristol N2).
2. Pflege der Darmmikrobiota-Isolatsammlungen (Tag 9)
- Die 48 Bakterienisolate auf einzelne 6 cm LB Agarplatten streifen und 48 h bei 20 °C wachsen lassen.
HINWEIS: Bakterien können bei 25 ° C für 24-36 h früher gezüchtet werden, aber das längere Wachstum von 20 ° C ermöglicht es, potenzielle Verunreinigungen zu erkennen. - Synchronisieren Sie eine große Anzahl von C. elegans.
- Gravide adulte Würmer werden nach der Standard-Eizubereitungsmethode33 gebleicht und die Eier für 24 h bei 15 °C auf zwei ungesäte 15-cm-NGM-Platten überführt, damit alle L1-Larven in den folgenden Schritten synchron schlüpfen und wachsen können.
ACHTUNG: Seien Sie vorsichtig beim Umgang mit Bleichlösungen.
- Gravide adulte Würmer werden nach der Standard-Eizubereitungsmethode33 gebleicht und die Eier für 24 h bei 15 °C auf zwei ungesäte 15-cm-NGM-Platten überführt, damit alle L1-Larven in den folgenden Schritten synchron schlüpfen und wachsen können.
3. Anbau großer C. elegans-Kulturen (Tag 10)
- Nach dem Schlüpfen sammeln Sie die L1-Larven (aus Schritt 2.2.1.) in 3-4 ml M9 in einem sauberen konischen 15-ml-Röhrchen. Pipetten Sie vier 10-μL-Tropfen Wurmlösung auf einen Objektträger oder eine Platte und zählen Sie die Anzahl der Würmer in jedem Tropfen unter einem Stereomikroskop mit 16-facher Vergrößerung. Bestimmen Sie die Wurmkonzentration der Lösung, indem Sie die Anzahl der Larven aus allen Tropfen der Wurmlösung mitteln. Multiplizieren Sie diesen Wert mit dem verbleibenden Volumen und schätzen Sie die Gesamtzahl der Würmer für jeden Stamm.
HINWEIS: 46.000-50.000 L1-Larven pro Stamm sind in diesem Stadium erforderlich, um später eine 384-Well-Platte oder zwei Halbplatten zu füllen.- Übertragen Sie für jeden Stamm alle L1-Larven auf zwei 15-cm-NGM-Platten (23.000-25.000 L1 pro Platte), die zuvor mit 3 ml OP50 (Schritt 1.5.) beimpft und mit 0,5 ml konzentriertem OP50 erneut ausgesät wurden.
- Bei 15 °C inkubieren und bei Bedarf täglich 0,5 ml konzentriertes OP50 auffüllen, bis die Würmer das L4-Stadium erreichen.
HINWEIS: Das L4-Stadium ist durch einen etwas dunkleren Darm und einen halbscheiben- oder halbmondförmigen weißen Fleck gekennzeichnet, in dem sich die Vulva schließlich32,33 bildet. - Bereiten Sie 96-Well-NGM-Agarose-Platten nach den folgenden Schritten vor.
- Bereiten Sie acht 96-Well-NGM-Agarose-Platten vor, indem Sie jede Vertiefung mit 125 μL NGM-Agarose (vier Platten pro Assay) füllen.
HINWEIS: Es wird empfohlen, einige zusätzliche Platten zu verkleiden, wenn einige in den folgenden Schritten kontaminiert werden. Zwei Plattenleser werden benötigt, um die Assays parallel durchzuführen, aber sie können auch nacheinander mit dem Hitzespannungstest durchgeführt werden, da er nur 6 Stunden lang durchgeführt werden kann. Für diese Platten wird der <4% Ascheagar durch Agarose ersetzt (siehe Materialtabelle), was eine langsamere und gleichmäßigere Trocknung über die NGM-Pfropfen ermöglicht und das Eingraben von Schnecken für eine bessere Erholung reduziert. - Stellen Sie sicher, dass die Vertiefungen gleichmäßig und blasenfrei gefüllt sind. Verwenden Sie einen auf 70 °C eingestellten Heizblock (bei langsamer Wärmeübertragung durch den Kunststoff der Multiwell-Platte darf sich die NGM-Agarose nur auf etwa 55-60 °C erhitzen), um zu verhindern, dass das Gemisch während des Prozesses erstarrt. Um Blasen in Vertiefungen zu entfernen, verwenden Sie eine sterile, flammenerhitzte Nadel.
- Lassen Sie die 96-Well-Platten vor dem Invertieren bei Raumtemperatur in einer sterilen Umgebung aushärten (Deckel nach unten, um Kondensation zu vermeiden) und lagern Sie sie bei 4 °C in einer sauberen Box, bis sie benötigt werden.
- Bereiten Sie acht 96-Well-NGM-Agarose-Platten vor, indem Sie jede Vertiefung mit 125 μL NGM-Agarose (vier Platten pro Assay) füllen.
- Überprüfen Sie an Tag 11 die Würmer aus Schritt 3.2., um sicherzustellen, dass keine Verunreinigungen aufgetreten sind und die Würmer noch voll sind.
- Überprüfen Sie an Tag 12 die Würmer aus Schritt 3.1., um sicherzustellen, dass keine Verunreinigungen aufgetreten sind und die Würmer noch voll sind. Überprüfen Sie auch das Entwicklungsstadium der Würmer.
HINWEIS: Das Geschlecht / der Stamm und das Entwicklungsstadium des Wurms, wie L4 oder L4 + 24 h Würmer, hängen von den Behandlungen ab, denen die Würmer unterzogen werden. Hier wurden Wildtyp-Hermaphroditen 36 h lang Bakterienisolaten aus L4 ausgesetzt.
4. Vorbereitung von Darmmikrobiota-Isolatsammlungen für die Wiederfütterung von Würmern
- Überwachen Sie das Bakterienwachstum auf den LB-Agarplatten ab Schritt 2.1. und weiter bei 20 °C inkubieren.
HINWEIS: Obwohl es nicht ideal ist, können Bakterien für den Fall, dass einige Klone nicht wachsen oder Verunreinigungen aufdecken, aus sauberen Beständen auf 6 cm LB-Platten zurückgestreift und bei 25-28 ° C für 24 h gezüchtet werden, um für das Experiment bereit zu sein. - Definieren Sie ein 96-Well-Array-Layout für die zu testende Bakteriensammlung, um eine systematische Plattenaussaat und Datenanalyse in den nachfolgenden Schritten zu erleichtern (Zusatztabelle 1).
- Sammeln Sie die Bakterienmasse von jeder 6 cm großen Bakterienplatte (Schritt 4.1.) und geben Sie sie in ein markiertes 1,5-ml-Mikrozentrifugenröhrchen mit 1 ml M9-Puffer. Verwenden Sie dazu entweder eine sterile Kunststoffschlaufe mit einem Durchmesser von 2 mm oder eine Metallschlaufe mit einem Durchmesser von 5 mm. Sterilisieren Sie die Metallschleife zwischen Bakterienstämmen, indem Sie 100% Ethanol eintauchen, brennen und 5 s lang abkühlen.
- Wirbeln Sie die Mikrozentrifugenröhrchen durch, bis die Bakterienpellets vollständig resuspendiert sind (je nach Bakterienstamm kann dies ~1-10 s dauern).
- Bei 9.300 x g für 5 min bei Raumtemperatur herunterdrehen, 700 μL Überstand entfernen und das Bakterienpellet durch Wirbeln resuspendieren.
- 200 μL jeder Bakteriensuspension werden gemäß dem in Schritt 4.2 beschriebenen Layout in eine einzige Vertiefung einer leeren sterilen 96-Well-Platte überführt.
- Von dieser Platte werden acht 96-Well-NGM-Agarose-Platten (hergestellt in Schritt 3.3) mit 10 μL Bakterienlösung unter Verwendung einer Mehrkanalpipette beimpft und mit aufgesetztem Deckel bei 25 °C für 24 h inkubiert. Versiegeln Sie die Platten nicht, um das Trocknen der Platten und das bakterielle aerobe Wachstum zu ermöglichen und übermäßige Kondensation zu vermeiden.
- Versiegeln Sie die in Schritt 4.6 vorbereitete 96-Well-Aufhängungsplatte. mit sauberer Klebefolie (siehe Materialtabelle) und bis zu 5 Tage bei 15 °C lagern. Dies wird bei Bedarf für die Wiederfütterung von Würmern verwendet.
5. LFASS Hitzeschock und oxidativer Assay Aufbau (Tage 13 - 14)
- Betrachten Sie die Platten aus Schritt 3.5. und beurteilen Sie das Entwicklungsstadium der Würmer. Sobald >90% der Würmer L434 erreicht haben, sammeln Sie die Würmer in bis zu 10 ml steriler M9-Lösung in 15 ml konischen Röhrchen.
- Waschen Sie die Würmer ausgiebig (mindestens 4x), indem Sie sie bei 142 x g für 2 min bei 4 ° C herunterdrehen, den Überstand entfernen und 10 ml frisches steriles M9 zwischen jeder Wäsche hinzufügen, um OP50-Bakterien loszuwerden. Resuspendieren Sie das Schneckenpellet in 10 ml M9.
- 50 μL Schneckenlösung in ein Binderohr mit niedriger Oberfläche (siehe Materialtabelle) mit 950 μL M9 überführen. Nachdem Sie den Röhrcheninhalt vorsichtig gemischt haben, um eine Wurmsedimentation zu vermeiden, verwenden Sie schnell eine benetzte Low-Bind-Pipettenspitze, um 3-4 separate 10-μL-Tropfen auf einen Glasobjektträger oder eine NGM-Platte zu übertragen und die Wurmzahlen unter einem Stereomikroskop (siehe Materialtabelle) bei 16-facher Vergrößerung zu zählen. Berechnen Sie den Durchschnitt der 3-4 Tropfen und bestimmen Sie die Anzahl der Würmer pro Mikroliter in der Wurmlösung (siehe Schritt 3.1).
- Stellen Sie die Wurmkonzentration im 10-ml-Röhrchen ein, um ~ 120 Würmer in 8 μL zu erreichen. Wenn die in Schritt 5.2 vorbereitete Lösung nicht konzentriert genug ist, drehen Sie die Würmer herunter und entfernen Sie M9 entsprechend, um 120 Würmer pro 8 μL zu erreichen.
- 8 μL Wurmlösung (~120 Würmer) werden mit einer Mehrkanalpipette oder einer Wiederholpipette in jede der Vertiefungen der acht 96-Well-NGM-Agaroseplatten aus Schritt 4.7 überführt. Stellen Sie sicher, dass Sie Tipps mit geringer Retention verwenden, um den Verlust von Würmern zu begrenzen. Es kann auch notwendig sein, die Spitzenenden zu schneiden, damit große erwachsene Würmer die mechanische Belastung erwachsener Würmer begrenzen können.
HINWEIS: Der Assay erfordert mindestens 30 lebende gesunde Würmer, um zuverlässig zu arbeiten, funktioniert aber am besten mit etwa 100 Würmern pro Bohrloch. - Die 96-Well-NGM-Agaroseplatten von Würmern und Bakterien bei 25 °C für 36 h inkubieren.
- Überprüfen Sie die Platten zwischen 12-24 h und stellen Sie sicher, dass die Würmer durchgehend voll bleiben. Wenn eine erneute Fütterung erforderlich ist, resuspendieren Sie die Bakterien innerhalb der 96-Well-Bakterien-Array-Platte, die in Schritt 4.8 bei 15 °C gelagert wurde, und geben Sie bis zu 10 μL der entsprechenden Bakterienlösung zu den 96-Well-NGM-Agarose-Platten, in denen Würmer vor Ablauf der 36-stündigen Inkubationszeit verhungert sind (ausgehungerte Würmer führen zu sehr unterschiedlichen Ergebnissen. Das ist also sehr wichtig).
HINWEIS: Die folgenden Schritte müssen an Tag 15 durchgeführt werden. Vor Beginn des Assays kann es notwendig sein, die Lesehöhe zu optimieren. Der optimale Messwert wird 20-50 μm über dem Boden des Bohrlochs erreicht. Dies hängt vom Modell des Plattenlesers ab. Einige bieten die Möglichkeit eines Z-Scans, während andere eine manuelle Höheneingabe ermöglichen. Stellen Sie die optimale Höhe auf dem Niveau ein, auf dem das höchste blaue Fluoreszenzsignal (365 nm/430 nm) erkannt wird. Einige Plattenleser arbeiten möglicherweise in einer festen Höhe, die für adhärente Zellassays optimiert ist, und sind möglicherweise nicht ideal für LFASS-Assays. - Nach 36 h 30 μL M9 in jede Vertiefung der 96-Well-Platte geben.
HINWEIS: Für thermische Spannungstests muss das Plattenlesegerät die erforderliche Temperatur erreicht haben, um den Assay durchzuführen, und muss möglicherweise vorzeitig eingeschaltet werden. Das aktuelle Protokoll verwendet 42 ° C, um die Tötungsgeschwindigkeit zu maximieren, aber der Ansatz gilt für andere Temperaturen über 30 ° C. - Transferschnecken (ca. 20 μL) auf die 384-Well-Platte nach festgelegten Layouts unter Verwendung von Spitzen mit geringer Retention (erwägen Sie, das Ende der Spitzen abzuschneiden, damit große Würmer die mechanische Belastung für erwachsene Würmer reduzieren können).
ANMERKUNG: Für die vorliegende Studie werden für die beiden hier beschriebenen Assays (thermischer Stress und oxidativer Stress) zwei unterschiedliche Plattenleseeinstellungen verwendet, und daher dürfen Proben, die für diese beiden Assays bestimmt sind, nicht in dieselbe 384-Well-Platte plattiert werden. - Stellen Sie sicher, dass die Plattenleser ordnungsgemäß eingerichtet sind (Tabelle 1).
- Füllen Sie die 384-Well-Platten mit mehr M9 auf, wobei ein Endvolumen von 60 μL pro Vertiefung angestrebt wird. Für die thermische Stressprobe fügen Sie 40 μL M9 hinzu, und für t-BHP-induzierten oxidativen Stress fügen Sie 34 μl M9 in 6 μl t-BHP hinzu (siehe Tabelle der Materialien).
- Beginnen Sie den Assay innerhalb von 2 Minuten nach Zugabe von t-BHP (idealerweise müssen alle Würmer gleichzeitig t-BHP ausgesetzt werden, wobei die Auflösung der Assayzeit 2 Minuten beträgt). Wenn dies nicht möglich ist, verwenden Sie einen Timer, um die Zeit zu schätzen, die für das Pipettieren von t-BHP vor Beginn des Assays aufgewendet wurde, um eine spätere Anpassung der mittleren Todeszeit zu ermöglichen.
- Verschließen Sie die Teller mit ihrem transparenten Deckel. Versiegeln Sie die Kanten der 384-Well-Platten mit Abdeckband (Klebeband über die Platte und den Deckel), um sicherzustellen, dass das Klebeband nicht über den Deckel oder unter die Platte geht. Schneiden Sie das Band zwischen Deckel und Platte in Abständen mit einem Skalpell auf, um den Luftaustausch zu ermöglichen und gleichzeitig die Verdunstung während des Assays zu minimieren.
- Legen Sie die Platte in das Plattenlesegerät ein (siehe Materialtabelle) und starten Sie den Lauf. Ziel ist die Anregung bei 365 nm und die Detektion der Emission bei 435 nm alle 2 min für 6-12 h (Tabelle 1).
HINWEIS: Typischerweise reichen 6 h für 42 °C Hitzestress-Assays und 8 h für 7% t-BHP oxidative Stress-Assays.
6. Datenverarbeitung für Plattenleser
- Speichern Sie die rohen Fluoreszenzdaten aus dem Plattenlesegerät als komma- oder tabulatorgetrennte .txt-, .csv- oder .xls /.xlsx-Format, und konvertieren Sie sie dann in das xls /.xlsx-Format. Organisieren Sie sie je nach Datenformat neu, damit sie dem für die LFASS-Analyse erforderlichen Excel-Tabellenlayout entsprechen. Befolgen Sie die detaillierten Anweisungen in Referenz30.
HINWEIS: Während Daten manuell analysiert werden können, indem jede Zeitreihe normalisiert und nach dem Zeitpunkt gesucht wird, zu dem die Todesfluoreszenz das halbe Maximum erreicht, kann eine automatisierte Analyse in Matlab durchgeführt werden, in dem die LFASS-Routine30 ausgeführt wird. - Laden Sie Matlab (Version 2014a oder höher) und das LFASS-Softwarepaket von https://github.com/ABA80/LFASS herunter und installieren Sie es. Befolgen Sie die darin enthaltenen Richtlinien und Anmerkungen.
ANMERKUNG: Abbildung 1C enthält eine kurze Beschreibung des Ansatzes. Matlab ist erforderlich, um die LFASS-Routine auszuführen. Alternativ kann der Matlab-Code in Oracle übersetzt werden, mit Ausnahme der Fitting-Funktion, die proprietär ist. Neue Glättungs- und Sigmoid-Funktionen können neu geschrieben werden, um die Verwendung in einer vollständig Open-Source-Plattform zu ermöglichen. - Verschieben Sie zwischen LFASS-Analysen die Daten und Ergebnisse an einen neuen Speicherort, da die LFASS-Analyse alle Dateien im Datenordner verarbeitet und Dateien im Ergebnisordner überschreibt.
7. Dateneinsicht
- Öffnen Sie die Excel-Datei und beschriften Sie die Zeilen entsprechend der Well-Position auf der 384-Well-Platte. Die Zusatzdatei 2 zeigt ein Beispiel für die Excel-Datei der Rohfluoreszenzdaten, die für den Hitzeschocktest generiert wurden. Verwenden Sie die Well-Position auf der 384-Well-Platte, um den Wurm und die Bakterienstämme zu kennzeichnen.
- Untersuchen Sie vor der Matlab-Analyse die Daten visuell in Excel und zeichnen Sie die Fluoreszenzintensität im Laufe der Zeit für ein repräsentatives Bohrloch auf. Je nach verwendetem Plattenleser können die Daten verrauscht sein, sollten aber einen deutlichen Peak anzeigen. Besonders:
- Bestimmen Sie einen Fluoreszenzwert, unterhalb dessen sich ein Peak nicht signifikant vom Rauschen unterscheidet (die Festlegung eines solchen Schwellenwerts in LFASS beschleunigt die Analyse durch Ausschluss leerer Bohrlöcher).
- Beachten Sie den frühesten Zeitpunkt, zu dem Fluoreszenzschwankungen vor dem Aufgehen dämpfen (Tiere können bis zu 30 Minuten lang kräftig schlagen, was zu schnell schwankenden blauen Fluoreszenzwerten führt).
HINWEIS: Die Peakanpassung kann verbessert werden, indem diese frühen Zeitpunkte aus dem Kurvenanpassungsfenster ausgeschlossen werden. - Beachten Sie die Zeitpunkte, zwischen denen minimale und maximale Fluoreszenzwerte voraussichtlich fallen werden (schauen Sie sich mehrere Vertiefungen an, um diese Bereiche zu identifizieren), da sie für die Kurvenanpassung verwendet werden.
- Überprüfen Sie, ob die Amplituden der Fluoreszenzpeaks zwischen den Vertiefungen signifikant variieren, normalisieren Sie die Daten vor der weiteren Analyse mit der folgenden Formel:
Normalisierte Fluoreszenzbohrung n (t) = (Fluoreszenzbrunnenn [t] - minimale Fluoreszenzbohrung [Dt]) / (maximale Fluoreszenzbohrung [Dt] - minimale Fluoreszenzmulde [Dt])
Dabei ist "n" die aktuelle Bohrlochzahl, "t" der Zeitpunkt und "Dt" die Reihe von Zeitpunkten für den Assay.
8. LFASS Datenverarbeitung
HINWEIS: Einzelheiten finden Sie auf https://github.com/ABA80/LFASS und in den ergänzenden Materialien von Referenz30.
- Erstellen Sie zwei Unterordner innerhalb des LFASS-Ordners, einen für die zu analysierenden Daten und einen für Ergebnisse, z. B. "Meine Daten" und "Ergebnisse".
- Kopieren Sie die Assay-Excel-Datendatei nach der Dateninspektion in den LFASS-Unterordner "Meine Daten".
- Starten Sie MATLAB, navigieren Sie zum LFASS-Ordner , geben Sie fitfolder ein und führen Sie fitfolder im Befehlsfenster aus (Zusatzdatei 3). Folgen Sie dann den Anweisungen auf dem Bildschirm.
- Nach Eingabe von "fitfolder" fragt das System nach dem Namen des Ordners, in dem sich die Excel-Datei befindet, z.B. "Meine Daten". Geben Sie den Namen Ihres Datenordners ein (in diesem Beispiel "Meine Daten").
- Folgen Sie den Anweisungen auf dem Bildschirm und geben Sie die verschiedenen angeforderten Parameter an.
- Geben Sie "2" für das Zeitintervall zwischen aufeinanderfolgenden Messungen im aktuellen Protokoll ein (wenn Sie dies angeben, können die Ergebnisse in Minuten anstelle von Zeitpunkteinheiten ausgedrückt werden).
HINWEIS: Das Zeitintervall kann geändert werden, um mehr oder weniger häufig Fluoreszenzmessungen durchzuführen (um die Zeitauflösung zu verringern oder zu erhöhen) und auch abhängig von den Fähigkeiten des Plattenlesers (d. H. Das Zeitintervall muss möglicherweise für Plattenleser erhöht werden, die nicht schnell genug Messungen durchführen können). Stellen Sie sicher, dass das experimentelle Zeitintervall immer mit der LFASS-Routine übereinstimmt. - Weisen Sie den oberen Toleranzschwellenwert zu, indem Sie "0,95" eingeben (dies kann nach Bedarf geändert werden, um die Passform zu verbessern) und den unteren Toleranzschwellenwert, indem Sie "0,05" eingeben (dies kann nach Bedarf geändert werden, um die Anpassung zu verbessern), um die Sigmoidanpassung einzuschränken.
HINWEIS: Andere Zeitparameter basieren auf Benutzernotizen aus der Datenprüfung (Schritt 7.2.).
- Geben Sie "2" für das Zeitintervall zwischen aufeinanderfolgenden Messungen im aktuellen Protokoll ein (wenn Sie dies angeben, können die Ergebnisse in Minuten anstelle von Zeitpunkteinheiten ausgedrückt werden).
- Wählen Sie aus, ob angepasste und geglättete Kurven angezeigt werden sollen oder nicht, indem Sie "y" für JA oder "n" für NEIN eingeben, wenn Sie dazu aufgefordert werden. Um die konvergierenden Passungen visuell zu prüfen, wählen Sie die erstere aus.
HINWEIS: Letzteres ist nützlich, um alle geglätteten Daten zu visualisieren, wird aber normalerweise nicht ausgewählt, da es zu viele Popup-Diagramme generiert. Danach führt Matlab die LFASS-Routine aus, was 1-10 Minuten dauern kann, wenn mehrere Excel-Dateien gleichzeitig verarbeitet werden. Popup-Fenster mit Kurven werden entsprechend der Auswahl in Schritt 8.6 angezeigt. Die Zusatzdatei 4A zeigt ein Beispiel für eine angepasste Kurve. - Wählen Sie, ob (1) als Rauschen identifizierte Kurven analysiert oder (2) schlecht angepasste Kurven mit einer Option [y/n] nachgerüstet werden sollen. Geben Sie y ein, um zu genehmigen, und n , um abzulehnen.
HINWEIS: Es wird empfohlen, eine Umrüstung zu genehmigen, insbesondere wenn viele schlecht angepasste oder nicht angepasste Kurven vorhanden sind. Auf diese Weise kann der Benutzer maßgeschneiderte Kurvenanpassungsparameter für jede Kurve angeben, wenn sie auf dem Bildschirm angezeigt wird, und nur nach früheren und späteren Grenzen für die Sigmoidanpassung fragen. Es kann so oft wie nötig versucht werden. - Sobald die Daten analysiert sind, schließen Sie Matlab und öffnen Sie den LFASS-Ordner .
- Klicken Sie auf den LFASS-Unterordner Meine Ergebnisse, da die Ergebnisdateien automatisch im Ergebnisordner als .txt gespeichert werden.
HINWEIS: Matlab generiert drei .txt Dateien: "Batch-fitted.txt", "Batch and noise-fitted.txt" und "Refitted.txt". Die ersten beiden werden als Vorsichtsmaßnahme für den Fall eines Computerabsturzes oder Benutzerfehlers während der Umrüstung gespeichert. Die Datei mit der genauesten vollständigen Analyse ist "Refitted.txt". - Öffnen Sie die Datei Refitted.txt mit Microsoft Excel und speichern Sie sie zur weiteren Verarbeitung als .xls. Die Zusatzdatei 4B zeigt ein Beispiel für eine solche Ergebnisdatei.
HINWEIS: Für jede Vertiefung (in Zeilen organisiert) werden in den Spalten drei Werte angegeben, die Schätzungen der mittleren Todeszeit der Wurmpopulation enthalten: "Raw": meldet die Zeit, die sich beim halben Maximum der experimentellen Datenspitze schneidet; "Batch-fitted": Gibt die Zeit an, die sich am halben Maximum der Batch-angepassten Kurve schneidet; "Refitted": Gibt die Zeit an, die sich am halben Maximum der neu angepassten Kurve schneidet. - Speichern Sie die Datei im .xls Format als Kopie an einem sicheren Ort. Andernfalls besteht die Gefahr, dass die Dateien beim nächsten Durchlauf der LFASS-Routine überschrieben werden.
HINWEIS: Die Ergebnisse können dann für die grafische Darstellung oder statistische Analyse weiterverarbeitet werden.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
LFASS-Assays bieten ein robustes, hohes Durchsatz- und schnelles Screening mehrerer Testbedingungen gleichzeitig, wie z. B. das Screening zahlreicher genetischer und Mikrobiota-Parameter, die zu Stressresistenz und Alterung beitragen. Es dauert nur 2-3 Wochen, bis das Experiment einen umfangreichen Datensatz mit mehreren Testbedingungen erhält. L4 + 36 h adulte Wildtyp-Wurmpopulationen wurden nach einer 36-stündigen Kultur an 48 Darmmikrobienisolaten für 36 h 42 °C thermischem Stress und 7% t-BHP-induziertem oxidativ...
Access restricted. Please log in or start a trial to view this content.
Diskussion
C. elegans bietet aufgrund seiner geringen Größe, Transparenz, schnellen Entwicklung, kurzen Lebensdauer, kostengünstigen und einfachen Handhabung viele Vorteile für das schnelle Screening mehrerer experimenteller Parameter auf einmal. Sein wesentlich einfacheres Genom, Körperplan, Nervensystem, Darm und Mikrobiom, aber komplex und ähnlich genug wie der Mensch, machen es zu einem leistungsstarken präklinischen Modell, in dem mechanistische Erkenntnisse gewonnen werden können, während bioaktive Wirksamke...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken dem CGC Minnesota (Madison, USA, NIH - P40 OD010440) für die Bereitstellung von Wurmstämmen und OP50 und Prof. Hinrich Schulenburg (CAU, Kiel, Deutschland) für die Bereitstellung aller hier abgebildeten Umweltmikrobiellen Isolate. Diese Arbeit wurde durch einen UKRI-BBSRC-Zuschuss an AB finanziert (BB/S017127/1). JM wird durch ein FHM-PhD-Stipendium der Lancaster University finanziert.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 10 cm diameter plates (Non-vented) | Fisher Scientific | 10720052 | Venting is not necessary for bacterial cultures |
| 15 cm diameter plates (Vented) | Fisher Scientific | 168381 | |
| 384-well black, transparent flat bottom plates | Corning | 3712 or 3762 | Not essential to be sterile for fast stress assays |
| 6 cm diameter plates (Vented) | Fisher Scientific | 150288 | Venting is necessary for worm cultures to avoid hypoxia |
| 96-well transparent plates (Biolite) | Thermo | 130188 | |
| Agar (<4% ash) | Sigma-Aldrich | 102218041 | Good quality agar is important for the structural integrity of the culture media, to avoid worm burrowing |
| Agarose | Fisher Scientific | BP1356 | |
| Avanti Centrifuge J-26 XP | Beckman coulter | ||
| Bleach | Honeywell | 425044 | |
| Calcium chloride | Sigma-Aldrich | C5080 | |
| Centrifuge 5415 R | Eppendorf | ||
| Centrifuge 5810 R | Eppendorf | ||
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB agar | Difco | 240110 | |
| LB broth | Invitrogen | 12795084 | |
| LoBind tips | VWR | 732-1488 | Lo-bind reduce worm loss during transfers |
| LoBind tubes | Eppendorf | 22431081 | |
| Magnesium sulfate | Fisher Scientific | M/1100/53 | |
| Plate reader- infinite M nano+ | Tecan | Monochromator setup enables fluorescence tuning but adequate filter-based setups may be used | |
| Plate reader- Spark | Tecan | ||
| Potassium phosphate monobasic | Honeywell | P0662 | |
| Sodium chloride | Sigma-Aldrich | S/3160/63 | |
| Stereomicroscope setup with transillumination base | Leica | MZ6, or M80 | Magnification from 0.6-0.8x up to 40-60x is necessary, as is a good quality transillumination base with a deformable, titable or slidable mirror to adjust contrast |
| t-BHP (tert-Butyl hydroperoxide) | Sigma-Aldrich | 458139 | |
| Transparent adhesive seals Nunc | Fisher Scientific | 101706871 | It is important that it is transparent and that it can tolerate the temperatures involved in the assays. |
| Tryptophan | Sigma-Aldrich | 1278-7099 | |
| Yeast extract | Fisher Scientific | BP1422 |
Referenzen
- Krishna, S., et al. Integrating microbiome network: establishing linkages between plants, microbes and human health. The Open Microbiology Journal. 13, 330-342 (2019).
- Amon, P., Sanderson, I. What is the microbiome. Archives of Disease in Childhood - Education & Practice Edition. 102 (5), 257-260 (2017).
- Belkaid, Y., Harrison, O. J. Homeostatic immunity and the microbiota. Immunity. 46 (4), 562-576 (2017).
- Cabreiro, F., Gems, D. Worms need microbes too: microbiota, health and aging in Caenorhabditis elegans. EMBO Molecular Medicine. 5 (9), 1300-1310 (2013).
- Vaga, S., et al. Compositional and functional differences of the mucosal microbiota along the intestine of healthy individuals. Scientific Reports. 10 (1), 14977(2020).
- Nagpal, R., et al. Gut microbiome and aging: Physiological and mechanistic insights. Nutrition and Healthy Aging. 4 (4), 267-285 (2018).
- Mitsuoka, T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 33 (3), 99-116 (2014).
- Bonfili, L., et al. Microbiota modulation as preventative and therapeutic approach in Alzheimer's disease. The FEBS Journal. 288 (9), 2836-2855 (2021).
- Vendrik, K. E. W., et al. Fecal microbiota transplantation in neurological disorders. Frontiers in Cellular and Infection Microbiology. 10, 98(2020).
- Wang, Q., et al. The role of gut dysbiosis in Parkinson's disease: mechanistic insights and therapeutic options. Brain. 144 (9), 2571-2593 (2021).
- Zhu, X., et al. The relationship between the gut microbiome and neurodegenerative diseases. Neuroscience Bulletin. 37 (10), 1510-1522 (2021).
- Miller, I. The gut-brain axis: historical reflections. Microbial Ecology in Health and Disease. 29 (1), 1542921(2018).
- Foster, J. A., Rinaman, L., Cryan, J. F. Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress. 7, 124-136 (2017).
- Coman, V., Vodnar, D. C. Gut microbiota and old age: Modulating factors and interventions for healthy longevity. Experimental Gerontology. 141, 111095(2020).
- Conway, J., Duggal, N. A. Ageing of the gut microbiome: Potential influences on immune senescence and inflammageing. Ageing Research Reviews. 68, 101323(2021).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10 (8), 1998-2009 (2016).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans Microbiome Resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: gateway to a new host-microbiome model. BMC Biology. 14, 38(2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Felix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Zimmermann, J., et al. The functional repertoire contained within the native microbiota of the model nematode Caenorhabditis elegans. The ISME Journal. 14 (1), 26-38 (2020).
- Dinic, M., et al. Host-commensal interaction promotes health and lifespan in Caenorhabditis elegans through the activation of HLH-30/TFEB-mediated autophagy. Aging. 13 (6), 8040-8054 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against alpha-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Hacariz, O., Viau, C., Karimian, F., Xia, J. The symbiotic relationship between Caenorhabditis elegans and members of its microbiome contributes to worm fitness and lifespan extension. BMC Genomics. 22 (1), 364(2021).
- Shin, M. G., et al. Bacteria-derived metabolite, methylglyoxal, modulates the longevity of C. elegans through TORC2/SGK-1/DAF-16 signaling. Proceedings of the National Academy of Sciences of the United States of America. 117 (29), 17142-17150 (2020).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Zhang, F., et al. High-throughput assessment of changes in the Caenorhabditis elegans gut microbiome. Methods in Molecular Biology. 2144, 131-144 (2020).
- Chan, J. P., et al. Using bacterial transcriptomics to investigate targets of host-bacterial interactions in Caenorhabditis elegans. Scientific Reports. 9 (1), 5545(2019).
- Hartsough, L. A., et al. Optogenetic control of gut bacterial metabolism to promote longevity. Elife. 9, 56849(2020).
- Pryor, R., et al. Host-microbe-drug-nutrient screen identifies bacterial effectors of Metformin therapy. Cell. 178 (6), 1299-1312 (2019).
- Benedetto, A., et al. New label-free automated survival assays reveal unexpected stress resistance patterns during C. elegans aging. Aging Cell. 18 (5), 12998(2019).
- Coburn, C., et al. Anthranilate fluorescence marks a calcium-propagated necrotic wave that promotes organismal death in C. elegans. PLOS Biology. 11 (7), 1001613(2013).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Naomi, R., et al. Probiotics for Alzheimer's disease: a systematic review. Nutrients. 14 (1), 20(2021).
- Zheng, S. Y., et al. Potential roles of gut microbiota and microbial metabolites in Parkinson's disease. Ageing Research Reviews. 69, 101347(2021).
- Gill, M. S., Olsen, A., Sampayo, J. N., Lithgow, G. J. An automated high-throughput assay for survival of the nematode Caenorhabditis elegans. Free Radical Biology and Medicine. 35 (6), 558-565 (2003).
- Park, H. -E. H., Jung, Y., Lee, S. -J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Partridge, F. A., et al. An automated high-throughput system for phenotypic screening of chemical libraries on C. elegans and parasitic nematodes. International Journal for Parasitology: Drugs and Drug Resistance. 8 (1), 8-21 (2018).
- Rahman, M., et al. NemaLife chip: a micropillar-based microfluidic culture device optimized for aging studies in crawling C. elegans. Scientific Reports. 10 (1), 16190(2020).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: a quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Brown, A. E., Schafer, W. R. Unrestrained worms bridled by the light. Nature Methods. 8 (2), 129-130 (2011).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652(2017).
- Jushaj, A., et al. Optimized criteria for locomotion-based healthspan evaluation in C. elegans using the WorMotel system. PLoS One. 15 (3), 0229583(2020).
- Nambyiah, P., Brown, A. E. X. Quantitative behavioural phenotyping to investigate anaesthesia induced neurobehavioural impairment. Scientific Reports. 11 (1), 19398(2021).
- Squiban, B., Belougne, J., Ewbank, J., Zugasti, O. Quantitative and automated high-throughput genome-wide RNAi screens in C. elegans. Journal of Visualized Experiments. (60), e3448(2012).
- Zugasti, O., et al. Activation of a G protein-coupled receptor by its endogenous ligand triggers the innate immune response of Caenorhabditis elegans. Nature Immunology. 15 (9), 833-838 (2014).
- Zugasti, O., et al. A quantitative genome-wide RNAi screen in C. elegans for antifungal innate immunity genes. BMC Biology. 14, 35(2016).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten