A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הקרנה בתפוקה גבוהה של מבודדים מיקרוביאליים עם השפעה על בריאות Caenorhabditis elegans
* These authors contributed equally
In This Article
Summary
חיידקי מעיים עשויים להשפיע באופן חיובי או שלילי על בריאות המארח שלהם באמצעות מנגנונים ספציפיים או שמורים. Caenorhabditis elegans היא פלטפורמה נוחה לסינון עבור חיידקים כאלה. הפרוטוקול הנוכחי מתאר סינון בתפוקה גבוהה של 48 חיידקים מבודדים להשפעה על עמידות לעקה של נמטודה, המשמשים כפרוקסי לבריאות התולעים.
Abstract
עם גודלו הקטן, תוחלת החיים הקצרה והגנטיקה הקלה שלו, Caenorhabditis elegans מציע פלטפורמה נוחה לחקר ההשפעה של מבודדים מיקרוביאליים על הפיזיולוגיה של המארח. הוא גם פלואורסצנטי בכחול בעת המוות, ומספק אמצעי נוח לאיתור מוות. נכס זה נוצל לפיתוח מבחני הישרדות C. elegans ללא תוויות בתפוקה גבוהה (LFASS). אלה כוללים רישום פלואורסצנטי בהילוך מהיר של אוכלוסיות תולעים הקבועות בלוחות מרובי בתים, שמהם ניתן לגזור את זמן המוות החציוני של האוכלוסייה. המחקר הנוכחי מאמץ את גישת LFASS לסינון מבודדים מיקרוביאליים מרובים בו-זמנית עבור ההשפעות על הרגישות של C. elegans לחום חמור ולעקות חמצוניות. כאן מדווח על צינור סינון מיקרוביאלי כזה, שניתן להשתמש בו בעיקר כדי לסנן מראש פרוביוטיקה, תוך שימוש בעמידות קשה ללחץ כפרוקסי לבריאות המארח. הפרוטוקול מתאר כיצד לגדל הן את אוספי המיקרוביוטה המבודדת של המעיים C. elegans והן אוכלוסיות תולעים סינכרוניות במערכים מרובי תאים לפני שילובם למבחנים. הדוגמה שסופקה מכסה בדיקה של 47 חיידקים מבודדים וזן בקרה אחד על שני זני תולעים, בשני מבחני עקה במקביל. עם זאת, צינור הגישה ניתן להרחבה בקלות וישים לסינון של שיטות רבות אחרות. לפיכך, הוא מספק מערך רב-תכליתי לסקירה מהירה של נוף רב-פרמטרי של תנאים ביולוגיים וביוכימיים המשפיעים על בריאות C. elegans.
Introduction
בגוף האדם חיים כ-10-100 טריליון תאים מיקרוביאליים חיים (חיידקים, פטריות ארכאיות), המצויים בעיקר בסביבות המעיים, העור והרירית1. במצב בריא, אלה מספקים יתרונות למארח שלהם, כולל ייצור ויטמינים, התבגרות של מערכת החיסון, גירוי של תגובות חיסוניות מולדות ונרכשות לפתוגנים, ויסות חילוף החומרים של השומן, ויסות תגובות ללחץ ועוד, עם השפעה על גדילה והתפתחות, התפרצות מחלות והזדקנות 2,3,4,5 . גם המיקרוביוטה של המעיים מתפתחת במידה ניכרת במהלך החיים. האבולוציה הדרסטית ביותר מתרחשת במהלך הינקות והילדות המוקדמת6, אך שינויים משמעותיים מתרחשים גם עם הגיל, כולל ירידה בשפע ביפידובקטריום ועלייה במינים קלוסטרידיום, לקטובצילוס, אנטרובקטריה ואנטרוקוקוס 7. אורח חיים יכול לשנות עוד יותר את ההרכב המיקרוביאלי של המעיים ולהוביל לדיסביוזיס (אובדן חיידקים מועילים, צמיחת יתר של חיידקים אופורטוניסטיים), וכתוצאה מכך פתולוגיות שונות כגון מחלות מעי דלקתיות, סוכרת והשמנת יתר5, אך גם לתרום למחלות אלצהיימר ופרקינסון 8,9,10,11.
הבנה זו תרמה תרומה קריטית לעידון הרעיון של ציר המעי-מוח (GBA), שבו אינטראקציות בין הפיזיולוגיה של המעיים (כיום כולל המיקרובים שבתוכה) לבין מערכת העצבים נחשבות לווסת העיקרי של חילוף החומרים של בעלי החיים ולתפקודים פיזיולוגיים12. עם זאת, התפקיד המדויק של המיקרוביוטה באיתות בין המעי למוח ומנגנוני הפעולה הקשורים אליו רחוקים מלהיות מובנים במלואם13. מאחר שמיקרוביוטה של המעיים היא גורם מפתח להזדקנות בריאה, האופן שבו חיידקים מווסתים את תהליך ההזדקנות הפך לנושא למחקר אינטנסיבי ולמחלוקת 6,14,15.
עם ההדגמה שהתולעת העגולה Caenorhabditis elegans מארחת מיקרוביוטה של המעי בונפיד הנשלטת - כמו במינים אחרים - על ידי Bacteroidetes, Firmicutes ו- Actinobacteria 16,17,18,19,20, עלייתה המהירה כפלטפורמה ניסיונית לחקר אינטראקציות בין המעי המארח למעיים 21,22,23,24 ,25,26 הרחיב משמעותית את ארסנל החקירות שלנו26,27,28,29. בפרט, ניתן להתאים גישות ניסיוניות בעלות תפוקה גבוהה הזמינות עבור C. elegans לחקר תזונה גנטית, גנים-תרופות, גנים-פתוגנים וכו', כדי לחקור במהירות כיצד חיידקים מבודדים וקוקטיילים משפיעים על הבריאות וההזדקנות של C. elegans.
הפרוטוקול הנוכחי מתאר צינור ניסיוני לסינון בבת אחת של מערכים של חיידקים מבודדים או תערובות שנקבעו בלוחות מרובי בתים להשפעות על עמידות ללחץ C. elegans כפרוקסי לבריאות, אשר ניתן להשתמש בהם כדי לזהות פרוביוטיקה. הוא מפרט כיצד לגדל אוכלוסיות תולעים גדולות ולטפל במערכי חיידקים בתבניות של לוחות 96 ו-384 בארות לפני עיבוד תולעים לניתוח אוטומטי של עמידות בפני עקה באמצעות קורא לוחות פלואורסצנטיים (איור 1). הגישה מבוססת על מבחני הישרדות אוטומטיים ללא תוויות (LFASS)30 המנצלים את תופעת פלואורסצנציית המוות31, לפיה תולעים גוססות מייצרות פרץ של פלואורסצנציה כחולה שניתן להשתמש בה כדי לאתר את זמן המוות. פלואורסצנציה כחולה נפלטת על ידי אסטרים של גלוקוזיל של חומצה אנתרנילית המאוחסנים בגרגרי מעיים של C. elegans (סוג של אברונים הקשורים לליזוזום), אשר מתפוצצים כאשר מפל נמק מופעל במעי התולעת עם המוות31.
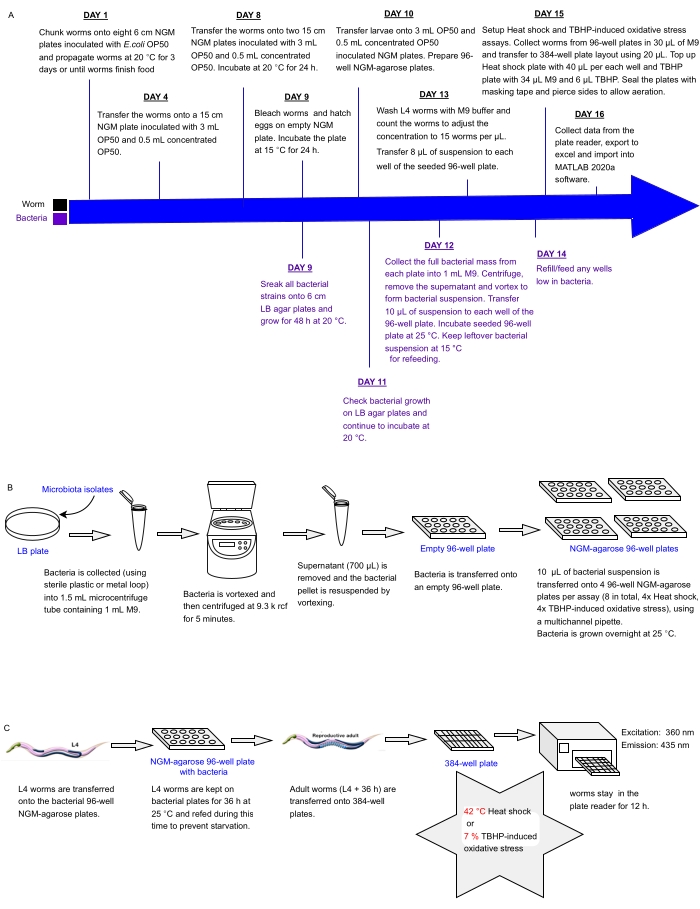
איור 1: זרימת עבודה ניסיונית לסינון בתפוקה גבוהה של חיידקים מבודדים עם השפעה על עמידות C. elegans ללחץ . (A) ציר זמן לתחזוקה והגדרת בדיקה של תולעים וחיידקים. (B) מערך לוחות חיידקים 96 באר התקנה וטיפול. (C) 384-באר צלחת תולעת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
שני זני C. elegans ששימשו במקביל למחקר הנוכחי היו בריסטול N2 מסוג פראי ו-HT1890: daf-16(mgDf50), הגדלים בקצב דומה. עם זאת, ניתן לשכפל את הפרוטוקול עם כל שילוב של שני זנים בעלי קצב צמיחה דומה. שימו לב שכאשר בודקים זנים אחרים במקביל (למשל, מוטנטים מסוג wild ו-daf-2 שגדלים לאט), יש לקחת בחשבון קצבי גדילה שונים, ובהתאם לכך יש להתאים את הפרוטוקול. לוחות הזמנים והכמויות של תולעים וחיידקים בפרוטוקול הבא מותאמים לבדיקה מקבילה של 48 חיידקים מבודדים על שני זני תולעים בשני מבחני LFASS בטטרפליקטים. יידרשו התאמות אם ייבדקו תנאים נוספים במקביל. Escherichia coli זן החיידק OP50 התקבל מהמרכז לגנטיקה של Caenorhabditis (CGC), אוניברסיטת מינסוטה. 48 החיידקים המבודדים התקבלו ממעבדת שולנבורג והוחזקו על אגר LB.
1. C. elegans culturing על OP50 (ימים 1 - 8)
הערה: הגישה הנוכחית שואפת לגדל הרמפרודיטים של C. elegans על מדיום מוצק בכל השלבים ולהימנע משינויים תזונתיים מיותרים (כלומר, שימוש בזני E. coli חלופיים הגדלים מהר יותר כגון NA22 או מדיית גדילה עשירה יותר כגון צלחות ביצים) כדי להישאר קרובים ככל האפשר לתנאי הגידול הסטנדרטיים32,33 שעדיין נמצאים בשימוש נרחב. טמפרטורת גדילת התולעת (כאן נקבעת על 15 מעלות צלזיוס) תלויה בזנים C. elegans המשמשים וייתכן שיהיה צורך בכוונון (למשל, כדי למנוע או להפעיל ביטוי של פנוטיפ רגיש לטמפרטורה או סמן ביולוגי). למידע על גידול תולעים, ראו הפניהמס' 33.
- הכינו שמונה צלחות NGM בקוטר 6 ס"מ (10 מ"ל של אגר מדיה לגידול נמטודה, NGM, קובץ משלים 1)32,33 לכל זן תולעת ותנו להן להתייבש במשך יום אחד בטמפרטורת החדר.
- הכינו תרבית נוזלית רוויה של חיידקי E. coli OP50 על ידי זריעת שיבוט חיידקי יחיד מצלחת אגר מרק ליזוגני טרי (LB agar, קובץ משלים 1) ב-25 מ"ל של מדיום OP50 (קובץ משלים 1) בצינור חרוטי של 50 מ"ל. לגדל את התרבית למשך הלילה בטמפרטורה של 37 מעלות צלזיוס באינקובטור שייקר.
- יש לחסן את שמונה צלחות ה-NGM בקוטר 6 ס"מ לכל זן עם 100 μL של תרבית נוזלית רוויה של E. coli OP50 לכל צלחת ולשמור את הצלחות בטמפרטורה של 20°C למשך יומיים לפני השימוש.
- בעזרת אזמל, חותכים ומעבירים נתח אגר מרובע של 0.5 ס"מ עם תולעים מצלחת NGM שהורעבה לאחרונה על כל אחת משמונה צלחות ה-NGM המחוסנות בקוטר 6 ס"מ ומדגרים את הצלחות הללו בטמפרטורה של 20 מעלות צלזיוס למשך 3 ימים (או עד שהתולעים מסיימות את האוכל).
- הכינו חמש צלחות NGM בקוטר 15 ס"מ לכל זן תולעת (30 מ"ל בינוני NGM לצלחת) וחסנו ב-3 מ"ל OP50. תנו לצלחות להתייבש לפני הדגירה בטמפרטורה של 37 מעלות צלזיוס למשך הלילה. יש לשמור את הצלחות על 20°C עד לשימוש בשלבים מאוחרים יותר.
- באמצעות פיפטה P-1000, הוסף עד 3 מ"ל של מאגר M9 סטרילי (קובץ משלים 1) ללוחות NGM בגודל 6 ס"מ (שלב 1.1.) כדי להשהות את התולעים, ואסוף את תמיסת התולעת מכל שמונה הצלחות לכל זן בצינור חרוטי יחיד של 15 מ"ל.
- צנטריפוגה ב 142 x גרם במשך 2 דקות ב 4 מעלות צלזיוס. הסר בזהירות את הסופרנטנט באמצעות פיפטה P-5000 או משאבת מים המצוידת בפיפטה או קצה פסטר סטרילי. הוסף 10 מ"ל של חיץ M9 סטרילי כדי לשטוף את כדור התולעת. חזור על 2x.
- הסר את הסופר-נאטנט (ככל האפשר) והעבר את התולעים לצלחת NGM מחוסנת OP50 בגודל 15 ס"מ (שלב 1.5.) באמצעות פיפטה. הוסף 0.5 מ"ל של תרבית OP50 מרוכזת.
- כדי ליצור OP50 מרוכז, יש לחסן כל אחד מארבעת בקבוקי ה-LB בנפח 1 ליטר עם 2 מ"ל של תרבית המתנע OP50 (שהוכנה בשלב 1.2.), ולגדול באינקובטור רועד במשך 6 שעות ב-37 מעלות צלזיוס ו-160 x גרם. גלולה את החיידקים ב 3057 x g ו 20 מעלות צלזיוס במשך 15 דקות. להשליך את supernatant, resuse את כדורי חיידקי עם 6 מ"ל של OP50 בינוני, ולאסוף בצינור סטרילי 50 מ"ל חרוטי.
הערה: ניתן לאחסן חיידקים בטמפרטורה של 4 מעלות צלזיוס למשך עד שבוע.
- לגדל כל זן תולעת על צלחת NGM בקוטר 15 ס"מ במשך 3-4 ימים בטמפרטורה של 15 מעלות צלזיוס על ידי הזנה מחדש של התולעים עם 0.5 מ"ל של OP50 מרוכז מדי יום.
- לאחר שהתולעים כמעט סיימו את המזון, אספו ושטפו במאגר M9 (שלב 1.6.1.), העבירו כל תרבית זן תולעים לשתי צלחות NGM בגודל 15 ס"מ (שלב 1.5.), והפיצו תולעים בטמפרטורה של 20 מעלות צלזיוס עד ~95% מהאוכלוסייה הם בוגרים גרבידיים (זה ייקח בערך 24 שעות עבור בריסטול N2 מסוג בר).
הערה: בוגרים גרבידים מאופיינים בנוכחות ביצים בתוך התולעת, והצלחת האידיאלית צריכה להכיל גם שפע של ביצים לא מבוקעות המוטלות על הצלחת ללא יותר מדי זחלים33.
- לאחר שהתולעים כמעט סיימו את המזון, אספו ושטפו במאגר M9 (שלב 1.6.1.), העבירו כל תרבית זן תולעים לשתי צלחות NGM בגודל 15 ס"מ (שלב 1.5.), והפיצו תולעים בטמפרטורה של 20 מעלות צלזיוס עד ~95% מהאוכלוסייה הם בוגרים גרבידיים (זה ייקח בערך 24 שעות עבור בריסטול N2 מסוג בר).
2. שמירה על אוספי מיקרוביוטה מבודדת של המעיים (יום 9)
- פסו את 48 החיידקים המבודדים על צלחות אגר בודדות של 6 ס"מ LB וגדלו במשך 48 שעות בטמפרטורה של 20 מעלות צלזיוס.
הערה: ניתן לגדל חיידקים בטמפרטורה של 25 מעלות צלזיוס למשך 24-36 שעות במידת הצורך מוקדם יותר, אך הגדילה הארוכה יותר של 20 מעלות צלזיוס מאפשרת לזהות מזהמים פוטנציאליים. - סנכרן מספר רב של C. elegans.
- אקונומיקה גרבדה תולעים בוגרות על ידי ביצוע שיטת הכנת הביציםהסטנדרטית 33 והעברת הביצים על שתי צלחות NGM לא מזוהמות בגודל 15 ס"מ למשך 24 שעות ב-15 מעלות צלזיוס כדי לאפשר לכל זחלי L1 לבקוע ולגדול באופן סינכרוני בשלבים הבאים.
התראה: היזהר בעת טיפול בתמיסות אקונומיקה.
- אקונומיקה גרבדה תולעים בוגרות על ידי ביצוע שיטת הכנת הביציםהסטנדרטית 33 והעברת הביצים על שתי צלחות NGM לא מזוהמות בגודל 15 ס"מ למשך 24 שעות ב-15 מעלות צלזיוס כדי לאפשר לכל זחלי L1 לבקוע ולגדול באופן סינכרוני בשלבים הבאים.
3. גידול תרבויות C. elegans גדולות (יום 10)
- לאחר הבקיעה, אספו את זחלי L1 (משלב 2.2.1.) ב-3-4 מ"ל של M9 בצינור חרוטי נקי של 15 מ"ל. שופכים ארבע טיפות של 10 μL של תמיסת תולעת על שקופית או צלחת וסופרים את מספר התולעים בכל טיפה תחת סטריאומיקרוסקופ בהגדלה של פי 16. קבע את ריכוז התולעים של התמיסה על ידי ממוצע מספר הזחלים מכל טיפות תמיסת התולעת. הכפל ערך זה בנפח שנותר והערך את ספירת התולעים הכוללת עבור כל זן.
הערה: 46,000-50,000 זחלי L1 לכל זן נדרשים בשלב זה כדי למלא מאוחר יותר צלחת של 384 בארות או שני חצאי צלחות.- עבור כל זן, העבירו את כל זחלי L1 לשני לוחות NGM בקוטר 15 ס"מ (23,000-25,000 L1 לצלחת) שחוסנו בעבר ב-3 מ"ל של OP50 (שלב 1.5.) ונזרעו מחדש עם 0.5 מ"ל של OP50 מרוכז.
- יש לדגום בטמפרטורה של 15 מעלות צלזיוס, עם 0.5 מ"ל של OP50 מרוכז מדי יום לפי הצורך עד שהתולעים מגיעות לשלב L4.
הערה: שלב L4 מאופיין במעי מעט כהה יותר ובכתם לבן בצורת חצי דיסק או סהר שבו הפות ייווצר בסופו של דבר32,33. - הכינו 96 צלחות NGM-agarose לפי השלבים הבאים.
- הכינו שמונה צלחות NGM-agarose בעלות 96 בארות על ידי מילוי כל באר ב-125 μL של NGM-agarose (ארבע צלחות בכל בדיקה).
הערה: מומלץ לצלוח כמה צלחות נוספות אם חלקן מזוהמות בשלבים הבאים. שני קוראי לוחות יידרשו להריץ מבחנים במקביל, אך הם עשויים גם להיות מופעלים ברצף החל מבדיקת עקת החום מכיוון שניתן להריץ אותה במשך 6 שעות בלבד. עבור צלחות אלה, אגר אפר <4% מוחלף באגרוז (ראו טבלת חומרים), מה שמאפשר ייבוש איטי ואחיד יותר על פני תקעי ה-NGM ומפחית את מחילה של התולעים להתאוששות טובה יותר. - יש לוודא שהבארות מלאות באופן שווה וללא בועות. השתמש בלוק חום שנקבע על 70 °C (עם העברת חום איטית דרך הפלסטיק של צלחת multiwell, NGM-agarose יכול רק להתחמם עד כ 55-60 ° C) כדי למנוע את התערובת מלהתמצק במהלך התהליך. כדי להסיר בועות בתוך בארות, השתמש במחט סטרילית מחוממת להבה.
- אפשרו ללוחות 96 הבארות להתייצב בטמפרטורת החדר בסביבה סטרילית לפני ההיפוך (המכסה כלפי מטה למניעת עיבוי) ואחסנו בטמפרטורה של 4 מעלות צלזיוס בקופסה נקייה עד הצורך.
- הכינו שמונה צלחות NGM-agarose בעלות 96 בארות על ידי מילוי כל באר ב-125 μL של NGM-agarose (ארבע צלחות בכל בדיקה).
- ביום 11, בדוק את התולעים משלב 3.2., וודא שלא הופיעו זיהומים והתולעים עדיין גדושות.
- ביום 12, בדוק את התולעים משלב 3.1., וודא שלא הופיעו זיהומים והתולעים עדיין גדושות. כמו כן, בדקו את השלב ההתפתחותי של התולעים.
הערה: המין/זן והשלב ההתפתחותי של התולעת, כגון L4 או L4 + 24 שעות שבהן נעשה שימוש, תלויים בטיפולים שהתולעים עוברות. כאן, הרמפרודיטים מסוג בר נחשפו לחיידקים מבודדים מ-L4 במשך 36 שעות.
4. הכנת אוספי מיקרוביוטה מבודדים של המעיים להאכלה מחדש של תולעים
- עקוב אחר צמיחת חיידקים על לוחות אגר LB משלב 2.1. ולהמשיך לדגור ב 20 מעלות צלזיוס.
הערה: למרות שזה לא אידיאלי, במקרה שחלק מהשיבוטים אינם גדלים או חושפים זיהומים, חיידקים עשויים להיות מפוספסים מחדש ממלאי נקי על צלחות של 6 ס"מ LB ולגדל אותם בטמפרטורה של 25-28 מעלות צלזיוס למשך 24 שעות כדי להיות מוכנים לניסוי. - הגדר מערך של 96 בארות עבור איסוף החיידקים הנבדקים, ואפשר זריעת צלחות שיטתית וניתוח נתונים בשלבים הבאים (טבלה משלימה 1).
- אסוף את מסת החיידקים מכל צלחת חיידקים בגודל 6 ס"מ (שלב 4.1.), והעבר אותה לצינור מיקרוצנטריפוגה מסומן בגודל 1.5 מ"ל המכיל 1 מ"ל של מאגר M9. בצע זאת באמצעות לולאת פלסטיק סטרילית חד-פעמית בקוטר 2 מ"מ או לולאת מתכת בקוטר 5 מ"מ. יש לעקר את לולאת המתכת בין זני חיידקים על ידי טבילה ב-100% אתנול, בעירה והתקררות למשך 5 שניות.
- מערבבים את צינורות המיקרוצנטריפוגה עד שכדורי החיידקים עוברים החייאה מלאה (בהתאם לזן החיידקים, זה עשוי לקחת ~ 1-10 שניות).
- סובבו מטה ב-9,300 x גרם למשך 5 דקות בטמפרטורת החדר, הסירו 700 μL של סופר-נטנט, ושתו מחדש את כדור החיידקים על ידי מערבולת.
- העבר 200 μL של כל תרחיף חיידקים לתוך באר אחת של צלחת סטרילית ריקה 96-well בהתאם לפריסה שנקבעה בשלב 4.2.
- מצלחת זו, יש לחסן שמונה צלחות NGM-agarose בעלות 96 בארות (שהוכנו בשלב 3.3.) עם 10 μL של תמיסת חיידקים באמצעות פיפטה רב-ערוצית ודגירה עם המכסה בטמפרטורה של 25 מעלות צלזיוס למשך 24 שעות. אין לאטום את הלוחות כדי לאפשר ייבוש צלחות וצמיחה אירובית חיידקית וכדי למנוע עיבוי עודף.
- אטמו את לוחית המתלים בעלת 96 הבארות שהוכנה בשלב 4.6. עם סרט איטום דבק נקי (ראו טבלת חומרים), ולאחסן בטמפרטורה של 15°C למשך עד 5 ימים. זה ישמש להזנה מחדש של תולעים לפי הצורך.
5. הלם חום LFASS ומערך בדיקה חמצונית (ימים 13 - 14)
- כשמסתכלים על הצלחות משלב 3.5., מעריכים את השלב ההתפתחותי של התולעים. לאחר ש->90% מהתולעים הגיעו ל-L434, אספו את התולעים בעד 10 מ"ל של תמיסת M9 סטרילית בצינורות חרוטיים של 15 מ"ל.
- שטפו את התולעים באופן נרחב (לפחות 4x) על ידי סיבוב בטמפרטורה של 142 x g למשך 2 דקות בטמפרטורה של 4 מעלות צלזיוס, הסרת הסופר-נטנט והוספת 10 מ"ל של M9 סטרילי טרי בין כל שטיפה כדי להיפטר מחיידקי OP50. לתלות את כדור התולעת ב 10 מ"ל של M9.
- העבר 50 μL של תמיסת תולעת לתוך צינור קשירה נמוך פני השטח (ראה טבלת חומרים) המכיל 950 μL של M9. לאחר ערבוב עדין של תכולת הצינור כדי למנוע שקיעה של תולעים, השתמש במהירות בקצה פיפטה רטוב בעל קשר נמוך כדי להעביר 3-4 טיפות נפרדות של 10 μL על שקופית זכוכית או צלחת NGM, וספור מספרי תולעים תחת סטריאומיקרוסקופ (ראו טבלת חומרים) בהגדלה של פי 16. ממוצע הספירות מ-3-4 הטיפות וקביעת מספר התולעים למיקרוליטר בתמיסת התולעת (ראה שלב 3.1.).
- התאם את ריכוז התולעים בצינור 10 מ"ל כדי להגיע ל~ 120 תולעים ב 8 μL. אם הפתרון הוכן בשלב 5.2. אינו מרוכז מספיק, סובב את התולעים כלפי מטה והסר M9 בהתאם כדי להגיע ל -120 תולעים לכל 8 μL.
- העבר 8 μL של תמיסת תולעת (~ 120 תולעים) לתוך כל אחת מהבארות של שמונה לוחות NGM-agarose 96-well משלב 4.7., באמצעות פיפט רב ערוצי או פיפט חוזר. הקפד להשתמש בעצות שמירה נמוכות כדי להגביל את אובדן התולעים. ייתכן שיהיה צורך גם לחתוך את קצוות הקצוות כדי לאפשר לתולעים בוגרות גדולות להגביל את הלחץ המכני על תולעים בוגרות.
הערה: הבדיקה דורשת מינימום של 30 תולעים בריאות חיות כדי לעבוד באופן אמין, אך פועלת בצורה הטובה ביותר עם כ-100 תולעים לכל באר. - דגרו את צלחות ה-NGM-agarose של 96 זרעים של תולעת וחיידק בטמפרטורה של 25 מעלות צלזיוס למשך 36 שעות.
- בדקו את הצלחות בין 12-24 שעות, וודאו שהתולעים נשארות גדושות לאורך כל הדרך. אם יש צורך בהזנה חוזרת, יש להשעות את החיידקים בתוך צלחת מערך החיידקים של 96 באר המאוחסנת בטמפרטורה של 15 מעלות צלזיוס בשלב 4.8., ולהוסיף עד 10 μL של התמיסה החיידקית המתאימה ללוחות NGM-agarose 96-well שבהם התולעים נמצאות בסיכון לרעב לפני תום תקופת הדגירה של 36 שעות (תולעים מורעבות יפיקו תוצאות שונות בתכלית, אז זה מאוד חשוב).
הערה: השלבים הבאים צריכים להתבצע ביום 15. לפני תחילת הבדיקה, ייתכן שיהיה צורך לייעל את גובה הקריאה. הקריאה האופטימלית תושג 20-50 מיקרומטר מעל תחתית הבאר. זה יהיה תלוי בדגם של קורא הלוחות. חלקם מציעים את האפשרות של סריקת Z, בעוד שאחרים מאפשרים קלט גובה ידני. הגדר את הגובה האופטימלי ברמה שבה מזוהה האות הפלואורסצנטי הכחול הגבוה ביותר (365 ננומטר/430 ננומטר). קוראי לוחות מסוימים עשויים לפעול בגובה קבוע הממוטב למבחני תא דבק וייתכן שאינם אידיאליים למבחני LFASS. - לאחר 36 שעות, יש לחלק 30 μL של M9 לתוך כל באר של צלחת 96 באר.
הערה: עבור מבחני לחץ תרמי, קורא הלוחות צריך להגיע לטמפרטורה הנדרשת לביצוע הבדיקה וייתכן שיהיה צורך להפעיל אותו מראש. הפרוטוקול הנוכחי משתמש ב-42 מעלות צלזיוס כדי למקסם את מהירות ההרג, אך הגישה חלה על טמפרטורות אחרות מעל 30 מעלות צלזיוס. - העבירו תולעים (כ-20 μL) לצלחת 384 הבאר בהתאם לפריסות שנקבעו, תוך שימוש בקצוות בעלי שימור נמוך (שקלו לחתוך את קצה הקצוות כדי לאפשר לתולעים גדולות להפחית את הלחץ המכני עבור תולעים בוגרות).
הערה: במחקר הנוכחי, שתי הגדרות שונות של קורא צלחות משמשות עבור שני המבחנים המתוארים כאן (עקה תרמית ועקה חמצונית), ולכן דגימות המיועדות לשני מבחנים אלה אינן חייבות להיות מצופות באותה צלחת 384 באר. - ודא שקוראי הלוחות מוגדרים כהלכה (טבלה 1).
- השלם את לוחות 384 הבאר עם יותר M9, בשאיפה לנפח סופי של 60 μL לכל באר. עבור בדיקת עקה תרמית, הוסף 40 μL של M9, ועבור עקה חמצונית הנגרמת על-ידי t-BHP, הוסף 34 μl של M9 ב- 6 μl של t-BHP (ראה טבלת חומרים).
- התחל את הבדיקה תוך 2 דקות מהוספת t-BHP (באופן אידיאלי, כל התולעים חייבות להיות חשופות ל- t-BHP בו זמנית, כאשר רזולוציית זמן הבדיקה היא 2 דקות). אם הדבר אינו אפשרי, השתמש בטיימר כדי להעריך את הזמן המושקע בצנרת t-BHP לפני תחילת הבדיקה כדי לאפשר התאמה מאוחרת יותר של זמן המוות החציוני.
- סגרו את הצלחות עם המכסה השקוף שלהן. אטמו את הקצוות של לוחות 384 בארות עם סרט מיסוך (הקשה על הצלחת והמכסה), כדי לוודא שהסרט לא יעבור מעל המכסה או מתחת לצלחת. חותכים את הסרט בין המכסה לצלחת במרווחי זמן באמצעות אזמל כדי לאפשר חילופי אוויר תוך מזעור האידוי במהלך הבדיקה.
- הכנס את הלוח לקורא הלוחות (ראה טבלת חומרים) והתחל את הריצה. יש לשאוף להלהיב במהירות של 365 ננומטר ולזהות פליטה ב-435 ננומטר כל 2 דקות למשך 6-12 שעות (טבלה 1).
הערה: בדרך כלל, 6 שעות מספיקות למבחני עקת חום של 42 מעלות צלזיוס ו-8 שעות למבחני עקה חמצונית של t-BHP ב-7%.
6. טיפול בנתונים של קורא צלחות
- שמור את נתוני הפלואורסצנציה הגולמיים מקורא הלוחות כתבניות .txt, .csv או .xls /.xlsx המופרדות באמצעות פסיקים או טאבים, ולאחר מכן המר לתבנית xls /.xlsx. בהתאם לתבנית הנתונים, ארגן אותם מחדש כך שיתאימו לפריסת גיליון Excel הדרושה לניתוח LFASS. בצע את ההוראות המפורטות המופיעות בהפניה30.
הערה: בעוד שניתן לנתח נתונים באופן ידני, לנרמל כל סדרת זמן ולחפש את הזמן שבו פלואורסצנטיות המוות מגיעה למחצית המקסימום, ניתוח אוטומטי יכול להתבצע ב- Matlab המפעילה את שגרת LFASS30. - הורד והתקן את Matlab (גרסה 2014a ומעלה) ואת חבילת התוכנה LFASS מבית https://github.com/ABA80/LFASS. עקוב אחר ההנחיות והביאורים המופיעים בו.
הערה: איור 1C נותן תיאור קצר של הגישה. Matlab נדרשת להפעיל את שגרת LFASS. לחלופין, ניתן לתרגם את קוד Matlab ל-Oracle, למעט פונקציית ההתאמה, שהיא קניינית. ניתן לשכתב פונקציות החלקה וסיגמואידים חדשות כדי לאפשר שימוש בפלטפורמת קוד פתוח לחלוטין. - בין ניתוחי LFASS, העבר את הנתונים והתוצאות למיקום חדש מכיוון שניתוח LFASS יעבד את כל הקבצים בתיקיית הנתונים ויחליף קבצים בתיקיה 'תוצאות'.
7. בדיקת נתונים
- פתח את קובץ האקסל ותייג את השורות בהתאם למיקום הבאר בלוח 384 הבאר. קובץ משלים 2 מציג דוגמה לקובץ האקסל של נתוני הפלואורסצנציה הגולמיים שנוצרו עבור בדיקת הלם החום. השתמש במיקום הבאר על צלחת 384-well כדי לסמן את התולעת ואת זני החיידקים.
- לפני ניתוח Matlab, בדוק חזותית את הנתונים באקסל, והתווה עוצמת פלואורסצנטיות לאורך זמן עבור באר מייצגת. בהתאם לקורא הצלחות שבו נעשה שימוש, הנתונים עשויים להיות רועשים אך אמורים להציג שיא ברור. בפרט:
- קבע ערך פלואורסצנטי שמתחתיו שיא לא יהיה שונה באופן משמעותי מרעש (קביעת סף כזה ב- LFASS תאיץ את הניתוח על ידי אי הכללת בארות ריקות).
- שימו לב לנקודת הזמן המוקדמת ביותר שבה תנודות פלואורסצנטיות נרגעות לפני העלייה (בעלי חיים עשויים לדהור במרץ במשך עד 30 דקות, מה שמוביל לתנודות מהירות של קריאות פלואורסצנטיות כחולות).
הערה: ניתן לשפר את התאמת השיא על-ידי אי-הכללת נקודות זמן מוקדמות אלה מחלון התאמת העקומה. - שים לב לנקודות הזמן שביניהן צפויים לרדת ערכי פלואורסצנציה מינימליים ומקסימליים (עיין במספר בארות כדי לזהות טווחים אלה) מכיוון שהם ישמשו להתאמת עקומות.
- בדוק אם המשרעת של פסגות הפלואורסצנציה משתנות באופן משמעותי בין הבארות, לנרמל את הנתונים לפני ניתוח נוסף באמצעות הנוסחה הבאה:
פלואורסצנציה מנורמלת היטב n (t) = (פלואורסצנציה היטבn [t] - מינימום פלואורסצנציה היטב [Dt]) / (פלואורסצנציה מקסימלית היטב [Dt] - מינימום פלואורסצנציה היטב [Dt])
כאשר "n" הוא מספר הבאר הנוכחי, "t" הוא נקודת הזמן, ו- "Dt" היא סדרת נקודות הזמן עבור הבדיקה.
8. עיבוד נתונים LFASS
הערה: הפרטים מופיעים https://github.com/ABA80/LFASS ובחומרים המשלימים של הפניה30.
- צור שתי תיקיות משנה בתוך תיקיית LFASS, אחת לניתוח הנתונים ואחת לתוצאות, לדוגמה, "הנתונים שלי" ו"תוצאות ".
- העתק את קובץ הנתונים של Excel לבדיקת תיקיית המשנה LFASS "הנתונים שלי" לאחר בדיקת נתונים.
- הפעל את MATLAB, נווט לתיקיית LFASS , הקלד והפעל את fitfolder בחלון הפקודה (קובץ משלים 3). לאחר מכן בצע את ההוראות המופיעות על המסך.
- לאחר הקלדת "fitfolder", המערכת מבקשת את שם התיקייה שבה נמצא קובץ ה- Excel, לדוגמה, 'הנתונים שלי'. הקלד את שם תיקיית הנתונים שלך (בדוגמה זו, "הנתונים שלי").
- בצע את ההוראות המופיעות על המסך, וספק את הפרמטרים השונים המבוקשים.
- הזן "2" עבור מרווח הזמן בין מדידות עוקבות בפרוטוקול הנוכחי (ציון זה מאפשר לבטא את התוצאות בדקות במקום ביחידות נקודת זמן).
הערה: ניתן לשנות את מרווח הזמן כדי לבצע מדידות פלואורסצנטיות בתדירות גבוהה יותר או פחות (כדי להקטין או להגדיל את רזולוציית הזמן) וגם בהתאם ליכולות קורא הלוחות (כלומר, ייתכן שיהיה צורך להגדיל את מרווח הזמן עבור קוראי לוחות שאינם יכולים לבצע מדידות מהירות מספיק). הקפידו תמיד להתאים את מרווח הזמן הניסיוני לשגרת LFASS. - הקצה את סף הסבילות העליון על ידי הקלדת "0.95" (ניתן לשנות זאת לפי הצורך כדי לשפר את ההתאמה) ואת סף הסבילות התחתון על ידי הקלדת "0.05" (ניתן לשנות זאת לפי הצורך כדי לשפר את ההתאמה) כדי להגביל את ההתאמה הסיגמואידית.
הערה: פרמטרי זמן אחרים מבוססים על הערות משתמש מבדיקת הנתונים (שלב 7.2.).
- הזן "2" עבור מרווח הזמן בין מדידות עוקבות בפרוטוקול הנוכחי (ציון זה מאפשר לבטא את התוצאות בדקות במקום ביחידות נקודת זמן).
- בחר אם להציג או לא להתאים ולהחליק עקומות על-ידי הקלדת "y" עבור YES או "n" עבור NO כאשר תתבקש לעשות זאת. כדי לבדוק חזותית את ההתאמות המתכנסות, בחר את הראשונה.
הערה: האחרון שימושי כדי להציג באופן חזותי את כל הנתונים שהוחלקו, אך בדרך כלל אינו נבחר מכיוון שהוא יוצר יותר מדי גרפים נפתחים. בעקבות זאת, Matlab תבצע את שגרת LFASS, שעשויה להימשך 1-10 דקות אם מספר קבצי אקסל מעובדים בבת אחת. חלונות קופצים עם עקומות יופיעו בהתאם לבחירה בשלב 8.6. קובץ משלים 4A מציג דוגמה לעקומה מותאמת. - בחר אם (1) לנתח עקומות המזוהות כרעש או (2) להתאים מחדש עקומות שאינן מותאמות היטב עם אפשרות [y/n]. הקלד y כדי לאשר ו - n כדי לדחות.
הערה: מומלץ לאשר התאמה מחדש, במיוחד אם יש הרבה עקומות לא מותאמות או לא מותאמות. זה יאפשר למשתמש לספק פרמטרים מותאמים להתאמת עקומה עבור כל עקומה כפי שהם מופיעים על המסך ולבקש רק גבולות מוקדמים ומאוחרים יותר עבור ההתאמה הסיגמואידית. ניתן לנסות זאת כמה פעמים שנדרש. - לאחר ניתוח הנתונים, סגור את Matlab ופתח את תיקיית LFASS .
- לחץ על תיקיית המשנה LFASS התוצאות שלי, מכיוון שקבצי התוצאות נשמרים באופן אוטומטי בתיקיה תוצאות כ- .txt.
הערה: Matlab יוצר שלושה קבצים .txt: "מותאם אצווה.txt", "אצווה ורעש מותאם.txt", ו "Refited.txt". שני הראשונים נשמרים כאמצעי זהירות במקרה של קריסת מחשב או שגיאת משתמש במהלך ההתאמה מחדש. הקובץ המכיל את הניתוח המלא המדויק ביותר הוא "Refitted.txt". - פתח את הקובץ מחדש.txt באמצעות Microsoft Excel ושמור כ- .xls לעיבוד נוסף. קובץ משלים 4B מציג דוגמה לקובץ תוצאות כזה.
הערה: עבור כל באר (מאורגנת בשורות), שלושה ערכים מסופקים בעמודות הנותנות אומדנים של זמן המוות החציוני של אוכלוסיית התולעים: "Raw": מדווח על הזמן המצטלב בחצי המקסימום של שיא הנתונים הניסויי; "מותקן אצווה": מדווח על הזמן להצטלב בחצי המקסימום של העקומה המותאמת לאצווה; "Refitted": מדווח על הזמן להצטלב בחצי המקסימום של העקומה המחודשת. - שמור את הקובץ בתבנית .xls כעותק במיקום בטוח. אם לא תעשה זאת, תסתכן בהחלפת הקבצים במהלך ההפעלה הבאה של שגרת LFASS.
הערה: לאחר מכן ניתן לעבד את התוצאות עוד יותר לצורך גרפים או ניתוח סטטיסטי.
Access restricted. Please log in or start a trial to view this content.
תוצאות
מבחני LFASS מספקים סינון חזק, בעל תפוקה גבוהה ומהירה של תנאי בדיקה מרובים בו-זמנית, כגון סינון פרמטרים גנטיים ומיקרוביוטה רבים התורמים לעמידות ללחץ ולהזדקנות. לוקח רק 2-3 שבועות עד שהניסוי מקבל מערך נתונים נרחב של תנאי בדיקה מרובים. L4 + 36 שעות אוכלוסיות תולעי בר בוגרות נחשפו לעקה תרמית של 42 מעל?...
Access restricted. Please log in or start a trial to view this content.
Discussion
C. elegans מציעה יתרונות רבים לסינון מהיר של מספר פרמטרים ניסיוניים בו זמנית, בשל גודלה הקטן, השקיפות, הפיתוח המהיר, תוחלת החיים הקצרה, הזולות וקלות הטיפול. הגנום, תוכנית הגוף, מערכת העצבים, המעיים והמיקרוביום הפשוטים הרבה יותר, אך מורכבים ודומים מספיק לבני אדם, הופכים אותו למודל פרה-קליני ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים ל- CGC מינסוטה (מדיסון, ארה"ב, NIH - P40 OD010440) על אספקת זני תולעים ו- OP50 ו- Pr. Hinrich Schulenburg (CAU, קיל, גרמניה) על אספקת כל המבודדים המיקרוביאליים הסביבתיים המתוארים כאן. עבודה זו מומנה על ידי מענק UKRI-BBSRC ל-AB (BB/S017127/1). JM ממומן על ידי מלגת דוקטורט FHM של אוניברסיטת לנקסטר.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 10 cm diameter plates (Non-vented) | Fisher Scientific | 10720052 | Venting is not necessary for bacterial cultures |
| 15 cm diameter plates (Vented) | Fisher Scientific | 168381 | |
| 384-well black, transparent flat bottom plates | Corning | 3712 or 3762 | Not essential to be sterile for fast stress assays |
| 6 cm diameter plates (Vented) | Fisher Scientific | 150288 | Venting is necessary for worm cultures to avoid hypoxia |
| 96-well transparent plates (Biolite) | Thermo | 130188 | |
| Agar (<4% ash) | Sigma-Aldrich | 102218041 | Good quality agar is important for the structural integrity of the culture media, to avoid worm burrowing |
| Agarose | Fisher Scientific | BP1356 | |
| Avanti Centrifuge J-26 XP | Beckman coulter | ||
| Bleach | Honeywell | 425044 | |
| Calcium chloride | Sigma-Aldrich | C5080 | |
| Centrifuge 5415 R | Eppendorf | ||
| Centrifuge 5810 R | Eppendorf | ||
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB agar | Difco | 240110 | |
| LB broth | Invitrogen | 12795084 | |
| LoBind tips | VWR | 732-1488 | Lo-bind reduce worm loss during transfers |
| LoBind tubes | Eppendorf | 22431081 | |
| Magnesium sulfate | Fisher Scientific | M/1100/53 | |
| Plate reader- infinite M nano+ | Tecan | Monochromator setup enables fluorescence tuning but adequate filter-based setups may be used | |
| Plate reader- Spark | Tecan | ||
| Potassium phosphate monobasic | Honeywell | P0662 | |
| Sodium chloride | Sigma-Aldrich | S/3160/63 | |
| Stereomicroscope setup with transillumination base | Leica | MZ6, or M80 | Magnification from 0.6-0.8x up to 40-60x is necessary, as is a good quality transillumination base with a deformable, titable or slidable mirror to adjust contrast |
| t-BHP (tert-Butyl hydroperoxide) | Sigma-Aldrich | 458139 | |
| Transparent adhesive seals Nunc | Fisher Scientific | 101706871 | It is important that it is transparent and that it can tolerate the temperatures involved in the assays. |
| Tryptophan | Sigma-Aldrich | 1278-7099 | |
| Yeast extract | Fisher Scientific | BP1422 |
References
- Krishna, S., et al. Integrating microbiome network: establishing linkages between plants, microbes and human health. The Open Microbiology Journal. 13, 330-342 (2019).
- Amon, P., Sanderson, I. What is the microbiome. Archives of Disease in Childhood - Education & Practice Edition. 102 (5), 257-260 (2017).
- Belkaid, Y., Harrison, O. J. Homeostatic immunity and the microbiota. Immunity. 46 (4), 562-576 (2017).
- Cabreiro, F., Gems, D. Worms need microbes too: microbiota, health and aging in Caenorhabditis elegans. EMBO Molecular Medicine. 5 (9), 1300-1310 (2013).
- Vaga, S., et al. Compositional and functional differences of the mucosal microbiota along the intestine of healthy individuals. Scientific Reports. 10 (1), 14977(2020).
- Nagpal, R., et al. Gut microbiome and aging: Physiological and mechanistic insights. Nutrition and Healthy Aging. 4 (4), 267-285 (2018).
- Mitsuoka, T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 33 (3), 99-116 (2014).
- Bonfili, L., et al. Microbiota modulation as preventative and therapeutic approach in Alzheimer's disease. The FEBS Journal. 288 (9), 2836-2855 (2021).
- Vendrik, K. E. W., et al. Fecal microbiota transplantation in neurological disorders. Frontiers in Cellular and Infection Microbiology. 10, 98(2020).
- Wang, Q., et al. The role of gut dysbiosis in Parkinson's disease: mechanistic insights and therapeutic options. Brain. 144 (9), 2571-2593 (2021).
- Zhu, X., et al. The relationship between the gut microbiome and neurodegenerative diseases. Neuroscience Bulletin. 37 (10), 1510-1522 (2021).
- Miller, I. The gut-brain axis: historical reflections. Microbial Ecology in Health and Disease. 29 (1), 1542921(2018).
- Foster, J. A., Rinaman, L., Cryan, J. F. Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress. 7, 124-136 (2017).
- Coman, V., Vodnar, D. C. Gut microbiota and old age: Modulating factors and interventions for healthy longevity. Experimental Gerontology. 141, 111095(2020).
- Conway, J., Duggal, N. A. Ageing of the gut microbiome: Potential influences on immune senescence and inflammageing. Ageing Research Reviews. 68, 101323(2021).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10 (8), 1998-2009 (2016).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans Microbiome Resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: gateway to a new host-microbiome model. BMC Biology. 14, 38(2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Felix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Zimmermann, J., et al. The functional repertoire contained within the native microbiota of the model nematode Caenorhabditis elegans. The ISME Journal. 14 (1), 26-38 (2020).
- Dinic, M., et al. Host-commensal interaction promotes health and lifespan in Caenorhabditis elegans through the activation of HLH-30/TFEB-mediated autophagy. Aging. 13 (6), 8040-8054 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against alpha-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Hacariz, O., Viau, C., Karimian, F., Xia, J. The symbiotic relationship between Caenorhabditis elegans and members of its microbiome contributes to worm fitness and lifespan extension. BMC Genomics. 22 (1), 364(2021).
- Shin, M. G., et al. Bacteria-derived metabolite, methylglyoxal, modulates the longevity of C. elegans through TORC2/SGK-1/DAF-16 signaling. Proceedings of the National Academy of Sciences of the United States of America. 117 (29), 17142-17150 (2020).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Zhang, F., et al. High-throughput assessment of changes in the Caenorhabditis elegans gut microbiome. Methods in Molecular Biology. 2144, 131-144 (2020).
- Chan, J. P., et al. Using bacterial transcriptomics to investigate targets of host-bacterial interactions in Caenorhabditis elegans. Scientific Reports. 9 (1), 5545(2019).
- Hartsough, L. A., et al. Optogenetic control of gut bacterial metabolism to promote longevity. Elife. 9, 56849(2020).
- Pryor, R., et al. Host-microbe-drug-nutrient screen identifies bacterial effectors of Metformin therapy. Cell. 178 (6), 1299-1312 (2019).
- Benedetto, A., et al. New label-free automated survival assays reveal unexpected stress resistance patterns during C. elegans aging. Aging Cell. 18 (5), 12998(2019).
- Coburn, C., et al. Anthranilate fluorescence marks a calcium-propagated necrotic wave that promotes organismal death in C. elegans. PLOS Biology. 11 (7), 1001613(2013).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Naomi, R., et al. Probiotics for Alzheimer's disease: a systematic review. Nutrients. 14 (1), 20(2021).
- Zheng, S. Y., et al. Potential roles of gut microbiota and microbial metabolites in Parkinson's disease. Ageing Research Reviews. 69, 101347(2021).
- Gill, M. S., Olsen, A., Sampayo, J. N., Lithgow, G. J. An automated high-throughput assay for survival of the nematode Caenorhabditis elegans. Free Radical Biology and Medicine. 35 (6), 558-565 (2003).
- Park, H. -E. H., Jung, Y., Lee, S. -J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Partridge, F. A., et al. An automated high-throughput system for phenotypic screening of chemical libraries on C. elegans and parasitic nematodes. International Journal for Parasitology: Drugs and Drug Resistance. 8 (1), 8-21 (2018).
- Rahman, M., et al. NemaLife chip: a micropillar-based microfluidic culture device optimized for aging studies in crawling C. elegans. Scientific Reports. 10 (1), 16190(2020).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: a quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Brown, A. E., Schafer, W. R. Unrestrained worms bridled by the light. Nature Methods. 8 (2), 129-130 (2011).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652(2017).
- Jushaj, A., et al. Optimized criteria for locomotion-based healthspan evaluation in C. elegans using the WorMotel system. PLoS One. 15 (3), 0229583(2020).
- Nambyiah, P., Brown, A. E. X. Quantitative behavioural phenotyping to investigate anaesthesia induced neurobehavioural impairment. Scientific Reports. 11 (1), 19398(2021).
- Squiban, B., Belougne, J., Ewbank, J., Zugasti, O. Quantitative and automated high-throughput genome-wide RNAi screens in C. elegans. Journal of Visualized Experiments. (60), e3448(2012).
- Zugasti, O., et al. Activation of a G protein-coupled receptor by its endogenous ligand triggers the innate immune response of Caenorhabditis elegans. Nature Immunology. 15 (9), 833-838 (2014).
- Zugasti, O., et al. A quantitative genome-wide RNAi screen in C. elegans for antifungal innate immunity genes. BMC Biology. 14, 35(2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved