È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Screening ad alta produttività di isolati microbici con impatto sulla salute di Caenorhabditis elegans
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I microbi intestinali possono avere un impatto positivo o negativo sulla salute del loro ospite attraverso meccanismi specifici o conservati. Caenorhabditis elegans è una comoda piattaforma per lo screening di tali microbi. Il presente protocollo descrive lo screening ad alto rendimento di 48 isolati batterici per l'impatto sulla resistenza allo stress dei nematodi, utilizzati come proxy per la salute dei vermi.
Abstract
Con le sue piccole dimensioni, la breve durata della vita e la facile genetica, Caenorhabditis elegans offre una comoda piattaforma per studiare l'impatto degli isolati microbici sulla fisiologia dell'ospite. Fluorescente anche in blu quando muore, fornendo un mezzo conveniente per individuare la morte. Questa proprietà è stata sfruttata per sviluppare saggi di sopravvivenza di C. elegans (LFASS) label-free ad alto rendimento. Questi comportano la registrazione della fluorescenza time-lapse delle popolazioni di vermi impostate in piastre multipozzetto, da cui può essere derivato il tempo mediano di morte della popolazione. Il presente studio adotta l'approccio LFASS per lo screening di più isolati microbici contemporaneamente per gli effetti sulla suscettibilità di C. elegans al calore severo e agli stress ossidativi. Tale pipeline di screening microbico, che può essere utilizzata in particolare per preselezionare i probiotici, utilizzando una grave resistenza allo stress come proxy per la salute dell'ospite è riportata qui. Il protocollo descrive come far crescere sia le collezioni di isolati di microbiota intestinale di C. elegans che le popolazioni di vermi sincroni in array multipozzetti prima di combinarli per i test. L'esempio fornito copre il test di 47 isolati batterici e un ceppo di controllo su due ceppi di vermi, in due saggi di stress in parallelo. Tuttavia, la pipeline di approccio è facilmente scalabile e applicabile allo screening di molte altre modalità. Pertanto, fornisce una configurazione versatile per esaminare rapidamente un panorama multiparametrico di condizioni biologiche e biochimiche che influiscono sulla salute di C. elegans.
Introduzione
Il corpo umano ospita circa 10-100 trilioni di cellule microbiche vive (batteri, funghi archaea), che si trovano principalmente negli ambienti dell'intestino, della pelle e delle mucose1. In uno stato sano, questi forniscono benefici al loro ospite, tra cui la produzione di vitamine, la maturazione del sistema immunitario, la stimolazione delle risposte immunitarie innate e adattative agli agenti patogeni, la regolazione del metabolismo dei grassi, la modulazione delle risposte allo stress e altro ancora, con un impatto sulla crescita e lo sviluppo, l'insorgenza della malattia e l'invecchiamento 2,3,4,5 . Anche il microbiota intestinale si evolve considerevolmente nel corso della vita. L'evoluzione più drastica si verifica durante l'infanzia e la prima infanzia6, ma cambiamenti significativi si verificano anche con l'età, tra cui una diminuzione dell'abbondanza di Bifidobacterium e un aumento di Clostridium, Lactobacillus, Enterobacteriaceae e Enterococcus specie7. Lo stile di vita può alterare ulteriormente la composizione microbica intestinale portando alla disbiosi (perdita di batteri benefici, crescita eccessiva di batteri opportunisti), causando varie patologie come malattie infiammatorie intestinali, diabete e obesità5, ma anche contribuendo alle malattie di Alzheimer e Parkinson 8,9,10,11.
Questa consapevolezza ha contribuito in modo critico ad affinare il concetto di asse intestino-cervello (GBA), dove le interazioni tra la fisiologia intestinale (ora inclusi i microbi al suo interno) e il sistema nervoso sono considerate il principale regolatore del metabolismo animale e delle funzioni fisiologiche12. Tuttavia, il ruolo preciso del microbiota nella segnalazione intestino-cervello e i meccanismi d'azione associati sono lontani dall'essere pienamente compresi13. Con il microbiota intestinale che è un determinante chiave dell'invecchiamento sano, il modo in cui i batteri modulano il processo di invecchiamento è diventato oggetto di intense ricerche e polemiche 6,14,15.
Con la dimostrazione che il nematode Caenorhabditis elegans ospita un microbiota intestinale in buona fede dominato - come in altre specie - da Bacteroidetes, Firmicutes e Actinobacteria 16,17,18,19,20, la sua rapida ascesa come piattaforma sperimentale per studiare le interazioni commensali ospite-intestino21,22,23,24 ,25,26 ha notevolmente ampliato il nostro arsenale investigativo26,27,28,29. In particolare, gli approcci sperimentali ad alto rendimento disponibili per C. elegans per studiare le interazioni gene-dieta, gene-farmaco, gene-patogeno, ecc., possono essere adattati per esplorare rapidamente come isolati e cocktail batterici influenzano la salute e l'invecchiamento di C. elegans.
Il presente protocollo descrive una pipeline sperimentale per lo screening simultaneo di array di isolati o miscele batteriche impostati in piastre multipozzetto per gli effetti sulla resistenza allo stress di C. elegans come proxy per la salute, che può essere utilizzato per identificare i probiotici. Descrive in dettaglio come far crescere grandi popolazioni di vermi e gestire array batterici in formati di piastre a 96 e 384 pozzetti prima di elaborare i vermi per l'analisi automatizzata della resistenza allo stress utilizzando un lettore di piastre a fluorescenza (Figura 1). L'approccio si basa su saggi di sopravvivenza automatizzati label-free (LFASS)30 che sfruttano il fenomeno della fluorescenza di morte31, per cui i vermi morenti producono un'esplosione di fluorescenza blu che può essere utilizzata per individuare il momento della morte. La fluorescenza blu è emessa dagli esteri glucosilici dell'acido antranilico immagazzinati nei granuli intestinali di C. elegans (un tipo di organello correlato al lisosoma), che scoppiano quando una cascata necrotica viene innescata nell'intestino del verme alla morte31.
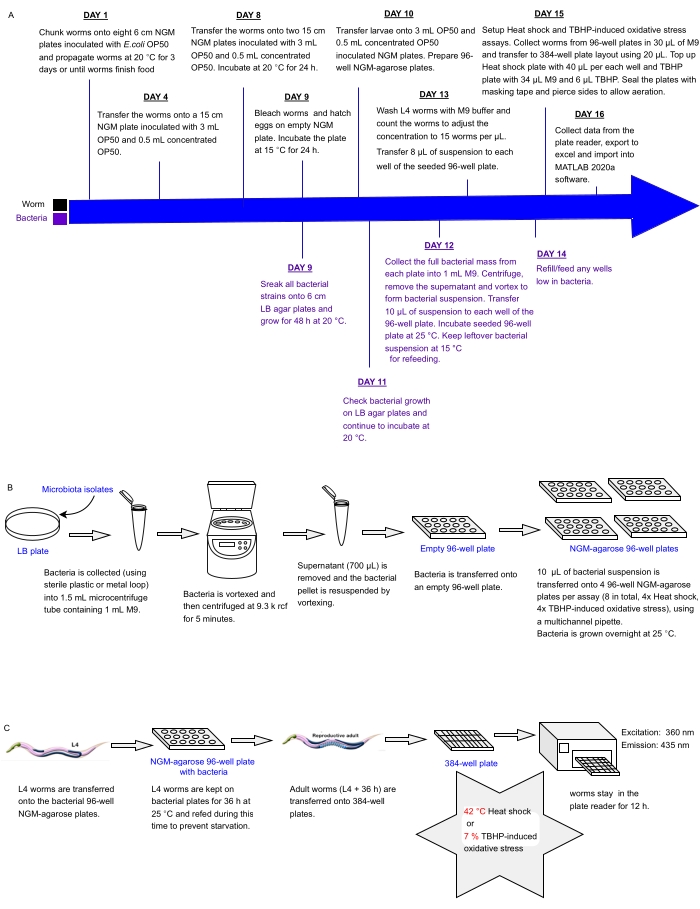
Figura 1: Flusso di lavoro sperimentale per lo screening ad alta produttività di isolati batterici con impatto sulla resistenza allo stress di C. elegans . (A) Cronologia per la manutenzione di vermi e batteri e la configurazione del test. (B) Configurazione e gestione dell'array di piastre batteriche a 96 pozzetti. (C) Configurazione della piastra a vite senza fine a 384 pozzetti. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
I due ceppi di C. elegans utilizzati in parallelo per il presente studio erano Bristol N2 wild type e HT1890: daf-16 (mgDf50), che crescono a tassi simili. Tuttavia, il protocollo può essere replicato con qualsiasi combinazione di due ceppi che hanno tassi di crescita simili. Si noti che, quando si testano altri ceppi in parallelo (ad esempio, mutanti daf-2 wild type e a crescita lenta), devono essere considerati diversi tassi di crescita e, di conseguenza, il protocollo deve essere adattato. I tempi e le quantità di vermi e batteri nel seguente protocollo sono ottimizzati per il test parallelo di 48 isolati batterici su due ceppi di vermi in due saggi LFASS in tetraplicati. Saranno necessari adeguamenti se si vogliono testare più condizioni in parallelo. Escherichia coli Il ceppo batterico OP50 è stato ottenuto dal Caenorhabditis Genetics Center (CGC), Università del Minnesota. I 48 isolati batterici sono stati ottenuti dal laboratorio di Schulenburg e mantenuti su agar LB.
1. C. elegans coltura su OP50 (giorni 1 - 8)
NOTA: L'approccio attuale mira a far crescere C. elegans ermafroditi su un terreno solido in tutte le fasi ed evita cambiamenti dietetici non necessari (ad esempio, utilizzando ceppi alternativi di E. coli a crescita più rapida come NA22 o terreni di crescita più ricchi come le piastre d'uovo) per rimanere il più vicino possibile alle condizioni di crescita standard32,33 che sono ancora ampiamente utilizzate. La temperatura di crescita del verme (qui fissata a 15 °C) dipende dal ceppo o dai ceppi di C. elegans utilizzati e potrebbe essere necessario un aggiustamento (ad esempio, per evitare o innescare l'espressione di un fenotipo o biomarcatore sensibile alla temperatura). Per informazioni sull'allevamento dei lombrichi, si veda il riferimento33.
- Preparare otto piastre NGM da 6 cm di diametro (10 mL di agar del terreno di crescita nematode, NGM, file supplementare 1)32,33 per ceppo di vermi e lasciarle asciugare per 1 giorno a temperatura ambiente.
- Preparare una coltura liquida satura di batteri E. coli OP50 seminando un singolo clone batterico da una piastra di agar di brodo lisogenico appena coltivato (agar LB, file supplementare 1) in 25 ml di terreno OP50 (file supplementare 1) in una provetta conica da 50 ml. Coltivare la coltura durante la notte a 37 °C in un incubatore shaker.
- Inoculare le otto piastre NGM da 6 cm per ceppo con 100 μL di coltura liquida satura di E. coli OP50 per piastra e mantenere le piastre a 20 °C per 2 giorni prima dell'uso.
- Usando un bisturi, tagliare e trasferire un pezzo quadrato di agar di 0,5 cm con vermi da una piastra NGM recentemente affamata su ciascuna delle otto piastre NGM inoculate da 6 cm e incubare queste piastre a 20 °C per 3 giorni (o fino a quando i vermi finiscono il cibo).
- Preparare cinque piastre NGM da 15 cm per ceppo di verme (30 mL di terreno NGM per piastra) e inoculare con 3 mL di OP50. Lasciare asciugare le piastre prima di incubare a 37 °C durante la notte. Conservare le piastre a 20 °C fino all'uso nelle fasi successive.
- Utilizzando una pipetta P-1000, aggiungere fino a 3 ml di tampone M9 sterile (file supplementare 1) alle piastre NGM da 6 cm (fase 1.1.) per risospendere i vermi e raccogliere la soluzione di vite senza fine da tutte le otto piastre per ceppo in un singolo tubo conico da 15 ml.
- Centrifugare a 142 x g per 2 minuti a 4 °C. Rimuovere con cautela il surnatante utilizzando una pipetta P-5000 o una pompa dell'acqua dotata di una pipetta o punta sterile Pasteur. Aggiungere 10 ml di tampone M9 sterile per lavare il pellet di verme. Ripeti 2x.
- Rimuovere il surnatante (per quanto possibile) e trasferire i vermi su una piastra NGM inoculata OP50 da 15 cm (Passo 1.5.) usando una pipetta. Aggiungere 0,5 ml di coltura OP50 concentrata.
- Per ottenere OP50 concentrato, inoculare ciascuno dei quattro flaconi da 1 L di LB con 2 ml di coltura starter OP50 (preparata nella fase 1.2.) e crescere in un incubatore per 6 ore a 37 °C e 160 x g. Pellettare i batteri a 3057 x g e 20 °C per 15 min. Scartare il surnatante, risospendere i pellet batterici con 6 ml di terreno OP50 e raccogliere in un tubo conico sterile da 50 ml.
NOTA: I batteri possono essere conservati a 4 °C per un massimo di 1 settimana.
- Coltivare ogni ceppo di verme su una piastra NGM di 15 cm di diametro per 3-4 giorni a 15 °C rialimentando i vermi con 0,5 ml di OP50 concentrato al giorno.
- Una volta che i vermi hanno quasi finito il cibo, raccogliere e lavare in tampone M9 (Passo 1.6.1.), trasferire ogni coltura di vermi in due piastre NGM da 15 cm (Fase 1.5.) e propagare i vermi a 20 °C fino a ~95% della popolazione sono adulti gravidi (ci vorranno circa 24 ore per il Bristol N2 wild type).
NOTA: Gli adulti gravidi sono caratterizzati dalla presenza di uova all'interno del verme e la piastra ideale dovrebbe anche avere un'abbondanza di uova non schiuse deposte sul piatto senza troppe larve33.
- Una volta che i vermi hanno quasi finito il cibo, raccogliere e lavare in tampone M9 (Passo 1.6.1.), trasferire ogni coltura di vermi in due piastre NGM da 15 cm (Fase 1.5.) e propagare i vermi a 20 °C fino a ~95% della popolazione sono adulti gravidi (ci vorranno circa 24 ore per il Bristol N2 wild type).
2. Mantenimento delle raccolte di isolati del microbiota intestinale (Giorno 9)
- Striare i 48 isolati batterici su singole piastre di agar LB da 6 cm e crescere per 48 ore a 20 °C.
NOTA: I batteri possono essere coltivati a 25 °C per 24-36 ore se necessario prima, ma la crescita più lunga di 20 °C consente di individuare potenziali contaminanti. - Sincronizzare un gran numero di C. elegans.
- Sbiancare i vermi adulti gravidi seguendo il metodo standard di preparazione delle uova33 e trasferire le uova su due piastre NGM da 15 cm non seminate per 24 ore a 15 °C per consentire a tutte le larve L1 di schiudersi e crescere in modo sincrono nelle fasi successive.
ATTENZIONE: Prestare attenzione durante la manipolazione delle soluzioni di candeggina.
- Sbiancare i vermi adulti gravidi seguendo il metodo standard di preparazione delle uova33 e trasferire le uova su due piastre NGM da 15 cm non seminate per 24 ore a 15 °C per consentire a tutte le larve L1 di schiudersi e crescere in modo sincrono nelle fasi successive.
3. Crescita di grandi colture di C. elegans (Giorno 10)
- Una volta schiuse, raccogliere le larve L1 (dal punto 2.2.1.) in 3-4 mL di M9 in un tubo conico pulito da 15 ml. Pipettare quattro gocce da 10 μL di soluzione di verme su un vetrino o una piastra e contare il numero di vermi in ogni goccia sotto uno stereomicroscopio con un ingrandimento 16x. Determinare la concentrazione di verme della soluzione calcolando la media del numero di larve da tutte le gocce di soluzione di verme. Moltiplicare questo valore per il volume rimasto e stimare il numero totale di viti senza fine per ciascun ceppo.
NOTA: 46.000-50.000 larve di L1 per ceppo sono necessarie in questa fase per riempire successivamente una piastra da 384 pozzetti o due semipiastre.- Per ogni ceppo, trasferire tutte le larve di L1 su due piastre NGM da 15 cm (23.000-25.000 L1 per piastra) precedentemente inoculate con 3 mL di OP50 (Fase 1.5.) e riseminate con 0,5 mL di OP50 concentrato.
- Incubare a 15 °C, rabboccare con 0,5 ml di OP50 concentrato al giorno secondo necessità fino a quando i vermi raggiungono lo stadio L4.
NOTA: Lo stadio L4 è caratterizzato da un intestino leggermente più scuro e da una chiazza bianca a forma di mezzo disco o mezzaluna dove la vulva alla fine formerà32,33. - Preparare le piastre di agarosio NGM-agasio a 96 pozzetti seguendo i passaggi seguenti.
- Preparare otto piastre di NGM-agarosio a 96 pozzetti riempiendo ciascun pozzetto con 125 μL di NGM-agarosio (quattro piastre per dosaggio).
NOTA: Si consiglia di placcare alcune piastre extra se alcune vengono contaminate nei passaggi successivi. Saranno necessari due lettori di piastre per eseguire i saggi in parallelo, ma possono anche essere eseguiti successivamente a partire dal saggio di stress termico in quanto può essere eseguito per un minimo di 6 ore. Per queste piastre, l'agar di cenere al <4% viene sostituito con agarosio (vedi Tabella dei materiali), consentendo un'asciugatura più lenta e uniforme attraverso i tappi NGM e riducendo lo scavo di vermi per un migliore recupero. - Assicurarsi che i pozzetti siano riempiti in modo uniforme e privo di bolle. Utilizzare un blocco termico impostato a 70 °C (con lento trasferimento di calore attraverso la plastica della piastra multipozzetto, l'agarosio NGM può riscaldarsi solo fino a circa 55-60 °C) per evitare che la miscela si solidifichi durante il processo. Per rimuovere le bolle all'interno dei pozzetti, utilizzare un ago sterile riscaldato a fiamma.
- Lasciare che le piastre a 96 pozzetti si stabilizzino a temperatura ambiente in un ambiente sterile prima di capovolgerle (coperchio verso il basso per evitare la condensa) e conservare a 4 °C in una scatola pulita fino al momento del bisogno.
- Preparare otto piastre di NGM-agarosio a 96 pozzetti riempiendo ciascun pozzetto con 125 μL di NGM-agarosio (quattro piastre per dosaggio).
- Il giorno 11, controllare i vermi dal passaggio 3.2., assicurandosi che non siano apparse contaminazioni e che i vermi siano ancora pieni.
- Il giorno 12, controllare i vermi dal passaggio 3.1., assicurandosi che non siano apparse contaminazioni e che i vermi siano ancora pieni. Inoltre, controlla lo stadio di sviluppo dei vermi.
NOTA: Il sesso/ceppo e lo stadio di sviluppo del verme, come i vermi L4 o L4 + 24 h utilizzati, dipendono dai trattamenti a cui i vermi sono sottoposti. Qui, ermafroditi selvatici sono stati esposti a isolati batterici da L4 per 36 ore.
4. Preparazione delle raccolte di isolati del microbiota intestinale per la rialimentazione dei vermi
- Monitorare la crescita batterica sulle piastre di agar LB dal punto 2.1. e continuare ad incubare a 20 °C.
NOTA: Anche se non è l'ideale, nel caso in cui alcuni cloni non crescano o rivelino contaminazioni, i batteri possono essere nuovamente striati da ceppi puliti su piastre da 6 cm LB e cresciuti a 25-28 °C per 24 ore per essere pronti per l'esperimento. - Definire un layout di array di 96 pozzetti per la raccolta batterica in fase di test, facilitando la semina sistematica delle piastre e l'analisi dei dati nelle fasi successive (Tabella supplementare 1).
- Raccogliere la massa batterica da ciascuna piastra batterica di 6 cm (Passo 4.1.) e trasferirla in una provetta da microcentrifuga marcata da 1,5 mL contenente 1 mL di tampone M9. Eseguire questa operazione utilizzando un anello di plastica sterile monouso da 2 mm di diametro o un anello metallico di 5 mm di diametro. Sterilizzare il circuito metallico tra i ceppi batterici immergendo in etanolo al 100%, bruciando e raffreddando per 5 secondi.
- Vortice i tubi della microcentrifuga fino a quando i pellet batterici sono completamente risospesi (a seconda del ceppo batterico, questo può richiedere ~ 1-10 s).
- Girare a 9.300 x g per 5 minuti a temperatura ambiente, rimuovere 700 μL di surnatante e risospendere il pellet batterico mediante vortice.
- Trasferire 200 μL di ciascuna sospensione batterica in un singolo pozzetto di una piastra sterile vuota da 96 pozzetti secondo lo schema descritto nella fase 4.2.
- Da questa piastra, inoculare otto piastre di agarosio NGM da 96 pozzetti (preparate nella fase 3.3.) con 10 μL di soluzione batterica utilizzando una pipetta multicanale e incubare con il coperchio a 25 °C per 24 ore. Non sigillare le piastre per consentire l'asciugatura delle piastre e la crescita aerobica batterica e per evitare l'eccesso di condensa.
- Sigillare la piastra di sospensione a 96 pozzetti preparata al punto 4.6. con pellicola sigillante adesiva pulita (vedi Tabella dei materiali) e conservare a 15 °C per un massimo di 5 giorni. Questo sarà utilizzato per la rialimentazione dei vermi, se necessario.
5. Impostazione dello shock termico e del saggio ossidativo LFASS (giorni 13 - 14)
- Osservando le piastre del Passo 3.5., valutare lo stadio di sviluppo dei vermi. Una volta che il >90% dei vermi ha raggiunto L434, raccogliere i vermi in un massimo di 10 ml di soluzione sterile di M9 in tubi conici da 15 ml.
- Lavare ampiamente i vermi (almeno 4 volte) ruotando verso il basso a 142 x g per 2 minuti a 4 °C, rimuovendo il surnatante e aggiungendo 10 ml di M9 sterile fresco tra ogni lavaggio per eliminare i batteri OP50. Risospendere il pellet di vite senza fine in 10 ml di M9.
- Trasferire 50 μL di soluzione di vite senza fine in un tubo legante a bassa superficie (vedi Tabella dei materiali) contenente 950 μL di M9. Dopo aver miscelato delicatamente il contenuto del tubo per evitare la sedimentazione del verme, utilizzare rapidamente una punta di pipetta a basso legame bagnata per trasferire 3-4 gocce separate da 10 μL su un vetrino o una piastra NGM e contare i numeri dei vermi sotto uno stereomicroscopio (vedere Tabella dei materiali) con un ingrandimento 16x. Calcola la media dei conteggi delle 3-4 gocce e determina il numero di vermi per microlitro nella soluzione di verme (vedi Passo 3.1.).
- Regolare la concentrazione di vermi nel tubo da 10 mL per raggiungere ~ 120 vermi in 8 μL. Se la soluzione preparata al punto 5.2. non è abbastanza concentrato, ruotare i vermi verso il basso e rimuovere M9 di conseguenza per raggiungere 120 vermi per 8 μL.
- Trasferire 8 μL di soluzione di vite senza fine (~120 vermi) in ciascuno dei pozzetti delle otto piastre di agarosio NGM da 96 pozzetti dal punto 4.7., utilizzando un pipet multicanale o un pipet ripetuto. Assicurarsi di utilizzare suggerimenti a bassa ritenzione per limitare la perdita di worm. Potrebbe anche essere necessario tagliare le estremità delle punte per consentire ai vermi adulti di grandi dimensioni di limitare lo stress meccanico sui vermi adulti.
NOTA: Il test richiede un minimo di 30 vermi vivi sani per funzionare in modo affidabile, ma funziona meglio con circa 100 vermi per pozzetto. - Incubare le piastre di agarosio NGM a 96 pozzetti seminate da vermi e batteri a 25 °C per 36 ore.
- Controllare le piastre tra 12-24 ore, assicurandosi che i vermi rimangano pieni per tutto il tempo. Se è necessaria una nuova alimentazione, risospendere i batteri all'interno della piastra batterica a 96 pozzetti conservati a 15 °C nella fase 4.8 e aggiungere fino a 10 μL della soluzione batterica corrispondente alle piastre di agarosio NGM a 96 pozzetti in cui i vermi sono a rischio di fame prima della fine del periodo di incubazione di 36 ore (i vermi affamati produrranno risultati molto diversi, quindi questo è molto importante).
NOTA: i seguenti passaggi devono essere eseguiti il giorno 15. Prima di iniziare il test, potrebbe essere necessario ottimizzare l'altezza di lettura. La lettura ottimale sarà raggiunta 20-50 μm sopra il fondo del pozzo. Questo dipenderà dal modello del lettore di piastre. Alcuni offrono la possibilità di una scansione Z, mentre altri consentono l'input manuale dell'altezza. Impostare l'altezza ottimale al livello in cui viene rilevato il segnale di fluorescenza blu più alto (365 nm/430 nm). Alcuni lettori di piastre possono funzionare ad un'altezza fissa ottimizzata per i saggi di cellule aderenti e potrebbero non essere ideali per i test LFASS. - Dopo 36 ore, erogare 30 μL di M9 in ciascun pozzetto della piastra a 96 pozzetti.
NOTA: per i saggi di stress termico, il lettore di piastre deve aver raggiunto la temperatura richiesta per eseguire il test e potrebbe essere necessario accenderlo in anticipo. Il protocollo attuale utilizza 42 °C per massimizzare la velocità di uccisione, ma l'approccio si applica ad altre temperature superiori a 30 °C. - Trasferire i vermi (circa 20 μL) alla piastra a 384 pozzetti secondo i layout impostati, utilizzando punte a bassa ritenzione (considerare di tagliare l'estremità delle punte per consentire ai vermi di grandi dimensioni di ridurre lo stress meccanico per i vermi adulti).
NOTA: Per il presente studio, per i due saggi qui descritti vengono utilizzate due diverse impostazioni del lettore di piastre (stress termico e stress ossidativo), e quindi i campioni destinati a questi due saggi non devono essere placcati nella stessa piastra a 384 pozzetti. - Assicurarsi che i lettori di piastre siano impostati correttamente (Tabella 1).
- Riempire le piastre da 384 pozzetti con più M9, puntando a un volume finale di 60 μL per pozzetto. Per il saggio dello stress termico, aggiungere 40 μL di M9 e per lo stress ossidativo indotto da t-BHP, aggiungere 34 μl di M9 in 6 μl di t-BHP (vedere Tabella dei materiali).
- Iniziare il test entro 2 minuti dall'aggiunta di t-BHP (idealmente, tutti i vermi devono essere esposti a t-BHP contemporaneamente, la risoluzione del tempo di analisi è di 2 minuti). Se non è possibile, utilizzare un timer per stimare il tempo impiegato per il pipettaggio t-BHP prima dell'inizio del test per consentire una successiva regolazione del tempo mediano di morte.
- Chiudere i piatti con il loro coperchio trasparente. Sigillare i bordi delle piastre a 384 pozzetti con nastro adesivo (nastro adesivo sopra la piastra e il coperchio), assicurandosi che il nastro non passi sopra il coperchio o sotto la piastra. Tagliare il nastro tra coperchio e piastra a intervalli utilizzando un bisturi per consentire lo scambio d'aria riducendo al minimo l'evaporazione durante il test.
- Inserire la piastra nel lettore di piastre (vedere Tabella dei materiali) e avviare la corsa. Puntare ad eccitare a 365 nm e rilevare l'emissione a 435 nm ogni 2 minuti per 6-12 ore (Tabella 1).
NOTA: In genere, 6 ore sono sufficienti per saggi di stress termico a 42 °C e 8 ore per saggi di stress ossidativo t-BHP al 7%.
6. Gestione dei dati del lettore di lastre
- Salvare i dati grezzi di fluorescenza dal lettore di piastre come formati .txt, .csv o .xls /.xlsx separati da virgole o tabulazioni, quindi convertirli in formato xls /.xlsx. A seconda del formato dei dati, riorganizzarli in modo che corrispondano al layout del foglio Excel necessario per l'analisi LFASS. Seguire le istruzioni dettagliate fornite nel riferimento30.
NOTA: Mentre i dati possono essere analizzati manualmente, normalizzando ogni serie storica e cercando il momento in cui la fluorescenza di morte raggiunge la metà massima, l'analisi automatizzata può essere eseguita in Matlab eseguendo la routine LFASS30. - Scarica e installa Matlab (versione 2014a o successiva) e il pacchetto software LFASS da https://github.com/ABA80/LFASS. Seguire le linee guida e le annotazioni fornite al suo interno.
NOTA: la Figura 1C fornisce una breve descrizione dell'approccio. Matlab è necessario per eseguire la routine LFASS. In alternativa, il codice Matlab può essere tradotto in Oracle, ad eccezione della funzione fitting, che è proprietaria. Nuove funzioni di smoothing e sigmoid possono essere riscritte per consentire l'utilizzo in una piattaforma completamente open source. - Tra un'analisi LFASS e l'altra, spostare i dati e i risultati in una nuova posizione poiché l'analisi LFASS elaborerà tutti i file nella cartella dati e sovrascriverà i file nella cartella Risultati.
7. Controllo dei dati
- Aprire il file excel ed etichettare le righe in base alla posizione del pozzo sulla piastra a 384 pozzetti. Il file supplementare 2 mostra un esempio del file excel dei dati grezzi di fluorescenza generati per il saggio dello shock termico. Utilizzare la posizione del pozzetto sulla piastra a 384 pozzetti per etichettare il verme e i ceppi batterici.
- Prima dell'analisi Matlab, ispeziona visivamente i dati in Excel, tracciando l'intensità della fluorescenza nel tempo per un pozzo rappresentativo. A seconda del lettore di piastre utilizzato, i dati possono essere rumorosi ma dovrebbero mostrare un picco chiaro. Soprattutto:
- Determinare un valore di fluorescenza al di sotto del quale un picco non sarebbe significativamente diverso dal rumore (l'impostazione di tale soglia in LFASS accelererà l'analisi escludendo i pozzi vuoti).
- Si noti il primo punto temporale in cui le fluttuazioni della fluorescenza si smorzano prima di aumentare (gli animali possono battere vigorosamente per un massimo di 30 minuti, portando a letture di fluorescenza blu fluttuanti veloci).
NOTA: il raccordo del picco può essere migliorato escludendo questi primi punti temporali dalla finestra di adattamento della curva. - Notare i punti temporali tra i quali si prevede che i valori di fluorescenza minima e massima cadranno (guardare diversi pozzetti per identificare questi intervalli) poiché verranno utilizzati per l'adattamento della curva.
- Controllare se le ampiezze dei picchi di fluorescenza variano significativamente tra i pozzetti, normalizzare i dati prima di ulteriori analisi utilizzando la seguente formula:
Pozzetto di fluorescenza normalizzato n (t) = (Pozzetto di fluorescenzan [t] - pozzetto di fluorescenza minima [Dt]) / (pozzetto di fluorescenza massimo [Dt] - pozzetto di fluorescenza minimo [Dt])
dove "n" è il numero corrente del pozzo, "t" è il punto temporale e "Dt" è la serie di punti temporali per il saggio.
8. Trattamento dei dati LFASS
NOTA: I dettagli sono forniti a https://github.com/ABA80/LFASS e nei materiali supplementari del riferimento30.
- Creare due sottocartelle all'interno della cartella LFASS, una per i dati da analizzare e una per i risultati, ad esempio "i miei dati" e "risultati".
- Copiare il file di dati Excel del test nella sottocartella LFASS "i miei dati" dopo l'ispezione dei dati.
- Avvia MATLAB, vai alla cartella LFASS, digita ed esegui fitfolder nella finestra di comando (File supplementare 3). Quindi seguire le istruzioni visualizzate sullo schermo.
- Dopo aver digitato "fitfolder", il sistema chiede il nome della cartella in cui si trova il file excel, ad esempio "i miei dati". Digitare il nome della cartella dati (in questo esempio, "i miei dati").
- Seguire le istruzioni sullo schermo, fornendo i vari parametri richiesti.
- Immettere "2" per l'intervallo di tempo tra misurazioni successive nel protocollo corrente (specificando questo si può esprimere i risultati in minuti anziché in unità di timepoint).
NOTA: L'intervallo di tempo può essere modificato per eseguire misurazioni di fluorescenza più o meno frequentemente (per ridurre o aumentare la risoluzione temporale) e anche in base alle capacità del lettore di piastre (ad esempio, potrebbe essere necessario aumentare l'intervallo di tempo per i lettori di piastre che non possono eseguire misurazioni abbastanza veloci). Assicurarsi di abbinare sempre l'intervallo di tempo sperimentale con la routine LFASS. - Assegnare la soglia di tolleranza superiore digitando "0,95" (che può essere modificata in base alle esigenze per migliorare l'adattamento) e la soglia di tolleranza inferiore digitando "0,05" (che può essere modificata secondo necessità per migliorare l'adattamento) per vincolare l'adattamento sigmoideo.
NOTA: altri parametri temporali si basano sulle note dell'utente dell'ispezione dei dati (Passaggio 7.2.).
- Immettere "2" per l'intervallo di tempo tra misurazioni successive nel protocollo corrente (specificando questo si può esprimere i risultati in minuti anziché in unità di timepoint).
- Scegliere se visualizzare o meno le curve adattate e smussate digitando "y" per SÌ o "n" per NO quando richiesto. Per ispezionare visivamente i raccordi convergenti, selezionare il primo.
NOTA: quest'ultimo è utile per visualizzare tutti i dati levigati, ma di solito non è selezionato perché genera troppi grafici popup. Successivamente, Matlab eseguirà la routine LFASS, che potrebbe richiedere 1-10 minuti se più file Excel vengono elaborati in una sola volta. Le finestre popup con curve appariranno in base alla selezione nel passaggio 8.6. Il file supplementare 4A mostra un esempio di curva adattata. - Scegliere se (1) analizzare le curve identificate come rumore o (2) riadattare le curve mal adattate con un'opzione [s/n]. Digitare y per approvare e n per rifiutare.
NOTA: si consiglia di approvare il refitting, soprattutto se ci sono molte curve mal adattate o non montate. Ciò consentirà all'utente di fornire parametri di adattamento della curva personalizzati per ogni curva come appaiono sullo schermo e richiedere solo i limiti precedenti e successivi per l'adattamento sigmoideo. Può essere tentato tutte le volte che è necessario. - Una volta analizzati i dati, chiudi Matlab e apri la cartella LFASS .
- Fare clic sulla sottocartella LFASS I miei risultati, poiché i file dei risultati vengono salvati automaticamente nella cartella Risultati come .txt.
NOTA: Matlab genera tre file .txt: "Batch-fitted.txt", "Batch and noise-fitted.txt" e "Refitted.txt". I primi due vengono salvati per precauzione in caso di crash del computer o errore dell'utente durante il refitting. Il file contenente l'analisi completa più accurata è "Refitted.txt". - Aprire il file Refitted.txt con Microsoft Excel e salvarlo .xls per ulteriori elaborazioni. Il file supplementare 4B mostra un esempio di tale file di risultati.
NOTA: Per ogni pozzo (organizzato in righe), nelle colonne che forniscono stime del tempo mediano di morte della popolazione di vermi: "Raw": riporta il tempo che si interseca alla metà massima del picco dei dati sperimentali; "Batch-fitted": riporta il tempo di intersezione alla metà massima della curva montata sul lotto; "Refitted": riporta il tempo di intersezione a metà della curva riadattata. - Salvare il file in formato .xls come copia in un luogo sicuro. In caso contrario, i file verranno sovrascritti durante la successiva esecuzione della routine LFASS.
NOTA: I risultati possono quindi essere ulteriormente elaborati per la creazione di grafici o l'analisi statistica.
Access restricted. Please log in or start a trial to view this content.
Risultati
I test LFASS forniscono uno screening robusto, ad alto rendimento e rapido di più condizioni di test contemporaneamente, come lo screening di numerosi parametri genetici e del microbiota che contribuiscono alla resistenza allo stress e all'invecchiamento. Ci vogliono solo 2-3 settimane perché l'esperimento acquisisca un ampio set di dati di più condizioni di test. Le popolazioni adulte di vermi selvatici L4 + 36 h sono state esposte a stress termico a 42 °C e stress ossidativo indotto da t-BHP del 7% dopo un...
Access restricted. Please log in or start a trial to view this content.
Discussione
C. elegans offre molti vantaggi per lo screening rapido di più parametri sperimentali contemporaneamente, grazie alle sue dimensioni ridotte, trasparenza, sviluppo rapido, breve durata, economicità e facilità di manipolazione. Il suo genoma considerevolmente più semplice, il piano corporeo, il sistema nervoso, l'intestino e il microbioma, ma complessi e abbastanza simili agli esseri umani, lo rendono un potente modello preclinico, in cui è possibile ottenere informazioni meccanicistiche durante i test di ef...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il CGC Minnesota (Madison, USA, NIH - P40 OD010440) per aver fornito ceppi di vermi e OP50 e Pr. Hinrich Schulenburg (CAU, Kiel, Germania) per aver fornito tutti gli isolati microbici ambientali qui raffigurati. Questo lavoro è stato finanziato da una sovvenzione UKRI-BBSRC ad AB (BB/S017127/1). JM è finanziato da una borsa di studio di dottorato FHM della Lancaster University.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 cm diameter plates (Non-vented) | Fisher Scientific | 10720052 | Venting is not necessary for bacterial cultures |
| 15 cm diameter plates (Vented) | Fisher Scientific | 168381 | |
| 384-well black, transparent flat bottom plates | Corning | 3712 or 3762 | Not essential to be sterile for fast stress assays |
| 6 cm diameter plates (Vented) | Fisher Scientific | 150288 | Venting is necessary for worm cultures to avoid hypoxia |
| 96-well transparent plates (Biolite) | Thermo | 130188 | |
| Agar (<4% ash) | Sigma-Aldrich | 102218041 | Good quality agar is important for the structural integrity of the culture media, to avoid worm burrowing |
| Agarose | Fisher Scientific | BP1356 | |
| Avanti Centrifuge J-26 XP | Beckman coulter | ||
| Bleach | Honeywell | 425044 | |
| Calcium chloride | Sigma-Aldrich | C5080 | |
| Centrifuge 5415 R | Eppendorf | ||
| Centrifuge 5810 R | Eppendorf | ||
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB agar | Difco | 240110 | |
| LB broth | Invitrogen | 12795084 | |
| LoBind tips | VWR | 732-1488 | Lo-bind reduce worm loss during transfers |
| LoBind tubes | Eppendorf | 22431081 | |
| Magnesium sulfate | Fisher Scientific | M/1100/53 | |
| Plate reader- infinite M nano+ | Tecan | Monochromator setup enables fluorescence tuning but adequate filter-based setups may be used | |
| Plate reader- Spark | Tecan | ||
| Potassium phosphate monobasic | Honeywell | P0662 | |
| Sodium chloride | Sigma-Aldrich | S/3160/63 | |
| Stereomicroscope setup with transillumination base | Leica | MZ6, or M80 | Magnification from 0.6-0.8x up to 40-60x is necessary, as is a good quality transillumination base with a deformable, titable or slidable mirror to adjust contrast |
| t-BHP (tert-Butyl hydroperoxide) | Sigma-Aldrich | 458139 | |
| Transparent adhesive seals Nunc | Fisher Scientific | 101706871 | It is important that it is transparent and that it can tolerate the temperatures involved in the assays. |
| Tryptophan | Sigma-Aldrich | 1278-7099 | |
| Yeast extract | Fisher Scientific | BP1422 |
Riferimenti
- Krishna, S., et al. Integrating microbiome network: establishing linkages between plants, microbes and human health. The Open Microbiology Journal. 13, 330-342 (2019).
- Amon, P., Sanderson, I. What is the microbiome. Archives of Disease in Childhood - Education & Practice Edition. 102 (5), 257-260 (2017).
- Belkaid, Y., Harrison, O. J. Homeostatic immunity and the microbiota. Immunity. 46 (4), 562-576 (2017).
- Cabreiro, F., Gems, D. Worms need microbes too: microbiota, health and aging in Caenorhabditis elegans. EMBO Molecular Medicine. 5 (9), 1300-1310 (2013).
- Vaga, S., et al. Compositional and functional differences of the mucosal microbiota along the intestine of healthy individuals. Scientific Reports. 10 (1), 14977(2020).
- Nagpal, R., et al. Gut microbiome and aging: Physiological and mechanistic insights. Nutrition and Healthy Aging. 4 (4), 267-285 (2018).
- Mitsuoka, T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 33 (3), 99-116 (2014).
- Bonfili, L., et al. Microbiota modulation as preventative and therapeutic approach in Alzheimer's disease. The FEBS Journal. 288 (9), 2836-2855 (2021).
- Vendrik, K. E. W., et al. Fecal microbiota transplantation in neurological disorders. Frontiers in Cellular and Infection Microbiology. 10, 98(2020).
- Wang, Q., et al. The role of gut dysbiosis in Parkinson's disease: mechanistic insights and therapeutic options. Brain. 144 (9), 2571-2593 (2021).
- Zhu, X., et al. The relationship between the gut microbiome and neurodegenerative diseases. Neuroscience Bulletin. 37 (10), 1510-1522 (2021).
- Miller, I. The gut-brain axis: historical reflections. Microbial Ecology in Health and Disease. 29 (1), 1542921(2018).
- Foster, J. A., Rinaman, L., Cryan, J. F. Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress. 7, 124-136 (2017).
- Coman, V., Vodnar, D. C. Gut microbiota and old age: Modulating factors and interventions for healthy longevity. Experimental Gerontology. 141, 111095(2020).
- Conway, J., Duggal, N. A. Ageing of the gut microbiome: Potential influences on immune senescence and inflammageing. Ageing Research Reviews. 68, 101323(2021).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10 (8), 1998-2009 (2016).
- Dirksen, P., et al. CeMbio - The Caenorhabditis elegans Microbiome Resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: gateway to a new host-microbiome model. BMC Biology. 14, 38(2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Felix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Zimmermann, J., et al. The functional repertoire contained within the native microbiota of the model nematode Caenorhabditis elegans. The ISME Journal. 14 (1), 26-38 (2020).
- Dinic, M., et al. Host-commensal interaction promotes health and lifespan in Caenorhabditis elegans through the activation of HLH-30/TFEB-mediated autophagy. Aging. 13 (6), 8040-8054 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against alpha-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Hacariz, O., Viau, C., Karimian, F., Xia, J. The symbiotic relationship between Caenorhabditis elegans and members of its microbiome contributes to worm fitness and lifespan extension. BMC Genomics. 22 (1), 364(2021).
- Shin, M. G., et al. Bacteria-derived metabolite, methylglyoxal, modulates the longevity of C. elegans through TORC2/SGK-1/DAF-16 signaling. Proceedings of the National Academy of Sciences of the United States of America. 117 (29), 17142-17150 (2020).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Zhang, F., et al. High-throughput assessment of changes in the Caenorhabditis elegans gut microbiome. Methods in Molecular Biology. 2144, 131-144 (2020).
- Chan, J. P., et al. Using bacterial transcriptomics to investigate targets of host-bacterial interactions in Caenorhabditis elegans. Scientific Reports. 9 (1), 5545(2019).
- Hartsough, L. A., et al. Optogenetic control of gut bacterial metabolism to promote longevity. Elife. 9, 56849(2020).
- Pryor, R., et al. Host-microbe-drug-nutrient screen identifies bacterial effectors of Metformin therapy. Cell. 178 (6), 1299-1312 (2019).
- Benedetto, A., et al. New label-free automated survival assays reveal unexpected stress resistance patterns during C. elegans aging. Aging Cell. 18 (5), 12998(2019).
- Coburn, C., et al. Anthranilate fluorescence marks a calcium-propagated necrotic wave that promotes organismal death in C. elegans. PLOS Biology. 11 (7), 1001613(2013).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Naomi, R., et al. Probiotics for Alzheimer's disease: a systematic review. Nutrients. 14 (1), 20(2021).
- Zheng, S. Y., et al. Potential roles of gut microbiota and microbial metabolites in Parkinson's disease. Ageing Research Reviews. 69, 101347(2021).
- Gill, M. S., Olsen, A., Sampayo, J. N., Lithgow, G. J. An automated high-throughput assay for survival of the nematode Caenorhabditis elegans. Free Radical Biology and Medicine. 35 (6), 558-565 (2003).
- Park, H. -E. H., Jung, Y., Lee, S. -J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Partridge, F. A., et al. An automated high-throughput system for phenotypic screening of chemical libraries on C. elegans and parasitic nematodes. International Journal for Parasitology: Drugs and Drug Resistance. 8 (1), 8-21 (2018).
- Rahman, M., et al. NemaLife chip: a micropillar-based microfluidic culture device optimized for aging studies in crawling C. elegans. Scientific Reports. 10 (1), 16190(2020).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: a quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Brown, A. E., Schafer, W. R. Unrestrained worms bridled by the light. Nature Methods. 8 (2), 129-130 (2011).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652(2017).
- Jushaj, A., et al. Optimized criteria for locomotion-based healthspan evaluation in C. elegans using the WorMotel system. PLoS One. 15 (3), 0229583(2020).
- Nambyiah, P., Brown, A. E. X. Quantitative behavioural phenotyping to investigate anaesthesia induced neurobehavioural impairment. Scientific Reports. 11 (1), 19398(2021).
- Squiban, B., Belougne, J., Ewbank, J., Zugasti, O. Quantitative and automated high-throughput genome-wide RNAi screens in C. elegans. Journal of Visualized Experiments. (60), e3448(2012).
- Zugasti, O., et al. Activation of a G protein-coupled receptor by its endogenous ligand triggers the innate immune response of Caenorhabditis elegans. Nature Immunology. 15 (9), 833-838 (2014).
- Zugasti, O., et al. A quantitative genome-wide RNAi screen in C. elegans for antifungal innate immunity genes. BMC Biology. 14, 35(2016).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon