Method Article
الفسفرة الثلاثية الكيميائية لأوليغونوكليوتيدات
In This Article
Summary
Oligonucleotide 5′-triphosphates هي مكونات في كل مكان في المسارات البيولوجية الأساسية وشهدت استخداما متزايدا في تطبيقات التكنولوجيا الحيوية. هنا ، نصف تقنيات التوليف الروتيني وتنقية oligonucleotide 5′-triphosphates ، بدءا من oligonucleotides التي أعدتها تقنيات التوليف الآلي القياسية.
Abstract
ال 5′-triphosphate هو تعديل أساسي للحمض النووي موجود طوال الحياة ويستخدم بشكل متزايد كتعديل وظيفي للأوليغونوكليوتيدات في التكنولوجيا الحيوية والبيولوجيا التركيبية. تم تحضير Oligonucleotide 5′-triphosphates تاريخيا في المختبر بطرق إنزيمية. ومع ذلك ، تقتصر هذه الطرق على أوليغونوكليوتيدات الحمض النووي الريبي الطبيعية ، ولها تفضيلات تسلسل قوية ، وتميل إلى إنتاج منتجات غير متجانسة. تكمل الطرق الجديدة للفسفرة الثلاثية الكيميائية كلا من التكلفة المخفضة لتخليق أوليغونوكليوتيد الآلي بواسطة كيمياء الفوسفوراميديت ومجموعة متنوعة من تعديلات النيوكليوتيدات المتاحة الآن. وبالتالي ، فإن تخليق ثلاثي فوسفات oligonucleotide من التسلسل والطول التعسفيين ، والذي يحتوي اختياريا على تعديلات غير طبيعية مختلفة ، أصبح الآن متاحا الآن.
تعرض هذه الورقة الطرق والتقنيات المناسبة للفسفرة الثلاثية الكيميائية للأوليغونوكليوتيدات باستخدام فوسفوروكلوريد الساليسيل والبيروفوسفات. تستخدم هذه الطريقة الكواشف المتاحة تجاريا ، وهي متوافقة مع معظم النوكليوتيدات القليلة التي يتم إعدادها بواسطة طرق توليف الطور الصلب القياسية ، ويمكن إكمالها في 2 ساعة بعد تخليق oligonucleotide ، قبل إزالة الحماية والتنقية. تم توضيح استخدامين لأوليغونوكليوتيدات ثلاثي الفوسفوريلات كيميائيا كركائز لإنزيمات الحمض النووي الريبي الحفازة ، بما في ذلك تخليق نسخة صورة طبق الأصل من ريبوزيم رأس المطرقة من ثلاثي الفوسفات L-RNA غير البيولوجي.
Introduction
شكل 5′-triphosphorylated من الحمض النووي الريبي هو في كل مكان في علم الأحياء كما يتم إنشاؤه عن طريق نسخ الحمض النووي الريبي في جميع مجالات الحياة وعن طريق تكرار الحمض النووي الريبي خلال دورة حياة العديد من فيروسات الحمض النووي الريبي. هذه التريفوسفات بمثابة الركيزة لتشكيل mRNA 7-methylguanylate المغطاة في حقيقيات النوى ، وبالتالي ، تلعب دورا أساسيا في التعبير عن البروتين1. في المقابل ، يتم الاحتفاظ بالفوسفات الثلاثي في البكتيريا والفيروسات. وبالتالي ، يتم التعرف على الحمض النووي الريبي 5 ′ ثلاثي الفوسفات من قبل منظمي الاستجابة للمناعة الفطرية في حقيقيات النوى2،3،4،5،6،7. خارج علم الأحياء ، تم تطوير مجموعة من ريبوزيمات الحمض النووي الريبي ليغاز لاستخدام 5 ′ ثلاثي الفوسفات في المختبر8 وتعديلها للاستخدام في الفحوصات التشخيصية9،10،11،12،13،14،15. يمكن استخدام أحد هذه الإنزيمات الريبوزية للتخليق المعتمد على القالب ل L-RNA ، وهو enantiomer "صورة مرآة" غير بيولوجي ل D-RNA الطبيعي ، من قليل النوكليوتيد L-RNA 5 ′ - ثلاثي الفوسفات16،17،18. يعد التحضير الروتيني لأوليغونوكليوتيدات ثلاثي الفوسفوريلات ذات التسلسل المختلف وتكوين العمود الفقري أمرا ضروريا للتحقيق في هذه الأنظمة.
الطريقة الأكثر شيوعا والتي يمكن الوصول إليها لإعداد الحمض النووي الريبي 5′-ثلاثي الفوسفات في المختبر هي عن طريق النسخ في المختبر. ومع ذلك ، فإن الحمض النووي الريبي الذي تنتجه هذه الطريقة مقيد في التسلسل والحجم حسب متطلبات المروج والركيزة لإنزيم بوليميراز الحمض النووي الريبي. بوليميراز الحمض النووي الريبي T7 ومشتقاته المتخصصة هي البوليميراز الأكثر شيوعا المستخدمة لهذا الغرض19،20،21،22. يجب أن يبدأ الحمض النووي الريبي المنسوخ في المختبر المحضر بهذه الإنزيمات باستخدام البيورين المكون من 5 أطراف وهو منحاز بشدة نحو البيورينات في أول 10 نيوكليوتيدات23,24. علاوة على ذلك ، فإن الدمج الأنزيمي للنيوكليوتيدات المعدلة بالقاعدة أو العمود الفقري غير فعال في أحسن الأحوال وغالبا ما يكون مستحيلا مع البوليميراز الطبيعي ، مما يحد من فرصة إنتاج أوليغونوكليوتيد 5 ′ ثلاثي الفوسفات يتكون من أي شيء باستثناء الحمض النووي الريبي D-RNA الطبيعي. عامل آخر مقيد هو أن الحمض النووي الريبي الناتج عن النسخ في المختبر يمكن أن يحتوي على عدم تجانس كبير 5 و 3 ويتم إنتاجه كمنتجات غير متجانسة للغاية عندما يكون أقصر من 20 nt 23,24,25,26,27.
في المقابل، يمكن استخدام الفسفرة الثلاثية الكيميائية لأوليغونوكليوتيدات المحضرة بواسطة تخليق الفوسفوراميديت ذي الطور الصلب28،29،30،31،32،33،34،35 لإعداد أوليغونوكليوتيد 5 ′-ثلاثي الفوسفات 3-50 نانوت طويلة، من أي تسلسل. بالإضافة إلى ذلك ، يمكن إضافة مجموعة واسعة من تعديلات الحمض النووي التي يمكن الوصول إليها لتخليق الفوسفوراميديت إلى oligonucleotides قبل 5′-triphosphorylation 14,15,16,17,18,29,36. تستخدم العديد من هذه الطرق كاشف الفوسفيتيل ساليسيل فوسفوروكلوريديت ، الذي طوره لودفيغ وإيكشتاين لمرحلة الحل ثلاثية الفسفرة من أحادي النوكليوسيدات37. يتم تحقيق الفسفرة الثلاثية للأوليغونوكليوتيدات مع هذا الكاشف في المرحلة الصلبة عن طريق فوسفيتيل أوليغونوكليوتيد 5′-هيدروكسيل ، وتحويله إلى ثلاثي الفوسفات عن طريق التفاعل مع بيروفوسفات والأكسدة ، تليها الإجراءات القياسية لانقسام أوليغونوكليوتيد من الدعم الصلب ، وإزالة الحماية ، والتنقية (الشكل 1) 28.
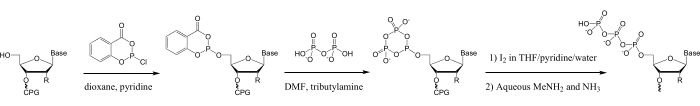
الشكل 1: مخطط للفسفرة الثلاثية للأوليغونوكليوتيدات الاصطناعية. في الخطوة الأولى ، يتم فوسفيتيل oligonucleotide 5ʹ-hydroxyl مع SalPCl. في الخطوة التالية ، يتم تفاعل فوسفيت 5ʹ-salicyl مع TBAP لتشكيل metaphosphite الدوري ، ثم في الخطوة الثالثة يتأكسد لتوليد الفوسفات الدوري 5ʹ-trimetametasphate في محلول أكسدة مركب الحمض النووي / الحمض النووي الريبي (0.1 M Iodine / pyridine / H2O / THF) ، والذي يتم تحلله بسرعة لإنتاج الخطي 5ʹ-triphosphate في نفس المحلول28,33 ، 37. سيؤدي الانقسام القلوي اللاحق من دعم CPG الصلب وإزالة الحماية من oligonucleotide في MeNH2 / الأمونيا المائية إلى تحلل أي ثلاثي ميتافوسفات دوري متبقي إلى الشكل الخطي. الاختصارات: SalPCl = ساليسيل فوسفوروكلوريديت; TBAP = ثلاثي التيلامونيوم بيروفوسفات; THF = رباعي هيدروفوران. CPG = زجاج المسام الذي يتم التحكم فيه ؛ MeNH2 = ميثيل أمين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
على الرغم من أن التقارير المنشورة في وقت مبكر باستخدام هذه الطريقة غالبا ما عانت من ضعف الغلة والمنتجات الجانبية غير المرغوب فيها28،37،38 ، إلا أن الصيانة الدقيقة للظروف اللامائية هي كل ما هو ضروري للحصول على غلات عالية بشكل روتيني. يمكن تحقيق ذلك عن طريق التحضير الدقيق للكواشف واستخدام جهاز تفاعل بسيط يتم تجميعه من مكونات بلاستيكية قياسية. هنا ، نوضح الخطوات المناسبة للفسفرة الثلاثية الكيميائية للأوليغونوكليوتيدات ، بما في ذلك تحضير الكواشف ، وتجميع غرفة التفاعل ، وتفاعل الفسفرة الثلاثية ، وإزالة الحماية والتنقية اللاحقة من أوليغونوكليوتيدات ثلاثي الفوسفوريلات. ويشمل أيضا الاستخدام التمثيلي ل 5′-triphosphorylated oligonucleotides كركائز لريبوزيمات الليغاز لتخليق منتجات الأحماض النووية الأكبر مع الحمض النووي الريبي D-RNA الطبيعي والعمود الفقري L-RNA اللاأحيائي.
Protocol
1. توليف الطور الصلب الآلي من 5 ′ هيدروكسيل oligonucleotides على دعم صلب
- قم بإعداد مركب الحمض النووي / الحمض النووي الريبي الآلي مع الكواشف والفوسفوراميديت وفقا لتكوين أوليغونوكليوتيد المستهدف وتعليمات الأداة.
- قم بتحميل عمود توليف يحتوي على دعم صلب على جهاز المزج وتوليف أوليغونوكليوتيدات وفقا لبروتوكولات أداة التوليف.
ملاحظة: تم تحسين إجراء الفسفرة الثلاثية للأوليغونوكليوتيدات المحضرة على مقياس 1 ميكرومول. - قم بإزالة مجموعة الحماية 5′-dimethoxytrityl لإنتاج oligonucleotide 5′-hydroxyl المدعوم بالمواد الصلبة كجزء من تخليق oligonucleotide في الخطوة السابقة ، أو عن طريق إجراء خطوة الانحراف الطرفي وفقا لبروتوكولات أداة التوليف.
- قم بإزالة العمود الذي يحتوي على أوليغونوكليوتيد 5′-hydroxyl على دعم صلب من المركب ، وجفف تحت فراغ المنزل لمدة 10 دقائق لإزالة المذيب المتبقي ، وانتقل إلى الفسفرة الثلاثية (القسمان 3 و 4) بمجرد إعداد المواد اللازمة للفسفرة الثلاثية (القسم 2).
ملاحظة: إذا لم يتم استخدامه على الفور ، يمكن تخزين العمود المجفف تحت جو طبيعي في حاوية بلاستيكية مغلقة مع مجفف عند -20 درجة مئوية. ليست هناك حاجة إلى مزيد من التجفيف في هذه المرحلة حيث يتم تجفيف العمود جيدا قبل الفسفرة الثلاثية في القسم 3.
2. إعداد المواد للفسفرة الثلاثية
- قم بتوصيل مصدر أرجون جاف بضغط قابل للتعديل بمشعب غاز بخطين على الأقل وقم بتوصيله بفقاعة. تأكد من انتهاء الخطوط في محاقن بلاستيكية سعة 1 مل لتسهيل الاتصال بجهاز التفاعل.
- اجمع المعدات لاستخدامها أثناء الفسفرة الثلاثية، بما في ذلك المحاقن البلاستيكية سعة 1 مل، وسدادة البولي بروبيلين ثلاثية الاتجاهات، وإبر غير متجانسة، وأنابيب بولي بروبيلين سعة 1.5 مل، وملعقة معدنية صغيرة. تخزينها في حاوية مغلقة أو مجفف مع المجفف في درجة حرارة الغرفة لمدة 1 يوم على الأقل قبل الاستخدام.
- تحضير 30 مل لكل من الديوكسان اللامائي 1,4 ، 3: 1 الديوكسان: البيريدين حسب الحجم ، N ، N-dimethylformamide (DMF) ، والأسيتونيتريل (ACN) في زجاجات زجاجية مجففة 30 مل مع مصائد تجفيف (4 Å غربال جزيئي في حزم غشاء مغلقة) قبل يوم واحد على الأقل من الاستخدام. ختم مع حاجز مطاطي ، وتخزينها في مجفف مع الجفف.
- تخزين الصلبة 2-كلورو-4H-1،3،2-بنزوديوكسافوسفورين-4-واحد (ساليسيل فوسفوروكلوريديت، SalPCl) في حاويته الأصلية داخل جرة مغلقة مع المجفف في 4 درجات مئوية. اغسل الحاوية دائما بالأرجون بين الاستخدامات.
- تحضير محلول بيروفوسفات تريبوتيلامونيوم (TBAP) قبل 5 أيام على الأقل من تفاعل الفسفرة الثلاثية:
- يزن 1-5 غرام من TBAP الصلب في زجاجة زجاجية مجففة 30 مل ويذوب في 1 مل من DMF و 0.5 مل من ثلاثي البوتيل لامين لكل غرام من TBAP.
- أضف ثلاثة مصائد تجفيف ، وأغلق الزجاجة بحاجز مطاطي تحت الأرجون ، وقم بفقاعة مع الأرجون لمدة 30 دقيقة للتخلص منها.
- يخزن داخل جرة مغلقة مع مجفف عند 4 درجات مئوية لمدة 5 أيام للسماح للغربال الجزيئية بامتصاص كل الماء النزرة. تخزين الجرة في -20 درجة مئوية وإعدادها طازجة بعد 6 أشهر.
3. تجميع واستخدام جهاز الفسفرة الثلاثية
- اسمح لعمود التوليف بالدفء إلى درجة حرارة الغرفة إذا تم استرجاعه من التخزين عند -20 درجة مئوية.
- تجميع غرفة التفاعل الموضحة في الشكل 2:
- تحضير غرفة الانتظار: قم بإزالة المكبس من حقنة جافة سعة 1 مل ، واقطع الجزء العلوي من المحقنة باستخدام مقص أو شفرة حلاقة ، وقم بإرفاق المحقنة بعمود التوليف. قم بتوصيل السدادة ثلاثية الاتجاهات بالجزء العلوي من المحقنة وقم بتوصيل المدخل الجانبي لجهاز التوقف بمصدر الأرجون الجاف باستخدام الفقاعة ، بحيث يكون المدخل العلوي لل stopcock هو منفذ حقن الكاشف.
- قم بتأمين هذا الجهاز على حامل مع المشابك وختم جميع مفاصل المنبع بفيلم ختم الشمع. اضبط الموقوف بحيث يتم إغلاق منفذ الحقن ، ويكون الجهاز مفتوحا لمصدر الأرجون. أغلق الفقاعة، واسمح للأرجون عند الضغط المنخفض (<10 رطل لكل بوصة مربعة) بالتدفق عبر غرفة التفاعل لمدة 5 دقائق.
ملاحظة: يمكن ضبط غرف التفاعل المتعددة بالتوازي مع ثلاثي الفوسفوريلات 2-4 أوليغونوكليوتيدات. ومع ذلك ، ينبغي حجز خط واحد من المشعب لتوريد الأرجون إلى زجاجات الكاشف. - أعد فتح الفقاعة وأرفق حقنة بأسفل عمود التوليف ، والتي ستكون حقنة النفايات. سحب الأرجون من خلال العمود بشكل متكرر باستخدام حقنة النفايات ؛ ثم ، أعد توصيل المحقنة باستخدام المكبس الذي تم دفعه بالكامل.
ملاحظة: ما لم يتم تحميل الكواشف، يجب ضبط الموقوف بحيث يتم إغلاق منفذ الحقن وفتح الجهاز لمصدر الأرجون، كما هو موضح في الشكل 2A. وبالمثل ، يجب إرفاق حقنة النفايات وختم المفصل بعمود التوليف بفيلم ختم الشمع ما لم تتم إزالة الكواشف بنشاط.
- لإضافة كاشف أو مذيب:
- قم بإرفاق إبرة بمصدر الأرجون الجاف وأدخلها في حاجز الكاشف أو زجاجة المذيبات ، مع الحرص على عدم غمر الإبرة في محتويات الزجاجة.
- قم بتجميع حقنة جافة بإبرة وأدخلها في حاجز الكاشف أو زجاجة المذيبات ، دون غمرها في محتويات الزجاجة. املأ المحقنة بالأرجون ، واسحب الإبرة من الحاجز ، واطرد الأرجون. املأ المحقنة بالأرجون وطردها مرة أخرى ؛ ثم املأ المحقنة بالحجم المطلوب من المذيب أو الكاشف تحت ضغط الأرجون.
- اضبط الإيقاف على الجهاز بحيث يتم إغلاق مصدر الأرجون ، ويكون منفذ الحقن مفتوحا (الشكل 2B). قم بإزالة المحقنة والإبرة المملوءة بسرعة من الزجاجة المصدر، وامسح أي مذيب عالق على جانب الإبرة أو طرفها، وأدخل الإبرة في منفذ الحقن. طرد الكاشف إلى غرفة الانتظار في الجهاز ، وإزالة الإبرة ، وإغلاق منفذ الحقن ، وإعادة فتح الجهاز إلى مصدر الأرجون.
- اسحب السائل بلطف من غرفة الانتظار على طول الطريق من خلال عمود التوليف باستخدام حقنة النفايات بحيث يتم الآن الاحتفاظ بكل السائل في حقنة النفايات. الآن ، ادفع المحلول ببطء مرة أخرى إلى عمود التوليف ، مما يضمن عدم وجود فقاعات غاز في العمود. للخلط أو التحريك ، اسحب المحلول برفق لأعلى ولأسفل فوق العمود باستخدام حقنة النفايات.
ملاحظة: حرك السائل دائما ببطء وبلطف عبر غرفة التفاعل لضمان عدم كسر الأختام ، مما يسمح للهواء بدخول الجهاز.
- لإزالة كاشف أو مذيب من العمود:
- اسحب المحلول ببطء إلى حقنة النفايات. بعد مرور الجزء الأكبر من المحلول إلى حقنة النفايات ، اسحب الأرجون لطرد المذيب المتبقي من العمود.
- قم بإزالة فيلم ختم الشمع حول مفصل حقنة النفايات ، ثم قم بإزالة المحقنة وتخلص من محلول النفايات. استبدل حقنة النفايات بحقنة جديدة جافة ، وأعد إغلاق المفصل بفيلم مانع للتسرب بالشمع.
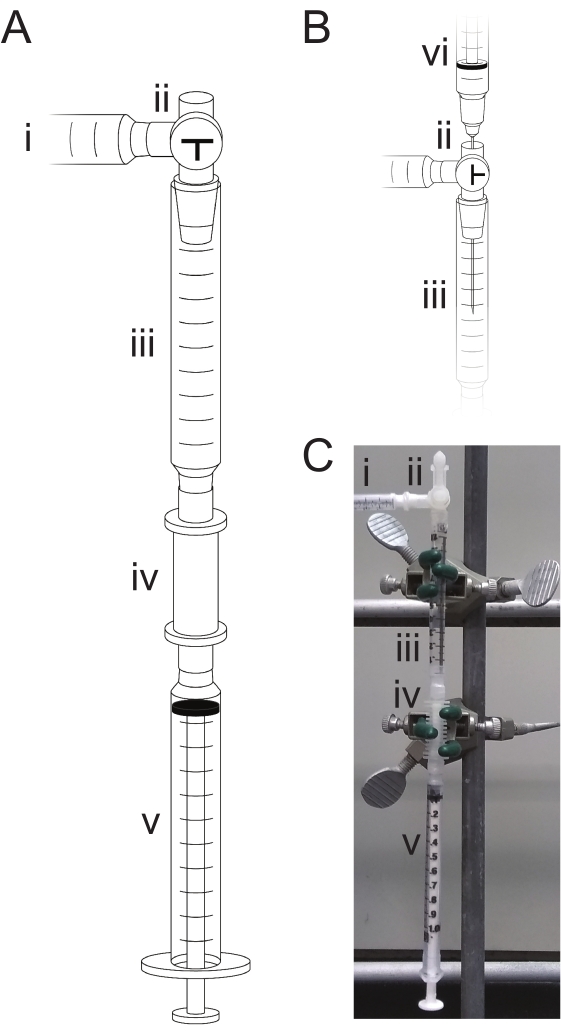
الشكل 2: جهاز الفسفرة الثلاثية. أثناء الخلط أو التفاعلات ، يكون الجهاز (A) مفتوحا لمصدر الأرجون (i) ومغلقا على الهواء عن طريق ضبط stopcock ثلاثي الاتجاهات (ii). يتم سحب الكواشف من غرفة الانتظار (iii) إلى عمود التوليف (iv) عن طريق حقنة النفايات (v). تتم إزالة الكواشف عن طريق سحب جميع السوائل إلى حقنة النفايات (v) والتخلص منها. عند تحميل الكواشف (B) ، يكون السدادة الثلاثية (ii) مفتوحة للغلاف الجوي ، ويتم تحميل الكاشف في غرفة الانتظار (iii) عن طريق حقنة وإبرة (vi). (ج) صورة فوتوغرافية للجهاز المجمع كما في (أ) لخلط الكواشف وتفاعلها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. الفسفرة الثلاثية على العمود من الاصطناعية 5 ′ هيدروكسيل أوليغونوكليوتيد
- قم بإزالة محلول SalPCl و TBAP من التخزين عند -20 درجة مئوية واتركه يسخن إلى درجة حرارة الغرفة قبل الاستخدام.
- أضف 200 ميكرولتر من البيريدين/الديوكسان إلى غرفة الانتظار، وفقا للخطوات 3-3-1-3-3-3-3. ومع ذلك، لا تقم بتحميل المذيب على عمود التوليف حتى الخطوة 4.4.
- استخدم ملعقة معدنية جافة لوزن 6-12 ملغ من SalPCl في أنبوب طرد مركزي دقيق جاف 1.5 مل ، وتذوب في 100 ميكرولتر من الديوكسان عن طريق حقن المذيب بلطف لأعلى ولأسفل داخل أنبوب الطرد المركزي الدقيق.
- أضف SalPCl المذاب إلى غرفة الانتظار وقم بتحميله على عمود التوليف ، باتباع الخطوة 3.3. دعه يتفاعل لمدة 15 دقيقة ، مما يؤدي إلى تحريك المحلول كل 5 دقائق. قم بإزالة حل SalPCl وتجاهله وفقا للخطوة 3.4.
ملاحظة: يضاف SalPCl بفائض كبير وسوف ينقب عن أي ماء يتم امتصاصه أثناء التحضير والتحميل في غرفة التفاعل. ومع ذلك ، فإن إدخال أي رطوبة خلال الخطوتين 4.5 و 4.6 سيضر بالعائد النهائي لأوليغونوكليوتيد 5 ′ ثلاثي الفوسفات. - أضف 250 ميكرولتر من محلول TBAP إلى غرفة الانتظار وقم بتحميله على عمود التوليف ، باتباع الخطوة 3.3. دعه يتفاعل لمدة 20 دقيقة ، مما يثير كل 5 دقائق. قم بإزالة حل TBAP وتجاهله وفقا للخطوة 3.4.
- اغسل العمود ب 0.5 مل من DMF ، ثم 0.5 مل من ACN ، وقم بإزالة المذيب بعد كل إضافة وفقا للخطوتين 3.3 و 3.4.
- أضف 250 ميكرولتر من محلول المؤكسد (0.1 مليون يود في رباعي هيدروفوران (THF) / بيريدين / ماء ، 88:10:2) إلى غرفة الانتظار وقم بتحميله على عمود التوليف ، باتباع الخطوة 3.3. دعه يتفاعل لمدة 30 دقيقة ، ويهيج كل 10 دقائق. قم بإزالة محلول المؤكسد والتخلص منه وفقا للخطوة 3.4.
- اغسل العمود ب 0.5 مل من ACN وقم بإزالته ، وفقا للخطوتين 3.3 و 3.4.
- تفكيك جهاز التفاعل. اغسل عمود التوليف ب 5 مل من ACN وجفف العمود.
5. الانقسام من الدعم الصلب ، وإزالة الحماية ، والتنقية
- قم بإزالة راتنج الدعم الصلب المجفف من عمود التوليف وانقله إلى أنبوب قابل للإغلاق بغطاء لولبي من البولي بروبيلين سعة 1.5 مل مع حلقة سيليكون o.
- الراتنج في 1 مل من خليط 1: 1 من 28٪ -30٪ من الأمونيا المائية و 40٪ من ميثيل أمين مائي (AMA) وأغلق الأنبوب بإحكام. تحضن عند 65 درجة مئوية لمدة 10 دقائق مع خلط متقطع عن طريق الانعكاس اللطيف39. استخدم علاجا أكثر اعتدالا في درجة حرارة الغرفة لمدة 2 ساعة لقلة النوكليوتيدات الأطول من 40 طن.
تنبيه: تسخين محلول AMA سيضع الأنبوب تحت ضغط عال. إذا لم يكن الأنبوب مغلقا بإحكام أو لا يستخدم حلقة o متوافقة مع الأمونيا (السيليكون) ، فقد يقوم الأنبوب بتنفيس الغاز أو مذيب التسرب ، مما قد يعرض السلامة أو عائد المنتج النهائي للخطر. لا تقم أبدا بفتح الأنبوب أثناء وجوده فوق درجة الحرارة المحيطة ، حيث يمكن لمحلول AMA الساخن أن يطور الغاز بعنف. - قم بتبريد الأنبوب على الجليد وقم بطرده مركزيا لفترة وجيزة (6000-12000 × جم لمدة 10 ثوان). قم بإزالة المادة الفائقة من الراتنج ، وقم بالتصفية من خلال حقنة مجهزة بمرشح 0.2 ميكرومتر ، وانقلها إلى أنبوب بولي بروبيلين جديد معقم. تبخر المحلول إلى الجفاف باستخدام جهاز طرد مركزي فراغي مزود بمصيدة كيميائية محايدة للأمونيا.
ملاحظة: إذا كان أوليغونوكليوتيد الاصطناعية لا يحتوي على أي نيوكليوتيدات الحمض النووي الريبي مع مجموعات حماية 2′-silyl، انتقل إلى الخطوة 5.8. - قم بإزالة مجموعات حماية السيليل عن طريق إذابة المادة المجففة في 1 مل من فلوريد رباعي بوتيلامونيوم 1 M (TBAF) في THF ، والتسخين إلى 55 درجة مئوية ، والاهتزاز إذا لزم الأمر لإذابة oligonucleotide بالكامل ، والحضانة في درجة حرارة الغرفة لمدة 16-24 ساعة40,41.
- قم بإخماد محلول TBAF باستخدام 1 مل من المخزن المؤقت 1 M Tris ، ودرجة الحموضة 7.5 ، وإزالة THF باستخدام جهاز طرد مركزي فراغي.
- قم بإزالة أملاح TBAF باستخدام عمود استبعاد الحجم القابل للتصرف، باتباع إرشادات الشركة المصنعة. بالنسبة لقلة النوكليوتيدات الأقصر من 15 نانوت ، تأكد من إزالة المنتج عن طريق جمع اللوات في كسور ، وتحديد كسور المنتج الرئيسية عن طريق الامتصاص عند 260 نانومتر على مقياس الطيف الضوئي UV-Vis.
- ركز أوليغونوكليوتيد الحمض النووي الريبي غير المحمي عن طريق التجفيد أو جهاز الطرد المركزي الفراغي إذا كان أقل من 15 نانوت ، أو عن طريق هطول الأمطار من الإيثانول إذا كان أكبر من 15 نانو.
- قم بإعداد مقياس تحضيري بنسبة 10٪ -20٪ بولي أكريلاميد / 8 م يوريا / 1x TBE gel باستخدام 19: 1 mono:bis acrylamide stock ، وفقا للبروتوكولات المناسبة لحجم oligonucleotide ، لوحة هلام ، وحامل. قم بتجميع لوحة الجل في حامل الجل مع 1x TBE في الخزانات وقم بتشغيلها مسبقا عند 35 واط (أو حسب الاقتضاء لتنسيق لوحة الهلام) لمدة 30 دقيقة على الأقل.
- قم بإذابة oligonucleotide الصلبة في مخزن مؤقت لتحميل هلام اليوريا (8 M يوريا ، 10٪ سكروز ، 50 mM Tris ، pH 8 ، 1 mM EDTA مع بروموفينول وأصباغ زيرين سيانول قيد التشغيل) وتسخينها إلى 80 درجة مئوية. قم بالتحميل على هلام البولي أكريلاميد واستمر لمدة 1-2 ساعة عند 25-35 واط (أو حسب الاقتضاء لتنسيق لوحة الجل وحجم oligonucleotide).
ملاحظة: يجب استبعاد بروموفينول الأزرق أو الزيلين سيانول من مخزن تحميل الجل المخزن المؤقت لأوليغونوكليوتيدات أقصر من 15 نانوت إذا كان أي منهما يهاجر مع المنتج ، حيث يصعب إزالة هذه الأصباغ من أوليغونوكليوتيد المسحوق دون هطول الأمطار من الإيثانول. - عند اكتمال الرحلان الكهربائي للهلام ، قم بإزالة لوحة الجل من حامل الجل ، وقم بتفكيك لوحة الجل ، ولف الجل في فيلم بولي فينيل كلوريد. حدد نطاقات المنتج عن طريق التظليل الخلفي بضوء الأشعة فوق البنفسجية 254 نانومتر ، واستقص نطاق المنتج الرئيسي باستخدام شفرة حلاقة.
- استخراج oligonucleotide من الجل المقتطع عن طريق طريقة سحق ونقع42.
- سحق الجل المقتطع عن طريق بثقه من خلال حقنة بلاستيكية أو ميكانيكيا.
- بالنسبة لأوليغونوكليوتيدات أطول من 15 نانو:
- العود في 3x أحجام من المخزن المؤقت للسحق والنقع (300 mM NaCl ؛ 10 mM Tris ، الرقم الهيدروجيني 8 ؛ 1 mM EDTA) لمدة 12 ساعة على الأقل مع الإثارة أو الاهتزاز.
- قم بإزالة قطع الجل الصلبة عن طريق تمرير المحلول من خلال حقنة مزودة بمرشح 0.2 ميكرومتر وتركيز oligonucleotide عن طريق هطول الأمطار من الإيثانول.
- بالنسبة لقلة النوكليوتيد الأقصر من 15 nt:
- العود في 3x كميات من الماء الخالي من النوكليز لمدة 12 ساعة على الأقل مع الإثارة أو الاهتزاز.
- قم بإزالة قطع الجل الصلبة عن طريق تمرير المحلول عبر حقنة مزودة بمرشح 0.2 ميكرومتر وركز عن طريق التجفيد.
- قم بإزالة الأملاح والمذابات المتبقية باستخدام عمود استبعاد الحجم القابل للتصرف كما في الخطوة 5.6. التركيز عن طريق التجفيد.
- تخزين أوليغونوكليوتيدات ثلاثي الفوسفوريلات النقية عند -20 درجة مئوية في مخزن TE العازل (10 mM Tris، الرقم الهيدروجيني 8؛ 1 mM EDTA) أو في مخزن مؤقت مماثل لتخزين النوكليوتيدات.
- تحديد تركيز أوليغونوكليوتيد عن طريق قياس الامتصاص عند 260 نانومتر باستخدام مقياس الطيف الضوئي للأشعة فوق البنفسجية.
ملاحظة: لا ينبغي أن يتأثر معامل الانقراض المقدر لقلة النوكليوتيد بحالة الفسفرة 5 ′ ، ويمكن حسابه من تسلسله باستخدام آلة حاسبة معامل انقراض oligonucleotide. - تحقق من الفسفرة الثلاثية عن طريق قياس الطيف الكتلي. ابحث عن كتلة متوقعة مقدارها +239.94 دا بالنسبة إلى كتلة أوليغونوكليوتيد 5′-هيدروكسيل.
ملاحظة: إما الامتزاز/التأين بالليزر بمساعدة المصفوفة أو قياس الطيف الكتلي للتأين بالرش الكهربائي (MALDI-MS أو ESI-MS، على التوالي) مناسبان لتحديد حالة الفسفرة الثلاثية لقلة النوكليوتيد عند استخدام بروتوكولات محسنة للأحماض النووية. ومع ذلك ، يوفر ESI-MS نتائج أكثر اتساقا بسبب انخفاض معدلات تجزئة الأيونات. يتم توفير خدمة تجارية تمثيلية في جدول المواد.
- تحديد تركيز أوليغونوكليوتيد عن طريق قياس الامتصاص عند 260 نانومتر باستخدام مقياس الطيف الضوئي للأشعة فوق البنفسجية.
6. أوليغونوكليوتيدات ثلاثي الفوسفوريلات كركائز للتكرار الذاتي للريبوزيم
تحذير: 32P هو نظير مشع ويجب تنفيذ الخطوات التالية باستخدام بروتوكولات السلامة القياسية للعمل مع المواد المشعة في المختبر ومن قبل باحث معتمد لاستخدام المواد المشعة من قبل إدارات الصحة والسلامة البيئية ذات الصلة. كبديل ، يمكن تحضير الركيزة الريبوزية A ذاتية التكرار صناعيا باستخدام ملصق 5′-fluorescein14 وتصويره بالفلورسنت ، كما هو الحال في الخطوة 7.9.
- تحضير المحلول A كخليط من الريبوزيم E ذاتي النسخ المتماثل والركيزة 5′-32 P للحمض النووي الريبي المسمى A14 إلى تركيزات 0.30 μM و 30μM ، على التوالي. قم بإعداد المحاليل B-transcribed و B-synthetic مع ركيزة الحمض النووي الريبي ثلاثي الفوسفوريلات 15 ميكرومتر B ، التي يتم إعدادها بواسطة النسخ المختبري 14 أو الفسفرة الثلاثية الكيميائية على النحو الوارد أعلاه ، على التوالي ، في مخزن مؤقت EPPS 75 mM ، ودرجة الحموضة 8.5 ، و 37.5 MgCl2. اجعل كلا الحلين 42 درجة مئوية.
ملاحظة: يتم سرد كافة مكونات الحمض النووي الريبي في جدول المواد. - لبدء النسخ المتماثل الذاتي ، امزج بسرعة 5 ميكرولتر من المحلول A مع 10 ميكرولتر من المحلول B المنسوخ أو B الاصطناعي إلى تركيز نهائي قدره 0.1 μM E و 10 μM A و 10 μM B و 25 mM MgCl2 و 50 mM EPPS buffer ، الرقم الهيدروجيني 8.5. احتضان خليط التفاعل عند 42 درجة مئوية.
- على فترات منتظمة ، خذ 0.5 ميكرولتر من الأليكوتات وقم بتبريد 9.5 ميكرولتر من مخزن مؤقت لتحميل هلام الفورماميد (95٪ فورماميد ؛ 10 mM EDTA ، الرقم الهيدروجيني 8).
- قم بإعداد هلام بولي أكريلاميد تحليلي / 8 M urea / 1x TBE ، وفقا للبروتوكولات المناسبة للوحة الجل والحامل. قم بتجميع الجل المصبوب والصفيحة في حامل هلام ، واملأ الخزانات ب 1x TBE ، وقم بتشغيلها مسبقا عند 40 واط (أو حسب الاقتضاء لألواح وحوامل هلامية مختلفة) لمدة 30 دقيقة.
- قم بتسخين عينات التفاعل المروية إلى 80 درجة مئوية ، وقم بتحميل 5 ميكرولتر من العينة في كل بئر ، وقم بتشغيل الجل عند 40 واط لمدة 40 دقيقة تقريبا (أو حسب الاقتضاء لألواح وحوامل هلامية مختلفة).
- قم بإزالة صفيحة الجل من حامل الجل ، وقم بتفكيكها ، ولفها في فيلم بولي فينيل كلوريد. قم بتغطية الجل بشاشة فوسفورية وكشفه لمدة 1 ساعة (أو حسب الاقتضاء ل 32بكسل في الدقيقة) ؛ امسح الشاشة ضوئيا باستخدام ماسح ضوئي هلام فلورسنت / فوسفورسنت.
- حدد عائد التفاعل باستخدام برنامج قياس كمية صورة الهلام.
- افتح صورة الجل باستخدام مربع أدوات التحليل، واختر تحليل | تعريف الشكل، حدد المساحات | شكل المستطيل، وارسم مستطيلات بنفس الحجم حول نطاقات تتوافق مع A غير المتفاعل والمنتج E لكل مرة وكلا التفاعلين.
- اختر | التحليل طرح الخلفية، حدد المساحات | شكل المستطيل، وارسم مستطيلا بنفس الحجم في جزء فارغ من صورة الهلام. قم بتغيير طريقة طرح الخلفية لكل المستطيلات إلى مستطيل الصورة.
- اختر نافذة | نافذة منطقة 2، ثم تحرير | تصدير إلى Excel لتصدير وحدات تخزين بيكسل النطاق الكمي إلى ملف جدول بيانات.
- ارسم تركيز المنتج E مقابل الوقت ، وتناسب البيانات مع النمو اللوجستي Eq (1) باستخدام برنامج تركيب البيانات الإحصائية:
[ه] =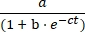 (1)
(1)
حيث a هو الحد الأقصى للتفاعل ، b هو درجة السيني ، و c هو معدل النمو الأسي.- في جدول البيانات المصدر، اقسم حجم المنتج E على مجموع أحجام الركيزة A والمنتج E لتحديد العائد الكسري للمنتج لكل مرة وكلا التفاعلين. اضرب في التركيز الأولي للركيزة A (10 μM) لتحديد عائد المنتج E كدالة للوقت.
- في برنامج ملائمة البيانات الإحصائية، اختر ملف | | الجديدة ملف مشروع جديد، حدد XY ضمن جدول ورسم بياني جديدين، ثم انقر فوق إنشاء. أدخل أوقات التفاعل وإنتاجية المنتج E لكل من التفاعلات في الأعمدة المتجاورة، وأعمدة التسمية المقابلة (على سبيل المثال، "الوقت" و"B المنسوخ" و"B الاصطناعي").
- اختر إدراج | تحليل جديد، حدد تحليلات XY | الانحدار غير الخطي (ملائمة المنحنى) ثم انقر فوق موافق. اختر منحنيات النمو | النمو اللوجستي وانقر فوق موافق ؛ لا تقم بضبط أي معلمات أخرى. راقب معلمات الملاءمة وفترات الثقة ضمن النتائج ومخطط نقاط البيانات والمنحنيات المجهزة أسفل الرسوم البيانية.
7. النسخ عبر الدائري من L-RNA
- قم بإعداد 10 ميكرولتر من محلول الحمض النووي الريبي الذي يحتوي على 20 ميكرومتر D-RNA 27.3t بوليميراز متقاطع ، و 2 ميكرومتر 5 ′ فلوريسين المسمى L-RNA التمهيدي ، و 4 ميكرومتر من قالب رأس المطرقة L-RNA البيوتينيل ، و 20 ميكرومتر لكل من L-RNA pppCUG و pppAUG و pppAGG و pppCGC ، في 10 ميكرولتر من 50 mM Tris ، الرقم الهيدروجيني 8.3. صلب الحمض النووي الريبي عن طريق تسخينه إلى 90 درجة مئوية لمدة 1 دقيقة والتبريد إلى 23 درجة مئوية عند 0.2 درجة مئوية / ثانية في دورة حرارية PCR. راجع جدول المواد للحصول على تفاصيل حول البوليميراز والتمهيدي والقالب.
- احتضن محلول الحمض النووي الريبي عند 17 درجة مئوية وابدأ التفاعل بإضافة 10 ميكرولتر من المخزن المؤقت لبدء التشغيل 2x (400 mM MgCl2 و 500 mM NaCl و 50 mM Tris ، الرقم الهيدروجيني 8.3). تأكد من أن التركيزات النهائية لجميع مكونات التفاعل هي 10 ميكرومتر بوليميراز ، 1 ميكرومتر تمهيدي ، قالب 2 ميكرومتر ، 10 ميكرومتر لكل ثلاثي نيوكليوتيد 5 ′-ثلاثي الفوسفات ، 200 mM MgCl2 ، 250 mM NaCl ، و 50 mM Tris ، الرقم الهيدروجيني 8.3.
- مع استمرار التفاعل ، خذ 10 ميكرولتر أليكوتس وقم بإخماد 5 ميكرولتر من 0.5 M EDTA ، الرقم الهيدروجيني 8.
- إلى كل عينة تفاعل مروية ، أضف 0.1 ملغ من الخرز المغناطيسي المطلي بالستربتافيدين (20 بمول بيوتين-أوليغونوكليوتيد قدرة الربط) معلقة في 10 ميكرولتر من 1 M NaCl في المخزن المؤقت TE مع منظف محايد بنسبة 0.05٪ لالتقاط الاشعال الممتد عبر القالب الحيوي واحتضان لمدة 30 دقيقة في درجة حرارة الغرفة مع الاهتزاز.
- التقط الخرز على مغناطيس التقاط الخرز ، وقم بإزالة السائل والتخلص منه ، وأضف 50 ميكرولتر من محلول الغسيل (250 mM NaCl في TE مع منظف محايد بنسبة 0.05٪). امزج الخرز والتقطه مرة أخرى وأزل محلول الغسيل. كرر مرة أخرى.
- لتلويح الاشعال الممتد من الخرز ، أضف 50 ميكرولتر من محلول الاستخلاص (25 mM NaOH مع منظف محايد بنسبة 0.05٪) ، واخلط الخرز. استعادة الخرز ، وإزالة محلول الاستخلاص ، وإخماد مع 100 mM Tris (الرقم الهيدروجيني 7.5) ، والراسب مع الإيثانول.
- قم بإعداد هلام بولي أكريلاميد تحليلي / 8 M urea / 1x TBE ، وفقا للبروتوكولات المناسبة للوحة الجل والحامل. قم بتجميع الجل المصبوب والصفيحة في حامل هلام ، واملأ الخزانات ب 1x TBE ، وقم بتشغيلها مسبقا عند 40 واط (أو حسب الاقتضاء لألواح وحوامل هلامية مختلفة) لمدة 30 دقيقة.
- قم بإذابة الحمض النووي الريبي المترسب في 10 ميكرولتر من المخزن المؤقت لتحميل هلام الفورماميد ، وقم بإعداد التمهيدي النهائي غير المتفاعل عند 0.5 ميكرومتر في مخزن مؤقت لتحميل هلام الفورماميد. قم بتسخين العينات إلى 80 درجة مئوية ، وقم بتحميل 5 ميكرولتر من العينة في كل بئر ، وقم بتشغيل الجل عند 40 واط لمدة 40 دقيقة تقريبا (أو حسب الاقتضاء لألواح وحوامل هلامية مختلفة).
- قم بإزالة صفيحة الجل من الحامل ، وامسح ضوئيا باستخدام ماسح ضوئي للهلام الفلورسنت / الفوسفورسنت لتصور منتجات تمديد L-RNA عبر الشيرال.
النتائج
يجب تصنيع أوليغونوكليوتيدات باستخدام بروتوكولات قياسية مناسبة للفوسفوراميديت ومركب الحمض النووي الآلي / الحمض النووي الريبي ، تاركة المنتج أوليغونوكليوتيد غير منكعب من الدعم الصلب في عمود التوليف البلاستيكي الأصلي ، مع إزالة مجموعة ثنائي إيميثوكسيتيل 5'-terminal لإنتاج 5ʹ-hydroxyl الحر (القسم 1). تم تحضير جميع النوكليوتيدات قليلة النوكليوتيدات المستخدمة في هذا العرض باستخدام راتنج زجاج المسام المتحكم فيه (CPG) 1000 Å كدعم صلب وتم إجراؤه على مقياس 0.2 أو 1 ميكرومول. يتم توفير أمثلة تمثيلية لأعمدة التوليف والراتنجات والكواشف والفوسفوراميدات في جدول المواد. بالنسبة للتفاعلات واسعة النطاق ، قد تحتاج إلى تعديل الأحجام والأوقات المستخدمة في الخطوات اللاحقة.
يتم إجراء تفاعل الفسفرة الثلاثية على عمود في غرفة تفاعل مصممة خصيصا (الشكل 2 ، القسم 3) باستخدام المكونات القياسية المتاحة تجاريا المدرجة في جدول المواد ويتبع المخطط الموضح في الشكل 1 (القسم 4) 28. من الضروري أن تبقى الظروف لامائية بشكل صارم أثناء الفسفرة الثلاثية ، وأن يتم تحضير جميع المذيبات والكواشف على المناخل الجزيئية مقدما والسماح لها بالجفاف الكامل قبل الاستخدام (القسم 2). عادة ما يستغرق الفسفرة الثلاثية 2 ساعة ليحدث ، وبعد ذلك ، يمكن معالجة العمود المغسول والمجفف وفقا لإجراءات إزالة وتنقية oligonucleotide القياسية (القسم 5).
بعد إزالة الحماية ، يتم تنقية ثلاثي فوسفات oligonucleotide عن طريق تمسخ الرحلان الكهربائي لهلام polyacrylamide (PAGE) ، مما يدل على نطاق منتج رئيسي واحد بواسطة التظليل الخلفي للأشعة فوق البنفسجية التي يمكن استئصالها وإزالتها من الجل. يتم فصل منتج 5′-triphosphate بسهولة عن المنتجات الجانبية للتفاعل ل oligonucleotides القصيرة ، كما هو موضح ل DNA trinucleotide 5ʹ-triphosphates و pppAAA و pppCCC ، و L-RNA trinucleotide 5ʹ-triphosphate pppGAA في الشكل 3A ، B. تم استئصال كل من منتجات 5′-hydroxyl و 5′-triphosphate لآلات تشذيب الحمض النووي AAA و CCC وتحديدها بواسطة قياس الطيف الكتلي وتم تصنيفها بالمقابل في الشكل 3A. النطاقات الإضافية ، كما هو مرئي لأداة تشذيب الحمض النووي AAA ، لا تحتوي عموما على مواد كافية لاستعادتها وتحديدها. ومع ذلك، يرتبط وجود هذه النطاقات بكتل منتجات إضافية في منتجات التفاعل غير النقية (الشكل 3C)، والتي تمثل عادة منتجات جانبية 5′-diphosphate، وmonophosphate، وH-phosphonate، كما هو موضح أدناه.
بعد تنقية PAGE ، يمكن التخلص من أوليغونوكليوتيدات أكبر باستخدام طريقة السحق والنقع42 وهطول الأمطار اللاحق للإيثانول. ومع ذلك ، لا يمكن ترسيب الأوليغنوكليوتيدات التي تقل عن 15 نانول بكفاءة ، وبالتالي ، تتطلب إجراء معدلا لإزالة الجل (الخطوة 5.11.3). يتم تصنيف عمود استبعاد الحجم القابل للتصرف المدرج في جدول المواد فقط للاستخدام مع oligonucleotides أطول من 10 nt. ومع ذلك ، فقد وجدنا أن oligonucleotides قصيرة مثل التريبر يمكن تحميصها بشكل فعال باستخدام البروتوكول الموصى به من قبل الشركة المصنعة. ومع ذلك ، يوصى عند تحلية أوليغونوكليوتيدات قصيرة (كما هو الحال في الخطوتين 5.6 و 5.11.3) بجمع عمود اللوح في كسور ، وتحديد كسور المنتج عن طريق الامتصاص عند 260 نانومتر باستخدام مقياس الطيف الضوئي UV-Vis. يتم توفير عمود استبعاد الحجم الأمثل لأوليغونوكليوتيدات أقصر في جدول المواد كخيار بديل. العائد النهائي من تخليق أوليغونوكليوتيد مقياس 1 ميكرومول بعد التنقية هو 50-300 نانومول.
يمكن تأكيد الفسفرة الثلاثية عن طريق قياس الطيف الكتلي ، حيث يكون للمنتج ثلاثي الفسفرة كتلة +239.94 Da أكبر من أوليغونوكليوتيد 5′-hydroxyl ، على الرغم من أن وجود المواد المقابلة ل 5′-di- و monophosphate (+159.96 و +79.98 Da ، على التوالي) غالبا ما يتم ملاحظته. يمكن أيضا ملاحظة منتج جانبي 5′-H-phosphonate بكتلة +63.98 Da من كتلة 5′-OH ، وتشير المستويات العالية من هذا المنتج إلى أن الظروف أثناء الفسفرة الثلاثية لم تكن لامائية بما فيه الكفاية. قبل التنقية ، ستعرض أوليغونوكليوتيدات غير المحمية عادة جميع هذه المنتجات (الشكل 3C) ، في حين أن المواد النقية ستظهر ذروة تتوافق مع منتج 5 ′ ثلاثي الفوسفات جنبا إلى جنب مع 5 ′ di- و monophosphates (الشكل 3D ، E).
عادة ما لا يعطي قياس الطيف الكتلي وحده مقياسا صارما لنقاء 5 ′ ثلاثي الفوسفات بسبب المعدلات التفاضلية للتأين وتفتيت ثلاثي الفوسفات أثناء التأين. لقياس نقاء المنتج النهائي، يوصى باستخدام كروماتوغرافيا سائلة ذات طور عكسي وترادف ESI-MS (RP-LC/ESI-MS)، خاصة بالنسبة للأوليغونوكليوتيدات الأطول. يظهر تحليل D-RNA 5ʹ-triphosphates pppACGAGG و pppGAGACCGCAACUUA بواسطة RP-LC / ESI-MS (الشكل 4A ، B ، على التوالي) نقاء المنتج النهائي النموذجي ، الذي يحتوي على 20٪ 5'-diphosphate حيث يصعب فصل هذين النوعين عند وجودهما على أوليغونوكليوتيدات أطول.
عادة ما تعمل أوليغونوكليوتيدات قليلة الفوسفات الاصطناعية 5 ′ ثلاثي الفوسفات بشكل جيد أو أفضل من المواد المحضرة إنزيميا في الدراسات الكيميائية الحيوية. في القسم 6 ، على سبيل المثال ، تمت مقارنة ركائز الحمض النووي الريبي 5′-triphosphate 14 nt المحضرة إما صناعيا أو عن طريق النسخ في المختبر في تفاعل التكرار الذاتي المحفز للحمض النووي الريبي 14,15,43,44,45. يحفز الريبوزيم E انضمام الركيزتين A و B لإنتاج نسخة جديدة من E في تفاعل محفز ذاتي قادر على النمو الأسي (الشكل 5A). تم إعداد المكونات E و 32P الموسومة A عن طريق النسخ في المختبر ، وتم تحضير الركيزة الثلاثية الفوسفوريلات B إما صناعيا ، كما هو موضح أعلاه ، أو عن طريق النسخ المختبري 14. تم رصد تقدم تفاعل التكرار الذاتي عن طريق أخذ عينات دورية تم تحليلها عن طريق تمسخ PAGE وتحديدها كميا عبر ماسح هلام الفلورسنت / الفوسفورسنت. وكشفت البيانات الناتجة، التي تتناسب مع دالة النمو اللوجستي، أن الركيزة B المنسوخة أو الاصطناعية تدعم النمو الأسي، ولكن B الاصطناعية تعطي كمية أكبر قليلا من المنتج (الشكل 5B). قد تعكس هذه النتيجة عدم التجانس التركيبي في نهاية 5 ′ من الحمض النووي الريبي الذي تم إعداده بواسطة النسخ المختبري 23,24.
كما تمكن الفسفرة الثلاثية الكيميائية من تخليق ثلاثي فوسفات أوليغونوكليوتيد الذي لا يمكن تحضيره بيولوجيا ، سواء في المختبر أو في الخلايا. في القسم 7 ، تم استخدام ثلاثي فوسفات أوليغونوكليوتيد غير بيولوجي يتكون من L-RNA ، وهو enantiomer من D-RNA الطبيعي ، المحضر كما هو الحال في الأقسام 1-5 ، كركائز لريبوزيم البوليميراز D-RNA "عبر chiral" 27.3t (الشكل 6A) ، الذي يحفز البلمرة الموجهة بالقالب لمنتج L-RNA أطول من أوليغونوكليوتيد L-RNA القصير 5 ′ ثلاثي الفوسفات بطريقة عامة تسلسلية. على سبيل المثال ، يمكن للريبوزيم توليف نسخة L-RNA من زخارف الانقسام الذاتي لرأس المطرقة (الشكل 6B)18. تم الجمع بين ثلاثي فوسفات ثلاثي النوكليوتيد L-RNA المنقى مع التمهيدي L-RNA المسمى بالفلوريسين وقالب L-RNA (الشكل 6C) وتفاعلت مع الليغاز عبر chiral. تم تحليل العينات على مدار التفاعل بواسطة PAGE وتصويرها باستخدام ماسح ضوئي هلام فلوري / فوسفوري لإثبات تخليق نسخة L-RNA من ريبوزيم رأس المطرقة المشفر بواسطة القالب (الشكل 6D).
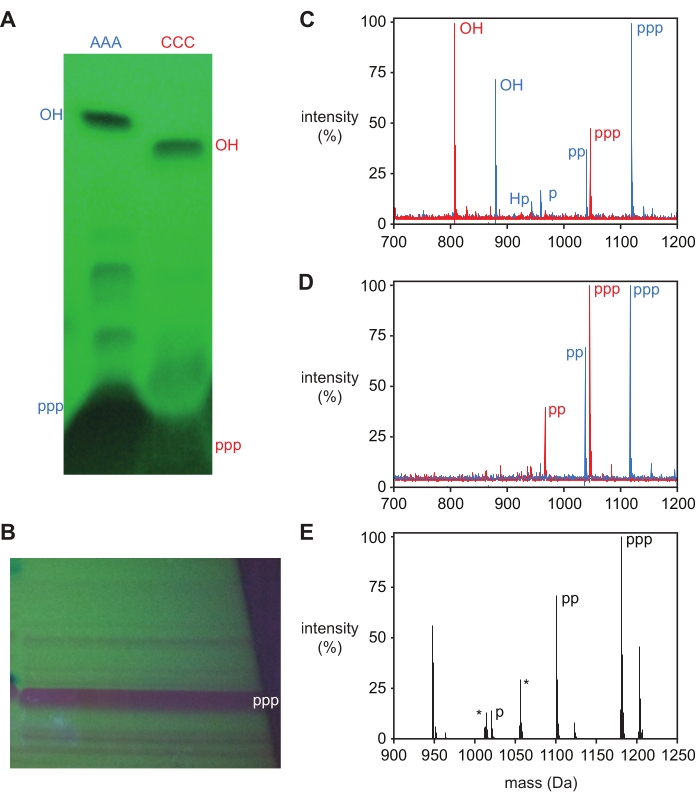
الشكل 3: تنقية ثلاثي النوكليوتيد 5'-ثلاثي الفوسفات. (أ) تحليل الصفحة (المتصور بواسطة التظليل الخلفي للأشعة فوق البنفسجية) للفسفرة الثلاثية لثلاثي النوكليوتيدات الحمض النووي ثلاثي ديوكسي أدينوسين (AAA ، أزرق) وثلاثي ديوكسي سيتيدين (CCC ، أحمر) ، مثقل عمدا لتصور المنتجات الجانبية الثانوية. تم استئصال كل من منتج 5'-triphosphate (ppp) والمواد الأولية 5ʹ-hydroxyl (OH) وتحديدها بواسطة MALDI-MS. (ب) الصفحة التحضيرية للفسفرة الثلاثية لثلاثي النوكليوتيد L-RNA GAA ، مع استئصال نطاق المنتج الرئيسي وتحديده على أنه 5'-triphosphate (ppp) بواسطة ESI-MS. (ج) MALDI-MS لمنتجات تفاعل النفط الخام بعد إزالة الحماية و (د) المنتجات المنقاة من (أ). 5'-ثلاثي الفوسفات (ppp; pppAAA توقع 1,119 Da, لاحظ 1,118 Da; pppCCC توقع 1,047 Da, لاحظ 1,046); يتم تصنيف 5ʹ-diphosphate (pp) و 5ʹ-monophosphate (p) و 5ʹ-hydroxyl (OH) و 5ʹ-H-phosphonate (Hp). (ه) الطيف الكتلي المنزوع الالتواء من الحقن المباشر ESI-MS لمنتج معزول 5'-triphosphate من (B)، مع وضع علامات على قمم محددة (من المتوقع 1,181.6 Da، ولوحظ 1,181.0 Da). كما لوحظت منتجات 5ʹ-diphosphate (pp) ، وكذلك قمم أيون الصوديوم لكل من المنتجات الثلاثية وثنائي الفوسفات (+22 Da). يتم تصنيف قمم الملوثات الشائعة بعلامة نجمية. ولسهولة المقارنة، تم تطبيع أطياف الكتلة إلى أعلى كثافة تقاس في كل طيف ويتم الإبلاغ عنها كنسبة مئوية بالنسبة لتلك القيمة. الاختصارات: PAGE = الرحلان الكهربائي هلام بولي أكريلاميد; MALDI-MS = امتزاز/تأين الليزر بمساعدة المصفوفة؛ ESI-MS = مطياف كتلة التأين بالرش الكهربائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
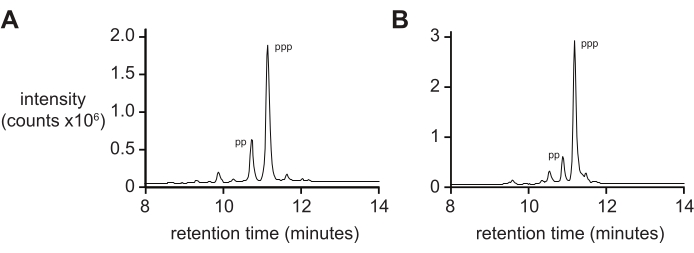
الشكل 4: تحليل RP-LC من 6 nt و 14 nt D-RNA oligonucleotide triphosphates . (A) 5ʹ-pppACGAGG-3ʹ و (B) 5ʹ-pppGAGACCGCAACUUA-3ʹ. حدد جنبا إلى جنب ESI-MS الذروة الرئيسية لكليهما (~ 70٪) على أنها 5ʹ-triphosphate (ppp) ، مع كميات أقل من 5ʹ-diphosphate (pp). الاختصارات: RP-LC = كروماتوغرافيا سائلة ذات طور عكسي. nt = النيوكليوتيدات; ESI-MS = مطياف كتلة التأين بالرش الكهربائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
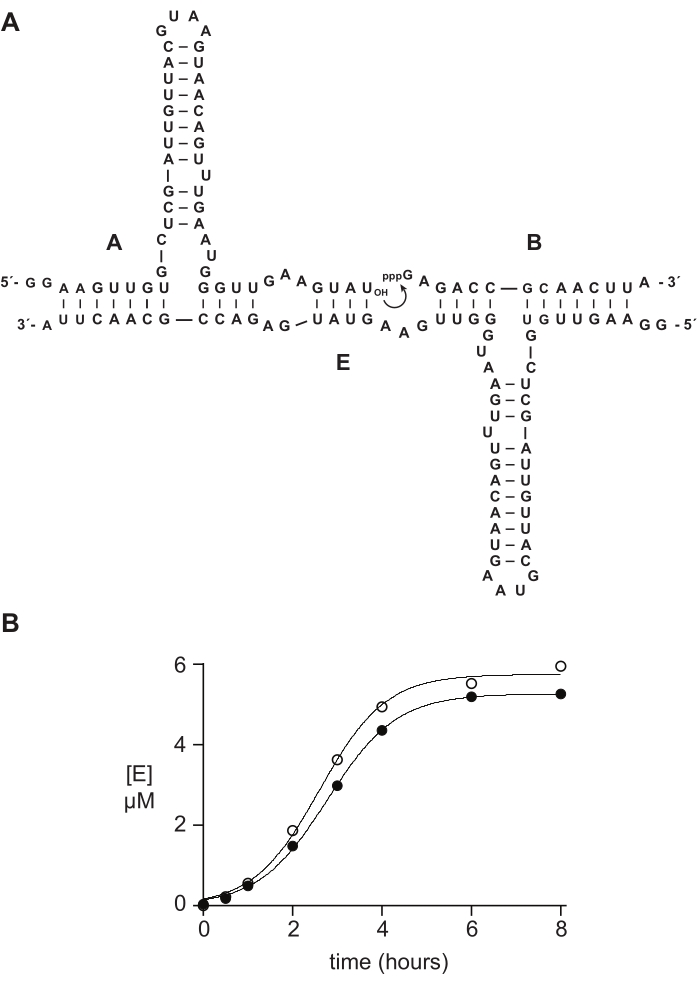
الشكل 5: مقارنة بين ركائز أوليغونوكليوتيد 5'-ثلاثي الفوسفات المحضرة عن طريق التوليف الكيميائي أو النسخ في المختبر . (أ) الريبوزيم E ذاتي التكرار يربط الحمض النووي الريبي A و 5′-triphosphorylated RNA B. (B) مقارنة تفاعلات التكرار الذاتي باستخدام 10 μM A و 10 μM B ، إما الاصطناعية (الدوائر المفتوحة) أو المنسوخة في المختبر (الدوائر المملوءة). (ب) كانت البيانات مناسبة لمعادلة النمو اللوجستي: [E] = a / (1 + b e-ct) ، حيث a هي العائد النهائي ، bهي درجة السيني ، و c هي معدل النمو الأسي. كانت معدلات النمو للتفاعلين متطابقة ، عند 1.14 h-1 ، في حين أن المدى النهائي كان أعلى بنسبة 10٪ للتفاعلات مع B الاصطناعية.
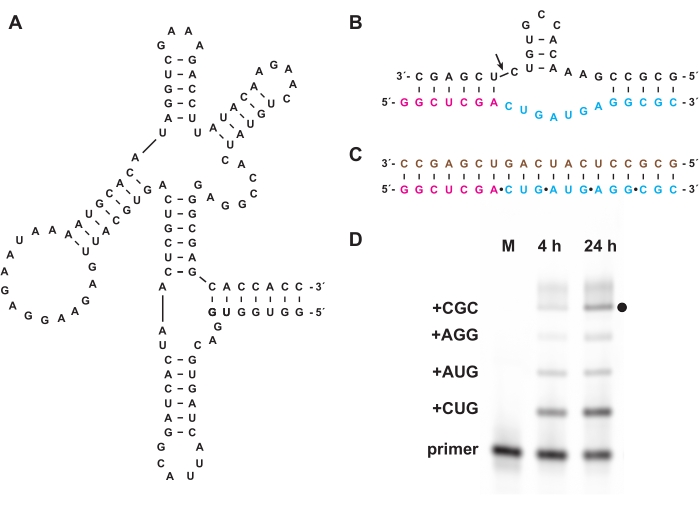
الشكل 6: بلمرة L-RNA عبر الشيرال مع ريبوزيم. (أ) الريبوزيم البوليميراز D-RNA 27.3t ، الذي يحفز الربط المعتمد على القالب ل L-RNA. (ب) يشكل منتج L-RNA الذي تم تصنيعه بواسطة 27.3t جزءا من زخارف إندونوكليز رأس المطرقة. (ج) بلمرة L-RNA التي يتم تحفيزها بواسطة 27.3t باستخدام قالب L-RNA ثنائي الفينيل (بني) ، وتمهيدي L-RNA (أرجواني) ، وأربعة ثلاثي فوسفات ثلاثي النوكليوتيد L-RNA (سماوي) ، يتم إعداده صناعيا. (د) تحليل الصفحة لنواتج التمديد من (ب) في 4 ساعات و 24 ساعة، مع إظهار كل دمج ثلاثي النوكليوتيدات حتى المنتج الكامل الطول (النقطة السوداء). يتم تضمين التمهيدي L-RNA غير المتفاعل كعلامة مرجعية. الاختصارات: PAGE = الرحلان الكهربائي هلام بولي أكريلاميد; M = علامة مرجعية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
إجراء الفسفرة الثلاثية الموصوف هنا متوافق على نطاق واسع مع تخليق أوليغونوكليوتيد باستخدام كيمياء الفوسفوراميديت القياسية. يجب أن تحتوي الفوسفوراميدات النيوكليوزيدية على مجموعات حماية أساسية متوافقة مع إزالة الحماية السريعة في AMA39 ، بما في ذلك مجموعات β-cyanoethyl القياسية على الفوسفيت ، والأيزوبوتيريل ، أو ثنائي ميثيل فورماميديل ، أو الأسيتيل ، أو فينوكسي أسيتيل ، أو 4-isopropylphenoxyacetyl على الأمينات الخارجية الحلقية للقواعد النووية. يجب حماية مجموعات الريبوز 2'-هيدروكسيل بواسطة مجموعات حماية سيليل ، إما t-butyldimethylsilyl (TBDMS) أو tri-iso-propylsilyloxymethyl (TOM) 40,41. كما تم الإبلاغ عن أن مجموعة pivaloyloxymethyl (PivOM) ذات الأساس الشفوي متوافقة مع الفسفرة الثلاثية الكيميائية30.
تم وصف طرق متعددة للفسفرة الثلاثية الكيميائية لأوليغونوكليوتيدات قليلة النوكليوتيدات الاصطناعية28،29،30،31،32،33،34،35. لقد وجدنا أن الفسفرة الثلاثية باستخدام كاشف Ludwig-Eckstein37 هي واحدة من أكثر الكواشف التي يمكن الوصول إليها ، ولا تتطلب أي توليف متخصص للكواشف ولا معدات متخصصة. تم استخدام Oligonucleotide 5′-triphosphates المحضر بهذه الطريقة بشكل روتيني كركائز لريبوزيمات RNA ligase ، بما في ذلك استخدام ثلاثي فوسفات L-RNA oligonucleotide ثلاثي الفوسفات الذي يتعذر الوصول إليه إنزيميا لتحقيق التوليف المعتمد على القالب وتكرار هذا الحمض النووي "الصورة المرآة"14,16,17,18 . هذه الطريقة مناسبة أيضا لإعداد الحمض النووي الريبي الصغير ذو الحلقة الجذعية 5 ′ ثلاثي الفوسفوريلات التي تعد منشطات قوية للاستجابة المناعية الفطرية في الفقاريات 6,7.
كاشف لودفيغ-إيكشتاين ، ساليسيل فوسفوروكلوريديت37 ، يتفاعل بشكل كبير مع الماء ، ويزيل بشكل فعال أي ماء يتم إدخاله عند إذابة الكاشف قبل تحميله على عمود أوليغونوكليوتيد. بعد هذه النقطة ، ومع ذلك ، فإن oligonucleotide 5 ′ الفوسفيتيل سوف يتفاعل بشكل تفضيلي مع أي ماء يتم إدخاله في النظام على pyrophosphate ، مما يشكل منتجا جانبيا 5′-H-phosphonate بعد العمل28,37,38. يضمن التحضير الدقيق لكواشف الفسفرة الثلاثية وغرفة تفاعل الفسفرة الثلاثية عدم تكوين هذا المنتج الجانبي. لتجفيف المذيبات ، تباع المناخل الجزيئية من النوع 4 Å معبأة مسبقا في أكياس تفلون متوافقة مع معظم المذيبات العضوية تحت أسماء تجارية مختلفة من قبل معظم شركات كاشف توليف أوليغونوكليوتيدات. الاحتياطات الإضافية ، مثل إجراء الفسفرة الثلاثية في صندوق قفازات تحت جو لا مائي ، ليست ضرورية بشكل عام.
يشكل تفاعل أوليغونوكليوتيد 5′-فوسفيتيل مع TBAP وسيطا دوريا 5′-trimetaphosphite ، والذي يتأكسد بعد ذلك إلى 5′-trimetametaphosphate الدوري باستخدام محلول مؤكسد توليف oligonucleotide (اليود في الماء / البيريدين / THF). تجدر الإشارة إلى أن محاليل المؤكسدات التجارية تستخدم كميات متفاوتة من اليود ، ومن الضروري استخدام تركيز اليود العالي 0.1 M لضمان الأكسدة الكاملة لثلاثي الفوسفات. يتم تحلل المنتج الدوري إلى الخيط الخطي النهائي 5′-triphosphate في نفس المحلول37 ، ويجب استخدام محاليل المؤكسدة اللامائية البديلة إذا كان الخطية مع النيوكليوفيلات بخلاف الماء مطلوبة (انظر أدناه للتطبيقات)33. ومع ذلك ، فإن أي ثلاثي ميتافوسفات دوري متبق ، سيتم خطيه أثناء إزالة الحماية القلوية اللاحقة من oligonucleotide. التحلل المائي للثلاثي فوسفات الدوري 5′-trimetasphate لا ينتج عنه سوى ثلاثي الفوسفات الخطي بدلا من ثلاثي الفوسفات المتفرع 37,46.
لا تحتاج إزالة الحماية من أوليغونوكليوتيد عادة إلى تعديل لاستيعاب 5 ′-triphosphorylation ، ولكن يجب اتخاذ بعض الاحتياطات. الثلاثي الفوسفات مستقر نسبيا للتعرض لفترة وجيزة للظروف القلوية ، ولكن يجب توخي الحذر لعدم تعريض ثلاثي الفوسفات ل AMA لفترة أطول من اللازم. يجب تجنب حماية المجموعات التي تتطلب علاجا مطولا في الأمونيا أو AMA لأكثر من 10 دقائق عند 65 درجة مئوية. العلاجات الأكثر لطفا ، مثل 2 ساعة في الأمونيا في درجة حرارة الغرفة مقبولة عندما تكون متوافقة مع مجموعات حماية الفوسفوراميديت الأخرى. تستخدم طريقة شائعة وسريعة لإزالة الحماية من الحمض النووي الريبي الاصطناعي oligonucleotides المحمية من السيليل ثلاثي إيثيلامين ثلاثي هيدروفلوريد ودرجة حرارة عالية47 ؛ ومع ذلك ، ينبغي تجنب ذلك عند تحضير الحمض النووي الريبي 5 ′ ثلاثي الفوسفات حيث تم العثور على الظروف الحمضية المطولة لتسريع التحلل المائي ثلاثي الفوسفات31,32.
وقد أثبتت الصفحة التحضيرية أنها الطريقة الأبسط والأكثر موثوقية لتنقية أوليغونوكليوتيدات 5 ثلاثي الفوسفوريلات بعد الحماية (الشكل 3 والشكل 4). ومع ذلك ، يمكن أيضا استخدام HPLC في المرحلة العكسية التحضيرية لتنقية المنتجات ثلاثية الفوسفوريلات. ويلاحظ وجود 5′-ثنائي الفوسفات، وبدرجة أقل، منتجات 5′-monophosphate بشكل روتيني عند التحقق من الفسفرة الثلاثية عن طريق قياس الطيف الكتلي. لقد لاحظنا تفتيت 5 ′ ثلاثي الفوسفات أثناء قياس الطيف الكتلي من مواد عالية النقاء يتم إعدادها عن طريق التوليف الكيميائي أو النسخ ، خاصة إذا لم يتم تحسين الأداة لتحليل oligonucleotides. ومع ذلك ، غالبا ما يظهر تحليل RP-LC أن 10٪ -20٪ من المنتج الجانبي 5 ′ ثنائي الفوسفات موجود في أوليغونوكليوتيدات أطول 5 ′ ثلاثي الفوسفور (الشكل 4). يمكن أن تكون المستحضرات التجارية لبيروفوسفات تريبوتيلامونيوم ملوثة بما يصل إلى 20٪ أحادي الفوسفات ، مما سيؤدي إلى 5 ′-diphosphate كمنتج جانبي أثناء الفسفرة الثلاثية30,31. يمكن أن يؤدي الإعداد الدقيق لهذا الكاشف في المنزل إلى إنتاج مخزون TBAP أكثر نقاء31. ومع ذلك ، فقد وجدنا أن oligonucleotides triphosphorylated باستخدام مصادر تجارية من TBAP لا تزال تظهر تفاعلا مماثلا أو أكبر عند استخدامها كركائز في التفاعلات الأنزيمية (الشكل 5B) ، مقارنة بالمواد التي يتم إعدادها بواسطة النسخ في المختبر.
أحد الاستخدامات الأخرى البارزة لفسفرة أوليغونوكليوتيد ثلاثية الفسفرة مع كاشف لودفيغ-إيكشتاين يستفيد من ثلاثي الميتافوسفيت الدوري الوسيط33. إذا تم إجراء خطوة الأكسدة اللاحقة باستخدام بيروكسيد 1 M t-butyl في الهكسانات ، والذي يستخدم غالبا لأكسدة oligonucleotide في ظل الظروف اللامائية ، تحدث أكسدة الفوسفيت دون التحلل المائي لفتح الحلقة ، مما يؤدي إلى ثلاثي ميتافوسفات دوري. يمكن بعد ذلك تفاعل هذا الوسيط مع الأمين الأولي أو نيوكليوفيلات الكحول لإنتاج 5 ′ ثلاثي الفوسفات مع تعديلات في γ الفوسفات. وتشمل هذه التعديلات إضافة علامة محبة للدهون مرتبطة برابطة فوسفوراميدات ، مما يسهل التنقية السريعة الخاصة بثلاثي الفوسفات بواسطة RP-LC ، تليها التحلل المائي الحمضي للعلامة من ثلاثي الفوسفات33. يمكن أيضا إدخال تعديلات الفلورسنت في موقع γ الفوسفات لاستخدامها كمراسلين فلورسنت في الوقت الفعلي لتفاعلات الربط المحفزة بالريبوزيم15,33.
Disclosures
ويعلن صاحبا البلاغ أنه ليس لديهما مصالح مالية منافسة.
Acknowledgements
المؤلفون ممتنون لجريج سبرينجستين وناتاشا بول وتشارلز أوليا جونيور وجوناثان شيبانسكي وكاترينا تجونج على المناقشات المفيدة حول أفضل الممارسات لتفاعلات الفسفرة الثلاثية الكيميائية ولجيرالد جويس على التعليقات المفيدة. تم دعم هذا العمل من خلال منحة MCB 2114588 من المؤسسة الوطنية للعلوم.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm polyethersulfone syringe filter | MilliporeSigma | SLMP025SS | Syringe filter for removing crushed polyacrylamide gel particles (Section 5) |
| 0.22 µm PTFE syringe filter | MilliporeSigma | SLLG013SL | Syringe filter for removing CPG resin (Section 5) |
| 1 mL plastic syringes | ThermoFisher Scientific | 14-823-434 (BD 309659) | Components of triphosphorylation apparatus (sections 2–4) |
| 1,4-Dioxane, anhydrous | MilliporeSigma | 296309 | Triphosphorylation solvent (sections 2–4) |
| 2-Chloro-4H-1,3,2-benzodioxaphosphorin-4-one, Salicyl Phosphorochloridite (SalPCl) | MilliporeSigma | 324124 | Triphosphorylation reagent (sections 2–4) |
| 30 mL glass bottles | MilliporeSigma | 23232 | Bottles for preparing triphosphorylation solvents and TBAP solution (section 2) |
| 3-way Stopcock, polycarbonate/polypropylene | Bio-Rad Laboratories | 7328103 | Component of triphosphorylation apparatus (sections 2–4) |
| 40% acrylamide/bis-acrylamide solution, 19:1 | Bio-Rad Laboratories | 1610144 | For PAGE (sections 5–7) |
| Acetonitrile, anhydrous, 100 mL | Glen Research | 40-4050-50 | Triphosphorylation solvent (sections 2–4) |
| Ammonia-neutralizing Trap | ThermoFisher Scientific | ANT100 and ANS121 | For use with Speedvac DNA130 (section 5) |
| Ammonium persulfate (APS) | Bio-Rad Laboratories | 1610700 | For PAGE, catalyst for acrylamide polymerization (sections 5–7) |
| Aqueous ammonia, 28% | MilliporeSigma | 338818 | For preparing AMA deprotection reagent (section 5) |
| Aqueous methylamine, 40% | TCI America | TCI-M0137 | For preparing AMA deprotection reagent (section 5) |
| Automated DNA/RNA oligonucleotide synthesizer | PerSeptive Biosystems | Expedite 8909 DNA/RNA Synthesizer | any column-based synthesizer is acceptable (section 1) |
| Bead-capture magnet | ThermoFisher Scientific | 12320D | For streptavidin bead capture (section 7) |
| Bromophenol blue | Bio-Rad Laboratories | 1610404 | For PAGE urea loading buffer (section 5) |
| Deep vacuum oil pump | ThermoFisher Scientific | VLP200-115 | For use with lyophilizer (section 5) |
| Drierite dessicant, 10-20 mesh | MilliporeSigma | 737828 | Desiccant for storing triphosphorylation chemicals and equipment (sections 1–2) |
| D-RNA 27.3t cross-chiral polymerase | prepared in house18 | 5′-GGUGGUGGAC GUGAUCAUUA CGGAUCACUA ACUCGUCAGU GCAUUGAGAA GGAGAAUAAA AUGCACAUAG GUCGAAAGAC CUUAUACAAG AACUGUAUCA CCGGAGGGCG AGCACCACC-3′ | For cross-chiral ribozyme reactions (section 7) |
| D-RNA CPG solid supports, 1,000Å, prepackaged 1 µmole synthesis columns | Glen Research | 20-3404-41E, 20-3415-41E, 20-3424-41E, 20-3430-41E | representative, for D-RNA oligonucleotide synthesis (section 1) |
| D-RNA TOM-protected phosphoramidites | ChemGenes | ANP-3201, 3202, 3203, 3205 | representative, for D-RNA oligonucleotide synthesis (section 1) |
| Empty Expedite Synthesis Columns, 1µm | Glen Research | 20-0021-01 | Synthesis columns for use with Expedite DNA/RNA synthesizer (section 1) |
| EPPS, N-(2-Hydroxyethyl)piperazine-N′-(3-propanesulfonic acid), solid | MilliporeSigma | E1894 | Ribozyme reaction buffer component (section 6) |
| Ethylenediaminetetraacetic acid (EDTA), solid | MilliporeSigma | EDS | Divalent metal ion chelator for use in various buffers (sections 5–7) |
| Filters for Expedite synthesis columns | Glen Research | 20-0021-0F | Expedite-style synthesis column filters, for use with empty synthesis columns (section 1) |
| Fluorescent/phosphorescent gel scanner | Cytiva | Amersham Typhoon RGB, 29187193 | For visualizing analytical PAGE (sections 6–7) |
| Formamide, deionized | VWR Life Science | 97062 | For PAGE formamide gel loading buffer (sections 6–7) |
| Gel image quantitation software | Cytiva | ImageQuant TL | For quantifying scanned gel images (section 6) |
| Glass desiccator | MilliporeSigma | CLS3121150 | Triphosphorylation solvent storage (section 2) |
| L-RNA CPG solid supports, 1,000Å, bulk | ChemGenes | N-4691-10, N-4692-10, N-4693-10, N-4694-10 | L-RNA oligonucleotide synthesis (section 1) |
| L-RNA hammerhead template | prepared in house18 | 5′-GCGCCUCAUC AGUCGAGCC-3′ | For cross-chiral ribozyme reactions (section 7) |
| L-RNA primer | prepared in house18 | 5′-fluorescein-GGCUCGA-3′ | For cross-chiral ribozyme reactions (section 7) |
| L-RNA TOM-protected phosphoramidites | ChemGenes | OP ANP-5201, 5202, 5203, 5205 | L-RNA oligonucleotide synthesis (section 1) |
| Lyophilizer/Freeze Dryer | VirTis | Benchtop K | For concentrating oligonucleotides (section 5) |
| Magnesium Chloride Hexahydrate, solid | MilliporeSigma | M2670 | For ribozyme reactions (sections 6–7) |
| N,N-Dimethylformamide, anhydrous | MilliporeSigma | 227056 | Triphosphorylation solvent (section 2) |
| NAP-25 Desalting column (Sephadex G-25 resin) | ThermoFisher Scientific | 45000150 | Disposable gravity-flow size exclusion chromatography columns containing Sephadex G-25 resin (section 5) |
| Non-coring stainless steel needle, 20 G | ThermoFisher Scientific | 14-815-410 | Needles for piercing rubber septa (sections 2–4) |
| Oligonucleotide extinction coefficient calculator | Integrated DNA Technologies | OligoAnalyzer Tool | Nearest-Neighbor Model Short Oligonucleotide 260nm extinction coefficient calculator (section 5) |
| Oxidizer solution, 0.1 M Iodine in THF/pyridine/water | ChemGenes | RN-1456 | Triphosphorylation reagent (section 4) |
| PAGE plates | Timberrock/CBS | NGP-250-BO and NO | For PAGE (sections 5–7) |
| PAGE power supply | Bio-Rad Laboratories | PowerPac HV 1645056 | For PAGE (sections 5–7) |
| PAGE spacers and combs (analytical) | Timberrock/CBS | VGS-0725 and VGC-0714 | For PAGE (sections 6–7) |
| PAGE spacers and combs (preparative) | Timberrock/CBS | VGS-3025R and VGC-3001 | For PAGE (section 5) |
| PAGE stand | Timberrock/CBS | ASG-250 | For PAGE (sections 5–7) |
| Parafilm M | ThermoFisher Scientific | 13-374-12 (Bemis PM999) | Wax sealing film for triphosphorylation apparatus (sections 2–4) |
| PCR thermocycler | Bio-Rad Laboratories | C1000 Touch Thermalcycler | For cross-chiral ribozyme reactions (section 7) |
| PD 10 Desalting column (Sephadex G-10 resin) | MilliporeSigma | GE17-0010-01 | Disposable gravity-flow size exclusion chromatography columns containing Sephadex G-10 resin, for oligonucleotides < 15 nt (section 5) |
| Phosphor screens | Cytiva | 28956480 | For visualizing 32P-labeled RNA (section 6) |
| Phosphoramidite synthesis reagents | Glen Research | 30-3142-52, 40-4050-53, 40-4012-52, 40-4122-52, 40-4132-52, 40-4060-62 | representative, for standard RNA/DNA synthesis (section 1) |
| Polypropylene screw-cap sealable tube | MilliporeSigma | BR780752 | 1.5 mL microcentrifuge tubes with screw-cap and silicone O-ring, for safe AMA deprotection (section 5) |
| Pyridine, anhydrous | MilliporeSigma | 270970 | Triphosphorylation solvent (section 2) |
| Reverse-phase liquid chromatography/electrospray ionization mass spectrometry (RP-LC/ESI-MS) | Novatia | n/a | Commercial service for LC/MS specializing in oligonucleotides (section 5) |
| Rubber Septa (ID x OD 7.9 mm x 14 mm), white | MilliporeSigma | Z564702 | Septa for preparing triphosphorylation solvents and TBAP (section 2) |
| Self-replicator ribozyme E | prepared in house14 | 5′-GGAAGUUGUG CUCGAUUGUU ACGUAAGUAA CAGUUUGAAU GGUUGAAGUA UGAGACCGCA ACUUA-3′ | For self-replicator ribozyme reactions (section 6) |
| Self-replicator substrate A | prepared in house14 | 5′-32P-GGAAGUUGUG CUCGAUUGUU ACGUAAGUAA CAGUUUGAAU GGUUGAAGUA U-3′-OH | For self-replicator ribozyme reactions (section 6) |
| Self-replicator substrate B, transcribed | prepared in house14 | 5′-pppGAGACCGCAA CUUA-3′ | For self-replicator ribozyme reactions (section 6) |
| Small Drying Traps, 4 Å molecular sieves | ChemGenes | DMT-1975 | Drying traps for DNA/RNA synthesizer phosphoramidites and triphosphorylation reagents (sections 1–2) |
| Sodium Chloride (NaCl), solid | MilliporeSigma | S7653 | Salt for use in various buffers (sections 5–7) |
| Sodium Hydroxide (NaOH), solid | MilliporeSigma | S8045 | Salt for use in various buffers (sections 5–7) |
| Statistical data-fitting software | GraphPad | Prism | For fitting data from analytical PAGE to kinetic models (section 6) |
| Streptavidin-coated magnetic beads | ThermoFisher Scientific | 65002 | For capturing biotin-labeled RNA in cross-chiral ribozyme reactions (section 7) |
| Sucrose | MilliporeSigma | 84097 | For PAGE urea loading buffer (section 5) |
| TBE running buffer, 10x | ThermoFisher Scientific | AAJ62788K3 | For PAGE (sections 5–7) |
| Tetrabutylammonium Fluoride, 1.0 M solution in Tetrahydrofuran | Aldrich | 216143 | For removing 2′-silyl protecting groups (section 5) |
| Tetramethylethylenediamine (TEMED) | Bio-Rad Laboratories | 1610801 | For polymerizing acrylamide for PAGE (sections 5–7) |
| Tributylamine | MilliporeSigma | 90781 | Triphosphorylation reagent (section 2) |
| Tributylammonium pyrophosphate (TBAP) | MilliporeSigma | P8533 | Triphosphorylation reagent (section 2) |
| Tris base | MilliporeSigma | T6666 | Buffering agent for use in various buffers (sections 5–7) |
| TWEEN20 polysorbate detergent | MilliporeSigma | P7949 | Neutral detergent for use with magnetic beads (Section 7) |
| Urea | MilliporeSigma | U5378 | For PAGE and gel loading buffer (sections 5–7) |
| UV-Vis spectrophotometer | ThermoFisher Scientific | NanoDrop 2000, ND2000 | For measuring oligonucleotide concentrations (section 5) |
| Vacuum centrifuge | ThermoFisher Scientific | Savant Speedvac DNA130-115 Vacuum Concentrator | For removing AMA and THF (section 5) |
| Xylene cyanol | Bio-Rad Laboratories | 1610423 | For PAGE urea loading buffer (section 5) |
References
- Shuman, S. What messenger RNA capping tells us about eukaryotic evolution. Nature Reviews. Molecular Cell Biology. 3 (8), 619-625 (2002).
- Pichlmair, A., et al. RIG-I-mediated antiviral responses single-stranded RNA bearing 5'-phosphates. Science. 314 (5801), 997-1001 (2006).
- Hornung, V., et al. 5'-Triphosphate RNA is the ligand for RIG-I. Science. 314 (5801), 994-997 (2006).
- Myong, S., et al. Cytosolic viral sensor RIG-I is a 5'-triphosphate-dependent translocase on double-stranded RNA. Science. 323 (5917), 1070-1074 (2009).
- Takeuchi, O., Akira, S. Pattern recognition receptors and inflammation. Cell. 140, 805-820 (2010).
- Wang, Y., et al. Structural and functional insights into 5'-ppp RNA pattern recognition by the innate immune receptor RIG-I. Nature Structural & Molecular Biology. 17 (7), 781-787 (2010).
- Goubau, D., et al. Antiviral immunity via RIG-I-mediated recognition of RNA bearing 5'-diphosphates. Nature. 514 (7522), 372-375 (2014).
- Joyce, G. F. Forty years of in vitro evolution. Angewandte Chemie. 46 (34), 6420-6436 (2007).
- Robertson, M. P., Ellington, A. D. In vitro selection of an allosteric ribozyme that transduces analytes to amplicons. Nature Biotechnology. 17 (1), 62-66 (1999).
- Robertson, M. P., Hesselberth, J. R., Ellington, A. D. Optimization and optimality of a short ribozyme ligase that joins non-Watson-Crick base pairings. RNA. 7 (4), 513-523 (2001).
- Hesselberth, J. R., Robertson, M. P., Knudsen, S. M., Ellington, A. D. Simultaneous detection of diverse analytes with an aptazyme ligase array. Analytical Biochemistry. 312 (2), 106-112 (2003).
- Lam, B. J., Joyce, G. F. Autocatalytic aptazymes enable ligand-dependent exponential amplification of RNA. Nature Biotechnology. 27 (3), 288-292 (2009).
- Lam, B. J., Joyce, G. F. An isothermal system that couples ligand-dependent catalysis to ligand-independent exponential amplification. Journal of the American Chemical Society. 133 (9), 3191-3197 (2011).
- Olea, C., Horning, D. P., Joyce, G. F. Ligand-dependent exponential amplification of a self-replicating L-RNA enzyme. Journal of the American Chemical Society. 134 (19), 8050-8053 (2012).
- Olea, C., Joyce, G. F. Real-Time Detection of a Self-Replicating RNA Enzyme. Molecules. 21 (10), (2016).
- Sczepanski, J. T., Joyce, G. F. A cross-chiral RNA polymerase ribozyme. Nature. 515 (7527), 440-442 (2014).
- Tjhung, K. F., Sczepanski, J. T., Murtfeldt, E. R., Joyce, G. F. RNA-catalyzed cross-chiral polymerization of RNA. Journal of the American Chemical Society. 142 (36), 15331-15339 (2020).
- Bare, G. A. L., Joyce, G. F. Cross-chiral, RNA-catalyzed exponential amplification of RNA. Journal of the American Chemical Society. 143 (45), 19160-19166 (2021).
- Milligan, J. F., Groebe, D. R., Witherell, G. W., Uhlenbeck, O. C. Oligoribonucleotide synthesis using T7 RNA polymerase and synthetic DNA templates. Nucleic Acids Research. 15 (21), 8783-8798 (1987).
- Chelliserrykattil, J., Ellington, A. D. Evolution of a T7 RNA polymerase variant that transcribes 2'-O-methyl RNA. Nature Biotechnology. 22 (9), 1155-1160 (2004).
- Ibach, J., et al. Identification of a T7 RNA polymerase variant that permits the enzymatic synthesis of fully 2′-O-methyl-modified RNA. Journal of Biotechnology. 167 (3), 287-295 (2013).
- Esvelt, K. M., Carlson, J. C., Liu, D. R. A system for the continuous directed evolution of biomolecules. Nature. 472 (7344), 499-503 (2011).
- Pleiss, J. A., Derrick, M. L., Uhlenbeck, O. C. T7 RNA polymerase produces 5' end heterogeneity during in vitro transcription from certain templates. RNA. 4 (10), 1313-1317 (1998).
- Schenborn, E. T., Mierendorf, R. C. A novel transcription property of SP6 and T7 RNA polymerases: dependence on template structure. Nucleic Acids Research. 13 (17), 6223-6236 (1985).
- Martin, C. T., Muller, D. K., Coleman, J. E. Processivity in early stages of transcription by T7 RNA polymerase. Biochemistry. 27 (11), 3966-3974 (1988).
- Gholamalipour, Y., Karunanayake Mudiyanselage, A., Martin, C. T. 3' end additions by T7 RNA polymerase are RNA self-templated, distributive and diverse in character-RNA-Seq analyses. Nucleic Acids Research. 46 (18), 9253-9263 (2018).
- Vasilyev, N., Serganov, A. Preparation of short 5′-triphosphorylated oligoribonucleotides for crystallographic and biochemical studies. Nucleic Acid Crystallography: Methods and Protocols. , 11-20 (2016).
- Lebedev, A. V., Koukhareva, I. I., Beck, T., Vaghefi, M. M. Preparation of oligodeoxynucleotide 5'-triphosphates using solid support approach. Nucleosides, Nucleotides & Nucleic Acids. 20 (4-7), 1403-1409 (2001).
- Paul, N., Springsteen, G., Joyce, G. F. Conversion of a ribozyme to a deoxyribozyme through in vitro evolution. Chemistry & Biology. 13 (3), 329-338 (2006).
- Zlatev, I., et al. Efficient solid-phase chemical synthesis of 5'-triphosphates of DNA, RNA, and their analogues. Organic Letters. 12 (10), 2190-2193 (2010).
- Zlatev, I., Manoharan, M., Vasseur, J. -J., Morvan, F. Solid-phase chemical synthesis of 5'-triphosphate DNA, RNA, and chemically modified oligonucleotides. Current Protocols in Nucleic Acid Chemistry. , Chapter 1, Unit1.28 (2012).
- Zlatev, I., et al. Automated parallel synthesis of 5'-triphosphate oligonucleotides and preparation of chemically modified 5'-triphosphate small interfering RNA. Bioorganic & Medicinal Chemistry. 21 (3), 722-732 (2013).
- Goldeck, M., Tuschl, T., Hartmann, G., Ludwig, J. Efficient solid-phase synthesis of pppRNA by using product-specific labeling. Angewandte Chemie. 53 (18), 4694-4698 (2014).
- Sarac, I., Meier, C. Efficient automated solid-phase synthesis of DNA and RNA 5′-triphosphates. Chemistry-A European Journal. 21 (46), 16421-16426 (2015).
- Sarac, I., Meier, C. Solid-phase synthesis of DNA and RNA 5'-O-triphosphates using cycloSal chemistry. Current Protocols in Nucleic Acid Chemistry. 64 (1), 4-67 (2016).
- Perez, J. T., et al. Influenza A virus-generated small RNAs regulate the switch from transcription to replication. Proceedings of the National Academy of Sciences of the United States of America. 107 (25), 11525-11530 (2010).
- Ludwig, J., Eckstein, F. Rapid and efficient synthesis of nucleoside 5'-0-(1-thiotriphosphates), 5'-triphosphates and 2',3'-cyclophosphorothioates using 2-chloro-4H-1,3,2-benzodioxaphosphorin-4-one. The Journal of Organic Chemistry. 54 (3), 631-635 (1989).
- Gaur, R. K., Sproat, B. S., Krupp, G. Novel solid phase synthesis of 2'-o-methylribonucleoside 5'-triphosphates and their α-thio analogues. Tetrahedron Letters. 33 (23), 3301-3304 (1992).
- Reddy, M. P., Hanna, N. B., Farooqui, F. Fast cleavage and deprotection of oligonucleotides. Tetrahedron Letters. 35 (25), 4311-4314 (1994).
- Hogrefe, R. I., McCaffrey, A. P., Borozdina, L. U., McCampbell, E. S., Vaghefi, M. M. Effect of excess water on the desilylation of oligoribonucleotides using tetrabutylammonium fluoride. Nucleic Acids Research. 21 (20), 4739-4741 (1993).
- Pitsch, S., Weiss, P. A., Jenny, L., Stutz, A., Wu, X. Reliable chemical synthesis of oligoribonucleotides (RNA) with 2′-O-[(Triisopropylsilyl)oxy]methyl(2′-O-tom)-protected phosphoramidites. Helvetica Chimica Acta. 84 (12), 3773-3795 (2001).
- Green, M. R., Sambrook, J. Isolation of DNA fragments from polyacrylamide gels by the crush and soak method. Cold Spring Harbor Protocols. 2019 (2), (2019).
- Paul, N., Joyce, G. F. A self-replicating ligase ribozyme. Proceedings of the National Academy of Sciences of the United States of America. 99 (20), 12733-12740 (2002).
- Lincoln, T. A., Joyce, G. F. Self-sustained replication of an RNA enzyme. Science. 323 (5918), 1229-1232 (2009).
- Robertson, M. P., Joyce, G. F. Highly efficient self-replicating RNA enzymes. Chemistry & Biology. 21 (2), 238-245 (2014).
- Singh, J., et al. Synthesis of modified nucleoside oligophosphates simplified: fast, pure, and protecting group free. Journal of the American Chemical Society. 141 (38), 15013-15017 (2019).
- Bellon, L. Oligoribonucleotides with 2'-O-(tert-butyldimethylsilyl) groups. Current Protocols in Nucleic Acid Chemistry. , Chapter 3., Unit 3.6 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved