A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم الضرر الحراري الناجم عن حج القحف المثقوب بواسطة الروبوت لجراحة نافذة الجمجمة في الفئران
* These authors contributed equally
In This Article
Summary
أصبحت نوافذ الجمجمة تقنية جراحية يتم تنفيذها في كل مكان للسماح بالتصوير داخل الجسم في الفئران المعدلة وراثيا. يصف هذا البروتوكول استخدام روبوت جراحي يقوم بحفر العظام شبه الآلي لنوافذ الجمجمة ويمكن أن يساعد في تقليل التباين من جراح إلى جراح والتخفيف جزئيا من تلف الحاجز الدموي الدماغي الحراري.
Abstract
تسمح جراحة نافذة الجمجمة بتصوير أنسجة المخ في الفئران الحية باستخدام متعدد الفوتون أو تقنيات التصوير الأخرى داخل الجسم. ومع ذلك ، عند إجراء أي حج قحف باليد ، غالبا ما يكون هناك تلف حراري لأنسجة المخ ، وهو بطبيعته متغير من جراحة إلى أخرى وقد يعتمد على تقنية الجراح الفردية. يمكن أن يؤدي تنفيذ الروبوت الجراحي إلى توحيد الجراحة ويؤدي إلى انخفاض في الأضرار الحرارية المرتبطة بالجراحة. في هذه الدراسة ، تم اختبار ثلاث طرق للحفر الروبوتي لتقييم الضرر الحراري: أفقي ، نقطة تلو الأخرى ، ونبض نقطة تلو الأخرى. يستخدم الحفر الأفقي تخطيطا مستمرا للحفر ، بينما يقوم الحفر نقطة تلو الأخرى بحفر عدة ثقوب تشمل نافذة الجمجمة. يضيف النبضي نقطة تلو الأخرى مخطط حفر "2 ثانية ، 2 ثانية إيقاف" للسماح بالتبريد بين الحفر. يقيس التصوير الفلوري لصبغة Evans Blue (EB) المحقونة عن طريق الوريد الأضرار التي لحقت بأنسجة المخ ، بينما يقيس المزدوج الحراري الموجود تحت موقع الحفر الضرر الحراري. تشير نتائج المزدوجة الحرارية إلى انخفاض كبير في التغير في درجة الحرارة في المجموعة النبضية نقطة تلو الأخرى (6.90 درجة مئوية ± 1.35 درجة مئوية) مقارنة بالمجموعات الأفقية (16.66 درجة مئوية ± 2.08 درجة مئوية) ونقطة بنقطة (18.69 درجة مئوية ± 1.75 درجة مئوية). وبالمثل ، أظهرت المجموعة النبضية نقطة بنقطة أيضا وجودا أقل بكثير من EB بعد حفر نافذة الجمجمة مقارنة بالطريقة الأفقية ، مما يشير إلى تلف أقل للأوعية الدموية في الدماغ. وبالتالي ، يبدو أن طريقة الحفر النبضي نقطة بنقطة هي المخطط الأمثل لتقليل الضرر الحراري. يعد المثقاب الآلي أداة مفيدة للمساعدة في تقليل التدريب والتباين وتقليل الضرر الحراري. مع التوسع في استخدام التصوير متعدد الفوتونات عبر مختبرات الأبحاث ، من المهم تحسين دقة النتائج وإمكانية تكرارها. ستساعد الطرق التي تم تناولها هنا في إعلام الآخرين بكيفية استخدام هذه الروبوتات الجراحية بشكل أفضل لمواصلة تقدم المجال.
Introduction
أصبحت نوافذ الجمجمة مستخدمة في كل مكان في جميع مجالات علم الأعصاب والهندسة العصبية والبيولوجيا للسماح بالتصور والتصوير المباشر للقشرة في الحيوانات الحية1،2،3،4،5،6،7،8،9،10،11. قدم المزيج القوي من الفئران المعدلة وراثيا والتصوير متعدد الفوتونات رؤى قيمة للغاية حول نشاط الدائرة والرؤى البيولوجية الأخرى في الدماغ في الجسم الحي 12،13،14،15،16،17،18. وقد وسعت المجاهر المصغرة المثبتة على الجمجمة هذه القدرات لتمكين التسجيلات في الحيوانات المستيقظة التي تتحرك بحرية19. تتطلب عملية إنشاء نافذة الجمجمة حفرا كهربائيا لتخفيف عظم الجمجمة أو إزالته تماما لإنتاج حج القحف الكبير بما يكفي لتأمين قطعة شفافة من الزجاج فوق القشرة20. كما تم اختبار Polydimethylsiloxane (PDMS) والبوليمرات الأخرى كمواد نافذة الجمجمة 9,21. في النهاية ، نافذة الجمجمة المثالية هي النافذة التي لا تغير أو تتداخل مع النشاط الداخلي الطبيعي تحتها. ومع ذلك ، فمن المقبول عموما أن حفر نافذة الجمجمة يؤدي إلى تفاقم الأنسجة الكامنة ، مما يؤدي إلى تلف الدماغ ، وتعطيل البيئة ، والتأثير على السحايا إلى درجة انسداد عمق التصوير متعدد الفوتونات22. الالتهاب العصبي الناتج له مجموعة واسعة من الآثار تتراوح من نفاذية الحاجز الدموي الدماغي (BBB) ، إلى تنشيط وتجنيد الخلايا الدبقية حول موقع الزرع23. لذلك ، يعد توصيف طرق حفر نافذة الجمجمة الأكثر أمانا وقابلية للتكرار أمرا بالغ الأهمية لجودة التصوير المتسقة وتقليل العوامل المربكة.
بينما يتم الحرص على تقليل الصدمة إلى الأنسجة الكامنة ، فإن عملية حفر العظام لديها القدرة على التسبب في اضطرابات حرارية وميكانيكية للدماغ24,25. قد تؤدي الصدمة الميكانيكية الناتجة عن اختراق الحفر العرضي إلى الجافية إلى زيادة درجات متفاوتة من الإصابة القشرية24. في دراسة أجراها Shoffstall et al.25 ، أدت الحرارة الناتجة عن حفر العظام إلى زيادة نفاذية BBB ، كما يتضح من وجود صبغة Evans Blue (EB) في حمة الدماغ 25. ترتبط صبغة EB ، التي يتم حقنها عن طريق الوريد ، بالألبومين المنتشر في مجرى الدم ، وبالتالي لا تعبر عادة BBB صحية بتركيزات ملموسة. نتيجة لذلك ، تستخدم صبغة EB بشكل شائع كعلامة حساسة لنفاذية BBB26,27. في حين أن دراستهم لم تقيس بشكل مباشر تأثير نفاذية BBB على العواقب البيولوجية اللاحقة قيد الدراسة ، فقد ربطت الدراسات السابقة نفاذية BBB بزيادة الاستجابة الالتهابية العصبية للأقطاب الكهربائية الدقيقة المزروعة بشكل مزمن والتغيرات في الوظيفة الحركية28.
اعتمادا على أهداف الدراسة ، قد يساهم حجم الضرر الحراري والميكانيكي في مصدر للخطأ التجريبي ، مما يؤثر سلبا على دقة الدراسة وقابليتها للتكرار. هناك العشرات من الطرق المذكورة لإنتاج نوافذ الجمجمة ، كل منها يستخدم معدات حفر مختلفة ، وسرعات ، وتقنيات ، ومستخدمين1،2،3،4،5،6،7،8،9،10،11. أفاد Shoffstall et al.25 أن الاختلاف الملحوظ في نتائج التسخين يعزى إلى التباين في القوة المطبقة للحفر ومعدل التغذية وزاوية التطبيق ، من بين جوانب أخرى لا يمكن التحكم فيها عند الحفر باليد 25. هناك اعتقاد بأن أنظمة الحفر الآلي وغيرها من المعدات المجسمة يمكن أن تحسن قابلية التكاثر واتساق النتائج ، لكن دراسات الطريقة المنشورة لم تقيم بدقة درجة الحرارة أو نفاذية BBB كواحدة من النتائج. لذلك ، هناك حاجة إلى طرق أكثر قابلية للتكرار وتطبيقها باستمرار لإنتاج نوافذ الجمجمة ، وكذلك الطرق المطبقة بدقة لتقييم تأثير حفر نافذة الجمجمة على الأنسجة العصبية الكامنة.
تركز هذه الدراسة على تحديد وتطوير طرق حفر متسقة وآمنة لنوافذ الجمجمة. حجم حج القحف لتركيب نافذة الجمجمة أكبر بكثير من حج القحف القياسي للأقطاب الكهربائية الدقيقة المزروعة في الدماغ. لا يمكن إكمال حج القحف هذا بفتحة لدغ واحدة عند استخدام المعدات القياسية ، وبالتالي إدخال المزيد من التباين في التقنية بين الجراحين عند إجراؤها يدويا20. تم إدخال روبوتات الحفر الجراحية إلى الميدان ، ولكن لم يتم اعتمادها على نطاق واسع1،6،29. توفر أتمتة الحفر التحكم في المتغيرات التي تساهم في التباين الملحوظ من تجربة إلى أخرى ، مما يشير إلى أن استخدام المعدات يمكن أن يقلل من التأثيرات بين الجراحين وأثناءهم. هذا له أهمية خاصة نظرا للصعوبة الإضافية لحج القحف الأكبر اللازم لوضع نافذة الجمجمة. في حين يمكن للمرء أن يفترض أن هناك فوائد واضحة للتحكم الذي توفره أتمتة الحفر ، لم يكن هناك تقييم يذكر لتنفيذ هذه المعدات. على الرغم من عدم ملاحظة الآفات المرئية5 ، إلا أن اختبار الحساسية الأعلى باستخدام EB مطلوب.
هنا ، يتم قياس نفاذية BBB باستخدام روبوت حفر جراحي متاح تجاريا مع البرامج المقابلة ، والذي يسمح ببرمجة الإحداثيات المجسمة ، وتخطيط / رسم خرائط حج القحف ، ومجموعة مختارة من أنماط الحفر ("نقطة بنقطة" مقابل "أفقي") ، في إشارة إلى المسار الموجه لقمة الحفر. في البداية ، يتم حفر ثماني نقاط "بذرة" (الشكل 1 أ) ، تحدد نافذة الجمجمة. من هنا ، يتم قطع المسافة بين البذور باستخدام طريقة الحفر "نقطة بنقطة" أو "أفقية". تقوم "نقطة تلو الأخرى" بإجراء عمليات قطع عمودية للثقب التجريبي (على غرار مكبس الحفر CNC) ، بينما تقوم "أفقية" بإجراء عمليات قطع أفقية على طول محيط نافذة الجمجمة التي تحدد الفتحة (على غرار جهاز التوجيه CNC). النتيجة لكلتا الطريقتين هي قطعة من الجمجمة يمكن إزالتها للكشف عن نافذة الجمجمة. لعزل الضرر الناتج عن الحفر ، لا تتم إزالة نافذة الجمجمة فعليا ، وذلك لتجنب أي ضرر إضافي. يتم استخدام مزيج من صبغة EB إلى جانب التصوير الفلوري لقياس نفاذية BBB بعد إجراء حج القحف في الفئران ، ويتم استخدام مزدوج حراري مدرج لقياس درجة حرارة سطح الدماغ مباشرة أثناء الحفر (الشكل 1B ، C). أشارت الملاحظات السابقة إلى أن الحفر النبضي على / إيقاف مع فترات 2 ثانية كان كافيا للتخفيف من تسخين الحفر25 ، وبالتالي تم دمجه في النهج التجريبي للروبوت الجراحي.
الهدف من العمل المقدم هو إظهار طرق تقييم الضرر الحراري الناتج عن حفر حج القحف. بينما يتم تقديم الطرق في سياق الحفر الآلي ، يمكن تطبيق هذه الأساليب على مخططات الحفر اليدوي أيضا. يمكن استخدام هذه الطرق للتحقق من صحة استخدام المعدات و / أو مخططات الحفر قبل اعتمادها كإجراء قياسي.
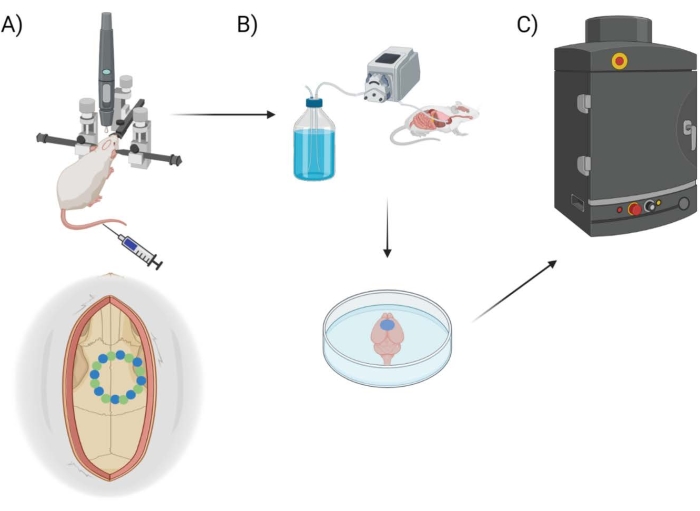
الشكل 1: مخطط خط الأنابيب التجريبي. رسم تخطيطي يوضح العملية التي خضعت لها الحيوانات لإجراء نافذة ما بعد الجمجمة بعد القياس الكمي EB. (أ) الإعداد التخطيطي للماوس مع الإطار التجسيمي وحفر الروبوت الجراحي. يظهر مثال على نافذة الجمجمة فوق القشرة الحركية بنقاط البذور (الخضراء) ونقاط الحافة (الأزرق). (ب) يتضمن إعداد التروية حقن 1x محلول ملحي مخزن بالفوسفات (PBS) في جميع أنحاء الحيوان لإزالة أي دم ، يليه استخراج الدماغ. (ج) يوضع الدماغ بعد ذلك في حجرة نظام التصوير الفلوري EB لإجراء تصوير فلوري على صبغة إيفانز الزرقاء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
تمت مراجعة جميع الإجراءات وممارسات رعاية الحيوان والموافقة عليها وتنفيذها وفقا للجنة رعاية واستخدام الحيوان المؤسسية التابعة لإدارة لويس ستوكس كليفلاند لشؤون المحاربين القدامى.
1. إعداد أجهزة الروبوت الجراحي
- قبل الجراحة ، اتبع دليل الروبوت الجراحي (انظر جدول المواد) ودليل لإعداد الأجهزة والبرامج. قم بإجراء معايرة الإطار كما هو مفصل في الدليل. إذا تم تحريك المثقاب أو الإطار ، فمن المستحسن إعادة معايرة المثقاب لضمان الدقة.
2. إعداد البرامج
- انتقل إلى البرنامج الجراحي (انظر جدول المواد) وأنشئ مشروعا جديدا عن طريق تحديد البدء بمشروع نظيف. قم بتعيين الموضوع على أنه ماوس في الأعلى لتعيين إحداثيات الحفر المراد استخدامها.
- حدد بدء مشروع جديد.
- من هنا ، انقر فوق التخطيط في الزاوية اليسرى السفلية للانتقال إلى شاشة تخطيط إحداثيات الحفر. إنشاء مخطط الحفر لتقنية نافذة الجمجمة المراد تنفيذها.
- للقيام بذلك ، انقر في أي مكان على أطلس المجسم. استخدم Bregma كمرجع ، وأدخل الإحداثيات التالية للقشرة الحركية: AP = 1.50 ، ML = 1.25 ، DV = 0.00. اضغط على Enter على لوحة المفاتيح لتحديث الإحداثيات المحددة.
ملاحظة: تشير الإحداثيات الظهرية البطنية (DV) إلى عمق الحفر وبالتالي لا تحتاج إلى إدخال هنا. - انقر فوق هدف المتجر لحفظ هذه الإحداثيات وإدخال اسم مناسب. من هنا ، انقر فوق الزر "نقل " في أسفل اليسار للانتقال مرة أخرى إلى شاشة الحفر الرئيسية.
- للقيام بذلك ، انقر في أي مكان على أطلس المجسم. استخدم Bregma كمرجع ، وأدخل الإحداثيات التالية للقشرة الحركية: AP = 1.50 ، ML = 1.25 ، DV = 0.00. اضغط على Enter على لوحة المفاتيح لتحديث الإحداثيات المحددة.
- انقر فوق أدوات > Project > حفظ باسم لإعادة استخدام مشروع القالب هذا للمشاريع اللاحقة. سيؤدي هذا تلقائيا إلى الاحتفاظ بإحداثيات الحفر لاستخدامها لاحقا.
3. التحضير للجراحة
- تخدير الفئران PrismPlus30,31 (انظر جدول المواد) في غرفة إيزوفلوران (3.5٪ في 1.5 لتر / دقيقة O2). ضع مادة تشحيم العين لمنع جفاف العينين ، وحلق الرأس باستخدام كليبرز ، وقم بقص الأظافر لمنع الفئران من خدش الغرز.
ملاحظة: الفئران PrismPlus هي نوع من الأنواع الفلورية المعدلة وراثيا المستخدمة في التصوير متعدد الفوتونات. تفتقر فئران PrismPlus غير المتجانسة إلى الجينات الفلورية ، وبالتالي تم استخدامها هنا لتقليل النفايات الحيوانية من الدراسات الجارية الأخرى ، وبما أنه لا يوجد تصوير متعدد الفوتونات في هذه الدراسة. ومن المتوقع أن تظهر الفئران البرية نتائج مماثلة. - تطبيق الحقن تحت الجلد للمضاد الحيوي سيفازولين (24 ملغ/كغ)، كاربروفين مسكن (5 ملغ/كغ)، والبوبرينورفين (0.05-0.10 ملغ/كغ) على الفئران المخدرة. قبل إجراء أي شق، يتم تطبيق حقنة واحدة تحت الجلد من الماركائين (0.25٪، 100 ميكرولتر) تحت موقع الشق (1 بوصة على طول خط الوسط للجمجمة بدءا من خلف العينين).
ملاحظة: الأدوية المستخدمة هنا تتبع بروتوكولات IACUC المحددة مسبقا. ومع ذلك ، فمن المستحسن النظر في كريم EMLA كمخدر موضعي لتأثير متعدد الوسائط قبل الجراحة وحقن الوريد الذيل وكذلك ميلوكسيكام SR بدلا من كاربروفين. يمكن توفير EMLA و Meloxicam SR قبل تخدير الأيزوفلوران. - قم بتركيب الحيوان على الإطار التجسيمي للروبوت الجراحي ، باستخدام قضبان الأذن المرفقة ، والحفاظ على التخدير بنسبة 0.5٪ -2٪ إيزوفلوران عن طريق الاستنشاق من خلال مخروط الأنف.
- تأكد من مراقبة عمق التخدير عن كثب من قبل فني أو موظف بيطري مدرب ، بناء على استجابة الماوس والتنفس (~ 55-65 نفسا / دقيقة) ومعدل ضربات القلب (300-450 نبضة في الدقيقة) واللون (وردي). يمكن أيضا استخدام الشارب وقرصة إصبع القدم العادية كمقياس لتحديد عمق التخدير. يتم تحديد قيم العناصر الحيوية من خلال لوائح IACUC المؤسسية.
- الحفاظ على درجة حرارة جسم الحيوان على وسادة المياه المتداولة ومراقبة العناصر الحيوية باستخدام نظام قياس الأكسجين في الدم ومعدل ضربات القلب.
- فرك المنطقة الجراحية مع غلوكونات الكلورهيكسيدين (CHG) و 70 ٪ الأيزوبروبانول للتعقيم. للحفاظ على العقم أثناء الجراحة ، ضع غلافا بلاستيكيا معقما على الماوس والإطار المجسم.
ملاحظة: في حين تم تطوير هذه البروتوكولات لجراحات البقاء على قيد الحياة ، فإن البيانات المقدمة تعكس استخدام الحيوانات غير الباقية ، حيث كان التركيز على اختبار وتحديد طرق بروتوكول الحفر المناسبة.
4. إعداد الجمجمة
- باستخدام شفرة مشرط ، قم بإجراء شق 1 بوصة على خط الوسط من الجمجمة ، بدءا من الجزء الخلفي من العينين.
- اسحب الجلد للخلف لكشف الجمجمة و (اختياريا) استخدم المبعدات للحفاظ على النافذة الجراحية. قم بإزالة أي أنسجة وغشاء متبقي باستخدام أدوات تطبيق معقمة ذات رؤوس قطنية.
- جفف الجمجمة ونظفها باستخدام 3٪ بيروكسيد الهيدروجين مع أدوات تطبيق ذات رؤوس قطنية.
ملاحظة: هذا سيجعل خيوط الجمجمة مرئية. يجب رؤية Bregma و Lambda بسهولة. إذا لم يكن كذلك ، ضع المزيد من بيروكسيد الهيدروجين أو قم بزيادة حجم الشق. - اسمح بوظيفة "الإيقاف التلقائي" عن طريق توصيل كابل مشبك التمساح من إعداد حفر الروبوت الجراحي بالماوس ، وفقا لتوصيات الشركة المصنعة. يعمل "الإيقاف التلقائي" عن طريق اكتشاف تغيير في المعاوقة ، لذلك بمجرد أن تلامس مثقاب الحفر السائل النخاعي (CSF) بدلا من العظام ، سيتوقف المثقاب عن الحفر ، وبالتالي يمنع تلف الدماغ.
5. حقن الوريد ذيل إيفانز الأزرق
تنبيه: EB هو مادة مسرطنة محتملة. استخدم القفازات عند المناولة.
- لتحضير الذيل لسهولة الحقن ، امسح بمسح الكحول. اختياريا ، يمكن تطبيق زيت وينترغرين موضعيا لتوسيع الوريد35.
- أمسك الذيل بيد واحدة أثناء التعامل مع المحقنة التي تحتوي على EB في اليد الأخرى. باستخدام الإبهام والسبابة ، ثني الذيل لفضح الوريد الذيل أعلى منحنى الذيل. أدخل المحقنة (1 أو 2 مل ، حقنة أنسولين 30 جم) بالتوازي مع الوريد وحقن حجم EB ببطء. يتم تطبيق EB (4٪ وزن / حجم) بتركيز 2 مل / كجم من وزن الجسم عن طريق حقن الوريد الذيل.
ملاحظة: يمكن الشعور بمقاومة ضئيلة أو معدومة للتدفق من المحقنة إلى الذيل إذا تم إدخال الإبرة بشكل صحيح. إذا كانت هناك مقاومة أو ظهرت صبغة EB في الذيل ، فانتقل لأسفل على الذيل وحاول مرة أخرى. - بمجرد الحقن ، انتظر لمدة 5 دقائق للسماح ل EB بالدوران في جميع أنحاء الماوس قبل بدء الحفر. يتم التحقق من الحقن الناجح على الفور حيث تتحول أطراف الفأر والنافذة الجراحية إلى اللون الأزرق.
6. إجراء حفر الروبوت الجراحي
- بمجرد تحضير الجمجمة للحفر ، انتقل مرة أخرى إلى البرنامج الجراحي. افتح مشروع القالب المحدد في الخطوة 2.4 حيث تم تعيين إحداثيات الحفر.
- اتبع الأدوات > Project > > جديد حدد مشروع قالب واختر مشروع القالب الذي تم تعيينه في الخطوة 2 (إعداد البرنامج).
- حدد نفس عناصر البروتوكول > التخطيط (النقاط المستهدفة) > معلمات الحفر للانتقال إلى هذا المشروع الجديد.
- انقر فوق بدء مشروع جديد.
- بعد ذلك ، قم بتصحيح المثقاب والإطار لحساب إمالة وتحجيم جمجمة الفأر للحيوان الحالي. انقر فوق أدوات وحدد تصحيح للإمالة والقياس... لفتح شاشة التصحيح. في الجزء العلوي من الشاشة ، تأكد من أن المثقاب نشط (وليس المحقنة) ، من خلال النقر على زر الحفر باللون الأحمر الفاتح.
ملاحظة: بمجرد تنشيطه ، سيتحول زر الحفر إلى اللون الأحمر الداكن / الساطع. يمكن تجاهل زر المحقنة ، حيث لا يتم استخدامه في هذا البروتوكول.- أولا ، قم بتصحيح المقياس ودرجة الصوت والانعراج عن طريق تحديد مكان وجود Bregma و Lambda على الحيوان الحالي. استخدم إما عناصر التحكم في لوحة المفاتيح أو عناصر التحكم التي تظهر على الشاشة لتحريك لقمة الحفر. بمجرد وضع لقمة الحفر فوق بريجما ، قم بخفضها حتى تلامس الجمجمة وانقر فوق تعيين بريجما. كرر هذا مع لامدا.
- بعد ذلك ، اضبط لفة الجمجمة المحددة. انقر فوق الزر Go to Midpoint لضبط مثقاب الحفر تلقائيا على مركز الجمجمة. انقر 2 مم إلى اليسار ثم اخفض مثقاب الحفر ببطء حتى تلمس الجمجمة. انقر فوق تعيين النقطة اليسرى.
- كرر الخطوة 6.2.2 للجانب الأيمن من الدماغ. الآن تم إعداد النظام لهذه الجمجمة المحددة.
ملاحظة: التصحيح هنا أمر بالغ الأهمية لضمان إحداثيات الحفر المناسبة والعمق. يجب تركيب الماوس بالقرب من المستقيم قدر الإمكان لتقليل الحاجة إلى التصحيح قدر الإمكان. إذا كانت هناك حاجة إلى تصحيحات كبيرة ، فقد يؤدي ذلك إلى ضعف دقة الحفر.
- بعد إجراء التصحيح ، اخرج من نافذة التصحيح بالنقر فوق غلق في الجزء السفلي الأوسط من الشاشة. انتقل إلى شاشة الحفر بالنقر فوق ادوات ثم حدد نقب... لبدء إجراء الحفر.
- تأكد من اختيار شكل حج القحف من القائمة المنسدلة Drill في الجزء العلوي من الشاشة. ثم ، انقر فوق تحديد مركز الحفر والشكل واختر الهدف المحدد مسبقا الذي تم تسميته في الخطوة 2.3.1. ضمن هذه الشاشة ، حدد دائرة كشكل للهدف وأدخل 2.60 مم كقطر2 للدائرة. انقر على إظهار.
ملاحظة: يتم إنشاء قطر نافذة الجمجمة باستخدام مركز مثقاب الحفر كمركز لنقاط البذور. يتم استخدام مثقاب صغير (القطر = 0.6 مم أو حجم اللقمة الموصى به المقدم من البائع) لتقليل القطر الإضافي المضاف نتيجة لاستخدام لقمة حفر أكبر. تستخدم لقم الثقب الخاصة خصيصا للروبوت الجراحي. ستظهر نقاط البذور الثمانية ونقاط الحافة الآن على الجمجمة كنقاط خضراء وزرقاء ، على التوالي. - انقر فوق النافذة الرئيسية واستخدم اختصار لوحة المفاتيح Control + Shift + D لإظهار قائمة Drill Points على الجانب الأيمن من الشاشة. هذا يسمح لعرض أعماق وحالات نقطة حفر محددة.
- قبل بدء الحفر ، قم بتخصيص ميزة الإيقاف التلقائي إذا لزم الأمر بالنقر فوق الزر الموجود بجوار مربع الاختيار Auto-Stop . يتم تعيين هذا الزر افتراضيا على Medium ، والذي يتوافق مع حساسية ميزة الإيقاف التلقائي.
ملاحظة: يمكن اختبار ذلك مسبقا للعثور على الحساسية المناسبة للحيوانات. في هذا البروتوكول ، تم استخدام أعلى حساسية لضمان الحد الأدنى من الحفر عبر الدماغ. - بمجرد تمكين ميزة الإيقاف التلقائي وتخصيصها ، ابدأ في حفر نقطة البذور. انقر فوق المسح التلقائي بحيث يبدأ الحفر تلقائيا عند البذور 1. بمجرد أن تلامس لقمة الحفر السائل الدماغي النخاعي ، ستكتشف ميزة التوقف التلقائي تغييرا في المعاوقة ، مما يؤدي إلى توقف الحفر وتراجع اللقمة من الجمجمة.
- راقب الحفر عن كثب في حالة فشل التوقف التلقائي في اكتشاف أي تغييرات. يمكن الضغط على مفتاح الهروب لإلغاء الحفر يدويا. يمكن أيضا النقر فوق الدائرة الوردية الموجودة في أسفل قائمة الحفر وعلى يمين قيم المعاوقة إما لبدء الحفر أو إيقافه.
ملاحظة: سيتم حفر لقمة الثقب تلقائيا إلى عمق يساوي سمك الجمجمة المقدر (أو حتى يتم تنشيط ميزة الإيقاف التلقائي). - إذا لم يتم تنشيط الإيقاف التلقائي قبل الوصول إلى العمق المقدر ، فستظهر شاشة تطالب المستخدم بما يلي: 1) استمر في الحفر والنزول # مم أكثر ، 2) ضع علامة على العمق الحالي واستمر ، 3) تخطي النقطة الحالية واستمر ، أو 4) أوقف العملية (قد تستمر لاحقا). اختر أحد الخيارات كما هو موضح أدناه.
- من أجل مواصلة الحفر والنزول # مم أبعد من ذلك ، أدخل مسافة حتى يتقدم المثقاب. بشكل افتراضي ، يتم استخدام 0.1 مم. يمكن اقتراح مسافة أصغر لمنع الاختراق العرضي للدماغ.
- إذا كان يعتقد أنه تم الوصول إلى الجافية في هذه الشاشة ، فحدد خيار وضع علامة على العمق الحالي واستمر للنظام لوضع علامة على الجافية عند هذا العمق والانتقال إلى البذرة التالية.
- استخدم الزر تخطي النقطة الحالية وتابع وأوقف العملية (قد تستمر لاحقا) لاستكشاف الأخطاء وإصلاحها أو تنظيف لقمة الحفر والعودة بمجرد أن يعمل الإيقاف التلقائي مرة أخرى.
- بمجرد حفر جميع نقاط البذور ، إذا لم يتم الانتهاء من أي منها باستخدام ميزة التوقف التلقائي ، فتحقق من عمق الحفرة يدويا باستخدام معول الجافية. سيضمن ذلك أن العمق المحفور قد اخترق الجمجمة.
- قبل البدء في حفر نقطة الحافة، حدد نوع "قص الحافة" المطلوب عن طريق تحديد القائمة المنسدلة بجوار نص Edge-Cut في قائمة Drill. الخياران هما نقطة بنقطة وأفقيا.
- حدد نقطة بنقطة لحفر كل نقطة حافة على حدة وإلى عمق تحدده أعماق نقطة البذور المجاورة. اضبط القياس إذا لزم الأمر من خلال الزر Edge Scaling ... أدناه ، على الرغم من أن الإعداد الافتراضي ل No Scaling عادة ما يكون كافيا.
- حدد أفقيا لبدء الحفر عند نقطة الحافة 1 واستخدم حركة حفر مستمرة للالتفاف حول محيط دائرة الحفر بالكامل. بشكل افتراضي ، سيتم قطع القطع الأفقي على فترات 100 ميكرومتر ، ويدور على طول محيط النافذة قبل التقدم بمقدار 100 ميكرومتر أخرى. إذا لزم الأمر ، قم بتغيير عمق الفاصل الزمني وسرعة الحفر ضمن خيارات القطع ... الزر أدناه.
- استخدم إزاحة القطع التلقائي (أسفل مربع قص الحافة) لضبط عمق القطع التلقائي عن طريق أخذ إزاحة محددة مسبقا من نقاط البذور المجاورة. في هذا البروتوكول ، تم استخدام إزاحة القطع التلقائي بمقدار 20 ميكرومتر. يمكن إجراء مزيد من الاختبارات لتحديد الإزاحة المثلى على أساس كل.
- بمجرد تحديد إعدادات قطع الحافة، ابدأ حفر نقطة الحافة بالنقر فوق الزر Auto Cut في منتصف قائمة Drill. بالنسبة للحفر نقطة بنقطة ، بمجرد حفر الحافة الأخيرة ، يتم الانتهاء من إجراء الحفر. للحفر الأفقي ، استمر حتى يتم حفر جمجمة كافية لتحرير نافذة الجمجمة.
ملاحظة: على الرغم من إجراء الحفر حتى يمكن تحرير النافذة ، إلا أن النافذة لا يتم تحريرها فعليا هنا لمنع أي تلف للأنسجة الكامنة. من المهم عزل الضرر نتيجة الحفر فقط لتقييم مخططات الحفر المختلفة.- بمجرد وصول الحفر الأفقي إلى عمق نقطة بذرة واحدة ، انقر بزر الماوس الأيمن فوق تلك البذرة (أو حدد عدة نقاط أولا) في قائمة نقاط الحفر وانقر فوق قفل العمق. سيسمح ذلك بمواصلة القطع الأفقي دون قطع أعمق لتلك المنطقة (وبالتالي تجنب اختراق الدماغ).
ملاحظة: إذا كانت هناك نقاط بذور ذات أعماق مختلفة للجافية، فقد يتسبب ذلك في اختلافات في العمق اللازم لإجراء الحفر الأفقي.
- بمجرد وصول الحفر الأفقي إلى عمق نقطة بذرة واحدة ، انقر بزر الماوس الأيمن فوق تلك البذرة (أو حدد عدة نقاط أولا) في قائمة نقاط الحفر وانقر فوق قفل العمق. سيسمح ذلك بمواصلة القطع الأفقي دون قطع أعمق لتلك المنطقة (وبالتالي تجنب اختراق الدماغ).
- إذا كانت ميزة الإيقاف التلقائي لا تعمل بشكل صحيح ، فتأكد من أن لقمة الحفر نظيفة تماما من أي حطام أو دم محتمل أو محلول ملحي وما إلى ذلك ، حيث قد يؤثر ذلك على مقاومة قاعدة البتة. بالإضافة إلى ذلك ، اختر أحد خيارات الحفر اليدوي العديدة الموضحة أدناه في حالة فشل التوقف التلقائي في العمل باستمرار.
- في قائمة Drill ، انتقل يدويا إلى كل بذرة عن طريق النقر بزر الماوس الأيمن على البذرة أو الحافة واختيار Go to Entry. هناك أيضا خيارات لمسح الأعماق المحددة ، وإعادة ضبط الحفرة ، وخيارات أخرى يمكن أن تساعد في إجراء الحفر.
- تحكم يدويا في تقدم عمق الحفر عن طريق تحديد عمق من القائمة المنسدلة الموجودة بجوار نص متقدم: بالقرب من أعلى قائمة الحفر. انقر فوق الزر "تقدم " أدناه مباشرة لتقديم حفر المسافة المحددة.
ملاحظة: يمكن استخدام هذه الميزة جنبا إلى جنب مع زري Set Dura وSet Surface أسفل الزر Advance لإخبار النظام يدويا بمكان وجود كل من سطح الجمجمة والجافية. استخدم وظيفة الإيقاف التلقائي حيثما أمكن ، ولكن إذا لزم الأمر ، تكفي هذه الخيارات اليدوية أيضا. - في حالة الحفر يدويا ، توخ مزيدا من الحذر بين كل فاصل زمني لعمق الحفر للتأكد من أن الحفر لا يتجاوز الجافية. تحقق من الحفرة المحفورة باستخدام معول الجافية بين فترات العمق للتأكد مما إذا كان قد تم الوصول إلى الجافية. بمجرد الانتهاء من حفر البذور يدويا ، استمر في إجراء قطع الحواف بشكل طبيعي كما هو موضح أعلاه.
- طريقة النبض
- لتنفيذ الحفر اليدوي للنبض، قم بإيقاف تشغيل ميزة الإيقاف التلقائي عن طريق إلغاء تحديد خانة الاختيار بجوار خيار الإيقاف التلقائي في قائمة الحفر . يجب إيقاف تشغيل هذا للسماح بالتحكم في وقت إيقاف تشغيل المثقاب للنبض.
ملاحظة: يتبع الحفر النبضي نمطا من 2 ثانية من الحفر متبوعا ب 2 ثانية من عدم الحفر للسماح للجمجمة بالتبريد. - في قائمة الحفر ، حدد 100 ميكرومتر كتقدم في عمق الحفر ، وهذا يعادل ~ 2 ثانية من الحفر لأسفل.
- بمجرد أن تصبح جاهزا ، انقر فوق تقدم لبدء الحفر.
ملاحظة: كن مستعدا لإيقاف المثقاب بسرعة بمجرد تقدمه بمقدار 100 ميكرومتر ، حيث يستمر المثقاب في الدوران على العمق حتى يتم الضغط على الهروب (توليد حرارة غير ضرورية). - بمجرد تقدم المثقاب بمقدار 100 ميكرومتر ، اضغط على Escape مرتين لإيقاف التدريب. بعد 2 ثانية ، كرر هذه الدورة لعمق الجمجمة.
ملاحظة: يمكن تنفيذ طريقة نقطة بنقطة فقط باستخدام الطريقة النبضية بسبب القيود البرمجية والميكانيكية. لا يمكن إجراء الحفر الأفقي المستمر بهذه الطريقة. - حفر جميع نقاط البذور والحافة باستخدام هذه الطريقة المفصلة أعلاه. تأكد من ضبط Dura باستخدام الزر الموجود في قائمة Drill بمجرد الوصول إلى الجافية.
- لتنفيذ الحفر اليدوي للنبض، قم بإيقاف تشغيل ميزة الإيقاف التلقائي عن طريق إلغاء تحديد خانة الاختيار بجوار خيار الإيقاف التلقائي في قائمة الحفر . يجب إيقاف تشغيل هذا للسماح بالتحكم في وقت إيقاف تشغيل المثقاب للنبض.
- تأكد من اختيار شكل حج القحف من القائمة المنسدلة Drill في الجزء العلوي من الشاشة. ثم ، انقر فوق تحديد مركز الحفر والشكل واختر الهدف المحدد مسبقا الذي تم تسميته في الخطوة 2.3.1. ضمن هذه الشاشة ، حدد دائرة كشكل للهدف وأدخل 2.60 مم كقطر2 للدائرة. انقر على إظهار.
7. التروية واستخراج الدماغ
- بمجرد الانتهاء من حفر البذور ونقاط الحافة ، احتفظ بالحيوان تحت تخدير الأيزوفلوران لمدة 1 ساعة إضافية للسماح لصبغة EB بالدوران والإسراف من خلال BBB التالف. قم بإجراء التروية القلبية لإزالة أي دم أو سوائل من الأوعية ، ثم قم بإزالة الدماغ للتصوير والتحليل كما هو موضح أدناه.
- بعد فترة دوران EB لمدة 1 ساعة بعد إنشاء نافذة الجمجمة ، قم بحقن كوكتيل من الكيتامين (160 مجم / كجم) والزيلازين (20 مجم / كجم) داخل الصفاق في الحيوان. بمجرد عدم الاستجابة ، قم بإجراء نضح القلب.
- قطع بطن الفأر باستخدام المقص وفضح القلب عن طريق قطع عموديا من خلال القفص الصدري وأفقيا عبر الحجاب الحاجز. اسحب القفص الصدري لعرض القلب بوضوح. أدخل إبرة فراشة في البطين الأيسر للقلب وابدأ في ضخ 1x محلول ملحي مخزن بالفوسفات (PBS) في جميع أنحاء الجسم. قص جزءا صغيرا من الأذين الأيمن للقلب لتحرير الضغط المتراكم.
- بعد 25 مل من 1x PBS قد تغلطت في جميع أنحاء الجسم ، ووقف التروية وقطع رأس الماوس كوسيلة ثانوية للقتل الرحيم.
ملاحظة: تأكد من تنفيذ الطريقة المعتمدة مؤسسيا للقتل الرحيم و / أو نضح نقطة النهاية للحيوان لعزل الدماغ. - من هنا ، استخرج الدماغ من الجمجمة عن طريق إزالة العظام والأنسجة باستخدام rongeurs.
- تخيل الدماغ المستخرج بنظام تصوير فلوري لمراقبة كمية EB الموجودة في الدماغ حول مواقع الحفر.
ملاحظة: يرتبط EB بالألبومين المتداول. في حالة حدوث تلف في الأوعية الدموية في الدماغ ، سوف يتسرب EB ويرتبط بأنسجة المخ ، مما يؤدي إلى مؤشر مرئي واضح للتلف.
8. إيفانز بلو التصوير والتحليل
- تهيئة الأجهزة
- قم بتشغيل الكمبيوتر المتصل بنظام التصوير الفلوري EB وابدأ تشغيل برنامج التصوير (انظر جدول المواد) أثناء إعداد العناصر الأخرى. قم بتشغيل مصدر الضوء والمنصة والكاميرا بهذا الترتيب.
- انتقل إلى برنامج التصوير وانقر فوق تهيئة ضمن لوحة التحكم في الاستحواذ. سيشير النظام والغرفة من الأحمر إلى الأخضر بمجرد اكتمال التهيئة.
ملاحظة: قم بتهيئة نظام التصوير الفلوري EB قبل 30 دقيقة من أي تصوير للسماح لدرجة حرارة مصدر الضوء بالوصول إلى المستويات المثلى.
- تصوير الدماغ
- ضع الدماغ المزروع في طبق واضح في وسط المسرح للتصوير.
- ضمن لوحة التحكم في الاكتساب ، اضبط إعدادات الصورة. حدد وقت التعرض: 1 ثانية ؛ بينينغ: متوسطة; F / إيقاف: F1 ؛ الإثارة: 535 إلى 675 نانومتر ؛ الانبعاثات: Cy 5.5 ؛ مستوى المصباح: عالي; و FOV: 5 سم. اترك الفلتر مغلقا وفحص تراكب التصوير الفوتوغرافي والتألق. تستند هذه الإعدادات إلى الخبرة المعملية السابقة والطرق المنشورة الأخرى للتصوير EB36.
- قم بتحميل صور نظام التصوير الفلوري EB في برنامج معالجة الصور مفتوح الوصول (انظر جدول المواد) وقم بإنشاء ثلاث مناطق اهتمام يدوية (ROIs) للعثور على شدة الفلورسنت ل EB عن طريق قياس متوسط الإشعاع على الخلفية والدماغ بالكامل ونافذة الجمجمة.
- تطبيع نافذة الجمجمة وقياسات الدماغ كله مقابل عائد الاستثمار في الخلفية المقابلة.
- تخيل كل دماغ تحت مرشحات إثارة مختلفة (535-675 نانومتر) للعثور على الطول الموجي مع أعلى نسبة إشارة إلى الضوضاء (تم اختيار 605 نانومتر) بين المجموعات التجريبية للتحكم في المياه المالحة.
- اعزل متوسط الإشعاع تحت الطول الموجي والمتوسط المناسبين للحصول على متوسط الإشعاع المتوسط أو شدة الفلورسنت للدماغ بأكمله وعائد الاستثمار لنافذة الجمجمة.
- ابحث عن متوسط الإشعاع المتوسط فوق منطقة نافذة الجمجمة لكل مجموعة مقابل التحكم في المحلول الملحي وقم بتطبيعه.
9. تقييم الحرارية
- قم بقياس التغيرات في درجة حرارة الجمجمة والدماغ باستخدام مزدوج حراري (انظر جدول المواد) بالاشتراك مع مخططات الحفر الثلاثة المختلفة. يتم توصيل المزدوجة الحرارية بنظام الحصول على البيانات (DAQ) الذي يسمح بقراءة القياس في MATLAB.
- قم بتركيب ماوس جثة على الإطار التجسيمي وإعداد المثقاب الآلي. قم بحفر حفرة صغيرة يدويا (بنفس حجم نقطة البذور) ~ 2 مم بعيدا عن المكان الذي سيتم فيه عمل نافذة الجمجمة في جانب الجمجمة25. سيسمح هذا الثقب بانزلاق المزدوجة الحرارية إلى موضعها تحت مكان حدوث حفر نافذة الجمجمة (الشكل 2 د).
ملاحظة: تستخدم الفئران الجثة لأن الحفر فتح جانب الجمجمة مطلوب لتحريك المزدوجة الحرارية فوق منطقة حفر نافذة الجمجمة. فأر الجثة هذا هو مختلف عن الحيوان المستخدم سابقا في تحليل إيفانز بلو. - ابدأ عملية الحفر لكل مخطط من المخططات الثلاثة كما تم سابقا (الخطوة 6). أثناء مرور المثقاب عبر الجمجمة ، سيكون هناك طفرات في تغير درجة الحرارة ، مما يشير إلى حدوث حرارة بالقرب من الدماغ.
- سجل ورسم النتائج في MATLAB لحساب أقصى فرق في درجة الحرارة. يجب أن يتم ذلك بشكل منفصل لحفر البذور وحفر الحواف لتقييم الحفر الأفقي مقابل الحفر نقطة بنقطة جنبا إلى جنب مع طريقة الحفر اليدوي النبضي.
10. الإحصاءات
- إجراء التحليل الإحصائي للتصوير الحراري والفلورسنت EB في R باستخدام اختبار مجموع رتبة Kruskal-Wallis مع تصحيح Benjamini-Hochberg متبوعا بمقارنات زوجية باستخدام اختبار مجموع رتبة Wilcoxon الدقيق25.
Access restricted. Please log in or start a trial to view this content.
النتائج
التقييم الحراري
تم تقييم احتمالية حدوث ضرر حراري عن طريق قياس التغير في درجة الحرارة من خط الأساس بسبب الحفر باستخدام الطرق الأفقية (الشكل 2 أ) ونقطة تلو الأخرى (الشكل 2 ب) والنبضية نقطة تلو الأخرى (الشكل 2 ج). يعرض الشكل 2D...
Access restricted. Please log in or start a trial to view this content.
Discussion
يعد استخدام صبغة EB والتصوير أمرا مباشرا وسريعا ومفيدا لتقييم تلف الأوعية الدموية في الدماغ للحصول على طرق وتقنيات جديدة. سواء كنت تستخدم روبوتا جراحيا أو تؤكد الطرق التي يتم إجراؤها حاليا في المختبر ، فمن المهم التحقق من صحة الأساليب الجراحية لعزل آثار العلاجات التجريبية مقابل التأثير ا?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإبلاغ عنه. لا تمثل المحتويات وجهات نظر وزارة شؤون المحاربين القدامى الأمريكية أو المعاهد الوطنية للصحة أو حكومة الولايات المتحدة.
Acknowledgements
تم دعم هذه الدراسة جزئيا من قبل جوائز Merit Review Awards GRANT12418820 (Capadona) و GRANTI01RX003420 (Shoffstall / Capadona) ، وجائزة عالم البحث الوظيفي # GRANT12635707 (Capadona) من خدمة أبحاث وتطوير إعادة التأهيل التابعة لوزارة شؤون المحاربين القدامى بالولايات المتحدة. بالإضافة إلى ذلك ، تم دعم هذا العمل جزئيا من قبل المعهد الوطني للصحة ، والمعهد الوطني للاضطرابات العصبية والسكتة الدماغية GRANT12635723 (Capadona) ، والمعهد الوطني للتصوير الطبي الحيوي والهندسة الحيوية ، T32EB004314 ، (Capadona / Kirsch). تستند هذه المادة إلى العمل المدعوم من زمالة أبحاث الدراسات العليا لمؤسسة العلوم الوطنية بموجب المنحة رقم GRANT12635723. أي رأي أو نتائج أو استنتاجات أو توصيات معبر عنها في هذه المادة هي آراء المؤلف (المؤلفين) ولا تعكس بالضرورة آراء المؤسسة الوطنية للعلوم.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1x Phosphate Buffered Saline Type: Reagent | VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool | Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug | Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool | Stoelting | 58640-1 | |
| Carprofen Type: Drug | Sourced from Animal Facility | ||
| Cefazolin Type: Drug | Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent | Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug | Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool | Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool | Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug | Sourced from Animal Facility | ||
| LivingImage Type: Tool | Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug | Sourced from Animal Facility | ||
| Neurostar Software Type: Tool | Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool | Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal | Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool | Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool | TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool | National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug | Sourced from Animal Facility |
References
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678(2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779(2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740(2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15(2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194(2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789(2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818(2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer's disease transgenic mice. Communications Biology. 4 (1), 1368(2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680(2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100(2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001(2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001(2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385(2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588(2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254(2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007(2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511(2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neuroscience. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. Clinical Laboratory Animal Medicine, second ed. , Blackwell Publishing. Ames Iowa. (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642(2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved