È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione del danno termico da craniotomia robotizzata per la chirurgia della finestra cranica nei topi
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Le finestre craniche sono diventate una tecnica chirurgica implementata ovunque per consentire l'imaging intravitale nei topi transgenici. Questo protocollo descrive l'uso di un robot chirurgico che esegue la perforazione ossea semi-automatica delle finestre craniche e può aiutare a ridurre la variabilità da chirurgo a chirurgo e parzialmente mitigare il danno termico della barriera emato-encefalica.
Abstract
La chirurgia della finestra cranica consente l'imaging del tessuto cerebrale nei topi vivi con l'uso di multifotoni o altre tecniche di imaging intravitale. Tuttavia, quando si esegue qualsiasi craniotomia a mano, c'è spesso un danno termico al tessuto cerebrale, che è intrinsecamente variabile da chirurgia a chirurgia e può dipendere dalla tecnica del singolo chirurgo. L'implementazione di un robot chirurgico può standardizzare la chirurgia e portare a una diminuzione del danno termico associato alla chirurgia. In questo studio, sono stati testati tre metodi di perforazione robotizzata per valutare il danno termico: orizzontale, punto per punto e pulsato punto per punto. La perforazione orizzontale utilizza uno schema di perforazione continua, mentre punta a punto perfora diversi fori che circondano la finestra cranica. Il punto per punto pulsato aggiunge uno schema di perforazione "2 s on, 2 s off" per consentire il raffreddamento tra una perforazione e l'altra. L'imaging fluorescente del colorante Evans Blue (EB) iniettato per via endovenosa misura i danni al tessuto cerebrale, mentre una termocoppia posizionata sotto il sito di perforazione misura il danno termico. I risultati della termocoppia indicano una significativa diminuzione della variazione di temperatura nel gruppo pulsato punto per punto (6,90 °C ± 1,35 °C) rispetto ai gruppi orizzontale (16,66 °C ± 2,08 °C) e punto per punto (18,69 °C ± 1,75 °C). Allo stesso modo, il gruppo pulsato punto per punto ha anche mostrato una presenza significativamente inferiore di EB dopo la perforazione della finestra cranica rispetto al metodo orizzontale, indicando meno danni ai vasi sanguigni nel cervello. Pertanto, un metodo di perforazione pulsato punto per punto sembra essere lo schema ottimale per ridurre il danno termico. Un trapano robotizzato è uno strumento utile per ridurre al minimo l'allenamento, la variabilità e ridurre i danni termici. Con l'uso crescente dell'imaging multifotonico nei laboratori di ricerca, è importante migliorare il rigore e la riproducibilità dei risultati. I metodi affrontati qui aiuteranno a informare gli altri su come utilizzare meglio questi robot chirurgici per far progredire ulteriormente il campo.
Introduzione
Le finestre craniche sono diventate onnipresenti nei campi delle neuroscienze, dell'ingegneria neurale e della biologia per consentire la visualizzazione diretta e l'imaging della corteccia negli animali viventi 1,2,3,4,5,6,7,8,9,10,11 . La potente combinazione di topi transgenici e imaging multifotonico ha fornito informazioni estremamente preziose sull'attività dei circuiti e altre intuizioni biologiche nel cervello in vivo 12,13,14,15,16,17,18. I microscopi miniaturizzati montati sul cranio hanno ulteriormente esteso queste capacità per consentire registrazioni in animali svegli e in movimento libero19. Il processo di creazione di una finestra cranica richiede una perforazione elettrica per assottigliare o rimuovere completamente l'osso cranico per produrre craniotomie abbastanza grandi da fissare un pezzo di vetro trasparente sopra la corteccia20. Anche il polidimetilsilossano (PDMS) e altri polimeri sono stati testati come materiali cranici per finestre 9,21. In definitiva, la finestra cranica ideale è quella che non altera o interferisce con la normale attività endogena sottostante. Tuttavia, è comunemente accettato che la perforazione della finestra cranica aggrava il tessuto sottostante, portando a danni al cervello, interruzione dell'ambiente e influenzando le meningi fino al punto di occludere la profondità di imaging multifotonico22. La neuroinfiammazione risultante ha una vasta gamma di effetti che vanno dalla permeabilità della barriera emato-encefalica (BBB), all'attivazione e al reclutamento delle cellule gliali intorno al sito dell'impianto23. Pertanto, caratterizzare metodi di perforazione della finestra cranica più sicuri e riproducibili è fondamentale per una qualità di imaging costante e per ridurre i fattori confondenti.
Mentre si presta attenzione a ridurre al minimo il trauma al tessuto sottostante, l'atto di perforare l'osso ha il potenziale di causare perturbazioni sia termiche che meccaniche al cervello24,25. Il trauma meccanico dovuto alla penetrazione accidentale del trapano nella dura può ulteriormente indurre vari gradi di lesioni corticali24. In uno studio di Shoffstall et al.25, il calore della perforazione ossea ha provocato un aumento della permeabilità alla BBB, come indicato dalla presenza di colorante Evans Blue (EB) nel parenchima cerebrale 25. Il colorante EB, iniettato per via endovenosa, si lega all'albumina circolante nel sangue e quindi normalmente non attraversa una BBB sana in concentrazioni apprezzabili. Di conseguenza, il colorante EB è comunemente usato come marcatore sensibile della permeabilità alla BBB26,27. Mentre il loro studio non ha misurato direttamente l'impatto della permeabilità della BEE sulle successive sequele biologiche in studio, studi precedenti hanno correlato la permeabilità della BBB a una maggiore risposta neuroinfiammatoria ai microelettrodi cronicamente impiantati e alle alterazioni della funzione motoria28.
A seconda degli obiettivi dello studio, l'entità del danno termico e meccanico può contribuire a una fonte di errore sperimentale, influenzando negativamente il rigore e la riproducibilità dello studio. Esistono dozzine di metodi citati per la produzione di finestre craniche, ognuno dei quali utilizza diverse attrezzature di perforazione, velocità, tecniche e utenti 1,2,3,4,5,6,7,8,9,10,11. Shoffstall et al.25 hanno riferito che la variazione osservata nei risultati del riscaldamento è stata attribuita alla variabilità della forza applicata del trapano, della velocità di avanzamento e dell'angolo di applicazione, tra gli altri aspetti che non possono essere controllati quando si perfora a mano 25. Si ritiene che i sistemi di perforazione automatizzati e altre apparecchiature stereotassiche possano migliorare la riproducibilità e la coerenza dei risultati, ma gli studi sui metodi pubblicati non hanno valutato rigorosamente la temperatura o la permeabilità alla BEE come uno dei risultati. Pertanto, vi è la necessità di metodi più riproducibili e applicati in modo coerente per produrre finestre craniche, nonché metodi rigorosamente applicati per valutare l'impatto della perforazione della finestra cranica sul tessuto neurale sottostante.
L'obiettivo di questo studio è determinare e sviluppare metodi di perforazione coerenti e sicuri per le finestre craniche. La dimensione della craniotomia per l'installazione della finestra cranica è significativamente più grande delle craniotomie standard per i microelettrodi impiantati al cervello. Tali craniotomie non possono essere completate con un singolo foro di bava quando si utilizza l'attrezzatura standard, introducendo così una maggiore variabilità della tecnica interchirurgica quando eseguita a mano20. I robot di perforazione chirurgica sono stati introdotti sul campo, ma non sono stati ampiamente adottati 1,6,29. L'automazione della perforazione offre il controllo sulle variabili che contribuiscono alla variazione osservata da prova a prova, suggerendo che l'uso dell'attrezzatura può ridurre gli effetti inter- e intra-chirurgici. Ciò è di particolare interesse data la difficoltà aggiuntiva della craniotomia più grande necessaria per il posizionamento della finestra cranica. Mentre si potrebbe presumere che ci siano chiari benefici per il controllo fornito dall'automazione della perforazione, c'è stata poca valutazione dell'implementazione di queste attrezzature. Sebbene non siano state osservate lesioni visibili5, si desidera il test di sensibilità più elevato utilizzando EB.
Qui, la permeabilità alla BBB viene misurata utilizzando un robot di perforazione chirurgica disponibile in commercio con il relativo software, che consente la programmazione delle coordinate stereotassiche, la pianificazione / mappatura della craniotomia e una selezione di stili di perforazione ("punto per punto" vs "orizzontale"), riferendosi al percorso instradato della punta del trapano. Inizialmente, vengono perforati otto punti "seme" (Figura 1A), che delineano la finestra cranica. Da qui, lo spazio tra i semi viene ritagliato utilizzando il metodo di perforazione "punto per punto" o "orizzontale". "Point-by-point" esegue tagli di fori pilota verticali (simili a una pressa per trapano CNC), mentre "orizzontale" esegue tagli orizzontali lungo la circonferenza della finestra cranica che delineano il foro (simile a un router CNC). Il risultato per entrambi i metodi è un pezzo di cranio che può essere rimosso per rivelare la finestra cranica. Per isolare i danni da perforazione, la finestra cranica non viene rimossa fisicamente, in modo da evitare ulteriori danni. Una combinazione di colorante EB accoppiato con imaging fluorescente viene utilizzata per misurare la permeabilità alla BBB dopo aver eseguito craniotomie nei topi e una termocoppia inserita viene utilizzata per misurare direttamente la temperatura della superficie cerebrale durante la perforazione (Figura 1B, C). Osservazioni precedenti hanno indicato che la perforazione pulsata on/off con intervalli di 2 s era sufficiente per mitigare il riscaldamento del trapano25, e quindi è incorporata nell'approccio sperimentale per il robot chirurgico.
L'intento del lavoro presentato è quello di dimostrare i metodi di valutazione del danno termico da perforazione craniotomia. Mentre i metodi sono presentati nel contesto della perforazione automatizzata, tali metodi possono essere applicati anche a schemi di perforazione manuale. Questi metodi possono essere utilizzati per convalidare l'uso di attrezzature e / o schemi di perforazione prima di adottare come procedura standard.
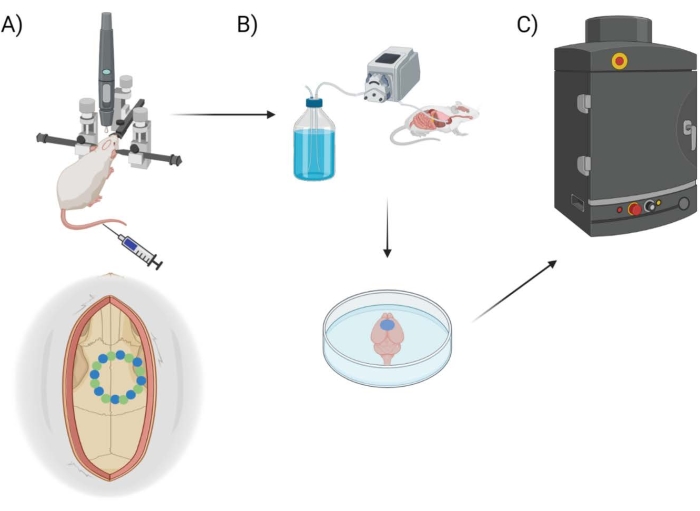
Figura 1: Schema sperimentale della pipeline . Schema che dimostra il processo che gli animali sono stati sottoposti per la quantificazione dell'EB dopo la procedura della finestra cranica. (A) Configurazione schematica del mouse con telaio stereotassico e trapano robotico chirurgico. Un esempio di finestra cranica è mostrato sopra la corteccia motoria con punti seme (verde) e punti di bordo (blu). (B) La configurazione della perfusione include l'iniezione di 1x soluzione salina tamponata con fosfato (PBS) in tutto l'animale per rimuovere il sangue, seguita dall'estrazione del cervello. (C) Il cervello viene quindi messo nella camera del sistema di imaging fluorescente EB per condurre l'imaging fluorescente sul colorante blu Evans. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure e le pratiche di cura degli animali sono state esaminate, approvate ed eseguite in conformità con il Louis Stokes Cleveland Department of Veterans Affairs Medical Center Institutional Animal Care and Use Committee.
1. Configurazione hardware del robot chirurgico
- Prima dell'intervento, seguire il manuale e la guida del robot chirurgico (vedere la tabella dei materiali) per configurare l'hardware e il software. Eseguire la calibrazione del fotogramma come descritto nel manuale. Se il trapano o il telaio vengono spostati, si consiglia di ricalibrare il trapano per garantire la precisione.
2. Preparazione del software
- Passare al software chirurgico (vedere Tabella dei materiali) e creare un nuovo progetto selezionando Inizia con un progetto pulito. Impostare il soggetto come Mouse nella parte superiore per designare le coordinate di foratura da utilizzare.
- Selezionare Avvia nuovo progetto.
- Da qui, fare clic su Pianificazione nell'angolo in basso a sinistra per passare alla schermata di pianificazione delle coordinate di foratura. Creare lo schema di perforazione per la tecnica della finestra cranica da eseguire.
- Per fare ciò, fai clic in un punto qualsiasi dell'atlante stereotassico. Usa Bregma come riferimento e inserisci le seguenti coordinate per la corteccia motoria: AP = 1,50, ML = 1,25, DV = 0,00. Premere Invio sulla tastiera per aggiornare le coordinate selezionate.
NOTA: le coordinate dorsale-ventrale (DV) indicano la profondità della perforazione e quindi non hanno bisogno di un input qui. - Fare clic su Store Target per salvare queste coordinate e immettere un nome appropriato. Da qui, fai clic sul pulsante Sposta in basso a sinistra per tornare alla schermata principale di foratura.
- Per fare ciò, fai clic in un punto qualsiasi dell'atlante stereotassico. Usa Bregma come riferimento e inserisci le seguenti coordinate per la corteccia motoria: AP = 1,50, ML = 1,25, DV = 0,00. Premere Invio sulla tastiera per aggiornare le coordinate selezionate.
- Fare clic su Strumenti > progetto > Salva con nome per riutilizzare questo progetto modello per progetti successivi. Ciò manterrà automaticamente le coordinate di perforazione per un uso successivo.
3. Preparazione per l'intervento chirurgico
- Anestetizzare i topi PrismPlus30,31 (vedere Tabella dei materiali) in una camera di isoflurano (3,5% in 1,5 L/min O2). Applicare lubrificante per gli occhi per prevenire l'asciugatura degli occhi, radersi la testa con le tosatrici e tagliare le unghie per evitare che i topi graffino le suture.
NOTA: I topi PrismPlus sono un tipo di specie fluorescente transgenica utilizzata nell'imaging multifotonico. I topi eterozigoti PrismPlus mancano dei geni fluorescenti e sono stati quindi utilizzati qui per ridurre i rifiuti animali da altri studi in corso, e poiché non vi è alcuna imaging multifotonico in questo studio. I topi wild-type dovrebbero mostrare risultati simili. - Somministrare iniezioni sottocutanee di antibiotico cefazolina (24 mg/kg), carprofen analgesico (5 mg/kg) e buprenorfina (0,05-0,10 mg/kg) ai topi anestetizzati. Prima di qualsiasi incisione, somministrare una singola iniezione sottocutanea di marcaina (0,25%, 100 μL) sotto il sito di incisione (1 pollice lungo la linea mediana del cranio a partire da dietro gli occhi).
NOTA: I farmaci utilizzati qui seguono i protocolli IACUC precedentemente stabiliti. Tuttavia, si raccomanda di considerare la crema EMLA come anestetico topico per un effetto multimodale prima dell'intervento chirurgico e l'iniezione della vena caudale e Meloxicam SR al posto del carprofene. EMLA e Meloxicam SR possono essere forniti prima dell'anestesia con isoflurano. - Montare l'animale sul telaio stereotassico del robot chirurgico, utilizzando le barre auricolari in dotazione, e mantenere l'anestesia con isoflurano allo 0,5%-2% tramite inalazione attraverso un cono nasale.
- Assicurarsi che la profondità dell'anestetico sia strettamente monitorata da un tecnico veterinario addestrato o da personale, in base alla reattività del mouse, alla respirazione (~ 55-65 respiri / min), alla frequenza cardiaca (300-450 bpm) e al colore (rosa). Il baffo e il pizzico regolare della punta possono anche essere usati come misura per determinare la profondità dell'anestesia. I valori dei parametri vitali sono determinati dai regolamenti istituzionali IACUC.
- Mantenere la temperatura corporea dell'animale su un tampone d'acqua circolante e monitorare i parametri vitali utilizzando un sistema di misurazione dell'ossigeno nel sangue e della frequenza cardiaca.
- Strofinare l'area chirurgica con clorexidina gluconato (CHG) e isopropanolo al 70% per la sterilizzazione. Per mantenere la sterilità durante l'intervento chirurgico, posizionare un involucro di plastica sterile sul mouse e sul telaio stereotassico.
NOTA: Mentre questi protocolli sono stati sviluppati per interventi chirurgici di sopravvivenza, i dati presentati riflettono l'uso di animali non sopravvissuti, poiché l'obiettivo era quello di testare e determinare i metodi del protocollo di perforazione appropriati.
4. Preparazione del cranio
- Usando una lama di bisturi, eseguire un'incisione di 1 pollice sulla linea mediana del cranio, iniziando dalla parte posteriore degli occhi.
- Tirare indietro la pelle per esporre il cranio e (facoltativamente) utilizzare divaricatori per mantenere la finestra chirurgica. Rimuovere qualsiasi residuo di tessuto e membrana utilizzando applicatori sterili con punta di cotone.
- Asciugare e pulire il cranio utilizzando perossido di idrogeno al 3% con applicatori con punta di cotone.
NOTA: Questo renderà visibili le suture del cranio. Bregma e Lambda dovrebbero essere facilmente visibili. In caso contrario, applicare più perossido di idrogeno o aumentare le dimensioni dell'incisione. - Consentire la funzionalità di "arresto automatico" collegando il cavo della clip a coccodrillo dalla configurazione di perforazione del robot chirurgico al mouse, secondo le raccomandazioni del produttore. "Auto-stop" funziona rilevando un cambiamento di impedenza, quindi una volta che la punta del trapano contatta il liquido cerebrospinale (CSF) anziché l'osso, il trapano interromperà la perforazione, prevenendo così danni al cervello.
5. Iniezione di vena caudale blu Evans
ATTENZIONE: EB è un possibile cancerogeno. Utilizzare i guanti durante la manipolazione.
- Per preparare la coda per una facile iniezione, pulire con una salvietta imbevuta di alcool. Opzionalmente, l'olio wintergreen può essere applicato localmente per dilatare la vena35.
- Afferrare la coda in una mano mentre si maneggia la siringa contenente EB nell'altra mano. Usando il pollice e l'indice, piega la coda per esporre la vena della coda sopra la curva della coda. Inserire la siringa (1 o 2 ml, siringa da insulina da 30 G) parallelamente alla vena e iniettare lentamente il volume di EB. L'EB (4% p/v) viene somministrato ad una concentrazione di 2 ml/kg di peso corporeo tramite iniezione della vena caudale.
NOTA: se l'ago è inserito correttamente, si avverte una resistenza minima o nulla al flusso dalla siringa alla coda. Se c'è resistenza o il colorante EB appare nella coda, quindi spostarsi verso il basso sulla coda e riprovare. - Una volta iniettato, attendere 5 minuti per consentire all'EB di circolare attraverso il mouse prima di iniziare la perforazione. L'iniezione riuscita viene immediatamente verificata quando le estremità del topo e la finestra chirurgica diventano blu.
6. Procedura di perforazione del robot chirurgico
- Una volta che il cranio è pronto per la perforazione, tornare al software chirurgico. Aprire il progetto modello definito nel passaggio 2.4 in cui sono state designate le coordinate per la foratura.
- Seguire Strumenti > progetto > Nuovo > Selezionare un progetto modello e scegliere il progetto modello designato nel passaggio 2 (preparazione software).
- Selezionare Stessi elementi di protocollo > Pianificazione (punti target) > Parametri drill da trasferire a questo nuovo progetto.
- Fare clic su Avvia nuovo progetto.
- Quindi, correggere il trapano e il telaio per tenere conto dell'inclinazione e del ridimensionamento del cranio del topo dell'animale corrente. Fate clic su Strumenti (Tools ) e selezionate Correggi per inclinazione e ridimensionamento... per aprire la schermata di correzione. Nella parte superiore dello schermo, assicurarsi che il trapano sia attivo (non la siringa), facendo clic sul pulsante Drill rosso chiaro.
NOTA: una volta attivato, il pulsante Drill diventerà rosso scuro/brillante. Il pulsante della siringa può essere ignorato, in quanto non viene utilizzato in questo protocollo.- Innanzitutto, correggi la scala, il passo e l'imbardata impostando dove si trovano Bregma e Lambda sull'animale corrente. Utilizzare i controlli da tastiera o i controlli su schermo per spostare la punta del trapano. Una volta che la punta del trapano si trova sopra Bregma, abbassarla fino a toccare il cranio e fare clic su Imposta Bregma. Ripeti questa operazione per Lambda.
- Quindi, regolare per il rotolo specifico del cranio. Fare clic sul pulsante Vai al punto medio per regolare automaticamente la punta del trapano al centro del cranio. Fare clic su 2 mm a sinistra e quindi abbassare lentamente la punta del trapano fino a toccare il cranio. Fate clic su Imposta punto sinistro.
- Ripetere il passaggio 6.2.2 per il lato destro del cervello. Ora il sistema è impostato per questo cranio specifico.
NOTA: la correzione qui è fondamentale per garantire le coordinate e la profondità di perforazione corrette. Il mouse deve essere montato il più vicino possibile al dritto per ridurre il più possibile la necessità di correzione. Se sono necessarie correzioni di grandi dimensioni, ciò potrebbe comportare una scarsa precisione della perforazione.
- Dopo aver eseguito la correzione, uscire dalla finestra di correzione facendo clic su Chiudere nella parte inferiore centrale dello schermo. Passare alla schermata di foratura facendo clic su Utensileria e quindi selezionando Trapano... per iniziare la procedura di perforazione.
- Assicurati che Craniotomia-Shape sia scelto dal menu a discesa Drill nella parte superiore dello schermo. Quindi, fare clic su Seleziona centro di foratura e forma e scegliere la destinazione predefinita denominata nel passaggio 2.3.1. Sotto questa schermata, selezionate Cerchio come forma per la destinazione e immettete 2,60 mm come diametro2 del cerchio. Fai clic su Mostra.
NOTA: il diametro della finestra cranica viene creato utilizzando il centro della punta del trapano come centro dei punti di partenza. Una punta di perforazione piccola (diametro = 0,6 mm o la dimensione della punta consigliata dal fornitore) viene utilizzata per ridurre al minimo il diametro aggiuntivo aggiunto come risultato dell'utilizzo di una punta di perforazione più grande. Le punte speciali vengono utilizzate specificamente per il robot chirurgico. Gli otto punti seme e i punti di bordo appariranno ora sul cranio come punti verdi e blu, rispettivamente. - Fare clic sulla finestra principale e utilizzare la scorciatoia da tastiera Control + Maiusc + D per visualizzare il menu Punti di perforazione sul lato destro dello schermo. Ciò consente di visualizzare profondità e stati specifici dei punti di foratura.
- Prima di iniziare la perforazione, personalizzare la funzione di arresto automatico, se necessario, facendo clic sul pulsante accanto alla casella di controllo Arresto automatico . Per impostazione predefinita, questo pulsante è Medio, che corrisponde alla sensibilità per la funzione di arresto automatico.
NOTA: Questo può essere testato in anticipo per trovare la giusta sensibilità per gli animali. In questo protocollo, è stata utilizzata la massima sensibilità per garantire una perforazione minima attraverso il cervello. - Una volta attivata e personalizzata la funzione di arresto automatico, iniziare la foratura del punto di partenza. Fare clic su Scansione automatica in modo che il trapano inizi automaticamente da Seed 1. Una volta che la punta del trapano tocca il CSF, la funzione di arresto automatico rileverà una variazione di impedenza, portando a un arresto nella perforazione e alla retrazione della punta dal cranio.
- Tieni d'occhio la perforazione nel caso in cui l'arresto automatico non riesca a rilevare eventuali modifiche. È possibile premere il tasto Esc per annullare manualmente la perforazione. È inoltre possibile fare clic sul cerchio rosa situato nella parte inferiore del menu Trapano e a destra dei valori di impedenza per avviare o interrompere la foratura.
NOTA: la punta del trapano forerà automaticamente fino a una profondità pari allo spessore stimato del cranio (o fino a quando non viene attivata la funzione di arresto automatico). - Se l'arresto automatico non viene attivato prima che venga raggiunta la profondità stimata, verrà visualizzata una schermata che richiede all'utente di: 1) Continuare la perforazione e la discesa # mm ulteriormente, 2) Contrassegnare alla profondità corrente e continuare, 3) Salta il punto corrente e continua, o 4) Interrompere il processo (può essere continuato in seguito). Scegli una delle opzioni descritte di seguito.
- Per Continua foratura (Continue drilling) e discende ulteriormente # mm, immettete una distanza per far avanzare la foratura. Per impostazione predefinita, viene utilizzato 0,1 mm. Una distanza minore può essere suggerita per prevenire la penetrazione accidentale del cervello.
- Se si ritiene che la dura sia stata raggiunta in questa schermata, selezionare l'opzione Segna alla profondità corrente e continua affinché il sistema segni la dura a quella profondità e passi al seme successivo.
- Utilizzare il pulsante Salta il punto corrente e continuare e Arrestare il processo (può essere continuato in seguito) per risolvere i problemi o pulire la punta del trapano e tornare una volta che l'arresto automatico funziona di nuovo.
- Una volta che tutti i punti di partenza sono stati forati, se non sono stati completati utilizzando la funzione di arresto automatico, controllare manualmente la profondità del foro utilizzando un plettro dura. Ciò assicurerà che la profondità perforata sia penetrata attraverso il cranio.
- Prima di iniziare la foratura del punto di spigolo, decidete quale tipo di taglio di spigolo è desiderato selezionando il menu a discesa accanto al testo Taglio spigolo nel menu Foratura. Le due opzioni sono Punto per punto e Orizzontalmente.
- Selezionate Punto per punto per eseguire il drilling di ciascun punto di spigolo singolarmente e fino a una profondità determinata dalle profondità del punto di partenza adiacenti. Se necessario, regolate il ridimensionamento tramite il pulsante Edge Scaling... riportato di seguito, anche se in genere è sufficiente l'impostazione predefinita No Scaling.
- Selezionate Orizzontalmente (Horizontally) per iniziare la foratura in corrispondenza del punto di spigolo 1 e utilizzate un movimento di foratura continuo per aggirare l'intera circonferenza del cerchio di foratura. Per impostazione predefinita, il taglio orizzontale taglierà a intervalli di 100 μm, percorrendo tutta la circonferenza della finestra prima di avanzare di altri 100 μm più in profondità. Se necessario, modificate la profondità dell'intervallo e la velocità di foratura sotto il pulsante Opzioni taglio... qui sotto.
- Utilizzate l'offset di taglio automatico (sotto la casella Taglio spigolo) per regolare la profondità di taglio automatico prendendo un offset predeterminato dai punti di partenza adiacenti. In questo protocollo, è stato utilizzato un offset di taglio automatico di 20 μm. Ulteriori test possono essere effettuati per determinare un offset ottimale su base per animale.
- Una volta determinate le impostazioni del taglio di spigolo, iniziate la foratura dei punti di spigolo facendo clic sul pulsante Taglio automatico (Auto Cut) al centro del menu Foratura (Drill). Per la perforazione punto per punto, una volta forato l'ultimo bordo, la procedura di foratura è terminata. Per la perforazione orizzontale, continuare fino a quando non è stato perforato abbastanza cranio per rilasciare la finestra cranica.
NOTA: sebbene la perforazione venga eseguita fino a quando la finestra non può essere rilasciata, la finestra non viene rilasciata fisicamente qui per evitare danni al tessuto sottostante. È importante isolare il danno come risultato della sola perforazione per valutare diversi schemi di perforazione.- Una volta che la foratura orizzontale ha raggiunto la profondità di un punto di partenza, fate clic con il pulsante destro del mouse su tale valore di partenza (o selezionate prima più punti) nel menu Punti di foratura (Drill Points) e fate clic su Blocca profondità (Lock Depth). Ciò consentirà al taglio orizzontale di continuare senza tagliare più in profondità per quell'area (evitando così di penetrare nel cervello).
NOTA: se ci sono punti di semina con diverse profondità di duratura, ciò può causare differenze nella profondità necessaria per la procedura di perforazione orizzontale.
- Una volta che la foratura orizzontale ha raggiunto la profondità di un punto di partenza, fate clic con il pulsante destro del mouse su tale valore di partenza (o selezionate prima più punti) nel menu Punti di foratura (Drill Points) e fate clic su Blocca profondità (Lock Depth). Ciò consentirà al taglio orizzontale di continuare senza tagliare più in profondità per quell'area (evitando così di penetrare nel cervello).
- Se la funzione di arresto automatico non funziona correttamente, assicurarsi che la punta del trapano sia completamente pulita da eventuali detriti o potenziale sangue, soluzione salina, ecc., poiché potrebbero influire sull'impedenza di base della punta. Inoltre, scegliere una delle diverse opzioni di foratura manuale descritte di seguito nel caso in cui l'arresto automatico non funzioni in modo coerente.
- Nel menu Foratura, individuate manualmente ciascun valore di partenza facendo clic con il pulsante destro del mouse sul seme o sullo spigolo e scegliendo Vai a inserimento. Ci sono anche opzioni per cancellare le profondità contrassegnate, ripristinare il foro e altre opzioni che possono aiutare con la procedura di foratura.
- Controllare manualmente l'avanzamento della profondità di foratura selezionando una profondità dal menu a discesa situato accanto al testo Avanza: nella parte superiore del menu Foratura. Fare clic sul pulsante Avanzate direttamente sotto per far avanzare il trapano alla distanza impostata.
NOTA: questa funzione può essere utilizzata insieme ai pulsanti Imposta dura e Imposta superficie sotto il pulsante Avanzate per indicare manualmente al sistema dove si trovano sia la superficie del cranio che la dura. Se possibile, utilizzare la funzione di arresto automatico, ma se necessario sono sufficienti anche queste opzioni manuali. - In caso di foratura manuale, prestare maggiore attenzione tra ogni intervallo di profondità di foratura per assicurarsi che il trapano non superi la durata. Controllare il foro praticato utilizzando un prelievo di dura tra gli intervalli di profondità per confermare se la dura è stata raggiunta. Una volta terminata tutta la seminatrice manuale, continuare la procedura di taglio dei bordi normalmente come descritto sopra.
- Metodo dell'impulso
- Per eseguire la perforazione manuale a impulsi, disattivate la funzione di arresto automatico deselezionando la casella di controllo accanto all'opzione Arresto automatico nel menu Trapano. Questo deve essere disattivato per consentire il controllo quando il trapano è spento per il pulsante.
NOTA: la perforazione a impulsi segue uno schema di 2 s di perforazione seguita da 2 s di nessuna perforazione per consentire al cranio di raffreddarsi. - Nel menu Trapano, selezionate 100 μm come avanzamento della profondità di perforazione, questo equivarrà a ~2 s di perforazione verso il basso.
- Una volta pronto, fate clic su Avanzate (Advance ) per iniziare la perforazione.
NOTA: essere pronti a fermare rapidamente il trapano una volta che è avanzato di 100 μm, poiché il trapano continua a ruotare alla profondità fino a quando non viene premuto l'escape (generando calore non necessario). - Una volta che il trapano è avanzato di 100 μm, premere Esc due volte per arrestare il trapano. Dopo 2 secondi, ripetere questo ciclo per la profondità del cranio.
NOTA: solo il metodo punto per punto può essere eseguito utilizzando il metodo pulsato a causa di vincoli software e meccanici. La perforazione orizzontale continua non può essere eseguita in questo modo. - Forare tutti i punti di partenza e di spigolo utilizzando questo metodo descritto sopra. Assicurarsi di impostare Dura utilizzando il pulsante nel menu Trapano una volta raggiunta la dura.
- Per eseguire la perforazione manuale a impulsi, disattivate la funzione di arresto automatico deselezionando la casella di controllo accanto all'opzione Arresto automatico nel menu Trapano. Questo deve essere disattivato per consentire il controllo quando il trapano è spento per il pulsante.
- Assicurati che Craniotomia-Shape sia scelto dal menu a discesa Drill nella parte superiore dello schermo. Quindi, fare clic su Seleziona centro di foratura e forma e scegliere la destinazione predefinita denominata nel passaggio 2.3.1. Sotto questa schermata, selezionate Cerchio come forma per la destinazione e immettete 2,60 mm come diametro2 del cerchio. Fai clic su Mostra.
7. Perfusione ed estrazione cerebrale
- Una volta terminata la perforazione del seme e dei punti di bordo, tenere l'animale in anestesia isoflurana per ulteriori 1 ora per consentire al colorante EB di circolare ed esvasare attraverso la BBB danneggiata. Eseguire la perfusione cardiaca per rimuovere sangue o fluidi dai vasi, quindi rimuovere il cervello per l'imaging e l'analisi come descritto di seguito.
- Dopo il periodo di circolazione di 1 h EB successivo alla creazione della finestra cranica, iniettare un cocktail di ketamina (160 mg/kg) e xilazina (20 mg/kg) per via intraperitoneale nell'animale. Una volta che non risponde, eseguire una perfusione cardiaca.
- Taglia l'addome del topo usando le forbici ed espongi il cuore tagliando verticalmente attraverso la gabbia toracica e orizzontalmente attraverso il diaframma. Ritrarre la gabbia toracica per vedere chiaramente il cuore. Inserire un ago a farfalla nel ventricolo sinistro del cuore e iniziare a infondere 1x soluzione salina tamponata fosfato (PBS) in tutto il corpo. Tagliare una piccola porzione dell'atrio destro del cuore per rilasciare l'accumulo di pressione.
- Dopo che 25 ml di 1x PBS si sono perfusi in tutto il corpo, interrompere la perfusione e decapitare il topo come mezzo secondario di eutanasia.
NOTA: Assicurarsi di eseguire il metodo approvato istituzionalmente di eutanasia e / o perfusione finale per l'animale per isolare il cervello. - Da qui, estrarre il cervello dal cranio rimuovendo l'osso e il tessuto con rongeurs.
- Immagina il cervello estratto con un sistema di imaging fluorescente per osservare la quantità di EB situato nel cervello intorno ai siti di perforazione.
NOTA: EB si lega all'albumina circolante. Se si verifica un danno vascolare nel cervello, EB fuoriesce e si lega al tessuto cerebrale, portando a un chiaro indicatore visivo del danno.
8. Imaging e analisi Evans Blue
- Inizializzazione hardware
- Accendere il computer collegato al sistema di imaging a fluorescenza EB e avviare il software di imaging (vedere Tabella dei materiali) mentre sono in preparazione altri elementi. Accendere la sorgente luminosa, la piattaforma e la fotocamera nell'ordine indicato.
- Accedere al software di imaging e fare clic su Inizializza nel Pannello di controllo dell'acquisizione. Il sistema e la camera segnaleranno da rosso a verde non appena l'inizializzazione è completa.
NOTA: inizializzare il sistema di imaging fluorescente EB 30 minuti prima di qualsiasi imaging per consentire alla temperatura della sorgente luminosa di raggiungere livelli ottimali.
- Imaging del cervello
- Posiziona il cervello espiantato in un piatto trasparente al centro del palco per l'imaging.
- Nel Pannello di controllo acquisizione, regolare le impostazioni per l'immagine. Selezionare il tempo di esposizione: 1 s; Binning: Medio; F/Stop: F1; Eccitazione: da 535 a 675 nm; Emissione: Cy 5.5; Livello della lampada: Alto; e FOV: 5 cm. Lasciare il filtro bloccato e la sovrapposizione di fotografia e fluorescenza selezionata. Queste impostazioni si basano su precedenti esperienze di laboratorio e altri metodi pubblicati di imaging EB36.
- Carica le immagini del sistema di imaging fluorescente EB in un software di elaborazione delle immagini ad accesso aperto (vedi Tabella dei materiali) e genera tre regioni di interesse (ROI) a mano libera per trovare l'intensità fluorescente di EB misurando la radianza media sullo sfondo, sull'intero cervello e sulla finestra cranica.
- Normalizzare la finestra cranica e le misurazioni dell'intero cervello rispetto al corrispondente ROI di fondo.
- Immagina ogni cervello sotto diversi filtri di eccitazione (535-675 nm) per trovare la lunghezza d'onda con il più alto rapporto segnale / rumore (è stato scelto 605 nm) tra i gruppi sperimentali al controllo salino.
- Isolare la radianza media sotto la lunghezza d'onda e la media appropriate per ottenere la radianza media media o l'intensità fluorescente per l'intero cervello e il ROI della finestra cranica.
- Trova e normalizza la radianza media media sull'area della finestra cranica per ciascun gruppo rispetto al controllo salino.
9. Valutazione delle termocoppie
- Misurare i cambiamenti di temperatura del cranio e del cervello usando una termocoppia (vedi Tabella dei materiali) in combinazione con i tre diversi schemi di perforazione. La termocoppia è collegata a un sistema di acquisizione dati (DAQ) che consente la lettura della misura in MATLAB.
- Montare un topo cadavere sul telaio stereotassico e sulla configurazione del trapano robotico. Praticare manualmente un piccolo foro (delle stesse dimensioni del punto di semina) a ~ 2 mm di distanza da dove la finestra cranica verrà fatta nel lato del cranio25. Questo foro consentirà alla termocoppia di essere fatta scivolare nella posizione sotto la quale avviene la perforazione della finestra cranica (Figura 2D).
NOTA: i topi cadaveri vengono utilizzati perché è necessario aprire il lato del cranio per far scorrere la termocoppia sulla regione di perforazione della finestra cranica. Questo topo cadavere è un animale diverso da quello precedentemente utilizzato per l'analisi di Evans Blue. - Iniziare il processo di perforazione per ciascuno dei tre schemi come fatto in precedenza (passaggio 6). Mentre il trapano passa attraverso il cranio, ci saranno picchi nel cambiamento di temperatura, indicando il riscaldamento che si verifica vicino al cervello.
- Registra e traccia i risultati in MATLAB per calcolare la differenza massima di temperatura. Questo dovrebbe essere fatto separatamente per la semina e la perforazione dei bordi per valutare la perforazione orizzontale rispetto alla foratura punto per punto insieme al metodo di perforazione manuale pulsato.
10. Statistiche
- Eseguire analisi statistiche per termocoppia e imaging fluorescente EB in R utilizzando un test della somma dei ranghi di Kruskal-Wallis con correzione di Benjamini-Hochberg seguita da confronti a coppie utilizzando il test esatto della somma del rango di Wilcoxon25.
Access restricted. Please log in or start a trial to view this content.
Risultati
Valutazione termica
Il potenziale di danno termico è stato valutato misurando la variazione di temperatura rispetto al basale dovuta alla perforazione utilizzando metodi orizzontali (Figura 2A), punto per punto (Figura 2B) e pulsati punto per punto (Figura 2C). La Figura 2D mostra la configurazione sperimentale per ottenere dati termici. Per la valutazione termica è stata utilizzat...
Access restricted. Please log in or start a trial to view this content.
Discussione
L'uso del colorante EB e dell'imaging è semplice, rapido e utile per valutare il danno vascolare nel cervello per nuovi metodi e tecniche. Sia che si utilizzi un robot chirurgico o che si confermino i metodi attualmente eseguiti in laboratorio, è importante convalidare i metodi chirurgici per isolare gli effetti dei trattamenti sperimentali rispetto all'impatto chirurgico e migliorare il benessere degli animali. Una configurazione a termocoppia è utile anche per valutare i metodi di perforazione per garantire che non ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi da segnalare. I contenuti non rappresentano le opinioni del Dipartimento degli affari dei veterani degli Stati Uniti, del National Institutes of Health o del governo degli Stati Uniti.
Riconoscimenti
Questo studio è stato supportato in parte dai Merit Review Awards GRANT12418820 (Capadona) e GRANTI01RX003420 (Shoffstall / Capadona) e dal Research Career Scientist Award # GRANT12635707 (Capadona) dal Department of Veterans Affairs Rehabilitation Research and Development Service degli Stati Uniti (USA). Inoltre, questo lavoro è stato anche supportato in parte dal National Institute of Health, dal National Institute of Neurological Disorders and Stroke GRANT12635723 (Capadona) e dal National Institute for Biomedical Imaging and Bioengineering, T32EB004314, (Capadona/Kirsch). Questo materiale si basa sul lavoro sostenuto dalla National Science Foundation Graduate Research Fellowship sotto Grant No. GRANT12635723. Qualsiasi opinione, risultato, conclusione o raccomandazione espressa in questo materiale è quella degli autori e non riflette necessariamente le opinioni della National Science Foundation.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 1x Phosphate Buffered Saline Type: Reagent | VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool | Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug | Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool | Stoelting | 58640-1 | |
| Carprofen Type: Drug | Sourced from Animal Facility | ||
| Cefazolin Type: Drug | Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent | Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug | Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool | Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool | Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug | Sourced from Animal Facility | ||
| LivingImage Type: Tool | Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug | Sourced from Animal Facility | ||
| Neurostar Software Type: Tool | Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool | Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal | Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool | Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool | TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool | National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug | Sourced from Animal Facility |
Riferimenti
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678(2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779(2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740(2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15(2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194(2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789(2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818(2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer's disease transgenic mice. Communications Biology. 4 (1), 1368(2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680(2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100(2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001(2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001(2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385(2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588(2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254(2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007(2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511(2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neuroscience. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. Clinical Laboratory Animal Medicine, second ed. , Blackwell Publishing. Ames Iowa. (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642(2017).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon