A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכת נזק תרמי מקרניוטומיה שנקדחה על ידי רובוט לניתוח חלון גולגולת בעכברים
* These authors contributed equally
In This Article
Summary
חלונות גולגולת הפכו לטכניקה כירורגית המיושמת בכל מקום כדי לאפשר הדמיה תוך חיונית בעכברים טרנסגניים. פרוטוקול זה מתאר את השימוש ברובוט כירורגי המבצע קידוח עצם חצי אוטומטי של חלונות גולגולת ויכול לסייע בהפחתת השונות בין מנתח למנתח ולהפחית חלקית את הנזק התרמי למחסום הדם-מוח.
Abstract
ניתוח חלון גולגולת מאפשר הדמיה של רקמת המוח בעכברים חיים באמצעות מולטיפוטון או טכניקות הדמיה תוך חיוניות אחרות. עם זאת, בעת ביצוע כל craniotomy ביד, יש לעתים קרובות נזק תרמי לרקמת המוח, אשר משתנה מטבעו ניתוח לניתוח עשוי להיות תלוי בטכניקה מנתח בודד. הטמעת רובוט כירורגי יכולה לתקנן את הניתוח ולהוביל לירידה בנזק התרמי הקשור לניתוח. במחקר זה נבדקו שלוש שיטות של קידוח רובוטי להערכת נזק תרמי: אופקי, נקודה אחר נקודה ופעימות נקודה אחר נקודה. קידוח אופקי משתמש בסכמת קידוח רציפה, בעוד נקודה אחר נקודה קודח מספר חורים המקיפים את חלון הגולגולת. פעימות נקודה אחר נקודה מוסיפות סכימת קידוח "2 שניות על, 2 שניות כבויות" כדי לאפשר קירור בין הקידוחים. הדמיה פלואורסצנטית של צבע כחול אוונס (EB) המוזרק לווריד מודדת נזק לרקמת המוח, בעוד זוג תרמי הממוקם מתחת לאתר הקידוח מודד נזק תרמי. תוצאות זוג תרמי מצביעות על ירידה משמעותית בשינוי הטמפרטורה בקבוצת הפועמים נקודה אחר נקודה (6.90 ° C ± 1.35 ° C) בהשוואה לקבוצה האופקית (16.66 ° C ± 2.08 ° C) ונקודה אחר נקודה (18.69 ° C ± 1.75 ° C). באופן דומה, קבוצת הפולסים נקודה אחר נקודה גם הראתה נוכחות EB נמוכה משמעותית לאחר קידוח חלון גולגולתי בהשוואה לשיטה האופקית, מה שמצביע על פחות נזק לכלי הדם במוח. לפיכך, שיטת קידוח פועמת נקודה אחר נקודה נראית כתוכנית האופטימלית להפחתת נזק תרמי. מקדחה רובוטית היא כלי שימושי המסייע למזער אימונים, שונות ולהפחית נזק תרמי. עם השימוש המתרחב בדימות מולטיפוטונים במעבדות מחקר, חשוב לשפר את הקשיחות ואת יכולת השחזור של התוצאות. השיטות המטופלות כאן יסייעו ליידע אחרים כיצד להשתמש טוב יותר ברובוטים כירורגיים אלה כדי לקדם עוד יותר את התחום.
Introduction
חלונות גולגולת נמצאים בשימוש נפוץ בכל תחומי מדעי המוח, הנדסה עצבית וביולוגיה כדי לאפשר הדמיה ישירה והדמיה של קליפת המוח בבעלי חיים 1,2,3,4,5,6,7,8,9,10,11 . השילוב רב העוצמה של עכברים טרנסגניים והדמיית מולטיפוטונים סיפק תובנות בעלות ערך רב על פעילות המעגלים ותובנות ביולוגיות אחרות במוח in vivo 12,13,14,15,16,17,18. מיקרוסקופים זעירים המותקנים על הגולגולת הרחיבו יכולות אלה עוד יותר כדי לאפשר הקלטות בבעלי חיים ערים הנעים בחופשיות19. תהליך יצירת חלון גולגולתי דורש קידוח כוח כדי לדלל או להסיר לחלוטין את עצם הגולגולת כדי לייצר קרניוטומיות גדולות מספיק כדי להבטיח חתיכת זכוכית שקופה מעל קליפת המוח20. פולידימתילסילוקסאן (PDMS) ופולימרים אחרים נבדקו גם כחומרי חלון גולגולתי 9,21. בסופו של דבר, חלון הגולגולת האידיאלי הוא חלון שאינו משנה או מפריע לפעילות אנדוגנית נורמלית מתחת. עם זאת, מקובל כי קידוח חלונות גולגולת מחמיר את הרקמה הבסיסית, מוביל לנזק למוח, הפרעה לסביבה והשפעה על קרומי המוח עד כדי הסתרת עומק הדמיה מולטיפוטון22. לדלקת העצבית המתקבלת יש מגוון רחב של השפעות החל מחדירות מחסום הדם-מוח (BBB), ועד הפעלה וגיוס של תאי גלייה סביב אתר השתל23. לכן, אפיון שיטות קידוח חלון גולגולת בטוחות וניתנות לשחזור הוא חיוני לאיכות הדמיה עקבית ולהפחתת גורמים מבלבלים.
בעוד שננקטת זהירות כדי למזער את הטראומה לרקמה הבסיסית, לפעולת קידוח העצם יש פוטנציאל לגרום להפרעות תרמיות ומכניות למוח24,25. טראומה מכנית מחדירת מקדח בשוגג לתוך הדורה עלולה לגרום בדרגות שונות של פגיעה בקליפת המוח24. במחקר שנערך על ידי Shoffstall et al.25, החום מקידוח עצם הביא לחדירות מוגברת של BBB, כפי שצוין על ידי נוכחות של צבע כחול אוונס (EB) בפרנכימה במוח 25. צבע EB, המוזרק לווריד, נקשר לאלבומין במחזור הדם ולכן בדרך כלל אינו חוצה BBB בריא בריכוזים ניכרים. כתוצאה מכך, צבע EB משמש בדרך כלל כסמן רגיש של חדירות BBB26,27. בעוד המחקר שלהם לא מדד ישירות את ההשפעה של חדירות BBB על sequelae ביולוגי לאחר מכן תחת מחקר, מחקרים קודמים מצאו קשר חדירות BBB לתגובה נוירו-דלקתית מוגברת למיקרואלקטרודות מושתלות כרוניות ושינויים בתפקוד המוטורי28.
בהתאם למטרות המחקר, עוצמת הנזק התרמי והמכני עשויה לתרום מקור לטעות ניסויית, ולהשפיע לרעה על הקשיחות והשחזור של המחקר. ישנן עשרות שיטות מצוטטות לייצור חלונות גולגולת, כל אחת באמצעות ציוד קידוח שונה, מהירויות, טכניקות, ומשתמשים 1,2,3,4,5,6,7,8,9,10,11. Shoffstall et al.25 דיווחו כי השונות שנצפתה בתוצאות החימום יוחסה לשונות בכוח המופעל של הקידוח, בקצב ההזנה ובזווית היישום שלו, בין היבטים אחרים שלא ניתן לשלוט בהם בעת קידוח ביד 25. קיימת אמונה כי מערכות קידוח אוטומטיות וציוד סטריאוטקסי אחר יכולים לשפר את יכולת השחזור ואת עקביות התוצאה, אך מחקרי שיטה שפורסמו לא העריכו בקפדנות טמפרטורה או חדירות BBB כאחת התוצאות. לכן, יש צורך בשיטות ניתנות יותר לשחזור ומיושמות באופן עקבי לייצור חלונות גולגולת, כמו גם שיטות המיושמות בקפדנות כדי להעריך את ההשפעה של קידוח חלון גולגולתי על רקמה עצבית בסיסית.
מטרת מחקר זה היא לקבוע ולפתח שיטות קידוח עקביות ובטוחות לחלונות גולגולת. גודל הקרניוטומיה להתקנת חלון גולגולתי גדול משמעותית מקרניוטומיות סטנדרטיות עבור מיקרואלקטרודות מושתלות במוח. קרניוטומיות כאלה לא ניתן להשלים עם חור בור יחיד בעת שימוש בציוד סטנדרטי, ובכך להציג יותר שונות טכניקה בין מנתחים כאשר מבוצע על ידי יד20. רובוטים לקידוח כירורגי הוכנסו לתחום, אך לא אומצו באופן נרחב 1,6,29. אוטומציה של קידוחים מציעה שליטה על משתנים התורמים לשונות שנצפתה מניסוי לניסוי, מה שמרמז על כך שהשימוש בציוד יכול להפחית את ההשפעות הבין-מנתחות והפנים-מנתחות. זה מעניין במיוחד בהתחשב בקושי הנוסף של קרניוטומיה גדולה יותר הדרושה למיקום חלון גולגולתי. בעוד שניתן להניח שיש יתרונות ברורים לבקרה המסופקת על ידי אוטומציה של הקידוחים, הייתה הערכה מועטה של יישום ציוד זה. למרות שנגעים גלויים לא נצפו5, בדיקת רגישות גבוהה יותר באמצעות EB רצויה.
כאן, חדירות BBB נמדדת באמצעות רובוט קידוח כירורגי זמין מסחרית עם תוכנה מתאימה, המאפשר תכנות של קואורדינטות סטריאוטקסיות, תכנון/מיפוי קרניוטומיה, ומבחר סגנונות קידוח ("נקודה אחר נקודה" לעומת "אופקי"), המתייחסים לנתיב המנותב של מקדח. בתחילה קודחים שמונה נקודות "זרע" (איור 1A), המתארות את חלון הגולגולת. מכאן, הרווח בין הזרעים נחתך בשיטת "נקודה אחר נקודה" או "אופקית". "נקודה אחר נקודה" מבצע חיתוכים אנכיים של חור טייס (בדומה למקדח CNC), ואילו "אופקי" מבצע חיתוכים אופקיים לאורך היקף חלון הגולגולת המתווה את החור (בדומה לנתב CNC). התוצאה עבור שתי השיטות היא חתיכת גולגולת שניתן להסיר כדי לחשוף את חלון הגולגולת. כדי לבודד נזק מקידוח, חלון הגולגולת אינו מוסר פיזית, כדי למנוע נזק נוסף. שילוב של צבע EB בשילוב עם הדמיה פלואורסצנטית משמש למדידת חדירות BBB לאחר ביצוע קרניוטומיות בעכברים, וזוג תרמי שהוחדר משמש למדידה ישירה של הטמפרטורה של פני השטח במוח במהלך הקידוח (איור 1B,C). תצפיות קודמות הצביעו על כך שקידוח פועם במרווחים של 2 שניות הספיק כדי להפחית את חימום הקידוח25, ולכן הוא משולב בגישה הניסויית עבור הרובוט הכירורגי.
מטרת העבודה המוצגת היא להדגים שיטות להערכת נזק תרמי מקידוח קרניוטומיה. בעוד שהשיטות מוצגות בהקשר של קידוח אוטומטי, ניתן ליישם שיטות כאלה גם על תוכניות קידוח ידניות. ניתן להשתמש בשיטות אלה כדי לאמת את השימוש בציוד ו / או תוכניות קידוח לפני אימוץ כהליך סטנדרטי.
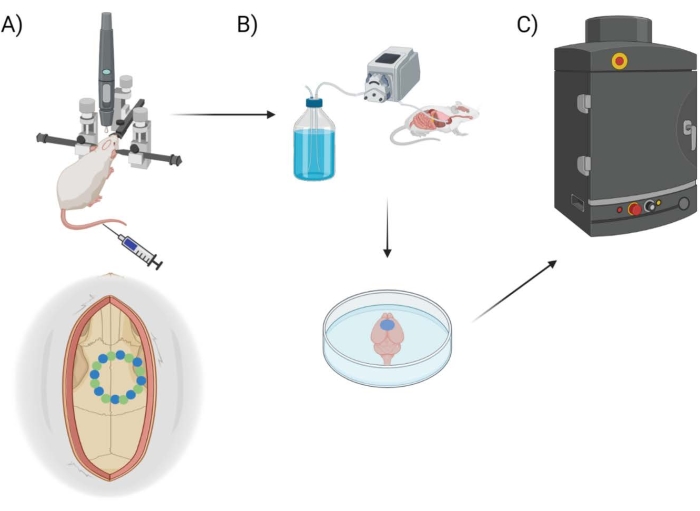
איור 1: סכמת צינור ניסיוני. הדגמה סכמטית של התהליך שבעלי חיים עברו לצורך כימות EB לאחר הליך חלון גולגולתי. (A) התקנה סכמטית של העכבר עם המסגרת הסטריאוטקסית ומקדח הרובוט הכירורגי. חלון גולגולתי לדוגמה מוצג מעל קליפת המוח המוטורית עם נקודות זרע (ירוק) ונקודות קצה (כחול). (B) מערך הזילוח כולל הזרקת 1x פוספט חוצץ מלוחים (PBS) ברחבי החיה כדי להסיר כל דם, ולאחר מכן מיצוי של המוח. (C) המוח מוכנס לאחר מכן לתא מערכת הדימות הפלואורסצנטי EB כדי לבצע הדמיה פלואורסצנטית על הצבע הכחול של אוונס. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הנהלים ונוהלי הטיפול בבעלי חיים נבדקו, אושרו ובוצעו בהתאם לוועדה המוסדית לטיפול ושימוש בבעלי חיים של המרכז הרפואי לואיס סטוקס קליבלנד.
1. הגדרת חומרת רובוט כירורגי
- לפני הניתוח, עקוב אחר המדריך לרובוט הכירורגי (ראה טבלת חומרים) ולמדריך להגדרת החומרה והתוכנה. בצע כיול מסגרות כמפורט במדריך. אם מקדחה או מסגרת זזים, מומלץ לכייל מחדש את המקדחה כדי להבטיח דיוק.
2. הכנת תוכנה
- נווט אל תוכנת הניתוח (ראה טבלת חומרים) וצור פרוייקט חדש על-ידי בחירה באפשרות התחל עם פרוייקט נקי. הגדר את הנושא כעכבר בחלק העליון כדי לייעד את קואורדינטות הקידוח שישמשו.
- בחר התחל פרוייקט חדש.
- מכאן, לחץ על תכנון בפינה השמאלית התחתונה כדי לנווט למסך תכנון קואורדינטות הקידוח. צור את סכימת הקידוח לביצוע טכניקת חלון הגולגולת.
- לשם כך, לחץ במקום כלשהו באטלס הסטריאוטקסי. השתמש בברגמה כהפניה, והזן את הקואורדינטות הבאות עבור קליפת המוח המוטורית: AP = 1.50, ML = 1.25, DV = 0.00. הקש Enter בלוח המקשים כדי לעדכן את הקואורדינטות שנבחרו.
הערה: הקואורדינטות הגב-גחוני (DV) מציינות את עומק הקידוח ולכן אינן זקוקות לקלט כאן. - לחץ על Store Target כדי לשמור קואורדינטות אלה ולהזין שם מתאים. מכאן, לחץ על כפתור הזז בפינה השמאלית התחתונה כדי לנווט חזרה למסך הקידוח הראשי.
- לשם כך, לחץ במקום כלשהו באטלס הסטריאוטקסי. השתמש בברגמה כהפניה, והזן את הקואורדינטות הבאות עבור קליפת המוח המוטורית: AP = 1.50, ML = 1.25, DV = 0.00. הקש Enter בלוח המקשים כדי לעדכן את הקואורדינטות שנבחרו.
- לחץ על כלים > Project > שמירה בשם כדי לעשות שימוש חוזר בפרוייקט תבנית זה עבור פרוייקטים עתידיים. פעולה זו תשמור באופן אוטומטי את קואורדינטות הקידוח לשימוש מאוחר יותר.
3. הכנה לניתוח
- הרדימו עכברי פריזמה30,31 (ראו טבלת חומרים) בתא איזופלורן (3.5% ב-1.5 ליטר/דקה O2). יש למרוח חומר סיכה לעיניים כדי למנוע התייבשות של העיניים, לגלח את הראש באמצעות קוצץ ולקצץ את הציפורניים כדי למנוע מהעכברים לגרד את התפרים.
הערה: עכברי PrismPlus הם סוג של מינים פלואורסצנטיים מהונדסים המשמשים בהדמיה מרובת פוטונים. עכברי PrismPlus ההטרוזיגוטיים חסרים את הגנים הפלואורסצנטיים ולכן שימשו כאן להפחתת פסולת בעלי חיים ממחקרים מתמשכים אחרים, ומכיוון שאין דימות מולטיפוטונים במחקר זה. עכברי בר צפויים להראות תוצאות דומות. - מתן זריקות תת עוריות של cefazolin אנטיביוטיקה (24 מ"ג / ק"ג), משכך כאבים carprofen (5 מ"ג / ק"ג), ו buprenorphine (0.05-0.10 מ"ג / ק"ג) לעכברים מורדמים. לפני כל חתך, יש לבצע זריקה תת-עורית אחת של מרקאין (0.25%, 100 μL) מתחת לאתר החתך (1 אינץ' לאורך קו האמצע של הגולגולת החל מאחורי העיניים).
הערה: התרופות המשמשות כאן עוקבות אחר פרוטוקולי IACUC שנקבעו בעבר. עם זאת, מומלץ לשקול קרם EMLA כהרדמה מקומית לאפקט רב-מודאלי לפני ניתוח והזרקת ורידים בזנב, כמו גם Meloxicam SR במקום קרפרופן. EMLA ו Meloxicam SR ניתן לספק לפני הרדמה isoflurane. - הרכיבו את בעל החיים על המסגרת הסטריאוטקסית של הרובוט הכירורגי, באמצעות מוטות אוזניים שסופקו, ושמרו על הרדמה עם איזופלורן 0.5%-2% באמצעות שאיפה דרך חרוט באף.
- ודא שעומק ההרדמה מנוטר מקרוב על ידי טכנאי וטרינר או צוות מיומן, בהתבסס על תגובת העכבר, הנשימה (~ 55-65 נשימות לדקה), קצב הלב (300-450 פעימות לדקה) והצבע (ורוד). שפם וצביטה רגילה של הבוהן יכולים לשמש גם כמדד לקביעת עומק ההרדמה. ערכי החיוניות נקבעים על פי תקנות IACUC מוסדיות.
- שמרו על טמפרטורת הגוף של בעלי החיים על משטח מים במחזור המים ונטרו את המדדים החיוניים באמצעות מערכת למדידת חמצן ודופק בדם.
- לקרצף את אזור הניתוח עם chlorhexidine gluconate (CHG) ו 70% isopropanol לעיקור. כדי לשמור על סטריליות במהלך הניתוח, הניחו ניילון נצמד סטרילי מעל העכבר והמסגרת הסטריאוטקסית.
הערה: בעוד פרוטוקולים אלה פותחו עבור ניתוחי הישרדות, הנתונים המוצגים משקפים את השימוש בבעלי חיים שאינם הישרדות, שכן המוקד היה לבדוק ולקבוע את שיטות פרוטוקול הקידוח המתאימות.
4. הכנת גולגולת
- באמצעות להב אזמל, לבצע חתך 1 אינץ 'על קו האמצע של הגולגולת, החל בחלק האחורי של העיניים.
- משוך את העור לאחור כדי לחשוף את הגולגולת ו(אופציונלי) השתמש במחזירים כדי לשמור על חלון הניתוח. הסר את שאריות הרקמה והקרום באמצעות אפליקטורים סטריליים עם קצוות כותנה.
- יש לייבש ולנקות את הגולגולת באמצעות 3% מי חמצן עם אפליקטורים בעלי קצוות כותנה.
הערה: פעולה זו תהפוך את התפרים של הגולגולת לגלויים. ברגמה ולמבדה צריכים להיראות בקלות. אם לא, יש למרוח יותר מי חמצן או להגדיל את גודל החתך. - אפשר פונקציונליות "עצירה אוטומטית" על ידי חיבור כבל תפס התנין ממערך הקידוח של הרובוט הכירורגי לעכבר, בהתאם להמלצות היצרן. "עצירה אוטומטית" פועלת על ידי זיהוי שינוי בעכבה, כך שברגע שהמקדח בא במגע עם נוזל מוחי שדרתי (CSF) במקום עצם, המקדחה תפסיק לקדוח, ובכך תמנע נזק למוח.
5. אוונס הזרקת ורידים זנב כחול
אזהרה: EB הוא מסרטן אפשרי. יש להשתמש בכפפות בעת הטיפול.
- כדי להכין את הזנב להזרקה קלה, נגבו עם מגבון אלכוהול. לחלופין, שמן wintergreen ניתן למרוח באופן מקומי כדי להרחיב את הווריד35.
- אחזו בזנב ביד אחת תוך כדי טיפול במזרק המכיל EB ביד השנייה. בעזרת האגודל והאצבע, כופפו את הזנב כדי לחשוף את וריד הזנב על גבי עיקול הזנב. הכנס את המזרק (1 או 2 מ"ל, מזרק אינסולין 30 גרם) במקביל לווריד והזריק לאט את נפח EB. EB (4% w/v) ניתן בריכוז של 2 מ"ל/ק"ג משקל גוף באמצעות הזרקת ורידי זנב.
הערה: ניתן לחוש התנגדות מינימלית עד אפסית לזרימה מהמזרק לתוך הזנב אם המחט מוחדרת כראוי. אם יש התנגדות או צבע EB מופיע בזנב, ואז לעבור למטה על הזנב ולנסות שוב. - לאחר ההזרקה, המתן 5 דקות כדי לאפשר ל- EB להסתובב ברחבי העכבר לפני תחילת הקידוח. הזרקה מוצלחת מאומתת באופן מיידי כאשר הגפיים של העכבר וחלון הניתוח הופכים כחולים.
6. הליך קידוח רובוט כירורגי
- לאחר הכנת הגולגולת לקידוח, נווט חזרה לתוכנת הניתוח. פתח את פרוייקט התבנית שהוגדר בשלב 2.4 שבו הוגדרו הקואורדינטות לקידוח.
- עקוב אחר כלים > Project > New > בחר פרוייקט תבנית ובחר את פרוייקט התבנית שהוגדר בשלב 2 (הכנת תוכנה).
- בחר רכיבי פרוטוקול זהים > תכנון (נקודות יעד) > פרמטרי קידוח כדי להעביר לפרוייקט חדש זה.
- לחץ על התחל פרוייקט חדש.
- לאחר מכן, תקן את המקדחה ואת המסגרת כדי להסביר את ההטיה ואת קנה המידה של גולגולת העכבר של החיה הנוכחית. לחץ על כלים ובחר תקן להטיה ושינוי קנה מידה... כדי לפתוח את מסך התיקון. בחלק העליון של המסך, ודא שהמקדחה פעילה (לא המזרק), על ידי לחיצה על כפתור המקדחה בצבע אדום בהיר.
הערה: לאחר ההפעלה, לחצן המקדחה יהפוך לאדום כהה/בוהק. ניתן להתעלם מכפתור המזרק, מכיוון שאינו משמש בפרוטוקול זה.- ראשית, תקן את קנה המידה, הגובה והפיהוק על ידי הגדרת המיקום של ברגמה ולמבדה על החיה הנוכחית. השתמש בפקדי לוח המקשים או בפקדים שעל המסך כדי להזיז את המקדחה. ברגע שהמקדח ממוקם מעל ברגמה, הנמיכו אותו עד שהוא רק נוגע בגולגולת ולחצו על Set Bregma. חזור על כך עבור Lambda.
- לאחר מכן, להתאים עבור גליל ספציפי של הגולגולת. לחץ על כפתור Go to Midpoint כדי להתאים את המקדח באופן אוטומטי למרכז הגולגולת. לחץ על 2 מ"מ שמאלה ולאחר מכן הנמיך לאט את המקדחה עד למגע בגולגולת. לחץ על הגדר נקודה שמאלית.
- חזור על שלב 6.2.2 עבור הצד הימני של המוח. כעת המערכת מוגדרת עבור הגולגולת הספציפית הזו.
הערה: התיקון כאן הוא קריטי כדי להבטיח קואורדינטות קידוח ועומק נאותים. העכבר צריך להיות מותקן קרוב ככל האפשר ישר כדי להפחית את הצורך תיקון ככל האפשר. אם יש צורך בתיקונים גדולים, הדבר עלול לגרום לדיוק ירוד של הקידוח.
- לאחר ביצוע התיקון, צא מחלון התיקון על-ידי לחיצה על קרוב באמצע התחתון של המסך. נווט אל מסך הקידוח על-ידי לחיצה על כלים ולאחר מכן בחירה מקדחה... כדי להתחיל את הליך הקידוח.
- ודא שהאפשרות Craniotomy-Shape נבחרה מהתפריט הנפתח Drill בחלק העליון של המסך. לאחר מכן, לחץ על בחר מרכז וצורה של מקדחה ובחר את היעד המוגדר מראש שקיבל את שמו בשלב 2.3.1. תחת מסך זה, בחר עיגול כצורה עבור המטרה והזן 2.60 מ"מ כקוטר2 של המעגל. לחץ על הצג.
הערה: קוטר חלון הגולגולת נוצר באמצעות מרכז המקדח כמרכז נקודות הזרע. מקדח קטן (קוטר = 0.6 מ"מ או גודל הסיביות המומלץ שסופק על ידי הספק) משמש כדי למזער את הקוטר הנוסף שנוסף כתוצאה משימוש בסיבית מקדחה גדולה יותר. מקדחות מיוחדות משמשות במיוחד עבור הרובוט הכירורגי. שמונה נקודות הזרע ונקודות הקצה יופיעו כעת על הגולגולת כנקודות ירוקות וכחולות, בהתאמה. - לחץ על החלון הראשי והשתמש בקיצור המקשים Control + Shift + D כדי להעלות את תפריט נקודות הסתעפות בצד ימין של המסך. הדבר מאפשר להציג עומקים ומצבים ספציפיים של נקודות קידוח.
- לפני תחילת ההסתעפות, התאם אישית את תכונת העצירה האוטומטית במידת הצורך על-ידי לחיצה על הלחצן לצד תיבת הסימון עצירה אוטומטית. לחצן זה מוגדר כברירת מחדל כבינוני, המתאים לרגישות של תכונת העצירה האוטומטית.
הערה: ניתן לבדוק זאת מראש כדי למצוא את הרגישות המתאימה לבעלי החיים. בפרוטוקול זה, נעשה שימוש ברגישות הגבוהה ביותר כדי להבטיח קידוח מינימלי במוח. - לאחר הפעלת תכונת העצירה האוטומטית והתאמה אישית, התחל בקידוח נקודת הזרע. לחץ על סריקה אוטומטית כדי שהמקדחה תתחיל באופן אוטומטי ב- Seed 1. ברגע שהמקדח נוגע ב-CSF, תכונת העצירה האוטומטית תזהה שינוי בעכבה, מה שיוביל לעצירה בקידוח ולנסיגה של הסיבית מהגולגולת.
- עקוב מקרוב אחר הקידוח למקרה שהעצירה האוטומטית לא תבחין בשינויים כלשהם. ניתן ללחוץ על מקש Escape כדי לבטל את הקידוח באופן ידני. ניתן גם ללחוץ על העיגול הוורוד הממוקם בתחתית התפריט 'מקדחה' ומימין לערכי העכבה כדי להתחיל או להפסיק את הקידוח.
הערה: המקדח יקדח באופן אוטומטי לעומק השווה לעובי הגולגולת המשוער (או עד להפעלת תכונת העצירה האוטומטית). - אם עצירה אוטומטית אינה מופעלת לפני ההגעה לעומק המשוער, יופיע מסך שיבקש מהמשתמש: 1) להמשיך לקדוח ולרדת # מ"מ נוסף, 2) לסמן בעומק הנוכחי ולהמשיך, 3) לדלג על הנקודה הנוכחית ולהמשיך, או 4) לעצור את התהליך (ניתן להמשיך מאוחר יותר). בחר אחת מהאפשרויות כמתואר להלן.
- להמשך קידוח וירידה # מ"מ נוספים, הזן מרחק כדי שהמקדח יתקדם. כברירת מחדל, נעשה שימוש ב- 0.1 מ"מ. ניתן להציע מרחק קטן יותר כדי למנוע חדירה מקרית של המוח.
- אם אתם מאמינים שהדורה הושגה במסך זה, בחרו באפשרות סימון בעומק הנוכחי והמשיכו עבור המערכת כדי לסמן את הדורה בעומק זה ולעבור לזרע הבא.
- השתמש בלחצן דלג על הנקודה הנוכחית והמשך ועצור את התהליך (ייתכן שיימשך מאוחר יותר) כדי לפתור בעיות או לנקות את המקדח ולחזור ברגע שהעצירה האוטומטית תפעל שוב.
- לאחר שכל נקודות הזרע נקדחו, אם לא סיימו להשתמש בתכונת העצירה האוטומטית, בדוק את עומק החור באופן ידני באמצעות פיק דורה. זה יבטיח שהעומק שנקדח אכן חדר דרך הגולגולת.
- לפני תחילת הקידוח בנקודת הקצה, החלט איזה סוג של 'חיתוך קצה' רצוי על-ידי בחירת התפריט הנפתח לצד הטקסט ' גזירת קצה' בתפריט 'קידוח'. שתי האפשרויות הן ' נקודה אחר נקודה ' ו'אופקית'.
- בחרו ' נקודה אחר נקודה' כדי לקדוח כל נקודת קצה בנפרד ולעומק שנקבע לפי עומק נקודות הזרעים הסמוכות. התאם את קנה המידה במידת הצורך באמצעות לחצן שינוי קנה מידה של שוליים... להלן, אם כי ברירת המחדל של ללא שינוי קנה מידה בדרך כלל מספיקה.
- בחר אופקי כדי להתחיל בקידוח בנקודת קצה 1 והשתמש בתנועת קידוח רציפה כדי להקיף את כל היקף מעגל הקידוח. כברירת מחדל, החיתוך האופקי יחתוך במרווחים של 100 מיקרומטר, ויעקף את היקף החלון לפני שיתקדם עוד 100 מיקרומטר עמוק יותר. במידת הצורך, שנה את עומק המרווח ואת מהירות הקידוח תחת לחצן אפשרויות גזירה ... להלן.
- השתמשו בהסטת החיתוך האוטומטי (מתחת לתיבה 'חיתוך קצוות') כדי להתאים לעומק החיתוך האוטומטי באמצעות הסטה שנקבעה מראש מנקודות הזרעים הסמוכות. בפרוטוקול זה נעשה שימוש בקיזוז חיתוך אוטומטי של 20 מיקרומטר. ניתן לבצע בדיקות נוספות כדי לקבוע קיזוז אופטימלי על בסיס לכל בעל חיים.
- לאחר קביעת הגדרות חיתוך הקצה, התחילו בקידוח נקודת קצה בלחיצה על הלחצן ' חיתוך אוטומטי ' במרכז התפריט 'קידוח'. עבור קידוח נקודה אחר נקודה, לאחר שנקדח הקצה האחרון, הליך הקידוח הסתיים. לקידוח אופקי, המשיכו עד שנקדחה מספיק גולגולת כדי לשחרר את חלון הגולגולת.
הערה: למרות שהקידוח מתבצע עד שניתן לשחרר את החלון, החלון אינו משוחרר כאן פיזית כדי למנוע נזק לרקמה הבסיסית. חשוב לבודד את הנזק כתוצאה מקידוח בלבד כדי להעריך סכמות קידוח שונות.- לאחר שהקידוח האופקי הגיע לעומק של נקודת זרע אחת, לחץ לחיצה ימנית על זרע זה (או בחר תחילה מספר נקודות) בתפריט נקודות קידוח ולחץ על נעל עומק. זה יאפשר חיתוך אופקי להמשיך מבלי לחתוך עמוק יותר עבור אותו אזור (ובכך למנוע חדירה למוח).
הערה: אם יש נקודות זרע עם עומקי דורה שונים, הדבר עלול לגרום להבדלים בעומק הדרוש להליך הקידוח האופקי.
- לאחר שהקידוח האופקי הגיע לעומק של נקודת זרע אחת, לחץ לחיצה ימנית על זרע זה (או בחר תחילה מספר נקודות) בתפריט נקודות קידוח ולחץ על נעל עומק. זה יאפשר חיתוך אופקי להמשיך מבלי לחתוך עמוק יותר עבור אותו אזור (ובכך למנוע חדירה למוח).
- אם תכונת העצירה האוטומטית אינה פועלת כראוי, ודא שהמקדח נקי לחלוטין מכל פסולת או דם פוטנציאלי, מלוחים וכו ', מכיוון שאלו עלולים להשפיע על עכבת הבסיס של הביט. בנוסף, בחר אחת ממספר אפשרויות הקידוח הידניות המתוארות להלן למקרה שהעצירה האוטומטית אינה פועלת באופן עקבי.
- בתפריט Drill, נווט ידנית לכל זרע על-ידי לחיצה ימנית על הזרע או הקצה ובחירה באפשרות Go to Entry. ישנן גם אפשרויות לנקות את העומקים המסומנים, לאפס את החור ואפשרויות נוספות שיכולות לסייע בהליך הקידוח.
- שלוט באופן ידני בהתקדמות עומק התרגיל על-ידי בחירת עומק מהתפריט הנפתח הממוקם לצד הטקסט מתקדם: בסמוך לחלק העליון של תפריט התרגיל. לחץ על הלחצן Advance ישירות למטה כדי לקדם את התרגיל למרחק שנקבע.
הערה: ניתן להשתמש בתכונה זו בשילוב עם הלחצנים Set Dura ו-Set Surface מתחת ללחצן Advance כדי לומר למערכת באופן ידני היכן נמצאים פני השטח של הגולגולת והדורה. השתמש בפונקציית העצירה האוטומטית במידת האפשר, אך במידת הצורך גם אפשרויות ידניות אלה מספיקות. - אם הקידוח מתבצע באופן ידני, יש לנקוט משנה זהירות בין כל מרווח עומק קידוח כדי להבטיח שהמקדח לא יחרוג מהדורה. בדוק את החור שנקדח באמצעות פיק דורה בין מרווחי עומק כדי לוודא אם הדורה הגיעה. לאחר סיום כל קידוח הזרעים הידני, המשך בהליך חיתוך הקצה כרגיל כמתואר לעיל.
- שיטת פולס
- כדי לבצע קידוח פולס ידני, כבה את תכונת העצירה האוטומטית על-ידי ביטול הסימון בתיבת הסימון לצד האפשרות עצירה אוטומטית בתפריט Drill. זה חייב להיות כבוי על מנת לאפשר שליטה כאשר המקדח כבוי לפעימה.
הערה: קידוח פולס עוקב אחר תבנית של 2 שניות של קידוח ואחריו 2 שניות ללא קידוח כדי לאפשר לגולגולת להתקרר. - בתפריט מקדחה, בחר 100 מיקרומטר כהתקדמות עומק הקידוח, זה יהיה שווה ~ 2 שניות של קידוח כלפי מטה.
- ברגע שאתה מוכן, לחץ על התקדמות כדי להתחיל בקידוח.
הערה: היו מוכנים לעצור במהירות את המקדחה ברגע שהיא התקדמה ב-100 מיקרומטר, מכיוון שהמקדח ממשיך להסתובב בעומק עד ללחיצה על המילוט (יצירת חום מיותר). - לאחר שהמקדחה התקדמה ב-100 מיקרומטר, לחץ פעמיים על Escape כדי לעצור את המקדחה. לאחר 2 שניות, חזור על מחזור זה עבור עומק הגולגולת.
הערה: רק שיטת נקודה אחר נקודה יכולה להתבצע בשיטת פולסים עקב אילוצי תוכנה ואילוצים מכניים. לא ניתן לבצע קידוח אופקי רציף בדרך זו. - קדח את כל נקודות הזרעים והקצה בשיטה זו המפורטת לעיל. הקפד להגדיר את Dura באמצעות הלחצן בתפריט Drill לאחר שתגיע לדורה.
- כדי לבצע קידוח פולס ידני, כבה את תכונת העצירה האוטומטית על-ידי ביטול הסימון בתיבת הסימון לצד האפשרות עצירה אוטומטית בתפריט Drill. זה חייב להיות כבוי על מנת לאפשר שליטה כאשר המקדח כבוי לפעימה.
- ודא שהאפשרות Craniotomy-Shape נבחרה מהתפריט הנפתח Drill בחלק העליון של המסך. לאחר מכן, לחץ על בחר מרכז וצורה של מקדחה ובחר את היעד המוגדר מראש שקיבל את שמו בשלב 2.3.1. תחת מסך זה, בחר עיגול כצורה עבור המטרה והזן 2.60 מ"מ כקוטר2 של המעגל. לחץ על הצג.
7. זילוח ומיצוי המוח
- לאחר סיום הקידוח של נקודות הזרע והקצה, שמור את בעל החיים תחת הרדמה איזופלורנית למשך שעה נוספת כדי לאפשר לצבע EB לזרום ולזרום דרך BBB הפגוע. בצע זילוח לב כדי להסיר דם או נוזלים מן כלי הדם, ולאחר מכן להסיר את המוח עבור הדמיה וניתוח כמתואר להלן.
- לאחר תקופת מחזור של 1 שעות EB לאחר יצירת חלון הגולגולת, הזריקו קוקטייל של קטמין (160 מ"ג / ק"ג) וקסילזין (20 מ"ג / ק"ג) תוך צפקית לתוך החיה. לאחר שאינו מגיב, בצע זילוח לב.
- לפתוח את הבטן של העכבר באמצעות מספריים ולחשוף את הלב על ידי חיתוך אנכי דרך כלוב הצלעות אופקית על פני הסרעפת. משוך את כלוב הצלעות כדי לראות את הלב בבירור. הכנס מחט פרפר לחדר השמאלי של הלב והתחל להחדיר 1x פוספט buffered מלוחים (PBS) בכל הגוף. חתכו חלק קטן מהאטריום הימני של הלב כדי לשחרר לחץ שהצטבר.
- לאחר 25 מ"ל של 1x PBS יש מחורר בכל הגוף, לעצור את הזילוח ולערוף את העכבר כאמצעי משני של המתת חסד.
הערה: הקפד לבצע את השיטה שאושרה במוסדות של המתת חסד ו / או זילוח נקודות קצה עבור בעל החיים כדי לבודד את המוח. - מכאן, לחלץ את המוח מן הגולגולת על ידי הסרת העצם והרקמה עם rongeurs.
- דמיינו את המוח שחולץ באמצעות מערכת דימות פלואורסצנטית כדי לצפות בכמות EB הממוקמת במוח סביב אתרי הקידוח.
הערה: EB נקשר לאלבומין במחזור. אם מתרחש נזק לכלי הדם במוח, EB ידלוף החוצה וייקשר לרקמת המוח, מה שיוביל לאינדיקטור חזותי ברור של נזק.
8. אוונס בלו הדמיה וניתוח
- אתחול חומרה
- הפעל את המחשב המחובר למערכת הדמיה פלואורסצנטית EB והפעל את תוכנת ההדמיה (ראה טבלת חומרים) בזמן הכנת פריטים אחרים. הפעל את מקור האור, הפלטפורמה והמצלמה, בסדר הזה.
- נווט אל תוכנת ההדמיה ולחץ על Initialize תחת לוח הבקרה של הרכישה. המערכת והחדר יאותת מאדום לירוק ברגע שהאתחול יושלם.
הערה: אתחל את מערכת ההדמיה הפלואורסצנטית EB 30 דקות לפני כל הדמיה כדי לאפשר לטמפרטורה של מקור האור להגיע לרמות מיטביות.
- הדמיה של המוח
- הניחו את המוח הנטוע בצלחת שקופה במרכז הבמה לצורך הדמיה.
- תחת לוח הבקרה של הרכישה, התאם את הגדרות התמונה. בחר את זמן החשיפה: 1 שניות; Binning: בינוני; F/עצירה: F1; עירור: 535 עד 675 ננומטר; פליטה: Cy 5.5; מפלס המנורה: גבוה; ו-FOV: 5 ס"מ. השאירו את הפילטר נעול ואת שכבת העל של הצילום והפלואורסצנטיות מסומנת. הגדרות אלה מבוססות על ניסיון מעבדה קודם ושיטות אחרות שפורסמו של הדמיה EB36.
- טען תמונות של מערכת הדמיה פלואורסצנטית EB לתוכנת עיבוד תמונה בגישה פתוחה (ראה רשימת חומרים) וצור שלושה אזורי עניין ביד חופשית (ROIs) כדי למצוא את עוצמת הפלואורסצנט של EB על ידי מדידת הקרינה הממוצעת על הרקע, המוח כולו וחלון הגולגולת.
- נרמל את חלון הגולגולת ואת מדידות המוח כולו כנגד החזר ההשקעה המתאים ברקע.
- דמיינו כל מוח תחת מסנני עירור שונים (535-675 ננומטר) כדי למצוא את אורך הגל עם יחס האות לרעש הגבוה ביותר (נבחר 605 ננומטר) בין קבוצות הניסוי לבקרת המלח.
- בודד את הקרינה הממוצעת תחת אורך הגל והממוצע המתאימים כדי לקבל את הקרינה הממוצעת או עוצמת הפלואורסצנט הממוצעת עבור כל החזר ההשקעה על המוח וחלון הגולגולת.
- מצא ונרמל את הקרינה הממוצעת הממוצעת על שטח חלון הגולגולת עבור כל קבוצה כנגד בקרת המלח.
9. הערכת זוג תרמי
- מדדו את השינויים בטמפרטורה של הגולגולת והמוח באמצעות זוג תרמי (ראו טבלת חומרים) בשילוב עם שלוש סכימות הקידוח השונות. הזוג התרמי מחובר למערכת איסוף נתונים (DAQ) המאפשרת לקרוא את המדידה לתוך MATLAB.
- הרכיבו עכבר גופה על המסגרת הסטריאוטקסית ועל מערך המקדחה הרובוטי. קדח ידנית חור קטן (באותו גודל כמו נקודת זרע) ~ 2 מ"מ מהמקום שבו חלון הגולגולת ייעשה לצד הגולגולת25. החור הזה יאפשר לזוג התרמי להחליק למקומו מתחת למקום שבו מתרחש הקידוח של חלון הגולגולת (איור 2D).
הערה: עכברי Cadaver משמשים מכיוון שקידוח פתיחת צד הגולגולת נדרש כדי להחליק את הזוג התרמי מעל אזור קידוח חלון הגולגולת. עכבר גופה זה הוא חיה שונה מזו ששימשה בעבר לניתוח אוונס בלו. - התחל את תהליך הקידוח עבור כל אחת משלוש התוכניות כפי שנעשה קודם לכן (שלב 6). כאשר המקדח עובר דרך הגולגולת, יהיו קפיצות בשינוי הטמפרטורה, המצביע על חימום המתרחש ליד המוח.
- הקליטו והתוו את התוצאות ב-MATLAB כדי לחשב את הפרש הטמפרטורה המרבי. יש לעשות זאת בנפרד עבור קידוח הזרעים וקידוח הקצה כדי להעריך קידוח אופקי לעומת קידוח נקודה אחר נקודה יחד עם שיטת הקידוח הידנית הפועמת.
10. סטטיסטיקה
- בצע ניתוח סטטיסטי עבור הדמיה פלואורסצנטית של זוג תרמי ו- EB ב- R באמצעות מבחן סכום דירוג קרוסקל-וואליס עם תיקון בנימיני-הוכברג ואחריו השוואות זוגיות באמצעות מבחן סכום הדירוג המדויק של Wilcoxon25.
Access restricted. Please log in or start a trial to view this content.
תוצאות
הערכה תרמית
פוטנציאל לנזק תרמי הוערך על-ידי מדידת השינוי בטמפרטורה מנקודת ההתחלה כתוצאה מקידוח בשיטות אופקיות (איור 2A), נקודה אחר נקודה (איור 2B) ופעימות נקודה אחר נקודה (איור 2C). איור 2D מציג את מערך הניסוי לקבלת נתו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
השימוש בצבע EB והדמיה הוא פשוט, מהיר ושימושי להערכת נזק לכלי הדם במוח עבור שיטות וטכניקות חדשות. בין אם באמצעות רובוט כירורגי ובין אם מדובר בשיטות אישור הנעשות כיום במעבדה, חשוב לתקף שיטות כירורגיות כדי לבודד את ההשפעות של טיפולים ניסיוניים לעומת השפעה כירורגית ולשפר את רווחת בעלי החיים. ה?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי עניינים לדווח עליהם. התוכן אינו מייצג את הדעות של המחלקה לענייני חיילים משוחררים של ארה"ב, המכונים הלאומיים לבריאות או ממשלת ארצות הברית.
Acknowledgements
מחקר זה נתמך בחלקו על ידי Merit Review Awards GRANT12418820 (Capadona) ו- GRANTI01RX003420 (Shoffstall/Capadona), ופרס מדען קריירת מחקר # GRANT12635707 (קפדונה) משירות המחקר והפיתוח השיקומי של המחלקה לענייני חיילים משוחררים בארצות הברית (ארה"ב). בנוסף, עבודה זו נתמכה בחלקה גם על ידי המכון הלאומי לבריאות, המכון הלאומי להפרעות נוירולוגיות ושבץ מוחי GRANT12635723 (קפדונה), והמכון הלאומי לדימות ביו-רפואי וביו-הנדסה, T32EB004314, (קפדונה / קירש). חומר זה מבוסס על עבודה הנתמכת על ידי מלגת המחקר לתארים מתקדמים של הקרן הלאומית למדע במסגרת מענק מס' GRANT12635723. כל דעה, ממצאים, מסקנות או המלצות המובעות בחומר זה הן של המחברים/ות ואינן משקפות בהכרח את השקפותיה של הקרן הלאומית למדע.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1x Phosphate Buffered Saline Type: Reagent | VWR | MRGF-6235 | For Evans Blue dilution |
| Aura Software Type: Tool | Spectral Instruments Imaging | Open access imaging processing software for Lumina imaging sytems | |
| Buprenorphine Type: Drug | Sourced from Animal Facility | ||
| Carbide Drill Bit, 0.6mm (Robot Drill) Type: Tool | Stoelting | 58640-1 | |
| Carprofen Type: Drug | Sourced from Animal Facility | ||
| Cefazolin Type: Drug | Sourced from Animal Facility | ||
| Evans Blue Dye Type: Reagent | Millipore Sigma | E2129 | Reconstituted in 1x phosphate-buffered saline |
| Isoflurane Type: Drug | Sourced from Animal Facility | ||
| IVIS Lumina II Type: Tool | Perkin Elmer | CLS136334 | IVIS Lumina III currently in place of Lumina II on the market |
| Jenco Linearizing Thermometer Type: Tool | Jenco | 765JF | For Thermocouple setup |
| Ketamine Type: Drug | Sourced from Animal Facility | ||
| LivingImage Type: Tool | Perkin Elmer | Software for IVIS Lumina III | |
| Marcaine Type: Drug | Sourced from Animal Facility | ||
| Neurostar Software Type: Tool | Stoelting | Comes with surgical robot purchase | |
| Physiosuite with MouseSTAT® Pulse Oximeter & Heart Rate Monitor Type: Tool | Kent Scientific | PS-03 | Used to monitor vitals |
| PrismPlus mice Type: Animal | Jackson Labortory | 031478, RRID:IMSR_JAX:031478, Male, ~8 months old | Animals used for the study |
| Stoelting Drill and Injection Robot for Motorized Stereotaxic Instruments Type: Tool | Stoelting | 58640 | Main robotic drill with stereotaxic frame |
| Thermocouple Type: Tool | TC Direct | 206-557 | For Thermocouple setup |
| USB-6008 Multifunction I/O DAQ Type: Tool | National Instruments | USB-6008 | For Thermocouple setup |
| Xylazine Type: Drug | Sourced from Animal Facility |
References
- Kilic, K., et al. Chronic cranial windows for long term multimodal neurovascular imaging in mice. Frontiers in Physiology. 11, 612678(2020).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nature Protocols. 9 (11), 2515-2538 (2014).
- Augustinaite, S., Kuhn, B. Intrinsic optical signal imaging and targeted injections through a chronic cranial window of a head-fixed mouse. STAR Protocols. 2 (3), 100779(2021).
- Wang, X., et al. A skull-removed chronic cranial window for ultrasound and photoacoustic imaging of the rodent brain. Frontiers in Neuroscience. 15, 673740(2021).
- Wang, Y., Xi, L. Chronic cranial window for photoacoustic imaging: a mini review. Visual Computing for Industry, Biomedicine, and Art. 4 (1), 15(2021).
- Augustinaite, S., Kuhn, B. Chronic cranial window for imaging cortical activity in head-fixed mice. STAR Protocols. 1 (3), 100194(2020).
- Kunori, N., Takashima, I. An implantable cranial window using a collagen membrane for chronic voltage-sensitive dye imaging. Micromachines. 10 (11), 789(2019).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomedical Optics Express. 10 (10), 5235-5250 (2019).
- Heo, C., et al. A soft, transparent, freely accessible cranial window for chronic imaging and electrophysiology. Scientific Reports. 6, 27818(2016).
- Holtmaat, A., et al. Imaging neocortical neurons through a chronic cranial window. Cold Spring Harbor Protocols. 2012 (6), 694-701 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Sundaram, G. S., et al. Characterization of a brain permeant fluorescent molecule and visualization of Abeta parenchymal plaques, using real-time multiphoton imaging in transgenic mice. Organic Letters. 16 (14), 3640-3643 (2014).
- Spires, T. L., et al. Dendritic spine abnormalities in amyloid precursor protein transgenic mice demonstrated by gene transfer and intravital multiphoton microscopy. Journal of Neuroscience. 25 (31), 7278-7287 (2005).
- Price, D. L., et al. High-resolution large-scale mosaic imaging using multiphoton microscopy to characterize transgenic mouse models of human neurological disorders. Neuroinformatics. 4 (1), 65-80 (2006).
- Kimchi, E. Y., Kajdasz, S., Bacskai, B. J., Hyman, B. T. Analysis of cerebral amyloid angiopathy in a transgenic mouse model of Alzheimer disease using in vivo multiphoton microscopy. Journal of Neuropathology and Experimental Neurology. 60 (3), 274-279 (2001).
- Hyman, B. T. The natural history of Alzheimer disease dissected through multiphoton imaging of transgenic mice. Alzheimer Disease and Associated Disorders. 20 (4), 206-209 (2006).
- Korzhova, V., et al. Long-term dynamics of aberrant neuronal activity in awake Alzheimer's disease transgenic mice. Communications Biology. 4 (1), 1368(2021).
- Chawda, C., McMorrow, R., Gaspar, N., Zambito, G., Mezzanotte, L. Monitoring immune cell function through optical imaging: a review highlighting transgenic mouse models. Molecular Imaging and Biology. 24 (2), 250-263 (2022).
- Courtin, J., et al. A neuronal mechanism for motivational control of behavior. Science. 375 (6576), (2022).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. Journal of Visualized Experiments. (12), e680(2008).
- Cramer, S. W., et al. Through the looking glass: A review of cranial window technology for optical access to the brain. Journal of Neuroscience Methods. 354, 109100(2021).
- Eles, J. R., Vazquez, A. L., Kozai, T. D. Y., Cui, X. T. Meningeal inflammatory response and fibrous tissue remodeling around intracortical implants: An in vivo two-photon imaging study. Biomaterials. 195, 111-123 (2019).
- Jorfi, M., Skousen, J. L., Weder, C., Capadona, J. R. Progress towards biocompatible intracortical microelectrodes for neural interfacing applications. Journal of Neural Engineering. 12 (1), 011001(2015).
- Cole, J. T., et al. Craniotomy: true sham for traumatic brain injury, or a sham of a sham. Journal of Neurotrauma. 28 (3), 359-369 (2011).
- Shoffstall, A. J., et al. Potential for thermal damage to the blood-brain barrier during craniotomy: implications for intracortical recording microelectrodes. Journal of Neural Engineering. 15 (3), 034001(2018).
- Saunders, N. R., Dziegielewska, K. M., Mollgard, K., Habgood, M. D. Markers for blood-brain barrier integrity: how appropriate is Evans blue in the twenty-first century and what are the alternatives. Frontiers in Neuroscience. 9, 385(2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Scientific Reports. 4, 6588(2014).
- Goss-Varley, M., et al. Microelectrode implantation in motor cortex causes fine motor deficit: Implications on potential considerations to Brain Computer Interfacing and Human Augmentation. Scientific Reports. 7 (1), 15254(2017).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007(2021).
- Dougherty, J. D., Zhang, J., Feng, H., Gong, S., Heintz, N. Mouse transgenesis in a single locus with independent regulation for multiple fluorophores. PLoS One. 7 (7), 40511(2012).
- Jung, S., et al. Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion. Molecular and Cellular Biology. 20 (3), 4106-4114 (2000).
- Kiyatkin, E. A., Sharma, H. S. Permeability of the blood-brain barrier depends on brain temperature. Neuroscience. 161 (3), 926-939 (2009).
- Eriksson, A. R., Albrektsson, T. Temperature threshold levels for heat-induced bone tissue injury: a vital-microscopic study in the rabbit. The Journal of Prosthetic Dentistry. 50 (1), 101-107 (1983).
- Bonfield, W., Li, C. H. The temperature dependence of the deformation of bone. Journal of Biomechanics. 1 (4), 323-329 (1968).
- Hrapkiewicz, K., Medina, L. Clinical Laboratory Animal Medicine, second ed. , Blackwell Publishing. Ames Iowa. (2007).
- McLean, R., Moritz, A. R., Roos, A. Studies of thermal Injury. VI. Hyperpotassemia caused by cutaneous exposure to excessive heat. Journal of Clinical Investigations. 26 (3), 497-504 (1947).
- Kyweriga, M., Sun, J., Wang, S., Kline, R., Mohajerani, M. H. A large lateral craniotomy procedure for mesoscale wide-field optical imaging of brain activity. Journal of Visualized Experiments. (123), e52642(2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved