A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس انضغاط الخلية والنواة على أساس المجهر الصوتي
In This Article
Summary
هنا يتم تقديم بروتوكول لبناء نظام سريع وغير مدمر لقياس انضغاط الخلية أو النواة على أساس microdevice المائع الصوتي. تم التحقيق في التغيرات في الخواص الميكانيكية للخلايا السرطانية بعد الانتقال الظهاري الوسيط أو الإشعاع المؤين ، مما يدل على احتمال تطبيق هذه الطريقة في البحث العلمي والممارسة السريرية.
Abstract
تلعب ميكانيكا الخلايا دورا مهما في ورم خبيث في ورم خبيث للخلايا والحساسية الإشعاعية. خلال هذه العمليات ، غالبا ما تكون دراسة الخواص الميكانيكية للخلايا صعبة. طرق القياس التقليدية القائمة على التلامس مثل الضغط أو التمدد عرضة للتسبب في تلف الخلايا ، مما يؤثر على دقة القياس وزراعة الخلايا اللاحقة. يمكن أن تؤثر القياسات في حالة الالتصاق أيضا على الدقة ، خاصة بعد التشعيع لأن الإشعاع المؤين سوف يسطيح الخلايا ويعزز الالتصاق. هنا ، تم تطوير نظام قياس ميكانيكا الخلايا على أساس طريقة الموائع الصوتية. يمكن الحصول على انضغاط الخلية عن طريق تسجيل مسار حركة الخلية تحت تأثير القوة الصوتية ، والتي يمكنها تحقيق قياس سريع وغير مدمر في الحالة المعلقة. تقدم هذه الورقة تقريرا مفصلا عن بروتوكولات تصميم الرقاقة وإعداد العينات وتسجيل المسار واستخراج المعلمات وتحليلها. تم قياس انضغاط أنواع مختلفة من الخلايا السرطانية بناء على هذه الطريقة. كما تم قياس انضغاط النواة عن طريق ضبط تردد الرنين للسيراميك الكهرضغطي وعرض القناة الدقيقة. جنبا إلى جنب مع التحقق من المستوى الجزيئي لتجارب التألق المناعي ، تمت مقارنة انضغاط الخلايا قبل وبعد الانتقال الظهاري الناجم عن الدواء إلى الانتقال الوسيط (EMT). علاوة على ذلك ، تم الكشف عن تغيير انضغاط الخلايا بعد تشعيع الأشعة السينية بجرعات مختلفة. طريقة قياس ميكانيكا الخلايا المقترحة في هذه الورقة عالمية ومرنة ولها آفاق تطبيق واسعة في البحث العلمي والممارسة السريرية.
Introduction
تلعب الخواص الميكانيكية للخلايا دورا مهما في ورم خبيث في ورم خبيث للخلايا والحساسية الإشعاعية 1,2. للحصول على فهم متعمق لدور الخواص الميكانيكية للخلية في العملية المذكورة أعلاه ، يعد القياس الدقيق للميكانيكا الخلوية أمرا بالغ الأهمية ، ويجب ألا يتسبب القياس في تلف الخلايا للزراعة والتحليل اللاحقين. يجب أن تكون عملية القياس في أسرع وقت ممكن ، وإلا فقد تتأثر صلاحية الخلية إذا تمت إزالة الخلايا من بيئة الزراعة لفترة طويلة.
تواجه طرق قياس ميكانيكا الخلايا الحالية بعض القيود. بعض الطرق ، مثل قياس الخلايا الملتوية المغناطيسي ، والملقط المغناطيسي ، وعلم الميكروريولوجيا لتتبع الجسيمات ، تسبب تلف الخلايا بسبب إدخال الجسيمات في الخلايا3،4،5. الطرق التي تقيس عن طريق الاتصال بالخلايا ، مثل مجهر القوة الذرية (AFM) ، وشفط الماصة الدقيقة ، والانقباض الدقيق ، وتقنية اللوحة المتوازية ، هي أيضا عرضة لتلف الخلايا ومن الصعب زيادة الإنتاجية6،7،8. بالإضافة إلى ذلك ، فإن الإشعاع المؤين سوف يسطيح الخلايا ويزيد من التصاقها9 ؛ لذلك من الضروري قياس ميكانيكا الخلايا بأكملها في التعليق.
استجابة للتحديات المذكورة أعلاه ، تم تطوير نظام قياس ميكانيكا الخلايا على أساس طريقة الموائع الصوتية10،11،12،13،14. يتطابق عرض القناة مع نصف الطول الموجي الصوتي ، مما يخلق عقدة موجة دائمة عند خط الوسط للقناة الدقيقة. تحت تأثير قوة الإشعاع الصوتي ، يمكن للخلايا أو الخرز القياسي الانتقال إلى عقدة الضغط الصوتي. نظرا لأن الخصائص الفيزيائية للخرز القياسي (الحجم والكثافة وقابلية الانضغاط) معروفة ، يمكن تحديد كثافة الطاقة الصوتية. بعد ذلك ، يمكن الحصول على انضغاط الخلايا عن طريق تسجيل مسارات حركة الخلايا في المجال الصوتي. يمكن تحقيق قياس عالي الإنتاجية غير مدمر للخلايا في حالة التعليق. ستقدم هذه الورقة تصميم رقاقة الموائع الدقيقة وإنشاء النظام وخطوات القياس. تم إجراء قياس أنواع مختلفة من الخلايا السرطانية للتحقق من دقة الطريقة. تم توسيع نطاق تطبيق هذه الطريقة ليشمل الهياكل دون الخلوية (مثل النواة) عن طريق ضبط تردد الرنين للسيراميك الكهرضغطي وعرض القناة الدقيقة. بالإضافة إلى ذلك ، تم التحقيق في التغيرات في انضغاط الخلايا بعد EMT الناجم عن الدواء أو تشعيع الأشعة السينية بجرعات مختلفة. تظهر النتائج قابلية التطبيق الواسعة لهذه الطريقة كأداة قوية لدراسة العلاقة بين التغيرات الكيميائية الحيوية والخواص الميكانيكية الخلوية.
Protocol
1. تصنيع وتجميع الجهاز المجهري الصوتي
- تصنيع رقاقة الموائع الدقيقة.
- صمم شريحة أحادية القناة مع مدخل ومخرج واحد فقط كما هو موضح في الشكل 1. لقياس الخلايا ، حافظ على المقطع العرضي المستطيل للقناة الدقيقة بعرض 740 ميكرومتر وعمق 100 ميكرومتر. لقياس نواة الخلية ، قم بتغيير عرض وعمق القناة الدقيقة إلى 250 ميكرومتر و 100 ميكرومتر ، على التوالي.
- تحضير القناة الدقيقة على رقاقة السيليكون عن طريق النقش الأيوني التفاعلي. أغلق الجزء العلوي من القناة الدقيقة بقطعة من الزجاج الشفاف المقاوم للحرارة عن طريق الترابط الأنودي15. اغسل الرقائق بمنظف بالموجات فوق الصوتية لمدة 10 دقائق. جففها في فرن تجفيف على درجة حرارة 50 درجة مئوية لاستخدامها لاحقا.
- تصنيع كتل بولي ثنائي ميثيل سيلوكسان (PDMS).
- أضف 30 مل من البوليمر المسبق إلى طبق زجاجي قطره 100 مم (قطره). أضف 3 مل من عامل المعالجة إلى البوليمر المسبق باستخدام حقنة.
ملاحظة: نسبة حجم عامل المعالجة وما قبل البوليمر هي 1:10. - امزج بقوة PDMS قبل البوليمر وعامل المعالجة بقضيب زجاجي لمدة 10 دقائق. ابحث عن فقاعات الهواء الصغيرة والمنفصلة بشكل موحد في المحلول ، والتي تشير إلى أن PDMS قبل البوليمر وعامل المعالجة مختلطان جيدا.
- ضع الطبق الزجاجي في مجفف فراغ وقم بالإخلاء لمدة 15-25 ثانية. كرر هذه العملية حتى لا تكون هناك فقاعات هواء في الخليط.
- ضع الطبق الزجاجي في فرن تجفيف على درجة حرارة 50 درجة مئوية لمدة 1 ساعة للسماح للخليط بالشفاء. بعد الحضانة ، استخدم مشرطا لقطع PDMS إلى كتل ذات حجم مناسب يبلغ طولها حوالي 1.2 سم وعرضها 1 سم.
ملاحظة: يتوافق طول كتلة PDMS مع عرض الرقاقة ، ويتم تحديد العرض لضمان وجود مساحة كافية في الوسط للسيراميك الكهرضغطي عند الالتزام بكتلتين PDMS على الشريحة.
- أضف 30 مل من البوليمر المسبق إلى طبق زجاجي قطره 100 مم (قطره). أضف 3 مل من عامل المعالجة إلى البوليمر المسبق باستخدام حقنة.
- ربط كتلة PDMS إلى الشريحة.
- ثقوب مثقوبة في كتلة PDMS لمنافذ المدخل والمخرج بإبرة مجوفة قطرها 1 مم. ضع كتل PDMS ورقاقة (الجانب الخلفي لأعلى) في منظف البلازما لمدة 1 دقيقة.
- قم بمحاذاة الثقوب الموجودة على كتل PDMS مع مدخل ومخرج الشريحة. اضغط برفق على كتل PDMS على الشريحة لمدة 15 ثانية. يجب أن يتسبب ذلك في حدوث الترابط بين كتل PDMS وسطح الشريحة.
- قم بتوصيل قسطرة البولي تترافلورو إيثيلين (PTFE) بالشريحة (الشكل 2B).
- قطع قطعتين من قسطرة PTFE بقطر داخلي يبلغ 0.8 مم وطول 10 سم. ثني إبرة من الفولاذ المقاوم للصدأ بقطر داخلي يبلغ 0.7 مم وطول 1.5 سم × 90 درجة في شكل L. قم بتوصيله بأحد طرفي القسطرة. إعداد اثنين من هذه القسطرة مع الإبر.
- أدخل الإبر المصنوعة من الفولاذ المقاوم للصدأ في ثقوب كتل PDMS. بالنسبة للمدخل ، قم بتوصيل إبرة توزيع 19 G بالطرف الآخر من القسطرة كموصل لمحقنة.
- بعد الانتهاء من الخطوات المذكورة أعلاه ، حقن الماء منزوع الأيونات لاختبار ضيق القناة الكلية. منيع للماء يعني ختم جيد.
- تجميع السيراميك الكهرضغطي (الشكل 2C)
- استخدم قاطع الأسلاك الماسية لقطع صفائح السيراميك الكهرضغطية التي يبلغ قطرها 2 سم إلى أربعة شرائط بعرض 5 مم.
- تأكد من أن التردد الرنانة للسيراميك الكهرضغطي يتطابق مع عرض القناة الدقيقة للرقاقة. بالنسبة للقناة الدقيقة العريضة 740 ميكرومتر و 250 ميكرومتر ، استخدم السيراميك الكهرضغطي بترددات رنين تبلغ 1 ميجاهرتز و 3 ميجاهرتز ، على التوالي.
- أسلاك اللحام على جانبي السيراميك الكهرضغطي في نهاية واحدة.
- الغراء السيراميك الكهرضغطي إلى منتصف الجزء الخلفي من رقاقة مع الغراء سيانوأكريلات.
- لنشر الغراء بالتساوي ، ضع قطرة من الغراء على السيراميك الكهرضغطي ، وقم بتنعيم الغراء باستخدام مسواك وإزالة الغراء الزائد. ثم اضغط عليه بسرعة على الشريحة واستمر في الضغط لمدة 1 دقيقة تقريبا. تأكد من أن السيراميك الكهرضغطي والرقاقة مرتبطان بإحكام ومتصلان بالتساوي.
- قم بتركيب الجهاز الصغير (الشكل 2D).
- قطع قطعة من PDMS (حوالي 1.5 سم طويلة وعرض 1 سم) كقاعدة للجهاز الصغير. باستخدام شريط على الوجهين ، قم بلصق جانب واحد من القاعدة بكتل PDMS للمدخل والمخرج ، والجانب الآخر بشريحة زجاجية شفافة. قم بإصلاح الجهاز الصغير بأكمله في مرحلة المجهر للحفاظ على الشريحة في مستوى بؤري واحد.
2. إعداد العينات
- إعداد حلول جسيمات البوليسترين القياسية.
- أضف 0.05 مل من محلول جسيمات البوليسترين (قطره 6 ميكرومتر) (2.1 × 108 جسيمات / مل) إلى 10 مل من محلول ملحي مخزن بالفوسفات (PBS) واخلطه جيدا.
ملاحظة: من أجل تقليل خطأ القياس الناجم عن تغير كثافة الطاقة الصوتية، تم خلط محلول جسيمات البوليسترين مع محلول العينة في كل تجربة كمعايرة.
- أضف 0.05 مل من محلول جسيمات البوليسترين (قطره 6 ميكرومتر) (2.1 × 108 جسيمات / مل) إلى 10 مل من محلول ملحي مخزن بالفوسفات (PBS) واخلطه جيدا.
- إعداد تعليق الخلايا.
- اغسل الخلايا الملتصقة (على سبيل المثال ، MCF7 ، MDA-MB-231 ، HCT116) عند التقاء 90٪ (~ 5 × 105 خلايا) باستخدام PBS. أضف 500 ميكرولتر 0.25٪ تريبسين (1x) لمدة 1-2 دقيقة في درجة حرارة الغرفة (25 درجة مئوية). قم بإزالة التربسين ، وأضف 1 مل وسط كامل وشكل تعليق خلية عن طريق السحب.
- جهاز الطرد المركزي لتعليق الخلية عند 100 × g لمدة 5 دقائق. قم بإزالة supernatant وإعادة التعليق في 0.5-1 مل من PBS من أجل الحصول على تعليق الخلية. تم حساب الخلايا باستخدام مقياس الدم وكان التركيز حوالي 3-5 × 105 خلايا / مل.
- تحضير تعليق نواة الخلية
- نفذ الخطوة 2.2. ثم ، قم بإزالة supernatant وإضافة 200 ميكرولتر من كاشف استخراج البروتين السيتوبلازمي A (مكمل بنسبة 1٪ PMSF) لكل 20 ميكرولتر من بيليه الخلية (حوالي 5 ملايين خلية) واخلطه جيدا.
- دوامة الخليط أعلاه في 220 × غرام لمدة 5 ثانية ، ثم وضعها على حمام الجليد لمدة 10 دقائق. بعد الحضانة ، أضف 10 ميكرولتر من كاشف استخراج البروتين السيتوبلازمي B إلى المحلول.
- دوامة في 220 × غرام لمدة 5 ثانية. ضعيه على حمام ثلجي لمدة 1 دقيقة ودوامة مرة أخرى عند 220 × جم لمدة 5 ثوان. ثم ، أخيرا ، جهاز طرد مركزي عند 1000 × g لمدة 5 دقائق عند 4 درجات مئوية.
ملاحظة: نسبة حجم كواشف استخراج البروتين السيتوبلازمي A و B هي 20: 1. - إزالة supernatant وإعادة تعليق الكريات في 1 مل من PBS. ثم ، جهاز طرد مركزي عند 1000 × g عند 4 درجات مئوية لمدة 4 دقائق. قم بإزالة supernatant وإعادة التعليق في 100 ميكرولتر من PBS كتعليق نواة الخلية.
- أضف التربان الأزرق إلى تعليق نواة الخلية أعلاه وصبغ في درجة حرارة الغرفة (25 درجة مئوية) لمدة 4 دقائق. نسبة حجم محلول تريبان الأزرق إلى تعليق النواة هي 1: 1. احسب عدد النوى تحت المجهر المقلوب بهدف 10x.
ملاحظة: لتحديد نوى الخلية بوضوح تحت المجهر ، يلزم تلطيخ التربان الأزرق. يجب أن يكون محلول التربان الأزرق في حمام مائي 37 درجة مئوية لمدة 10 دقائق قبل الاستخدام لتلطيخ فعال. - قم بتخفيف تعليق نواة الخلية أعلاه باستخدام مخزن PBS المؤقت إلى تركيز 2-3 × 105 نواة / مل. قم بتصفية تعليق نواة الخلية من خلال غربال 70 ميكرومتر.
3. قياس انضغاط الخلية والنواة
- إعداد نظام القياس (الشكل 3)
- قم بتشغيل مصدر الضوء للمجهر وافتح برنامج الكاميرا. استخدم هدف 4x لإيجاد الموضع الأوسط للقناة الدقيقة ، أي موضع السيراميك الكهرضغطي.
- قم بتوصيل الأسلاك ولحامها بالمحطات الموجبة والسلبية لخرج مولد الإشارة على السيراميك الكهرضغطي ، على التوالي.
- ضع المحقنة على مضخة الحقن المجهري وقم بتوصيلها بقسطرة المدخل. ضع حاوية صغيرة في نهاية قسطرة المخرج لإبقاء السائل يتدفق من القناة الدقيقة.
- تحديد معلمات القياس
- شفط محلول جسيمات البوليسترين باستخدام المحقنة وحقنه في القناة الدقيقة للرقاقة. تجنب فقاعات الهواء في القناة الدقيقة للرقاقة لضمان القياس الدقيق. تأكد من توزيع الجسيمات بالتساوي في القناة الدقيقة للرقاقة.
ملاحظة: يمكن إجراء القياس بدون تدفق أو مضخة حقنة. إذا لزم الأمر ، يجب ضبط معدل تدفق مضخة الحقن المجهري على قيمة مناسبة. هنا ، نطاق معدل التدفق هو 0-20 ميكرولتر / ساعة. - اضبط خرج مولد الإشارة على إشارة جيبية بتردد 1 ميجاهرتز (3 ميجاهرتز لقياس نواة الخلية) وجهد من الذروة إلى الذروة (Vpp) يبلغ 10 فولت.
- اضبط تردد الإشارة بدقة حتى يلاحظ أن الجسيمات تتحرك نحو خط الوسط للقناة الدقيقة وتظل في حركة أمامية على طول خط الوسط بعد الوصول إلى خط الوسط (الشكل 4).
ملاحظة: يتم تحديد سرعة الجسيمات التي تتحرك نحو خط الوسط من خلال سعة الجهد ، والتي يمكن تعديلها بين 5 فولت لكل بوصة و 20 فولت لكل بوصة.
- شفط محلول جسيمات البوليسترين باستخدام المحقنة وحقنه في القناة الدقيقة للرقاقة. تجنب فقاعات الهواء في القناة الدقيقة للرقاقة لضمان القياس الدقيق. تأكد من توزيع الجسيمات بالتساوي في القناة الدقيقة للرقاقة.
- قياس الخلايا والنوى
- امزج خلية 1 مل أو تعليق النواة مع محلول الجسيمات القياسي بنسبة 1: 1 وحقنه في القناة الدقيقة باستخدام حقنة.
- ابدأ التسجيل باستخدام كاميرا CCD عندما تدخل الخلايا أو النوى مجال الرؤية. ثم قم بتشغيل مولد الإشارة. توقف عن التسجيل عندما تصل الخلايا أو النوى إلى خط الوسط.
- شطف القناة الدقيقة بالماء منزوع الأيونات ، والكحول بنسبة 75٪ ، والماء منزوع الأيونات بالتسلسل للاستخدام لاحقا.
4. معالجة البيانات
- تعيين مسارات الجسيمات أو الخلايا.
- استيراد الفيديو الذي تم التقاطه إلى برنامج ImageJ: ملف > فتح> تحديد مجلد. انقر على شكل القطع الناقص في شريط أدوات برنامج ImageJ لاختيار خلية ذات أهمية وجسيم مجاور لها (الشكل 5).
- كما هو موضح في الشكل 5 ، معلمات القياس المحددة مسبقا في برنامج ImageJ كتحليل → تعيين القياس → المنطقة ، المركز ، تسمية العرض.
- أخذ الإطار الذي تخضع فيه الخلية المستهدفة أو الجسيم للإزاحة الطولية كإطار بداية ؛ سجل موضع البكسل وحجم الخلية أو الجسيم في كل إطار حتى يصل إلى خط الوسط للقناة الدقيقة. تصدير البيانات كملف جدول بيانات وكرر الخطوة حتى يتم الحصول على مسارات لجميع الخلايا ذات الاهتمام.
- تنسيق التحول والتصحيح.
- سجل إحداثيات البيكسل للزوايا الأربع للقناة الدقيقة في مجال الرؤية هذا على النحو التالي (0، y1)، (0، y2)، (x3، y3)، (x4، y4). هنا x3 = x4.
- لكل نقطة قياس (xi، yi)، احسب الإحداثي الجديد (xi', yi') بعد تصحيح الدوران باستخدام الصيغ التالية:
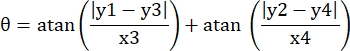
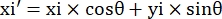

- تحويل إحداثيات البكسل إلى إحداثيات بالحجم الحقيقي. يمكن الحصول على الإحداثيات الفعلية عن طريق ضرب إحداثيات البكسل في النسبة. كانت النسبة هي العرض الفعلي للقناة الدقيقة مقسوما على عرض البكسل (H) للقناة المصغرة.
- قم بتحويل وتصحيح إحداثيات البكسل للخلايا والجسيمات التي تم الحصول عليها في الخطوة 4.1 إلى بيانات مسار الحركة النهائية. جميع الإحداثيات مطروحا منها إحداثيات الزاوية السفلية اليسرى ، أي (0 ، y2). معدل إطارات الفيديو هو 40 إطارا في الثانية ، لذا اضرب عدد الإطارات المقابلة لكل إحداثي في 0.025 s للحصول على وقت حركة الجسيمات ، وبالتالي الحصول على تغيير الموضع في اتجاه y مع مرور الوقت.
- احسب كثافة الطاقة الصوتية (الشكل 6A,B).
- حركة الخلية أو الجسيم في اتجاه Y مدفوعة بالقوة الصوتية F ac والقوة الهيدروديناميكية FD. احسب مسار الحركة باستخدام الصيغ التالية:
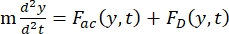 (1)
(1)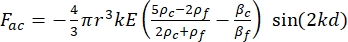 (2)
(2)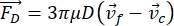 (3)
(3)
حيث r و D هما نصف قطر وقطر الخلية أو الجسيم ، ρ و β هما الكثافة والانضغاط ، ν هو متجه السرعة. يشير الحرفان المنخفضان c و f إلى الخلية والسائل ، على التوالي. d هي المسافة من أقرب عقدة ضغط صوتي ، μ هي اللزوجة الديناميكية للسائل ، k هي رقم الموجة ، و E هي كثافة الطاقة الصوتية.
ملاحظة: كانت كثافة MCF7 و HCT116 و A549 ونوى الخلايا 1068 كجم / م 3 و 1077 كجم / م 3 و 1073 كجم / م 3 و 1155 كجم / م 3 ، على التوالي 12،16،17. - وفقا للصيغ الموضحة في الخطوة 4.3.1 ، استخدم برنامج MATLAB للحصول على الحل العددي لمسار الجسيمات القياسي تحت المجال الصوتي بطريقة الفرق المحدود.
- ضمن نطاق المجال الصوتي المحدد مسبقا، قم بتغيير كثافة الطاقة الصوتية وتناسب الحل العددي (الذي تم الحصول عليه في الخطوة 4.3.2) ومسار الحركة المقاسة (الذي تم الحصول عليه في الخطوة 4.2) للجسيم القياسي. حدد أفضل نتيجة تركيب وفقا لخطأ مربع متوسط التركيب. يتم استخدام كثافة الطاقة الصوتية التي تم الحصول عليها هنا كمعلمة للحساب اللاحق لقابلية انضغاط الخلية.
- حركة الخلية أو الجسيم في اتجاه Y مدفوعة بالقوة الصوتية F ac والقوة الهيدروديناميكية FD. احسب مسار الحركة باستخدام الصيغ التالية:
- احسب انضغاط الخلية (الشكل 6C,D).
- اضبط كثافة الطاقة الصوتية على القيمة التي تم الحصول عليها في الخطوة 4.3.3.
- وفقا للصيغ الموضحة في الخطوة 4.3.1 ، استخدم برنامج MATLAB للحصول على الحل العددي لمسار الخلية تحت المجال الصوتي بطريقة الفرق المحدود.
- على غرار الخطوة 4.3.3 ، ضمن نطاق الانضغاط المحدد مسبقا ، قم بتغيير قابلية الانضغاط وتناسب الحل العددي (الذي تم الحصول عليه في الخطوة 4.4.2) ومسار الحركة المقاسة للخلية (تم الحصول عليه في الخطوة 4.2). استخدم معامل الانضغاط المقابل لأفضل نتيجة مناسبة كقابلية انضغاط الخلية المقاسة.
النتائج
هنا ، قدم العمل بروتوكولا لبناء نظام قياس انضغاط الخلايا السريع وغير المدمر على أساس microdevice المائع الصوتي وأظهر مزاياه لقياس الخلية والنواة في ظل مواقف مختلفة. يوضح الشكل 1 مخطط قناة الموائع الدقيقة. يتم عرض مكونات وتجميع الجهاز المجهري المائع بالأوسيتيك في الش...
Discussion
طرق قياس ميكانيكا الخلايا شائعة الاستخدام هي AFM ، وشفط الماصة الدقيقة ، وطرق الموائع الدقيقة ، وتقنية اللوحة المتوازية ، والملقط البصري ، والنقالة البصرية ، والطرق الصوتية20. يمكن أن تعمل طرق الموائع الدقيقة مع ثلاثة طرق: الانقباض الجزئي ، والتدفق الممتد ، وتدفق القص. من بينها ...
Disclosures
ليس لدى المؤلفين مصالح مالية متنافسة أو تضارب مصالح آخر.
Acknowledgements
تم دعم هذه الدراسة من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (أرقام المنح 12075330 و U1932165) ومؤسسة العلوم الطبيعية في مقاطعة قوانغدونغ ، الصين (رقم المنحة 2020A1515010270).
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin(1x) | GIBCO | 15050-065 | |
| 502 glue | Evo-bond | cyanoacrylate glue | |
| A549 | ATCC | CCL-185 | lung adenocarcinoma |
| Cytonucleoprotein and cytoplasmic protein extraction kit | Beyotime | P0027 | Contains cytoplasmic protein extraction reagents A and B |
| Dulbecco’s modified Eagle medium (DMEM) | corning | 10-013-CVRC | |
| Fetal Bovine Srum(FBS) | AUSGENEX | FBS500-S | |
| HCT116 | ATCC | CCL247 | colorectal carcinoma |
| Heat-resistant glass | Pyrex | ||
| Leibovitz’s L-15 medium | GIBCO | 11415-064 | |
| MCF-7 | ATCC | HTB-22 | breast Adenocarcinoma |
| MDA-MB-231 | ATCC | HTB-26 | breast Adenocarcinoma |
| Minimum Essential Medium (MEM) | corning | 10-010-CV | |
| Penicillin-Streptomycin | GIBCO | 15140-122 | |
| Phosphate buffer | corning | 21-040-cvc | |
| PMSF | Beyotime | ST506 | 100mM |
| Polybead Polystyrene Red Dyed Microsphere | polysciences | 15714 | The diameter of microshpere is 6.00µm |
| propidium iodide(PI) | Sigma-Aldrich | P4170 | |
| SYLGARD 184Silicone ELASTOMER | Dow-Corning | 1673921 | Contains prepolymers and curing agents |
| Trypan Blue | Beyotime | C0011 |
References
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews. Cancer. 11 (7), 512-522 (2011).
- Frame, F. M., et al. HDAC inhibitor confers radiosensitivity to prostate stem-like cells. British Journal of Cancer. 109 (12), 3023-3033 (2013).
- Tseng, Y., Kole, T. P., Wirtz, D. Micromechanical mapping of live cells by multiple-particle-tracking microrheology. Biophysical Journal. 83 (6), 3162-3176 (2002).
- Möller, W., Brown, D. M., Kreyling, W. G., Stone, V. Ultrafine particles cause cytoskeletal dysfunctions in macrophages: role of intracellular calcium. Particle and Fibre Toxicology. 2, 7 (2005).
- Wang, X., et al. A three-dimensional magnetic tweezer system for intraembryonic navigation and measurement. IEEE Transactions on Robotics. 34 (1), 240-247 (2018).
- Machida, S., et al. Direct manipulation of intracellular stress fibres using a hook-shaped AFM probe. Nanotechnology. 21 (38), 385102 (2010).
- Bufi, N., et al. Human primary immune cells exhibit distinct mechanical properties that are modified by inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Jung, J. -. W., et al. Ionising radiation induces changes associated with epithelial-mesenchymal transdifferentiation and increased cell motility of A549 lung epithelial cells. European Journal of Cancer. 43 (7), 1214-1224 (2007).
- Hartono, D., et al. On-chip measurements of cell compressibility via acoustic radiation. Lab-on-a-Chip. 11 (23), 4072-4080 (2011).
- Sitters, G., et al. Acoustic force spectroscopy. Nature Methods. 12 (1), 47-50 (2015).
- Augustsson, P., Karlsen, J. T., Su, H. -. W., Bruus, H., Voldman, J. Iso-acoustic focusing of cells for size-insensitive acousto-mechanical phenotyping. Nature Communications. 7 (1), 11556 (2016).
- Cushing, K. W., et al. Ultrasound characterization of microbead and cell suspensions by speed of sound measurements of neutrally buoyant samples. Analytical Chemistry. 89 (17), 8917-8923 (2017).
- Riaud, A., Wang, W., Thai, A. L. P., Taly, V. Mechanical characterization of cells and microspheres sorted by acoustophoresis with in-line resistive pulse sensing. Physical Review Applied. 13 (3), 034058 (2020).
- Petersson, F., Aberg, L., Swärd-Nilsson, A. -. M., Free Laurell, T. flow acoustophoresis: microfluidic-based mode of particle and cell separation. Analytical Chemistry. 79 (14), 5117-5123 (2007).
- Griwatz, C., Brandt, B., Assmann, G., Zänker, K. S. An immunological enrichment method for epithelial cells from peripheral blood. Journal of Immunological Methods. 183 (2), 251-265 (1995).
- Katholnig, K., Poglitsch, M., Hengstschläger, M., Weichhart, T. Lysis gradient centrifugation: a flexible method for the isolation of nuclei from primary cells. Methods in Molecular Biology. 1228, 15-23 (2015).
- Fu, Q., Zhang, Y., Huang, T., Liang, Y., Liu, Y. Measurement of cell compressibility changes during epithelial-mesenchymal transition based on acoustofluidic microdevice. Biomicrofluidics. 15 (6), 064101 (2021).
- Zhang, Y., et al. Ionizing radiation-induced DNA damage responses affect cell compressibility. Biochemical and Biophysical Research Communications. 603, 116-122 (2022).
- Hao, Y., et al. Mechanical properties of single cells: Measurement methods and applications. Biotechnology Advances. 45, 107648 (2020).
- Yousafzai, M., et al. Effect of neighboring cells on cell stiffness measured by optical tweezers indentation. Journal of Biomedical Optics. 21 (5), 057004 (2016).
- Wei, M. -. T., et al. A comparative study of living cell micromechanical properties by oscillatory optical tweezers. Optics Express. 16 (12), 8594-8603 (2008).
- Khan, Z. S., Vanapalli, S. A. Probing the mechanical properties of brain cancer cells using a microfluidic cell squeezer device. Biomicrofluidics. 7 (1), 011806 (2013).
- Hirawa, S., Masudo, T., Okada, T. Acoustic recognition of counterions in ion-exchange resins. Analytical Chemistry. 79 (7), 3003-3007 (2007).
- Joosse, S. A., Gorges, T. M., Biology Pantel, K. detection, and clinical implications of circulating tumor cells. EMBO Molecular Medicine. 7 (1), 1-11 (2015).
- Martin, O. A., Anderson, R. L., Narayan, K., MacManus, M. P. Does the mobilization of circulating tumour cells during cancer therapy cause metastasis. Nature Reviews Clinical Oncology. 14 (1), 32-44 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved