JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
음향유체 마이크로장치를 기반으로 한 세포 및 핵의 압축성 측정
요약
여기에서는 음향 유체 마이크로 장치를 기반으로 세포 또는 핵 압축성을 측정하기위한 빠르고 비파괴적인 시스템을 구축하기위한 프로토콜이 제시됩니다. 상피-중간엽 전이 또는 전리 방사선 후 종양 세포의 기계적 특성 변화를 조사하여 과학 연구 및 임상 실습에서이 방법의 적용 가능성을 입증했습니다.
초록
세포 역학은 종양 전이, 세포의 악성 형질 전환 및 방사선 민감성에 중요한 역할을합니다. 이러한 과정에서 세포의 기계적 특성을 연구하는 것은 종종 어려운 일입니다. 압축 또는 스트레칭과 같은 접촉을 기반으로 하는 기존의 측정 방법은 세포 손상을 일으키기 쉽고 측정 정확도 및 후속 세포 배양에 영향을 미칩니다. 부착 상태에서의 측정은 특히 전리 방사선이 세포를 평평하게 하고 접착력을 향상시키기 때문에 조사 후 정확도에 영향을 미칠 수 있습니다. 여기에서는 음향 유체 방법에 기반한 세포 역학 측정 시스템이 개발되었습니다. 세포 압축성은 음력의 작용하에 세포 운동 궤적을 기록하여 얻을 수 있으며, 이는 부유 상태에서 빠르고 비파괴적인 측정을 실현할 수 있습니다. 이 백서는 칩 설계, 샘플 준비, 궤적 기록, 매개 변수 추출 및 분석을위한 프로토콜을 자세히보고합니다. 상이한 유형의 종양 세포의 압축성은 이 방법에 기초하여 측정되었다. 핵의 압축성의 측정은 또한 압전 세라믹의 공명 주파수와 마이크로 채널의 폭을 조정함으로써 달성되었다. 면역형광 실험의 분자 수준 검증과 결합하여 약물 유도 상피에서 중간엽으로의 전이(EMT) 전후의 세포 압축성을 비교했습니다. 또한, 상이한 선량으로 X 선 조사 후 세포 압축성의 변화가 밝혀졌다. 이 논문에서 제안한 세포 역학 측정 방법은 보편적이고 유연하며 과학 연구 및 임상 실습에서 광범위한 응용 전망을 가지고 있습니다.
서문
세포의 기계적 특성은 종양 전이, 세포의 악성 형질 전환 및 방사선 민감성 1,2에 중요한 역할을합니다. 위의 과정에서 세포 기계적 특성의 역할에 대한 심층적 인 이해를 얻으려면 세포 역학의 정확한 측정이 중요하며 측정은 후속 배양 및 분석을 위해 세포에 손상을 일으키지 않아야합니다. 측정 과정은 가능한 한 빨라야 하며, 그렇지 않으면 세포가 배양 환경에서 장기간 제거되면 세포 생존율에 영향을 미칠 수 있습니다.
기존의 세포 역학 측정 방법은 몇 가지 한계에 직면해 있습니다. 자기 비틀림 세포 분석, 자기 핀셋 및 입자 추적 미세 유변학과 같은 일부 방법은 세포 3,4,5에 입자가 도입되어 세포손상을 일으 킵니다. 원자력 현미경(AFM), 마이크로피펫 흡인, 미세 수축 및 평행판 기술과 같이 세포와의 접촉으로 측정하는 방법도 세포 손상이 발생하기 쉽고 처리량을 증가시키기가 어렵습니다 6,7,8. 또한 전리 방사선은 세포를 평평하게하고 접착력을 증가시킵니다9; 따라서 현탁액에서 전체 세포 역학을 측정해야 합니다.
위의 과제에 대응하여 음향 유체 방법10,11,12,13,14에 기반한 세포 역학 측정 시스템이 개발되었습니다. 채널 폭은 음향 반파장과 일치하여 마이크로 채널의 정중선에 정상파 노드를 생성합니다. 음향 복사력의 작용으로 셀 또는 표준 비드는 음향 압력 노드로 이동할 수 있습니다. 표준 비드의 물리적 특성(크기, 밀도 및 압축성)이 알려져 있기 때문에, 음향 에너지 밀도가 결정될 수 있다. 이어서, 셀 압축성은 음장에서 셀의 운동 궤적을 기록함으로써 얻어질 수 있다. 부유 상태의 세포의 비파괴 고처리량 측정을 달성할 수 있습니다. 이 백서에서는 미세 유체 칩의 설계, 시스템 구축 및 측정 단계를 소개합니다. 상기 방법의 정확성을 검증하기 위해 다양한 형태의 종양 세포의 측정이 수행되었다. 이 방법의 적용 범위는 압전 세라믹의 공명 주파수와 마이크로 채널의 폭을 조정하여 세포 내 구조 (예 : 핵)로 확장되었습니다. 또한, 약물 유도 EMT 또는 다른 용량의 X 선 조사 후 세포 압축성의 변화를 조사했다. 결과는 생화학적 변화와 세포의 기계적 특성 사이의 상관관계를 연구하기 위한 강력한 도구로서 이 방법의 광범위한 적용 가능성을 보여줍니다.
프로토콜
1. 음향 유체 마이크로 장치의 제작 및 조립
- 마이크로유체 칩의 제조.
- 그림 1과 같이 입구와 출구가 하나만 있는 단일 채널 칩을 설계합니다. 세포 측정을 위해 마이크로 채널의 직사각형 단면을 폭 740μm, 깊이 100μm로 유지하십시오. 세포핵을 측정하려면 마이크로 채널의 너비와 깊이를 각각 250μm 및 100μm로 변경하십시오.
- 반응성 이온 에칭을 통해 실리콘 웨이퍼 상의 마이크로채널을 준비한다. 양극 접합15에 의해 투명한 내열 유리 조각으로 마이크로 채널의 상단을 밀봉하십시오. 초음파 세척기로 칩을 10 분 동안 씻으십시오. 나중에 사용하기 위해 50 ° C의 건조 오븐에서 건조하십시오.
- 폴리디메틸실록산(PDMS) 블록을 제작합니다.
- 100mm(직경) 유리 접시에 30mL의 예비 폴리머를 추가합니다. 주사기로 프리폴리머에 경화제 3mL를 추가합니다.
참고: 경화제와 프리폴리머의 부피비는 1:10입니다. - PDMS 프리폴리머와 경화제를 유리 막대로 약 10분 동안 격렬하게 혼합합니다. 용액에서 작고 균일하게 분리된 기포를 찾으면 PDMS 프리폴리머와 경화제가 잘 혼합되어 있음을 나타냅니다.
- 유리 접시를 진공 데시케이터에 넣고 15-25초 동안 대피시킵니다. 혼합물에 기포가 없을 때까지이 과정을 반복하십시오.
- 유리 접시를 50°C로 설정된 건조 오븐에 1시간 동안 넣어 혼합물이 경화되도록 합니다. 배양 후 메스를 사용하여 PDMS를 길이 약 1.2cm, 너비 1cm의 적절한 크기의 블록으로 자릅니다.
참고: PDMS 블록의 길이는 칩의 너비와 일치하며 두 개의 PDMS 블록이 칩에 접착될 때 중간에 압전 세라믹을 위한 충분한 공간이 있는지 확인하기 위해 너비가 선택됩니다.
- 100mm(직경) 유리 접시에 30mL의 예비 폴리머를 추가합니다. 주사기로 프리폴리머에 경화제 3mL를 추가합니다.
- PDMS 블록을 칩에 바인딩합니다.
- 입구 및 출구 포트용 PDMS 블록에 직경 1mm 중공 바늘로 구멍을 뚫습니다. PDMS 블록과 칩(뒷면이 위로)을 플라즈마 클리너에 1분 동안 넣습니다.
- PDMS 블록의 구멍을 칩 입구 및 출구에 맞춥니다. PDMS 블록을 칩에 15초 동안 부드럽게 누릅니다. 이로 인해 PDMS 블록과 칩 표면 사이에 본딩이 발생해야합니다.
- 폴리테트라플루오로에틸렌(PTFE) 카테터를 칩에 연결합니다(그림 2B).
- 내경 0.8mm, 길이 10cm의 PTFE 카테터 두 개를 자릅니다. 내경 0.7mm, 길이 1.5cm x 90°의 스테인리스 스틸 바늘을 L자 모양으로 구부립니다. 카테터의 한쪽 끝에 연결하십시오. 바늘로 두 개의 카테터를 준비하십시오.
- 스테인리스 스틸 바늘을 PDMS 블록의 구멍에 삽입합니다. 입구의 경우 19G 분배 바늘을 카테터의 다른 쪽 끝에 주사기 용 커넥터로 연결합니다.
- 위의 단계를 완료한 후 탈이온수를 주입하여 전체 채널의 견고성을 테스트합니다. 물에 영향을받지 않는다는 것은 좋은 밀봉을 의미합니다.
- 압전 세라믹 어셈블리(그림 2C)
- 다이아몬드 와이어 커터를 사용하여 직경 2cm의 압전 세라믹 시트를 너비 5mm의 4 개의 스트립으로 자릅니다.
- 압전 세라믹의 공진 주파수가 칩 마이크로 채널의 너비와 일치하는지 확인하십시오. 740μm 및 250μm 너비의 마이크로 채널의 경우 각각 1MHz 및 3MHz의 공진 주파수를 가진 압전 세라믹을 사용하십시오.
- 한쪽 끝에서 압전 세라믹의 양쪽에 와이어를 용접하십시오.
- 압전 세라믹을 시아 노 아크릴 레이트 접착제로 칩 뒷면 중앙에 붙입니다.
- 접착제를 고르게 펴려면 압전 세라믹에 접착제 한 방울을 놓고 이쑤시개로 접착제를 부드럽게하고 여분의 접착제를 제거하십시오. 그런 다음 칩에서 빠르게 누르고 약 1분 동안 계속 누릅니다. 압전 세라믹과 칩이 단단히 접착되고 고르게 접촉되는지 확인하십시오.
- 마이크로 장치를 장착합니다(그림 2D).
- PDMS 조각 (길이 약 1.5cm, 너비 1cm)을 마이크로 장치의베이스로 자릅니다. 양면 테이프를 사용하여 베이스의 한쪽을 입구 및 출구 PDMS 블록에 붙이고 다른 쪽을 투명 유리 슬라이드에 붙입니다. 전체 마이크로 장치를 현미경 스테이지에 고정하여 칩을 하나의 초점면에 유지합니다.
2. 샘플 준비
- 폴리스티렌 표준 입자 용액의 제조.
- 0.05mL의 폴리스티렌 입자 (직경 6μm) 용액 (2.1 x 108 입자 / mL)을 인산염 완충 식염수 (PBS) 10mL에 넣고 잘 섞는다.
참고: 음향 에너지 밀도의 변화로 인한 측정 오류를 줄이기 위해 폴리스티렌 입자 용액을 보정으로 각 실험에서 샘플 용액과 혼합했습니다.
- 0.05mL의 폴리스티렌 입자 (직경 6μm) 용액 (2.1 x 108 입자 / mL)을 인산염 완충 식염수 (PBS) 10mL에 넣고 잘 섞는다.
- 세포 현탁액의 제조.
- 부착 세포(예: MCF7, MDA-MB-231, HCT116)를 90% 컨플루언시(~5 x 105 세포)로 PBS로 세척합니다. 실온(25°C)에서 1-2분 동안 500μL 0.25% 트립신(1x)을 추가합니다. 트립신을 제거하고 1mL의 완전 배지를 추가하고 피펫팅으로 세포 현탁액을 형성합니다.
- 세포 현탁액을 100 x g 에서 5분 동안 원심분리합니다. 세포 현탁액을 얻기 위해 상층액을 제거하고 0.5-1 mL의 PBS에 재현탁시켰다. 세포를 혈구계로 계수하였고, 농도는 약 3-5 x 105 cells/mL이었다.
- 세포핵 현탁액의 제조
- 2.2단계를 수행합니다. 그런 다음 상청액을 제거하고 20μL 세포 펠릿(약 500만 세포) 당 200μL의 세포질 단백질 추출 시약 A(1% PMSF 보충)를 추가하고 잘 혼합합니다.
- 위의 혼합물을 220 x g 에서 5 초 동안 소용돌이 한 다음 얼음 욕조에 10 분 동안 두십시오. 배양 후 10μL의 세포질 단백질 추출 시약 B를 용액에 첨가합니다.
- 5 초 동안 220 x g 의 소용돌이. 얼음 욕조에 1분 동안 놓고 220 x g 에서 5초 동안 다시 소용돌이합니다. 이어서, 최종적으로 4°C에서 5분 동안 1,000 x g 로 원심분리한다.
참고: 세포질 단백질 추출 시약 A와 B의 부피비는 20:1입니다. - 상청액을 제거하고 펠렛을 1mL의 PBS에 재현탁합니다. 그런 다음 4°C에서 1,000 x g 에서 4분 동안 원심분리합니다. 상청액을 제거하고 세포핵 현탁액으로서 100 μL의 PBS에 재현탁한다.
- 위의 세포핵 현탁액에 트리판 블루를 추가하고 실온(25°C)에서 4분 동안 염색합니다. 트리판 블루 용액과 핵 현탁액의 부피 비율은 1:1입니다. 10x 대물렌즈로 도립 현미경 아래의 핵 수를 세십시오.
참고: 현미경으로 세포핵을 명확하게 식별하려면 트리판 블루 염색이 필요합니다. 트리판 블루 용액은 효과적인 염색을 위해 사용하기 전에 37°C 수조에서 10분 동안 담가야 합니다. - 위의 세포핵 현탁액을 PBS 완충액으로 2-3 x 105 핵/mL의 농도로 희석합니다. 세포핵 현탁액을 70 μm 체를 통해 여과한다.
3. 세포와 핵의 압축성 측정
- 측정 시스템 설정(그림 3)
- 현미경의 광원을 켜고 카메라 소프트웨어를 엽니다. 4x 대물렌즈를 사용하여 마이크로채널의 중간 위치, 즉 압전 세라믹의 위치를 찾습니다.
- 전선을 연결하고 압전 세라믹의 신호 발생기 출력의 양극 및 음극 단자에 각각 용접하십시오.
- 주사기를 미세 주입 펌프에 놓고 입구 카테터에 연결합니다. 마이크로 채널에서 흘러 나오는 유체를 유지하기 위해 출구 카테터 끝에 작은 용기를 놓습니다.
- 측정 파라미터 결정
- 주사기로 폴리스티렌 입자 용액을 흡인하여 칩 마이크로 채널에 주입하십시오. 정확한 측정을 보장하기 위해 칩 마이크로 채널의 기포를 피하십시오. 입자가 칩 마이크로 채널에 고르게 분포되어 있는지 확인하십시오.
알림: 유량 또는 주사기 펌프 없이 측정을 수행할 수 있습니다. 필요한 경우 미세 주입 펌프의 유량을 적절한 값으로 설정해야 합니다. 여기서 유량 범위는 0-20 μL / h입니다. - 신호 발생기의 출력을 주파수가 1MHz(세포핵 측정의 경우 3MHz)이고 피크 대 피크 전압(Vpp)이 10V인 사인 신호로 설정합니다.
- 입자가 마이크로 채널의 정중선을 향해 이동하고 정중선에 도달한 후 정중선을 따라 전진 운동을 유지하는 것이 관찰될 때까지 신호의 주파수를 미세 조정합니다(그림 4).
알림: 정중선을 향해 이동하는 입자의 속도는 전압 진폭에 의해 결정되며 5Vpp에서 20Vpp 사이에서 조정할 수 있습니다.
- 주사기로 폴리스티렌 입자 용액을 흡인하여 칩 마이크로 채널에 주입하십시오. 정확한 측정을 보장하기 위해 칩 마이크로 채널의 기포를 피하십시오. 입자가 칩 마이크로 채널에 고르게 분포되어 있는지 확인하십시오.
- 세포와 핵 측정
- 1mL 세포 또는 핵 현탁액을 표준 입자 용액과 1:1 비율로 혼합하고 주사기로 마이크로채널에 주입합니다.
- 세포 또는 핵이 시야에 들어갈 때 CCD 카메라로 녹화를 시작하십시오. 그런 다음 신호 발생기를 켭니다. 세포 또는 핵이 정중선에 도달하면 기록을 중지합니다.
- 나중에 사용할 수 있도록 마이크로 채널을 탈 이온수, 75 % 알코올 및 탈 이온수로 순서대로 헹굽니다.
4. 데이터 처리
- 입자 또는 세포 궤적을 매핑합니다.
- 캡처한 비디오를 ImageJ 소프트웨어로 가져오기: 파일 > 열기> 폴더 선택. ImageJ 소프트웨어의 도구 모음에서 타원 모양을 클릭하여 원하는 셀과 그에 인접한 입자를 선택합니다(그림 5).
- 그림 5와 같이 ImageJ 소프트웨어에서 측정 파라미터를 분석→ 측정 설정→면적, 중심, 디스플레이 레이블로 사전 설정합니다.
- 타겟 셀 또는 입자가 종방향 변위를 겪는 프레임을 시작 프레임으로 취하는 단계; 마이크로 채널의 중간 선에 도달 할 때까지 각 프레임에서 셀 또는 입자의 픽셀 위치와 크기를 기록합니다. 데이터를 스프레드시트 파일로 내보내고 관심 있는 모든 셀에 대한 궤적을 얻을 때까지 단계를 반복합니다.
- 변환 및 수정을 조정합니다.
- 이 시야에서 마이크로 채널의 네 모서리의 픽셀 좌표를 (0, y1), (0, y2), (x3, y3), (x4, y4)로 기록합니다. 여기서 x3 = x4입니다.
- 각 측정 점(xi, yi)에 대해 다음 공식을 사용하여 회전 보정 후 새 좌표(xi', yi')를 계산합니다.
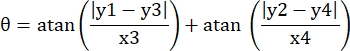
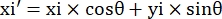

- 픽셀 좌표를 실제 크기 좌표로 변환합니다. 실제 좌표는 픽셀 좌표에 비율을 곱하여 얻을 수 있습니다. 상기 비율은 마이크로채널의 실제 폭을 마이크로채널의 픽셀 폭(H)으로 나눈 값이었다.
- 단계 4.1에서 얻은 셀 및 입자의 픽셀 좌표를 최종 운동 궤적 데이터로 변환하고 수정합니다. 모든 좌표에서 왼쪽 아래 모서리의 좌표를 뺀 값(예: (0, y2)입니다. 영상의 프레임 레이트는 초당 40프레임이므로 각 좌표에 해당하는 프레임 수에 0.025초를 곱하여 파티클 이동 시간을 구하면 시간에 따른 y 방향의 위치 변화를 얻을 수 있다.
- 음향 에너지 밀도를 계산합니다(그림 6A,B).
- Y 방향으로의 셀 또는 입자의 운동은 음향력 Fac 및 유체 역학적 힘 FD에 의해 구동됩니다. 다음 공식을 사용하여 동작 궤적을 계산합니다.
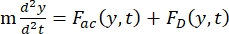 (1)
(1)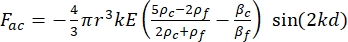 (2)
(2)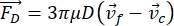 (3)
(3)
여기서 r 과 D 는 셀 또는 입자의 반경과 직경, ρ 와 β 는 밀도와 압축성, ν는 속도 벡터입니다. 첨자 c와 f 는 각각 세포와 유체를 나타냅니다. d 는 가장 가까운 음압 노드로부터의 거리, μ 는 유체의 동적 점도, k 는 파수, E 는 음향 에너지 밀도입니다.
참고: MCF7, HCT116, A549 및 세포핵의 밀도는 각각 1068kg/m3, 1077kg/m3, 1073kg/m3 및 1155kg/m3, 12,16,17이었습니다. - 4.3.1단계에서 설명한 공식에 따라 MATLAB 소프트웨어를 사용하여 유한 차분 방법으로 음향장 아래의 표준 입자 궤적에 대한 수치 해를 구합니다.
- 사전 설정된 음향장 범위 내에서 음향 에너지 밀도를 변경하고 표준 입자에 대한 수치 용액(4.3.2단계에서 얻음)과 측정된 운동 궤적(4.2단계에서 얻음)을 맞춥니다. 적합 평균 제곱 오차에 따라 최상의 적합 결과를 선택합니다. 여기서 얻은 음향 에너지 밀도는 셀 압축률의 후속 계산을위한 매개 변수로 사용됩니다.
- Y 방향으로의 셀 또는 입자의 운동은 음향력 Fac 및 유체 역학적 힘 FD에 의해 구동됩니다. 다음 공식을 사용하여 동작 궤적을 계산합니다.
- 셀 압축률을 계산합니다(그림 6C, D).
- 음향 에너지 밀도를 4.3.3단계에서 얻은 값으로 설정합니다.
- 4.3.1단계에서 설명한 공식에 따라 MATLAB 소프트웨어를 사용하여 유한 차분 방법을 사용하여 음장 아래의 세포 궤적에 대한 수치 해를 구합니다.
- 4.3.3단계와 유사하게 사전 설정된 압축률 범위 내에서 압축률을 변경하고 수치 솔루션(4.4.2단계에서 얻음) 및 셀에 대해 측정된 운동 궤적(4.2단계에서 얻음)을 맞춥니다. 가장 적합한 결과에 해당하는 압축률 계수를 측정된 셀 압축률로 사용합니다.
결과
여기에서 연구는 음향 유체 마이크로 장치를 기반으로 한 빠르고 비파괴적인 세포 압축률 측정 시스템의 구축을위한 프로토콜을 제시하고 다양한 상황에서 세포와 핵을 측정하는 이점을 보여주었습니다. 도 1 은 마이크로유체 채널의 개략도를 나타낸다. 음향 유체 마이크로 장치의 구성 요소 및 어셈블리는 그림 2에 나와 있습니다. 그?...
토론
일반적으로 사용되는 세포 역학 측정 방법은 AFM, 마이크로 피펫 흡인, 미세 유체 방법, 병렬 플레이트 기술, 광학 핀셋, 광학 들것 및 음향 방법20입니다. 미세 유체 학적 방법은 미세 수축, 확장 흐름 및 전단 흐름의 세 가지 접근 방식으로 작동 할 수 있습니다. 그 중 광학 들것, 광학 핀셋, 음향 방법, 확장 흐름 및 전단 흐름 접근 방식은 비접촉 측정입니다. 접촉 측정과 달리 비접...
공개
저자는 경쟁하는 재정적 이해 관계나 기타 이해 상충이 없습니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단(보조금 번호 12075330 및 U1932165)과 중국 광동성 자연 과학 재단(보조금 번호 2020A1515010270)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin(1x) | GIBCO | 15050-065 | |
| 502 glue | Evo-bond | cyanoacrylate glue | |
| A549 | ATCC | CCL-185 | lung adenocarcinoma |
| Cytonucleoprotein and cytoplasmic protein extraction kit | Beyotime | P0027 | Contains cytoplasmic protein extraction reagents A and B |
| Dulbecco’s modified Eagle medium (DMEM) | corning | 10-013-CVRC | |
| Fetal Bovine Srum(FBS) | AUSGENEX | FBS500-S | |
| HCT116 | ATCC | CCL247 | colorectal carcinoma |
| Heat-resistant glass | Pyrex | ||
| Leibovitz’s L-15 medium | GIBCO | 11415-064 | |
| MCF-7 | ATCC | HTB-22 | breast Adenocarcinoma |
| MDA-MB-231 | ATCC | HTB-26 | breast Adenocarcinoma |
| Minimum Essential Medium (MEM) | corning | 10-010-CV | |
| Penicillin-Streptomycin | GIBCO | 15140-122 | |
| Phosphate buffer | corning | 21-040-cvc | |
| PMSF | Beyotime | ST506 | 100mM |
| Polybead Polystyrene Red Dyed Microsphere | polysciences | 15714 | The diameter of microshpere is 6.00µm |
| propidium iodide(PI) | Sigma-Aldrich | P4170 | |
| SYLGARD 184Silicone ELASTOMER | Dow-Corning | 1673921 | Contains prepolymers and curing agents |
| Trypan Blue | Beyotime | C0011 |
참고문헌
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews. Cancer. 11 (7), 512-522 (2011).
- Frame, F. M., et al. HDAC inhibitor confers radiosensitivity to prostate stem-like cells. British Journal of Cancer. 109 (12), 3023-3033 (2013).
- Tseng, Y., Kole, T. P., Wirtz, D. Micromechanical mapping of live cells by multiple-particle-tracking microrheology. Biophysical Journal. 83 (6), 3162-3176 (2002).
- Möller, W., Brown, D. M., Kreyling, W. G., Stone, V. Ultrafine particles cause cytoskeletal dysfunctions in macrophages: role of intracellular calcium. Particle and Fibre Toxicology. 2, 7 (2005).
- Wang, X., et al. A three-dimensional magnetic tweezer system for intraembryonic navigation and measurement. IEEE Transactions on Robotics. 34 (1), 240-247 (2018).
- Machida, S., et al. Direct manipulation of intracellular stress fibres using a hook-shaped AFM probe. Nanotechnology. 21 (38), 385102 (2010).
- Bufi, N., et al. Human primary immune cells exhibit distinct mechanical properties that are modified by inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Jung, J. -. W., et al. Ionising radiation induces changes associated with epithelial-mesenchymal transdifferentiation and increased cell motility of A549 lung epithelial cells. European Journal of Cancer. 43 (7), 1214-1224 (2007).
- Hartono, D., et al. On-chip measurements of cell compressibility via acoustic radiation. Lab-on-a-Chip. 11 (23), 4072-4080 (2011).
- Sitters, G., et al. Acoustic force spectroscopy. Nature Methods. 12 (1), 47-50 (2015).
- Augustsson, P., Karlsen, J. T., Su, H. -. W., Bruus, H., Voldman, J. Iso-acoustic focusing of cells for size-insensitive acousto-mechanical phenotyping. Nature Communications. 7 (1), 11556 (2016).
- Cushing, K. W., et al. Ultrasound characterization of microbead and cell suspensions by speed of sound measurements of neutrally buoyant samples. Analytical Chemistry. 89 (17), 8917-8923 (2017).
- Riaud, A., Wang, W., Thai, A. L. P., Taly, V. Mechanical characterization of cells and microspheres sorted by acoustophoresis with in-line resistive pulse sensing. Physical Review Applied. 13 (3), 034058 (2020).
- Petersson, F., Aberg, L., Swärd-Nilsson, A. -. M., Free Laurell, T. flow acoustophoresis: microfluidic-based mode of particle and cell separation. Analytical Chemistry. 79 (14), 5117-5123 (2007).
- Griwatz, C., Brandt, B., Assmann, G., Zänker, K. S. An immunological enrichment method for epithelial cells from peripheral blood. Journal of Immunological Methods. 183 (2), 251-265 (1995).
- Katholnig, K., Poglitsch, M., Hengstschläger, M., Weichhart, T. Lysis gradient centrifugation: a flexible method for the isolation of nuclei from primary cells. Methods in Molecular Biology. 1228, 15-23 (2015).
- Fu, Q., Zhang, Y., Huang, T., Liang, Y., Liu, Y. Measurement of cell compressibility changes during epithelial-mesenchymal transition based on acoustofluidic microdevice. Biomicrofluidics. 15 (6), 064101 (2021).
- Zhang, Y., et al. Ionizing radiation-induced DNA damage responses affect cell compressibility. Biochemical and Biophysical Research Communications. 603, 116-122 (2022).
- Hao, Y., et al. Mechanical properties of single cells: Measurement methods and applications. Biotechnology Advances. 45, 107648 (2020).
- Yousafzai, M., et al. Effect of neighboring cells on cell stiffness measured by optical tweezers indentation. Journal of Biomedical Optics. 21 (5), 057004 (2016).
- Wei, M. -. T., et al. A comparative study of living cell micromechanical properties by oscillatory optical tweezers. Optics Express. 16 (12), 8594-8603 (2008).
- Khan, Z. S., Vanapalli, S. A. Probing the mechanical properties of brain cancer cells using a microfluidic cell squeezer device. Biomicrofluidics. 7 (1), 011806 (2013).
- Hirawa, S., Masudo, T., Okada, T. Acoustic recognition of counterions in ion-exchange resins. Analytical Chemistry. 79 (7), 3003-3007 (2007).
- Joosse, S. A., Gorges, T. M., Biology Pantel, K. detection, and clinical implications of circulating tumor cells. EMBO Molecular Medicine. 7 (1), 1-11 (2015).
- Martin, O. A., Anderson, R. L., Narayan, K., MacManus, M. P. Does the mobilization of circulating tumour cells during cancer therapy cause metastasis. Nature Reviews Clinical Oncology. 14 (1), 32-44 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유