Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Messung der Kompressibilität von Zelle und Zellkern mittels akustofluidischem Mikrogerät
In diesem Artikel
Zusammenfassung
Hier wird ein Protokoll vorgestellt, um ein schnelles und zerstörungsfreies System zur Messung der Zell- oder Kernkompressibilität basierend auf akustofluidischen Mikrogeräten aufzubauen. Veränderungen der mechanischen Eigenschaften von Tumorzellen nach epithelial-mesenchymalem Übergang oder ionisierender Strahlung wurden untersucht, was die Anwendungsperspektive dieser Methode in der wissenschaftlichen Forschung und klinischen Praxis aufzeigt.
Zusammenfassung
Die Zellmechanik spielt eine wichtige Rolle bei der Tumormetastasierung, der malignen Transformation von Zellen und der Strahlenempfindlichkeit. Während dieser Prozesse ist die Untersuchung der mechanischen Eigenschaften der Zellen oft eine Herausforderung. Konventionelle Messmethoden, die auf Kontakt basieren, wie Kompression oder Dehnung, neigen dazu, Zellschäden zu verursachen, was die Messgenauigkeit und die anschließende Zellkultur beeinträchtigt. Messungen im adhärenten Zustand können auch die Genauigkeit beeinträchtigen, insbesondere nach der Bestrahlung, da ionisierende Strahlung Zellen abflacht und die Adhäsion verbessert. Hier wurde ein zellmechanisches Messsystem entwickelt, das auf einer akustofluidischen Methode basiert. Die Zellkompressibilität kann durch Aufzeichnung der Zellbewegungsbahn unter Einwirkung der akustischen Kraft erreicht werden, wodurch eine schnelle und zerstörungsfreie Messung im suspendierten Zustand realisiert werden kann. In diesem Artikel werden die Protokolle für Chipdesign, Probenvorbereitung, Trajektorienaufzeichnung, Parameterextraktion und -analyse ausführlich beschrieben. Anhand dieser Methode wurde die Kompressibilität verschiedener Tumorzelltypen gemessen. Die Messung der Kompressibilität des Kerns wurde ebenfalls durch Anpassung der Resonanzfrequenz der piezoelektrischen Keramik und der Breite des Mikrokanals erreicht. In Kombination mit der molekularen Verifikation von Immunfluoreszenzexperimenten wurde die Zellkompressibilität vor und nach dem medikamenteninduzierten epithelialen zu mesenchymalen Übergang (EMT) verglichen. Weiterhin wurde die Veränderung der Zellkompressibilität nach Röntgenbestrahlung mit unterschiedlichen Dosen aufgedeckt. Die in dieser Arbeit vorgeschlagene zellmechanische Messmethode ist universell und flexibel und hat breite Anwendungsperspektiven in der wissenschaftlichen Forschung und klinischen Praxis.
Einleitung
Zellmechanische Eigenschaften spielen eine wichtige Rolle bei der Tumormetastasierung, der malignen Transformation von Zellen und der Strahlenempfindlichkeit 1,2. Um ein tiefes Verständnis der Rolle der zellmechanischen Eigenschaften in dem oben genannten Prozess zu erlangen, ist eine genaue Messung der Zellmechanik von entscheidender Bedeutung, und die Messung sollte keine Schäden an den Zellen für die anschließende Kultur und Analyse verursachen. Der Messprozess sollte so schnell wie möglich sein, da sonst die Zelllebensfähigkeit beeinträchtigt werden kann, wenn Zellen für längere Zeit aus der Kultivierungsumgebung entfernt werden.
Bestehende zellmechanische Messmethoden stoßen auf einige Einschränkungen. Einige Methoden, wie die magnetische Drehzytometrie, die Magnetpinzette und die Partikelverfolgungsmikrorheologie, verursachen Zellschäden durch die Einführung von Partikeln in Zellen 3,4,5. Methoden, die durch Kontakt mit Zellen messen, wie Rasterkraftmikroskop (AFM), Mikropipettenaspiration, Mikrokonstriktion und Parallelplattentechnik, sind ebenfalls anfällig für Zellschäden und der Durchsatz ist schwer zu erhöhen 6,7,8. Darüber hinaus wird ionisierende Strahlung Zellen abflachen und ihre Adhäsion erhöhen9; Es ist daher notwendig, die Ganzzellmechanik in Suspension zu messen.
Als Antwort auf die oben genannten Herausforderungen wurde ein zellmechanisches Messsystem entwickelt, das auf der akustofluidischen Methode 10,11,12,13,14 basiert. Die Kanalbreite ist auf die akustische Halbwellenlänge abgestimmt, wodurch ein stehender Wellenknoten an der Mittellinie des Mikrokanals entsteht. Unter Einwirkung der akustischen Strahlungskraft können sich die Zellen oder Standardperlen zum akustischen Druckknoten bewegen. Da die physikalischen Eigenschaften der Standardkügelchen (Größe, Dichte und Kompressibilität) bekannt sind, kann die akustische Energiedichte bestimmt werden. Dann kann die Zellkompressibilität durch Aufzeichnung der Bewegungsbahnen von Zellen im akustischen Feld erhalten werden. Eine zerstörungsfreie Hochdurchsatzmessung von Zellen im Suspensionszustand kann erreicht werden. In diesem Beitrag werden das Design des mikrofluidischen Chips, der Aufbau des Systems und die Messschritte vorgestellt. Es wurden verschiedene Arten von Tumorzellen gemessen, um die Genauigkeit der Methode zu überprüfen. Der Anwendungsbereich dieser Methode wurde durch Anpassung der Resonanzfrequenz der piezoelektrischen Keramik und der Breite des Mikrokanals auf subzelluläre Strukturen (z.B. Kern) erweitert. Darüber hinaus wurden die Veränderungen der Zellkompressibilität nach medikamenteninduzierter EMT- oder Röntgenbestrahlung mit unterschiedlichen Dosen untersucht. Die Ergebnisse zeigen die breite Anwendbarkeit dieser Methode als leistungsfähiges Werkzeug zur Untersuchung der Korrelation zwischen biochemischen Veränderungen und zellulären mechanischen Eigenschaften.
Protokoll
1. Herstellung und Montage des akustofluidischen Mikrogeräts
- Herstellung des mikrofluidischen Chips.
- Entwerfen Sie einen Einkanalchip mit nur einem Ein- und Auslass, wie in Abbildung 1 dargestellt. Für Messzellen ist der rechteckige Querschnitt des Mikrokanals bei 740 μm Breite und 100 μm Tiefe zu halten. Um den Zellkern zu messen, ändern Sie die Breite und Tiefe des Mikrokanals auf 250 μm bzw. 100 μm.
- Bereiten Sie den Mikrokanal auf Siliziumwafern durch reaktives Ionenätzen vor. Versiegeln Sie die Oberseite des Mikrokanals mit einem Stück transparentem hitzebeständigem Glas durch anodische Verklebung15. Waschen Sie die Chips mit einem Ultraschallreiniger für 10 min. Trocknen Sie sie im Trockenofen bei 50 °C für den späteren Gebrauch.
- Herstellung von Polydimethylsiloxan (PDMS) -Blöcken.
- Fügen Sie 30 ml Prepolymer in eine Glasschale mit 100 mm (Durchmesser) hinzu. Mit einer Spritze 3 ml Härter in das Prepolymer geben.
HINWEIS: Das Volumenverhältnis von Härter und Vorpolymer beträgt 1:10. - PDMS-Prepolymer und Härter mit einem Glasstab ca. 10 min kräftig mischen. Achten Sie auf kleine und gleichmäßig getrennte Luftblasen in der Lösung, die darauf hinweisen, dass PDMS-Prepolymer und Härter gut gemischt sind.
- Legen Sie die Glasschale in einen Vakuum-Exsikkator und evakuieren Sie für 15-25 s. Wiederholen Sie diesen Vorgang, bis keine Luftblasen mehr in der Mischung vorhanden sind.
- Die Glasschale für 1 h in einen Trockenofen bei 50 °C stellen, damit die Mischung aushärten kann. Nach der Inkubation schneiden Sie das PDMS mit einem Skalpell in Blöcke geeigneter Größe von etwa 1,2 cm Länge und 1 cm Breite.
HINWEIS: Die Länge des PDMS-Blocks stimmt mit der Breite des Chips überein, und die Breite wird ausgewählt, um sicherzustellen, dass in der Mitte genügend Platz für die piezoelektrische Keramik vorhanden ist, wenn zwei PDMS-Blöcke auf dem Chip aufgeklebt sind.
- Fügen Sie 30 ml Prepolymer in eine Glasschale mit 100 mm (Durchmesser) hinzu. Mit einer Spritze 3 ml Härter in das Prepolymer geben.
- Binden Sie den PDMS-Block an den Chip.
- Stanzlöcher im PDMS-Block für Ein- und Auslassanschlüsse mit einer Hohlnadel mit 1 mm Durchmesser. Legen Sie die PDMS-Blöcke und den Chip (Rückseite nach oben) für 1 min in einen Plasmareiniger.
- Richten Sie die Löcher an den PDMS-Blöcken am Chipeinlass und -auslass aus. Drücken Sie die PDMS-Blöcke 15 s lang vorsichtig auf den Chip. Dies sollte zu einer Bindung zwischen den PDMS-Blöcken und der Oberfläche des Chips führen.
- Verbinden Sie den Polytetrafluorethylen (PTFE)-Katheter mit dem Chip (Abbildung 2B).
- Schneiden Sie zwei Stück PTFE-Katheter mit einem Innendurchmesser von 0,8 mm und einer Länge von 10 cm. Biegen Sie eine Edelstahlnadel mit einem Innendurchmesser von 0,7 mm und einer Länge von 1,5 cm mal 90° in eine L-Form. Verbinden Sie es mit einem Ende des Katheters. Bereiten Sie zwei solcher Katheter mit Nadeln vor.
- Führen Sie die Edelstahlnadeln in die Löcher der PDMS-Blöcke ein. Schließen Sie für den Einlass eine 19 G Dosiernadel als Anschluss für eine Spritze an das andere Ende des Katheters an.
- Nach Abschluss der obigen Schritte injizieren Sie entionisiertes Wasser, um die Dichtheit des Gesamtkanals zu testen. Wasserundurchlässig bedeutet eine gute Abdichtung.
- Piezokeramische Baugruppe (Abbildung 2C)
- Mit einem Diamantdrahtschneider schneiden Sie piezoelektrische Keramikplatten mit einem Durchmesser von 2 cm in vier Streifen mit einer Breite von 5 mm.
- Stellen Sie sicher, dass die Resonanzfrequenz der piezoelektrischen Keramik mit der Breite des Chip-Mikrokanals übereinstimmt. Verwenden Sie für den 740 μm und 250 μm breiten Mikrokanal piezoelektrische Keramik mit Resonanzfrequenzen von 1 MHz bzw. 3 MHz.
- Schweißdrähte auf beiden Seiten der piezoelektrischen Keramik an einem Ende.
- Kleben Sie die piezoelektrische Keramik mit Cyanacrylatkleber auf die Mitte der Rückseite des Chips.
- Um den Kleber gleichmäßig zu verteilen, legen Sie einen Tropfen Klebstoff auf die piezoelektrische Keramik, glätten Sie den Kleber mit einem Zahnstocher und entfernen Sie den überschüssigen Kleber. Dann drücken Sie es schnell auf den Chip und drücken Sie es für ca. 1 Minute. Stellen Sie sicher, dass die piezoelektrische Keramik und der Chip fest verbunden und gleichmäßig miteinander verbunden sind.
- Montieren Sie das Mikrogerät (Abbildung 2D).
- Schneiden Sie ein Stück PDMS (ca. 1,5 cm lang und 1 cm breit) als Basis des Mikrogeräts ab. Kleben Sie mit doppelseitigem Klebeband eine Seite der Basis an die Ein- und Auslass-PDMS-Blöcke und die andere Seite an einen transparenten Glasschieber. Befestigen Sie das gesamte Mikrogerät am Mikroskoptisch, um den Chip in einer Fokusebene zu halten.
2. Probenvorbereitung
- Herstellung von Polystyrol-Standardpartikellösungen.
- 0,05 ml Polystyrolpartikellösung (6 μm Durchmesser) (2,1 x 108 Partikel/ml) zu 10 ml phosphatgepufferter Kochsalzlösung (PBS) geben und gut mischen.
HINWEIS: Um den Messfehler durch die Änderung der akustischen Energiedichte zu reduzieren, wurde die Polystyrol-Partikellösung in jedem Experiment als Kalibrierung mit der Probenlösung gemischt.
- 0,05 ml Polystyrolpartikellösung (6 μm Durchmesser) (2,1 x 108 Partikel/ml) zu 10 ml phosphatgepufferter Kochsalzlösung (PBS) geben und gut mischen.
- Herstellung von Zellsuspensionen.
- Waschen Sie die adhärenten Zellen (z. B. MCF7, MDA-MB-231, HCT116) bei 90% Konfluenz (~ 5 x 105 Zellen) mit PBS. 500 μL 0,25% Trypsin (1x) für 1-2 min bei Raumtemperatur (25 °C) zugeben. Entfernen Sie das Trypsin, fügen Sie 1 ml komplettes Medium hinzu und formen Sie durch Pipettieren eine Zellsuspension.
- Zentrifugieren Sie die Zellsuspension bei 100 x g für 5 min. Entfernen Sie den Überstand und resuspendieren Sie ihn in 0,5-1 ml PBS, um eine Zellsuspension zu erhalten. Die Zellen wurden mit einem Hämozytometer gezählt und die Konzentration betrug etwa 3-5 x 105 Zellen/ml.
- Herstellung der Zellkernsuspension
- Führen Sie Schritt 2.2 durch. Dann entfernen Sie den Überstand und fügen Sie 200 μL zytoplasmatisches Proteinextraktionsreagenz A (ergänzt mit 1% PMSF) pro 20 μL Zellpellet (ca. 5 Millionen Zellen) hinzu und mischen Sie gut.
- Wirbeln Sie die obige Mischung bei 220 x g für 5 s an und legen Sie sie dann für 10 min auf Eisbad. Nach der Inkubation 10 μL zytoplasmatisches Proteinextraktionsreagenz B in die Lösung geben.
- Wirbel bei 220 x g für 5 s. Für 1 min auf das Eisbad legen und erneut bei 220 x g für 5 s vorstruken. Dann schließlich bei 1.000 x g für 5 min bei 4 °C zentrifugieren.
HINWEIS: Das Volumenverhältnis der zytoplasmatischen Proteinextraktionsreagenzien A und B beträgt 20:1. - Entfernen Sie den Überstand und resuspendieren Sie das Pellet in 1 ml PBS. Dann bei 1.000 x g bei 4 °C für 4 min zentrifugieren. Entfernen Sie den Überstand und resuspendieren Sie ihn in 100 μL PBS als Zellkernsuspension.
- Trypanblau in die obige Zellkernsuspension geben und bei Raumtemperatur (25 °C) 4 min anfärben. Das Volumenverhältnis von Trypanblaulösung zu Kernsuspension beträgt 1:1. Zählen Sie die Anzahl der Kerne unter dem inversen Mikroskop mit einem 10x-Objektiv.
HINWEIS: Um die Zellkerne unter dem Mikroskop eindeutig zu identifizieren, ist eine Trypanblau-Färbung erforderlich. Die Trypanblaulösung muss vor der Anwendung 10 Minuten in einem 37 °C warmen Wasserbad sein, um eine effektive Färbung zu erzielen. - Die obige Zellkernsuspension wird mit PBS-Puffer auf eine Konzentration von 2-3 x 105 Kern/ml verdünnt. Filtern Sie die Zellkernsuspension durch ein 70 μm Sieb.
3. Messung der Kompressibilität von Zelle und Zellkern
- Einrichten des Messsystems (Abbildung 3)
- Schalten Sie die Lichtquelle des Mikroskops ein und öffnen Sie die Kamerasoftware. Verwenden Sie das 4x-Objektiv, um die mittlere Position des Mikrokanals zu finden, d.h. die Position der piezoelektrischen Keramik.
- Verbinden Sie die Drähte und schweißen Sie sie mit den Plus- und Minuspolen des Signalgeneratorausgangs an der piezoelektrischen Keramik.
- Setzen Sie die Spritze auf die Mikroinjektionspumpe und verbinden Sie sie mit dem Einlasskatheter. Platzieren Sie einen kleinen Behälter am Ende des Auslasskatheters, um die Flüssigkeit zu halten, die aus dem Mikrokanal fließt.
- Messparameter ermitteln
- Die Polystyrolpartikellösung mit der Spritze absaugen und in den Chip-Mikrokanal injizieren. Vermeiden Sie Luftblasen im Chip-Mikrokanal, um eine genaue Messung zu gewährleisten. Stellen Sie sicher, dass die Partikel gleichmäßig im Mikrokanal des Chips verteilt sind.
HINWEIS: Die Messung kann ohne Durchfluss oder Spritzenpumpe durchgeführt werden. Falls erforderlich, sollte der Durchfluss der Mikroinjektionspumpe auf einen geeigneten Wert eingestellt werden. Hier liegt der Durchflussbereich bei 0-20 μL/h. - Stellen Sie den Ausgang des Signalgenerators auf ein Sinussignal mit einer Frequenz von 1 MHz (3 MHz für die Zellkernmessung) und einer Spitze-Spitze-Spannung (Vpp) von 10 V ein.
- Passen Sie die Frequenz des Signals genau an, bis beobachtet wird, dass sich die Partikel in Richtung der Mittellinie des Mikrokanals bewegen und nach Erreichen der Mittellinie in Vorwärtsbewegung entlang der Mittellinie bleiben (Abbildung 4).
HINWEIS: Die Geschwindigkeit der Partikel, die sich in Richtung der Mittellinie bewegen, wird durch die Spannungsamplitude bestimmt, die zwischen 5 Vpp und 20 Vpp eingestellt werden kann.
- Die Polystyrolpartikellösung mit der Spritze absaugen und in den Chip-Mikrokanal injizieren. Vermeiden Sie Luftblasen im Chip-Mikrokanal, um eine genaue Messung zu gewährleisten. Stellen Sie sicher, dass die Partikel gleichmäßig im Mikrokanal des Chips verteilt sind.
- Zellen und Zellkerne messen
- Mischen Sie 1 ml Zell- oder Kernsuspension mit der Standardpartikellösung im Verhältnis 1:1 und injizieren Sie sie mit einer Spritze in den Mikrokanal.
- Starten Sie die Aufnahme mit der CCD-Kamera, wenn die Zellen oder Kerne in das Sichtfeld gelangen. Schalten Sie dann den Signalgenerator ein. Stoppen Sie die Aufnahme, wenn die Zellen oder Kerne die Mittellinie erreichen.
- Spülen Sie den Mikrokanal nacheinander mit entionisiertem Wasser, 75% Alkohol und entionisiertem Wasser für die spätere Verwendung ab.
4. Datenverarbeitung
- Bilden Sie Partikel- oder Zellbahnen ab.
- Importieren Sie das aufgenommene Video in die ImageJ-Software: Datei > öffnen> Ordner auswählen. Klicken Sie auf die Ellipsenform in der Symbolleiste der ImageJ-Software, um eine gewünschte Zelle und das angrenzende Partikel auszuwählen (Abbildung 5).
- Wie in Abbildung 5 dargestellt, stellen Sie die Messparameter in der ImageJ-Software wie Analysieren→ Messung festlegen →Fläche, Schwerpunkt, Anzeigebeschriftung ein.
- Nehmen Sie den Rahmen, in dem die Zielzelle oder das Zielpartikel eine Längsverschiebung erfährt, als Startrahmen; Zeichnen Sie die Pixelposition und -größe der Zelle oder des Partikels in jedem Frame auf, bis sie die Mittellinie des Mikrokanals erreichen. Exportieren Sie die Daten als Tabellenkalkulationsdatei und wiederholen Sie den Schritt, bis Trajektorien für alle interessierenden Zellen erhalten sind.
- Koordinatentransformation und -korrektur.
- Notieren Sie die Pixelkoordinaten der vier Ecken des Mikrokanals in diesem Sichtfeld als (0, y1), (0, y2), (x3, y3), (x4, y4). Hier x3 = x4.
- Berechnen Sie für jeden Messpunkt (xi, yi) die neue Koordinate (xi', yi') nach der Drehungskorrektur mit den folgenden Formeln:
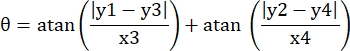
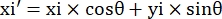

- Konvertieren Sie Pixelkoordinaten in Koordinaten in echter Größe. Die tatsächlichen Koordinaten können durch Multiplikation der Pixelkoordinaten mit dem Verhältnis erhalten werden. Das Verhältnis war die tatsächliche Breite des Mikrokanals geteilt durch die Pixelbreite (H) des Mikrokanals.
- Transformieren und korrigieren Sie die Pixelkoordinaten der in Schritt 4.1 erhaltenen Zellen und Partikel in die endgültigen Bewegungsbahndaten. Alle Koordinaten abzüglich der Koordinaten der linken unteren Ecke, d.h. (0, y2). Die Bildrate des Videos beträgt 40 Bilder pro Sekunde, also multiplizieren Sie die Anzahl der Bilder, die jeder Koordinate entsprechen, mit 0,025 s, um die Zeit der Partikelbewegung zu erhalten, wodurch die Änderung der Position in y-Richtung mit der Zeit erhalten wird.
- Berechnen Sie die akustische Energiedichte (Abbildung 6A,B).
- Die Bewegung der Zelle oder des Partikels in Y-Richtung wird durch die Schallkraft F ac und die hydrodynamische Kraft FD angetrieben. Berechnen Sie die Bewegungstrajektorie mit den folgenden Formeln:
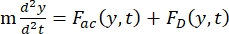 (1)
(1)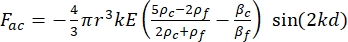 (2)
(2)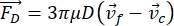 (3)
(3)
wobei r und D der Radius und der Durchmesser der Zelle oder des Teilchens sind, ρ und β die Dichte und Kompressibilität sind, ν der Geschwindigkeitsvektor ist. Die Indizes c und f bezeichnen die Zelle bzw. die Flüssigkeit. d ist der Abstand vom nächsten akustischen Druckknoten, μ die dynamische Viskosität des Fluids, k die Wellenzahl und E die akustische Energiedichte.
ANMERKUNG: Die Dichte von MCF7, HCT116, A549 und Zellkernen betrug 1068 kg/m 3, 1077 kg/m 3, 1073 kg/m 3 bzw. 1155 kg/m 3 bzw. 12,16,17. - Verwenden Sie gemäß den in Schritt 4.3.1 beschriebenen Formeln die MATLAB-Software, um die numerische Lösung für die Standard-Partikeltrajektorie unter der akustischen Feldmethode mit Finite-Differenzen-Methode zu erhalten.
- Ändern Sie innerhalb des voreingestellten akustischen Feldbereichs die akustische Energiedichte und passen Sie die numerische Lösung (erhalten in Schritt 4.3.2) und die gemessene Bewegungstrajektorie (erhalten in Schritt 4.2) für das Standardpartikel an. Wählen Sie das beste Anpassungsergebnis entsprechend dem mittleren quadratischen Fehler der Anpassung aus. Die hier erhaltene akustische Energiedichte dient als Parameter für die anschließende Berechnung der Zellkompressibilität.
- Die Bewegung der Zelle oder des Partikels in Y-Richtung wird durch die Schallkraft F ac und die hydrodynamische Kraft FD angetrieben. Berechnen Sie die Bewegungstrajektorie mit den folgenden Formeln:
- Berechnen Sie die Zellkompressibilität (Abbildung 6C,D).
- Stellen Sie die akustische Energiedichte auf den in Schritt 4.3.3 ermittelten Wert ein.
- Verwenden Sie gemäß den in Schritt 4.3.1 beschriebenen Formeln die MATLAB-Software, um die numerische Lösung für die Zelltrajektorie unter dem akustischen Feld mit der Finite-Differenzen-Methode zu erhalten.
- Ähnlich wie in Schritt 4.3.3 ändern Sie innerhalb des voreingestellten Kompressibilitätsbereichs die Kompressibilität und passen Sie die numerische Lösung (erhalten in Schritt 4.4.2) und die gemessene Bewegungstrajektorie für die Zelle (erhalten in Schritt 4.2) an. Verwenden Sie den Kompressibilitätskoeffizienten, der dem am besten passenden Ergebnis entspricht, als gemessene Zellkompressibilität.
Ergebnisse
Hier stellte die Arbeit ein Protokoll für den Aufbau eines schnellen und zerstörungsfreien Zellkompressibilitätsmesssystems auf Basis eines akustofluidischen Mikrogeräts vor und demonstrierte dessen Vorteile für die Messung von Zelle und Kern unter verschiedenen Situationen. Abbildung 1 zeigt das Schema des mikrofluidischen Kanals. Die Komponenten und der Aufbau des akustofluidischen Mikrogeräts sind in Abbildung 2 dargestellt. Abbildu...
Diskussion
Häufig verwendete zellmechanische Messmethoden sind AFM, Mikropipettenaspiration, mikrofluidische Methoden, Parallelplattentechnik, optische Pinzette, optische Trage und akustische Methoden20. Mikrofluidik-Methoden können mit drei Ansätzen arbeiten: Mikroverengung, Dehnströmung und Scherströmung. Unter ihnen sind optische Stretcher, optische Pinzetten, akustische Methoden, Dehnströmung und Scherströmungsansätze berührungslose Messungen. Im Gegensatz zu Kontaktmessungen können berührungs...
Offenlegungen
Die Autoren haben keine konkurrierenden finanziellen Interessen oder andere Interessenkonflikte.
Danksagungen
Diese Studie wurde von der National Natural Science Foundation of China (Förderkennzeichen 12075330 und U1932165) und der Natural Science Foundation der Provinz Guangdong, China (Förderkennzeichen 2020A1515010270) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin(1x) | GIBCO | 15050-065 | |
| 502 glue | Evo-bond | cyanoacrylate glue | |
| A549 | ATCC | CCL-185 | lung adenocarcinoma |
| Cytonucleoprotein and cytoplasmic protein extraction kit | Beyotime | P0027 | Contains cytoplasmic protein extraction reagents A and B |
| Dulbecco’s modified Eagle medium (DMEM) | corning | 10-013-CVRC | |
| Fetal Bovine Srum(FBS) | AUSGENEX | FBS500-S | |
| HCT116 | ATCC | CCL247 | colorectal carcinoma |
| Heat-resistant glass | Pyrex | ||
| Leibovitz’s L-15 medium | GIBCO | 11415-064 | |
| MCF-7 | ATCC | HTB-22 | breast Adenocarcinoma |
| MDA-MB-231 | ATCC | HTB-26 | breast Adenocarcinoma |
| Minimum Essential Medium (MEM) | corning | 10-010-CV | |
| Penicillin-Streptomycin | GIBCO | 15140-122 | |
| Phosphate buffer | corning | 21-040-cvc | |
| PMSF | Beyotime | ST506 | 100mM |
| Polybead Polystyrene Red Dyed Microsphere | polysciences | 15714 | The diameter of microshpere is 6.00µm |
| propidium iodide(PI) | Sigma-Aldrich | P4170 | |
| SYLGARD 184Silicone ELASTOMER | Dow-Corning | 1673921 | Contains prepolymers and curing agents |
| Trypan Blue | Beyotime | C0011 |
Referenzen
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews. Cancer. 11 (7), 512-522 (2011).
- Frame, F. M., et al. HDAC inhibitor confers radiosensitivity to prostate stem-like cells. British Journal of Cancer. 109 (12), 3023-3033 (2013).
- Tseng, Y., Kole, T. P., Wirtz, D. Micromechanical mapping of live cells by multiple-particle-tracking microrheology. Biophysical Journal. 83 (6), 3162-3176 (2002).
- Möller, W., Brown, D. M., Kreyling, W. G., Stone, V. Ultrafine particles cause cytoskeletal dysfunctions in macrophages: role of intracellular calcium. Particle and Fibre Toxicology. 2, 7 (2005).
- Wang, X., et al. A three-dimensional magnetic tweezer system for intraembryonic navigation and measurement. IEEE Transactions on Robotics. 34 (1), 240-247 (2018).
- Machida, S., et al. Direct manipulation of intracellular stress fibres using a hook-shaped AFM probe. Nanotechnology. 21 (38), 385102 (2010).
- Bufi, N., et al. Human primary immune cells exhibit distinct mechanical properties that are modified by inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Jung, J. -. W., et al. Ionising radiation induces changes associated with epithelial-mesenchymal transdifferentiation and increased cell motility of A549 lung epithelial cells. European Journal of Cancer. 43 (7), 1214-1224 (2007).
- Hartono, D., et al. On-chip measurements of cell compressibility via acoustic radiation. Lab-on-a-Chip. 11 (23), 4072-4080 (2011).
- Sitters, G., et al. Acoustic force spectroscopy. Nature Methods. 12 (1), 47-50 (2015).
- Augustsson, P., Karlsen, J. T., Su, H. -. W., Bruus, H., Voldman, J. Iso-acoustic focusing of cells for size-insensitive acousto-mechanical phenotyping. Nature Communications. 7 (1), 11556 (2016).
- Cushing, K. W., et al. Ultrasound characterization of microbead and cell suspensions by speed of sound measurements of neutrally buoyant samples. Analytical Chemistry. 89 (17), 8917-8923 (2017).
- Riaud, A., Wang, W., Thai, A. L. P., Taly, V. Mechanical characterization of cells and microspheres sorted by acoustophoresis with in-line resistive pulse sensing. Physical Review Applied. 13 (3), 034058 (2020).
- Petersson, F., Aberg, L., Swärd-Nilsson, A. -. M., Free Laurell, T. flow acoustophoresis: microfluidic-based mode of particle and cell separation. Analytical Chemistry. 79 (14), 5117-5123 (2007).
- Griwatz, C., Brandt, B., Assmann, G., Zänker, K. S. An immunological enrichment method for epithelial cells from peripheral blood. Journal of Immunological Methods. 183 (2), 251-265 (1995).
- Katholnig, K., Poglitsch, M., Hengstschläger, M., Weichhart, T. Lysis gradient centrifugation: a flexible method for the isolation of nuclei from primary cells. Methods in Molecular Biology. 1228, 15-23 (2015).
- Fu, Q., Zhang, Y., Huang, T., Liang, Y., Liu, Y. Measurement of cell compressibility changes during epithelial-mesenchymal transition based on acoustofluidic microdevice. Biomicrofluidics. 15 (6), 064101 (2021).
- Zhang, Y., et al. Ionizing radiation-induced DNA damage responses affect cell compressibility. Biochemical and Biophysical Research Communications. 603, 116-122 (2022).
- Hao, Y., et al. Mechanical properties of single cells: Measurement methods and applications. Biotechnology Advances. 45, 107648 (2020).
- Yousafzai, M., et al. Effect of neighboring cells on cell stiffness measured by optical tweezers indentation. Journal of Biomedical Optics. 21 (5), 057004 (2016).
- Wei, M. -. T., et al. A comparative study of living cell micromechanical properties by oscillatory optical tweezers. Optics Express. 16 (12), 8594-8603 (2008).
- Khan, Z. S., Vanapalli, S. A. Probing the mechanical properties of brain cancer cells using a microfluidic cell squeezer device. Biomicrofluidics. 7 (1), 011806 (2013).
- Hirawa, S., Masudo, T., Okada, T. Acoustic recognition of counterions in ion-exchange resins. Analytical Chemistry. 79 (7), 3003-3007 (2007).
- Joosse, S. A., Gorges, T. M., Biology Pantel, K. detection, and clinical implications of circulating tumor cells. EMBO Molecular Medicine. 7 (1), 1-11 (2015).
- Martin, O. A., Anderson, R. L., Narayan, K., MacManus, M. P. Does the mobilization of circulating tumour cells during cancer therapy cause metastasis. Nature Reviews Clinical Oncology. 14 (1), 32-44 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten