É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medição da Compressão de Células e Núcleos Baseados em Microdevice Acoustofluidic
Neste Artigo
Resumo
Aqui é apresentado um protocolo para construir um sistema rápido e não destrutivo para medir a compressão celular ou núcleo com base em microdispositivos acoustofluidos. Foram investigadas alterações nas propriedades mecânicas das células tumorais após transição epitelial-mesenquimal ou radiação ionizante, demonstrando a perspectiva de aplicação desse método em pesquisa científica e prática clínica.
Resumo
A mecânica celular desempenha um papel importante na metástase tumoral, transformação maligna das células e radiosensibilidade. Durante esses processos, estudar as propriedades mecânicas das células é muitas vezes desafiador. Métodos convencionais de medição baseados em contato, como compressão ou alongamento, são propensos a causar danos celulares, afetando a precisão da medição e a cultura celular subsequente. Medições em estado de aderente também podem afetar a precisão, especialmente após a irradiação, uma vez que a radiação ionizante irá achatar as células e aumentar a adesão. Aqui, foi desenvolvido um sistema de medição de mecânica celular baseado no método acoustofluido. A compressão celular pode ser obtida registrando a trajetória de movimento celular sob a ação da força acústica, que pode realizar uma medição rápida e não destrutiva em estado suspenso. Este artigo relata detalhadamente os protocolos para design de chips, preparação de amostras, registro de trajetória, extração e análise de parâmetros. A compressão de diferentes tipos de células tumorais foi medida com base neste método. A medição da compressão do núcleo também foi obtida pelo ajuste da frequência de ressonância da cerâmica piezoelétrica e da largura do microcanal. Combinada com a verificação do nível molecular dos experimentos de imunofluorescência, a compressão celular antes e depois da epitelial induzida por drogas à transição mesenquimal (EMT) foram comparadas. Além disso, foi revelada a mudança da compressão celular após a irradiação de raios-X com doses diferentes. O método de medição da mecânica celular proposto neste artigo é universal e flexível e possui amplas perspectivas de aplicação em pesquisa científica e prática clínica.
Introdução
As propriedades mecânicas celulares desempenham um papel importante na metástase tumoral, transformação maligna das células e radiosensibilidade 1,2. Para obter uma compreensão aprofundada do papel das propriedades mecânicas celulares no processo acima, a medição precisa da mecânica celular é crítica, e a medição não deve causar danos às células para posterior cultura e análise. O processo de medição deve ser o mais rápido possível, caso contrário, a viabilidade celular pode ser afetada se as células forem removidas do ambiente de cultivo por um longo tempo.
Os métodos de medição da mecânica celular existentes enfrentam algumas limitações. Alguns métodos, como citometria de torção magnética, pinças magnéticas e microrreheologia de rastreamento de partículas, causam danos celulares devido à introdução de partículas nas células 3,4,5. Métodos que medem pelo contato com células, como microscópio de força atômica (AFM), aspiração de micropipette, microcostrição e técnica de placa paralela, também são propensos a danos celulares e o throughput é difícil de aumentar 6,7,8. Além disso, a radiação ionizante irá achatar as células e aumentar sua adesão9; por isso, é necessário medir toda a mecânica celular em suspensão.
Em resposta aos desafios acima, foi desenvolvido um sistema de medição de mecânica celular baseado no método acoustofluidic 10,11,12,13,14. A largura do canal é combinada com o comprimento de onda acústico, criando assim um nó de onda em pé na linha média do microcanal. Sob a ação da força de radiação acústica, as células ou contas padrão podem se mover para o nó de pressão acústica. Uma vez que as propriedades físicas das contas padrão (tamanho, densidade e compressão) são conhecidas, a densidade de energia acústica pode ser determinada. Em seguida, a compressão celular pode ser obtida registrando as trajetórias de movimento das células no campo acústico. A medição não destrutiva de alta produtividade das células em estado de suspensão pode ser alcançada. Este artigo introduzirá o desenho do chip microfluido, o estabelecimento do sistema e as etapas de medição. A medição de vários tipos de células tumorais foi realizada para verificar a exatidão do método. O escopo de aplicação deste método foi estendido para estruturas subcelulares (como núcleo) ajustando a frequência de ressonância da cerâmica piezoelétrica e a largura do microcanal. Além disso, foram investigadas as alterações na compressão celular após a irradiação de paramédicos ou raios-X induzidos por drogas com diferentes doses. Os resultados demonstram a ampla aplicabilidade deste método como uma poderosa ferramenta para estudar a correlação entre alterações bioquímicas e propriedades mecânicas celulares.
Protocolo
1. Fabricação e montagem do microdispositivo acoustofluidic
- Fabricação do chip microfluido.
- Projete um chip de canal único com apenas uma entrada e saída, como mostrado na Figura 1. Para medir células, mantenha a seção transversal retangular do microcanal a 740 μm de largura e 100 μm de profundidade. Para medir o núcleo celular, altere a largura e a profundidade do microcanal para 250 μm e 100 μm, respectivamente.
- Prepare o microcanal no wafer de silício através de gravura de íons reativos. Sele a parte superior do microcanal com um pedaço de vidro transparente resistente ao calor por ligação anordica15. Lave os chips com um limpador ultrassônico por 10 minutos. Seque-os em um forno de secagem a 50 °C para uso posterior.
- Fabricar blocos de polidimtilsiloxano (PDMS).
- Adicione 30 mL de pré-polímero a uma antena de vidro de 100 mm (de diâmetro). Adicione 3 mL de agente de cura ao pré-polímero com uma seringa.
NOTA: A razão de volume do agente de cura e do pré-polímero é de 1:10. - Misture vigorosamente o pré-polímero PDMS e o agente de cura com uma haste de vidro por cerca de 10 minutos. Procure por bolhas de ar pequenas e uniformemente separadas na solução, que indicam que o PDMS pré-polímero e o agente de cura estão bem misturados.
- Coloque o prato de vidro em um desiccador a vácuo e evacue para 15-25 s. Repita este processo até que não haja bolhas de ar na mistura.
- Coloque o prato de vidro em um forno de secagem a 50 °C por 1h para permitir que a mistura cure. Após a incubação, use um bisturi para cortar o PDMS em blocos de tamanho adequado de cerca de 1,2 cm de comprimento e 1 cm de largura.
NOTA: O comprimento do bloco PDMS é consistente com a largura do chip, e a largura é selecionada para garantir que haja espaço suficiente no meio para a cerâmica piezoelétrica quando dois blocos PDMS são aderidos no chip.
- Adicione 30 mL de pré-polímero a uma antena de vidro de 100 mm (de diâmetro). Adicione 3 mL de agente de cura ao pré-polímero com uma seringa.
- Ligue o bloco PDMS ao chip.
- Furos no bloco PDMS para portas de entrada e saída com uma agulha oca de 1 mm de diâmetro. Coloque os blocos PDMS e o chip (lado de trás para cima) em um limpador de plasma por 1 min.
- Alinhe os orifícios nos blocos PDMS com a entrada e saída do chip. Pressione suavemente os blocos PDMS para o chip por 15 s. Isso deve fazer com que ocorra a ligação entre os blocos PDMS e a superfície do chip.
- Conecte o cateter de politetrafluoroetileno (PTFE) ao chip (Figura 2B).
- Corte dois pedaços de cateter PTFE com diâmetro interno de 0,8 mm e um comprimento de 10 cm. Dobre uma agulha de aço inoxidável com um diâmetro interno de 0,7 mm e um comprimento de 1,5 cm por 90° em uma forma L. Conecte-o a uma extremidade do cateter. Prepare dois cateteres com agulhas.
- Insira as agulhas de aço inoxidável nos orifícios dos blocos PDMS. Para a entrada, conecte uma agulha de distribuição de 19 G à outra extremidade do cateter como conector para uma seringa.
- Após completar as etapas acima, injete água deionizada para testar o aperto do canal geral. Impermeável à água significa um bom selo.
- Montagem cerâmica piezoelétrica (Figura 2C)
- Use um cortador de arame de diamante para cortar folhas de cerâmica piezoelétricas com diâmetro de 2 cm em quatro tiras com largura de 5 mm.
- Certifique-se de que a frequência ressonante da cerâmica piezoelétrica corresponde à largura do microcanal do chip. Para o microcanal de 740 μm e 250 μm de largura, utilize cerâmicas piezoelétricas com frequências de ressonância de 1 MHz e 3 MHz, respectivamente.
- Soldar fios em ambos os lados da cerâmica piezoelétrica em uma extremidade.
- Cole a cerâmica piezoelétrica no meio da parte de trás do chip com cola cianoacrilato.
- Para espalhar a cola uniformemente, coloque uma gota de cola na cerâmica piezoelétrica, suavize a cola com um palito de dente e remova o excesso de cola. Em seguida, pressione-o rapidamente sobre o chip e continue pressionando por cerca de 1 min. Certifique-se de que a cerâmica piezoelétrica e o chip estejam firmemente ligados e contatados uniformemente.
- Monte o microdispositivo (Figura 2D).
- Corte um pedaço de PDMS (cerca de 1,5 cm de comprimento e 1 cm de largura) como base do microdispositivo. Usando fita dupla face, coloque um lado da base na entrada e na saída de blocos PDMS e do outro lado em uma lâmina de vidro transparente. Fixar todo o microdispositivo no estágio do microscópio para manter o chip em um plano focal.
2. Preparação da amostra
- Preparação de soluções de partículas padrão de poliestireno.
- Adicione 0,05 mL de partícula de poliestireno (6 μm de diâmetro) (2,1 x 108 partícula/mL) a 10 mL de soro fisco tamponado de fosfato (PBS) e misture bem.
NOTA: Para reduzir o erro de medição causado pela alteração da densidade de energia acústica, a solução de partículas de poliestireno foi misturada com a solução amostral em cada experimento como calibração.
- Adicione 0,05 mL de partícula de poliestireno (6 μm de diâmetro) (2,1 x 108 partícula/mL) a 10 mL de soro fisco tamponado de fosfato (PBS) e misture bem.
- Preparação de suspensões celulares.
- Lave as células aderentes (por exemplo, MCF7, MDA-MB-231, HCT116) a 90% de confluência (~5 x 105 células) com PBS. Adicione 500 μL 0,25% de trippsina (1x) por 1-2 min a temperatura ambiente (25 °C). Remova a trippsina, adicione 1 mL de meio completo e forme uma suspensão celular por pipetação.
- Centrifugar a suspensão da célula a 100 x g por 5 min. Remova o supernatante e resuspende em 0,5-1 mL de PBS para obter uma suspensão celular. As células foram contadas com hemótmetro e a concentração foi de cerca de 3-5 x 105 células/mL.
- Preparação da suspensão do núcleo celular
- Realizar a etapa 2.2. Em seguida, remova o supernasce e adicione 200 μL de reagente de extração de proteína citoplasmática A (suplementado com 1% de TPM) por 20 μL de pelota celular (aproximadamente 5 milhões de células) e misture bem.
- Vórtice a mistura acima a 220 x g para 5 s, e, em seguida, coloque no banho de gelo por 10 minutos. Após a incubação, adicione 10 μL de reagente de extração de proteína citoplasmática B à solução.
- Vórtice a 220 x g para 5 s. Coloque no banho de gelo por 1 min e vórtice novamente a 220 x g para 5 s. Em seguida, finalmente centrífuga a 1.000 x g para 5 min a 4 °C.
NOTA: A razão de volume dos reagentes de extração de proteína citoplasmática A e B é de 20:1. - Remova o supernatante e resuspense a pelota em 1 mL de PBS. Em seguida, centrífuga a 1.000 x g a 4 °C por 4 min. Remova o supernatante e resuspend em 100 μL de PBS como suspensão do núcleo celular.
- Adicione o azul trypan à suspensão do núcleo celular acima e colorir à temperatura ambiente (25 °C) por 4 minutos. A razão de volume da solução azul trypan para a suspensão do núcleo é de 1:1. Conte o número de núcleos sob o microscópio invertido com um objetivo de 10x.
NOTA: Para identificar claramente os núcleos celulares sob o microscópio, é necessária uma coloração azul trypan. A solução azul trypan precisa estar em um banho de água de 37 °C por 10 minutos antes de ser usada para uma coloração eficaz. - Diluir a suspensão do núcleo celular acima com tampão PBS a uma concentração de 2-3 x 105 núcleos/mL. Filtre a suspensão do núcleo celular através de uma peneira de 70 μm.
3. Medir a compressão de células e núcleos
- Configurar o sistema de medição (Figura 3)
- Ligue a fonte de luz do microscópio e abra o software da câmera. Use o objetivo 4x para encontrar a posição média do microcanal, ou seja, a posição da cerâmica piezoelétrica.
- Conecte os fios e solde-os aos terminais positivos e negativos da saída do gerador de sinal na cerâmica piezoelétrica, respectivamente.
- Coloque a seringa na bomba de microinjeção e conecte-a ao cateter de entrada. Coloque um pequeno recipiente no final do cateter de saída para manter o fluido fluindo para fora do microcanal.
- Determinar parâmetros de medição
- Aspire a solução de partículas de poliestireno com a seringa e injete-a no microcanal do chip. Evite bolhas de ar no microcanal do chip para garantir uma medição precisa. Certifique-se de que as partículas estão distribuídas uniformemente no microcanal do chip.
NOTA: A medição pode ser realizada sem fluxo ou bomba de seringa. Se necessário, a taxa de fluxo da bomba de microinjeção deve ser definida como um valor adequado. Aqui, a faixa de fluxo é de 0-20 μL/h. - Defina a saída do gerador de sinal para um sinal seno com uma frequência de 1 MHz (3 MHz para medição do núcleo celular) e tensão de pico a pico (Vpp) de 10 V.
- Ajuste a frequência do sinal até que se observe que as partículas se movem em direção à linha média do microcanal e permanecem em movimento dianteiro ao longo da linha média depois de atingir a linha média (Figura 4).
NOTA: A velocidade das partículas que se movem em direção à linha média é determinada pela amplitude de tensão, que pode ser ajustada entre 5 Vpp e 20 Vpp.
- Aspire a solução de partículas de poliestireno com a seringa e injete-a no microcanal do chip. Evite bolhas de ar no microcanal do chip para garantir uma medição precisa. Certifique-se de que as partículas estão distribuídas uniformemente no microcanal do chip.
- Medir células e núcleos
- Misture a suspensão de célula ou núcleo de 1 mL com a solução de partículas padrão na proporção de 1:1 e injete-a no microcanal com uma seringa.
- Comece a gravar com a câmera CCD quando as células ou núcleos entrarem no campo de visão. Então, ligue o gerador de sinal. Pare de gravar quando as células ou núcleos chegarem à linha média.
- Enxágüe o microcanal com água deionizada, 75% de álcool e água deionizada em sequência para uso posterior.
4. Processamento de dados
- Mapear partículas ou trajetórias celulares.
- Importe o vídeo capturado para o software ImageJ: Arquivo > Abra> Selecionar pasta. Clique na forma de elipse na barra de ferramentas do software ImageJ para escolher uma célula de interesse e sua partícula adjacente (Figura 5).
- Como mostrado na Figura 5, parâmetros de medição predefinidos no software ImageJ como Analyze→ Set Measurement →Area, Centroid, Display Label.
- Tomar o quadro onde a célula alvo ou partícula sofre deslocamento longitudinal como o quadro inicial; registrar a posição do pixel e o tamanho da célula ou partícula em cada quadro até atingir a linha média do microcanal. Exporte os dados como um arquivo de planilha e repita a etapa até que as trajetórias para todas as células de interesse sejam obtidas.
- Coordenar transformação e correção.
- Registo as coordenadas de pixels dos quatro cantos do microcanal neste campo de visão como (0, y1), (0, y2), (x3, y3), (x4, y4). Aqui x3 = x4.
- Para cada ponto de medição (xi, yi), calcule a nova coordenada (xi', yi') após a correção de rotação usando as seguintes fórmulas:
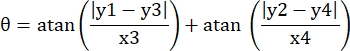
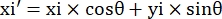

- Converta coordenadas de pixels em coordenadas de tamanho real. As coordenadas reais podem ser obtidas multiplicando coordenadas de pixels pela razão. A razão foi a largura real do microcanal dividido pela largura do pixel (H) do microcanal.
- Transforme e corrija as coordenadas de pixels das células e partículas obtidas na etapa 4.1 para os dados da trajetória de movimento final. Todas as coordenadas menos as coordenadas do canto inferior esquerdo, ou seja, (0, y2). A taxa de quadros do vídeo é de 40 quadros por segundo, então multiplique o número de quadros correspondentes a cada coordenada por 0,025 s para obter o tempo de movimento de partículas, obtendo assim a mudança da posição na direção y com o tempo.
- Calcular a densidade de energia acústica (Figura 6A,B).
- O movimento da célula ou partícula na direção Y é impulsionado pela força acústica Fac e força hidrodinâmica FD. Calcule a trajetória de movimento usando as seguintes fórmulas:
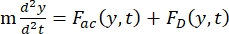 (1)
(1)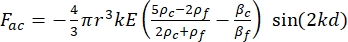 (2)
(2)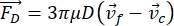 (3)
(3)
onde r e D são o raio e o diâmetro da célula ou partícula, ρ e β são a densidade e compressão, ν é o vetor de velocidade. Os subscritores c e f denotam a célula e o fluido, respectivamente. d é a distância do nó de pressão acústica mais próximo, μ é a viscosidade dinâmica do fluido, k é o número de onda, e E é a densidade de energia acústica.
NOTA: A densidade dos núcleos MCF7, HCT116, A549 e células foi de 1068 kg/m3, 1077 kg/m3, 1073 kg/m3 e 1155 kg/m3, respectivamente 12,16,17. - De acordo com as fórmulas descritas na etapa 4.3.1, utilize o software MATLAB para obter a solução numérica para a trajetória de partículas padrão sob o campo acústico com método de diferença finita.
- Dentro da faixa de campo acústico predefinido, altere a densidade de energia acústica e ajuste a solução numérica (obtida na etapa 4.3.2) e a trajetória de movimento medida (obtida na etapa 4.2) para a partícula padrão. Selecione o melhor resultado de ajuste de acordo com o erro quadrado médio de montagem. A densidade de energia acústica obtida aqui é usada como parâmetro para cálculo subsequente da compressão celular.
- O movimento da célula ou partícula na direção Y é impulsionado pela força acústica Fac e força hidrodinâmica FD. Calcule a trajetória de movimento usando as seguintes fórmulas:
- Calcular a compressão celular (Figura 6C,D).
- Defina a densidade de energia acústica ao valor obtido na etapa 4.3.3.
- De acordo com as fórmulas descritas na etapa 4.3.1, utilize o software MATLAB para obter a solução numérica para a trajetória celular sob o campo acústico com método de diferença finita.
- Semelhante ao passo 4.3.3, dentro da faixa de compressão predefinida, altere a compressão e ajuste a solução numérica (obtida na etapa 4.4.2) e a trajetória de movimento medida para a célula (obtida na etapa 4.2). Use o coeficiente de compressão correspondente ao melhor resultado de montagem como a compressão celular medida.
Resultados
Aqui, o trabalho apresentou um protocolo para a construção de um sistema de medição de compressão celular rápida e não destrutiva baseado em microdispositivo acoustofluido e demonstrou suas vantagens para medir células e núcleos em diferentes situações. A Figura 1 mostra o esquema do canal microfluido. Os componentes e a montagem do microdispositivo acoustofluidic são mostrados na Figura 2. A Figura 3 mostra a configura?...
Discussão
Os métodos de medição da mecânica celular comumente utilizados são AFM, aspiração de micropipette, métodos de microfluidos, técnica de placa paralela, pinça óptica, maca óptica e métodos acústicos20. Os métodos de microfluidos podem trabalhar com três abordagens: micro-constrição, fluxo extensal e fluxo de cisalhamento. Entre elas, maca óptica, pinça óptica, métodos acústicos, fluxo extensão e abordagens de fluxo de cisalhamento são medidas sem contato. Em contraste com as...
Divulgações
Os autores não têm interesses financeiros concorrentes ou outros conflitos de interesse.
Agradecimentos
Este estudo foi apoiado pela Fundação Nacional de Ciência Natural da China (Grant numbers 12075330 e U1932165) e pela Natural Science Foundation of Guangdong Province, China (Grant number 2020A1515010270).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin(1x) | GIBCO | 15050-065 | |
| 502 glue | Evo-bond | cyanoacrylate glue | |
| A549 | ATCC | CCL-185 | lung adenocarcinoma |
| Cytonucleoprotein and cytoplasmic protein extraction kit | Beyotime | P0027 | Contains cytoplasmic protein extraction reagents A and B |
| Dulbecco’s modified Eagle medium (DMEM) | corning | 10-013-CVRC | |
| Fetal Bovine Srum(FBS) | AUSGENEX | FBS500-S | |
| HCT116 | ATCC | CCL247 | colorectal carcinoma |
| Heat-resistant glass | Pyrex | ||
| Leibovitz’s L-15 medium | GIBCO | 11415-064 | |
| MCF-7 | ATCC | HTB-22 | breast Adenocarcinoma |
| MDA-MB-231 | ATCC | HTB-26 | breast Adenocarcinoma |
| Minimum Essential Medium (MEM) | corning | 10-010-CV | |
| Penicillin-Streptomycin | GIBCO | 15140-122 | |
| Phosphate buffer | corning | 21-040-cvc | |
| PMSF | Beyotime | ST506 | 100mM |
| Polybead Polystyrene Red Dyed Microsphere | polysciences | 15714 | The diameter of microshpere is 6.00µm |
| propidium iodide(PI) | Sigma-Aldrich | P4170 | |
| SYLGARD 184Silicone ELASTOMER | Dow-Corning | 1673921 | Contains prepolymers and curing agents |
| Trypan Blue | Beyotime | C0011 |
Referências
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews. Cancer. 11 (7), 512-522 (2011).
- Frame, F. M., et al. HDAC inhibitor confers radiosensitivity to prostate stem-like cells. British Journal of Cancer. 109 (12), 3023-3033 (2013).
- Tseng, Y., Kole, T. P., Wirtz, D. Micromechanical mapping of live cells by multiple-particle-tracking microrheology. Biophysical Journal. 83 (6), 3162-3176 (2002).
- Möller, W., Brown, D. M., Kreyling, W. G., Stone, V. Ultrafine particles cause cytoskeletal dysfunctions in macrophages: role of intracellular calcium. Particle and Fibre Toxicology. 2, 7 (2005).
- Wang, X., et al. A three-dimensional magnetic tweezer system for intraembryonic navigation and measurement. IEEE Transactions on Robotics. 34 (1), 240-247 (2018).
- Machida, S., et al. Direct manipulation of intracellular stress fibres using a hook-shaped AFM probe. Nanotechnology. 21 (38), 385102 (2010).
- Bufi, N., et al. Human primary immune cells exhibit distinct mechanical properties that are modified by inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Jung, J. -. W., et al. Ionising radiation induces changes associated with epithelial-mesenchymal transdifferentiation and increased cell motility of A549 lung epithelial cells. European Journal of Cancer. 43 (7), 1214-1224 (2007).
- Hartono, D., et al. On-chip measurements of cell compressibility via acoustic radiation. Lab-on-a-Chip. 11 (23), 4072-4080 (2011).
- Sitters, G., et al. Acoustic force spectroscopy. Nature Methods. 12 (1), 47-50 (2015).
- Augustsson, P., Karlsen, J. T., Su, H. -. W., Bruus, H., Voldman, J. Iso-acoustic focusing of cells for size-insensitive acousto-mechanical phenotyping. Nature Communications. 7 (1), 11556 (2016).
- Cushing, K. W., et al. Ultrasound characterization of microbead and cell suspensions by speed of sound measurements of neutrally buoyant samples. Analytical Chemistry. 89 (17), 8917-8923 (2017).
- Riaud, A., Wang, W., Thai, A. L. P., Taly, V. Mechanical characterization of cells and microspheres sorted by acoustophoresis with in-line resistive pulse sensing. Physical Review Applied. 13 (3), 034058 (2020).
- Petersson, F., Aberg, L., Swärd-Nilsson, A. -. M., Free Laurell, T. flow acoustophoresis: microfluidic-based mode of particle and cell separation. Analytical Chemistry. 79 (14), 5117-5123 (2007).
- Griwatz, C., Brandt, B., Assmann, G., Zänker, K. S. An immunological enrichment method for epithelial cells from peripheral blood. Journal of Immunological Methods. 183 (2), 251-265 (1995).
- Katholnig, K., Poglitsch, M., Hengstschläger, M., Weichhart, T. Lysis gradient centrifugation: a flexible method for the isolation of nuclei from primary cells. Methods in Molecular Biology. 1228, 15-23 (2015).
- Fu, Q., Zhang, Y., Huang, T., Liang, Y., Liu, Y. Measurement of cell compressibility changes during epithelial-mesenchymal transition based on acoustofluidic microdevice. Biomicrofluidics. 15 (6), 064101 (2021).
- Zhang, Y., et al. Ionizing radiation-induced DNA damage responses affect cell compressibility. Biochemical and Biophysical Research Communications. 603, 116-122 (2022).
- Hao, Y., et al. Mechanical properties of single cells: Measurement methods and applications. Biotechnology Advances. 45, 107648 (2020).
- Yousafzai, M., et al. Effect of neighboring cells on cell stiffness measured by optical tweezers indentation. Journal of Biomedical Optics. 21 (5), 057004 (2016).
- Wei, M. -. T., et al. A comparative study of living cell micromechanical properties by oscillatory optical tweezers. Optics Express. 16 (12), 8594-8603 (2008).
- Khan, Z. S., Vanapalli, S. A. Probing the mechanical properties of brain cancer cells using a microfluidic cell squeezer device. Biomicrofluidics. 7 (1), 011806 (2013).
- Hirawa, S., Masudo, T., Okada, T. Acoustic recognition of counterions in ion-exchange resins. Analytical Chemistry. 79 (7), 3003-3007 (2007).
- Joosse, S. A., Gorges, T. M., Biology Pantel, K. detection, and clinical implications of circulating tumor cells. EMBO Molecular Medicine. 7 (1), 1-11 (2015).
- Martin, O. A., Anderson, R. L., Narayan, K., MacManus, M. P. Does the mobilization of circulating tumour cells during cancer therapy cause metastasis. Nature Reviews Clinical Oncology. 14 (1), 32-44 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados