Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure de la compressibilité de la cellule et du noyau basée sur un microdispositif acoustofluidique
Dans cet article
Résumé
Ici, un protocole est présenté pour construire un système rapide et non destructif de mesure de la compressibilité des cellules ou des noyaux basé sur un microdispositif acoustofluidique. Les modifications des propriétés mécaniques des cellules tumorales après une transition épithéliale-mésenchymateuse ou des rayonnements ionisants ont été étudiées, démontrant les perspectives d’application de cette méthode dans la recherche scientifique et la pratique clinique.
Résumé
La mécanique cellulaire joue un rôle important dans les métastases tumorales, la transformation maligne des cellules et la radiosensibilité. Au cours de ces processus, l’étude des propriétés mécaniques des cellules est souvent difficile. Les méthodes de mesure conventionnelles basées sur le contact, telles que la compression ou l’étirement, sont susceptibles de causer des dommages cellulaires, affectant la précision de la mesure et la culture cellulaire ultérieure. Les mesures à l’état adhérent peuvent également affecter la précision, en particulier après l’irradiation, car les rayonnements ionisants aplatiront les cellules et amélioreront l’adhésion. Ici, un système de mesure de la mécanique cellulaire basé sur la méthode acoustofluidique a été développé. La compressibilité de la cellule peut être obtenue en enregistrant la trajectoire du mouvement de la cellule sous l’action de la force acoustique, ce qui permet de réaliser une mesure rapide et non destructive à l’état suspendu. Cet article décrit en détail les protocoles de conception de puces, de préparation des échantillons, d’enregistrement de trajectoire, d’extraction et d’analyse des paramètres. La compressibilité de différents types de cellules tumorales a été mesurée sur la base de cette méthode. La mesure de la compressibilité du noyau a également été réalisée en ajustant la fréquence de résonance de la céramique piézoélectrique et la largeur du microcanal. Combiné à la vérification au niveau moléculaire des expériences d’immunofluorescence, la compressibilité cellulaire avant et après la transition épithéliale à mésenchymateuse induite par le médicament (EMT) a été comparée. En outre, le changement de compressibilité cellulaire après l’irradiation aux rayons X avec différentes doses a été révélé. La méthode de mesure de la mécanique cellulaire proposée dans cet article est universelle et flexible et a de larges perspectives d’application dans la recherche scientifique et la pratique clinique.
Introduction
Les propriétés mécaniques cellulaires jouent un rôle important dans les métastases tumorales, la transformation maligne des cellules et la radiosensibilité 1,2. Pour acquérir une compréhension approfondie du rôle des propriétés mécaniques cellulaires dans le processus ci-dessus, une mesure précise de la mécanique cellulaire est essentielle, et la mesure ne doit pas endommager les cellules pour une culture et une analyse ultérieures. Le processus de mesure doit être aussi rapide que possible, sinon la viabilité cellulaire peut être affectée si les cellules sont retirées de l’environnement de culture pendant une longue période.
Les méthodes de mesure existantes de la mécanique cellulaire font face à certaines limites. Certaines méthodes, telles que la cytométrie par torsion magnétique, les pinces magnétiques et la microrhéologie de suivi des particules, causent des dommages cellulaires en raison de l’introduction de particules dans les cellules 3,4,5. Les méthodes de mesure par contact avec des cellules, telles que le microscope à force atomique (AFM), l’aspiration par micropipette, la microconstriction et la technique à plaques parallèles, sont également sujettes aux dommages cellulaires et le débit est difficile à augmenter 6,7,8. De plus, les rayonnements ionisants vont aplatir les cellules et augmenter leur adhérence9 ; Il est donc nécessaire de mesurer la mécanique des cellules entières en suspension.
En réponse aux défis ci-dessus, un système de mesure de la mécanique cellulaire basé sur la méthode acoustofluidique 10,11,12,13,14 a été développé. La largeur du canal est adaptée à la demi-longueur d’onde acoustique, créant ainsi un nœud d’onde stationnaire à la ligne médiane du microcanal. Sous l’action de la force de rayonnement acoustique, les cellules ou les billes standard peuvent se déplacer vers le nœud de pression acoustique. Comme les propriétés physiques des billes standard (taille, densité et compressibilité) sont connues, la densité d’énergie acoustique peut être déterminée. Ensuite, la compressibilité cellulaire peut être obtenue en enregistrant les trajectoires de mouvement des cellules dans le champ acoustique. Une mesure non destructive à haut débit des cellules en suspension peut être réalisée. Cet article présentera la conception de la puce microfluidique, la mise en place du système et les étapes de mesure. La mesure de différents types de cellules tumorales a été effectuée pour vérifier la précision de la méthode. Le champ d’application de cette méthode avait été étendu aux structures subcellulaires (telles que le noyau) en ajustant la fréquence de résonance de la céramique piézoélectrique et la largeur du microcanal. En outre, les changements dans la compressibilité cellulaire après l’EMT induite par le médicament ou l’irradiation aux rayons X avec différentes doses ont été étudiés. Les résultats démontrent la large applicabilité de cette méthode en tant qu’outil puissant pour étudier la corrélation entre les changements biochimiques et les propriétés mécaniques cellulaires.
Protocole
1. Fabrication et assemblage du microdispositif acoustofluidique
- Fabrication de la puce microfluidique.
- Concevez une puce monocanal avec une seule entrée et une seule sortie, comme illustré à la Figure 1. Pour les cellules de mesure, maintenir la section transversale rectangulaire du microcanal à 740 μm de large et 100 μm de profondeur. Pour mesurer le noyau cellulaire, modifiez la largeur et la profondeur du microcanal à 250 μm et 100 μm, respectivement.
- Préparez le microcanal sur une plaquette de silicium par gravure ionique réactive. Scellez le haut du microcanal avec un morceau de verre transparent résistant à la chaleur par collage anodique15. Lavez les copeaux avec un nettoyeur à ultrasons pendant 10 min. Séchez-les dans une étuve de séchage à 50 °C pour une utilisation ultérieure.
- Fabriquer des blocs de polydiméthylsiloxane (PDMS).
- Ajouter 30 mL de prépolymère à une capsule en verre de 100 mm (diamètre). Ajouter 3 mL d’agent de durcissement au prépolymère avec une seringue.
NOTE: Le rapport volumique de l’agent de durcissement et du prépolymère est de 1:10. - Mélanger vigoureusement le prépolymère PDMS et l’agent de durcissement avec une tige de verre pendant environ 10 min. Recherchez de petites bulles d’air uniformément séparées dans la solution, ce qui indique que le prépolymère PDMS et l’agent de durcissement sont bien mélangés.
- Placer le plat en verre dans un dessiccateur sous vide et évacuer pendant 15-25 s. Répétez ce processus jusqu’à ce qu’il n’y ait plus de bulles d’air dans le mélange.
- Placer le plat en verre dans une étuve de séchage réglée à 50 °C pendant 1 h pour permettre au mélange de durcir. Après l’incubation, utilisez un scalpel pour couper le PDMS en blocs de taille appropriée d’environ 1,2 cm de long et 1 cm de large.
REMARQUE: La longueur du bloc PDMS est cohérente avec la largeur de la puce, et la largeur est sélectionnée pour s’assurer qu’il y a suffisamment d’espace au milieu pour la céramique piézoélectrique lorsque deux blocs PDMS sont collés sur la puce.
- Ajouter 30 mL de prépolymère à une capsule en verre de 100 mm (diamètre). Ajouter 3 mL d’agent de durcissement au prépolymère avec une seringue.
- Liez le bloc PDMS à la puce.
- Perforez des trous dans le bloc PDMS pour les orifices d’entrée et de sortie avec une aiguille creuse de 1 mm de diamètre. Mettez les blocs PDMS et la puce (dos vers le haut) dans un nettoyant plasma pendant 1 min.
- Alignez les trous sur les blocs PDMS avec l’entrée et la sortie de la puce. Appuyez doucement sur les blocs PDMS sur la puce pendant 15 s. Cela devrait provoquer une liaison entre les blocs PDMS et la surface de la puce.
- Connectez le cathéter en polytétrafluoroéthylène (PTFE) à la puce (Figure 2B).
- Couper deux morceaux de cathéter en PTFE d’un diamètre intérieur de 0,8 mm et d’une longueur de 10 cm. Pliez une aiguille en acier inoxydable d’un diamètre intérieur de 0,7 mm et d’une longueur de 1,5 cm sur 90° en forme de L. Connectez-le à une extrémité du cathéter. Préparez deux cathéters de ce type avec des aiguilles.
- Insérez les aiguilles en acier inoxydable dans les trous des blocs PDMS. Pour l’entrée, connectez une aiguille de distribution de 19 G à l’autre extrémité du cathéter comme connecteur pour une seringue.
- Après avoir terminé les étapes ci-dessus, injectez de l’eau désionisée pour tester l’étanchéité de l’ensemble du canal. Imperméable à l’eau signifie une bonne étanchéité.
- Ensemble céramique piézoélectrique (figure 2C)
- Utilisez un coupe-fil diamanté pour couper des feuilles de céramique piézoélectriques d’un diamètre de 2 cm en quatre bandes d’une largeur de 5 mm.
- Assurez-vous que la fréquence de résonance de la céramique piézoélectrique correspond à la largeur du microcanal de la puce. Pour les microcanaux de 740 μm et 250 μm de large, utilisez des céramiques piézoélectriques avec des fréquences de résonance de 1 MHz et 3 MHz, respectivement.
- Souder des fils des deux côtés de la céramique piézoélectrique à une extrémité.
- Collez la céramique piézoélectrique au milieu du dos de la puce avec de la colle cyanoacrylate.
- Pour étaler la colle uniformément, placez une goutte de colle sur la céramique piézoélectrique, lissez la colle avec un cure-dent et retirez l’excès de colle. Ensuite, appuyez rapidement sur la puce et continuez à appuyer pendant environ 1 min. Assurez-vous que la céramique piézoélectrique et la puce sont fermement collées et uniformément contactées.
- Montez le microdispositif (Figure 2D).
- Découpez un morceau de PDMS (environ 1,5 cm de long et 1 cm de large) comme base du microdispositif. À l’aide de ruban adhésif double face, collez un côté de la base aux blocs PDMS d’entrée et de sortie, et l’autre côté à une lame de verre transparente. Fixez l’ensemble du microdispositif à l’étage du microscope pour maintenir la puce dans un plan focal.
2. Préparation des échantillons
- Préparation de solutions de particules étalons de polystyrène.
- Ajouter 0,05 mL de solution de particules de polystyrène (6 μm de diamètre) (2,1 x 108 particules/mL) à 10 mL de solution saline tamponnée au phosphate (PBS) et bien mélanger.
NOTE: Afin de réduire l’erreur de mesure causée par le changement de la densité d’énergie acoustique, la solution de particules de polystyrène a été mélangée avec la solution échantillon dans chaque expérience comme étalonnage.
- Ajouter 0,05 mL de solution de particules de polystyrène (6 μm de diamètre) (2,1 x 108 particules/mL) à 10 mL de solution saline tamponnée au phosphate (PBS) et bien mélanger.
- Préparation de suspensions cellulaires.
- Lavez les cellules adhérentes (par exemple, MCF7, MDA-MB-231, HCT116) à 90% de confluence (~5 x 105 cellules) avec PBS. Ajouter 500 μL de trypsine à 0,25% (1x) pendant 1-2 min à température ambiante (25 °C). Retirer la trypsine, ajouter 1 mL de milieu complet et former une suspension cellulaire par pipetage.
- Centrifuger la suspension cellulaire à 100 x g pendant 5 min. Retirer le surnageant et remettre en suspension dans 0,5-1 mL de PBS afin d’obtenir une suspension cellulaire. Les cellules ont été comptées à l’aide d’un hémocytomètre et la concentration était d’environ 3-5 x 105 cellules/mL.
- Préparation de la suspension du noyau cellulaire
- Effectuez l’étape 2.2. Ensuite, retirez le surnageant et ajoutez 200 μL de réactif d’extraction de protéines cytoplasmiques A (complété par 1% PMSF) par pastille cellulaire de 20 μL (environ 5 millions de cellules) et mélangez bien.
- Vortex le mélange ci-dessus à 220 x g pendant 5 s, puis placer sur un bain de glace pendant 10 min. Après l’incubation, ajouter 10 μL de réactif d’extraction de protéines cytoplasmiques B à la solution.
- Vortex à 220 x g pendant 5 s. Placer sur un bain de glace pendant 1 min et vortex à nouveau à 220 x g pendant 5 s. Enfin, centrifuger à 1 000 x g pendant 5 min à 4 °C.
REMARQUE: Le rapport volumique des réactifs d’extraction de protéines cytoplasmiques A et B est de 20: 1. - Retirer le surnageant et remettre en suspension la pastille dans 1 mL de PBS. Ensuite, centrifuger à 1 000 x g à 4 °C pendant 4 min. Retirer le surnageant et remettre en suspension dans 100 μL de PBS comme suspension du noyau cellulaire.
- Ajouter le bleu de trypan à la suspension du noyau cellulaire ci-dessus et colorer à température ambiante (25 °C) pendant 4 min. Le rapport volumique de la solution de bleu de trypan à la suspension du noyau est de 1:1. Comptez le nombre de noyaux sous le microscope inversé avec un objectif 10x.
REMARQUE: Pour identifier clairement les noyaux cellulaires au microscope, une coloration au bleu de trypan est nécessaire. La solution de bleu de trypan doit être dans un bain-marie à 37 °C pendant 10 minutes avant utilisation pour une coloration efficace. - Diluer la suspension du noyau cellulaire ci-dessus avec un tampon PBS à une concentration de 2-3 x 105 noyau/mL. Filtrer la suspension du noyau cellulaire à travers un tamis de 70 μm.
3. Mesure de la compressibilité de la cellule et du noyau
- Configuration du système de mesure (Figure 3)
- Allumez la source lumineuse du microscope et ouvrez le logiciel de l’appareil photo. Utilisez l’objectif 4x pour trouver la position médiane du microcanal, c’est-à-dire la position de la céramique piézoélectrique.
- Connectez les fils et soudez-les aux bornes positives et négatives de la sortie du générateur de signaux sur la céramique piézoélectrique, respectivement.
- Placez la seringue sur la pompe de micro-injection et connectez-la au cathéter d’admission. Placez un petit récipient à l’extrémité du cathéter de sortie pour retenir le fluide qui s’écoule du microcanal.
- Déterminer les paramètres de mesure
- Aspirez la solution de particules de polystyrène avec la seringue et injectez-la dans le microcanal de la puce. Évitez les bulles d’air dans le microcanal de la puce pour assurer une mesure précise. Assurez-vous que les particules sont réparties uniformément dans le microcanal de la puce.
REMARQUE: La mesure peut être effectuée sans débit ni pompe à seringue. Si nécessaire, le débit de la pompe de micro-injection doit être réglé sur une valeur appropriée. Ici, la plage de débit est de 0 à 20 μL / h. - Réglez la sortie du générateur de signaux sur un signal sinusoïdal avec une fréquence de 1 MHz (3 MHz pour la mesure du noyau de cellule) et une tension de crête à crête (Vpp) de 10 V.
- Ajustez la fréquence du signal jusqu’à ce que l’on observe que les particules se déplacent vers la ligne médiane du microcanal et restent en mouvement vers l’avant le long de la ligne médiane après avoir atteint la ligne médiane (Figure 4).
REMARQUE: La vitesse des particules se déplaçant vers la ligne médiane est déterminée par l’amplitude de tension, qui peut être ajustée entre 5 Vpp et 20 Vpp.
- Aspirez la solution de particules de polystyrène avec la seringue et injectez-la dans le microcanal de la puce. Évitez les bulles d’air dans le microcanal de la puce pour assurer une mesure précise. Assurez-vous que les particules sont réparties uniformément dans le microcanal de la puce.
- Mesurer les cellules et les noyaux
- Mélanger 1 mL de suspension cellulaire ou de noyau avec la solution de particules étalon dans un rapport de 1:1 et l’injecter dans le microcanal avec une seringue.
- Commencez à enregistrer avec la caméra CCD lorsque les cellules ou les noyaux entrent dans le champ de vision. Ensuite, allumez le générateur de signaux. Arrêtez l’enregistrement lorsque les cellules ou les noyaux atteignent la ligne médiane.
- Rincez le microcanal avec de l’eau désionisée, de l’alcool à 75% et de l’eau désionisée en séquence pour une utilisation ultérieure.
4. Traitement des données
- Cartographier les trajectoires des particules ou des cellules.
- Importez la vidéo capturée dans le logiciel ImageJ : Fichier > Ouvrir> Sélectionnez un dossier. Cliquez sur la forme de l’ellipse dans la barre d’outils du logiciel ImageJ pour choisir une cellule d’intérêt et sa particule adjacente (Figure 5).
- Comme illustré à la figure 5, préréglez les paramètres de mesure dans le logiciel ImageJ comme Analyse→ Définir la mesure →surface, Centroïde, Étiquette d’affichage.
- Prendre le cadre où la cellule ou la particule cible subit un déplacement longitudinal comme cadre de départ; Enregistrez la position et la taille des pixels de la cellule ou de la particule dans chaque image jusqu’à ce qu’elle atteigne la ligne médiane du microcanal. Exportez les données sous forme de feuille de calcul et répétez l’étape jusqu’à ce que les trajectoires de toutes les cellules d’intérêt soient obtenues.
- Coordonner la transformation et la correction.
- Enregistrez les coordonnées en pixels des quatre coins du microcanal dans ce champ de vision sous la forme (0, y1), (0, y2), (x3, y3), (x4, y4). Ici x3 = x4.
- Pour chaque point de mesure (xi, yi), calculer la nouvelle coordonnée (xi', yi') après correction de rotation à l’aide des formules suivantes:
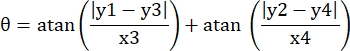
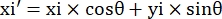

- Convertissez les coordonnées des pixels en coordonnées de taille réelle. Les coordonnées réelles peuvent être obtenues en multipliant les coordonnées de pixels par le rapport. Le rapport était la largeur réelle du microcanal divisée par la largeur en pixels (H) du microcanal.
- Transformez et corrigez les coordonnées de pixels des cellules et des particules obtenues à l’étape 4.1 en données de trajectoire de mouvement finale. Toutes les coordonnées moins les coordonnées du coin inférieur gauche, c’est-à-dire (0, y2). La fréquence d’images de la vidéo est de 40 images par seconde, multipliez donc le nombre d’images correspondant à chaque coordonnée par 0,025 s pour obtenir le temps de mouvement des particules, obtenant ainsi le changement de position dans la direction y avec le temps.
- Calculer la densité d’énergie acoustique (Figure 6A,B).
- Le mouvement de la cellule ou de la particule dans la direction Y est entraîné par la force acoustique F ac et la force hydrodynamique FD. Calculez la trajectoire de mouvement à l’aide des formules suivantes :
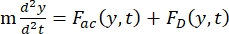 (1)
(1)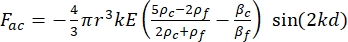 (2)
(2)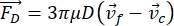 (3)
(3)
où r et D sont le rayon et le diamètre de la cellule ou de la particule, ρ et β sont la densité et la compressibilité, ν est le vecteur vitesse. Les indices c et f désignent respectivement la cellule et le fluide. d est la distance du nœud de pression acoustique le plus proche, μ est la viscosité dynamique du fluide, k est le nombre d’onde et E est la densité d’énergie acoustique.
NOTE: La densité de MCF7, HCT116, A549 et des noyaux cellulaires était de 1068 kg / m 3, 1077 kg / m 3, 1073 kg / m 3 et 1155 kg / m 3, respectivement 12,16,17. - Selon les formules décrites à l’étape 4.3.1, utilisez le logiciel MATLAB pour obtenir la solution numérique de la trajectoire standard des particules sous la méthode du champ acoustique avec différence finie.
- Dans la plage de champ acoustique prédéfinie, modifier la densité d’énergie acoustique et ajuster la solution numérique (obtenue à l’étape 4.3.2) et la trajectoire de mouvement mesurée (obtenue à l’étape 4.2) pour la particule standard. Sélectionnez le meilleur résultat d’ajustement en fonction de l’erreur quadratique moyenne d’ajustement. La densité d’énergie acoustique obtenue ici est utilisée comme paramètre pour le calcul ultérieur de la compressibilité de la cellule.
- Le mouvement de la cellule ou de la particule dans la direction Y est entraîné par la force acoustique F ac et la force hydrodynamique FD. Calculez la trajectoire de mouvement à l’aide des formules suivantes :
- Calculer la compressibilité de la cellule (Figure 6C,D).
- Réglez la densité d’énergie acoustique sur la valeur obtenue à l’étape 4.3.3.
- Selon les formules décrites à l’étape 4.3.1, utilisez le logiciel MATLAB pour obtenir la solution numérique de la trajectoire de la cellule sous la méthode du champ acoustique avec différence finie.
- Comme à l’étape 4.3.3, dans la plage de compressibilité prédéfinie, modifier la compressibilité et ajuster la solution numérique (obtenue à l’étape 4.4.2) et la trajectoire de mouvement mesurée pour la cellule (obtenue à l’étape 4.2). Utiliser le coefficient de compressibilité correspondant au meilleur résultat d’ajustement comme compressibilité de cellule mesurée.
Résultats
Ici, le travail a présenté un protocole pour la construction d’un système de mesure de compressibilité cellulaire rapide et non destructif basé sur un microdispositif acoustofluidique et a démontré ses avantages pour mesurer la cellule et le noyau dans différentes situations. La figure 1 montre le schéma du canal microfluidique. Les composants et l’assemblage du microdispositif acoustofluidique sont illustrés à la figure 2. La...
Discussion
Les méthodes de mesure de la mécanique cellulaire couramment utilisées sont l’AFM, l’aspiration par micropipette, les méthodes microfluidiques, la technique des plaques parallèles, les pinces optiques, les civières optiques et les méthodes acoustiques20. Les méthodes microfluidiques peuvent fonctionner avec trois approches : la micro-constriction, l’écoulement d’extension et l’écoulement de cisaillement. Parmi eux, les civières optiques, les pincettes optiques, les méthodes a...
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts financiers concurrents ou d’autres conflits d’intérêts.
Remerciements
Cette étude a été soutenue par la Fondation nationale des sciences naturelles de Chine (numéros de subvention 12075330 et U1932165) et la Fondation des sciences naturelles de la province du Guangdong, Chine (numéro de subvention 2020A1515010270).
matériels
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin(1x) | GIBCO | 15050-065 | |
| 502 glue | Evo-bond | cyanoacrylate glue | |
| A549 | ATCC | CCL-185 | lung adenocarcinoma |
| Cytonucleoprotein and cytoplasmic protein extraction kit | Beyotime | P0027 | Contains cytoplasmic protein extraction reagents A and B |
| Dulbecco’s modified Eagle medium (DMEM) | corning | 10-013-CVRC | |
| Fetal Bovine Srum(FBS) | AUSGENEX | FBS500-S | |
| HCT116 | ATCC | CCL247 | colorectal carcinoma |
| Heat-resistant glass | Pyrex | ||
| Leibovitz’s L-15 medium | GIBCO | 11415-064 | |
| MCF-7 | ATCC | HTB-22 | breast Adenocarcinoma |
| MDA-MB-231 | ATCC | HTB-26 | breast Adenocarcinoma |
| Minimum Essential Medium (MEM) | corning | 10-010-CV | |
| Penicillin-Streptomycin | GIBCO | 15140-122 | |
| Phosphate buffer | corning | 21-040-cvc | |
| PMSF | Beyotime | ST506 | 100mM |
| Polybead Polystyrene Red Dyed Microsphere | polysciences | 15714 | The diameter of microshpere is 6.00µm |
| propidium iodide(PI) | Sigma-Aldrich | P4170 | |
| SYLGARD 184Silicone ELASTOMER | Dow-Corning | 1673921 | Contains prepolymers and curing agents |
| Trypan Blue | Beyotime | C0011 |
Références
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews. Cancer. 11 (7), 512-522 (2011).
- Frame, F. M., et al. HDAC inhibitor confers radiosensitivity to prostate stem-like cells. British Journal of Cancer. 109 (12), 3023-3033 (2013).
- Tseng, Y., Kole, T. P., Wirtz, D. Micromechanical mapping of live cells by multiple-particle-tracking microrheology. Biophysical Journal. 83 (6), 3162-3176 (2002).
- Möller, W., Brown, D. M., Kreyling, W. G., Stone, V. Ultrafine particles cause cytoskeletal dysfunctions in macrophages: role of intracellular calcium. Particle and Fibre Toxicology. 2, 7 (2005).
- Wang, X., et al. A three-dimensional magnetic tweezer system for intraembryonic navigation and measurement. IEEE Transactions on Robotics. 34 (1), 240-247 (2018).
- Machida, S., et al. Direct manipulation of intracellular stress fibres using a hook-shaped AFM probe. Nanotechnology. 21 (38), 385102 (2010).
- Bufi, N., et al. Human primary immune cells exhibit distinct mechanical properties that are modified by inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Jung, J. -. W., et al. Ionising radiation induces changes associated with epithelial-mesenchymal transdifferentiation and increased cell motility of A549 lung epithelial cells. European Journal of Cancer. 43 (7), 1214-1224 (2007).
- Hartono, D., et al. On-chip measurements of cell compressibility via acoustic radiation. Lab-on-a-Chip. 11 (23), 4072-4080 (2011).
- Sitters, G., et al. Acoustic force spectroscopy. Nature Methods. 12 (1), 47-50 (2015).
- Augustsson, P., Karlsen, J. T., Su, H. -. W., Bruus, H., Voldman, J. Iso-acoustic focusing of cells for size-insensitive acousto-mechanical phenotyping. Nature Communications. 7 (1), 11556 (2016).
- Cushing, K. W., et al. Ultrasound characterization of microbead and cell suspensions by speed of sound measurements of neutrally buoyant samples. Analytical Chemistry. 89 (17), 8917-8923 (2017).
- Riaud, A., Wang, W., Thai, A. L. P., Taly, V. Mechanical characterization of cells and microspheres sorted by acoustophoresis with in-line resistive pulse sensing. Physical Review Applied. 13 (3), 034058 (2020).
- Petersson, F., Aberg, L., Swärd-Nilsson, A. -. M., Free Laurell, T. flow acoustophoresis: microfluidic-based mode of particle and cell separation. Analytical Chemistry. 79 (14), 5117-5123 (2007).
- Griwatz, C., Brandt, B., Assmann, G., Zänker, K. S. An immunological enrichment method for epithelial cells from peripheral blood. Journal of Immunological Methods. 183 (2), 251-265 (1995).
- Katholnig, K., Poglitsch, M., Hengstschläger, M., Weichhart, T. Lysis gradient centrifugation: a flexible method for the isolation of nuclei from primary cells. Methods in Molecular Biology. 1228, 15-23 (2015).
- Fu, Q., Zhang, Y., Huang, T., Liang, Y., Liu, Y. Measurement of cell compressibility changes during epithelial-mesenchymal transition based on acoustofluidic microdevice. Biomicrofluidics. 15 (6), 064101 (2021).
- Zhang, Y., et al. Ionizing radiation-induced DNA damage responses affect cell compressibility. Biochemical and Biophysical Research Communications. 603, 116-122 (2022).
- Hao, Y., et al. Mechanical properties of single cells: Measurement methods and applications. Biotechnology Advances. 45, 107648 (2020).
- Yousafzai, M., et al. Effect of neighboring cells on cell stiffness measured by optical tweezers indentation. Journal of Biomedical Optics. 21 (5), 057004 (2016).
- Wei, M. -. T., et al. A comparative study of living cell micromechanical properties by oscillatory optical tweezers. Optics Express. 16 (12), 8594-8603 (2008).
- Khan, Z. S., Vanapalli, S. A. Probing the mechanical properties of brain cancer cells using a microfluidic cell squeezer device. Biomicrofluidics. 7 (1), 011806 (2013).
- Hirawa, S., Masudo, T., Okada, T. Acoustic recognition of counterions in ion-exchange resins. Analytical Chemistry. 79 (7), 3003-3007 (2007).
- Joosse, S. A., Gorges, T. M., Biology Pantel, K. detection, and clinical implications of circulating tumor cells. EMBO Molecular Medicine. 7 (1), 1-11 (2015).
- Martin, O. A., Anderson, R. L., Narayan, K., MacManus, M. P. Does the mobilization of circulating tumour cells during cancer therapy cause metastasis. Nature Reviews Clinical Oncology. 14 (1), 32-44 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon