Method Article
عد وحدة تشكيل مستعمرة سريعة بتنسيق لوحة 96 بئرا مطبقة على ميكروبيوم ذبابة الفاكهة
In This Article
Summary
تحدد هذه الطريقة الوفرة الميكروبية باستخدام تنسيق لوحة 96 بئرا لوحدات تشكيل مستعمرة الألواح (CFUs) ويتم تطبيقها على ميكروبيوم ذبابة الفاكهة في عينات متجانسة كاملة من الذباب. يتم حساب CFUs باستخدام برنامج تحليل الصور الآلي المقدم هنا.
Abstract
يتم استعمار أمعاء الحيوانات بواسطة الميكروبات المتعايشة ، والتي تؤثر على نمو المضيف وصحته وسلوكه. يعد القياس الكمي الدقيق للاستعمار أمرا ضروريا لدراسة التفاعلات المعقدة بين المضيف والميكروب للتحقق من صحة التركيب الميكروبي ودراسة آثاره. برزت ذبابة الفاكهة الميلانوجاستر ، التي تتميز بتنوع ميكروبي محلي منخفض واقتصادية في تربيتها بتركيبة ميكروبية محددة ، ككائن نموذجي لدراسة ميكروبيوم الأمعاء. يتطلب تحليل ميكروبيوم كائن فردي تحديد الأنواع الميكروبية الموجودة وتحديد وفرتها المطلقة. تقدم هذه المقالة طريقة لتحليل عدد كبير من ميكروبات الذباب الفردية. يتم تحضير الذباب في 96 لوحة بئر ، مما يتيح التعامل مع عدد كبير من العينات في وقت واحد. يتم قياس الوفرة الميكروبية عن طريق طلاء ما يصل إلى 96 تجانسا كاملا للذباب على صفيحة أجار واحدة في مجموعة من البقع ثم عد وحدات تشكيل المستعمرة (CFUs) التي تنمو في كل بقعة. يقترن نظام الطلاء هذا بمنصة قياس كمية CFU آلية ، والتي تتضمن التصوير الفوتوغرافي للألواح ، وتمايز مستعمرات الفلورسنت ، والعد الآلي للمستعمرات باستخدام مكون إضافي ImageJ. المزايا هي أن (i) هذه الطريقة حساسة بما يكفي لاكتشاف الاختلافات بين العلاجات ، (ii) طريقة الطلاء الموضعي دقيقة مثل طرق الطلاء التقليدية ، و (iii) عملية العد الآلي دقيقة وأسرع من العد اليدوي. يتيح سير العمل المقدم هنا القياس الكمي عالي الإنتاجية لوحدات CFU في عدد كبير من النسخ المتماثلة ويمكن تطبيقه على أنظمة دراسة علم الأحياء الدقيقة الأخرى بما في ذلك النماذج المختبرية وغيرها من النماذج الحيوانية الصغيرة.
Introduction
العلاقة بين الجراثيم المعوية ومضيفها الحيواني هي بشكل متزايد في طليعة الدراسات البيولوجية1 ، والتي تظهر أن تكوين سلالة الميكروبيوم مهم لفسيولوجيا المضيف2،3،4. كانت وتيرة الاكتشاف محدودة بسبب عوامل مربكة مثل التباين الطبيعي العالي بين الأفراد والتنوع العالي للبكتيريا المستعمرة5،6،7. ظهرت ذبابة الفاكهة ، ذبابة الفاكهة ، كنموذج واعد بسبب ميكروبيوم منخفض التنوع بشكل طبيعي ، وسهولة التعامل معها ، وعلم الوراثة المضيف القوي8،9،10،11. يمكن جعل الذباب خاليا من الجراثيم وإعادة ربطه بميكروبيوتامحددة 12 ، وقد ثبت أن النباتات تؤثر على السمات الفسيولوجية للذبابة13,14. تتكون النباتات الفطرية من مجموعة محدودة من البكتيريا التي يمكن زراعتها جميعا ، كما أن الأقارب المقربين منها هم أيضا داخليون في أمعاء الثدييات ، بما في ذلك العصيات اللبنية والبكتيريا البروتينية والمكورات المعوية15.
تتطلب دراسة تأثير الميكروبيوم على سمات المضيف قياسا كميا للميكروبيوم من حيث الأنواع الموجودة ووفرتها المطلقة16. الطرق السائدة لتحليل ميكروبيوم الذباب هي عدد وحدات تشكيل المستعمرات (CFU)17 ، وتسلسل أمبليكون جين 16S rRNA9 ، و qPCR لجين 16S rRNA18. يمكن الحصول على عدد CFU بدون كواشف باهظة الثمن ، وهي تؤكد صلاحية الخلايا البكتيرية19. تتمتع تقنيات 16S بما في ذلك qPCR بمزايا في أنه يمكن التحقق من الهويات التصنيفية للميكروبات بغض النظر عن متطلبات نموها أو مورفولوجيا المستعمرة20.
في الحالة التي تستخدم فيها التجارب الذباب مع ميكروبيوم محدد من البكتيريا المعروفة (الذباب gnotobiotic) ، فإن أعداد CFU لها مزايا خاصة على التسلسل21. التسلسل مكلف ، ويتطلب استخراج الحمض النووي ، وإعداد مكتبة قائمة على تفاعل البوليميراز المتسلسل ، وتسلسل عالي الإنتاجية للحصول على وفرة نسبية22. نظرا للتكلفة العالية ، يجب عادة تنفيذ طرق التسلسل عالية الإنتاجية بكميات كبيرة لتقليل السعر لكل عينة23. هناك حاجة إلى طرق أخرى مثل qPCR للحصول على وفرة مطلقة16. في المقابل ، فإن عدد CFU سريع ورخيص ويعطي الأرقام المطلقة للخلايا القابلة للحياة. ذبابة الفاكهة8 وغيرها من نماذج الميكروبيوم الصغيرة24 ، بما في ذلك الدودة ، Caenorhabditis elegans 25,26 ، وسمك الزرد اليرقات ، Danio rerio ، نمت gnotobiotically27 ، لديها مجموعة محدودة من البكتيريا ، والتي لها خصائص نمو معروفة 28. في هذه الحالات ، خاصة مع الحيوانات gnotobiotic ، يمكن أن يفرق عد CFU بين جميع أنواع البكتيريا داخل مجتمعات الأمعاء متعددة الأنواع21،27،29. من شأن طرق حساب CFU ذات الإنتاجية العالية أن تزيد من فعالية التكلفة وسرعة قياس تكوين الميكروبيوم ويمكن تطبيقها على العديد من تجارب علم الأحياء الدقيقة الأخرى.
يعد عد وحدات CFU عن طريق طلاء التخفيف التسلسلي للتعليق البكتيري على وسائط النمو القائمة على الأجار طريقة قياسية في مجال علم الأحياء الدقيقة. ثم يتم حساب المستعمرات التي تنمو على اللوحات يدويا. تسمح التخفيفات للباحث باختيار كثافة المستعمرات القابلة للعد (على سبيل المثال ، ~ 100 CFUs لكل لوحة) ، مما يعني أن المستعمرات لا تنمو في بعضها البعض ويمكن حسابها في فترة زمنية معقولة. يستخدم معظم علماء الأحياء الدقيقة بشكل أساسي نفس طريقة عد CFU التي تم تطويرها قبل 140 عاما في مختبر روبرت كوخ ، وبالنسبة للعديد من التطبيقات ، لا تزال هذه الطريقة كافية. ومع ذلك ، تنشأ مشكلة عند السعي لتحديد عدد كبير من العينات. قد تتطلب عينة واحدة طلاء 1 إلى 10 تخفيفات تسلسلية للعينة للحصول على وحدات CFU قابلة للعد ، لذلك تصبح التجارب التي تتضمن أكثر من بضع عشرات من العينات مرهقة. تم تطوير طرق مختلفة لزيادة كفاءة تعداد CFU. يلغي الطلاء الحلزوني الآلي الحاجة إلى التخفيفات التسلسلية30 ، مما يجعل لوحة واحدة فقط ضرورية لحساب CFU ولكن زيادة الوقت اللازم للوحة العينة. يسمح اكتشاف التخفيف التسلسلي أحادي اللوحة (SP-SDS) بتقديرات CFU من عدد أقل من اللوحات لكل عينة31. هذه الطرق هي تحسين على طريقة الطلاء المنتشر التقليدية ولكنها لا تزال تتطلب معالجة وطلاء العينات البكتيرية بشكل فردي ، وبالتالي فهي ليست مثالية للإنتاجية العالية. إن التعامل مع العينات في 96 لوحة بئر والطلاء الموضعي لتلك العينات ال 96 على ألواح أجار مستطيلة يحسن بشكل كبير من إنتاجية العينات19.
تتكون الميكروبات عادة من سلالات وأنواع متعددة. بينما يمكن تمييز الأنواع غالبا عن طريق مورفولوجيا المستعمرة أو وسائط النمو ، يمكن استخدام التألق لزيادة التمييز بين الأنواع المختلفة من البكتيريا وسمات نموها32. على سبيل المثال ، يمكن تسمية الأنماط الجينية المختلفة لنفس النوع ببروتينات فلورية مختلفة مشفرة وراثيا. تسمح طرق تصوير الألواح التي تتضمن مضان للباحثين بالاستفادة من هذه التقنيات الجينية في المقايسات القائمة على CFU32. إن دمج التألق في طرق عد CFU عالية الإنتاجية من شأنه أن يعزز فائدتها.
يصبح عد وحدات CFU يدويا مرهقا عندما يكون هناك عدد كبير من العينات. يمكن إجراء العد الآلي لوحدات CFU عن طريق تصوير اللوحة ومعالجة الصورة باستخدام برنامج متخصص33. Sieuwerts et al. الجمع بين كفاءة الطلاء المحسنة للطلاء الموضعي مع عد المستعمرات الآلي باستخدام التصوير الرقمي التقليدي وبرنامج ImageJ19.
من شأن طريقة عالية الإنتاجية لفحص الأنماط الظاهرية لميكروبات معينة وجمعيات مضيفة أن تساعد في دراسات تجميع مجتمع الميكروبيوم والتأثير على صحة المضيف واللياقة البدنية. بالنسبة لدراسات ميكروبيوم ذبابة الفاكهة ، ستتضمن منصة علم الأحياء الدقيقة عالية الإنتاجية التعامل مع عينات الذباب في شكل لوحة 96 بئرا ، وتحلل الذباب بدون تحلل بكتيري ، وكفاءة الطلاء الموضعي ، والقدرة على استخدام التألق والتمييز بين الفلوروفورات المتعددة ، وبيئة ضوئية خاضعة للرقابة للتصوير القابل للتكرار لألواح CFU ، وبرنامج موثوق لعد المستعمرات الآلي. توضح هذه المقالة طريقة محسنة لفحص CFUs في الذباب gnotobiotic ، وهي بسيطة وسريعة وآلية. يحدد هذا البروتوكول سير عمل جديد يجمع بين أفضل الطرق المنشورة مسبقا والأمثل لاستكشاف ميكروبيوم الأمعاء في ذبابة الفاكهة.
Protocol
1. يطير الاستعمار
ملاحظة: هذه الطريقة مناسبة للتحليل الكمي للذباب باستخدام ميكروبيوم الأمعاء القابل للزراعة عن طريق طلاء نمو CFUs. تم نشر بروتوكول مفصل لتربية الذباب gnotobiotic سابقا12.
- إنشاء استعمار مستقر من قبل الأنواع البكتيرية المشتركة.
- تحضير مزرعة بكتيرية جديدة ، بيليه عن طريق الطرد المركزي في 400 × غرام لمدة 3 دقائق في درجة حرارة الغرفة ، وإعادة تعليق بيليه الخلية في PBS إلى OD600 من 1.0. بالنسبة لهذا البروتوكول ، تمت زراعة Lactiplantibacillus plantarum (المعروف سابقا باسم Lactobacillus plantarum) بين عشية وضحاها إلى OD600 من 2.0.
- ماصة 100 ميكرولتر على الطعام في قارورة ذبابة (انظر جدول المواد). يوزع بالتساوي ويترك السائل يمتص لمدة 15-30 دقيقة.
- انقل 20 ذبابة خالية من الجراثيم إلى هذه القارورة باستخدام تقنية التقليب القياسية من القارورة إلى القارورة34. ستأكل كل ذبابة كمية متساوية تقريبا من الجرعة البكتيرية35. بدلا من ذلك ، يمكن إضافة بيض خال من الجراثيم.
- نقل الذباب إلى طعام معقم طازج يوميا لمدة 3 أيام. افعل كل هذا في خزانة السلامة البيولوجية واستخدم تقنية معقمة (الشكل 1A-1).
- قبل قياس حمل CFU ، انقل الذباب إلى قارورة تحتوي على ماء أجار معقم لمدة 4 ساعات لإزالة البكتيريا العابرة من الأمعاء. توفر قوارير ماء الأجار مصدرا للرطوبة للذبابة ولكنها لا توفر تغذية للذبابة أو البكتيريا على السطح. يتم تحضيرها في نفس قوارير الذباب المعقمة كما هو الحال مع الطعام القياسي ولكنها تحتوي فقط على ماء منزوع الأيونات و 1.5٪ أجار.
2. تجانس الذباب بشكل فردي في لوحة PCR 96 بئر
- إعداد لوحات الخافق حبة مقدما.
- صب حبات زجاجية 0.5 ميكرومتر (انظر جدول المواد) على صينية قياس الخرز (3D مطبوعة بمساعدة ملف الترميز التكميلي 1 S1-bead-measurer.stl). انشر الخرز على الدرج بحيث تكون جميع الآبار ممتلئة ومستوية ، ثم قم بإزالة الخرز الزائد في أنبوب مخروطي لاستعادتها.
- ضع لوحة PCR شبه ذات حواف (انظر جدول المواد) رأسا على عقب على صينية القياس وقم بمحاذاتها مع الآبار عن طريق تركيبها في المسافة البادئة على درج القياس. ثم اقلبها بسرعة لنقل الخرز.
- قم بإزالة الخرز الزائد من سطح لوحة PCR وقم بتغطيته بورق الألمنيوم. افحص لوحة PCR للتأكد من أن جميع الآبار تحتوي على خرز. استخدم مغرفة وزن إذا لزم الأمر لإضافة حبات إلى بئر واحدة. إذا تسببت الكهرباء الساكنة في التصاق الخرز بأسطح الألواح ، فقم بمسح أو رش الجزء الخلفي من صينية القياس ولوحة PCR بنسبة 70٪ من الإيثانول.
- مع تغطية رقائق الألومنيوم. يمكن تحضير العديد من اللوحات بهذه الطريقة ثم تعقيمها وتخزينها لاستخدامها لاحقا. عندما تكون جاهزا للاستخدام ، أضف 100 ميكرولتر من PBS إلى كل بئر باستخدام ماصة 96 قناة (انظر جدول المواد).
- تعقيم الذباب المستعمر بالميكروبات (انظر الخطوة 1) بنسبة 70٪ من الإيثانول قبل التجانس.
- تخدير الذباب بنسبة 100٪ CO2 لمدة 5 ثوان. نقل الذباب المخدر من القارورة إلى أنبوب طرد مركزي دقيق سعة 1.5 مل باستخدام قمع صغير (الشكل 1A-2). في هذه الدراسة ، تمت إضافة 25 ذبابة عادة لكل أنبوب.
- رش على الفور ~ 1 مل من الإيثانول 70 ٪ في الأنبوب ، أغلق الأنبوب واخلطه عن طريق الانقلاب لمدة 10 ثوان. بعد ذلك ، قم بشفط الإيثانول باستخدام ماصة P1000 ، مع الحرص على عدم استنشاق أي ذباب. كرر مرة أخرى مع الإيثانول ، ثم مرتين مع PBS المعقم (الشكل 1A-3).
- بعد غسل PBS النهائي ، أغلق الأنبوب ، ومع وضع جانب الغطاء لأسفل ، اضغط عليه بقوة عدة مرات على المقعد حتى يدخل الذباب في الغطاء.
- افتح الأنبوب ووزع الذباب في الآبار باستخدام ملقط (الشكل 1A-4). ضع ذبابة واحدة في كل بئر (الشكل 1A-5). احتفظ بالطبق على الثلج أثناء التحميل للحفاظ على تخدير الذباب.
- أغلق اللوحة باستخدام رقائق الختم الحراري Thermal Bond (انظر جدول المواد).
- أولا ، قم بإزالة أي خرزات شاردة قريبة من الآبار لأنها يمكن أن تسبب تسربا في ختم الرقائق. تأكد من توجيه الجانب الباهت من الرقاقة لأسفل على اللوحة والجانب اللامع لأعلى نحو مانع التسرب الحراري. اضغط على مانع تسرب الحرارة (انظر جدول المواد) لأسفل بقوة لمدة 5 ثوان (الشكل 1A-6). قم بتلميعه باستخدام قضيب اليد (انظر جدول المواد) لتأمين ورق القصدير.
ملاحظة: سوء الختم هو سبب فقدان العينة.
- أولا ، قم بإزالة أي خرزات شاردة قريبة من الآبار لأنها يمكن أن تسبب تسربا في ختم الرقائق. تأكد من توجيه الجانب الباهت من الرقاقة لأسفل على اللوحة والجانب اللامع لأعلى نحو مانع التسرب الحراري. اضغط على مانع تسرب الحرارة (انظر جدول المواد) لأسفل بقوة لمدة 5 ثوان (الشكل 1A-6). قم بتلميعه باستخدام قضيب اليد (انظر جدول المواد) لتأمين ورق القصدير.
- تأمين لوحة في شاكر لوحة. تجانس لمدة 5 دقائق (الشكل 1A-7). قم بتدوير لوح الخرز لمدة 30 ثانية في لوحة دوارة صغيرة (انظر جدول المواد) عند 350 × جم لإزالة السائل من رقائق الختم.
- قم بإزالة الرقاقة أثناء الإمساك باللوحة حتى لا تتناثر قطرات من ذبابة متجانسة من الآبار.
3. التخفيف التسلسلي لتجانس الذباب واكتشافه على ألواح CFU
- ضع أربع لوحات نمو مستطيلة MRS agar (انظر جدول المواد) في خزانة السلامة البيولوجية وقم بإزالة أغطيتها. في هذا البروتوكول ، تم استخدام MRS agar لنمو L. plantarum. اترك هذه الأطباق لتجف لمدة 10 دقائق على الأقل (20 دقيقة إذا تم سكبها حديثا أو باردة من التخزين).
ملاحظة: إذا كانت الألواح مبللة ، فإن القطرات من اللوحة المكونة من 96 بئرا ستعمل معا وتدمر العد. - قم بإعداد ثلاث لوحات تخفيف عن طريق إضافة 100 ميكرولتر من PBS إلى كل بئر من لوحة معقمة من 96 بئرا باستخدام ماصة 96 قناة. قم بتحميل رف من أطراف P20 على الماصة ذات 96 قناة.
- قم بعمل تخفيف 1:10 عن طريق استنشاق 11.1 ميكرولتر من التجانس من لوحة العينة المعدة في القسم 2 (الشكل 1A-8). تأكد من السحب من منتصف الآبار بدلا من قاع الآبار لأن تجانس الذباب والخرز الزجاجي سوف يسد الماصات. تغرق الخرز ، وتطفو جسيمات الذبابة ، تاركة الطبقة الوسطى واضحة في الغالب.
- قم بتوزيع 11.1 ميكرولتر في لوحة التخفيف الأولى ، والتي تحتوي بالفعل على 100 ميكرولتر من PBS المعقم لكل بئر. احتفظ بلوحة التخفيف على شاكر اللوحة لمدة 10 ثوان عند 600 دورة في الدقيقة. امزج مرة أخرى عن طريق السحب لأعلى ولأسفل لمدة خمس دورات. انقل 11.1 ميكرولتر من لوحة التخفيف الأولى إلى لوحة التخفيف الثانية ، وكرر خطوات الخلط لوحتي التخفيف التاليتين.
- قم بإجراء طلاء سلسلة التخفيف كما هو موضح أدناه.
- استرجع لوحات النمو من خزانة السلامة البيولوجية.
- بدءا من اللوحة الأكثر تخفيفا ، حدد 2 ميكرولتر من كل بئر على ألواح الآجار باستخدام ماصة 96 بئرا (الشكل 1A-9).
- اخفض رأس الماصة ببطء على اللوحة ، مع الحرص على عدم الطعن في أجار. افحص اللوحة بعناية وتأكد من توزيع جميع البقع ؛ إذا لم يكن كذلك ، أضف 2 ميكرولتر يدويا إلى الموضع المناسب. تأكد من أن البقع السائلة تنقع بسرعة في أجار ولا تعمل معا.
- إذا كانت البقع تعمل معا ، جفف مجموعة جديدة من ألواح الآجار الطازجة لفترة أطول وأعد اكتشافها. إذا كان هناك أنواع متعددة من الألواح (على سبيل المثال ، وسائط مختلفة أو مع المضادات الحيوية) ، فاكتشفها أيضا. قم بتوزيع أي محلول متبقي مرة أخرى في لوحة التخفيف وانتقل إلى التركيز الأعلى التالي.
ملاحظة: عند اكتشاف التخفيفات ، امزج التخفيف التالي خمس مرات للتأكد من إزالة محتويات أطراف الماصة من التخفيف السابق. يمكن تخزين ألواح التخفيف >8 ساعة عند 4 درجات مئوية دون التأثير على عدد المستعمرات35.
- كرر عملية الطلاء كما هو موضح في الخطوة 3.5 لألواح التخفيف المتبقية ، مع التقدم من الأكثر تخفيفا إلى الأكثر تركيزا حتى اللوحة ذات التجانس الأصلي.
- عندما يتم امتصاص كل السائل في أجار ، اقلب الألواح وضعها في الحاضنة (الشكل 1A-10). بالنسبة ل Lactiplantibacillus و Acetobacter من ذبابة الفاكهة ، تكون درجة الحرارة المثلى 30 درجة مئوية على وسائط MRS. احتضان حتى تصل المستعمرات إلى الحجم الأمثل: المستعمرات كبيرة بما يكفي لرؤيتها بوضوح ولكنها ليست كبيرة جدا بحيث تندمج أو تتداخل مع نمو بعضها البعض (انظر النتائج التمثيلية لتحديد الحجم الأمثل).
ملاحظة: تعتمد ظروف النمو المثلى على الإجهاد ويجب تحديدها تجريبيا. بالنسبة ل Lactiplantibacillus من ذبابة الفاكهة ، فإن الوقت الأمثل للحضانة هو 26 ساعة إلى 30 ساعة على أجار MRS. بالنسبة إلى Acetobacter من ذبابة الفاكهة ، فإن الوقت الأمثل للحضانة هو 30 ساعة إلى 48 ساعة على MRS اعتمادا على السلالة. - بعد الحضانة ، قم بتخزين الألواح في درجة حرارة 4 درجات مئوية إذا لزم الأمر حتى تصبح جاهزة للعد.
4. القياس الكمي لوحدات CFU
- قم بتحديد CFUs عن طريق تصوير الألواح ثم عد المستعمرات باستخدام برنامج آلي ، كما هو مفصل أدناه. إذا تم تخزين الألواح عند 4 درجات مئوية ، اسمح لها أولا بالوصول إلى درجة حرارة الغرفة حتى لا يكون هناك تكاثف على الألواح ، مما ينتج عنه وهج.
- قم بتنظيم اللوحات في تسلسل منطقي واحتفظ بها بهذا الترتيب أثناء التصوير - مما يسهل تسمية الملفات. قم بتوجيه جميع اللوحات بحيث يكون A1 في الزاوية اليسرى العليا لجميع اللوحات. يوصى بتسمية الزاوية A1 بمعرف فريد لضمان عدم خلط الصور. قم بتكديس كل سلسلة تخفيف بالترتيب.
- قم بإزالة غطاء اللوحة وضع اللوحة على المسرح مع توجيه A1 في الزاوية الصحيحة. يتم تضمين التصميمات لصندوق صور اللوحة (الملف التكميلي 1 ، الملف التكميلي 2) ، والذي تم تحسينه لتصوير لوحات الصواني هذه ويتضمن خيارات الإضاءة والتصفية لتصوير مستعمرات الفلورسنت.
- صورة اللوحات. استخدم الكاميرا (انظر جدول المواد) مع الإعدادات اليدوية لتحقيق مستوى تعريض ضوئي ثابت بين اللوحات. يوصى بإعداد البعد البؤري الطويل لتقليل تشوه المنظور. التقط الصورة باستخدام غالق عن بعد لتقليل الضبابية الناتجة عن اهتزاز الكاميرا.
- انقل الصور إلى جهاز كمبيوتر وأعد تسميتها ، بما في ذلك اسم التجربة ونوع الوسائط وعامل التخفيف وأي تفاصيل أخرى ذات صلة. تحتوي بعض أنظمة التشغيل (انظر جدول المواد) على ميزة إعادة تسمية دفعات مفيدة في Finder بالنقر بزر الماوس الأيمن فوق مجموعة مختارة من الملفات.
5. عد المستعمرة الآلي باستخدام مجموعة Count-On-It (ملف تكميلي 3)
- قم بقص الصور باستخدام المكون الإضافي Croptacular المقدم (ملف الترميز التكميلي 2) ل ImageJ. يساعد هذا المكون الإضافي على تقسيم الصورة إلى مجموعة منظمة من المناطق الفرعية (على سبيل المثال ، 8 × 12 للوحة 96 بئرا). وستحسب المناطق الفرعية كل على حدة.
ملاحظة: تم وصف مكون إضافي منفصل لحساب اللوحات الدائرية يسمى Circus في ملف الترميز التكميلي 3 Circus_.ijm.- تنظيم الصور المراد معالجتها للقياس الكمي في مجلد. اختر أسماء الملفات التي تميز اللوحات، حيث تصبح أسماء الملفات هذه عناوين أعمدة لكل مجموعة من العد . داخل هذا المجلد ، قم بإنشاء مجلدات فرعية باسم "اقتصاص" و "إيصالات" .
- قم بتشغيل Croptacular ، وانقر فوق "موافق " لبدء الاقتصاص.
ملاحظة: يتم عرض الإعدادات الافتراضية وعادة ما تكون كافية. اعتمادا على دقة الصورة والإضاءة وحجم البقعة وما إلى ذلك ، قد يكون من المفيد ضبط المعلمات الأساسية. - إذا كانت الصورة مستقيمة بالفعل ، فما عليك سوى الضغط على Space. خلاف ذلك ، قم بتصويب الصورة عن طريق رسم خط على طول حافة يجب أن تصبح أفقية. أعد رسم الخط عدة مرات حسب الحاجة إذا كانت الصورة لا تزال لا تظهر مستقيمة.
- بعد ذلك ، ارسم مربع حدود للمنطقة التي سيتم العد لها. اضبط الحجم والنسبة حتى تصبح جميع البقع داخل خلاياها. اسحب المؤشر خارج مربع الحدود لتحديث الشبكة. عندما تبدو الشبكة جيدة، اضغط على Space.
- تأكد من أن الصورة التالية تدور تلقائيا إلى نفس زاوية الصورة الأولى ؛ يفترض المكون الإضافي محاذاة جميع الصور بنفس الطريقة. إذا كان هذا دقيقا، فاضغط على مفتاح المسافة للمتابعة. خلاف ذلك ، قم بتصويب الصورة كما كان من قبل. تتذكر الشبكة أيضا نفس موضع الصورة السابقة ؛ اضبط إذا لزم الأمر، ثم اضغط على Space.
- قم بتعداد المستعمرات الموجودة على اللوحات باستخدام المكون الإضافي Count-On-It: Gridiron المقدم ل ImageJ (ملف الترميز التكميلي 4). يتم تضمين تعليمات مفصلة لتثبيت واستخدام المكون الإضافي في الملف التكميلي 3.
- إطلاق العد على ذلك > Gridiron. استخدم نفس إعدادات الشبكة كما هو الحال مع Croptacular. يمكن للمستخدمين تجميع مجلد كامل أو تحليل صورة واحدة أو البدء من الصورة الحالية.
- قم بتعيين الحد استنادا إلى قيمة كثافة البكسل الأعلى والسفلي. اجعل العتبة صارمة قدر الإمكان مع الاستمرار في اختيار جميع المستعمرات. من الناحية المثالية ، سيكون هناك بعض المساحة بين المستعمرات المحددة ، لكن البرنامج قادر على تقسيم النقط إلى حد ما. انقر فوق "موافق" في مربع الحوار "الإجراء المطلوب " عندما تكون العتبة مرضية .
- لفحص النتائج ، قم بالتكبير وإلقاء نظرة فاحصة على عدد المستعمرات. سيؤدي النقر فوق إلغاء إلى إحباط المكون الإضافي. انقر فوق موافق للمتابعة.
- في الصورة الأولى ، تأكد من إعطاء الخيار للمتابعة أو العودة إلى قائمة الإعداد ، على سبيل المثال ، لتغيير الحد الأدنى لحجم المستعمرة. لمتابعة عملية الدفعات، انقر فوق موافق. ثم حدد مجلدا للاحتفاظ بجدول الإيصالات والنتائج. استخدم مجلد "الإيصالات" أو أنشئ مجلدا جديدا.
- بعد الصورة الأولى ، سيتم تعيين الصور التالية افتراضيا على نفس عتبة الإعدادات السابقة. انقر فوق موافق لاستخدام هذه الإعدادات أو ضبط الإعدادات. إذا كانت الصور متسقة وكان الإعداد دقيقا ، فانقر فوق "موافق" في مربع الحوار " الإجراء المطلوب".
ملاحظة: بمجرد اكتمال جميع الصور الموجودة في الدفعة، يتم حفظ جدول النتائج تلقائيا في نفس المجلد مثل الإيصالات. - راجع إيصالات العد التي ينتجها البرنامج وقم بتصحيح أي أخطاء عد يدويا. المكون الإضافي ImageJ دقيق إحصائيا، ولكن تحدث أخطاء. إثبات الإيصالات لفحص القيم المتطرفة وتحديد العد الخاطئ. البرنامج يحفظ بيانات CFU كملف .csv في نفس المجلد مثل الإيصالات.
- تحليل البيانات باستخدام البرنامج المفضل لدى المستخدم.
النتائج
تعداد وحدات CFU في مئات الذباب الفردي في شكل لوحة 96 بئرا باستخدام مقايسة الاستعمار
لفهم تكوين العديد من ميكروبات الذباب الفردية ، تم قياس CFUs باستخدام البروتوكول المصاحب ، والذي مكن من تحديد الأنواع الموجودة ، والنسبة المئوية للذباب المستعمر ، والوفرة المطلقة للبكتيريا في كل ذبابة. أسباب التباين الكبير الملاحظ من فرد إلى فرد في تكوين الميكروبيوم غير مفهومة بشكل جيد ، ويمكن أن يساعد تحديد التوزيع الإحصائي للاستعمار في دراسة هذا الاختلاف36,37. للحصول على عدد كبير من التكرارات البيولوجية ، تم تطوير خط أنابيب عالي الإنتاجية لتحديد وفرة الميكروبات في العديد من الذباب الفردي باستخدام أعداد CFU (الشكل 1 أ).
يمكن أن يتأثر القياس الكمي النهائي لوحدات CFU بكيفية التعامل مع الذباب قبل التحليل ، على سبيل المثال ، عوامل بما في ذلك التعقيم السطحي ، والوقت منذ استهلاك البكتيريا ، وإزالة البكتيريا العابرة من الأمعاء. أولا ، مع التركيز على الأنواع البكتيرية Drosophila commensal L. plantarum (Lp ؛ انظر سلالة Lp WF في Obadia et al.36) ، تم تغذية الذباب بجرعة ~ 105 CFUs من Lp والاحتفاظ بها في مجموعات من 25 ذبابة لكل قارورة. تم الاحتفاظ بهذه الذباب في نفس القارورة لمدة 3 أيام أو نقلها يوميا (منقولة) إلى طعام طازج ومعقم (الشكل 1 ب). ثم تم غسل الذباب غير المنقول في الإيثانول لإزالة البكتيريا السطحية (غسلها) أو لم يتم غسلها (غير مغسولة). أنتج الغسيل انخفاضا غير كبير في إجمالي وحدات CFU المقاسة (الشكل 1B) ، مما يشير إلى أنه في ظل ظروف التلقيح عالية التحكم هذه ، لا يصبح سطح الذبابة مستعمرا بشكل كبير بواسطة البكتيريا في 3 أيام. تم نقل المجموعات الأخرى من الذباب كل يوم للحد من تراكم البكتيريا من النمو على الغذاء (منقولة) ؛ بالإضافة إلى ذلك ، تم نقل مجموعة إلى طعام طازج لمدة 4 ساعات قبل أخذ العينات (بعد النقل) ، أو تم وضعها في قوارير مع ماء أجار معقم فقط لمدة 4 ساعات (تم تطهيرها) للسماح للميكروبات التي يتم تناولها بشكل عابر بالتخلص من الأمعاء. أنتجت كل خطوة من هذه الخطوات لتوفير قياس استعماري أكثر صرامة انخفاضا ذا دلالة إحصائية في وفرة CFUs في الذباب ، باستثناء الغسيل السطحي في الإيثانول. أدى النقل إلى طعام معقم (بعد النقل) أو ماء أجار (مسح) لمدة 4 ساعات قبل القياس إلى تأثيرات لا يمكن تمييزها ، مما يشير إلى أن النقل إلى ظروف معقمة قبل 4 ساعات من القياس يقلل من الحمل البكتيري. تتوافق هذه النتيجة مع التفسير القائل بأن بعض بكتيريا الأمعاء في أمعاء الذباب عابرة ، بينما يرتبط البعض الآخر بشكل أكثر ثباتا35. تراوحت وفرة Lp من 1 × 10 4.3 CFUs / ذبابة في الذباب الذي تم تطهيره إلى 1 × 104.9 CFUs في الذباب غير المغسول (n = 724 ذبابة).
بعد ذلك ، تم إجراء نفس الاختبار باستخدام Acetobacter indonesiensis (Ai) ، وهي بكتيريا سالبة الجرام تستعمر أمعاء الذبابة (الشكل 1C ؛ انظر سلالة Ai SB003 في Obadia et al.36). كما هو الحال مع الذباب المستعمر Lp ، أنتج التعقيم السطحي انخفاضا غير كبير في CFUs. وبالمثل ، فإن النقل اليومي إلى الطعام المعقم قلل بشكل كبير من الحمل البكتيري ، والنقل إلى ظروف معقمة لمدة 4 ساعات قبل التجانس أدى إلى انخفاض إضافي في الحمل البكتيري. تراوحت وفرة Ai من 1 × 104.7 CFUs / ذبابة في الذباب الذي تم تطهيره إلى 1 × 105.0 CFUs في الذباب غير المغسول (n = 528 ذبابة). وبالتالي ، فإن التحديد الكمي الدقيق لبكتيريا الأمعاء يعتمد على تكرار النقل ، بما في ذلك يوم النقل. كان لإزالة الحمل البكتيري الخارجي عن طريق الغسيل في الإيثانول تأثير غير كبير ، ولكن يمكن ملاحظة تأثيرات أكثر أهمية لسلالات مختلفة من البكتيريا أو ظروف زراعة مختلفة. يجب التحكم في هذه العوامل تجريبيا.
كما تم اختبار التأثير المحتمل لطريقة التجانس على عدد CFU. تم تجانس الذباب باستخدام مضرب خرز مع خرز زجاجي 0.5 ميكرومتر في 100 ميكرولتر من PBS ، مما قد يقلل من صلاحية الخلايا البكتيرية. أولا ، تم تحضير تعليق بكتيريا Lp من الثقافة في PBS ثم تم طلاؤها لحساب CFUs كعنصر تحكم إيجابي. تم وضع نفس الثقافة في لوحة مضرب الخرز و (i) متجانسة مع الخرز ، (ii) متجانسة مع الخرز وذبابة خالية من الجراثيم ، أو (iii) متجانسة في PBS بدون خرز (الشكل 1D). لم يؤثر التجانس في الخرز عند وجود ذبابة بشكل كبير على وفرة الخلايا القابلة للحياة في المحلول ، في حين أن تجانس البكتيريا في غياب الذبابة قتل عددا كبيرا من الخلايا البكتيرية. كما أدى التجانس في PBS بدون خرز إلى تقليل عدد الخلايا القابلة للحياة بشكل كبير. وبالمثل ، تم الحفاظ على صلاحية الذكاء الاصطناعي عند تجانسها في وجود ذبابة ، في حين أن التجانس بدون ذبابة قلل من عدد الخلايا القابلة للحياة في المحلول (الشكل 1E). تشير هذه النتائج إلى أن نسيج الذبابة يحمي البكتيريا من التدمير بواسطة الخرز أثناء التجانس. ومع ذلك ، تم إجراء التجارب في الشكل 1D والشكل 1E مع أكثر من 108 CFUs لكل بئر. في الممارسة العملية ، تم العثور على الآبار التي تحتوي على ~ 106 خلايا لكل بئر أو أقل لإظهار القليل من فقدان الخلايا عند استخدام الخرز بدون ذبابة. تبريد اللوحة على الجليد في منتصف الطريق من خلال ضرب الخرز يحسن أيضا من صلاحية الخلية. تكمن أهمية هذه النتائج في أن القراء يجب أن يكونوا على دراية بهذه المشكلات المحتملة وأن يصمموا عناصر تحكم مناسبة لحالة الاستخدام الخاصة بهم.
دقة الطلاء الموضعي لألواح 96 بئرا لقياس كمية CFU عالية الإنتاجية
نظرا لأن الهدف هو قياس وفرة CFU لمئات إلى آلاف الذباب الفردي ، فإن طرق الطلاء المنتشرة التقليدية باهظة الوقت والمواد المكثفة. الطلاء الموضعي هو طريقة فعالة وفعالة لنمو CFU والتعداد19،31. تستخدم طريقة الطلاء الموضعي ماصة ذات 96 قناة لتوزيع 2 ميكرولتر من التعليق البكتيري على وسائط محضرة في ألواح صينية مستطيلة (الشكل 2 أ). تمثل كل بقعة الحمل البكتيري لعينة واحدة ، لذلك يمكن تحليل 96 ذبابة بلوحة واحدة (الشكل 2 ب). تمت مقارنة دقة الطلاء الموضعي مع الطلاء التقليدي عن طريق تلقيح ألواح النمو باستخدام نفس تعليق 0.0001 OD ل Lp لكلتا الطريقتين. تم تخفيف التعليق مرتين بشكل متسلسل خمس مرات في PBS. كمقارنة وجها لوجه ، تم نشر 50 ميكرولتر من اللقاح على ألواح مستديرة فردية ، أو تم عمل بقع 2 ميكرولتر على ألواح MRS مستطيلة. ثم تم تحضين الصفائح عند 30 درجة مئوية حتى أصبحت المستعمرات قابلة للعد. تم استخدام أعداد CFU الناتجة لكل تخفيف لحساب التركيز الأصلي للتعليق ومقارنته (الشكل 2C). تم احتساب الألواح المستديرة التي تحتوي على 50-500 CFUs كعنصر تحكم. لم يلاحظ أي فرق كبير بين طرق الطلاء الدائري عالية الإنتاجية والتقليدية.
نظرا لأن كثافة المستعمرات يمكن أن تؤثر على نموها وقياسها ، فقد تم اختبار تأثير كثافة CFU على الأعداد النهائية. لم تظهر البقع التي تحتوي على 2 إلى 25 مستعمرة لكل بقعة أي فرق في العد النهائي مقارنة بطريقة الصفائح المستديرة التقليدية (الشكل 2C). أنتجت البقع التي يبلغ متوسطها 35 مستعمرة نتائج انحرفت قليلا عن لوحات انتشار التحكم (الشكل 2C; ع = 0.0017). أشار الفحص الدقيق لصور البقع الفردية إلى أن هذا الانحراف كان بسبب تداخل المستعمرات في البقع الكثيفة. وأسفرت القياسات المستندة إلى البقع التي يبلغ متوسطها 11 مستعمرة لكل بقعة عن تركيزات أقرب إلى تلك القائمة على لوحات الانتشار (الشكل 2C؛ الشكل 2C؛ الشكل 2C). لوحات الانتشار: المتوسط = 1 × 104.4 CFUs ؛ SD = 0.086 مقابل البقع التي تحتوي على 11 مستعمرة متوسطة: المتوسط = 1 × 104.4 CFUs ؛ SD = 0.12 ، p = 0.42 ، اختبار Welch's t).
توليد صور عالية الجودة للقياس الكمي باستخدام منصة تصوير متخصصة إما بالضوء الأبيض أو التألق
يولد الطلاء الموضعي عالي الإنتاجية بشكل طبيعي عددا كبيرا من المناطق المستهدفة ، والتي يجب حسابها بدقة. يمكن استخدام الصور عالية الجودة لتوثيق البيانات وتسهيل عد وحدات CFU. تم تطوير منصة تصوير قوية ومباشرة باستخدام المواد المتاحة تجاريا (الشكل 3 أ). تم إرفاق كاميرا رقمية بقوس أعلى صندوق إضاءة مصمم خصيصا ، يسمى FluoroBox ، وتم توجيهه مباشرة لأسفل ، عموديا على مركز اللوحة. تم وضع مرشح انبعاث ملون اختياريا أمام العدسة باستخدام شريط تمرير المرشح. منع الدرع الضوئي توهج العدسة عن طريق حجب الضوء المباشر من شرائط LED أدناه. أضاءت شرائط LED اللوحة من الجانبين ، وليس من الأعلى ، لمنع الوهج على اللوحة. بالإضافة إلى الضوء الأبيض ، تم استخدام مصابيح LED أحادية اللون باللونين الأزرق والأخضر لإثارة بروتينات الفلورسنت الخضراء والحمراء ، على التوالي. تم تثبيت اللوحة في مكانها بواسطة حامل لوحة على الدرج ، وتم تجهيز الدرج بمنزلقات درج لتسهيل إدخال اللوحة. تتوفر التصميمات الكاملة في الملف التكميلي 1 والملف التكميلي 2.
تم التقاط صورة للوحة موضعية لمستعمرات Lp باستخدام مصابيح LED ذات الضوء الأبيض وكاميرا رقمية للمساعدة في عد المستعمرات وتمييز الألوان والأشكال المختلفة (الشكل 3 ب). للتحقق من أن شدة الإضاءة كانت متساوية ، تم قياس شدة خلفية الآجار عبر مناطق مختلفة من صورة لوحة (الشكل 3C). لإثبات أنه يمكن تمييز المستعمرات بوضوح عن الخلفية ، تم قياس الكثافة عبر قطر 10 مستعمرات مختلفة على أجزاء مختلفة من اللوحة ووجد أنها أعلى بنسبة ~ 300٪ تقريبا من الخلفية (الشكل 3C). تم تلقيح الصفيحة ب Lp مع بلازميد يعبر عن بروتين الفلورسنت mCherry ، بالإضافة إلى بعض Lp التي لا تحتوي على البلازميد ، لذلك كانت المستعمرات إما إيجابية mCherry أو سلبية mCherry. للتمييز بين هذين النوعين من المستعمرات ، تم تصوير اللوحة باستخدام نفس الكاميرا مع ضوء LED أخضر (515-525 نانومتر) ومرشح أحمر (Tiffen # 29) ، مما تسبب في تألق المستعمرات الإيجابية mCherry (الشكل 3D). تم تحديد الفرق في الشدة بين mCherry الإيجابي و mCherry السلبي عن طريق قياس الكثافة عبر عينة من المستعمرات (n = 10 مستعمرات). كانت المستعمرات الإيجابية mCherry ~ 1,000٪ أعلى كثافة من mCherry السلبية (الشكل 3E). تم تصوير مستعمرات Ai التي تعبر عن GFP ومستعمرات Ai التي لا تعبر عن أي مضان باستخدام مصابيح LED زرقاء (465-475 نانومتر) ومرشح أخضر (Tiffen # 58) (الشكل 3F). أظهرت المستعمرات الإيجابية ل GFP كثافة أعلى بنسبة 200٪ من سلبية GFP (الشكل 3G).
العد الآلي لوحدات CFU على اللوحات الموضعية باستخدام المكون الإضافي ImageJ المخصص Count-On-It
تساعد الصور وحدها في عد المستعمرات (على سبيل المثال ، عن طريق تخزين البيانات ، ومشاركة البيانات ، والتكبير ، ووضع علامة على تراكب ، وفصل الألوان ، وما إلى ذلك). ومع ذلك ، فإن عملية عد وتنظيم نتائج مئات المواقع يدويا يمكن أن تكون مملة وتستغرق وقتا طويلا وعرضة للاختلافات بين البشر في العد النهائي. لتسريع عملية العد وتوحيد قابلية استنساخ الأعداد ، تم تطوير مكون إضافي متخصص ل ImageJ يسمى Count-On-It (الشكل 4 أ). يتيح هذا المكون الإضافي العد الدقيق شبه الآلي لوحدات CFU على ألواح أجار. يقوم المستخدم بإعداد الصور للعد عن طريق اقتصاصها أولا وتقويمها باستخدام المكون الإضافي Croptacular الإضافي. يمكن اختياريا معالجة الصور دفعة واحدة ، ويمكن تعديل العتبة لكل لوحة. تتيح العديد من الخيارات الأخرى للمستخدم زيادة دقة عد الألواح ، بما في ذلك ضبط الأطوال الموجية للضوء (صور RGB) ، وتحديد نطاق لحجم المستعمرة (بالبكسل) ، وتغيير الحد الأقصى لنسبة العرض إلى الارتفاع ، وتخصيص أبعاد شبكة التحديد النشطة. يقوم Count-On-It بإخراج جدول نتائج مع تمثيل كل لوحة كعمود من أعداد CFU. كما أنه ينشئ إيصالا مصورا يظهر تراكبا لتوثيق نتائج العد بصريا والمساعدة في تصحيح الخطأ يدويا (الشكل 4 ب). أثناء حدوث أخطاء ، عندما تمت مقارنة عدد المستعمرات التي تم حسابها يدويا بعدد المستعمرات التي تم عدها باستخدام هذا المكون الإضافي (الشكل 4C) ، كانت العلاقة متكافئة بشكل عام ، حيث أظهر الانحدار الخطي بين العد اليدوي والآلي منحدرا قدره 0.95 بدقة تزيد عن 90٪ (R2 = 0.93) ، على الرغم من زيادة الخطأ عندما تجاوز عدد المستعمرات 20.
يمكن أيضا استخدام Count-On-It لحساب مستعمرات الفلورسنت بشكل منفصل باستخدام ميزة التألق في FluoroBox. كان عدد المستعمرات الإيجابية mCherry (الشكل 4D) بواسطة المكون الإضافي للبرنامج مقابل الدليل R2 من 0.92 (الشكل 4E). وبالمثل ، فإن المستعمرات الإيجابية ل GFP (الشكل 4F) التي تم حسابها باستخدام المكون الإضافي للبرنامج مقابل الدليل كان لها R2 من 0.90 (الشكل 4G). يمكن تمييز المستعمرات الفلورية مقابل المستعمرات غير الفلورية داخل عينة واحدة ، ويمكن أيضا استخدام حجم المستعمرة وشكلها للتمييز بين المجموعات السكانية الفرعية المنفصلة (الشكل 4H-K). توفر إيصالات الصور سجلا يسمح للمستخدم بالتحقق بسرعة من دقة الأعداد وتصحيح الأخطاء يدويا. في الشكل 4C ، E ، G ، I ، K ، لم يتم استخدام إيصالات الصور لتحسين دقة العد حتى يتمكن القراء من رؤية الإخراج الخام للطريقة. يمكن اكتشاف حالات مثل الشكل 4G ، حيث أدى العد اليدوي ل 1 إلى عد آلي يبلغ 21 ، بسرعة باستخدام إيصالات الصور. في هذه الحالة ، أدى الوهج الموجود على حافة اللوحة إلى إنشاء نقاط تم احتسابها كمستعمرات. لكل حالة استخدام، يجب تحديد الإعدادات المثلى للمكون الإضافي للبرنامج قبل حساب الإنتاجية العالية.

الشكل 1: يقيس اختبار الاستعمار CFUs في مئات الذباب الفردي باستخدام شكل لوحة 96 بئر. (أ) نظرة عامة مصورة على مقايسة الاستعمار وطريقة القياس الكمي عالية الإنتاجية المستخدمة كما هو موضح في قسم البروتوكول. (ب) تم قياس وفرة Lactiplantibacillus plantarum (Lp) في الذباب بعد مقايسة الاستعمار في ظل ظروف مختلفة باستخدام طريقة القياس الكمي CFU عالية الإنتاجية. تم الاحتفاظ بالذباب في نفس القارورة لمدة 3 أيام ثم تم تجانسه وطلائه (غير مغسول) ، وغسله في الإيثانول قبل الطلاء (غسله) ، وغسله ونقله كل يوم (منقولة) ، ونقله يوميا ثم حفظه على طعام معقم قبل الطلاء (بعد النقل) ، أو حفظه في قوارير مع الماء فقط لمدة 4 ساعات (تم تطهيره) (ن = إجمالي 724 ذبابة ، 3 مكررات بيولوجية و ~ 72 ذبابة إجمالا لكل علاج). (ج) تم إجراء نفس الفحص كما في (B) باستخدام Acetobacter indonesiensis (Ai) (n = 528 ذبابة). (د) تم تحضير المعلق البكتيري Lp في PBS ثم تم طلاؤه لحساب CFUs أو تم تجانسه أولا عن طريق ضرب الخرز ، أو ضرب الخرز بالاشتراك مع ذبابة خالية من الجراثيم (GF) ، أو هزه على مضرب الخرز بدون خرز أو ذبابة (ن = 236 عينة آبار). (ه) تم اختبار التجانس اللاحق لجدوى الذكاء الاصطناعي بنفس الطريقة كما في (D) (n = 282 عينة من الآبار). تم حساب الدلالة الإحصائية للوحات (B-E) باستخدام اختبار Kruskal-Wallis متبوعا باختبارات مجموع رتبة Wilcoxon الزوجية مع تصحيح مقارنات Bonferroni المتعددة. مربع يعطي المدى الربيعي. يشير الخط إلى الوسيط. شعيرات تعطي النطاق الكلي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
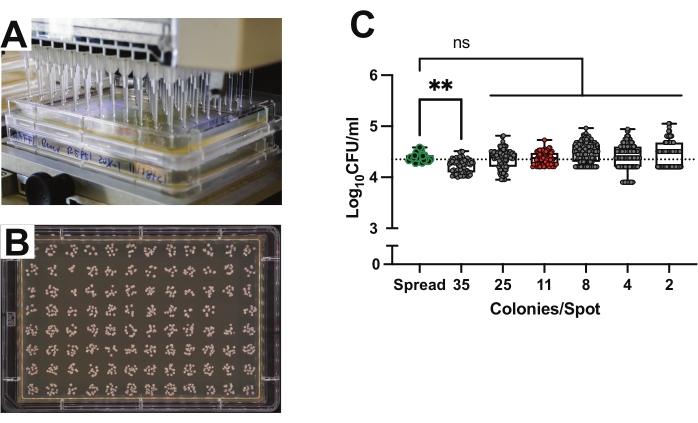
الشكل 2: دقة الطلاء الموضعي لألواح 96 بئرا لقياس كمية CFU عالية الإنتاجية. (أ) الطلاء الموضعي باستخدام ماصة ذات 96 قناة لتوزيع 2 ميكرولتر على وسائط محضرة في ألواح صينية مستطيلة. (ب) صفيحة نمو MRS-agar مع 96 بقعة من مستعمرات Lp . (C) تركيز معلق Lp بناء على عدد CFU من الصفائح المستديرة التقليدية (n = 24 لوحة) مقارنة بالتركيز بناء على عدد CFU من الصفائح الموضعية (n = 680 بقعة) مخففة بشكل متسلسل ومرتبة حسب متوسط عدد المستعمرات لكل بقعة (~ تم حساب 48 بقعة لكل عامل تخفيف واحد لثلاث لوحات مكررة). تمثل كل نقطة بيانات المستعمرات الدقيقة لكل بقعة ، بينما يمثل كل عمود متوسط المستعمرات لهذا التخفيف. يشير الخط المنقط الأفقي إلى عدد CFU المحسوب للثقافة المطلية. تبرز النقاط الخضراء المحددة عدد الألواح المستديرة التقليدية. تسلط النقاط المملوءة باللون الأحمر الضوء على كثافة المستعمرة المثلى البالغة 11 وحدة CFU لكل بقعة 2 ميكرولتر. تم حساب الدلالة الإحصائية باستخدام ANOVA العادي أحادي الاتجاه بمقارنة متوسط كل عمود مقابل متوسط عمود التحكم في لوحة الانتشار مع تصحيح المقارنات المتعددة لبونفيروني. مربع يعطي المدى الربيعي. يشير الخط إلى الوسيط. شعيرات تعطي النطاق الكلي. ** ص < 0.01. NS = غير مهم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: تنتج منصة التصوير الفوتوغرافي صورا قابلة للقياس الكمي للألواح باستخدام الضوء الأبيض أو التألق . (أ) نظرة عامة على تصميم FluoroBox. (ب) صورة لصفيحة موضعية لمستعمرات Lp تستخدم الضوء الأبيض. (ج) ملف تعريف الشدة للمستعمرات المفردة تحت الضوء الأبيض مقارنة بكثافة الخلفية (BKG) (n = 10 مستعمرات ، يمثل الخط المتقطع الانحراف المعياري). (د) صورة لنفس اللوحة الموضعية كما في (B) ، باستخدام أضواء خضراء أحادية اللون ومرشح أحمر لتحديد مستعمرات Lp إيجابية mCherry. (ه) ملف تعريف الكثافة للمستعمرات المفردة يوضح الفرق بين المستعمرات مع وبدون انبعاث mCherry . (و) صورة للوحة موضعية تحتوي على مستعمرات منظمة العفو الدولية، وبعضها يحمل علامة GFP. (ز) ملف تعريف كثافة المستعمرات المفردة يوضح الفرق بين المستعمرات السلبية ل GFP والمستعمرات الإيجابية ل GFP. E ، F ، G: n = 10 مستعمرات لكل قطعة أرض. أقطار المستعمرة حوالي 1.5 مم. الخط المتقطع هو SD. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
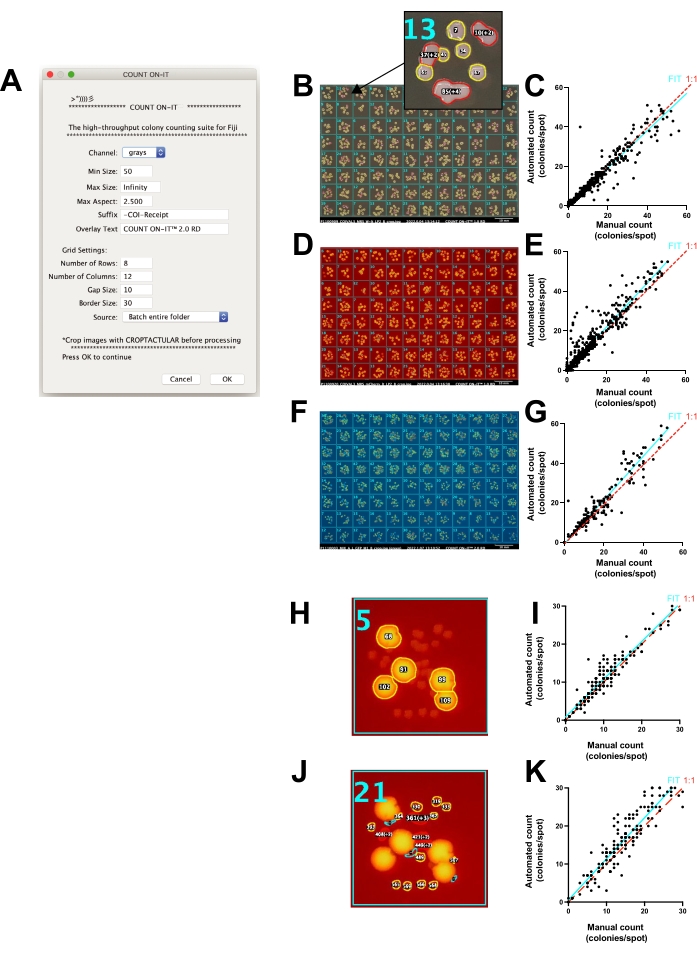
الشكل 4: العد الدقيق للوحات الموضعية بواسطة المكون الإضافي ImageJ Count-On-It. (A) لقطة شاشة لنافذة إعداد المكون الإضافي. (ب) ينشئ المكون الإضافي إيصالا لعد المستندات والمساعدة في تصحيح الأخطاء. الداخلي: تراكب مع عدد المستعمرات المحسوبة لكل منطقة بقعة ؛ يشير المخطط الأصفر إلى أنه تم حساب مستعمرة واحدة والأحمر إلى أنه تم حساب مستعمرات متعددة. (ج) مخطط يوضح عدد المستعمرات التي تم عدها يدويا مقارنة بعدد المستعمرات التي تم عدها باستخدام المكون الإضافي (آلي) عند استخدام صورة الضوء الأبيض ، حيث تمثل كل نقطة على الرسم البياني نقطة واحدة يتم عدها يدويا أو تلقائيا (ميل الملاءمة = 0.95 ، الخط السماوي ؛ خط 1: 1 منقط باللون الأحمر ؛ R2 = 0.93 ، معامل ارتباط بيرسون ، p < 0.0001). (د) صورة إيصال الصورة من المكون الإضافي عند تحديد مستعمرات mCherry الإيجابية باستخدام ميزة التألق في صندوق الصور. (ه) مخطط يوضح عدد المستعمرات الموجبة للكرز التي تم حسابها يدويا مقارنة بالطريقة الآلية عند استخدام التألق الأحمر (ميل الملاءمة = 1.1 ، الخط السماوي ؛ الخط 1: 1 منقط باللون الأحمر ؛ R2 = 0.92 ، معامل ارتباط بيرسون ، p < 0.0001). لاحظ أنه لم يتم تصحيح القيم المتطرفة والأخطاء باستخدام إيصالات التحليل ل E و G و I و K. (F) صورة إيصال الصورة من المكون الإضافي عند تحديد المستعمرات الإيجابية ل GFP باستخدام ميزة التألق الأخضر لمربع الصور وتحديد القناة الخضراء مع المكون الإضافي. (ز) رسم بياني يوضح عدد المستعمرات الموجبة ل GFP التي تم حسابها يدويا مقارنة بالطريقة الآلية عند استخدام الإضاءة الفلورية الخضراء (ميل الملاءمة = 1.1 ، الخط السماوي ؛ الخط 1: 1 منقط باللون الأحمر ؛ R2 = 0.90 ، معامل ارتباط بيرسون ، p < 0.0001). (H) مستعمرات إيجابية الكرز مختارة من مورفولوجيا مستعمرة مختلطة باستخدام عتبة مضان عالية في المكون الإضافي. (I) رسم يوضح عدد المستعمرات الموجبة للكرز التي تم حسابها يدويا مقارنة بالطريقة الآلية عند استخدام الإضاءة الفلورية الحمراء (ميل الملاءمة = 0.99 ؛ R2 = 0.91 ، معامل ارتباط بيرسون ، p < 0.0001). (J) مستعمرات سالبة الكرز منتقاة من مورفولوجيات مستعمرة مختلطة باستخدام عتبة مضان منخفضة. (K) رسم بياني يوضح عدد المستعمرات السلبية mCherry التي تم حسابها يدويا مقارنة بالطريقة الآلية عندما تم تعيين عتبة الكثافة لاختيار مستعمرات غير فلورية (ميل الملاءمة = 1.1 ؛ R2 = 0.85 ، معامل ارتباط بيرسون ، p < 0.0001). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الملف التكميلي 1: تعليمات تجميع FluoroBox. يسير هذا الملف القارئ خطوة بخطوة من خلال بناء صندوق الإضاءة المتحكم فيه المستخدم في الفيديو. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 2: قطع ليزر الأكريليك FluoroBox. يوفر هذا الملف قالب قطع لقطع الأكريليك بالليزر لصندوق الإضاءة الذي يتم التحكم فيه. يمكن إرسال الملف إلى بائع أكريليك مقطوع بالليزر. راجع جدول المواد للبائع المستخدم في هذا البروتوكول. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 3: تعليمات البرنامج. يوجه هذا الملف القارئ خطوة بخطوة خلال تثبيت واستخدام برنامج Croptacular و Count-On-It المتوفر مع هذا البروتوكول. الرجاء الضغط هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 1: رمز الطباعة ثلاثي الأبعاد لدرج قياس الخرز (S1-bead-measurer.stl). الرجاء الضغط هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 2: البرنامج المساعد ImageJ لقص صور اللوحة المستطيلة (Croptacular_.ijm). الرجاء الضغط هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 3: البرنامج المساعد لقص الصور المستديرة (Circus_.ijm). الرجاء الضغط هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 4: لوحة مستطيلة 96 بقعة عداد البرنامج المساعد (Gridiron_.ijm). الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
تتيح التقنيات التفصيلية المقدمة هنا زيادة >100 ضعف في عدد العينات التي يمكن تقييمها في تجربة عد CFU. تعمل هذه التقنية على تطوير الطرق الحالية لتجارب الميكروبيوم في ذبابة الفاكهة12،35،36 باستخدام تنسيق لوحة 96 بئرا لفحص الذباب الفردي. علاوة على ذلك ، فإنه يطبق طريقة طلاء موضعي أكثر كفاءة 19,31 وسير عمل آلي مع منصة للتصوير الفوتوغرافي وعد المستعمرات. تكمن أهمية هذه الطريقة بالنسبة لذبابة الفاكهة في توحيد التجارب على شكل لوحة 96 بئرا ، مما يتيح المعالجة المتزامنة لعدد كبير من النسخ البيولوجية المكررة مع الأتمتة لتحقيق تقدير كمي عالي الإنتاجية لوحدات CFUs.
تظهر المنصة المكونة من 96 بئرا أن زيادة وتيرة النقل و "تطهير" البكتيريا العابرة تسبب انخفاضا كبيرا في كل من متوسط الوفرة والتباين بين العينات (الشكل 1B ، C) ، مما يدل على صرامة هذا البروتوكول المحسن. أحد قيود الذباب المشترك هو النقل الأفقي للبكتيريا بين الذباب. الحل المقترح هو الاحتفاظ بالذباب بشكل فردي في شكل لوحة 96 بئرا ، مثل Whole Animal Feeding Flat38.
على الرغم من عدم ملاحظة انخفاض كبير في الحمل البكتيري عندما تم غسل الذباب في الإيثانول ، إلا أن هذه الذباب لم يتم الاحتفاظ بها إلا في وجود بكتيريا خارجية لمدة 3 أيام. يمكن أن يسمح السكن لفترات زمنية أطول بتراكم حمولة بكتيرية أكبر39. لذلك ، لا يزال يوصى بالغسيل في الإيثانول.
يعد نقل الذباب إلى لوحة 96 بئرا الخطوة الأولى الحاسمة لإعداد سير العمل (الشكل 1 أ). بمجرد غسل الذباب ، يتم توزيعه في الآبار واحدا تلو الآخر. يعد مخطط اللوحة مفيدا في هذه المرحلة لملاحظة الظروف الموجودة في كل بئر وإضافة أي ملاحظات مثل "فقدت الذبابة". التجانس هو خطوة حاسمة أخرى مع بعض المحاذير الهامة. تنجو البكتيريا من عملية التجانس عندما تكون في وجود ذبابة (الشكل 1D ، E) ، ويفترض أن هذا المبدأ صحيح أيضا عندما تكون البكتيريا داخل أمعاء الذبابة. ومع ذلك ، يتم قتل البكتيريا أيضا عندما يتم تجانسها في ألواح مضرب الخرز وحدها ، مما يدل على أن التجانس يمكن أن يقتل الخلايا البكتيرية في ظروف معينة ، وهو قيد قد يكون مهما إذا كان المرء يجانس الشجاعة المشرحة ، على سبيل المثال. والجدير بالذكر أن فقدان CFUs عند التجانس يعتمد على عدد وحدات CFU في العينة ، وتكون الخسارة ضئيلة عند استخدام ~ 105 CFUs لكل بئر. يمكن تحقيق مزيد من الحفاظ على CFUs عن طريق إيقاف التجانس في منتصف الطريق وتبريد اللوحة على الجليد.
تم إجراء التجانس لمدة 5 دقائق في هذا البروتوكول بناء على تجارب التحكم حيث تم خلط عدد معروف من وحدات CFU مع ذبابة خالية من الجراثيم ، وهذا عمل تجريبيا مع بكتيريا الذباب. تسبب الضرب الأقل في وجود أجزاء ذبابة أكبر ، مما يتداخل مع السحب ، في حين أن أوقات التجانس الأطول بكثير ~ 10 دقائق جعلت أعداد CFU أكثر تباينا. لوحظ أن الحجم الأصغر والشكل الزاوي للآبار المخروطية يقلل من كفاءة ضرب الخرز مقارنة بالأنابيب الأسطوانية سعة 2 مل. العديد من الاختلافات في هذا النهج العام ممكنة ، بما في ذلك السلالات البكتيرية ، وحاوية ضرب الخرز ، والخرز ، والنمط الجيني للذبابة المستخدم. تحتاج حالات المستخدم الفردية إلى استخدام ضوابط إيجابية لتحديد نهجها.
تم استخدام طريقة الطلاء الموضعي بطريقة محددة: تم رصد التخفيفات 1: 2 من L. plantarum WF في PBS على ألواح MRS وتم تحضينها عند 30 درجة مئوية لمدة يومين (يمكن تنفيذ أوقات حضانة أقصر لتوليد أحجام مستعمرة أصغر). تتطلب الطريقة بعض الاستثمار المسبق في المعدات ، في المقام الأول مضرب الخرز والماصة ذات 96 قناة (الشكل 2 أ) ، وهو أمر ضروري لكل من سلسلة التخفيف والطلاء الموضعي. ومع ذلك ، تتوفر خيارات أقل تكلفة ، بما في ذلك جهاز نسخ لوحة 96 بئرا مع دبابيس مشقوقة. سلسلة التخفيف هي خطوة حاسمة تؤثر على دقة نتائج عد CFU. فيما يتعلق بأوضاع الفشل ، من الممكن سد أطراف الماصة بأجزاء ذبابة أو خرز زجاجي وعدم إغلاق أطراف الماصة بشكل صحيح على الماصة أو الفشل لسبب آخر. كل هذه المشاكل تؤدي إلى العد الناقص للآبار المتضررة ويجب مراقبتها. يعد الخلط الكافي في كل خطوة من سلسلة التخفيف أمرا بالغ الأهمية أيضا. يجب خلط كل تخفيف جيدا إما عن طريق وضع اللوحة على شاكر لوحة أو عن طريق سحب لأعلى ولأسفل 15-20 مرة ، مما يعمل أيضا على شطف الأطراف. من خلال الإكتشاف من اللوحة الأكثر تخفيفا إلى الأقل تمييعا ، يمكن إعادة استخدام الأطراف لسلسلة التخفيف بأكملها. مع التخفيفات 1: 2 ، يكون العد دقيقا على نطاق من 2-25 مستعمرة ، تمتد بترتيب من حيث الحجم (الشكل 2C). لذلك ، 1:10 التخفيفات توفر الوقت والمواد. متغير آخر يمكن الاستفادة منه هو وقت الحضانة ، والذي يمكن تعديله لإنتاج مستعمرات أصغر ، وبالتالي زيادة نطاق البقع القابلة للعد عن طريق منع دمج المستعمرات المجاورة.
تعد الصورة عالية الجودة للوحة ضرورية لأنها تصبح بيانات المصدر الخام التي يتم من خلالها تحليل وحدات CFU ويمكن أرشفتها إلى أجل غير مسمى. تم تصميم FluoroBox لإنتاج صور للألواح بكثافة ضوء موحدة ، مما يقلل من الوهج على سطح الآجار. بالإضافة إلى ذلك ، فإن التصميم قادر على تصوير مستعمرات الفلورسنت بشكل انتقائي باستخدام مصابيح LED أحادية اللون ومرشحات الصور الملونة (الشكل 3 أ). يمكن أن يؤدي إنشاء إعداد مثل FluoroBox ، مع إعدادات الإضاءة والكاميرا التي يتم التحكم فيها ، إلى زيادة كبيرة في قابلية استنساخ صور CFU ، وهو أمر مهم للتحليل الآلي. مورفولوجيا المستعمرة ، وشدة التألق ، وتأثيرات الوقت أو الكثافة على نمو المستعمرة ليست سوى عدد قليل من الخصائص التي يمكن تحليلها باستخدام الصور. يمكن إنشاء صندوق الصور بدون مرشحات الألوان والأضواء أحادية اللون إذا لم يتم استخدام بكتيريا الفلورسنت ، مما يقلل من التكلفة والتعقيد. يمكن استبدال مصابيح الإثارة المختلفة ومرشحات الانبعاث بتلك الموصى بها هنا إذا تم استخدام فلوروفور مختلف من قبل المختبر. تعد الكاميرا المتصلة بجهاز لوحي عبر شبكة WiFi باستخدام تطبيق مفيدة لكل من ميزة الغالق الآلي لمنع الاهتزاز ولسهولة نقل البيانات. يمكن نقل الصور إلى الجهاز اللوحي ثم إلى جهاز كمبيوتر محمول باستخدام برنامج نقل الملفات اللاسلكي. يشار إلى الكاميرات الموصى بها بهذه الإمكانات في جدول المواد.
Count-On-It هو مكون إضافي مكتوب في ImageJ. يقوم برنامج حساب CFU الآلي بتقسيم صورة اللوحة إلى شبكة موحدة مكونة من 96 بئرا ، ويحسب المستعمرات في كل خلية شبكة ، ويجمع النتائج في جدول بيانات بسيط. نظرا لوجود اختلاف دائما في موضع الشبكة الموضعية على اللوحة وفي الصورة ، يجب على المستخدم مطابقة الشبكة يدويا مع الصورة باستخدام المكون الإضافي Croptacular . يساعد هذا أيضا في استبعاد المناطق القريبة من حافة اللوحة ، والتي لها وهج. يعد تعيين العتبة أمرا أساسيا للحصول على عدد CFU الأكثر دقة من الصورة. إذا تم تعيين العتبة عالية جدا ، دمج المستعمرات ؛ إذا تم تعيين العتبة منخفضة للغاية ، استبعاد المستعمرات. بمجرد تعيين العتبة، يطبق الماكرو تمويه غاوسي لتنعيم الحواف وتقليل التعرج، ويقسم مرشح مستجمعات المياه المستعمرات المتداخلة، ويتم حساب النقط باستخدام تحليل الجسيمات.
في بعض الأحيان ، تكون كثافة المستعمرات عالية جدا في بقعة معينة. يوفر الاعتماد على طريقة للتعامل مع هذا. لتقدير عدد المستعمرات في خلية شبكية ذات مستعمرات مدمجة جزئيا ، يتم أولا أخذ متوسط مساحة النقطة الدائرية من اللوحة بأكملها على أنها C avg. بعد ذلك ، يتم تقسيم مساحة النقطة A 1 على متوسط مساحة النقطة الدائرية A1 / Cمتوسط. يتم تقريب هذا الرقم إلى أقرب عدد صحيح ، وهذا هو تقدير عدد المستعمرات الموجودة في النقطة. هذه الوظيفة هي أحد الأسباب التي تجعل العتبة يمكن أن تؤثر على نتائج العد: سيختلف المتوسط النسبي لمنطقة المستعمرة مقابل منطقة النقطة المدمجة اعتمادا على كيفية تأثر العتبة بالنقط المدمجة.
الأساليب المقدمة لها العديد من القيود. وتشمل هذه الحاجة إلى معدات لتوزيع الوسائط السائلة بدقة من 96 لوحة بئر. يمكن أن تكلف هذه المعدات ، إما ماصة ذات 96 قناة أو أداة دبوس نسخ مشقوق ، آلاف الدولارات للحصول عليها. توجد بدائل أرخص ولكنها أقل دقة. العد الآلي عبر Count-On-It يقدم أيضا بعض القيود. على سبيل المثال ، إذا تم تحديد نوعين من المستعمرات في مجموعة سكانية مختلطة بناء على الحجم وحده ، فلن يتمكن عد النقاط من تعيين مستعمرات للنوع الصحيح. في هذه الحالة ، يجب إزالة البقع ذات النقط من العد. سيكون المزيد من التمايز بين المستعمرات على أساس التشكل امتدادا قيما للطريقة التي لم يتم تنفيذها حاليا. إن استخدام الوسائط الانتقائية بما في ذلك العناصر الغذائية والمضادات الحيوية الخاصة بالسلالة يبسط الحاجة إلى تحليل الصور المعقدة.
إن الحفاظ على تجارب ذبابة الفاكهة في 96 لوحة بئر يضاعف عدد العينات والظروف التي يمكن اختبارها في تجربة واحدة ويمكن أن يسهل الشاشات عالية الإنتاجية في الأنماط الظاهرية لجمعية ذبابة الفاكهة. نتصور أنه يمكن توسيع هذه الطريقة باستخدام وسائط انتقائية للتمييز بين العديد من السلالات البكتيرية في المخاليط المعقدة. لا تقتصر الطريقة على دراسة ميكروبيوم الذبابة. يعد القياس الكمي لوحدات CFU أمرا شائعا في العديد من تطبيقات علم الأحياء الدقيقة ، من تعداد القولونيات في مياه الشرب إلى تحديد مسببات الأمراض. يتيح نظام طلاء CFU المعروض هنا شاشات عالية الإنتاجية ، بالإضافة إلى الاستحواذ الآلي على النتائج ومعالجتها وتخزينها وتسليمها.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
قدم الدكتور كيروين كيسي هوانغ والدكتور أندريس أراندا دياز وتيد كوبر وأعضاء مختبر لودينجتون مدخلات قيمة حول تطوير هذا البروتوكول. تم توفير التمويل من قبل NSF IOS منحة 2032985 ، ومنحة المعاهد الوطنية للصحة DP5OD017851 ، ومنحة معهد كارنيجي الكندي ، ووقف معهد كارنيجي للعلوم.
Materials
| Name | Company | Catalog Number | Comments |
| Bead beating and spot plating | |||
| Fly vials | Genesee | 32-121 | autoclavable |
| Fly vial stoppers | Genesee | 59-201 | autoclavable |
| Hand Applicator | 3M | 3M PA1 | |
| Heat Sealer | Eppendorf | 5390 | |
| Mini-Beadbeater 96 | BioSpec | 1001 | |
| Mini-BeadBeater Glass Mill Beads, 0.5 mm | BioSpec | 11079105 | |
| MPS 1000 Mini PCR Plate Spinner | Labnet | LI-CF-P1000 | |
| Rainin BenchSmart 96 semi-automated pipettor | Mettler Toledo | 30296705 | Less expensive options available, including slotted 96 well pin tool from VP Scientific |
| TempPlate semi-skirted 96-well PCR plate, straight skirt, natural | USA scientific | 1402-9220 | Must be polypropylene for heat sealer |
| Thermal Bond Heat Seal Foil | 4titude | 4ti-0591 | Keep sterile |
| Tray Plate,128 x 85 mm, Polystyrene, Sterile | SPL Life Sciences | 31001 | For making rectangular agar plates |
| Photobox construction | |||
| ¼”-20 X ½” Bolts (X2) | Amazon | ASIN: B07BP1WR3H | To attach the camera bracket. Brand not important. Any 1/4"-20 1/2" bolt works. |
| ¼”-20 x ½” Connector Nut | Amazon | UPC: 799862376780 | AKA cap nut or connector bolt. This is for attaching the rubber bands on the plate holder. Brand not important. |
| ¼”-20 x ¾” bolts (X3) | Amazon | ASIN: B003QZSZY4 | For the plate holder. Brand not important. |
| 1/8” x ½” washer | Amazon | UPC: 611982484599 | Washer for the cap nuts on outside of box. Brand not important. Spray paint black before attaching to blend with the acrylic. |
| 18 Gauge Wire - Two Conductor Power Wire - 18 AWG Power Wire – 10ft | Superbrightleds.com | WP18-2 | |
| 22-10 AWG Red Wire Nut - WN-R2210 – Quantity 4 | Superbrightleds.com | WN-R2210 | |
| 22-18 AWG 3/16in Female Push On Connector - 22-18 AWG – Quantity 3 | Superbrightleds.com | SCFP-2218 | |
| 4" Solderless Clamp-On Jumper Connector - 8mm Single Color LED Strip Lights - Quantity 3 | Superbrightleds.com | SBL-MA2P-8-2 | |
| 4" Solderless Clamp-On Pigtail Adaptor - 8mm Single Color LED Strip Lights – Quantity 3 | Superbrightleds.com | SBL-MA2P-8-1 | |
| 6” drawer handle | Amazon | ASIN: B07Z331P99 | Any drawer handle should work. |
| 6” Drawer slides | Btibpse | UPC: 712243424979 | Trim the soft close rubber stoppers on the drawer sliders. |
| 8-32 x ½” Cap Nuts (x4) | Amazon | ASIN: B00HYLZB98 | Attaches drawer slide bolts on outside of box. Brand not important. Nylon won't damage the acrylic. Spray paint black before attaching to blend with the acrylic. |
| 8-32 x ½” Nylon Bolts (x4) | Amazon | ASIN: B07KX9T7NF | To attach drawer slides. Brand not important. Any bolt or machine screw meeting the specifications works. Nylon won't damage the acrylic and allows you to cut the bolt flush with the nut. Spray paint black before attaching to blend with the acrylic. |
| Acrylic Glue | SCIGRIP | Ean: 7844908489337 | SCIGRIP Weld-On #4 Adhesive, Pint and Weld-On Applicator Bottle with Needle |
| Black Cable Ties - 10 Pack - 4 Inch Long | Superbrightleds.com | CT-B04-10 | |
| Camera L-Bracket | WLPREOE, Vikerer, Unbranded | ASIN: B09X46YKQZ | The bracket should be "reversed" from its intended configuration so that the camera is on the "outside" of the L. Some brackets come in two pieces and allow for this alternate configuration, some don't, you'll need one that can be flipped. Also should have 1/4" holes for attachment. WLPREOE, Vikerer, Unbranded. Amazon Serial Identification Number given as an example. |
| Canon T series camera for tethering option OR | Canon, Panasonic, Sony, Nikon, etc.. | 1894C002 | The Canon Ti series cameras are a good option and can tether to a computer. Use with the 18-55mm standard kit lens. Used options are recommended from the Canon T5 to T7 (current model). |
| Custom Length Single Color LED Strip Light - Eco Series Tape Light - 24V - IP20 - 250 lm/ft - Blue - 2 meters | Superbrightleds.com | STN-BBLU-B6A-08C1M-24V | |
| Custom Length Single Color LED Strip Light - Eco Series Tape Light - 24V - IP20 - 250 lm/ft - Green – 2 meters | Superbrightleds.com | STN-BGRE-B6A-08C1M-24V | |
| Custom Length Single Color LED Strip Light - Eco Series Tape Light - 24V - IP20 - 250 lm/ft - Natural White 4000K – 2 meters | Superbrightleds.com | STN-A40K80-B6A-08C1M-24V | |
| Drill with ¼”, 1/8” drill bits | Black & Decker | BDCDD12PK | Brand not important. |
| Flat Black Spray Paint, 2X Ultra-Matte | Rustoleum | 331182 | Paint the interior of everything FLAT black. Brand not important. |
| Laser Cut Acrylic Walls | Big Blue Saw | www.bigbluesaw.com | Use the attached PDF, delete all cutouts in the top piece except desired hole for camera |
| Mean Well LED Switching Power Supply - LPV Series 20-100W Single Output LED Power Supply - 24V DC - 20 Watt | Superbrightleds.com | LPV-20-24 | |
| Panasonic ZS100 for wifi connection to a phone, tablet, or computer | Canon, Panasonic, Sony, Nikon, etc. | DMC-ZS100K | Panasonic cameras can be wirelessly connected to a computer for data transfer and remote shutter options. Used options are good. |
| Quick Release Plate | Neewer Aluminium 50mm Quick Release Plate QR Clamp 3/8-inch with 1/4-inch | ASIN: B07417F21D | Add this to the bracket so the camera can be easily removed for changing color filters. Amazon Serial Identification Number given as an example. |
| Rubber Bands, Assorted sizes | BAZIC Products | Alliance Rubber 26649 | Rubber bands go on the plate holder. Brand not important. |
| Screw/Adhesive Cable Tie Mounting Bases - 3/4 inch base – Quantity 4 | Superbrightleds.com | CTMB-20 | |
| SPST Round Rocker Switch - No LED – Quantity 3 | Superbrightleds.com | RRS-SP | |
| Tiffen 29 Filter (Red) 72 mm | Tiffen | 72R29 | |
| Tiffen 58 Filter (Green) 72 mm | Tiffen | 7258 | |
| Software | |||
| ImageJ64 | https://imagej.net/downloads | N/A | Free. Just cite: Schindelin, J., Arganda-Carreras, I., Frise, E., Kaynig, V., Longair, M., Pietzsch, T., … Cardona, A. (2012). Fiji: an open-source platform for biological-image analysis. Nature Methods, 9(7), 676–682. doi:10.1038/nmeth.2019 |
| MacOSX | Apple | N/A | Has a useful batch rename feature in Finder to rename a group of photos to facilitate organizing and analyzing in Count-on-it. |
| Unix | BSD | N/A | 64 bit |
| Windows | Microsoft | N/A | 64 bit |
References
- McFall-Ngai, M., et al. Animals in a bacterial world, a new imperative for the life sciences. Proceedings of the National Academy of Sciences. 110 (9), 3229-3236 (2013).
- Shepherd, E. S., Deloache, W. C., Pruss, K. M., Whitaker, W. R., Sonnenburg, J. L. An exclusive metabolic niche enables strain engraftment in the gut microbiota. Nature. 557 (7705), 434-438 (2018).
- Taur, Y., et al. Intestinal domination and the risk of bacteremia in patients undergoing allogeneic hematopoietic stem cell transplantation. Clinical Infectious Diseases. 55 (7), 905-914 (2012).
- Buffie, C. G., et al. Precision microbiome reconstitution restores bile acid mediated resistance to Clostridium difficile. Nature. 517 (7533), 205-208 (2015).
- Callahan, B. J., et al. DADA2: High-resolution sample inference from Illumina amplicon data. Nature Methods. 13 (7), 581-583 (2016).
- Vandeputte, D., et al. Temporal variability in quantitative human gut microbiome profiles and implications for clinical research. Nature Communications. 12 (1), 6740(2021).
- D'hoe, K., et al. Integrated culturing, modeling and transcriptomics uncovers complex interactions and emergent behavior in a three-species synthetic gut community. eLife. 7, 2892(2018).
- Ludington, W. B., Ja, W. W. Drosophila as a model for the gut microbiome. PLoS Pathogens. 16 (4), 1008398(2020).
- Chandler, J. A., Lang, J. M., Bhatnagar, S., Eisen, J. A., Kopp, A. Bacterial communities of diverse Drosophila species: Ecological context of a host-microbe model system. PLoS Genetics. 7 (9), 1002272(2011).
- Pais, I. S., Valente, R. S., Sporniak, M., Teixeira, L. Drosophila melanogaster establishes a species-specific mutualistic interaction with stable gut-colonizing bacteria. PLoS Biology. 16 (7), 2005710(2018).
- Adair, K. L., et al. Host determinants of among-species variation in microbiome composition in drosophilid flies. The ISME Journal. 14, 217-229 (2019).
- Koyle, M. L., et al. Rearing the fruit fly Drosophila melanogaster under axenic and gnotobiotic conditions. Journal of Visualized Experiments. (113), e54219(2016).
- Lesperance, D. N. A., Broderick, N. A. Microbiomes as modulators of Drosophila melanogaster homeostasis and disease. Current Opinion in Insect Science. 39, 84-90 (2020).
- Grenier, T., Leulier, F. How commensal microbes shape the physiology of Drosophila melanogaster. Current Opinion in Insect Science. 41, 92-99 (2020).
- Broderick, N. A., Lemaitre, B. Gut-associated microbes of Drosophila melanogaster. Gut Microbes. 3 (4), 307-321 (2012).
- Tkacz, A., Hortala, M., Poole, P. S. Absolute quantitation of microbiota abundance in environmental samples. Microbiome. 6 (1), 110(2018).
- Téfit, M. A., Gillet, B., Joncour, P., Hughes, S., Leulier, F. Stable association of a Drosophila-derived microbiota with its animal partner and the nutritional environment throughout a fly population's life cycle. Journal of Insect Physiology. 106, 2-12 (2017).
- Ryu, J. -H., et al. Innate immune homeostasis by the homeobox gene caudal and commensal-gut mutualism in Drosophila. Science. 319 (5864), 777-782 (2008).
- Sieuwerts, S., De Bok, F. A. M., Mols, E., De Vos, W. M., Van Hylckama Vlieg, J. E. T. A simple and fast method for determining colony forming units. Letters in Applied Microbiology. 47 (4), 275-278 (2008).
- Eckburg, P. B., et al. Diversity of the human intestinal microbial flora. Science. 308 (5728), 1635-1638 (2005).
- Newell, P. D., Douglas, A. E. Interspecies interactions determine the impact of the gut microbiota on nutrient allocation in Drosophila melanogaster. Applied and Environmental Microbiology. 80 (2), 788-796 (2013).
- Costello, E. K., et al. Bacterial community variation in human body habitats across space and time. Science. 326 (5960), 1694-1697 (2009).
- Fadrosh, D. W., et al. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform. Microbiome. 2 (1), 6(2014).
- Vega, N. M., Ludington, W. B. From a parts list to assembly instructions and an operating manual: How small host models can re-write microbiome theory. Current Opinion in Microbiology. 64, 146-151 (2021).
- Samuel, B. S., Rowedder, H., Braendle, C., Félix, M. -A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10, 1998-2009 (2016).
- Sundarraman, D., et al. Higher-order interactions dampen pairwise competition in the zebrafish gut microbiome. mBio. 11 (5), 1-15 (2020).
- Douglas, A. E. Simple animal models for microbiome research. Nature Reviews Microbiology. 17, 764-775 (2019).
- Friedman, J., Higgins, L. M., Gore, J. Community structure follows simple assembly rules in microbial microcosms. Nature Ecology & Evolution. 1, 0109(2017).
- Gilchrist, J. E., Campbell, J. E., Donnelly, C. B., Peeler, J. T., Delaney, J. M. Spiral plate method for bacterial determination. Applied Microbiology. 25 (2), 244-252 (1973).
- Thomas, P., Sekhar, A. C., Upreti, R., Mujawar, M. M., Pasha, S. S. Optimization of single plate-serial dilution spotting (SP-SDS) with sample anchoring as an assured method for bacterial and yeast cfu enumeration and single colony isolation from diverse samples. Biotechnology Reports. 8, 45-55 (2015).
- Nuñez, I., et al. Low cost and open source multi-fluorescence imaging system for teaching and research in biology and bioengineering. PLoS One. 12 (11), 0187163(2017).
- Putman, M., Burton, R., Nahm, M. H. Simplified method to automatically count bacterial colony forming unit. Journal of Immunological Methods. 302 (1-2), 99-102 (2005).
- Ashburner, M. Drosophila. A Laboratory Handbook. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, New York. (1989).
- Dodge, R., et al. A gut commensal niche regulates stable association of a multispecies microbiota. bioRxiv. , (2021).
- Obadia, B., et al. Probabilistic invasion underlies natural gut microbiome stability. Current Biology. 27 (13), 1999-2006 (2017).
- Vega, N. M., Gore, J. Stochastic assembly produces heterogeneous communities in the Caenorhabditis elegans intestine. PLoS Biology. 15 (3), 2000633(2017).
- Jaime, M., et al. The high-throughput WAFFL system for treating and monitoring individual Drosophila melanogaster adults. bioRxiv. , (2018).
- Ren, C., Webster, P., Finkel, S. E., Tower, J. Increased internal and external bacterial load during Drosophila aging without life-span trade-off. Cell Metabolism. 6 (2), 144-152 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved