Method Article
초파리 마이크로바이옴에 적용된 96웰 플레이트 형식의 빠른 콜로니 형성 단위 계수
요약
이 방법은 콜로니 형성 단위(CFU)를 플레이트하기 위해 96웰 플레이트 형식을 사용하여 미생물 풍부도를 정량화하고 전체 파리 균질물 샘플의 초파리 마이크로바이옴에 적용됩니다. CFU는 여기에 제공된 자동 이미지 분석 소프트웨어로 계산됩니다.
초록
동물의 내장은 숙주 발달, 건강 및 행동에 영향을 미치는 공생 미생물에 의해 식민지화됩니다. 집락화의 정확한 정량화는 미생물 구성을 검증하고 그 효과를 연구하기 위해 숙주와 미생물 간의 복잡한 상호 작용을 연구하는 데 필수적입니다. 초파리 멜라노가스터는 토착 미생물 다양성이 낮고 정의된 미생물 구성으로 사육하기에 경제적이며 장내 미생물군집을 연구하기 위한 모델 유기체로 부상했습니다. 개별 유기체의 미생물군집을 분석하려면 어떤 미생물 종이 존재하는지 식별하고 절대 풍부도를 정량화해야 합니다. 이 기사는 많은 수의 개별 파리 미생물 군집을 분석하는 방법을 제시합니다. 파리는 96웰 플레이트에서 준비되므로 한 번에 많은 수의 샘플을 처리할 수 있습니다. 미생물 풍부도는 일련의 반점에서 단일 한천 플레이트에 최대 96 개의 전체 파리 균질 물을 도금 한 다음 각 지점에서 자라는 집락 형성 단위 (CFU)를 계산하여 정량화됩니다. 이 도금 시스템은 ImageJ 플러그인을 사용하여 플레이트 사진, 형광 콜로니 분화 및 콜로니 자동 계수를 통합하는 자동화된 CFU 정량화 플랫폼과 쌍을 이룹니다. 장점은 (i) 이 방법이 처리 간의 차이를 감지할 만큼 충분히 민감하고, (ii) 스폿 도금 방법이 기존 도금 방법만큼 정확하며, (iii) 자동 계수 공정이 수동 계수보다 정확하고 빠르다는 것입니다. 여기에 제시된 워크플로우는 많은 수의 반복에서 CFU의 고처리량 정량화를 가능하게 하며 체외 및 기타 소형 동물 모델을 포함한 다른 미생물학 연구 시스템에 적용할 수 있습니다.
서문
장내 미생물총과 동물 숙주 사이의 관계는생물학적 연구1의 최전선에 점점 더 많이 등장하고 있으며, 이는 미생물군집의 균주 구성이 숙주 생리학 2,3,4에 중요하다는 것을 보여줍니다. 발견의 속도는 높은 자연적 개인 간 변이 및 식민지 박테리아 5,6,7의 높은 다양성과 같은 교란 요인에 의해 제한되었습니다. 초파리인 초파리 멜라노가스터(Drosophila melanogaster)는 자연적으로 낮은 다양성의 미생물군집, 취급 용이성 및 강력한 숙주 유전학 8,9,10,11로 인해 유망한 모델로 부상했습니다. 파리는 무균으로 만들 수 있고 정의된 미생물총(12)과 재연관될 수 있으며, 식물상이 파리의 생리학적 형질(13,14)에 영향을 미치는 것으로 나타났다. 타고난 식물상은 모두 배양 가능한 제한된 박테리아 세트로 구성되며, 이들의 가까운 친척도 락토바실러스, 프로테오박테리아 및 엔테로코커스15를 포함한 포유류의 장에 내인성입니다.
숙주 특성에 대한 마이크로바이옴의 영향을 연구하려면 존재하는 종과 절대 풍부도 측면에서 마이크로바이옴을 정량화해야 합니다16. 파리 마이크로바이옴을 분석하는 주된 방법은 콜로니 형성 단위(CFU) 카운트17, 16S rRNA 유전자 앰플리콘 시퀀싱9 및 16S rRNA 유전자18의 qPCR입니다. CFU 계수는 값비싼 시약 없이 얻을 수 있고, 이들은 박테리아 세포(19)의 생존성을 확인한다. qPCR을 포함하는 16S 기술은 미생물의 분류학적 정체성이 그들의 성장 요건 또는 콜로니 형태학에 관계없이 확인될 수 있다는 점에서 이점이 있다(20).
실험에서 알려진 박테리아(gnotobiotic flies)의 정의된 마이크로바이옴이 있는 파리를 사용하는 경우 CFU 카운트는 시퀀싱21에 비해 특별한 이점이 있습니다. 시퀀싱은 비용이 많이 들고 DNA 추출, PCR 기반 라이브러리 준비 및 상대적 풍부도를 얻기 위해 고처리량 시퀀싱이 필요합니다22. 높은 비용으로 인해, 고처리량 시퀀싱 방법은 일반적으로 샘플당 가격을 낮추기 위해 대량으로 수행될 필요가 있다(23). 절대 풍부도16을 얻기 위해서는 qPCR과 같은 추가 방법이 필요합니다. 대조적으로, CFU 카운트는 빠르고 저렴하며 생존 가능한 세포의 절대 수를 제공합니다. 초파리8 및 기타 작은 마이크로바이옴 모델 24, 웜, Caenorhabditis elegans 25,26 및 뇨토비오로 성장한 유충 제브라피쉬, 다니오 레리오(Danio rerio)27을 포함하여, 제한된 범위의 박테리아를 가지며, 이는 알려진 성장 특성28을 갖는다. 이러한 경우, 특히 gnotobiotic 동물의 경우, CFU 계수는 다종 장내 공동체 21,27,29 내의 모든 박테리아 종을 구별 할 수 있습니다. 더 높은 처리량의 CFU 계수 방법은 마이크로바이옴의 구성을 측정하는 비용 효율성과 속도를 더욱 향상시키고 다른 많은 미생물학 실험에 적용할 수 있습니다.
한천 기반 성장 배지에서 박테리아 현탁액의 연속 희석 도금으로 CFU를 계수하는 것은 미생물학 분야의 표준 방법입니다. 그런 다음 판에서 자라는 식민지를 수동으로 계산합니다. 희석을 통해 연구원은 셀 수 있는 콜로니 밀도(예: 플레이트당 ~100CFU)를 선택할 수 있으며, 이는 콜로니가 서로 성장하지 않고 합리적인 시간 내에 계산될 수 있음을 의미합니다. 대부분의 미생물학자들은 140년 전 Robert Koch의 실험실에서 개발된 것과 본질적으로 동일한 CFU 계수 방법을 사용하며 많은 응용 분야에서 이 방법이 여전히 적합합니다. 그러나 많은 수의 샘플을 정량화하려고 할 때 문제가 발생합니다. 단일 샘플은 가산 가능한 CFU를 얻기 위해 샘플의 1-10 연속 희석을 도금해야 할 수 있으므로 수십 개 이상의 샘플을 포함하는 실험은 부담이됩니다. CFU 열거의 효율성을 높이기 위해 다양한 방법이 개발되었습니다. 자동 나선형 도금은 연속 희석(30)의 필요성을 제거하여 CFU 계수에 하나의 플레이트만 필요하지만 샘플을 도금하는 시간을 늘립니다. 단일 플레이트 직렬 희석 스포팅 (SP-SDS)은 샘플 당 더 적은 플레이트에서 CFU 추정을 허용합니다31. 이러한 방법은 기존의 확산 도금 방법을 개선한 것이지만 여전히 박테리아 시료를 단독으로 취급 및 도금해야 하므로 높은 처리량에는 적합하지 않습니다. 96웰 플레이트에서 샘플을 처리하고 직사각형 한천 플레이트에서 96개의 샘플을 스폿 플레이팅하면 샘플(19)의 처리량이 크게 향상됩니다.
마이크로바이옴은 일반적으로 여러 균주와 종으로 구성됩니다. 종은 종종 콜로니 형태 또는 성장 배지에 의해 구별될 수 있지만, 형광은 상이한 유형의 박테리아 및 이들의 성장 형질을 추가로 구별하기 위해 사용될 수 있다(32). 예를 들어, 동일한 종의 다른 유전자형은 서로 다른 유전적으로 암호화된 형광 단백질로 표지될 수 있습니다. 형광을 포함하는 플레이트 이미징 방법을 통해 연구자들은 CFU 기반 분석에서 이러한 유전 기술을 활용할 수 있습니다32. 형광을 고처리량 CFU 계수 방법에 통합하면 유용성이 더욱 향상됩니다.
CFU를 수동으로 계수하는 것은 샘플 수가 많은 경우 번거로워집니다. CFU의 자동 계수는 플레이트를 촬영하고 특수 소프트웨어(33)를 사용하여 이미지를 처리함으로써 수행될 수 있다. Sieuwerts 등은 종래의 디지털 사진 및 ImageJ 소프트웨어19를 사용하여 자동 콜로니 계수와 스폿 도금의 향상된 도금 효율을 결합했다.
특정 미생물 및 숙주 협회의 표현형을 스크리닝하는 고처리량 방법은 마이크로바이옴 커뮤니티 어셈블리와 숙주 건강 및 피트니스에 미치는 영향에 대한 연구에 도움이 될 것입니다. 초파리 마이크로바이옴 연구를 위해 고처리량 미생물학 플랫폼은 96웰 플레이트 형식의 파리 샘플 처리, 박테리아 용해 없는 파리 용해, 스팟 플레이팅의 효율성, 형광을 사용하고 다중 형광단을 구별하는 기능, CFU 플레이트의 재현 가능한 이미징을 위한 제어된 조명 환경 및 신뢰할 수 있는 자동 콜로니 계수 소프트웨어를 통합합니다. 이 기사에서는 간단하고 빠르며 자동화된 gnotobiotic 파리의 CFU 분석에 최적화된 방법을 설명합니다. 이 프로토콜은 이전에 발표된 최고의 방법을 결합하고 초파리의 장내 마이크로바이옴을 탐색하는 데 최적화된 새로운 워크플로를 설명합니다.
프로토콜
1. 비행 식민지화
참고: 이 방법은 CFU의 성장 도금에 의한 배양 가능한 장내 마이크로바이옴이 있는 파리의 정량 분석에 적합합니다. gnotobiotic 파리를 사육하기위한 자세한 프로토콜은 이전에 발표되었습니다12.
- 공생 박테리아 종에 의한 안정적인 식민지화를 확립합니다.
- 새로운 박테리아 배양물을 준비하고, 실온에서 3분 동안 400 x g에서 원심분리하여 펠릿을 만들고, 세포 펠렛을 PBS 중에 1.0의 OD600으로 재현탁시킨다. 이 프로토콜을 위해, 락티플란티바실러스 플란타룸(이전에는 락토바실러스 플란타룸으로 알려짐)을 하룻밤 사이에 OD600 2.0으로 성장시켰다.
- 플라이 바이알의 음식에 100 μL를 피펫팅합니다( 재료 표 참조). 고르게 펴 바르고 액체가 15-30 분 동안 흡수되도록하십시오.
- 20개의 무균 파리를 표준 바이알 대 바이알 뒤집기 기술34를 사용하여 이 바이알 내로 옮깁니다. 각 파리는 대략 동일한 양의 박테리아 용량35를 먹습니다. 또는 무균 계란을 추가할 수 있습니다.
- 파리를 매일 3 일 동안 신선한 멸균 식품으로 옮깁니다. 이 모든 것을 생물안전 캐비닛에서 수행하고 멸균 기술을 사용하십시오(그림 1A-1).
- CFU 부하를 측정하기 전에 파리를 멸균 한천 물이 들어있는 바이알로 4 시간 동안 옮겨 장에서 일시적인 박테리아를 제거합니다. 한천 물 바이알은 파리에게 수분 공급원을 제공하지만 파리나 표면의 박테리아에는 영양을 공급하지 않습니다. 그들은 표준 식품과 동일한 멸균 플라이 바이알에서 준비되지만 탈 이온수와 1.5 % 한천 만 포함합니다.
2. 96웰 PCR 플레이트에서 개별적으로 파리를 균질화
- 비드 비터 플레이트를 미리 준비하십시오.
- 0.5μm 유리 비드( 재료 표 참조)를 비드 측정 트레이( 보충 코딩 파일 1 S1-bead-measurer.stl의 도움으로 3D 프린팅)에 붓습니다. 모든 우물이 가득 차고 수평이 되도록 트레이에 구슬을 펼친 다음 여분의 구슬을 원추형 튜브에 털어 회수합니다.
- 세미 스커트 PCR 플레이트( 재료 표 참조)를 측정 트레이에 거꾸로 놓고 측정 트레이의 움푹 들어간 곳에 끼워 웰과 맞춥니다. 그런 다음 빠르게 뒤집어 구슬을 옮깁니다.
- PCR 플레이트 표면에서 과도한 비드를 제거하고 호일로 덮습니다. PCR 플레이트를 검사하여 모든 웰에 구슬이 포함되어 있는지 확인합니다. 단일 웰에 비드를 추가하기 위해 필요한 경우 계량 스쿱을 사용하십시오. 정전기로 인해 플레이트 표면에 비드가 달라붙는 경우 측정 트레이와 PCR 플레이트 뒷면을 70% 에탄올로 닦거나 스프레이합니다.
- 알루미늄 호일로 덮으십시오. 이러한 방식으로 많은 플레이트를 준비한 다음 나중에 사용하기 위해 고압멸균 및 보관할 수 있습니다. 사용할 준비가 되면 96채널 피펫터를 사용하여 각 웰에 100μL의 PBS를 추가합니다( 재료 표 참조).
- 균질화 전에 미생물 군락화 된 파리 (1 단계 참조)를 70 % 에탄올로 표면 살균하십시오.
- 파리를 100 % CO2로 5 초 동안 마취하십시오. 작은 깔때기를 사용하여 바이알에서 1.5mL 미세 원심분리 튜브로 마취된 파리를 옮깁니다(그림 1A-2). 이 연구에서는 일반적으로 튜브 당 25 마리의 파리가 추가되었습니다.
- 즉시 ~1mL의 70% 에탄올을 튜브에 뿌리고 튜브를 닫고 10초 동안 뒤집어 혼합합니다. 그런 다음 파리를 흡인하지 않도록 주의하면서 P1000 피펫으로 에탄올을 흡입합니다. 에탄올로 다시 한 번 반복 한 다음 멸균 PBS로 두 번 반복합니다 (그림 1A-3).
- 최종 PBS 세척 후 튜브를 닫고 캡 면이 아래로 향하도록 벤치에서 몇 번 세게 두드려 파리가 캡에 들어가도록 합니다.
- 튜브를 열고 집게를 사용하여 우물에 파리를 분배합니다 (그림 1A-4). 각 웰에 파리 한 마리씩 놓습니다(그림 1A-5). 파리를 마취 상태로 유지하기 위해 적재하는 동안 접시를 얼음 위에 보관하십시오.
- 열 결합 열 밀봉 호일을 사용하여 플레이트를 밀봉하십시오( 재료 표 참조).
- 먼저 우물에 가까운 흩어진 구슬은 호일 씰에 누출을 일으킬 수 있으므로 제거하십시오. 호일의 둔한 면이 플레이트에서 아래로 향하고 반짝이는 면이 히트 실러를 향하도록 하십시오. 히트 실러(재료 표 참조)를 5초 동안 단단히 누릅니다(그림 1A-6). 핸드 애플리케이터(재료 표 참조)로 광택을 내어 호일을 고정합니다.
참고: 밀봉 불량은 시료 손실의 원인입니다.
- 먼저 우물에 가까운 흩어진 구슬은 호일 씰에 누출을 일으킬 수 있으므로 제거하십시오. 호일의 둔한 면이 플레이트에서 아래로 향하고 반짝이는 면이 히트 실러를 향하도록 하십시오. 히트 실러(재료 표 참조)를 5초 동안 단단히 누릅니다(그림 1A-6). 핸드 애플리케이터(재료 표 참조)로 광택을 내어 호일을 고정합니다.
- 플레이트 셰이커에 플레이트를 고정합니다. 5 분 동안 균질화합니다 (그림 1A-7). 미니 플레이트 스피너(재료 표 참조)에서 비드 플레이트를 350 x g으로 30초 동안 돌려 밀봉 호일에서 액체를 제거합니다.
- 우물에서 파리 균질 물 방울이 튀지 않도록 플레이트를 잡고 호일을 제거하십시오.
3. CFU 플레이트에 파리 균질액과 스포팅의 연속 희석
- 4 개의 직사각형 MRS 한천 성장 플레이트 ( 재료 표 참조)를 생물 안전 캐비닛에 놓고 뚜껑을 제거합니다. 이 프로토콜에서 MRS 한천은 L. plantarum의 성장에 사용되었습니다. 이 접시를 최소 10분 동안 건조시키십시오(보관에서 갓 붓거나 차갑게 부은 경우 20분).
알림: 플레이트가 젖 으면 96 웰 플레이트의 물방울이 함께 흐르고 카운트를 망칠 수 있습니다. - 96채널 피펫터를 사용하여 멸균된 96웰 플레이트의 각 웰에 100μL의 PBS를 추가하여 3개의 희석 플레이트를 준비합니다. P20 팁 랙을 96채널 피펫터에 로드합니다.
- 섹션 2에서 준비한 샘플 플레이트에서 11.1μL의 균질액을 흡인하여 1:10 희석을 만듭니다(그림 1A-8). 파리 균질액과 유리 구슬이 피펫을 막을 수 있으므로 우물 바닥이 아닌 우물 중앙에서 그려야 합니다. 구슬이 가라 앉고 파리 미립자가 떠 다니며 중간 층은 대부분 투명합니다.
- 11.1 μL를 이미 웰당 100 μL의 멸균 PBS가 들어 있는 첫 번째 희석 플레이트에 분주합니다. 희석 플레이트를 플레이트 셰이커에 600rpm에서 10초 동안 유지합니다. 5주기 동안 위아래로 피펫팅하여 다시 혼합합니다. 11.1 μL를 제1 희석 플레이트로부터 제2 희석 플레이트로 옮기고, 다음 2개의 희석 플레이트에 대해 혼합 단계를 반복한다.
- 아래 설명된 대로 희석 시리즈 도금을 수행합니다.
- 생물안전 캐비닛에서 성장판을 회수합니다.
- 가장 희석된 플레이트부터 시작하여 96웰 피펫터를 사용하여 각 웰에서 한천 플레이트로 2μL를 스폿합니다(그림 1A-9).
- 피펫터 헤드를 플레이트 위로 천천히 내리고 한천에 찌르지 않도록 주의하십시오. 플레이트를 주의 깊게 검사하고 모든 지점이 분배되었는지 확인하십시오. 그렇지 않은 경우 적절한 위치에 2μL를 수동으로 추가합니다. 액체 반점이 한천에 빨리 스며 들어 함께 움직이지 않는지 확인하십시오.
- 반점이 함께 달리면 새로운 한천 접시 세트를 더 오랜 기간 동안 말리고 얼룩을 다시하십시오. 여러 플레이트 유형(예: 다른 배지 또는 항생제 포함)이 있는 경우 해당 플레이트도 발견하십시오. 남은 용액을 희석 플레이트에 다시 분주하고 다음으로 더 높은 농도로 진행합니다.
알림: 희석액을 발견할 때 다음 희석액을 5회 혼합하여 피펫 팁의 내용물이 이전 희석액에서 제거되도록 합니다. 희석 플레이트는 콜로니 카운트(35)에 영향을 주지 않고 4°C에서 >8 h 저장될 수 있다.
- 나머지 희석 플레이트에 대해 단계 3.5에 기재된 바와 같이 도금 공정을 반복하고, 플레이트가 원래의 균질액이 될 때까지 가장 희석된 것부터 가장 농축된 것까지 진행한다.
- 모든 액체가 한천에 흡수되면 플레이트를 뒤집어 인큐베이터에 넣으십시오 (그림 1A-10). 초파리의 락티플란티바실러스 및 아세토박터의 경우 MRS 배지에서 최적 온도는 30°C입니다. 콜로니가 최적의 크기에 도달 할 때까지 배양하십시오 : 콜로니는 명확하게 볼 수있을만큼 충분히 크지 만 너무 커서 병합되거나 서로의 성장을 방해하지는 않습니다 (최적 크기의 정량화는 대표 결과 참조).
참고: 최적의 성장 조건은 균주에 따라 다르며 경험적으로 결정되어야 합니다. 초파리의 락티플란티바실러스의 경우 최적의 배양 시간은 MRS 한천에서 26시간에서 30시간입니다. 초파리의 아세토 박터의 경우, 배양의 최적 시간은 균주에 따라 MRS에서 30 시간에서 48 시간입니다. - 배양 후, 필요한 경우 계수할 준비가 될 때까지 플레이트를 4°C에서 보관합니다.
4. CFU의 정량화
- 아래에 자세히 설명된 대로 플레이트를 촬영한 다음 자동화된 소프트웨어를 사용하여 콜로니를 계산하여 CFU를 정량화합니다. 플레이트를 4°C에서 보관한 경우 먼저 플레이트에 결로가 발생하여 눈부심이 발생하지 않도록 실온에 도달하도록 합니다.
- 플레이트를 논리적인 순서로 구성하고 사진을 찍는 동안 순서대로 유지하면 파일 이름을 더 쉽게 지정할 수 있습니다. A1이 모든 플레이트의 왼쪽 상단 모서리에 오도록 모든 플레이트의 방향을 지정합니다. 사진이 섞이지 않도록 A1 모서리에 고유 ID를 표시하는 것이 좋습니다. 각 희석 시리즈를 순서대로 쌓습니다.
- 플레이트 뚜껑을 제거하고 A1이 올바른 모서리를 향하도록 플레이트를 스테이지에 놓습니다. 플레이트 사진 상자(보충 파일 1, 보충 파일 2)에 대한 디자인이 포함되어 있으며, 이 상자는 이러한 트레이 플레이트 촬영에 최적화되어 있으며 형광 콜로니를 이미지화하는 조명 및 필터 옵션을 포함합니다.
- 접시를 이미지화합니다. 카메라( 재료 표 참조)를 수동 설정으로 사용하여 플레이트 사이에 일관된 노출 수준을 얻으십시오. 원근 왜곡을 최소화하기 위해 긴 초점 거리 설정을 권장합니다. 카메라 흔들림으로 인한 흐림을 최소화하기 위해 원격 셔터를 사용하여 사진을 캡처합니다.
- 이미지를 컴퓨터로 전송하고 실험 이름, 배지 유형, 희석 계수 및 기타 관련 세부 정보를 포함하여 이름을 바꿉니다. 일부 운영 체제( 재료 표 참조)에는 Finder에서 선택한 파일을 마우스 오른쪽 버튼으로 클릭하여 유용한 일괄 이름 바꾸기 기능이 있습니다.
5. Count-On-It 제품군을 사용한 자동 식민지 계수 (보충 파일 3)
- ImageJ에 제공된 자르기 플러그인(보조 코딩 파일 2)을 사용하여 이미지를 자릅니다. 이 플러그인은 이미지를 하위 영역의 정렬 배열로 나누는 데 도움이됩니다 (예 : 96 웰 플레이트의 경우 8 x 12). 하위 지역은 개별적으로 계산됩니다.
참고 : 서커스라고하는 원형 플레이트를 계산하기위한 별도의 플러그인은 보충 코딩 파일 3 Circus_.ijm에 설명되어 있습니다.- 정량화를 위해 처리할 이미지를 폴더로 구성합니다. 플레이트를 구별하는 파일 이름을 선택하면 이러한 파일 이름이 각 카운트 집합에 대한 열 제목이 됩니다. 이 폴더 내에서 "잘린" 및 "영수증"이라는 하위 폴더를 만듭니다.
- 자르기를 시작하고 확인을 클릭하여 자르기를 시작합니다.
참고: 기본 설정이 표시되며 일반적으로 충분합니다. 이미지의 해상도, 조명, 스폿 크기 등에 따라 기본 매개 변수를 조정하는 것이 도움이 될 수 있습니다. - 이미지가 이미 직선이면 스페이스바를 누르기만 하면 됩니다. 그렇지 않으면 수평이되어야하는 가장자리를 따라 선을 그려 이미지를 똑바로 펴십시오. 이미지가 여전히 똑바르게 표시되지 않는 경우 필요한 만큼 선을 다시 그립니다.
- 다음으로 계산을 수행 할 영역의 경계 상자를 그립니다. 모든 반점이 셀 안에 있을 때까지 크기와 비율을 조정합니다. 커서를 경계 상자 밖으로 끌어 그리드를 새로 고칩니다. 그리드가 좋아 보이면 스페이스바를 누릅니다.
- 다음 이미지가 첫 번째 이미지와 동일한 각도로 자동으로 회전하는지 확인하십시오. 플러그인은 모든 사진이 동일하게 정렬되었다고 가정합니다. 이것이 정확하면 스페이스바 를 눌러 계속합니다. 그렇지 않으면 이전과 같이 이미지를 똑바르게 합니다. 그리드는 또한 이전 이미지와 동일한 위치를 호출합니다. 필요한 경우 조정한 다음 스페이스바를 누릅니다.
- 제공된 Count-On-It: ImageJ용 그리드아이언 플러그인(보충 코딩 파일 4)을 사용하여 플레이트에 콜로니를 열거합니다. 플러그인 설치 및 사용에 대한 자세한 지침은 보충 파일 3에 포함되어 있습니다.
- Count-On-It > Gridiron을 시작하십시오. 자르기와 동일한 그리드 설정을 사용합니다. 사용자는 전체 폴더를 일괄 처리하거나, 단일 이미지를 분석하거나, 현재 이미지에서 시작할 수 있습니다.
- 상한 및 하한 픽셀 강도 값을 기준으로 임계값을 설정합니다. 모든 식민지를 선택하면서 임계 값을 가능한 한 엄격하게 설정하십시오. 이상적으로는 선택한 콜로니 사이에 약간의 공간이 있지만 소프트웨어는 Blob을 어느 정도 분할할 수 있습니다. 임계값이 만족스러울 때 "작업 필요" 대화 상자에서 확인을 클릭합니다.
- 결과를 검사하려면 확대하여 식민지 수를 더 자세히 살펴보십시오. 취소를 클릭하면 플러그인이 중단됩니다. OK(확인 )를 클릭하여 계속합니다.
- 첫 번째 이미지에서 계속 진행하거나 설정 메뉴로 돌아가는 옵션(예: 최소 콜로니 크기 변경)이 제공되는지 확인합니다. 일괄 처리를 계속하려면 확인을 클릭합니다. 그런 다음 영수증 및 결과 테이블을 보관할 폴더를 선택합니다. "영수증"폴더를 사용하거나 새 폴더를 만듭니다.
- 첫 번째 이미지 이후의 다음 이미지는 기본적으로 이전 설정과 동일한 임계값으로 설정됩니다. 확인을 클릭하여 이러한 설정을 사용하거나 설정을 조정합니다. 사진이 일관되고 설정이 정확하면 "작업 필요" 대화 상자에서 확인을 클릭합니다.
참고: 배치의 모든 이미지가 완료되면 결과 테이블이 영수증과 동일한 폴더에 자동으로 저장됩니다. - 소프트웨어에서 생성된 카운트 영수증을 검토하고 카운트 오류를 수동으로 수정합니다. ImageJ 플러그 인은 통계적으로 정확하지만 오류가 발생합니다. 영수증을 증명하여 이상값을 조사하고 잘못된 계산을 식별합니다. 소프트웨어는 CFU 데이터를 영수증과 동일한 폴더에 .csv 파일로 저장합니다.
- 사용자가 선호하는 소프트웨어를 사용하여 데이터를 분석합니다.
결과
식민지화 분석을 사용하여 96웰 플레이트 형식으로 수백 개의 개별 파리에 대한 CFU 열거
많은 개별 파리 미생물군집의 구성을 이해하기 위해 CFU는 함께 제공되는 프로토콜을 사용하여 측정되었으며, 이를 통해 존재하는 종, 식민지화된 파리의 비율 및 각 파리의 절대 박테리아 풍부도를 식별할 수 있었습니다. 마이크로바이옴 구성에서 관찰된 개인 간 변동이 큰 이유는 잘 이해되지 않았으며 식민지화의 통계적 분포를 정량화하면 이러한 변화를 연구하는 데 도움이 될 수 있습니다36,37. 상당한 수의 생물학적 복제물을 얻기 위해 CFU 카운트를 사용하여 많은 개별 파리에서 미생물 풍부도를 정량화하기 위해 고처리량 파이프라인이 개발되었습니다(그림 1A).
CFU의 최종 정량화는 분석 전에 파리를 처리하는 방법(예: 표면 살균, 박테리아 소비 이후 시간, 장에서 일시적인 박테리아 제거를 포함한 요인)에 의해 영향을 받을 수 있습니다. 첫째, 초파리 공생 박테리아 종 L. plantarum(Lp; Obadia et al.36의 Lp 균주 WF 참조)에 초점을 맞추고, 파리에게 ~10~5CFU의 Lp를 공급하고 바이알당 25마리의 파리 그룹으로 유지했습니다. 이 파리들은 3 일 동안 동일한 바이알에 보관되거나 매일 신선하고 멸균 된 음식으로 옮겨졌습니다 (그림 1B). 그런 다음 옮겨지지 않은 파리를 에탄올로 세척하여 표면 박테리아를 제거하거나(세척) 세척하지 않았습니다(Unwashed). 세척은 측정된 총 CFU에서 유의하지 않은 감소를 생성했으며(그림 1B), 이는 이러한 고도로 통제된 접종 조건에서 파리 표면이 3일 이내에 박테리아에 의해 크게 식민지화되지 않음을 나타냅니다. 파리의 다른 그룹은 음식에 대한 성장으로 인한 박테리아의 축적을 줄이기 위해 매일 옮겨졌습니다 (Transfered). 또한 샘플링 (Post-Transferred) 전에 4 시간 동안 그룹을 신선한 음식으로 옮기거나 일시적으로 섭취 한 미생물이 장에서 제거 할 수 있도록 4 시간 동안 멸균 한천 물만 담긴 바이알에 넣었습니다 (Cleared). 보다 엄격한 집락화 측정을 제공하기 위한 이러한 각 단계는 에탄올의 표면 세척을 제외하고 파리에서 CFU의 풍부도를 통계적으로 유의하게 감소시켰습니다. 측정 전 4시간 동안 멸균 식품(사후 이송) 또는 한천수(투명)로 옮기면 구별할 수 없는 효과가 발생했으며, 이는 측정 4시간 전에 멸균 상태로 옮기면 박테리아 부하가 감소함을 나타냅니다. 이 결과는 파리 장내 일부 장내 박테리아가 일시적 인 반면 다른 박테리아는 더 안정적으로 연관되어 있다는 해석과 일치합니다35. Lp의 풍부도는 클리어 된 파리의 1 x 10 4.3 CFU / 플라이에서 씻지 않은 파리의 1 x 104.9 CFU (n = 724 파리)까지 다양했습니다.
다음으로, 파리 내장을 식민지화하는 그람 음성 박테리아 인 Acetobacter indonesiensis (Ai)를 사용하여 동일한 분석을 수행했습니다 (그림 1C; Obadia et al.36의 Ai SB003 균주 참조). Lp 식민지 파리와 마찬가지로 표면 살균은 CFU를 크게 감소시키지 않았습니다. 마찬가지로, 멸균 식품으로의 일일 이동은 박테리아 부하를 크게 감소시켰고, 균질화 전에 4시간 동안 멸균 상태로 전환하면 박테리아 부하가 더욱 감소했습니다. Ai의 풍부도는 클리어 된 파리의 1 x 104.7 CFU / 플라이에서 씻지 않은 파리의 1 x 105.0 CFU (n = 528 파리)까지 다양했습니다. 따라서 장내 세균의 정확한 정량화는 이송 당일을 포함하여 이송 빈도에 따라 달라집니다. 에탄올로 세척하여 외부 박테리아 부하를 제거하는 것은 유의하지 않은 효과를 가졌지만, 박테리아의 다른 균주 또는 상이한 배양 조건에 대해 더 현저한 효과가 관찰될 수 있다. 이러한 요소는 실험적으로 제어되어야합니다.
CFU 카운트에 대한 균질화 방법의 잠재적 효과도 테스트되었습니다. 파리는 박테리아 세포의 생존력을 감소시킬 수 있는 100μL의 PBS에 0.5μm 유리 비드가 있는 비드 비터를 사용하여 균질화되었습니다. 먼저, 배양물로부터 Lp 박테리아의 현탁액을 PBS에서 준비한 다음, CFU를 양성 대조군으로 계수하기 위해 도말하였다. 동일한 배양물을 비드 비터 플레이트에 넣고, (i) 비드로 균질화하거나, (ii) 비드 및 무균 파리로 균질화하거나, 또는 (iii) 비드 없이 PBS에서 균질화하였다(도 1D). 파리가 존재할 때 비드의 균질화는 용액에서 생존 가능한 세포의 풍부함에 큰 영향을 미치지 않은 반면, 파리가없는 박테리아의 균질화는 상당한 수의 박테리아 세포를 죽였습니다. 비드가 없는 PBS에서의 균질화는 또한 생존 가능한 세포의 수를 상당히 감소시켰다. 유사하게, Ai 생존력은 파리의 존재 하에서 균질화 될 때 보존되는 반면, 파리가없는 균질화는 용액에서 생존 가능한 세포의 수를 감소시켰다 (그림 1E). 이러한 결과는 파리 조직이 균질화 동안 비드에 의해 파괴되는 박테리아를 보호한다는 것을 나타냅니다. 그러나 그림 1D 및 그림 1E의 실험은 웰당 10개 이상의8CFU로 수행되었습니다. 실제로, 웰당 ~106개 이하의 세포가 있는 웰은 비드를 파리 없이 사용할 때 세포 손실이 거의 없는 것으로 나타났습니다. 비드 박동을 통해 중간에 얼음 위에서 플레이트를 냉각하면 세포 생존력도 향상됩니다. 이러한 결과의 중요성은 독자가 이러한 잠재적인 문제를 인식하고 특정 사용 사례에 적합한 컨트롤을 설계해야 한다는 것입니다.
고처리량 CFU 정량화를 위한 스폿 도금 96웰 플레이트의 정확도
목표는 수백에서 수천 개의 개별 파리에 대한 CFU 풍부도를 측정하는 것이기 때문에 기존의 확산 도금 방법은 엄청나게 시간과 재료 집약적입니다. 스폿 도금은 CFU 성장 및 열거를 위한 효과적이고 효율적인 방법입니다19,31. 스팟 도금 방법은 96채널 피펫터를 사용하여 직사각형 트레이 플레이트에서 준비된 배지에 2μL의 박테리아 현탁액을 분주합니다(그림 2A). 각 지점은 단일 샘플의 박테리아 부하를 나타내므로 단일 플레이트로 96 파리를 분석 할 수 있습니다 (그림 2B). 스폿 도금의 정확도는 두 방법 모두에 대해 정확히 동일한 0.0001 OD Lp의 현탁액을 사용하여 성장판을 접종하여 기존 도금과 비교되었습니다. 현탁액을 PBS에서 5회 연속 희석하여 2배 희석하였다. 일대일 비교로서, 50 μL의 접종 물을 개별 원형 플레이트에 펼치거나 직사각형 MRS 플레이트에 2 μL 스팟을 만들었습니다. 이어서, 플레이트를 콜로니가 계수될 때까지 30°C에서 인큐베이션하였다. 각 희석에 대한 결과 CFU 카운트를 사용하여 현탁액의 원래 농도를 계산하고 비교했습니다(그림 2C). 50-500 CFU의 원형 플레이트가 대조군으로 계산되었습니다. 고처리량과 기존 원형 도금 방법 간에 유의미한 차이는 관찰되지 않았습니다.
콜로니의 밀도가 성장 및 정량화에 영향을 미칠 수 있기 때문에 CFU 밀도가 최종 카운트에 미치는 영향을 테스트했습니다. 스팟당 2-25개의 콜로니가 있는 스팟은 기존의 원형 플레이트 방법과 비교하여 최종 카운트에 차이가 없었습니다(그림 2C). 평균 35개의 콜로니가 있는 반점은 대조군 확산판보다 약간 낮게 기울어진 결과를 생성했습니다(그림 2C; p = 0.0017). 개별 지점의 사진을 면밀히 조사한 결과이 왜곡은 빽빽한 지점에서 겹치는 식민지 때문임을 나타냅니다. 스팟 당 평균 11 개의 콜로니가있는 스팟을 기반으로 측정 한 결과 확산 플레이트를 기반으로 한 농도에 가장 가까운 농도가 나타났습니다 (그림 2C; 스프레드 플레이트: 평균 = 1 x 104.4 CFU; SD = 0.086 대 평균 콜로니가 11개인 지점: 평균 = 1 x 104.4 CFU; SD = 0.12, p = 0.42, 웰치의 t-검정).
백색광 또는 형광이 있는 특수 사진 플랫폼을 사용하여 정량화를 위한 고품질 이미지 생성
고처리량 스폿 도금은 자연스럽게 많은 수의 대상 영역을 생성하므로 정확하게 계산해야 합니다. 고품질 사진을 사용하여 데이터를 문서화하고 CFU 계수를 용이하게 할 수 있습니다. 견고하고 간단한 사진 플랫폼은 상업적으로 이용 가능한 재료를 사용하여 개발되었습니다 (그림 3A). 디지털 카메라는 FluoroBox라고 하는 맞춤형 라이트 박스 상단의 브래킷에 부착되었으며 플레이트 중앙에 수직으로 직접 아래를 향하게 했습니다. 착색 방출 필터는 필터 슬라이더를 사용하여 렌즈 앞에 선택적으로 배치되었습니다. 라이트 쉴드는 아래 LED 스트립의 직사광선을 차단하여 렌즈 플레어를 방지했습니다. LED 스트립은 플레이트의 눈부심을 방지하기 위해 위가 아닌 측면에서 플레이트를 비췄습니다. 백색광 외에도 단색 청색 및 녹색 LED를 사용하여 각각 녹색 및 적색 형광 단백질을 여기시켰습니다. 접시는 서랍의 접시 홀더로 제자리에 고정되었으며 서랍에는 접시를 쉽게 삽입할 수 있도록 서랍 슬라이더가 장착되어 있습니다. 전체 설계는 보충 파일 1 및 보충 파일 2에서 사용할 수 있습니다.
Lp 콜로니의 스팟 플레이트 사진은 콜로니를 계산하고 다양한 색상과 형태를 구별하는 데 도움이 되도록 백색광 LED와 디지털 카메라를 사용하여 촬영되었습니다(그림 3B). 조명 강도가 균일한지 검증하기 위해 한천의 배경 강도를 플레이트 사진의 여러 영역에 걸쳐 측정했습니다(그림 3C). 콜로니가 배경과 명확하게 구별 될 수 있음을 입증하기 위해 플레이트의 다른 부분에있는 10 개의 서로 다른 콜로니의 직경에 걸친 강도를 측정하고 배경보다 약 ~ 300 % 높은 것으로 나타났습니다 (그림 3C). 플레이트에 mCherry 형광 단백질 발현 플라스미드와 플라스미드를 포함하지 않은 일부 Lp가 있는 Lp를 접종하여 콜로니는 mCherry 양성 또는 mCherry 음성이었습니다. 이 두 가지 유형의 콜로니를 구별하기 위해 녹색 LED 조명(515-525nm)과 빨간색 필터(Tiffen #29)가 있는 동일한 카메라를 사용하여 플레이트를 촬영하여 mCherry 양성 콜로니가 형광을 발하도록 했습니다(그림 3D). mCherry-양성과 mCherry-음성의 강도 차이는 콜로니 샘플(n = 10 콜로니)에 걸친 강도를 측정하여 정량화되었습니다. m체리 양성 콜로니는 m체리 음성보다 ~1,000% 더 높은 강도였습니다(그림 3E). GFP를 발현하는 Ai의 콜로니와 형광을 발현하지 않는 Ai의 콜로니는 청색 LED 조명(465-475nm)과 녹색 필터(Tiffen #58)를 사용하여 촬영되었습니다(그림 3F). GFP 양성 콜로니는 GFP 음성보다 200% 더 높은 강도를 보였습니다(그림 3G).
맞춤형 ImageJ 플러그인 카운트온잇을 사용한 스팟 플레이트의 CFU 자동 계수
사진만으로도 식민지 계산에 도움이 됩니다(예: 데이터 저장, 데이터 공유, 확대, 오버레이 표시, 색상 분리 등). 그러나 수백 개의 스팟 결과를 수동으로 계산하고 구성하는 작업은 지루하고 시간이 많이 걸리며 최종 계산에서 인간 대 인간 차이가 발생하기 쉽습니다. 계수 프로세스의 속도를 높이고 계수의 재현성을 표준화하기 위해 Count-On-It(그림 4A)이라는 특수 ImageJ 플러그인이 개발되었습니다. 이 플러그인을 사용하면 한천 플레이트에서 CFU를 정확하게 반자동으로 계수할 수 있습니다. 사용자는 먼저 추가 Croptacular 플러그인을 사용하여 이미지를 자르고 똑바르게 하여 카운팅할 이미지를 준비합니다. 사진은 선택적으로 일괄 처리 할 수 있으며 각 플레이트에 대해 임계 값을 조정할 수 있습니다. 몇 가지 다른 옵션을 통해 사용자는 광 파장(RGB 이미지) 조정, 콜로니 크기 범위(픽셀 단위) 설정, 최대 종횡비 변경, 활성 선택 그리드의 크기 사용자 지정 등 플레이트 카운팅의 정확도를 높일 수 있습니다. Count-On-It은 각 플레이트가 CFU 카운트 열로 표시되는 결과 테이블을 출력합니다. 또한 계수 결과를 시각적으로 문서화하고 수동 오류 수정을 지원하는 오버레이를 보여주는 사진 영수증을 생성합니다(그림 4B). 오류가 발생하지만 수동으로 계산된 콜로니 수를 이 플러그인을 사용하여 계산한 콜로니 수와 비교했을 때(그림 4C) 관계는 일반적으로 동일했으며 수동 카운트와 자동 카운트 간의 선형 회귀는 90% 이상의 정확도로 0.95의 기울기를 나타냈지만(R2 = 0.93), 콜로니 수가 20을 초과하면 오류가 증가했습니다.
Count-On-It은 또한 FluoroBox의 형광 기능을 사용하여 형광 콜로니를 별도로 계수하는 데 사용할 수 있습니다. 소프트웨어 플러그인 대 매뉴얼에 의한 mCherry-양성 콜로니 카운트(도 4D)는 R2가0.92였다(도 4E). 유사하게, 소프트웨어 플러그인 대 수동으로 계산된 GFP 양성 콜로니(그림 4F)는R2가 0.90이었습니다(그림 4G). 형광 콜로니와 비형광 콜로니는 단일 샘플 내에서 구별할 수 있으며, 콜로니 크기와 모양을 추가로 사용하여 별도의 하위 집단을 구별할 수 있습니다(그림 4H-K). 사진 영수증은 사용자가 카운트의 정확성을 빠르게 확인하고 수동으로 오류를 수정할 수있는 기록을 제공합니다. 그림 4C, E, G, I, K에서 사진 영수증은 독자가 방법의 원시 출력을 볼 수 있도록 카운트 정확도를 향상시키는 데 사용되지 않았습니다. 그림 4G와 같이 수동 카운트 1이 자동 카운트 21을 산출하는 경우는 사진 영수증을 사용하여 빠르게 감지할 수 있습니다. 이 경우 판 가장자리의 눈부심으로 인해 콜로니로 계산되는 얼룩이 생성되었습니다. 각 사용 사례에 대해 높은 처리량을 계산하기 전에 소프트웨어 플러그인에 대한 최적의 설정을 결정해야 합니다.

그림 1: 집락화 분석은 96웰 플레이트 형식을 사용하여 수백 개의 개별 파리에서 CFU를 측정합니다. (A) 프로토콜 섹션에 설명된 바와 같이 사용된 집락화 분석 및 고처리량 정량화 방법의 그림 개요. (b) 락티플란 티바실러스 플란타 룸(Lp) 개체락타룸 존재비는 콜로니화 분석에 이어 고처리량 CFU 정량법을 사용하여 다양한 조건에서 측정하였다. 파리를 동일한 바이알에 3일 동안 보관한 다음, 균질화 및 도말(Unwashed), 도금 전에 에탄올로 세척(Washed), 매일 세척 및 이송(Transferred), 매일 옮긴 다음 플레이팅 전에 멸균 식품에 보관(Post-Transferred), 또는 4시간 동안 물만 있는 바이알에 보관(Cleared)(n = 총 724마리, 3개의 생물학적 복제 및 처리당 총 ~72마리의 파리). (C) (B)에서와 동일한 분석을 아 세토박터 인도네시아엔시스 (Ai)(n=528 파리)를 사용하여 수행하였다. (d) Lp 박테리아 현탁액을 PBS에서 제조한 다음, CFUs를 계수하기 위해 도말하거나, 비드 비팅에 의해 먼저 균질화하거나, 비드-무세균(GF) 플라이와 조합하여 비드 비팅하거나, 비드 또는 플라이가 없는 비드 비터 상에서 진탕시켰다(n=236 샘플 웰). (e) 균 질화 후 Ai 생존율은 (D)와 동일한 방법으로 시험하였다(n=282 샘플 웰). 패널(B-E)에 대한 통계적 유의성은 Kruskal-Wallis 검정에 이어 Bonferroni의 다중 비교 보정을 사용한 쌍별 Wilcoxon 순위합 검정을 사용하여 계산되었습니다. 상자는 사분위수 범위를 제공합니다. 선은 중앙값을 나타냅니다. 수염은 전체 범위를 제공합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
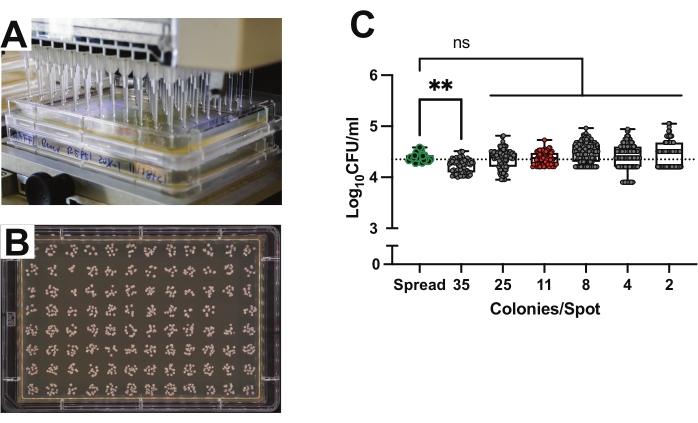
그림 2: 고처리량 CFU 정량화를 위한 스폿 도금 96웰 플레이트의 정확도. (A) 96채널 피펫터를 사용하여 직사각형 트레이 플레이트에서 준비된 매체에 2μL를 분주하는 스팟 플레이팅. (B) 96개의 Lp 콜로니를 갖는 MRS-한천 성장판. (C) 직렬로 희석되고 스팟당 평균 콜로니 카운트로 배열된 스팟 플레이트(n = 680 스팟)의 CFU 카운트를 기반으로 한 농도와 비교하여 전통적인 원형 플레이트(n = 24 플레이트)의 CFU 카운트를 기반으로 한 Lp 현탁액의 농도(3개의 반복 플레이트에 대한 각 단일 희석 계수에 대해 ~48개의 스팟이 계산됨). 각 데이터 포인트는 스팟당 정확한 콜로니를 나타내고 각 열은 해당 희석에 대한 평균 콜로니를 나타냅니다. 수평 점선은 도금된 배양물의 계산된 CFU 수를 나타냅니다. 녹색 윤곽선이 표시된 점은 전통적인 원형 플레이트 수를 강조 표시합니다. 빨간색으로 채워진 포인트는 2μL 스팟당 11CFU의 최적 콜로니 밀도를 강조합니다. 통계적 유의성은 Bonferroni의 다중 비교 보정을 사용하여 각 컬럼의 평균을 확산판 대조군 컬럼의 평균과 비교하는 일반 일원 분산 분석을 사용하여 계산되었습니다. 상자는 사분위수 범위를 제공합니다. 선은 중앙값을 나타냅니다. 수염은 전체 범위를 제공합니다. **p < 0.01. ns = 유의하지 않음. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 사진 플랫폼은 백색광 또는 형광을 사용하여 플레이트의 정량화 가능한 이미지를 생성합니다. (A) 플루오로박스 디자인 개요. (B) 백색광을 이용한 Lp 콜로니의 스팟 플레이트 사진. (c) 배경의 강도(BKG)와 비교한 백색광 하에서의 단일 콜로니의 강도 프로파일(n=10개의 콜로니, 점선은 표준 편차를 나타냄). (D) 단색 녹색 조명과 빨간색 필터를 사용하여 mCherry 양성 Lp 콜로니를 선택하는 (B)와 동일한 스팟 플레이트의 사진. (E) mCherry 방출이 있는 콜로니와 없는 콜로니의 차이를 보여주는 단일 콜로니의 강도 프로파일. (F) Ai 콜로니를 포함하는 스팟 플레이트의 사진, 그 중 일부에는 GFP 라벨이 있습니다. (G) GFP 음성 콜로니와 GFP 양성 콜로니의 차이를 보여주는 단일 콜로니의 강도 프로파일. E, F, G : n = 각 플롯에 대해 10 개의 콜로니. 콜로니 직경은 약 1.5mm입니다. 파선은 SD입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
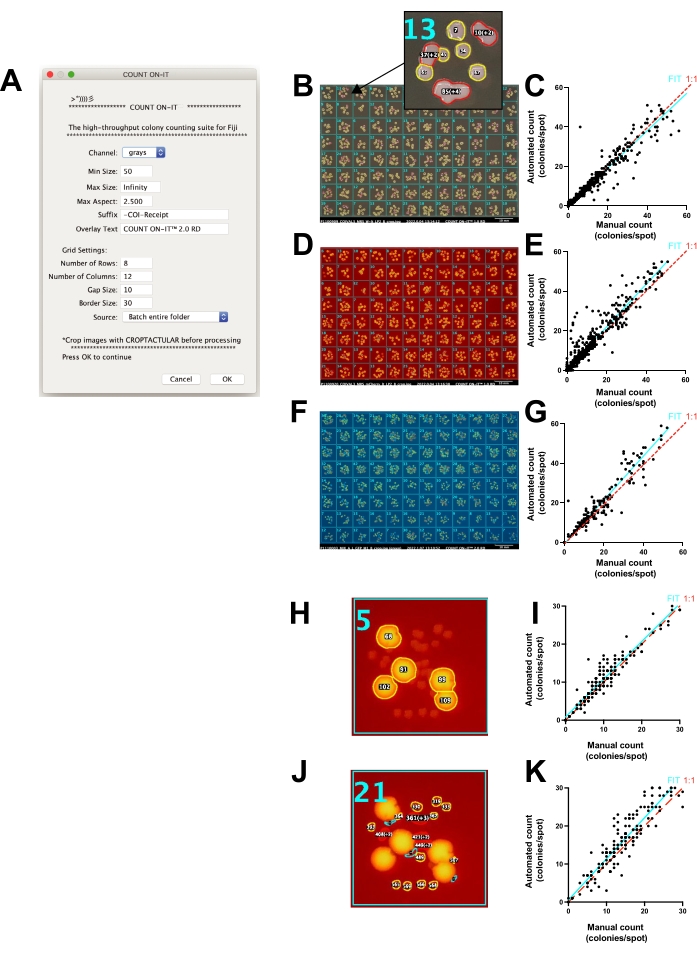
그림 4: Count-On-It ImageJ 플러그인에 의한 스팟 플레이트의 정확한 계수. (ᅡ) 플러그인 설정 창의 스크린샷. (B) 플러그인은 계산을 문서화하고 오류 수정을 돕기 위해 영수증을 생성합니다. 삽입하다: 각 스팟 영역에 대해 계산된 콜로니의 수와 오버레이합니다. 노란색 윤곽선은 단일 식민지가 계산되었음을 나타내고 빨간색은 여러 식민지가 계산되었음을 나타냅니다. (C) 백색광 이미지를 사용할 때 플러그인(자동화)을 사용하여 계수된 콜로니 수와 비교하여 수동으로 계수된 콜로니 수를 보여주는 플롯으로, 여기서 그래프의 각 점은 수동 또는 자동으로 계수된 단일 지점을 나타냅니다(적합도 기울기 = 0.95, 청록색선; 1:1 선은 빨간색 점선; R2 = 0.93, 피어슨 상관 계수, p < 0.0001). (D) 포토박스의 형광 특징을 이용하여 mCherry-양성 콜로니를 선택하였을 때의 플러그인으로부터의 사진 영수증 이미지. (E) 적색 형광을 사용했을 때 자동 방법과 비교하여 수동을 사용하여 계수된 mCherry 양성 콜로니의 수를 보여주는 플롯(적합 기울기 = 1.1, 청록색선; 1:1 선은 빨간색 점선; R2 = 0.92, 피어슨 상관 계수, p < 0.0001). 이상값과 오류는 E,G,I,K에 대한 분석 영수증을 사용하여 수정되지 않았습니다. (F) GFP 양성 콜로니를 포토박스의 녹색 형광 특징을 이용하여 선택하고 플러그인으로 그린 채널을 선택했을 때의 플러그인으로부터의 사진 수신 이미지. (G) 녹색 형광 조명을 사용했을 때 자동 방법과 비교하여 수동 사용하여 계수된 GFP 양성 콜로니의 수를 보여주는 플롯(적합 기울기 = 1.1, 청록색선; 1:1 선은 빨간색 점선; R2 = 0.90, 피어슨 상관 계수, p < 0.0001). (h) mCherry-양성 콜로니는 플러그인에서 높은 형광 역치를 사용하는 혼합 콜로니 형태로부터 선택된다. (I) 적색 형광 조명을 사용했을 때 자동 방법과 비교하여 수동으로 계수 된 mCherry 양성 콜로니의 수를 보여주는 플롯 (적합 기울기 = 0.99; R2=0.91, 피어슨 상관계수, p < 0.0001). (j) 낮은 형광 역치를 사용하는 혼합 콜로니 형태로부터 선택된 mCherry-음성 콜로니. (K) 강도 임계 값이 비 형광 콜로니를 선택하도록 설정된 경우 자동 방법과 비교하여 수동으로 계산 된 mCherry-음성 콜로니의 수를 보여주는 플롯 (적합 기울기 = 1.1; R2 = 0.85, 피어슨 상관 계수, p < 0.0001). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 플루오로박스 조립 지침. 이 파일은 비디오에 사용된 제어된 조명 상자의 구성을 단계별로 독자에게 안내합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: 플루오로박스 아크릴 레이저 절단. 이 파일은 제어 된 조명 상자의 아크릴 조각을 레이저로 절단하는 절단 템플릿을 제공합니다. 파일은 레이저 컷 아크릴 공급 업체로 보낼 수 있습니다. 이 프로토콜에 사용된 공급업체의 재료 표를 참조하십시오. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 3: 소프트웨어 지침. 이 파일은 이 프로토콜과 함께 제공되는 Croptacular 및 Count-On-It 소프트웨어의 설치 및 사용을 통해 리더를 단계별로 안내합니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 파일 1: 비드 측정 트레이( S1-bead-measurer.stl)용 3D 프린팅 코드. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 파일 2 : 직사각형 판 사진 자르기 도구 ImageJ 플러그인 (Croptacular_.ijm). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 파일 3 : 둥근 판 사진 자르기 플러그인 (Circus_.ijm). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 코딩 파일 4: 직사각형 플레이트 96 스팟 카운터 플러그인 (Gridiron_.ijm). 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에 제시된 세부 기술을 통해 CFU 계수 실험에서 평가할 수 있는 샘플 수를 >100배 늘릴 수 있습니다. 이 기술은 개별 파리를 분석하기 위해 96웰 플레이트 형식을 사용하여 Drosophila 12,35,36의 마이크로바이옴 실험을 위한 기존 방법을 발전시킵니다. 또한 보다 효율적인 스폿 도금 방법(19,31)과 사진 및 콜로니 계수 플랫폼을 통한 자동화된 워크플로우를 적용합니다. 초파리에 대한 이 방법의 중요성은 실험을 96웰 플레이트 형식으로 표준화하여 자동화를 통해 많은 수의 생물학적 복제물을 동시에 처리하여 CFU의 고처리량 정량화를 달성할 수 있도록 하는 것입니다.
96웰 플랫폼은 전달 빈도가 증가하고 일시적인 박테리아의 "제거"가 평균 존재비와 샘플 간의 변동을 크게 감소시킨다는 것을 보여주며(그림 1B,C), 이 개선된 프로토콜의 엄격성을 보여줍니다. 공동 주택 파리의 한 가지 한계는 파리 사이의 박테리아의 수평 이동입니다. 제안된 해결책은 Whole Animal Feeding Flat38과 같은 96웰 플레이트 형식으로 파리를 개별적으로 유지하는 것입니다.
파리를 에탄올로 씻었을 때 박테리아 부하의 현저한 감소는 관찰되지 않았지만,이 파리는 3 일 동안 외부 박테리아가있는 곳에서만 보관되었습니다. 더 긴 기간 동안 수용하면 더 큰 박테리아 부하가 축적 될 수 있습니다39. 따라서 에탄올로 세척하는 것이 좋습니다.
파리를 96웰 플레이트로 옮기는 것은 워크플로를 설정하기 위한 중요한 첫 번째 단계입니다(그림 1A). 파리가 씻겨지면 한 번에 하나씩 우물에 분배됩니다. 플레이트 차트는 이 단계에서 각 웰에 어떤 조건이 있는지 확인하고 "파리가 손실되었습니다"와 같은 메모를 추가하는 데 유용합니다. 균질화는 몇 가지 중요한 주의 사항이 있는 또 다른 중요한 단계입니다. 박테리아는 파리가있을 때 균질화 과정에서 살아남 았으며 (그림 1D, E), 아마도이 원리는 박테리아가 파리의 내장 내부에있을 때도 마찬가지입니다. 그러나 박테리아는 비드 비터 플레이트에서만 균질화될 때도 사멸되며, 이는 균질화가 특정 상황에서 박테리아 세포를 죽일 수 있음을 보여주며, 예를 들어 해부된 내장을 균질화하는 경우 중요할 수 있는 한계입니다. 특히, 균질화할 때 CFU의 손실은 샘플의 CFU 수에 따라 달라지며, 웰당 ~105 CFU를 사용할 때 손실이 최소화됩니다. CFU의 추가 보존은 중간에 균질화를 중지하고 플레이트를 얼음 위에서 냉각함으로써 달성할 수 있습니다.
균질화는 알려진 수의 CFU가 무균 파리와 혼합 된 대조 실험을 기반으로이 프로토콜에서 5 분 동안 수행되었으며, 이는 파리 박테리아에 대해 경험적으로 작동했습니다. 박동이 적으면 더 큰 플라이 부품이 존재하여 피펫팅을 방해하는 반면, ~10분의 훨씬 더 긴 균질화 시간으로 인해 CFU 카운트가 더 가변적입니다. 원뿔형 플레이트 웰의 더 작은 부피와 각진 모양은 원통형 2mL 튜브에 비해 비드 박동의 효율성을 감소시키는 것으로 관찰되었습니다. 이 일반적인 접근법에 대한 많은 변형이 가능하며, 여기에는 어떤 박테리아 균주, 어떤 비드 박동 용기, 어떤 비드 및 어떤 파리 유전자형이 사용되는지가 포함됩니다. 개별 사용자 사례는 포지티브 컨트롤을 사용하여 접근 방식을 설정해야 합니다.
스팟 도금 방법은 특정 방식으로 사용되었다 : PBS 중 L. plantarum WF의 1 : 2 희석물을 MRS 플레이트 상에 발견하고, 2 일 동안 30 °C에서 배양 하였다 (더 짧은 배양 시간은 더 작은 콜로니 크기를 생성하기 위해 구현 될 수있다). 이 방법은 주로 비드 비터와 96채널 피펫터(그림 2A)와 같은 장비에 대한 초기 투자가 필요하며, 이는 희석 시리즈와 스폿 도금 모두에 필요합니다. 그러나 슬롯형 핀이 있는 96웰 플레이트 복제기를 포함하여 더 저렴한 옵션을 사용할 수 있습니다. 희석 시리즈는 CFU 계수 결과의 정확도에 영향을 미치는 중요한 단계입니다. 고장 모드의 경우, 플라이 부품 또는 유리 비드로 피펫 팁이 막히고 피펫 팁이 피펫터에 제대로 밀봉되지 않거나 다른 이유로 고장날 수 있습니다. 이러한 모든 문제로 인해 영향을받는 우물이 과소 계산되므로 모니터링해야합니다. 희석 시리즈의 각 단계에서 적절한 혼합도 중요합니다. 각 희석액은 플레이트를 플레이트 셰이커에 올려 놓거나 15-20 회 위아래로 피펫 팅하여 철저히 혼합해야하며, 이는 또한 팁을 헹구는 역할을합니다. 가장 희석된 플레이트에서 가장 덜 희석된 플레이트까지 발견함으로써 팁을 전체 희석 시리즈에 재사용할 수 있습니다. 1:2 희석을 사용하면 2-25개의 콜로니 범위에서 계수가 정확하며 수십 배에 걸쳐 있습니다(그림 2C). 따라서 1:10 희석은 시간과 재료를 절약합니다. 활용할 수있는 또 다른 변수는 배양 시간으로, 더 작은 콜로니를 생성하도록 조정할 수 있으므로 인접한 콜로니의 병합을 방지하여 가산 가능한 지점의 범위를 늘릴 수 있습니다.
플레이트의 고품질 사진은 CFU가 분석되고 무기한 보관할 수 있는 원시 소스 데이터가 되기 때문에 필수적입니다. FluoroBox는 한천 표면의 눈부심을 최소화하는 균일한 광도로 플레이트의 사진을 생성하도록 설계되었습니다. 또한 이 설계는 단색 LED 조명과 컬러 사진 필터를 사용하여 형광 콜로니를 선택적으로 촬영할 수 있습니다(그림 3A). 조명 및 카메라 설정이 제어된 FluoroBox와 같은 설정을 구성하면 CFU 이미지의 재현성을 크게 높일 수 있으며, 이는 자동화된 분석에 중요합니다. 콜로니 형태, 형광 강도, 콜로니 성장에 대한 시간 또는 밀도의 영향은 사진을 사용하여 분석할 수 있는 특성 중 일부에 불과합니다. 형광 박테리아를 사용하지 않는 경우 컬러 필터와 단색 조명 없이 포토 박스를 구성할 수 있어 비용과 복잡성이 줄어듭니다. 실험실에서 다른 형광단을 사용하는 경우 여기에서 권장하는 것을 다른 여기등과 방출 필터로 대체할 수 있습니다. 앱을 사용하여 WiFi를 통해 태블릿에 연결된 카메라는 흔들림을 방지하고 데이터 전송을 용이하게 하는 자동 셔터 기능 모두에 유용합니다. 이미지를 태블릿으로 전송한 다음 무선 파일 전송 소프트웨어를 사용하여 노트북으로 전송할 수 있습니다. 이러한 기능을 갖춘 권장 카메라는 재료 표에 표시되어 있습니다.
카운트 온 잇은 ImageJ로 작성된 플러그인입니다. 자동화된 CFU 계수 소프트웨어는 플레이트 이미지를 균일한 96웰 그리드로 분할하고 각 그리드 셀의 콜로니를 계수한 다음 결과를 간단한 스프레드시트로 배치합니다. 플레이트와 사진에서 스폿 격자의 위치에는 항상 차이가 있으므로 사용자는 Croptacular 플러그인을 사용하여 격자를 사진에 수동으로 맞춰야 합니다. 이것은 또한 눈부심이 있는 플레이트 가장자리 근처의 영역을 제외하는 데 도움이 됩니다. 임계값 설정은 이미지에서 가장 정확한 CFU 계수를 얻는 데 중요합니다. 임계값을 너무 높게 설정하면 식민지가 병합됩니다. 임계값을 너무 낮게 설정하면 콜로니가 제외됩니다. 임계값이 설정되면 매크로는 가우시안 블러를 적용하여 가장자리를 부드럽게 하고 앨리어싱을 줄이고, 유역 필터는 겹치는 콜로니를 분할하고, Blob은 파티클 분석을 사용하여 계산됩니다.
때로는 식민지의 밀도가 특정 지점에서 너무 높습니다. Count-On-It은 이를 처리하는 방법을 제공합니다. 부분적으로 병합된 콜로니가 있는 그리드 셀의 콜로니 수를 추정하려면 먼저 전체 플레이트에서 원형 블롭의 평균 면적을 C평균으로 사용합니다. 이어서, 블롭 A1의 면적을 원형 블롭A1/C 평균의평균 면적으로 나눈다. 이 숫자는 가장 가까운 정수로 반올림되며, 이는 Blob에 있는 콜로니 수에 대한 추정치입니다. 이 함수는 임계값이 계산 결과에 영향을 줄 수 있는 한 가지 이유입니다: 상대 평균 콜로니 영역과 병합된 Blob 영역은 임계값이 병합된 Blob에 미치는 영향에 따라 달라집니다.
제시된 방법에는 몇 가지 제한 사항이 있습니다. 여기에는 96웰 플레이트에서 액체 매체를 정확하게 분주하기 위한 장비의 필요성이 포함됩니다. 96채널 피펫터 또는 슬롯형 복제기 핀 공구인 이 장비는 구입하는 데 수천 달러의 비용이 들 수 있습니다. 더 저렴한 대안이 존재하지만 정확도는 떨어집니다. Count-On-It을 통한 자동 계산에도 몇 가지 제한 사항이 있습니다. 예를 들어, 혼합 개체군의 두 콜로니 유형이 크기만으로 구분된 경우 얼룩 계산은 콜로니를 올바른 유형에 할당할 수 없습니다. 이 경우 Blob이 있는 스폿을 개수에서 제거해야 합니다. 형태학에 기초한 콜로니의 추가 차별화는 현재 구현되지 않은 방법의 가치있는 확장이 될 것입니다. 균주 특이적 영양소 및 항생제를 포함한 선택적 배지를 사용하면 복잡한 이미지 분석의 필요성이 간소화됩니다.
96웰 플레이트에서 초파리 실험을 유지하면 단일 실험에서 테스트할 수 있는 샘플 수와 조건이 늘어나고 초파리-박테리아 연관 표현형에서 고처리량 스크린을 용이하게 할 수 있습니다. 우리는 이 방법을 선택적 배지를 사용하여 복잡한 혼합물에서 많은 박테리아 균주를 구별함으로써 확장할 수 있다고 생각합니다. 상기 방법은 플라이 마이크로바이옴의 연구에만 국한되지 않는다. CFU의 정량화는 식수의 대장균군 수에서 병원균 식별에 이르기까지 미생물학의 많은 응용 분야에서 일반적입니다. 여기에 제시된 CFU 도금 시스템은 높은 처리량의 스크린뿐만 아니라 결과의 자동 수집, 처리, 저장 및 전달을 가능하게 합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
Kerwyn Casey Huang 박사, Andrés Aranda-Díaz 박사, Ted Cooper 및 Ludington 연구소 구성원은이 프로토콜의 개발에 귀중한 정보를 제공했습니다. 자금은 NSF IOS 보조금 2032985, NIH 보조금 DP5OD017851, 캐나다 카네기 연구소 보조금 및 카네기 과학 연구소 기부금에서 제공했습니다.
자료
| Name | Company | Catalog Number | Comments |
| Bead beating and spot plating | |||
| Fly vials | Genesee | 32-121 | autoclavable |
| Fly vial stoppers | Genesee | 59-201 | autoclavable |
| Hand Applicator | 3M | 3M PA1 | |
| Heat Sealer | Eppendorf | 5390 | |
| Mini-Beadbeater 96 | BioSpec | 1001 | |
| Mini-BeadBeater Glass Mill Beads, 0.5 mm | BioSpec | 11079105 | |
| MPS 1000 Mini PCR Plate Spinner | Labnet | LI-CF-P1000 | |
| Rainin BenchSmart 96 semi-automated pipettor | Mettler Toledo | 30296705 | Less expensive options available, including slotted 96 well pin tool from VP Scientific |
| TempPlate semi-skirted 96-well PCR plate, straight skirt, natural | USA scientific | 1402-9220 | Must be polypropylene for heat sealer |
| Thermal Bond Heat Seal Foil | 4titude | 4ti-0591 | Keep sterile |
| Tray Plate,128 x 85 mm, Polystyrene, Sterile | SPL Life Sciences | 31001 | For making rectangular agar plates |
| Photobox construction | |||
| ¼”-20 X ½” Bolts (X2) | Amazon | ASIN: B07BP1WR3H | To attach the camera bracket. Brand not important. Any 1/4"-20 1/2" bolt works. |
| ¼”-20 x ½” Connector Nut | Amazon | UPC: 799862376780 | AKA cap nut or connector bolt. This is for attaching the rubber bands on the plate holder. Brand not important. |
| ¼”-20 x ¾” bolts (X3) | Amazon | ASIN: B003QZSZY4 | For the plate holder. Brand not important. |
| 1/8” x ½” washer | Amazon | UPC: 611982484599 | Washer for the cap nuts on outside of box. Brand not important. Spray paint black before attaching to blend with the acrylic. |
| 18 Gauge Wire - Two Conductor Power Wire - 18 AWG Power Wire – 10ft | Superbrightleds.com | WP18-2 | |
| 22-10 AWG Red Wire Nut - WN-R2210 – Quantity 4 | Superbrightleds.com | WN-R2210 | |
| 22-18 AWG 3/16in Female Push On Connector - 22-18 AWG – Quantity 3 | Superbrightleds.com | SCFP-2218 | |
| 4" Solderless Clamp-On Jumper Connector - 8mm Single Color LED Strip Lights - Quantity 3 | Superbrightleds.com | SBL-MA2P-8-2 | |
| 4" Solderless Clamp-On Pigtail Adaptor - 8mm Single Color LED Strip Lights – Quantity 3 | Superbrightleds.com | SBL-MA2P-8-1 | |
| 6” drawer handle | Amazon | ASIN: B07Z331P99 | Any drawer handle should work. |
| 6” Drawer slides | Btibpse | UPC: 712243424979 | Trim the soft close rubber stoppers on the drawer sliders. |
| 8-32 x ½” Cap Nuts (x4) | Amazon | ASIN: B00HYLZB98 | Attaches drawer slide bolts on outside of box. Brand not important. Nylon won't damage the acrylic. Spray paint black before attaching to blend with the acrylic. |
| 8-32 x ½” Nylon Bolts (x4) | Amazon | ASIN: B07KX9T7NF | To attach drawer slides. Brand not important. Any bolt or machine screw meeting the specifications works. Nylon won't damage the acrylic and allows you to cut the bolt flush with the nut. Spray paint black before attaching to blend with the acrylic. |
| Acrylic Glue | SCIGRIP | Ean: 7844908489337 | SCIGRIP Weld-On #4 Adhesive, Pint and Weld-On Applicator Bottle with Needle |
| Black Cable Ties - 10 Pack - 4 Inch Long | Superbrightleds.com | CT-B04-10 | |
| Camera L-Bracket | WLPREOE, Vikerer, Unbranded | ASIN: B09X46YKQZ | The bracket should be "reversed" from its intended configuration so that the camera is on the "outside" of the L. Some brackets come in two pieces and allow for this alternate configuration, some don't, you'll need one that can be flipped. Also should have 1/4" holes for attachment. WLPREOE, Vikerer, Unbranded. Amazon Serial Identification Number given as an example. |
| Canon T series camera for tethering option OR | Canon, Panasonic, Sony, Nikon, etc.. | 1894C002 | The Canon Ti series cameras are a good option and can tether to a computer. Use with the 18-55mm standard kit lens. Used options are recommended from the Canon T5 to T7 (current model). |
| Custom Length Single Color LED Strip Light - Eco Series Tape Light - 24V - IP20 - 250 lm/ft - Blue - 2 meters | Superbrightleds.com | STN-BBLU-B6A-08C1M-24V | |
| Custom Length Single Color LED Strip Light - Eco Series Tape Light - 24V - IP20 - 250 lm/ft - Green – 2 meters | Superbrightleds.com | STN-BGRE-B6A-08C1M-24V | |
| Custom Length Single Color LED Strip Light - Eco Series Tape Light - 24V - IP20 - 250 lm/ft - Natural White 4000K – 2 meters | Superbrightleds.com | STN-A40K80-B6A-08C1M-24V | |
| Drill with ¼”, 1/8” drill bits | Black & Decker | BDCDD12PK | Brand not important. |
| Flat Black Spray Paint, 2X Ultra-Matte | Rustoleum | 331182 | Paint the interior of everything FLAT black. Brand not important. |
| Laser Cut Acrylic Walls | Big Blue Saw | www.bigbluesaw.com | Use the attached PDF, delete all cutouts in the top piece except desired hole for camera |
| Mean Well LED Switching Power Supply - LPV Series 20-100W Single Output LED Power Supply - 24V DC - 20 Watt | Superbrightleds.com | LPV-20-24 | |
| Panasonic ZS100 for wifi connection to a phone, tablet, or computer | Canon, Panasonic, Sony, Nikon, etc. | DMC-ZS100K | Panasonic cameras can be wirelessly connected to a computer for data transfer and remote shutter options. Used options are good. |
| Quick Release Plate | Neewer Aluminium 50mm Quick Release Plate QR Clamp 3/8-inch with 1/4-inch | ASIN: B07417F21D | Add this to the bracket so the camera can be easily removed for changing color filters. Amazon Serial Identification Number given as an example. |
| Rubber Bands, Assorted sizes | BAZIC Products | Alliance Rubber 26649 | Rubber bands go on the plate holder. Brand not important. |
| Screw/Adhesive Cable Tie Mounting Bases - 3/4 inch base – Quantity 4 | Superbrightleds.com | CTMB-20 | |
| SPST Round Rocker Switch - No LED – Quantity 3 | Superbrightleds.com | RRS-SP | |
| Tiffen 29 Filter (Red) 72 mm | Tiffen | 72R29 | |
| Tiffen 58 Filter (Green) 72 mm | Tiffen | 7258 | |
| Software | |||
| ImageJ64 | https://imagej.net/downloads | N/A | Free. Just cite: Schindelin, J., Arganda-Carreras, I., Frise, E., Kaynig, V., Longair, M., Pietzsch, T., … Cardona, A. (2012). Fiji: an open-source platform for biological-image analysis. Nature Methods, 9(7), 676–682. doi:10.1038/nmeth.2019 |
| MacOSX | Apple | N/A | Has a useful batch rename feature in Finder to rename a group of photos to facilitate organizing and analyzing in Count-on-it. |
| Unix | BSD | N/A | 64 bit |
| Windows | Microsoft | N/A | 64 bit |
참고문헌
- McFall-Ngai, M., et al. Animals in a bacterial world, a new imperative for the life sciences. Proceedings of the National Academy of Sciences. 110 (9), 3229-3236 (2013).
- Shepherd, E. S., Deloache, W. C., Pruss, K. M., Whitaker, W. R., Sonnenburg, J. L. An exclusive metabolic niche enables strain engraftment in the gut microbiota. Nature. 557 (7705), 434-438 (2018).
- Taur, Y., et al. Intestinal domination and the risk of bacteremia in patients undergoing allogeneic hematopoietic stem cell transplantation. Clinical Infectious Diseases. 55 (7), 905-914 (2012).
- Buffie, C. G., et al. Precision microbiome reconstitution restores bile acid mediated resistance to Clostridium difficile. Nature. 517 (7533), 205-208 (2015).
- Callahan, B. J., et al. DADA2: High-resolution sample inference from Illumina amplicon data. Nature Methods. 13 (7), 581-583 (2016).
- Vandeputte, D., et al. Temporal variability in quantitative human gut microbiome profiles and implications for clinical research. Nature Communications. 12 (1), 6740 (2021).
- D'hoe, K., et al. Integrated culturing, modeling and transcriptomics uncovers complex interactions and emergent behavior in a three-species synthetic gut community. eLife. 7, 2892 (2018).
- Ludington, W. B., Ja, W. W. Drosophila as a model for the gut microbiome. PLoS Pathogens. 16 (4), 1008398 (2020).
- Chandler, J. A., Lang, J. M., Bhatnagar, S., Eisen, J. A., Kopp, A. Bacterial communities of diverse Drosophila species: Ecological context of a host-microbe model system. PLoS Genetics. 7 (9), 1002272 (2011).
- Pais, I. S., Valente, R. S., Sporniak, M., Teixeira, L. Drosophila melanogaster establishes a species-specific mutualistic interaction with stable gut-colonizing bacteria. PLoS Biology. 16 (7), 2005710 (2018).
- Adair, K. L., et al. Host determinants of among-species variation in microbiome composition in drosophilid flies. The ISME Journal. 14, 217-229 (2019).
- Koyle, M. L., et al. Rearing the fruit fly Drosophila melanogaster under axenic and gnotobiotic conditions. Journal of Visualized Experiments. (113), e54219 (2016).
- Lesperance, D. N. A., Broderick, N. A. Microbiomes as modulators of Drosophila melanogaster homeostasis and disease. Current Opinion in Insect Science. 39, 84-90 (2020).
- Grenier, T., Leulier, F. How commensal microbes shape the physiology of Drosophila melanogaster. Current Opinion in Insect Science. 41, 92-99 (2020).
- Broderick, N. A., Lemaitre, B. Gut-associated microbes of Drosophila melanogaster. Gut Microbes. 3 (4), 307-321 (2012).
- Tkacz, A., Hortala, M., Poole, P. S. Absolute quantitation of microbiota abundance in environmental samples. Microbiome. 6 (1), 110 (2018).
- Téfit, M. A., Gillet, B., Joncour, P., Hughes, S., Leulier, F. Stable association of a Drosophila-derived microbiota with its animal partner and the nutritional environment throughout a fly population's life cycle. Journal of Insect Physiology. 106, 2-12 (2017).
- Ryu, J. -. H., et al. Innate immune homeostasis by the homeobox gene caudal and commensal-gut mutualism in Drosophila. Science. 319 (5864), 777-782 (2008).
- Sieuwerts, S., De Bok, F. A. M., Mols, E., De Vos, W. M., Van Hylckama Vlieg, J. E. T. A simple and fast method for determining colony forming units. Letters in Applied Microbiology. 47 (4), 275-278 (2008).
- Eckburg, P. B., et al. Diversity of the human intestinal microbial flora. Science. 308 (5728), 1635-1638 (2005).
- Newell, P. D., Douglas, A. E. Interspecies interactions determine the impact of the gut microbiota on nutrient allocation in Drosophila melanogaster. Applied and Environmental Microbiology. 80 (2), 788-796 (2013).
- Costello, E. K., et al. Bacterial community variation in human body habitats across space and time. Science. 326 (5960), 1694-1697 (2009).
- Fadrosh, D. W., et al. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform. Microbiome. 2 (1), 6 (2014).
- Vega, N. M., Ludington, W. B. From a parts list to assembly instructions and an operating manual: How small host models can re-write microbiome theory. Current Opinion in Microbiology. 64, 146-151 (2021).
- Samuel, B. S., Rowedder, H., Braendle, C., Félix, M. -. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10, 1998-2009 (2016).
- Sundarraman, D., et al. Higher-order interactions dampen pairwise competition in the zebrafish gut microbiome. mBio. 11 (5), 1-15 (2020).
- Douglas, A. E. Simple animal models for microbiome research. Nature Reviews Microbiology. 17, 764-775 (2019).
- Friedman, J., Higgins, L. M., Gore, J. Community structure follows simple assembly rules in microbial microcosms. Nature Ecology & Evolution. 1, 0109 (2017).
- Gilchrist, J. E., Campbell, J. E., Donnelly, C. B., Peeler, J. T., Delaney, J. M. Spiral plate method for bacterial determination. Applied Microbiology. 25 (2), 244-252 (1973).
- Thomas, P., Sekhar, A. C., Upreti, R., Mujawar, M. M., Pasha, S. S. Optimization of single plate-serial dilution spotting (SP-SDS) with sample anchoring as an assured method for bacterial and yeast cfu enumeration and single colony isolation from diverse samples. Biotechnology Reports. 8, 45-55 (2015).
- Nuñez, I., et al. Low cost and open source multi-fluorescence imaging system for teaching and research in biology and bioengineering. PLoS One. 12 (11), 0187163 (2017).
- Putman, M., Burton, R., Nahm, M. H. Simplified method to automatically count bacterial colony forming unit. Journal of Immunological Methods. 302 (1-2), 99-102 (2005).
- Ashburner, M. . Drosophila. A Laboratory Handbook. , (1989).
- Dodge, R., et al. A gut commensal niche regulates stable association of a multispecies microbiota. bioRxiv. , (2021).
- Obadia, B., et al. Probabilistic invasion underlies natural gut microbiome stability. Current Biology. 27 (13), 1999-2006 (2017).
- Vega, N. M., Gore, J. Stochastic assembly produces heterogeneous communities in the Caenorhabditis elegans intestine. PLoS Biology. 15 (3), 2000633 (2017).
- Jaime, M., et al. The high-throughput WAFFL system for treating and monitoring individual Drosophila melanogaster adults. bioRxiv. , (2018).
- Ren, C., Webster, P., Finkel, S. E., Tower, J. Increased internal and external bacterial load during Drosophila aging without life-span trade-off. Cell Metabolism. 6 (2), 144-152 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유