A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصميم مفاعل حيوي لتحسين الحصول على البيانات ونمذجة إنتاجية أنسجة القلب المهندسة
In This Article
Erratum Notice
Summary
ظهرت أنسجة القلب ثلاثية الأبعاد المهندسة بيولوجيا باستخدام خلايا عضلة القلب المشتقة من الخلايا الجذعية كنماذج واعدة لدراسة عضلة القلب البشرية السليمة والمريضة في المختبر مع تلخيص الجوانب الرئيسية لمكانة القلب الأصلية. تصف هذه المخطوطة بروتوكولا لتصنيع وتحليل أنسجة القلب المهندسة عالية المحتوى الناتجة عن خلايا عضلة القلب المشتقة من الخلايا الجذعية البشرية متعددة القدرات.
Abstract
لا يزال قصور القلب السبب الرئيسي للوفاة في جميع أنحاء العالم ، مما يخلق حاجة ملحة لنماذج أفضل قبل السريرية لقلب الإنسان. هندسة الأنسجة أمر بالغ الأهمية لأبحاث القلب العلوم الأساسية. في زراعة الخلايا البشرية في المختبر يزيل الاختلافات بين الأنواع من النماذج الحيوانية ، في حين أن بيئة 3D أكثر مثل الأنسجة (على سبيل المثال ، مع مصفوفة خارج الخلية واقتران الخلايا غير المتجانسة) يحاكي في ظروف الجسم الحي إلى حد أكبر من الثقافة التقليدية ثنائية الأبعاد على أطباق بتري البلاستيكية. ومع ذلك ، يتطلب كل نظام نموذجي معدات متخصصة ، على سبيل المثال ، المفاعلات الحيوية المصممة خصيصا وأجهزة التقييم الوظيفي. بالإضافة إلى ذلك ، غالبا ما تكون هذه البروتوكولات معقدة وكثيفة العمالة وتعاني من فشل الأنسجة الصغيرة والحساسة.
تصف هذه الورقة عملية لتوليد نظام نموذج قوي للأنسجة القلبية البشرية المهندسة (hECT) باستخدام خلايا عضلة القلب المستحثة متعددة القدرات المشتقة من الخلايا الجذعية للقياس الطولي لوظيفة الأنسجة. يتم استزراع ستة hECTs مع هندسة الشريط الخطي بالتوازي ، مع تعليق كل hECT من زوج من أعمدة polydimethylsiloxane (PDMS) المستشعرة للقوة المرفقة برفوف PDMS. يتم تغطية كل منشور بمتتبع منشور PDMS مستقر أسود (SPoT) ، وهي ميزة جديدة تعمل على تحسين سهولة الاستخدام والإنتاجية والاحتفاظ بالأنسجة وجودة البيانات. يسمح الشكل بالتتبع البصري الموثوق به للانحرافات اللاحقة ، مما يؤدي إلى تحسين تتبع قوة النشل مع التوتر النشط والسلبي المطلق. تعمل هندسة الغطاء على التخلص من فشل الأنسجة بسبب انزلاق hECTs من الأعمدة ، ولأنها تتضمن خطوة ثانية بعد تصنيع رف PDMS ، يمكن إضافة SPoTs إلى التصميمات الحالية القائمة على PDMS دون تغييرات كبيرة في عملية تصنيع المفاعل الحيوي.
يستخدم النظام لإثبات أهمية قياس وظيفة hECT في درجات الحرارة الفسيولوجية ويظهر وظيفة الأنسجة المستقرة أثناء الحصول على البيانات. باختصار ، وصفنا نظاما نموذجيا متطورا يعيد إنتاج الظروف الفسيولوجية الرئيسية لتعزيز الدقة الحيوية والكفاءة والدقة لأنسجة القلب المهندسة للتطبيقات في المختبر .
Introduction
تأتي نماذج أنسجة القلب المهندسة في مجموعة متنوعة من الأشكال الهندسية والتكوينات لتلخيص الجوانب المختلفة لمكانة القلب الأصلية التي يصعب تحقيقها باستخدام ثقافة الخلايا التقليدية ثنائية الأبعاد. أحد أكثر التكوينات شيوعا هو شريط الأنسجة الخطي ، مع مثبتات مرنة في كل طرف للحث على التجميع الذاتي للأنسجة وتزويد الأنسجة بتحميل مسبق محدد وقراءة لقوى النشل الناتجة1،2،3،4،5،6،7،8،9،10،11 ، 12,13,14,15,16,17,18,19,20,21
، 22،23،24،25،26،27. يمكن تحديد القوة المتولدة بقوة من خلال التتبع البصري لتقصير الأنسجة واستخدام نظرية الحزمة المرنة لحساب القوة من الانحرافات المقاسة وثابت الزنبرك للمثبتات1،2،3،4،5،6،7،8،9،10،11 ، 12,13,14,15,16,17,18,19,20,
21،22،25،26،28.
ومع ذلك ، لا تزال هندسة أنسجة القلب مجالا متطورا ، ولا تزال هناك بعض التحديات. المعدات المتخصصة ، مثل المفاعلات الحيوية المصنوعة حسب الطلب وأجهزة التقييم الوظيفي ، مطلوبة لكل نظام نموذجي10،29،30،31. غالبا ما يكون حجم وتعقيد البيئة المكروية لهذه التركيبات محدودا بسبب انخفاض الإنتاجية بسبب البروتوكولات كثيفة العمالة ، والأعداد الكبيرة من الخلايا ، وهشاشة الأنسجة. لمعالجة هذا الأمر ، تحولت بعض المجموعات إلى تصنيع الأنسجة الدقيقة التي تحتوي فقط على مئات أو آلاف الخلايا لتسهيل المقايسات عالية الإنتاجية المفيدة لاكتشاف الأدوية. ومع ذلك ، فإن هذا المقياس المخفض يعقد التقييم الدقيق للوظيفة12 ، ويزيل الجوانب الرئيسية لمكانة القلب الأصلية (مثل تدرجات انتشار المغذيات / الأكسجين والهندسة المعقدة36) ، ويحد من كمية المواد المتاحة للتحليل الجزيئي والهيكلي اللاحق (غالبا ما يتطلب تجميع الأنسجة). يلخص الجدول 1 بعض تكوينات نماذج شريط الأنسجة الخطية في الأدبيات1،2،3،4،5،6،7،8،9،10،11،12،13،14،15 ، 16,17,18,19,20,
21،22،23،24،25،26،37،38،39،40.
| مجموعة | الخلايا لكل نسيج | المناديل لكل لوحة | شكل لوحة | ميزة الإرساء | طريقة الحصول على البيانات الوظيفية | حمام وسائط مشترك؟ | مقياس وظيفي- منة في الموقع؟ | ||||
| يوشيدا (إلخ)38 | 4 مليون | 6 | لوحة معدلة من 6 آبار * | محول القوة | قياس القوة المباشرة | لا | لا | ||||
| تشان (hESC-CM-ECTs)26 | 310 ألف | 6 | طبق مخصص 6 آبار | مشاركات PDMS | قياس القوة المباشرة | نعم | لا | ||||
| فاينبرغ (dyn-EHT)16 | 1.5 مليون | 6 | طبق مخصص 6 آبار | سلك PDMS | شكل الأنسجة | لا | نعم | ||||
| راديسيك (بيوواير)39, 40 | 110 ألف | 8 | سلك البوليمر | شكل سلك | نعم | نعم | |||||
| كوستا (واحد hECT) 1 ، 2 | 1-2 مليون | 4** | صحن بتري 10 سم** | مشاركات PDMS | الانحراف البصري (تتبع الحافة/الكائن) | نعم | نعم | ||||
| كوستا (متعدد العلاج بالصدمات الكهربائية)3–9 | 500 ك - 1 مليون | 6 | طبق بتري 6 سم | مشاركات PDMS | الانحراف البصري (تتبع الحافة/الكائن) | نعم | نعم | ||||
| كوستا (متعدد hECT W / SPoT) | 1 مليون | 6 | طبق بتري 6 سم | منشورات PDMS بأحرف كبيرة سوداء | الانحراف البصري (تتبع الكائن) | نعم | نعم | ||||
| باسير (EHT)17 | 245 ألف | 36 | لوحة 12 بئر | منشورات PDMS بأحرف كبيرة سوداء | الانحراف البصري (تتبع الكائن) | نعم | نعم | ||||
| فونجاك نوفاكوفيتش13 ، 18 | 1 مليون | 12 | طبق بتري 6 سم | مشاركات PDMS مع الأحرف الاستهلالية | الانحراف البصري (اكتشاف الحواف) | نعم | نعم | ||||
| فونجاك نوفاكوفيتش (ميلي بيلار)14 | 550 ألف | 6 | طبق مخصص 6 آبار | مشاركات PDMS مع الأحرف الاستهلالية | الانحراف البصري (تتبع الكائن) ؛ تصوير الكالسيوم | لا | نعم | ||||
| إيشنهاغن (EHT)10, 19–21 | 1 مليون | 12 | لوحة 12 بئر | مشاركات PDMS مع الأحرف الاستهلالية | الانحراف البصري (كشف حافة الانحراف اللاحق) ؛ تصوير الكالسيوم | لا | نعم | ||||
| زاندسترا (كاميري)22 | 25-150 ك | 96 | لوحة 96 بئر | منشورات PDMS مع خطافات | الانحراف البصري (اكتشاف الحواف) | لا | نعم | ||||
| موري23 ، 24 | 900 ألف | 24 | لوحة 24 بئر | أعمدة PDMS مع أغطية ، مغناطيس مدمج | جهاز استشعار مغناطيسي | لا | نعم | ||||
| الرايخ (μTUG) 11 ، 12 ، 25 | غير معروف | 156 | طبق 156 بئر | أعمدة PDMS مع أغطية ، مغناطيس مدمج | التتبع البصري (حبة الفلورسنت) | نعم | نعم | ||||
الجدول 1: خصائص بعض نماذج أنسجة القلب المهندسة خطيا في الأدبيات. تختلف نماذج أنسجة القلب الخطية المهندسة في الحجم والإنتاجية وتصميمات ميزات التثبيت وتسهيل الحمامات المتوسطة المشتركة ، بالإضافة إلى متطلبات نظام حمام عضلي منفصل للتوصيف الوظيفي. * استخدم الباحثون نظام أنسجة هندسيا متاحا تجاريا يعتمد على أبعاد لوحة قياسية من 6 آبار. ** نظام معياري يتم فيه تثبيت المفاعلات الحيوية أحادية الأنسجة على أي طبق استزراع بلاستيكي بالعدد والموقع المطلوبين.
تصف هذه الورقة أحدث بروتوكول لتصنيع نموذجنا الراسخ لأنسجة القلب الخطية البشرية المهندسة (hECT) 1،2،3،4،5،6،7،8،9،15،27 وطرق تقييم وظيفة انقباض hECT. يستوعب كل مفاعل حيوي متعدد الأنسجة ما يصل إلى ستة hECTs في حمام متوسط مشترك ويتكون من قطعتين "رف" مصنوعتين من بوليديميثيل سيلوكسان من المطاط الصناعي السيليكوني (PDMS) مثبت على إطار بولي سلفون صلب. يحتوي كل حامل PDMS على ستة أعمدة مرنة متكاملة لاستشعار القوة يبلغ قطرها 0.5 مم وطولها 3.25 مم ، ومعا ، يوفر رفان ستة أزواج من الدعامات ، كل منها يحمل hECT واحدا. يساعد انعكاس المفاعل الحيوي في التغلب على أي عائق أمام تصور hECTs من الأسفل بسبب تكثيف الماء من وسط الاستزراع أو التشوهات من الغضروف المفصلي لواجهة الهواء والسائل. يؤدي كل انكماش ل hECT إلى انحراف الأعمدة الطرفية المتكاملة ، ويتم معالجة القياس البصري لإشارة الانحراف إلى قوة مقابل تتبع الوقت يمثل وظيفة انقباض hECT1،2،3،4،5،6،7،8،9،15،27. بالمقارنة مع المفاعلات الحيوية أحادية الأنسجة المستخدمة عادة للأنسجة بهذا الحجم ، فإن التصميم متعدد الأنسجة يحسن الإنتاجية التجريبية ويمكن من دراسة إشارات paracrine بين الأنسجة المجاورة ذات التركيب الخلوي المختلف المحتمل. تم التحقق من صحة هذا النظام في الدراسات المنشورة التي تصف التطبيقات في نمذجة المرض 4,8 ، وإشارات paracrine 6,7 ، والثقافة غير المتجانسة 5,9 ، والفحص العلاجي 7,9.
في هذا النظام ، تم تصميم hECTs ليبلغ طولها حوالي 6 مم وقطرها 0.5 مم لتسهيل التتبع البصري القوي لقياسات القوة ذات الضوضاء المنخفضة. علاوة على ذلك ، فإن جوانب تعقيد الأنسجة مثل تدرجات الانتشار والتنظيم الخلوي متوازنة مع متطلبات يمكن التحكم فيها تبلغ 1 مليون خلية لكل نسيج. مع تقنية كاميرا CCD القياسية ، تولد قوى ضعيفة تصل إلى 1 μN (تمثل أقل من 5 ميكرومتر بعد الانحراف) إشارة واضحة ، مما يضمن أنه حتى وظيفة الانقباض الضعيفة للغاية ، كما لوحظ مع بعض نماذج مرض hECT ، يمكن قياسها بدقة. يسهل هذا أيضا التحليل التفصيلي لمنحنى قوة النشل ، مما يتيح تحليل المحتوى العالي لما يصل إلى 16 مقياسا للانقباض41 ، بما في ذلك القوة المتقدمة ومعدلات الانكماش (+ dF / dt) والاسترخاء (−dF / dt) ، وتقلب معدل الفوز.
يبدأ هذا البروتوكول بتعليمات لتصنيع مكونات المفاعل الحيوي. يتم إيلاء اهتمام خاص للخطوات اللازمة لزيادة إنتاجية hECT ، وتقليل التباين التقني في وظيفة الأنسجة ، وتحسين جودة وعمق تقييم الأنسجة. لا تبلغ معظم دراسات هندسة أنسجة القلب عن معدلات فقدان الأنسجة أثناء التصنيع والاختبار طويل المدى ، على الرغم من أنه يمثل تحديا معروفا في هذا المجال ويقلل من إنتاجية وكفاءة الدراسات27. تم تحسين طرق هندسة الأنسجة الموصوفة هنا على مر السنين لضمان الاحتفاظ بجميع hECTs في معظم المفاعلات الحيوية (بغض النظر عن كيفية تصنيع رفوف PDMS). ومع ذلك ، حتى فقدان الأنسجة بنسبة 5٪ -20٪ يمكن أن يؤثر بشكل كبير على القوة الإحصائية ، لا سيما في التجارب الأصغر التي تقتصر على عدد خلايا عضلة القلب المتاحة (على سبيل المثال ، بسبب تحديات التمايز مع بعض خطوط الخلايا المريضة4 أو بسبب التكلفة العالية لخلايا عضلة القلب المشتراة تجاريا) ، أو حسب حالة العلاج (على سبيل المثال ، التوافر المحدود أو التكلفة العالية لمركبات العلاج المختلفة).
يصف هذا البروتوكول تصنيع أجهزة تتبع البريد المستقرة (SPoTs) ، وهي ميزة جديدة لرفوف PDMS ، والتي تعمل كأغطية في نهايات أعمدة استشعار القوة التي تحمل hECTs27. يوضح كيف تقلل هندسة الغطاء بشكل كبير من خسارة hECT من السقوط أو سحب الأعمدة ، مما يفتح فرصا جديدة لزراعة hECTs مع مجموعة أكبر من الصلابة والتوترات ، والتي تشكل تحديا للثقافة على المشاركات غير المغطاة. بالإضافة إلى ذلك ، توفر SPoTs كائنا عالي التباين لتحسين التتبع البصري لانكماش hECT من خلال شكل متسق ومحدد جيدا27. يتبع ذلك وصف لزراعة الخلايا الجذعية متعددة القدرات التي يسببها الإنسان (iPSCs) وتمايز خلايا عضلة القلب بناء على البروتوكولات المنشورة مسبقا3،42،43 وشرح لتصنيع hECT والثقافة والقياسات الوظيفية.
تتناول هذه المقالة أيضا الحاجة إلى قياس وظيفة الأنسجة في درجة الحرارة الفسيولوجية. عضلة القلب البشرية (أنسجة الجنين وكذلك الأنسجة السليمة والمريضة للبالغين) ، وكذلك أنسجة القلب من مجموعة واسعة من الأنواع الحيوانية (بما في ذلك الجرذان والقطط والفئران والقوارض والأرانب)44,45 ، تظهر زيادة ملحوظة في قوة الارتعاش المتطابقة مع التردد عند درجات حرارة 28 °C -32 °C مقارنة بدرجة الحرارة الفسيولوجية - وهي ظاهرة تعرف باسم التقلص العضلي منخفض الحرارة45 ، 46. ومع ذلك ، فإن آثار درجة الحرارة على وظيفة أنسجة عضلة القلب المهندسة لا تزال غير مدروسة. تم تصميم العديد من نماذج أنسجة القلب المهندسة حديثا في الأدبيات ليتم تقييمها وظيفيا عند 37 درجة مئوية لتقريب الظروف الفسيولوجية13،14،37. ومع ذلك ، على حد علمنا ، لم يتم التحقيق بشكل منهجي في التأثيرات المعتمدة على درجة الحرارة على القوة الناتجة عن أنسجة القلب المهندسة. يصف هذا البروتوكول تصميم قطب كهربائي سريع يقلل من فقد الحرارة أثناء الاختبار ، بالإضافة إلى السماح بدمج عنصر تسخين معزول في الإعداد للقياسات الوظيفية ، والتي يمكن أن تحافظ على hECTs في درجة حرارة فسيولوجية دون المساس بالعقم27. ثم نبلغ عن بعض التأثيرات الملحوظة لدرجة الحرارة على وظيفة hECT ، بما في ذلك القوة المتقدمة ، وتردد الضرب التلقائي ، + dF / dt ، و −dF / dt. إجمالا ، توفر هذه الورقة التفاصيل المطلوبة لتصنيع نظام المفاعل الحيوي متعدد الأنسجة لاستشعار القوة لتصنيع أنسجة القلب المهندسة بشريا وتقييم وظيفتها الانقباضية ، ويتم تقديم مجموعة من البيانات التي توفر أساسا للمقارنة للقياسات في درجة حرارة الغرفة وعند 37 درجة مئوية27.
Access restricted. Please log in or start a trial to view this content.
Protocol
استخدم هذا البروتوكول خط iPSC غير محدد الهوية ، SkiPS 31.3 (تمت إعادة برمجته في الأصل باستخدام الخلايا الليفية الجلدية من ذكر سليم يبلغ من العمر 45 عاما) 47 ، وبالتالي ، تم إعفاؤه من موافقة مجلس المراجعة المؤسسية المحددة ، بما يتوافق مع إرشادات لجنة أخلاقيات البحوث البشرية في المؤسسة. قم بإجراء جميع عمليات معالجة الخلايا و hECT في ظروف معقمة في خزانة أمان بيولوجي من الفئة الثانية تمت تصفيتها HEPA أو مقعد عمل التدفق الصفحي. تعقيم جميع المحاليل غير المعقمة عن طريق الترشيح من خلال مرشح 0.22 ميكرومتر ، والحفاظ على جميع الخلايا و hECTs في حاضنة عند 37 درجة مئوية ، ورطوبة نسبية 95٪ ، و 5٪ CO2.
1. تصنيع المفاعل الحيوي
- مكونات المفاعل الحيوي وتصنيع الألمنيوم الرئيسي المصبوب
ملاحظة: يتم توفير ملفات التصميم بمساعدة الكمبيوتر (CAD) في الملف التكميلي 1. قد يتم إيقاف البروتوكول مؤقتا في أي مكان بين هذه الخطوات. يوصى بالاستعانة بميكانيكي محترف لتصنيع القوالب الرئيسية الموضحة في هذا القسم ، حيث يلزم وجود تفاوتات عالية (≤5 ميكرومتر) وتشطيب سلس لهندسة ما بعد دقيقة ولتركيب الضغط المناسب لإطارات البولي سلفون على ألواح البولي تترافلوروإيثيلين (PTFE) (بهدف ملاءمة الاحتكاك المريحة ، ولكن ليس ضيقا جدا).- باستخدام مطحنة التحكم العددي بالكمبيوتر (CNC) ، قم بإخراج الصفيحة الأساسية من PTFE وفقا للمخططات الواردة في الشكل 1A. سيتم تشكيل hECTs في الآبار الستة المتباعدة بالتساوي (الأسهم البيضاء).
- باستخدام مطحنة CNC ، قم بتصنيع حامل البولي ثنائي ميثيل سيلوكسان (PDMS) الرئيسي السلبي المصبوب من الألومنيوم وفقا للمخططات الواردة في الشكل 1B ، مع ثلاثة دعامات إطار (العلامات النجمية الخضراء). قم بحفر ستة ثقوب متباعدة بشكل متساو (رؤوس أسهم أرجوانية) بقطر 0.5 مم لإنشاء أعمدة PDMS.
- باستخدام مطحنة CNC ، قم بتصنيع إطار المفاعل الحيوي من البولي سلفون وفقا للمخططات الواردة في الشكل 1C. تتوافق دعامات الإطار (العلامات النجمية الخضراء) مع دعامات الإطار التي تظهر في قالب الحامل (الشكل 1 ب ، العلامات النجمية الخضراء).
- باستخدام مطحنة CNC ، قم بتصنيع حامل الألمنيوم المصبوب من الألومنيوم وفقا للمخططات الواردة في الشكل 1D. تحتوي كل فتحة على رف مثلث (مثلث برتقالي) يبلغ ارتفاعه 0.25 مم لتوفير مساحة ميتة لتدفق PDMS عبر الثقوب الموجودة في قوالب حامل PDMS (الشكل 1B ، رؤوس الأسهم الأرجواني).
- صب رف PDMS من سادة الألومنيوم السلبية
- باستخدام طابعة 3D نمذجة ترسيب تنصهر بالحرارة ، اطبع اثنين من أقواس جهاز صب الرف PDMS (الملف التكميلي 1). استخدم إعدادات الطباعة التالية: ارتفاع الطبقة 0.1 مم ، وسمك الجدار / القاع / العلوي 1 مم ، وكثافة الحشو بنسبة 90٪ مع مثلثات ، ودرجة حرارة الطباعة 230 درجة مئوية ، ودرجة حرارة لوحة البناء 70 درجة مئوية ، وحافة الالتصاق.
- ضع أربعة قوالب رئيسية سالبة من الألومنيوم في حامل الصب (الشكل 2AI) بحيث تتماشى ثقوب العمود مع المساحة الميتة المقابلة لأرفف المثلث (انظر الشكل 1 د). لف الجهاز بقطعة مستطيلة من صفائح السيليكون بسمك 0.5 مم (الشكل 2 ب ، أسهم بيضاء) كحشية لمنع تسرب PDMS السائل وتثبيته بين قوسين مطبوعين متوازيين 3D باستخدام مشبك لولبي.
- أضف 0.5 مل من عامل المعالجة PDMS إلى 5 مل من قاعدة المطاط الصناعي PDMS (نسبة 1:10 ، وفقا لتعليمات الشركة المصنعة) في حاوية ضحلة ، واخلطها بقوة لمدة 5 دقائق. قم بإزالة غاز خليط PDMS في غرفة مفرغة ، وقم بتطبيق فراغ قوي (0.1-1 كيلو باسكال) لمدة 20-60 دقيقة في درجة حرارة الغرفة أو حتى تختفي الفقاعات.
- صب خليط PDMS على جهاز الصب ، وامتلأ أكثر من اللازم لضمان التغطية الكاملة لكل فتحة (الشكل 2AII). إذا رغبت في ذلك ، أضف حبات زجاجية صغيرة ملونة إلى جسم رفوف PDMS (الشكل 2AII) ، مقابل الجانب مع الأعمدة (الشكل 2B) ، للتعرف الفريد على كل رف PDMS. أعد جهاز الصب إلى غرفة التفريغ (تأكد من أنه مستو أفقيا) ، وقم بتطبيق فراغ قوي لمدة 12 ساعة على الأقل. اترك PDMS يعالج في درجة حرارة الغرفة لمدة 48 ساعة تقريبا بعيدا عن الغبار لتمكين المعالجة الكاملة والقوة القصوى للأعمدة الحساسة. تجنب استخدام الفرن لأن هذا يشوه المكونات المطبوعة 3D.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا.
- إزالة رف PDMS من قوالب الألومنيوم الرئيسية السلبية
- قم بإزالة المشبك والأقواس وألواح السيليكون من جهاز الصب. باستخدام شفرة حلاقة من الفولاذ المقاوم للصدأ ، قم بقص فيلم PDMS أعلى جهاز الصب ودعامات الإطار ، واستخدم الأصابع برفق لفصل رفوف PDMS عن جوانب حامل الصب. أدخل شفرة حلاقة من الفولاذ المقاوم للصدأ في المساحة الميتة بين الجبيرة وحامل الجبس ، وقم بفصلها عن بعضها البعض (الشكل 2CI ، II) ، مع التأكد من أن PDMS الذي يملأ المساحة الميتة يظل مع حامل المدلى به (حيث يتم إرفاق هذا بالوظائف). باستخدام شفرة حادة من الفولاذ المقاوم للصدأ ، قم بقطع أفلام PDMS المتبقية ، وقطع PDMS في الفضاء الميت من أطراف الأعمدة (الشكل 2C III-V).
- الخطوة الحرجة: حرر حامل PDMS من المدلى بها (الشكل 2D). بدءا من الجانب المقابل للأعمدة ، استخدم الأصابع لفصل حامل PDMS ببطء عن الجبس ، والعمل على جوانب بديلة حتى تصبح المشاركات خالية من القوالب الرئيسية.
- كرر الخطوة السابقة حتى يتم تحرير جميع رفوف PDMS وجميع المنشورات. استخدم شفرة حلاقة حادة لتقليم أي PDMS زائد متبقي من الرفوف. والنتيجة هي رف PDMS (الشكل 2E) مع ستة أعمدة سليمة (رؤوس أسهم برتقالية) وخرز ملون (سهم أزرق) لتحديد الهوية.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا.
- تصنيع تعقب آخر مستقر (SPoT)
- باستخدام طابعة ثلاثية الأبعاد لنمذجة الترسيب المنصهر بالحرارة ، اطبع مكونات جهاز صب SPoT (الملف التكميلي 2 والشكل 3AI ، II). استخدم إعدادات الطباعة التالية: ارتفاع الطبقة 0.1 مم ، وسمك الجدار / الأسفل / العلوي 1 مم ، وكثافة الحشو بنسبة 80٪ مع مثلثات ، ودرجة حرارة الطباعة 230 درجة مئوية ، ودرجة حرارة لوحة البناء 70 درجة مئوية ، وحافة الالتصاق.
- تأكد من ملاءمة الصحافة الآمنة بين القطع المطبوعة 3D ، وكذلك بين رفوف PDMS والرقصة ثلاثية المحاور ، وتأكد من أن رفوف PDMS تتناسب بشكل مريح مع المشاركات التي تصل إلى قيعان الآبار دون ثنيها. تقليم / ملف البلاستيك إذا لزم الأمر.
- أضف 0.5 مل من PDMS الأسود الجزء أ إلى 0.5 مل من الجزء ب (نسبة 1: 1 ، وفقا لتعليمات الشركة المصنعة) إلى قارب وزن صغير (أو حاوية صغيرة ضحلة مماثلة) ، واخلطها جيدا حتى يصبح لونها موحدا. قم بإزالة PDMS الأسود المختلط في غرفة مفرغة تحت فراغ قوي لمدة 20 دقيقة. صب PDMS الأسود الذي تم تفريغه على القاعدة المطبوعة 3D لملء الثقوب ، وانقر لضمان عدم بقاء فقاعات. كشط أكبر قدر ممكن من PDMS الزائد من القاعدة.
- قم بتثبيت القطعة ثلاثية المحاور على القاعدة ، وضع رفوف PDMS في الأخاديد على الرقصة ثلاثية المحاور (الشكل 3AII ، مستطيل فيروزي) ، مع التأكد من أن نهايات الأعمدة تغمس في PDMS الأسود في الآبار الدائرية (الشكل 3B ، C). علاج PDMS الأسود في درجة حرارة الغرفة ومحمية من الغبار لمدة 48 ساعة.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا. - حرك القطعة ثلاثية المحاور للخارج ، مما يقلل من التوتر على الأعمدة. استخدم ملقط صغير لكشط الطبقة الرقيقة من PDMS الأسود الذي يحيط بكل SPoT ؛ بعد ذلك ، أدخل ملقط منحني ذو رؤوس دقيقة في بئر SPoT لتحريره من القاعدة المطبوعة ثلاثية الأبعاد (الشكل 3D).
- افحص SPoTs (الشكل 3E) ، وقم بقص أي فيلم PDMS أسود متبقي من عملية الصب لم تتم إزالته في الخطوة 1.4.5 باستخدام مقص Vannas الناعم. تأكد من أن الدعامات النهائية بالطول الصحيح عن طريق تركيب رفوف PDMS على إطار polysulfone ثم تحريكها على الصفيحة الأساسية السوداء (الشكل 4A).
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا. - قم بإقران رفوف PDMS ، وأضفها إلى الإطار باستخدام علامات تبويب الإطار (الشكل 4 أ). الأوتوكلاف في كيس مع صفيحة PTFE لمدة 30 دقيقة على الأقل دورة (<122 درجة مئوية لتقليل الالتواء).
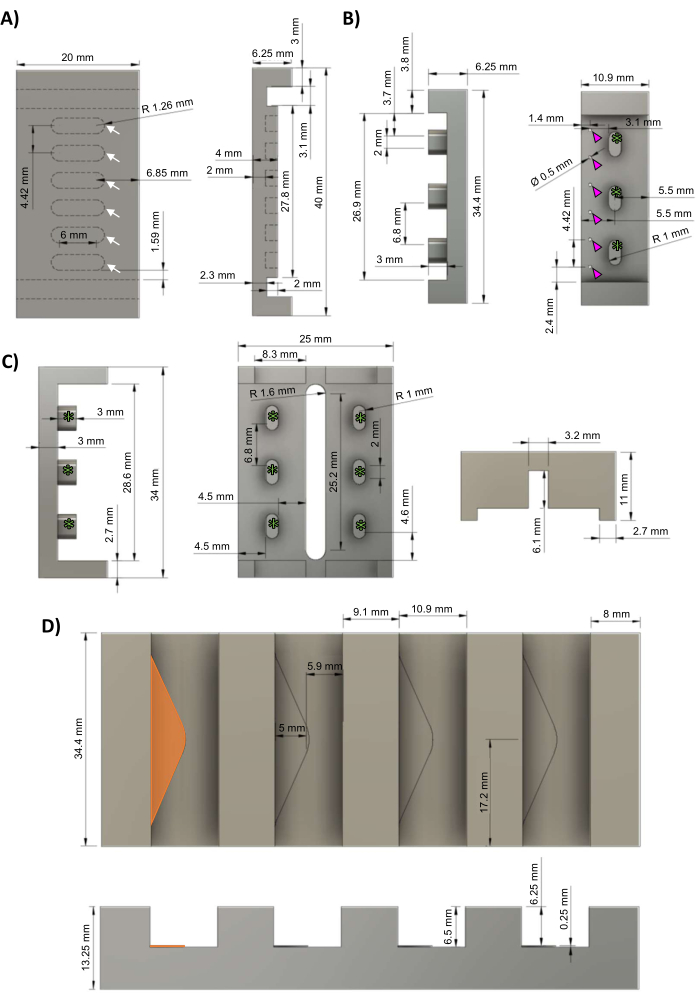
الشكل 1: مكونات المفاعل الحيوي hECT. (أ) منظر علوي (يسار) ومنظر جانبي (يمين) لصفيحة PTFE مع ستة آبار متباعدة بشكل متساو لتشكيل hECTs (أسهم بيضاء). (B) منظر جانبي (يسار) ومنظر علوي (يمين) لقوالب الألومنيوم الرئيسية السلبية لرفوف PDMS مع ستة أعمدة متباعدة بشكل متساو (رؤوس أسهم أرجوانية) وثلاث فجوات للربط بإطار المفاعل الحيوي (العلامات النجمية الخضراء). (C) منظر جانبي (يسار) ومنظر سفلي (يمين) لإطارات polysulfone لرفوف PDMS مع ثلاثة دعامات إطار متباعدة بشكل متساو (علامات نجمية خضراء) تتوافق مع دعامات الإطار في قالب حامل PDMS (اللوحة B). (D) منظر علوي (أعلى) ومنظر جانبي (أسفل) لحامل الألمنيوم المصبوب مع أربع فتحات لقوالب رف PDMS ، كل منها برف مثلث بارتفاع 0.25 مم (أقصى اليسار رف مظلل باللون البرتقالي). تم تعديل هذا الرقم من فان نيست27. الاختصارات: hECT = أنسجة القلب المهندسة البشرية. Ø = القطر ؛ PTFE = بولي تترافلورو إيثيلين ؛ PDMS = بوليديميثيل سيلوكسان ؛ R = نصف القطر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
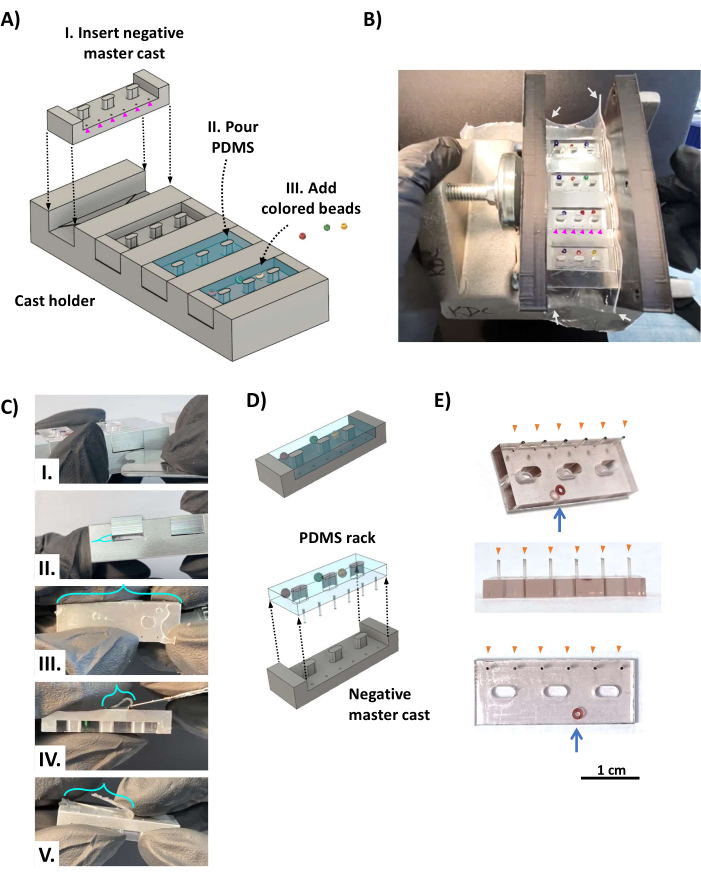
الشكل 2: تصنيع رفوف PDMS. (أ) تظهر عروض CAD منظرا مائلا لجهاز الصب. (I) يتم إدخال قالب رئيسي لحامل PDMS سلبي في كل من الفتحات الأربع لحامل الصب مع وضع الثقوب التي تشكل أعمدة PDMS (رؤوس الأسهم الأرجواني) فوق المساحة الميتة المقابلة للرف الثلاثي (الشكل 1D ، مثلث برتقالي). (II) يتم سكب PDMS في كل تجويف من الزهر الرئيسي السلبي. (III) تضاف الخرزات الملونة إلى PDMS غير المعالج كنظام تعريف مرمز بالألوان. (B) صورة تظهر جهاز صب الرف PDMS المجمع ، والذي يتم تثبيته على كلا الجانبين بقوسين مطبوعين 3D مثبتين في مكانهما بواسطة مشبك لولبي وملفوف بألواح سيليكون بسمك 0.5 مم (أسهم بيضاء) لإغلاق الجوانب المثبتة. يتم وضع الخرز الملون بحيث لا يغطي الثقوب التي يبلغ قطرها 0.5 مم والتي تشكل الأعمدة (رؤوس الأسهم الأرجواني). (ج) بمجرد معالجة PDMS ، تتم إزالة الجبيرة من حامل الجبيرة. (I) يتم إدخال شفرة حلاقة من الفولاذ المقاوم للصدأ أو أداة معدنية رقيقة مماثلة بين المصبوب وحامل القالب لنزع الجبيرة من حامل الجبس (II). (III) يتم توصيل الفيلم (الأقواس الفيروزية) الذي يتكون من PDMS المتدفق عبر فتحات الأعمدة بأطراف الأعمدة ويجب قطعه باستخدام شفرة حادة (IV ، V). (د) يتم فصل حامل PDMS عن الجبيرة. (E) صور تظهر مناظر مائلة (أعلى) وجانبية (وسط) وأسفل (أسفل) لحامل PDMS مع خرزة زجاجية مدمجة في الجسم لتحديد الهوية (سهم أزرق). تم تمييز أطراف الأعمدة (رؤوس الأسهم البرتقالية) بالحبر الأسود. شريط المقياس = 1 سم. تم تعديل هذا الرقم من فان نيست27. الاختصارات: CAD = التصميم بمساعدة الكمبيوتر ؛ PDMS = بوليديميثيل سيلوكسان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
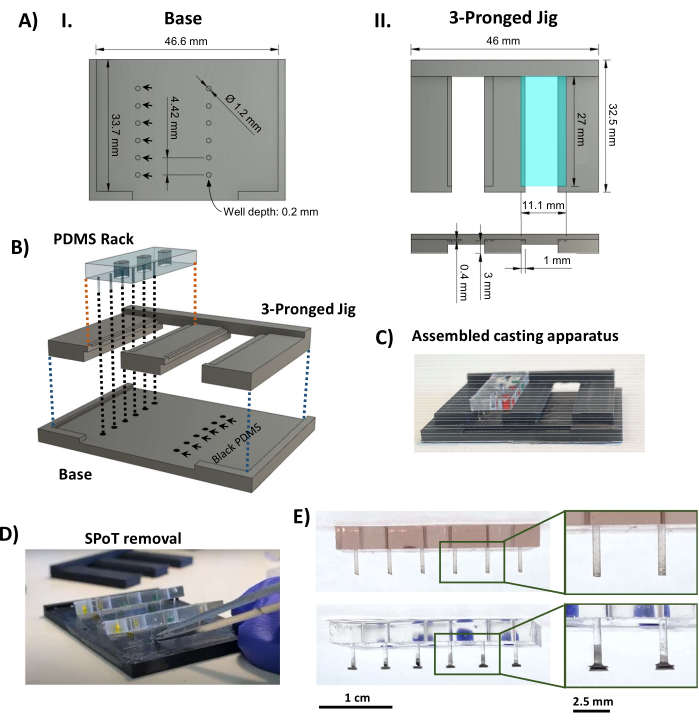
الشكل 3: تصنيع SPoT. (أ) عروض CAD التي تشير إلى الأبعاد الرئيسية للقاعدة (I) و (II) القطعة ثلاثية المحاور من رقصة صب SPoT. يتم تعيين أبعاد أشكال SPoT الدائرية (الذكاء الاصطناعي ، الأسهم السوداء) بعمق 0.2 مم × قطر 1.2 مم ، ويحمل كل منها PDMS الأسود ل SPoT فردي. يتم الضغط على الرف مقاس 11.1 مم × 27 مم الذي يظهر في المنظر العلوي (AII ، أعلى ، مستطيل فيروزي) بمقدار 0.4 مم (كما هو موضح في المنظر الجانبي أدناه) لتثبيت حامل PDMS في مكانه أثناء المعالجة. (ب) عرض CAD يوضح تجميع جهاز صب SPoT. (ج) صورة لجهاز صب SPoT المجمع. (د) بعد معالجة PDMS ، تنزلق الرقصة ثلاثية المحاور من أسفل رفوف PDMS ، ويتم تحرير SPoTs من آبارها باستخدام ملقط دقيق. (E) صور لحامل PDMS بدون (أعلى) ومع (أسفل) SPoTs. تظهر الأجزاء الداخلية طرق عرض مكبرة للمنشورات. أشرطة المقياس = 1 سم (E)، 2.5 سم (الصور المكبرة ل E). تم تعديل هذا الرقم من فان نيست27. الاختصارات: CAD = التصميم بمساعدة الكمبيوتر ؛ Ø = القطر ؛ PDMS = بوليديميثيل سيلوكسان ؛ R = نصف القطر ؛ SPoT = تعقب آخر مستقر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. ثقافة الخلية
- زراعة iPSCs
ملاحظة: قد تتطلب خطوط الخلايا المختلفة تعديلات على تخفيف المرور والتردد و / أو معايرة المواد المضافة المتوسطة.- قم بتغطية صفيحة 6 آبار معالجة بزراعة الخلايا بمصفوفة غشاء قاعدي مؤهلة (مخففة في 1: 1 Modified Eagle Medium: Ham's F12 Nutrient Solution [DMEM / F12] وفقا لتعليمات الشركة المصنعة) ، واحتضان اللوحة عند 37 درجة مئوية لمدة 30 دقيقة على الأقل. قم بإعداد 500 مل من وسط زراعة iPSC وفقا لتعليمات الشركة المصنعة ، وأضف 5 مل من محلول مخزون البنسلين والستربتومايسين (10000 وحدة دولية / مل إلى 10000 ميكروغرام / مل).
- لتمرير iPSCs ، قم بشفط الوسط من الآبار واغسل كل بئر مرة واحدة باستخدام 1 مل من المحلول الملحي المخزن بالفوسفات (PBS). أضف 1 مل من محلول تفكك iPSC لكل بئر ، واحتضانه في غطاء التدفق الصفحي لمدة دقيقة واحدة.
- نضح محلول تفكك iPSC ، واحتضان الخلايا عند 37 درجة مئوية (بدون أي وسيط) لمدة 5 دقائق. أضف 1 مل من 2 ميكرومتر ثيازوفيفين في وسط iPSC لتحييد محلول تفكك iPSC.
- استخدم ماصة مصلية سعة 2 مل لفصل المستعمرات إلى كتل من حوالي 10 خلايا ، واغسل كل بئر ب 1 مل إضافي من ثيازوفيفين 2 ميكرومتر في وسط iPSC. أضف 2 مل من تعليق الخلية إلى كل بئر من اللوحة المطلية حديثا بمصفوفة غشاء القاعدية (الخطوة 2.1.1).
- بعد 24 ساعة ، قم بإزالة الوسيط وإضافة وسيط iPSC جديد (بدون ثيازوفيفين). قم بتغذية iPSCs كل 48 ساعة ب 2 مل من وسط iPSC أو كل 72 ساعة ب 4 مل من الوسط. أعد طلاء الخلايا بتخفيف 1: 6 للمرور كل 3 أيام أو عندما تصل إلى التقاء 80٪.
ملاحظة: قد تتطلب خطوط الخلايا المختلفة ضبط تردد التخفيف والمرور.
- تمايز عضلة القلب
- ابدأ التمايز عندما تكون الطبقات أحادية iPSC متقاربة بنسبة 80٪ -90٪.
- تحضير وسط التمايز عن طريق إضافة 10 مل من مكمل B27 بدون أنسولين و 5 مل من محلول مخزون البنسلين والستربتومايسين إلى 500 مل من وسط معهد روزويل بارك التذكاري 1640 (RPMI). تحضير وسط صيانة عضلة القلب عن طريق إضافة 10 مل من مكمل B27 و 5 مل من محلول مخزون البنسلين والستربتومايسين إلى 500 مل من RPMI 1640.
ملاحظة: يمكن تخزين وسط التمايز ووسط صيانة عضلة القلب عند 4 °C لمدة تصل إلى 2 أسابيع. - اليوم 0: اغسل الخلايا ب 1 مل من DMEM / F12 ، وأضف 2 مل من 10 ميكرومتر CHIR99021 ومصفوفة غشاء القاعدية المخففة في وسط التمايز.
- اليوم الأول: بعد 24 ساعة ، أو عندما ينخفض التقاء الخلية إلى أقل من 70٪ ، اغسل الخلايا ب 1 مل من DMEM / F12 ، وأضف 2 مل من وسط التمايز ، واحتضنها لمدة 48 ساعة.
- الأيام 3-4: اغسل الخلايا ب 1 مل من DMEM / F12 ، وأضف 2 مل من 5 ميكرومتر IWR-1 في وسط التمايز. كرر في اليوم 4.
- الأيام 5-6: اغسل الخلايا ب 1 مل من DMEM / F12 ، وأضف 2 مل من وسط التمايز. كرر في اليوم 6.
- الأيام 7-10: اغسل الخلايا ب 1 مل من DMEM / F12 ، وأضف 2 مل من وسط صيانة خلايا عضلة القلب. كرر كل 24 ساعة.
- أيام 11+: استبدل الوسط ب 4 مل من وسط صيانة خلايا عضلة القلب الطازجة كل 48-72 ساعة. نضح وماصة ببطء لتجنب إتلاف الطبقات الأحادية النابضة بقوة.
3. ثقافة hECT
- حصاد الخلايا العضلية القلبية
- حصاد أحاديات الخلايا العضلية القلبية لاستخدامها في تصنيع hECT 8-60 يوما بعد تحريض التمايز. توقع 2-5 مليون خلية لكل بئر.
ملاحظة: إذا لم تبدأ الخلايا في النبض بحلول اليوم 10 ، فمن غير المرجح أن يكون التمايز ناجحا. غالبا ما تنفصل الطبقات الأحادية الضرب بقوة بعد 11-15 يوما في التمايز وتضغط في الأنسجة الكثيفة. يوصى باستخدام هذه الخلايا أو إعادة صفيحها في هذا الوقت. - شطف كل بئر من خلايا عضلة القلب 2x مع 2 مل من برنامج تلفزيوني. أضف 1 مل من درجة حرارة الغرفة 0.25٪ تربسين-EDTA. احتضان في 37 درجة مئوية لمدة 5-10 دقائق حتى تظهر الخلايا مستديرة وسوف تنفصل مع النقر الخفيف على اللوحة.
- أضف 1 مل من 10٪ FBS في وسط صيانة خلايا عضلة القلب إلى كل بئر لتحييد التفكك. ماصة برفق أحادي الطبقات باستخدام طرف ماصة مصلية 5 مل ، وانقلها إلى أنبوب مخروطي 50 مل لتفتيت الحبيبات إلى كتل من 10-20 خلية.
- امزج معلق الخلية عن طريق قلب الأنبوب المخروطي قبل نقل 10 ميكرولتر من الخلايا إلى 10 ميكرولتر من التريبان الأزرق. عد الخلايا باستخدام عداد الخلايا الآلي أو مقياس الدم الزجاجي. افصل تعليق الخلية بشكل مناسب إذا لم يتم استخدام جميع الخلايا أو إذا تم تخصيص بعض الخلايا لقياس التدفق الخلوي.
ملاحظة: يمكن إضافة الخلايا التكميلية (مثل الخلايا الليفية) في هذه المرحلة. - أجهزة الطرد المركزي الخلايا في 250 × غرام لمدة 5 دقائق. استنشق على الفور أكبر قدر ممكن من الطافات دون إزعاج بيليه الخلية ، والحفاظ على الجليد. اعمل بسرعة لتقليل الوقت الذي تقضيه الخلايا في الحبيبات.
- حصاد أحاديات الخلايا العضلية القلبية لاستخدامها في تصنيع hECT 8-60 يوما بعد تحريض التمايز. توقع 2-5 مليون خلية لكل بئر.
- تصنيع hECT
- استخدم وحدات التخزين في الجدول 2 ، واضبطها وفقا لعدد الخلايا في الحبيبات بحيث يحتوي كل hECT على 1 مليون خلية. بعد كل خطوة ، اخلطها عن طريق السحب ببطء لتجنب الفقاعات.
ملاحظة: نفذ الخطوات من 3.2.2 إلى 3.2.3 المحمية من الضوء المباشر لأن بعض المكونات حساسة للضوء. - قم بإعداد محلول كولاجين من النوع 1 سعة 2.9 جم / مل في أنبوب دقيق سعة 1.7 مل عن طريق إضافة 13.442 ميكرولتر من الماء المقطر ، و 4.4 ميكرولتر من 10x PBS ، و 0.638 ميكرولتر من 1M هيدروكسيد الصوديوم. أضف 25.52 ميكرولتر من محلول مرق الكولاجين 5 مجم / مل ، واخلطه ببطء.
- تحضير مزيج المصفوفة خارج الخلية (مزيج ECM من الجدول 2): أضف 5.5 ميكرولتر من محلول HEPES 0.2 N pH 9 متبوعا ب 5.5 ميكرولتر من 10x MEM. تخلط جيدا حتى يتم ملاحظة لون موحد من الأصفر الفاتح إلى الوردي الفاتح. نقل 35.2 ميكرولتر من محلول مزيج ECM إلى حبيبات الخلية ، وإضافة 4.4 ميكرولتر من مصفوفة الغشاء القاعدي.
- افتح الكيس المعقم لأجزاء المفاعل الحيوي (الخطوة 1.4.7 ، الشكل 4 أ). أثناء ارتداء القفازات المعقمة بنسبة 70٪ من الإيثانول ، قم بإزالة الصفيحة السوداء من كيس الأوتوكلاف ، وضعها في طبق 60 مم مع توجيه الآبار لأعلى. ماصة 44 ميكرولتر من خليط الخلية في كل بئر ببطء لتجنب إدخال الفقاعات. إذا لزم الأمر ، استخدم الماصة لإزالة أي فقاعات تم إدخالها عن طريق السحب أو تشكلت بسبب كره الماء ل PTFE. قم باستعادة حجم hECT بحيث يكون سطح السائل متدفقا مع شفة البئر (الشكل 4BI).
- ارتد زوجا جديدا من القفازات المعقمة ، وقم بإزالة إطار البولي سلفون مع رفوف PDMS من كيس الأوتوكلاف. قم بخفض الإطار على الصفيحة الأساسية بحيث تتناسب نهايات الإطار مع الأخاديد الموجودة في نهايات الصفيحة الأساسية (الشكل 4BII ، III). افحص المفاعل الحيوي للتأكد من أن جميع الأعمدة مستقيمة وأن الإطار غير مائل قبل وضعه في طبق 60 مم.
- أضف 1 مل من 10٪ FBS في وسط صيانة خلايا عضلة القلب إلى الطبق 60 مم (احرص على عدم إزعاج hECTs) لزيادة الرطوبة في الطبق مع تصلب hECTs. ضع الطبق مقاس 60 مم بدون غطاء في طبق مرتفع (طوله 20 مم) 100 مم ، وقم بتغطيته بغطاء طبق 100 مم ، وأعد المفاعل الحيويإلى حاضنة CO 2 37 درجة مئوية ، 5٪ للسماح للكولاجين بتكوين هلام مع الخلايا المعلقة.
- بعد 2 ساعة ، أخرج الطبق من الحاضنة. أضف 13 مل من 10٪ FBS في وسط صيانة خلايا عضلة القلب ، وقم بإمالة الطبق لتشجيع الوسط على التدفق بين صفيحة PTFE ورفوف PDMS.
- افحص المفاعل الحيوي من الجانب للتأكد من عدم وجود فقاعات هواء محاصرة بين الأسطح الكارهة للماء لصفيحة PTFE ورفوف PDMS ، وأعد الطبق إلى الحاضنة. إذا كان هناك هواء محبوس ، فقم بإمالة المفاعل الحيوي خارج الوسط للسماح للفقاعة بالكسر ، وقم بخفضها ببطء مرة أخرى ، أو استخدم ماصة صغيرة مع طرف تحميل هلام لسحب الهواء ، مع الحرص على عدم إزعاج الأعمدة.
- استخدم وحدات التخزين في الجدول 2 ، واضبطها وفقا لعدد الخلايا في الحبيبات بحيث يحتوي كل hECT على 1 مليون خلية. بعد كل خطوة ، اخلطها عن طريق السحب ببطء لتجنب الفقاعات.
- إزالة الصفيحة الأساسية
- افحص ضغط hECT من خلال الفجوة الموجودة في الإطار. على مدار 24-96 ساعة ، تضغط hECTs وتصبح أكثر غموضا (الشكل 4CI-III). بمجرد وجود فجوة مرئية بين hECTs وجدار الصفيحة الأساسية (الشكل 4CII) ، قم بإجراء تغييرين متوسطين نصف الحجم لتغيير الوسط إلى وسط صيانة خلايا عضلة القلب بدون FBS. قم بإزالة الصفيحة الأساسية عندما يتم ضغط hECTs بنسبة 30٪ على الأقل مقارنة بالقطر الأصلي (الشكل 4CIII). املأ الطبق 60 مم الذي يحتوي على المفاعل الحيوي بوسط صيانة خلايا عضلة القلب حتى يتدفق السائل مع شفة الطبق ، وأضف 14 مل إلى طبق جديد 60 مم.
- خطوة حاسمة: أثناء ارتداء قفازات معقمة ، اقلب المفاعل الحيوي في طبقه بحيث تكون الصفيحة في الأعلى (الشكل 4BIV). افحص فقاعات الهواء المحبوسة كما في الخطوة 3.2.8. ارفع الصفيحة ببطء ، مع الحفاظ على مستواها (الشكل 4BV).
- إذا سقط hECT أثناء إزالة الصفيحة الأساسية ولكنه ظل في الصفيحة الأساسية ، فاستخدم ملقط دقيق منحني معقم لنقل hECT من الصفيحة الأساسية إلى طبق 60 مم. استخدم الملقط لتوجيه نهاية hECT إلى موقعه. استخدم زوجا ثانيا من الملقط لتثبيت العمود ، وقم بتمريره من خلال الفتحة الموجودة في العلاج بالصدمات الكهربائية. كرر للوظيفة الثانية إذا لزم الأمر.
- مع إرفاق جميع hECTs بالأعمدة ، انقل الإطار مع hECTs إلى الطبق الجديد مقاس 60 مم ، وضع الإطار مع توجيه الأعمدة لأسفل (الشكل 4BVI). افحص المفاعل الحيوي للتأكد من بقاء hECTs على مواقعها بالقرب من SPoT.
- إذا تم دفع hECT بواسطة التوتر السطحي إلى قاعدة وظائفه ، فقم بتثبيت الإطار بزوج من الملقط المنحني المعقم. أدخل الزوج الآخر من الملقط من خلال الفتحة الموجودة في الإطار ، مع إبقائه مغلقا. بمجرد خفض طرف الملقط بعد رفوف PDMS ، قم بلفه بحيث يصل إلى العمود ، واستخدم الأطراف المغلقة لدفع hECT برفق نحو نهاية العمود حتى يستقر على SPoT (الشكل 4BVI ، أقحم).
- صيانة hECT
- إجراء تغييرات متوسطة نصف الحجم مع وسط صيانة عضلة القلب كل 24-48 ساعة (بعد أسبوعين من الثقافة ، يمكن تقليل التردد إلى مرتين في الأسبوع.)
- عندما تعرض hECTs مجموعات من الضرب التلقائي ، عادة بحلول اليوم 3 ، والضرب المنسق مع انحراف ما بعد المرئي بحلول اليوم 5 ، ابدأ القياسات الوظيفية ، وكرر كلما رغبت في ذلك.
ملاحظة: من غير المرجح أن تفعل ذلك على الإطلاق hECTs التي لم تبدأ في الضرب المنسق بحلول اليوم 7.
| مكون | الحجم (ميكرولتر) | |||||||
| المقطر H2O | 13.442 | 2.9 ملغ/مل محلول كولاجين | "مزيج ECM" | خليط الخلايا النهائي hECT | ||||
| هيدروكسيد الصوديوم 1N | 0.638 | |||||||
| برنامج تلفزيوني 10x | 4.4 | |||||||
| 5 ملغ/مل من مرق الكولاجين | 25.52 | |||||||
| 0.2 نيوتن درجة الحموضة 9 HEPES | 5.5 | |||||||
| 10x ميم | 5.5 | |||||||
| حجم مزيج ECM لنقله إلى بيليه الخلية | 35.2 | |||||||
| حجم ماتريجيل | 4.4 | |||||||
الجدول 2: كواشف hECT. يجب إضافة المكونات بالترتيب المدرج والاحتفاظ بها على الجليد.
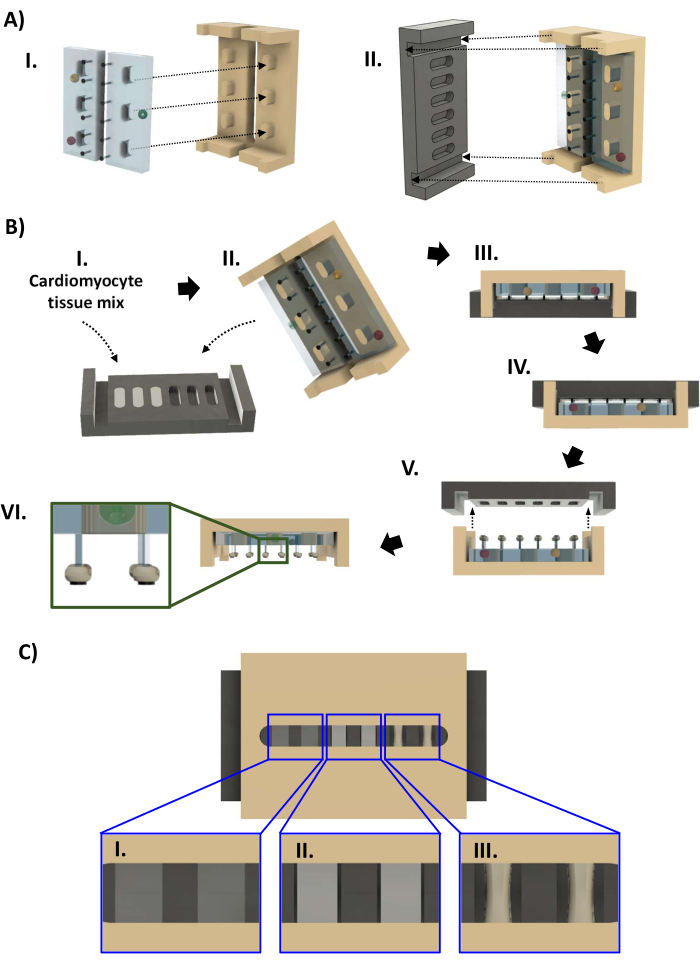
الشكل 4: تجميع المفاعلات الحيوية وتصنيع hECT. (أ) (ط) رفان PDMS (يسار، أزرق فاتح) مثبتان على إطار البولي سلفون (يمين، أسمر). (II) ثم يتم تركيب صفيحة PTFE (أسود ، يسار) على الإطار (يمين) بحيث يتناسب كل زوج من الأعمدة مع بئر الصفيحة. (ب) (ط) يضاف أربعة وأربعون ميكرولترا من معلق الخلايا العضلية القلبية في مصفوفة خارج الخلية قائمة على الكولاجين إلى كل بئر من آبار الصفيحة الأساسية الستة. (الثاني والثالث) الإطار المزود برفوف PDMS مناسب للضغط على الصفيحة الأساسية. بعد 1-4 أيام ، يمكن إزالة hECTs من الصفيحة الأساسية. (IV) أولا ، يتم قلب المفاعل الحيوي قبل (V) يتم رفع الصفيحة الأساسية عن الإطار. (VI) منظر جانبي للمفاعل الحيوي بستة hECTs. أقحم: عرض مكبرة يوضح موضع hECT على المشاركات المتعلقة ب SPoTs (داخلي). (C) عرض CAD يظهر ثلاثة مستويات من ضغط hECT ([I] منخفض ، [II] متوسط ، و [III] مرتفع) كما يظهر من خلال الفجوة في إطار polysulfone. تم تعديل هذا الرقم من فان نيست27. الاختصارات: CAD = التصميم بمساعدة الكمبيوتر ؛ PDMS = بوليديميثيل سيلوكسان ؛ PTFE = بولي تترافلورو إيثيلين ؛ SPoT = تعقب آخر مستقر ؛ hECT = أنسجة القلب المهندسة للإنسان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. معدات سرعة hECT
- سترة للمرحلة الساخنة
- استخدم آلة القطع بالليزر لقطع مكونات الغلاف العازل للأكريليك من لوح أكريليك شفاف بسمك 0.635 سم (الملف التكميلي 3) ، واحد من كل من الشكل 5A-D ، واثنان من كل من الشكل 5E ، F.
- قم بتجميع الأجزاء (ب) و (ج) و (د) وواحد من (ه) من الشكل 5 ، واربطها معا باستخدام غراء الأكريليك كما هو موضح في الشكل 5GI. قم بتوصيل اللوحة العلوية (الشكل 5GII) ، واترك عدة ساعات حتى يتماسك الغراء ، ثم حرك المرحلة الساخنة إلى جانب الغلاف (الشكل 5GIII).
- بمجرد وضع الغلاف في مكانه ، استخدم شريطا لتثبيت الإدخالات بين أرجل المرحلة الساخنة ، وأضف اللوحة الأمامية (الشكل 5GIV) لإنهاء التجميع (الشكل 5GV).
- تصنيع قطب الجرافيت
- قطع قضبان الجرافيت بسمك 6.25 مم وعرض 25 مم باستخدام منشار شريطي إلى كتل بطول 35 مم ؛ بعد ذلك ، قم بقص كل كتلة بالطول في خط منحني بحيث يبلغ طول كل قطب كهربائي 13-16 مم في أحد طرفيه وطوله 8-10 مم في الطرف الآخر. احفر فتحتين بقطر 0.7 مم في الزاوية العلوية (الشكل 6AI). تلميع القطع باستخدام مناشف ورقية ، وصوتنيكات في الماء لمدة 20 دقيقة لإزالة غبار الجرافيت. تأكد من أن الأقطاب الكهربائية تتأرجح بين جدران الطبق والمفاعل الحيوي بعرض 25 مم لضمان مسافة ثابتة بين الأقطاب الكهربائية (الشكل 6AII).
- قم بربط سلك فولاذي بطول 150 مم × قطر 0.25 مم من خلال فتحات الأقطاب الكهربائية ، وثنيه ليناسب شفة الطبق 60 مم وحول جدران الطبق 100 مم بحيث يمكن إغلاق الغطاء (الشكل 6AII).
- نظف الأقطاب الكهربائية عن طريق نقعها في الماء المقطر لمدة 1-2 ساعة بعد كل استخدام لإزالة أي وسط ممتص ، واتركه يجف طوال الليل ، ثم الأوتوكلاف عند 132 درجة مئوية لمدة 30 دقيقة. قبل البدء في القياسات ، ضع قطبا كهربائيا واحدا على جانبي المفاعل الحيوي (الشكل 6AII). ضع الأسلاك بحيث يمكن إغلاق غطاء الطبق 100 مم ، وأعد المفاعل الحيوي إلى الحاضنة لتحقيق التوازن.
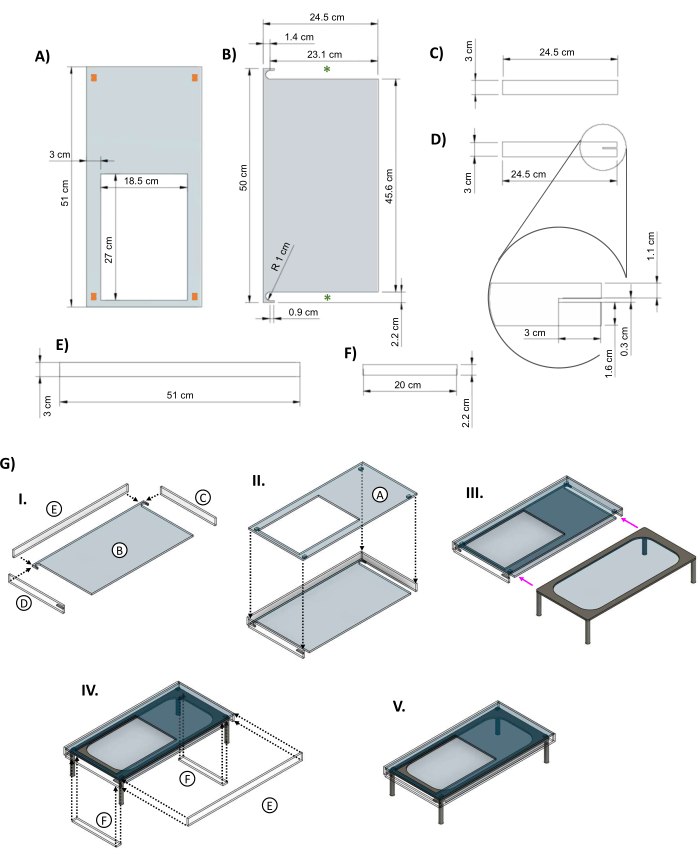
الشكل 5: سترة أكريليك لعزل المرحلة الزجاجية الساخنة. صور CAD توضح الأبعاد الرئيسية لقطع سترة الأكريليك المصممة للطاولة الزجاجية. (أ) تحتوي اللوحة العلوية على فتحة مقاس 27 سم × 18.5 سم للسماح لطبق المفاعل الحيوي بالجلوس على عنصر التسخين. تشير المستطيلات البرتقالية في الزوايا إلى الوضع المقترح لقطع مباعدة صغيرة لتوفير مساحة بين الجزء العلوي من الغلاف وعنصر التسخين. (ب) تحتوي القطعة السفلية من الغلاف على قطعتين للسماح لأرجل المرحلة الساخنة بالانزلاق (العلامات النجمية الخضراء). (ج &د) لوحان جانبيان يتناسبان تحت القطعة العلوية. (د) تشتمل اللوحة الجانبية اليسرى على فتحة 3 سم × 0.3 سم (أقحم) لسلك طاقة المسرح. (ه) تلائم الألواح الطويلة الأمام والخلف. (F) تضاف إدخالات لملء الفجوات بمجرد دخول الطاولة إلى الداخل. (G) (I) يتم توصيل الألواح الجانبية والخلفية بالقطعة السفلية ، ثم (II) تتم إضافة اللوحة العلوية. (III) تنزلق الطاولة الزجاجية في الغلاف (أسهم أرجوانية). (IV) يتم تثبيت الحشوات بين أرجل الطاولة ، ويتناسب الظهر مع الفتحة لإغلاق الصندوق. (V) مجموعة السترة المكتملة. تم تعديل هذا الرقم من فان نيست27. الاختصارات: CAD = التصميم بمساعدة الكمبيوتر ؛ R = نصف القطر ؛ Ø = القطر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: الحصول على بيانات انكماش hECT. (أ) (ط) صور الأقطاب الكهربائية المقطوعة من قضبان الجرافيت. تشير الأسهم الأرجواني إلى ثقوب لربط أسلاك الفولاذ المقاوم للصدأ. شريط المقياس = 1 سم (II) منظر مائل (يسار) ومنظر علوي (يمين) يوضح موضع أقطاب الجرافيت في المفاعل الحيوي. تشغل الأقطاب الكهربائية المسافة بين المفاعل الحيوي بعرض 25 مم وجدار الطبق لضمان مسافة ثابتة بين الأقطاب الكهربائية. الأسلاك مثنية للسماح بإغلاق غطاء الطبق. (ب) صورة لإعداد سرعة hECT داخل جهاز طاولة تنظيف التدفق الصفحي - يتم وضع جميع المعدات على طاولة عزل الاهتزاز لتقليل ضوضاء الاهتزاز من المقعد النظيف. يجلس المفاعل الحيوي (رأس السهم الأرجواني) على المسرح الساخن المغلف ، مضاء بمصدر ضوء LED من الأعلى. يتم توجيه مجهر التشريح أفقيا إلى مرآة قائمة الزاوية (علامة النجمة البرتقالية) لرؤية المفاعل الحيوي من الأسفل ومزود بكاميرا CCD (يسار). يشير القوس الفيروزي إلى حمام مائي للمراقبة المستمرة لدرجة الحرارة لتوفير التغذية المرتدة لوحدة التحكم في المرحلة المسخنة ذات الحلقة المغلقة. تم تعديل هذا الرقم من فان نيست27. الاختصارات: hECT = أنسجة القلب المهندسة البشرية. LED = الصمام الثنائي الباعث للضوء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. القياسات الوظيفية hECT
- إعداد مساحة عمل السرعة
- قم بتشغيل المرحلة الساخنة إلى 39.5 درجة مئوية ، وقم بإعداد معدات السرعة على طاولة عزل الاهتزاز داخل مقعد نظيف للتدفق الصفحي وفقا للشكل 6 ب. قم بتركيب مجهر التشريح على حامل ذراع الرافعة ، ووجهه إلى مرآة قائمة الزاوية (الشكل 6B ، علامة النجمة البرتقالية) الموجودة على مقبس مختبر أسفل الطاولة الزجاجية لعرض المفاعل الحيوي من الأسفل. قم بتثبيت كاميرا CCD عالية السرعة على المجهر ، وقم بتوصيلها بالكمبيوتر. قم بإشعاع الإعداد بضوء الأشعة فوق البنفسجية لمدة 15 دقيقة لتعقيم مساحة العمل.
- ضع المفاعل الحيوي (الشكل 6B ، رأس سهم أرجواني) على المسرح الساخن المغلف ، مضاء بمصدر ضوء LED مزدوج الرأس معقوفة من الأعلى (يمكن تثبيت أعناق مصابيح LED بشكل أكثر إحكاما على الوحدة الرئيسية مقارنة بمصابيح الألياف البصرية). قلل الضوضاء الإضافية من خلال التأكد من أن معدات السرعة الموجودة على طاولة الاهتزاز (والطاولة نفسها) لا تلامس أي جزء من مقعد تنظيف التدفق الصفحي.
- أضف طبقا ثانيا مقاس 60 مم مملوءا بالماء المسخن مسبقا داخل طبق 100 مم على الطاولة المسخنة (الشكل 6 ب ، قوس الفيروز) ، والزي مع مسبار درجة الحرارة للمراقبة المستمرة لدرجة الحرارة. اضبط إعداد درجة حرارة المرحلة الساخنة حسب الحاجة للحفاظ على درجة حرارة الطبق المرجعي عند 36-37 درجة مئوية.
- اضبط تكبير المجهر على 1.5x (أو تكبير آخر مرغوب فيه يمكن من خلاله تصور hECT بالكامل بدقة كافية).
- ضبط إعدادات الكاميرا
- افتح برنامج الكاميرا. قم بتغيير حجم موجز الفيديو لاقتصاص مجال العرض قدر الإمكان مع الاستمرار في تصور hECT بالكامل. هذا يزيد من سرعة الكاميرا.
- اضبط معدل الالتقاط على 90 إطارا في الثانية. اضبط وقت التعرض وموضع مصدر الضوء لتحسين توحيد ظروف الإضاءة عبر مجال الرؤية وزيادة تباين SPoTs إلى أقصى حد.
- إعداد برنامج الاستحواذ
- قم بتشغيل محفز النبض المربع ، وقم بتوصيله بالكمبيوتر. اضبط الإعدادات لتقديم نبضات ثنائية الطور بسعة 12 فولت ومدة 5 مللي ثانية.
- افتح برنامج الحصول على البيانات ، ثم افتح الملف "AutomatedPostTracking3.vi" (الملف التكميلي 4). بمجرد تحميله ، انقر فوق السهم الأبيض على الجانب الأيسر من شريط الأدوات لتهيئة البرنامج (الشكل 7 أ).
- معايرة البرنامج باستخدام مقياس الدم الزجاجي على المسرح الساخن. في شريط الأدوات (الشكل 7B) ، انقر فوق أداة الخط لرسم خط عبر 1 مم من علامات مقياس الدم (غير معروض). في مربع معايرة المسافة (بكسل / مم) (الشكل 7C) ، اضبط الطول المرجعي (مم) على 1 ، ثم انقر فوق الزر "حساب ".
- قم بقياس منطقة المقطع العرضي hECT باستخدام أداة الخط لرسم خط عبر عرض النسيج. انقر فوق 1 في مربع مساحة المقطع العرضي (مم ^ 2) (الشكل 7 د) لحساب المساحة (بافتراض هندسة أسطوانية لشرائط الأنسجة الخطية ، كما هو محدد في الأدبيات1،2،3،4،5،6،7،8،9،10،11 ، 12,15,16,18,19,20,
21,22,23,24,25,26,37,38). كرر على طول أجزاء مختلفة من hECT ، وسجل القيم أسفل الزرين الآخرين في المربع. يبلغ ملف جدول بيانات الإخراج عن متوسط هذه القيم الثلاث لحساب قطر الأنسجة.
- التوصيف الوظيفي hECT
- تأكد من التركيز على نصائح المنشور. قم بتشغيل مفتاح العتبة (الشكل 7E) ، واضبط شريط التمرير (الشكل 7F) حتى يتم ترسيم SPoTs (الشكل 7G) بشكل جيد ولا تغير شكلها عند تقلص hECT.
- استخدم أداة المستطيل لرسم مستطيل حول أحد SpoTs (الشكل 7 ، المستطيل الأخضر) ، وانقر فوق الزر Set 1 داخل مربع حدود المنشور (الشكل 7H) لتعيين موضع المستطيل حول SPoT ، مما يضمن بقاء SPoT داخل حدود المستطيل في جميع الأوقات. كرر المنشور الآخر ، وقم بتسجيله ضمن المجموعة 2.
- اضبط إعدادات حجم الكائن (الشكل 7I) لمنع البرنامج من تتبع الكائنات الصغيرة. تأكد من أن عدد الكائنات المتعقبة في كل مستطيل يظل ثابتا. توضح الواجهة (الشكل 7J) المسافة المقاسة بين الكائنات المتعقبة في الوقت الفعلي. استخدم هذا الرسم البياني لمراقبة الضوضاء.
- حدد دليلا لحفظ الملفات (الشكل 7K). تخزين البيانات من أيام مختلفة في مجلدات منفصلة. حدد رقم المناديل الحالي ، واكتب أي تعليقات مطلوبة في مربع التعليقات .
- تحت رأس تردد السرعة (هرتز) (الشكل 7L) ، أشر إلى نطاق الترددات المطلوبة (الحد الأدنى والحد الأقصى) ، والفاصل الزمني المطلوب للانتقال من الحد الأدنى إلى الحد الأقصى. في حالة تحديد سرعة hECTs عبر نطاق الالتقاط بالكامل ، اختبر ترددات سرعة مختلفة للعثور على أدنى تردد يتم عنده تحقيق نسبة تحفيز 1: 1 ، واستمر في زيادة التردد حتى تفقد هذه النسبة. قم بقياس الوظيفة التلقائية عن طريق اختيار نطاق تردد تعسفي (على سبيل المثال ، 0.01 هرتز إلى 0.01 هرتز) والحفاظ على إخراج محفز النبضة المربعة.
- في المربعات الموجودة على اليمين ، اختر وقت (زمانات) الإعداد المطلوب (فاصل زمني بعد ضبط التردد ولكن لا يتم تسجيل البيانات) للسماح ل hECT بالتكيف مع تردد السرعة الجديد. حدد وقت (زمان) التسجيل وجهد السرعة (V). ابدأ البرنامج بالنقر فوق الزر "بدء البرنامج" (الشكل 7M).
ملاحظة: يتم حفظ النتائج تلقائيا في الدليل المحدد. بعد كل تسجيل ، لاحظ أن البرنامج النصي يعرض تحويل فورييه للبيانات (الشكل 7N) ، حيث تتوافق القمم مع تردد الضرب المكتشف. - إذا رغبت في ذلك ، قم بتشغيل برنامج "اكتشاف عتبة الإثارة" للعثور على الحد الأدنى من الجهد المطلوب لتحفيز hECT في العرض (الشكل 7O). إذا رغبت في ذلك ، احسب الحد الأقصى والحد الأدنى من انحرافات الوظائف (الشكل 7P).
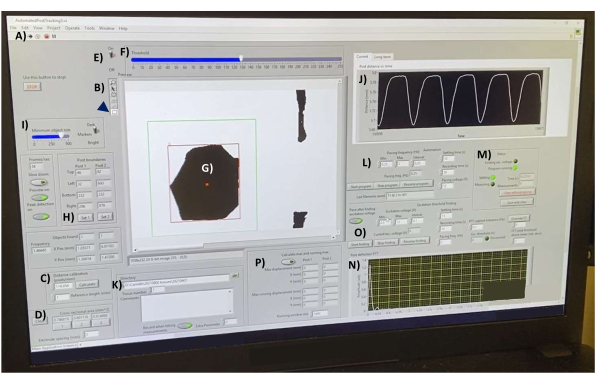
الشكل 7: واجهة الحصول على بيانات ما بعد الانحراف. ( أ) زر لتشغيل البرنامج. (ب) شريط أدوات يحتوي على أداتي الخط والمستطيل لقياسات الطول واختيار الجسم، على التوالي. (ج) ضوابط معايرة المسافة. (د) أدوات لقياس مساحة المقطع العرضي hECT في ثلاث نقاط مختلفة. (E) مفتاح العتبة وشريط التمرير (F) لتحويل تغذية الفيديو إلى صور عالية التباين في الوقت الفعلي. (ز) SPoT مرئي في نافذة المعاينة. (ح) أدوات لاختيار SPoT. (I) شريط التمرير لتصفية الكائنات حسب الحجم. (ي) رسم بياني يوضح المسافة المقاسة بين الأجسام المتعقبة في الوقت الفعلي. (K) خيارات لتحديد الدليل لحفظ ملفات الإخراج. (L) خيارات لضبط نطاق التردد والفاصل الزمني للتردد ووقت التسجيل وضبط الوقت بين التسجيلات لبرنامج التتبع اللاحق (M). (N) ناتج الرسم البياني لتحويل فورييه لمنحنى الانحراف لآخر تسجيل محفوظ. (O) برنامج لإيجاد الحد الأدنى من الجهد المطلوب لتحفيز hECTs. (ع) برنامج لحساب الحد الأقصى والحد الأدنى من انحرافات الوظائف. الاختصارات: hECT = أنسجة القلب المهندسة البشرية. SPoT = تعقب آخر مستقر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. قياسات رف PDMS
- المسافات التي تم تفريغها
- قبل تصنيع hECT ، قم بتركيب الزوج المطلوب من رفوف PDMS على إطار. استخدم إعداد السرعة والبرامج الموضحة في الخطوة 5.1 للقياسات الوظيفية. حدد SPoTs الثابتة في نهايات المنشورات.
- اضبط مصدر الضوء و / أو الحد الأدنى إذا لزم الأمر لتقليل الضوضاء إلى <2 ميكرومتر. سجل متوسط قيمة y المباشرة المشار إليها في الرسم البياني في جدول بيانات.
- ارتفاعات ما بعد وارتفاعات hECT
- من إعداد السرعة الموضح في الخطوة 5.2 ، قم بإزالة المرآة المائلة والمرحلة الساخنة. ضع المفاعل الحيوي مباشرة على مقبس المختبر للحصول على منظر جانبي للمفاعل الحيوي.
- افتح برنامج الكاميرا. اضبط وقت التعرض وموضع مصدر الضوء لتحسين توحيد ظروف الإضاءة عبر مجال الرؤية وزيادة رؤية الأعمدة.
- افتح برنامج الحصول على البيانات ثم قم بفتح الملف "PostMeasurement_PB3.vi" (الملف التكميلي 5). بمجرد تحميله ، انقر فوق السهم الأبيض على الجانب الأيسر من شريط الأدوات لتهيئة البرنامج.
- معايرة البرنامج باستخدام مقياس الدم الزجاجي. انقر فوق أداة الخط في شريط الأدوات الرأسي على يسار نافذة العرض ، وارسم خطا عبر 1 مم من علامات مقياس الدم. في مربع معايرة المسافة (بكسل / مم) في الجزء السفلي الأيسر من الشاشة ، اضبط الطول المرجعي (مم) على 1 ، ثم انقر فوق الزر حساب .
- أسفل حقول المعايرة، قم بتعيين رقم الأنسجة المطلوب (للتعريف) في حقل رقم الأنسجة . ركز الكاميرا على العمود الأيسر من hECT، وحدد يسار في مربع جانب المشاركة .
- استخدم أداة الخط لرسم خط من قاعدة المنشور (أعلى) إلى طرف SPoTs (أسفل) ، وقم بالتسجيل بالنقر فوق قياس المنشور Ht.
- ارسم خطا من قاعدة المنشور إلى الحافة البعيدة ل hECT ، وقم بالتسجيل بالنقر فوق قياس الأنسجة أعلى Ht. ارسم خطا من قاعدة المنشور إلى الحافة القريبة من hECT ، وقم بالتسجيل بالنقر فوق قياس قاعدة الأنسجة Ht.
- في هذه المرحلة ، أدر المفاعل الحيوي لقياس ارتفاع العمود الأيمن. حدد خيار المنشور الصحيح لتسجيل نفس القياسات. انقر فوق الزر "إضافة " لملء جدول البيانات بالقيم المقاسة وحساب متوسط ارتفاع hECT تلقائيا ، والذي سيتم استخدامه في الخطوة 7.
- بمجرد الانتهاء من تسجيل ارتفاعات الأنسجة ، انقر فوق حفظ زر لحفظ القيم في ملف نصي.
7. معالجة البيانات الوظيفية باستخدام البرامج النصية للتحليل المخصص
- في محرر جدول البيانات، املأ ملف الملخص باستخدام النموذج (الملف التكميلي 6). استخدم قيم طول العمود ومتوسط ارتفاع الأنسجة المكتسبة في الخطوة 6.2. تأكد من تمثيل كافة hECTs التي تحتوي على بيانات في المجلد في ملف الملخص. قم بتسمية الملف "ملخص #.csv" ، حيث يشير # إلى عدد الأيام في التجربة.
ملاحظة: يجب أن تكون البيانات الوظيفية hECT في مجلدات منفصلة وفقا ليوم التجربة. - تأكد من إضافة المجلد الذي يحتوي على البرامج النصية AnalyzeLogsGUI (الملف التكميلي 7) والمجلد الذي يحتوي على تسجيلات hECT إلى المسار.
- افتح برنامج تحليل البيانات. على يسار شريط الدليل ، انقر فوق الزر استعراض بحثا عن مجلد للانتقال إلى المجلد الأصل الذي يحتوي على كل من مجلد AnalyzeLogsGUI والبيانات الوظيفية hECT. في الشريط الجانبي للنافذة الحالية ، انقر بزر الماوس الأيمن فوق هذه المجلدات لإضافة إلى المسار | إضافة المجلدات والمجلدات الفرعية المحددة.
- افتح ملف "AnalyzeLogsGui_SC.m". في علامة التبويب محرر ، اضغط على الزر تشغيل ، وانتظر حتى تظهر واجهة المستخدم الرسومية (GUI) في نافذة جديدة.
- في مربع تحديد السجل (الشكل 8AI) ، انقر فوق الزر تحديد الدليل ، وانتقل إلى المجلد الذي يتضمن البيانات الوظيفية hECT. حدد hECT المطلوب لتتم معالجته من القائمة المنسدلة الأنسجة .
- في مربع مدخلات البيانات (الشكل 8AII) ، أدخل المسافة التي تم تفريغها بين المشاركات المسجلة من الخطوات 6.1 في حقل المسافة الانبساطي. أدخل 0.25 في حقل Post Radius (مم).
- في مربع قيود التحليل (الشكل 8AIII) ، اختر الترددات المراد حذفها من التحليل ، أو حدد ترددات معينة لتضمينها (مفصولة بفواصل). يتم تعيين وقت البدء ووقت الانتهاء على 0 و −1 ، على التوالي ، افتراضيا لمعالجة طول التسجيلات بالكامل. قم بتغيير هذه القيم لقص التسجيلات إذا لزم الأمر.
- قم بتغيير معلمات المرشح (الشكل 8AIV) للترتيب متعدد الحدود وحجم الإطار لتغيير مستوى التجانس أثناء عملية التصفية وشريط تمرير عتبة اكتشاف الذروة لتعيين الحد الأدنى لحجم الذروة الذي سيتم التعرف عليه بواسطة البرامج النصية.
ملاحظة: يحتوي البرنامج النصي على خيار إزالة سبايك ، الذي قص قمم طويلة الناجمة عن القطع الأثرية; ومع ذلك ، لا ينصح بهذا لأنه يغير شكل التشنجات. قم بإزالة القطع الأثرية من خلال قص التسجيل بدلا من ذلك (الشكل 8AIII). - استخدم خيارات إضافية (الشكل 8AV) لإخراج تحليل البيانات الإضافي: تحليل ما بعد الانحراف لتشغيل خوارزمية إضافية للكشف عن الذروة ، ومقياس المحور y تلقائيا على مخططات التكبير / التصغير لضبط المحاور تلقائيا على منحنى قوة النشل (الشكل 8B) ، وحفظ منحنيات تتبع القوة لحفظ كل شكل من أشكال قوة النشل في ملف .fig ، وحفظ بيانات وقت القوة لحفظ إحداثيات x و y للبيانات التي تمت تصفيتها المرسومة في شكل منحنى قوة Twitch.
- انقر فوق تشغيل التحليل لإنشاء ملف .txt يحتوي على سمات منحنى قوة النشل (الملف التكميلي 8) في المتوسط عبر تسجيل كامل.
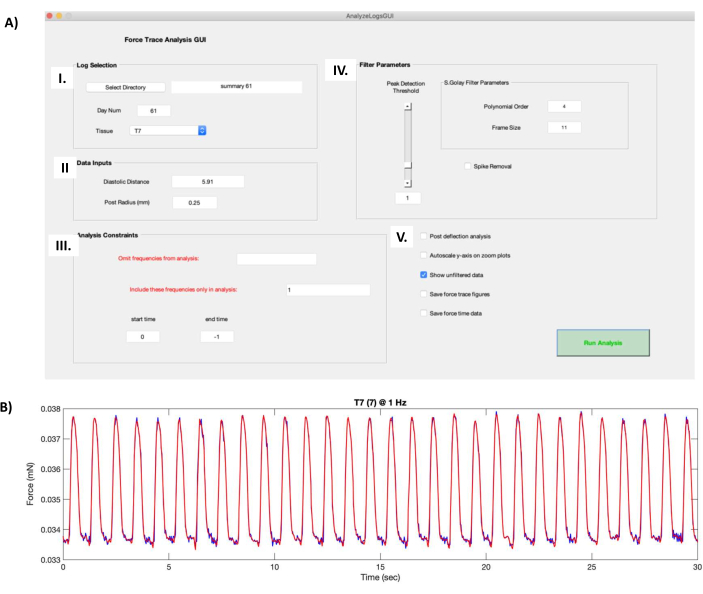
الشكل 8: حسابات منحنى قوة نشل. (أ) يؤدي تشغيل ملف "AnalyzeLogsGUI.m" في برنامج معالجة البيانات إلى فتح نافذة واجهة المستخدم الرسومية. (I) يسمح مربع تحديد السجل للمستخدم بتحديد الدليل للمجلد الذي يحتوي على البيانات الوظيفية hECT. يتم ملء الحقل Day Num تلقائيا من عنوان ملف الملخص الذي تم إنشاؤه في خطوة البروتوكول 7.1. يتم تحديد hECT المراد معالجته باستخدام القائمة المنسدلة الأنسجة . (II) يحتوي مربع مدخلات البيانات على معلومات حول زوج منشورات PDMS التي تدعم hECT ، مثل المسافة التي تم تفريغها (التي تم الحصول عليها في خطوة البروتوكول 6.1) ونصف قطر المنشور (0.25 مم). (III) يسمح مربع قيود التحليل للمستخدم باختيار الترددات لحذفها أو تضمينها واقتطاعها من التسجيلات. (IV) يحتوي مربع معلمات المرشح على خيارات لاختيار كيفية تصفية منحنى قوة نشل الخام. يغير ترتيب كثير الحدود وحجم الإطار مستوى التجانس أثناء عملية التصفية. يحدد شريط تمرير عتبة اكتشاف الذروة الحد الأدنى لحجم الذروة الذي سيتم التعرف عليه بواسطة البرامج النصية. يقوم خيار إزالة الارتفاع بقص القمم الطويلة الناتجة عن القطع الأثرية. (V) تشمل الخيارات الإضافية تحليل ما بعد الانحراف ، الذي يدير خوارزمية إضافية للكشف عن الذروة ، والمحور الصادي Autoscale على مخططات التكبير / التصغير ، والذي يعمل على منحنى قوة النشل ، وحفظ منحنيات تتبع القوة ، الذي يحفظ أرقام قوة النشل ، وحفظ بيانات وقت القوة ، الذي يحفظ بيانات قوة النشل المرسومة. (B) مثال على منحنى قوة النشل لتسجيل 30 ثانية ل hECT يسير بخطى 1 هرتز ناتج عن لقطة شاشة واجهة المستخدم الرسومية من اللوحة A. يظهر منحنى قوة النشل الأحمر القوة المفلترة الناتجة عن المعلمات في AIV ، متراكبة على منحنى قوة النشل الخام (منحنى أزرق داكن ، يظهر عند تحديد خيار إظهار البيانات غير المصفاة في AV ). الاختصارات: hECT = أنسجة القلب المهندسة البشرية. واجهة المستخدم الرسومية = واجهة المستخدم الرسومية ؛ PDMS = بوليديميثيل سيلوكسان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
النتائج
باتباع البروتوكول أعلاه ، تم إنشاء خلايا عضلة القلب من خط iPSC صحي استخدمته سابقامجموعتنا 9،15 وتم تصنيعها في hECTs بعد 8-61 يوما في الثقافة. يوضح الشكل 9A صورا تمثيلية ل hECTs كما يتم عرضها من الأسفل ، والتي تم إنشاؤها بدون (أعلى) ومع (أسفل) SPoTs. تم أخذ ال?...
Access restricted. Please log in or start a trial to view this content.
Discussion
هناك العديد من نماذج أنسجة القلب المهندسة خطيا المنشورة في الأدبيات ، وبعضها موصوف في الجدول 1. تتضمن بعض النماذج القياس المباشر لقوة الأنسجة ، ولكن هذه تتطلب عادة نقل البنية إلى حمام عضلي منفصل38. تم تصميم معظم النماذج مع الأنسجة المثبتة بشكل دائم في كلا الطرفين ، وال...
Access restricted. Please log in or start a trial to view this content.
Disclosures
K.D.C. هو المؤسس المشارك والرئيس العلمي لشركة Novoheart ويمتلك ملكية الأسهم في الشركة القابضة Medera Biopharmaceutical. لم تساهم نوفوهارت في تمويل أو تخطيط أو تنفيذ هذه الدراسة. ومع ذلك ، يمكن أن يكون لنتائج الدراسة تأثير مالي على Novoheart و Medera. يعلن المؤلفون الآخرون أنه ليس لديهم مصالح متنافسة.
Acknowledgements
يعترف المؤلفون بالدكتور تيموثي كاشمان لعمله السابق على هذه الطريقة. تم دعم هذه الدراسة بتمويل من المعاهد الوطنية للصحة (NIH) (R01-HL132226 و K01 HL133424) وبرنامج شبكات التميز الدولية لمؤسسة Leducq (CURE-PLaN).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25 mm diamete 304 Stainless Steel Wire | McMaster Carr | 6517K61 | |
| 0.25% trypsin-EDTA | Gibco | 25200056 | |
| 1.7 mL Microtubes | Axygen | MCT-175-C | |
| 10 cm dishes (20 mm tall) | Corning | 353003 | |
| 10 mL Serological Pipette | Drummond | 6-000-010 | |
| 10 N NaOH | Fisher Scientific | SS225-1 | dilute 1:10 in sterile distilled water |
| 10X Modified Eagle Medium | Sigma Aldrich | M0275 | |
| 20 - 200 μL Micropipette | Eppendorf | 3123000055 | |
| 200 μL MicroPipette Tips | VWR | 76322-150 | |
| 5 mL Serological Pipette | Drummond | 6-000-005 | |
| 50 mL Conical Centrifuge Tubes | Falcon | 352070 | |
| 6 cm Petri Dish | Corning | 353002 | |
| 6 Watt LED Dual Gooseneck Illuminator | AmScope | LED-6W | |
| 6-Well Plates | Corning | 353046 | |
| 90 degree angle mirror | Edmund Optics | 45-594 | |
| Acrylic bonding glue | SCIGRIP | #4 | |
| Adjustable 10 cm x 10 cm jack | Fisher Scientific | 14-673-50 | |
| Aluminum 6061 | McMaster Carr | 9008K82 | |
| A-Plan 10X Objective Lens | ZEISS | 1020-863 | |
| Autoclave Bags | Propper | 21002 | |
| B-27 supplement | ThermoFisher | 17504044 | |
| B-27 supplement (without insulin) | ThermoFisher | A1895601 | |
| Benchtop Centrifuge | Eppendorf | 5810 R | |
| Black ABS | Ultimaker | 2.85 mm wide | |
| Bovine Collagen I | Gibco | A1064401 | |
| CHIR99021 | Tocris | 4423 | |
| Class II Biosafety Cabinet | Labconco | 3430009 | |
| Clear Acrylic Sheeting | estreetplastics | 1002502436 | 6.25 mm thick |
| CNC Vertical Mill | Haas | VF-1 | |
| Conductive Graphite Bars | McMaster Carr | 1763T33 | |
| Dissection microscope | Olympus | SZ61 | |
| Dulbecco's Modified Eagle Medium/Ham's F-12 Nutrient Mix | ThermoFisher | 11330032 | |
| Ethanol | Fisher Scientific | A4094 | Dilute to 70% in water |
| EVE Automated Cell counter | NanoEntek | E1000 | |
| EVE Cell Counting Slide | NanoEntek | EVS-050 | |
| Fetal Bovine Serum | Life Technologies | 10438026 | |
| Fine Curved Forceps | Fine Science Tools | 11253-25 | |
| Forma Series II Water Jacketed CO2 Incubator | Thermo Electron Corporation | 3110 | AKA "incubator". With HEPA class 100 filter |
| Fusion360 software | Autodesk | AKA "CAD software" | |
| Glass Hemocytometer | Reichert | 1475 | 0.1 mm deep |
| HEPES | Sigma Aldrich | H3784 | |
| hESC qualified matrigel | Corning | 354277 | AKA "basement membrane matrix". Store in frozen aliquots |
| High Speed CCD Camera | PixelLINK | P7410 | |
| Inverted Microscope | Carl Zeiss Werk | Axiovert 40 CFL | 10X phase contrast objective |
| IWR-1 | Selleck Chem | S7086 | |
| LabView Software | National Instruments | 2016 | |
| Laminar flow clean bench | NuAire | NU-201-330 | necessary for hECT functional analysis |
| Laptop | AsusTek | Strix | Intel Core i& processor ,CPU 2.8GHz, 16GB RAM |
| Laser Cutting Machine | Epilog | Helix 24 | |
| Magnification headset | ExcelBlades | 70020 | Recommended for steps requiring fine manipulations |
| Matlab | Mathworks | Version 2019b or later | AKA "data analysis software" |
| Micro Vannas Scissors, 3 mm blade | WPI Instruments | 501839 | |
| Microscope Boom Stand | Olympus | SZ2-STU1 | |
| Penicillin-Streptomycin stock solution | ThermoFisher | 15140122 | 10,000 IU/ml penicillin; 10,000 μg/ml streptomycin |
| Phosphate-buffered saline without divalent cations | Sigma Aldrich | P3813 | Diluted in distilled water to 1X and 10X concentrations |
| Pipette Controller | Drummond | 4-000-100 | |
| PixelLINK Capture OEM | PixelLINK | 10.2.1.6 | AKA "Camera Software" |
| Polysulfone | McMaster Carr | 86735K73 | translucent amber color |
| Polytetrafluoroethylene (PTFE) | McMaster Carr | 8545K176 | Black, molded |
| ReLeSR | Stem Cell Technologies | 5872 | AKA "iPSC dissociation media" |
| Rosewell Park Memorial Institute 1640 Media | ThermoFisher | 11875135 | |
| Silicone Sheeting | SMI manufacturing | glossy, 0.02 in thickness, durometer 40 | |
| Size 10/0 Blue, Green, Red, and Yellow Glass Seed Beads | Michael's | color should withstand autoclaving | |
| Spatula | Fisher Scientific | 14-373 | used for mixing PDMS |
| Square Pulse Stimulator | Astro-Med / Grass Technologies | S88X | |
| Stainless Steel Razoblades | GEM | 62-0179-CTN | preferred over non-stainless steel due to lower hardness |
| Stemflex | ThermoFisher | A3349401 | AKA "iPSC culture media" |
| Sterile distilled water | ThermoFisher | 5230 | |
| Sylgard 170 - Silicone Elastomer Encapsulant Black 0.9 kg Kit | Dow | DOWSIL 170 2LB KIT | AKA black Polydimethylsiloxane (black PDMS) |
| Sylgard 184 - Silicone Elastomer Clear 1 lb Kit | Dow | DC 184 SYLGARD 0.5KG 1.1LB KIT | AKA Polydimethylsiloxane (PDMS) |
| Temperature-controlled heated stage | Okolab | H401-HG-SMU | Set height to 10 cm |
| Thermoplastic 3D printer | Ultimaker | Ultimaker 3 | |
| Thiazovivin | Selleck Chem | S1459 | |
| Trypan Blue | NanoEntek | EBT-001 | |
| Vacuum Chamber | Bel-Art Parts | F42027-0000 | |
| Variable Speed Mini Band Saw | Micro-Mark | 82203 | |
| Variable Speed Miniature Drill Press | Micro-Mark | 82959 | |
| Vibration Isolation Table | Labconco | 3618000 | |
| Weighing Boats | VWR | 10803-140 | |
| Talon Cylinder Bench Clamp | VWR | 97035-528 | AKA screw clamp |
References
- Serrao, G. W., et al. Myocyte-depleted engineered cardiac tissues support therapeutic potential of mesenchymal stem cells. Tissue Engineering. Part A. 18 (13-14), 1322-1333 (2012).
- Turnbull, I. C., et al. Advancing functional engineered cardiac tissues toward a preclinical model of human myocardium. FASEB Journal. 28 (2), 644-654 (2014).
- Cashman, T. J., et al. Construction of defined human engineered cardiac tissues to study mechanisms of cardiac cell therapy. Journal of Visualized Experiments. (109), e53447(2016).
- Stillitano, F., et al. Genomic correction of familial cardiomyopathy in human engineered cardiac tissues. European Heart Journal. 37 (43), 3282-3284 (2016).
- Mayourian, J., et al. Experimental and computational insight into human mesenchymal stem cell paracrine signaling and heterocellular coupling effects on cardiac contractility and arrhythmogenicity. Circulation Research. 121 (4), 411-423 (2017).
- Mayourian, J., et al. therapeutic paracrine modulation of cardiac excitation-contraction coupling. Circulation Research. 122 (1), 167-183 (2018).
- Mayourian, J., et al. Exosomal microRNA-21-5p mediates mesenchymal stem cell paracrine effects on human cardiac tissue contractility. Circulation Research. 7 (122), 933-944 (2018).
- Turnbull, I. C., et al. Cardiac tissue engineering models of inherited and acquired cardiomyopathies. Methods in Molecular Biology. 1816, 145-159 (2018).
- Murphy, J. F., et al. Adult human cardiac stem cell supplementation effectively increases contractile function and maturation in human engineered cardiac tissues. Stem Cell Research & Therapy. 10 (1), 373(2019).
- Breckwoldt, K., et al. Differentiation of cardiomyocytes and generation of human engineered heart tissue. Nature Protocols. 12 (6), 1177-1197 (2017).
- Huang, C. Y., et al. Enhancement of human iPSC-derived cardiomyocyte maturation by chemical conditioning in a 3D environment. Journal of Molecular and Cellular Cardiology. 138, 1-11 (2020).
- Ramade, A., Legant, W. R., Picart, C., Chen, C. S., Boudou, T. Microfabrication of a platform to measure and manipulate the mechanics of engineered microtissues. Methods in Cell Biology. 121, 191-211 (2014).
- Ronaldson-Bouchard, K., et al. Engineering of human cardiac muscle electromechanically matured to an adult-like phenotype. Nature Protocols. 14 (10), 2781-2817 (2019).
- Tamargo, M. A., et al. milliPillar: A platform for the generation and real-time assessment of human engineered cardiac tissues. ACS Biomaterials Science & Engineering. 7 (11), 5215-5229 (2021).
- Ceholski, D. K., et al. CXCR4 and CXCR7 play distinct roles in cardiac lineage specification and pharmacologic β-adrenergic response. Stem Cell Research. 23, 77-86 (2017).
- Bliley, J. M., et al. Dynamic loading of human engineered heart tissue enhances contractile function and drives a desmosome-linked disease phenotype. Science Translational Medicine. 13 (603), (2021).
- Ribeiro, M. C., et al. A new versatile platform for assessment of improved cardiac performance in human-engineered heart tissues. Journal of Personalized Medicine. 12 (2), 214(2022).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Mannhardt, I., et al. Human engineered heart tissue: Analysis of contractile force. Stem Cell Reports. 7 (1), 29-42 (2016).
- Mannhardt, I., et al. Blinded contractility analysis in hiPSC-cardiomyocytes in engineered heart tissue format: Comparison with human atrial trabeculae. Toxicological Sciences. 158 (1), 164-175 (2017).
- Saleem, U., et al. Force and calcium transients analysis in human engineered heart tissues reveals positive force-frequency relation at physiological frequency. Stem Cell Reports. 14 (2), 312-324 (2020).
- Thavandiran, N., et al. Functional arrays of human pluripotent stem cell-derived cardiac microtissues. Scientific Reports. 10 (1), 6919(2020).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Engineering. Part C, Methods. 22 (10), 932-940 (2016).
- Leonard, A., et al. Afterload promotes maturation of human induced pluripotent stem cell derived cardiomyocytes in engineered heart tissues. Journal of Molecular and Cellular Cardiology. 118, 147-158 (2018).
- Bose, P., Huang, C. Y., Eyckmans, J., Chen, C. S., Reich, D. H. Fabrication and mechanical properties measurements of 3D microtissues for the study of cell-matrix interactions. Methods in Molecular Biology. 1722, 303-328 (2018).
- Zhang, W., et al. Maturation of human embryonic stem cell-derived cardiomyocytes (hESC-CMs) in 3D collagen matrix: Effects of niche cell supplementation and mechanical stimulation. Acta Biomaterialia. 49, 204-217 (2017).
- van Neste, C. Advances in bioreactor design and multi-dimensional analysis for assessing maturation phenotype of human engineered cardiac tissues. PhD thesis. Icahn School of Medicine at Mount Sinai. , New York. https://www.prouest.com/docview/2722362863 (2022).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Salazar, B. H., Cashion, A. T., Dennis, R. G., Birla, R. K. Development of a cyclic strain bioreactor for mechanical enhancement and assessment of bioengineered myocardial constructs. Cardiovascular Engineering and Technology. 6 (4), 533-545 (2015).
- Putame, G., et al. Application of 3D printing technology for design and manufacturing of customized components for a mechanical stretching bioreactor. Journal of Healthcare Engineering. 2019, 3957931(2019).
- Akintewe, O. O., Roberts, E. G., Rim, N. -G., Ferguson, M. A. H., Wong, J. Y. Design approaches to myocardial and vascular tissue engineering. Annual Review of Biomedical Engineering. 19, 389-414 (2017).
- Chen, G., et al. Phospholamban as a crucial determinant of the inotropic response of human pluripotent stem cell-derived ventricular cardiomyocytes and engineered 3-dimensional tissue constructs. Circulation. Arrhythmia and Electrophysiology. 8 (1), 193-202 (2015).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Beauchamp, P., et al. 3D co-culture of hiPSC-derived cardiomyocytes with cardiac fibroblasts improves tissue-like features of cardiac spheroids. Frontiers in Molecular Biosciences. 7, 14(2020).
- Campostrini, G., et al. functional analysis and applications of isogenic three-dimensional self-aggregating cardiac microtissues from human pluripotent stem cells. Nature Protocols. 16 (4), 2213-2256 (2021).
- Swiatlowska, P., Iskratsch, T. Tools for studying and modulating (cardiac muscle) cell mechanics and mechanosensing across the scales. Biophysical Reviews. 13 (5), 611-623 (2021).
- Zhao, Y., et al. Engineering microenvironment for human cardiac tissue assembly in heart-on-a-chip platform. Matrix Biology. 85-86, 189-204 (2020).
- Fujiwara, Y., Deguchi, K., Miki, K., Nishimoto, T., Yoshida, Y. A method for contraction force measurement of hiPSC-derived engineered cardiac tissues. Methods in Molecular Biology. 2320, 171-180 (2021).
- Wang, E. Y., et al. Biowire model of interstitial and focal cardiac fibrosis. ACS Central Science. 5 (7), 1146-1158 (2019).
- Zhao, Y., et al. A platform for generation of chamber-specific cardiac tissues and disease modeling. Cell. 176 (4), 913-927 (2019).
- Lee, E. K., et al. Machine learning of human pluripotent stem cell-derived engineered cardiac tissue contractility for automated drug classification. Stem Cell Reports. 9 (5), 1560-1572 (2017).
- Batalov, I., Feinberg, A. W. Differentiation of cardiomyocytes from human pluripotent stem cells using monolayer culture. Biomarker Insights. 10, 71-76 (2015).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), E1848-E1857 (2012).
- Penefsky, Z. J., Buckley, N. M., Litwak, R. S. Effect of temperature and calcium on force-frequency relationships in mammalian ventricular myocardium. Pflugers Archiv. 332 (4), 271-282 (1972).
- Bers, D. M. Excitation-Contraction Coupling and Cardiac Contractile Force. , Springer. Dordrecht, the Netherlands. (2001).
- Kanaya, N., Gable, B., Wickley, P. J., Murray, P. A., Damron, D. S. Experimental conditions are important determinants of cardiac inotropic effects of propofol. Anesthesiology. 103 (5), 1026-1034 (2005).
- Galende, E., et al. Amniotic fluid cells are more efficiently reprogrammed to pluripotency than adult cells. Cellular Reprogramming. 12 (2), 117-125 (2010).
- Wacker-Gussmann, A., Strasburger, J. F., Cuneo, B. F., Wakai, R. T. Diagnosis and treatment of fetal arrhythmia. American Journal of Perinatology. 31 (7), 617-628 (2014).
- Federmann, M., Hess, O. M. Differentiation between systolic and diastolic dysfunction. European Heart Journal. 15, 2-6 (1994).
- Knight, W. E., et al. Maturation of pluripotent stem cell-derived cardiomyocytes enables modeling of human hypertrophic cardiomyopathy. Stem Cell Reports. 16 (3), 519-533 (2021).
- Ma, Z., et al. Contractile deficits in engineered cardiac microtissues as a result of MYBPC3 deficiency and mechanical overload. Nature Biomedical Engineering. 2 (12), 955-967 (2018).
- de Lange, W. J., et al. Human iPSC-engineered cardiac tissue platform faithfully models important cardiac physiology. American Journal of Physiology. Heart and Circulatory Physiology. 320 (4), H1670-H1686 (2021).
- Hiranandani, N., Varian, K. D., Monasky, M. M., Janssen, P. M. L. Frequency-dependent contractile response of isolated cardiac trabeculae under hypo-, normo-, and hyperthermic conditions. Journal of Applied Physiology. 100 (5), 1727-1732 (2006).
- Puglisi, J. L., Bassani, R. A., Bassani, J. W., Amin, J. N., Bers, D. M. Temperature and relative contributions of Ca transport systems in cardiac myocyte relaxation. The American Journal of Physiology. 270 (5), H1772-H1778 (1996).
- Puglisi, J. L., Yuan, W., Bassani, J. W., Bers, D. M. Ca(2+) influx through Ca(2+) channels in rabbit ventricular myocytes during action potential clamp: Influence of temperature. Circulation Research. 85 (6), e7-e16 (1999).
- Li, R. A., et al. Bioengineering an electro-mechanically functional miniature ventricular heart chamber from human pluripotent stem cells. Biomaterials. 163, 116-127 (2018).
- Sharma, A., et al. Biomanufacturing in low Earth orbit for regenerative medicine. Stem Cell Reports. 17 (1), 1-13 (2022).
- Strauss, D. G., Wu, W. W., Li, Z., Koerner, J., Garnett, C. Translational models and tools to reduce clinical trials and improve regulatory decision making for QTc and proarrhythmia risk (ICH E14/S7B updates). Clinical Pharmacology & Therapeutics. 109 (2), 319-333 (2021).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756(2020).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
Posted by JoVE Editors on 1/10/2024. Citeable Link.
An erratum was issued for: Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues. The title was corrected from:
Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues
to:
Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved